3.2: Кислоты и основания Бренстеда и Льюиса
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 183304
- Химия 310
- Penn State University via Wikibook
Три теории кислот и оснований
Существуют три основные классификации веществ, известных как кислоты или основания. Определение Аррениуса гласит, что кислота образует H + в растворе, а основание производит OH —. Эта теория была разработана Сванте Аррениусом в 1883 году. Позже были предложены две более сложные и общие теории. Это определения кислот и оснований Бренстеда-Лоури и Льюиса. Связь между этими теориями показана на рисунке ниже.
Иллюстрация иерархии кислотно-основных теорий. Кислоты и основания Аррениуса являются подклассом кислот и оснований Бренстеда, которые сами по себе являются подклассом кислот и оснований Льюиса. |
Теория Аррениуса, являющаяся простейшим и наименее общим описанием кислот и оснований, включает такие кислоты, как HClO 4 , и основания, такие как NaOH или Mg(OH) 2 . Эта теория успешно описывает, как кислоты и основания реагируют друг с другом с образованием воды и солей. Однако это не объясняет, почему некоторые вещества, не содержащие гидроксид-ионов, например F — и NO 2 —
Здесь правая стрелка (→) означает, что реакция идет до конца. То есть 1,0 М раствор HClO 4 в воде фактически содержит 1,0 М H + (водн.) и 1,0 М ClO 4 — (водн.) и очень мало недиссоциированного HClO 4 .
То есть 1,0 М раствор HClO 4 в воде фактически содержит 1,0 М H + (водн.) и 1,0 М ClO 4 — (водн.) и очень мало недиссоциированного HClO 4 .
И наоборот, слабые кислоты, такие как уксусная кислота (CH
| Антацидные таблетки обычно содержат кальциевые соли иона бикарбоната (HCO 3 — ), слабое основание. Его сопряженная кислота, угольная кислота (H 2 CO 3 ), является слабой кислотой. Кислотно-щелочное равновесие между угольной кислотой и бикарбонатом важно для поддержания рН крови. |
Пример
Бытовой аммиак представляет собой раствор NH 3 в воде с концентрацией от 5 до 10% по весу. Рассчитаем процент ионизации и рН раствора.
Рассчитаем процент ионизации и рН раствора.
Раствор
Для раствора, содержащего 8% аммиака по весу, при условии, что плотность примерно такая же, как у жидкой воды, аналитическая концентрация аммиака составляет (80 г/л) / (17 г/моль ) = 4,7 M.
Еще одна вещь, которую нам нужно знать, чтобы решить эту проблему, — это базовая константа диссоциации \(K_b\). 9{-3}M / 4,7M = \textbf{0,19%}\)
Этот пример показывает, что технически неправильно маркировать бутылку с водным аммиаком как «гидроксид аммония», так как только около 2/10 одного процента слабое основание существует в этой форме.
Сопряженные кислоты и основания
Распространенное заблуждение состоит в том, что сильные кислоты имеют слабые сопряженные основания, а слабые кислоты имеют сильные сопряженные основания. Легко видеть, что это неверно, если вспомнить, что К а К б = К в . Наше определение сильной кислоты или основания таково: K >> 1, т. е. вещество полностью диссоциирует. Наше определение слабой кислоты или основания: 1 > K > K w . Отсюда следует, что если K a >> 1 (сильное), то K b не может быть > K w (слабое).
е. вещество полностью диссоциирует. Наше определение слабой кислоты или основания: 1 > K > K w . Отсюда следует, что если K a >> 1 (сильное), то K b не может быть > K w (слабое).
Фактически, сильные кислоты , такие как HCl, диссоциируют с образованием ионов-спектаторов , таких как Cl — , в виде сопряженных оснований, тогда как слабые кислоты 9{10}\))
Сила сопряженной кислоты/основания обратно пропорциональна силе или слабости исходной кислоты или основания. Любая кислота или основание технически также является сопряженной кислотой или сопряженным основанием; эти термины просто используются для обозначения видов в растворе (например, уксусная кислота представляет собой сопряженную кислоту аниона ацетата, основание, а ацетат представляет собой сопряженное основание уксусной кислоты, кислоты).
Нейтральные оксикислоты (H 2 SO 4 , H 3 PO 4 , HNO 3 , HClO 2 и т. д.) можно классифицировать как сильные или слабые в соответствии с простым правилом, впервые отмеченным Лайнусом Полингом. Если число атомов кислорода превышает число атомов водорода на два и более, то кислота сильная; иначе он слаб. Например, HClO 4 и HClO 3 , где разница составляет 3 и 2 соответственно, являются сильными кислотами. HNO 2 и HClO 2 являются слабыми, потому что в обоих случаях разница равна 1. Для слабых кислот относительная сила зависит от этой разницы (т.е. HClO 2 — более сильная слабая кислота, чем HOCl) и на электроотрицательность центрального атома (HOCl сильнее, чем HOI).
д.) можно классифицировать как сильные или слабые в соответствии с простым правилом, впервые отмеченным Лайнусом Полингом. Если число атомов кислорода превышает число атомов водорода на два и более, то кислота сильная; иначе он слаб. Например, HClO 4 и HClO 3 , где разница составляет 3 и 2 соответственно, являются сильными кислотами. HNO 2 и HClO 2 являются слабыми, потому что в обоих случаях разница равна 1. Для слабых кислот относительная сила зависит от этой разницы (т.е. HClO 2 — более сильная слабая кислота, чем HOCl) и на электроотрицательность центрального атома (HOCl сильнее, чем HOI).
Кислоты, которые могут отдавать более одного протона, называются полипротонными кислотами . Например, серная кислота H 2 SO 4 является сильной кислотой, которая имеет сопряженное основание, которое на самом деле является слабой кислотой. Это означает, что каждый моль H 2 SO 4 в водном растворе отдает более 1 моля протонов. Углекислота (H 2 CO 3 ) и фосфорная кислота (H 3 PO 4 ) являются слабыми полипротонными кислотами. Как правило, последовательные pK и полипротоновой кислоты разделены примерно на 5 единиц pH, потому что становится все труднее удалять протоны по мере того, как ион становится более отрицательно заряженным. Например, три pK a фосфорной кислоты равны 2,15, 7,20 и 12,35.
Углекислота (H 2 CO 3 ) и фосфорная кислота (H 3 PO 4 ) являются слабыми полипротонными кислотами. Как правило, последовательные pK и полипротоновой кислоты разделены примерно на 5 единиц pH, потому что становится все труднее удалять протоны по мере того, как ион становится более отрицательно заряженным. Например, три pK a фосфорной кислоты равны 2,15, 7,20 и 12,35.
Амфотерные соединения
Некоторые вещества могут действовать и как кислота, и как основание. Пример — вода. Н 2 Молекулы O могут либо отдавать ион водорода, либо принимать его. Это свойство делает воду амфотерным растворителем. В ситуации, когда кислота диссоциирует в растворе, вода действует как основание. И наоборот, вода действует как кислота при диссоциации оснований. самая сильная кислота , которую мы можем получить в H 2 O, представляет собой H + (водн.), а  ).
).
Другими примерами амфотерных соединений являются оксиды и гидроксиды элементов, которые лежат на границе между металлическими и неметаллическими элементами в периодической таблице. Например, гидроксид алюминия (Al(OH) 3 ) нерастворим при нейтральном pH, но может принимать протоны в кислоте с образованием [Al(H 2 O) 6 ] 3+ или принимать ион OH — в основании с образованием Al(OH ) 4 — ионы. Следовательно, оксид алюминия растворим в кислоте и щелочи, но не в нейтральной воде. Другими примерами амфотерных оксидов являются BeO, ZnO, Ga
Периодическая таблица, показывающая основные (синий), амфотерные (зеленый) и кислотные (красный) оксиды. |
Выравнивание растворителем
Выравнивание растворителем — это эффект, возникающий при помещении сильной кислоты в растворитель, такой как (но не ограничиваясь) H 2 O. Поскольку сильные кислоты отдают свои протоны растворителю, самая сильная кислота, которая может существовать, является сопряженной кислотой растворителя. В водном растворе это H 3 O + . Это означает, что сила кислот, таких как HCl и HBr, не может быть дифференцирована в воде, поскольку они обе диссоциируют на 100% до H 3 O + . В контексте нашего обсуждения сопряженных оснований выше мы бы сказали, что и Cl — , и Br — являются ионами-спектаторами в воде: ни одно из них не является достаточно сильным основанием, чтобы принять протон от H 3 О + . Чтобы различать кислотности сильных кислот, таких как HClO 4 и HCl, или основности сильных оснований, таких как CH 3 O — и NH 2 — , мы обычно должны работать в не- водные растворители, как описано ниже.
Неводные растворы
Теория Бренстеда охватывает любой тип растворителя, который может отдавать и принимать ионы H + , а не только водные растворы. Сила кислоты или основания зависит от растворителя. Неводная кислотно-щелочная химия следует тем же правилам, что и разработанные для кислот и оснований в воде. Например, в жидком аммиаке растворитель самодиссоциирует в реакции: 9{-}}\]
Это равновесие аналогично автодиссоциации воды, но имеет меньшую константу равновесия (K ≈ 10 -30 ). По аналогии с водой следует, что NH  Точно так же уксусная кислота слаба в воде, но сильна в аммиаке. Выравнивание растворителя фактически делает HCl, CH
Точно так же уксусная кислота слаба в воде, но сильна в аммиаке. Выравнивание растворителя фактически делает HCl, CH
Сильные кислоты, выравниваемые в воде, имеют различную кислотную силу в кислых растворителях, таких как HF или безводная уксусная кислота. Например, кислотная диссоциация HX в уксусной кислоте (CH 9{-}}\]
Отсюда следует, что кислые растворители увеличивают основность по Бренстеду веществ, которые не могут принимать протоны в воде. И наоборот, основные растворители увеличивают кислотность веществ, которые не могут отдать протон OH — .
Кислотность и основность неводных растворителей трудно точно определить количественно, но одной хорошей относительной мерой является функция кислотности Гаммета, H
\[H_{o} = pK_{a} + \log(\frac{[основание]}{[конъюгат \: кислота]})\]
Для неводных растворителей или для кислых или основных соединений в растворяется в растворителях, которые сами по себе не диссоциируют, H o является грубой мерой pH рассматриваемого растворителя или соединения. Безводный HF и H 2 SO 4 имеют значения H o примерно -10 и -12 соответственно.
Безводный HF и H 2 SO 4 имеют значения H o примерно -10 и -12 соответственно.
Суперкислоты и супероснования.
 |
При 140 °C, FSO 3 H–SbF 5 превращает метан в трет-бутилкарбокатион, реакция, которая начинается с протонирования метана: [2] 9{+} + 3h3}\]
Фторсурьмяная кислота, HSbF 6 , может давать растворы с H 0 до –28. [3] Фторсурьмяная кислота производится путем объединения HF и SbF 5 . В этой системе HF высвобождает свой протон (H + ) одновременно со связыванием F — пентафторидом сурьмы, который (как описано ниже) представляет собой кислоту Льюиса. Образовавшийся анион (SbF 6 -) является одновременно слабым нуклеофилом и чрезвычайно слабым основанием.
Суперкислоты используются в таких реакциях, как изомеризация алканов. В промышленности цеолиты с безводным кислотным обменом, которые представляют собой суперкислотные катализаторы, широко используются для изомеризации углеводородов при переработке сырой нефти в бензин. Супероснования, такие как диэтиламид лития (LiNEt 2 ), соединения алкиллития (RLi) и реактивы Гриньяра (RMgX), применимые в широком диапазоне органических реакций. LiNEt 2 депротонирует связи C-H с образованием реакционноспособных карбанионов. RLi и RMgX являются мощными нуклеофилами.
Супероснования, такие как диэтиламид лития (LiNEt 2 ), соединения алкиллития (RLi) и реактивы Гриньяра (RMgX), применимые в широком диапазоне органических реакций. LiNEt 2 депротонирует связи C-H с образованием реакционноспособных карбанионов. RLi и RMgX являются мощными нуклеофилами.
Использование супероснований в неводных средах позволяет ранжировать кислотности (и измерять pKa) различных классов молекул. Это ранжирование особенно важно для понимания реакций органических молекул. Обратите внимание, что порядок кислотности для углеводородов следующий: алкины >> алкены, ароматические соединения >> алканы. Это упорядочение связано с гибридизацией атома углерода, образующего карбанион. Отрицательно заряженная неподеленная пара карбаниона стабилизируется на орбиталях с высоким s-характером (например, sp против sp 2 или sp 3 ). Это связано с тем, что s-орбитали имеют конечную плотность вероятности в ядре и «чувствуют» положительный ядерный заряд (тем самым стабилизируя дополнительный отрицательный заряд на углероде) больше, чем p-орбитали. Резонансные эффекты также стабилизируют карбанионы. Таким образом, циклопентадиен более кислый, чем даже алкин, потому что отрицательный заряд делокализован по всему (ароматическому) кольцу C 5 H 5 — , когда C 5 H 6 депротонировано.
Резонансные эффекты также стабилизируют карбанионы. Таким образом, циклопентадиен более кислый, чем даже алкин, потому что отрицательный заряд делокализован по всему (ароматическому) кольцу C 5 H 5 — , когда C 5 H 6 депротонировано.
| имя | формула | структурная формула | рКа |
|---|---|---|---|
| Метан | СН 4 | 56 | |
| Пропен | С 3 Н 6 | 44 | |
| Бензол | С 6 Н 6 | 43 | |
| Ацетилен | С 2 Н 2 | 25 | |
| Циклопентадиен | С 5 Н 6 | 18 |
Таблица 1. {2-}}\]
{2-}}\]
Из этого следует, что в этом очень щелочном растворителе вода (сопряженная кислота растворителя) является самой сильной кислотой, которая может существовать. Сопряженное основание растворителя O 2- является самым сильным основанием. Это равновесие автодиссоциации позволяет легко регулировать кислотность флюса путем добавления или выпаривания воды. «Мокрый» флюс более кислый и может растворять оксиды металлов, содержащие основной анион O 2-. И наоборот, «сухой» флюс является более основным и вызывает осаждение оксидов. Таким образом, флюсы расплавленных гидроксидов можно использовать в синтезе оксидных кристаллов, таких как перовскитный сверхпроводник (K 1- X Ba X BiO 3 ). [5] . Эвтектические смеси NaOH и KOH имеют относительно низкую температуру плавления (≈ 200 °C) и могут использоваться в качестве растворителей для кристаллизации различных основных оксидов.
Кислоты и основания Льюиса
Классификация кислот и оснований Льюиса шире, чем определение Бренстеда-Лоури, и включает гораздо больше веществ. В то время как классификации Бренстеда-Лоури и Аррениуса основаны на переносе протонов, кислотность и основность Льюиса основаны на совместном использовании пары электронов. Кислоты Льюиса могут принимать электронную пару, а Основания Льюиса могут отдавать электронную пару. Это определение охватывает определение Бренстеда-Лоури, в котором H + является акцептором электронной пары (при взаимодействии с основанием), а основание является донором электронной пары при взаимодействии с H + . Это показано ниже для протонирования аммиака.
В то время как классификации Бренстеда-Лоури и Аррениуса основаны на переносе протонов, кислотность и основность Льюиса основаны на совместном использовании пары электронов. Кислоты Льюиса могут принимать электронную пару, а Основания Льюиса могут отдавать электронную пару. Это определение охватывает определение Бренстеда-Лоури, в котором H + является акцептором электронной пары (при взаимодействии с основанием), а основание является донором электронной пары при взаимодействии с H + . Это показано ниже для протонирования аммиака.
Трифторид бора, BF 3 действует как кислота Льюиса, когда он соединяется с основным ионом или молекулой, которая может отдавать электронную пару. Такая реакция показана ниже. 9{-}
Здесь кислотой является BF 3 , а основанием — F — . Эта кислотно-основная реакция позволяет бору (который является электронодефицитным в BF 3 ) завершить свой октет. Точно так же AlCl 3 представляет собой кислоту Льюиса, которая может реагировать с Cl — (основание Льюиса) с образованием «соли» Льюиса AlCl 4 — . Обратите внимание, что в воде Cl – представляет собой ион-спектатор (более слабое основание, чем растворитель) в кислотно-основных реакциях Бренстеда.
Обратите внимание, что в воде Cl – представляет собой ион-спектатор (более слабое основание, чем растворитель) в кислотно-основных реакциях Бренстеда.
\(\ce{SF4 + SbF5 <=>SSbF9}\)
В других реакциях кислоты и основания по Льюису и кислота, и основание являются молекулами, а продукт называется аддуктом.
\(\ce{(Ch4)3B + N(Ch4)3 -> (Ch4)3B-N(Ch4)3}\)
\(\ce{I2 + S(Ch4)2 -> I2- S(Ch4)2}\)
\(\ce{C5N5N + Cu(HFacac)2 -> C5N5N-Cu(HFacac)2}\)
Кислотность по Льюису является основой для координационной химии, эту тему мы обсудим более подробно в главе 5. Это связано с тем, что координационная химия включает ионы металлов , представляющие собой кислоты Льюиса, которые связываются с лигандами, представляющими собой основания Льюиса.
Определение силы кислот Льюиса для ионов металлов
Сила кислот Льюиса для ионов металлов определяется тремя факторами:
1. Чем выше положительный заряд металла, тем он более кислый. Например, Al 3 + и Fe 3 + являются хорошими кислотами Льюиса и их соли образуют кислые растворы в воде, а K + и Na + нет.
Например, Al 3 + и Fe 3 + являются хорошими кислотами Льюиса и их соли образуют кислые растворы в воде, а K + и Na + нет.
2. Чем меньше атомный радиус иона металла, тем он более кислый. Спускаясь вниз по периодической таблице, льюисовская кислотность ионов металлов уменьшается (например, Al 3 + > Ga 3 + > In 3 + ), поскольку ионный радиус увеличивается.
3. Что касается ионов переходных металлов, более электроотрицательные металлы имеют тенденцию образовывать более сильные кислоты Льюиса. Электроотрицательность имеет максимумы при W и Au в ряду 5d, поэтому ионы металлов в этой части периодической таблицы являются хорошими кислотами Льюиса.
Молекулы с пятикоординатной геометрией (например, PCl 5 , AsF 5 , SbF 5 ) обычно являются сильными кислотами Льюиса, потому что, принимая другую пару электронов от основания, они образуют октаэдрическую молекулу или анион. Ни одна из распространенных пятикоординатных геометрий (тригонально-бипирамидальная или квадратно-пирамидальная) не является эффективной с точки зрения упаковки. Кислотно-основная реакция Льюиса образует дополнительную связь с относительно небольшими энергетическими затратами на растяжение существующих связей: 9{2-} + 2h3O}\]
Ни одна из распространенных пятикоординатных геометрий (тригонально-бипирамидальная или квадратно-пирамидальная) не является эффективной с точки зрения упаковки. Кислотно-основная реакция Льюиса образует дополнительную связь с относительно небольшими энергетическими затратами на растяжение существующих связей: 9{2-} + 2h3O}\]
Основания Льюиса стабилизируют высокие степени окисления.
Интересным примером использования кислотно-основной химии Льюиса для управления реакциями является химический синтез газообразного фтора, который был разработан Карлом О. Кристе в 1986 году. 100-летие выделения элементарного фтора Анри Муассаном, которое Муассан сделал в 1886 году путем электролиза раствора безводного HF. Спустя 100 лет прямого (неэлектрохимического) синтеза F 9 все еще не было.{2-}_{(aq)} -> K2MnF6_{(s)}}\]
Второй этап включал взаимодействие K 2 MnF 6 с мощной кислотой Льюиса SbF 5 с получением метастабильного MnF 4 , который самопроизвольно разлагается на MnF 3 и газообразный фтор:
\[\ce{K2MnF6_{(s)} + 2SbF5_{(l)} -> 2KSbF6_{(s)} + MnF4_{(s) }}\]
\[\ce{MnF4_{(s)} -> MnF3_{(s)} + \frac{1}{2}F2_{(g)}}\]
Эта реакция нас кое-чему учит интересно и важно о связи между кислотно-щелочной и окислительно-восстановительной химией. Кислоты имеют тенденцию стабилизировать низкие степени окисления, а основания стабилизируют высокие степени окисления (мы скоро увидим это снова в главе 4, в контексте диаграмм Пурбе). Mn стабилен в степени окисления +4 в K 2 MnF 6 , где он окружен шестью основными анионами F — . Однако самым стабильным нейтральным фторидом Mn является MnF 3 , а MnF 4 (временно образованный из K 2 MnF 6 ) самопроизвольно разлагается с образованием фтора.
Кислоты имеют тенденцию стабилизировать низкие степени окисления, а основания стабилизируют высокие степени окисления (мы скоро увидим это снова в главе 4, в контексте диаграмм Пурбе). Mn стабилен в степени окисления +4 в K 2 MnF 6 , где он окружен шестью основными анионами F — . Однако самым стабильным нейтральным фторидом Mn является MnF 3 , а MnF 4 (временно образованный из K 2 MnF 6 ) самопроизвольно разлагается с образованием фтора.
Оксид является лучшим основанием, чем фторид. Интересно, что Mn может терять все свои валентные электроны с образованием Mn 7 + в перманганат-ионе, MnO 4 — . Здесь степень окисления 7+ стабилизируется электростатически за счет координации с четырьмя ионами O 2- и общим зарядом -1 на анионе MnO 4 — . Из-за своего 2-заряда O 2- является более сильным основанием и лучшим ионом для стабилизации высоких степеней окисления, чем F —. Это общая тенденция среди переходных металлов: высшая степень окисления обычно достигается в оксиде, а не во фториде, несмотря на то, что F является более электроотрицательным элементом, чем O. Например, Cr 6 + является стабильным в CRO 4 2 — и CR 2 O 7 2 — Анионы, но не во всех нейтральных флюоре. Степень окисления +8 встречается в RuO 4 и OsO 4 , но не во всех фторидах Ru или Os.
Это общая тенденция среди переходных металлов: высшая степень окисления обычно достигается в оксиде, а не во фториде, несмотря на то, что F является более электроотрицательным элементом, чем O. Например, Cr 6 + является стабильным в CRO 4 2 — и CR 2 O 7 2 — Анионы, но не во всех нейтральных флюоре. Степень окисления +8 встречается в RuO 4 и OsO 4 , но не во всех фторидах Ru или Os.
Эта страница под названием 3.2: Кислоты и основания Бренстеда и Льюиса распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Chemistry 310 (Wikibook) посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами. платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Химия 310 Студенты
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- source@https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry
Альдегиды, кетоны, карбоновые кислоты и сложные эфиры
Результаты обучения
- Описать структуру и свойства альдегидов, кетонов, карбоновых кислот и сложных эфиров
Другой класс органических молекул содержит атом углерода, соединенный с атомом кислорода двойной связью, обычно называемой карбонильной группой. Тригональный плоский углерод в карбонильной группе может присоединяться к двум другим заместителям, что приводит к нескольким подсемействам (альдегиды, кетоны, карбоновые кислоты и сложные эфиры), описанным в этом разделе.
Альдегиды и кетоны
Альдегиды и кетоны содержат карбонильную группу , функциональную группу с двойной углерод-кислородной связью. Названия альдегидных и кетоновых соединений получены с использованием тех же правил номенклатуры, что и для алканов и спиртов, и включают суффиксы, идентифицирующие класс, -al и -one соответственно:
Названия альдегидных и кетоновых соединений получены с использованием тех же правил номенклатуры, что и для алканов и спиртов, и включают суффиксы, идентифицирующие класс, -al и -one соответственно:
В альдегиде карбонильная группа связана с хотя бы один атом водорода. В кетонах карбонильная группа связана с двумя атомами углерода:
В тексте альдегидная группа представлена как –CHO; кетон представлен как –C(O)– или –CO–.
И в альдегидах, и в кетонах геометрия вокруг атома углерода в карбонильной группе тригонально-плоская; атом углерода проявляет sp 2 гибридизацию. Две из sp 2 орбиталей на атоме углерода в карбонильной группе используются для образования σ-связей с другими атомами углерода или водорода в молекуле. Остальные сп 2 гибридная орбиталь образует σ-связь с атомом кислорода. Негибридизованная орбиталь p атома углерода в карбонильной группе перекрывается с орбиталью p атома кислорода с образованием π-связи в двойной связи.
Рисунок 1. Карбонильная группа полярна, а геометрия связей вокруг центрального атома углерода является тригонально-плоской.
Подобно связи [латекс]\text{C}=\text{O}[/latex] в диоксиде углерода, связь [латекс]\text{C}=\text{O}[/latex] карбонила группа является полярной (напомним, что кислород значительно более электроотрицательный, чем углерод, и общие электроны притягиваются к атому кислорода и от атома углерода). Многие реакции альдегидов и кетонов начинаются с реакции между основанием Льюиса и атомом углерода на положительном конце полярной [латексной]\text{C}=\text{O}[/latex] связи с образованием нестабильной промежуточное соединение, которое впоследствии подвергается одной или нескольким структурным перестройкам с образованием конечного продукта (рис. 1).
Важность молекулярной структуры для реакционной способности органических соединений иллюстрируется реакциями, в результате которых образуются альдегиды и кетоны. Мы можем получить карбонильную группу путем окисления спирта — для органических молекул говорят, что окисление атома углерода происходит, когда связь углерод-водород заменяется связью углерод-кислород. Обратная реакция — замена связи углерод-кислород на связь углерод-водород — представляет собой восстановление этого атома углерода. Напомним, что кислороду обычно присваивается степень окисления -2, если только он не является элементарным или не присоединен к фтору. Водороду обычно присваивается степень окисления +1, если он не связан с металлом. Поскольку для углерода нет определенного правила, его степень окисления определяется алгебраически путем факторизации атомов, к которым он присоединен, и общего заряда молекулы или иона. Как правило, атом углерода, присоединенный к атому кислорода, будет иметь более положительную степень окисления, а атом углерода, присоединенный к атому водорода, будет иметь более отрицательную степень окисления. Это должно хорошо соответствовать вашему пониманию полярности связей C–O и C–H. Другие реагенты и возможные продукты этих реакций выходят за рамки этой главы, поэтому мы сосредоточимся только на изменениях атомов углерода:
Обратная реакция — замена связи углерод-кислород на связь углерод-водород — представляет собой восстановление этого атома углерода. Напомним, что кислороду обычно присваивается степень окисления -2, если только он не является элементарным или не присоединен к фтору. Водороду обычно присваивается степень окисления +1, если он не связан с металлом. Поскольку для углерода нет определенного правила, его степень окисления определяется алгебраически путем факторизации атомов, к которым он присоединен, и общего заряда молекулы или иона. Как правило, атом углерода, присоединенный к атому кислорода, будет иметь более положительную степень окисления, а атом углерода, присоединенный к атому водорода, будет иметь более отрицательную степень окисления. Это должно хорошо соответствовать вашему пониманию полярности связей C–O и C–H. Другие реагенты и возможные продукты этих реакций выходят за рамки этой главы, поэтому мы сосредоточимся только на изменениях атомов углерода:
Пример 1:
Окисление и восстановление в органической химии Метан представляет собой полностью восстановленную форму органической молекулы, которая содержит один атом углерода. Последовательная замена каждой связи углерод-водород связью углерод-кислород приведет к спирту, затем к альдегиду, затем к карбоновой кислоте (обсуждается позже) и, наконец, к двуокиси углерода:
Последовательная замена каждой связи углерод-водород связью углерод-кислород приведет к спирту, затем к альдегиду, затем к карбоновой кислоте (обсуждается позже) и, наконец, к двуокиси углерода:
[латекс] {\ текст { CH}}_{4}\rightarrow{\text{CH}}_{3}\text{OH}\rightarrow{\text{CH}}_{2}\text{O}\rightarrow{\text{HCO }}_{2}\text{H}\rightarrow{\text{CO}}_{2}[/латекс]
Каковы степени окисления атомов углерода в молекулах, показанных здесь?
Показать решение
Проверьте свои знания
Укажите, окисляются или восстанавливаются отмеченные здесь атомы углерода в трех молекулах по отношению к отмеченному атому углерода в этаноле:
В этом случае нет необходимости вычислять степени окисления; вместо этого просто сравните типы атомов, связанных с отмеченными атомами углерода:
Показать решение
Альдегиды обычно получают окислением спиртов, у которых функциональная группа –ОН расположена на атоме углерода в конце цепочки атомов углерода в спирте:
Спирты, содержащие группы –ОН в середине цепи, необходимы для синтеза кетона, для которого требуется, чтобы карбонильная группа была связана с двумя другими атомами углерода:
Спирт, группа –ОН которого связана с атомом углерода который не связан ни с одним другим атомом углерода или с одним другим атомом углерода, образует альдегид.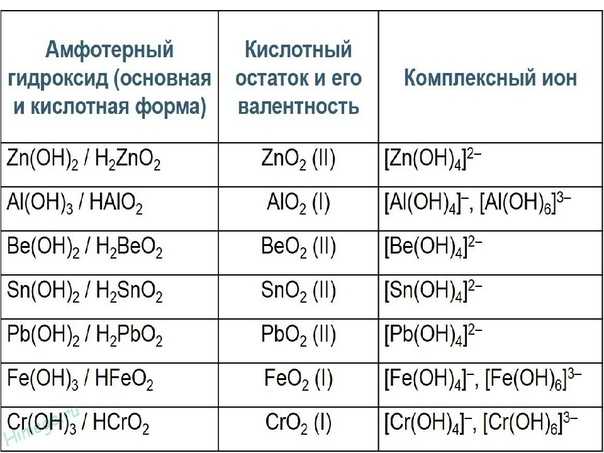 Спирт, у которого группа –ОН присоединена к двум другим атомам углерода, образует кетон. Если к углероду, связанному с –ОН, присоединены три атома углерода, в молекуле не будет замещаемой связи С–Н, поэтому она не будет восприимчива к окислению.
Спирт, у которого группа –ОН присоединена к двум другим атомам углерода, образует кетон. Если к углероду, связанному с –ОН, присоединены три атома углерода, в молекуле не будет замещаемой связи С–Н, поэтому она не будет восприимчива к окислению.
Формальдегид, альдегид с формулой HCHO, представляет собой бесцветный газ с резким раздражающим запахом. Он продается в виде водного раствора, называемого формалином, который содержит около 37% формальдегида по весу. Формальдегид вызывает коагуляцию белков, поэтому он убивает бактерии (и любой другой живой организм) и останавливает многие биологические процессы, вызывающие разложение тканей. Так, формальдегид используется для консервации образцов тканей и бальзамирования тел. Он также используется для стерилизации почвы или других материалов. Формальдегид используется в производстве бакелита, твердого пластика, обладающего высокой химической и электрической стойкостью.
Диметилкетон, CH 3 COCH 3 , обычно называемый ацетоном, является простейшим кетоном. Его производят путем ферментации кукурузы или патоки или путем окисления 2-пропанола. Ацетон — бесцветная жидкость. Среди его многочисленных применений — растворитель для лака (включая лак для ногтей), ацетат целлюлозы, нитрат целлюлозы, ацетилен, пластмассы и лаки; как средство для снятия краски и лака; и как растворитель в производстве фармацевтических препаратов и химикатов.
Его производят путем ферментации кукурузы или патоки или путем окисления 2-пропанола. Ацетон — бесцветная жидкость. Среди его многочисленных применений — растворитель для лака (включая лак для ногтей), ацетат целлюлозы, нитрат целлюлозы, ацетилен, пластмассы и лаки; как средство для снятия краски и лака; и как растворитель в производстве фармацевтических препаратов и химикатов.
Вы можете просмотреть стенограмму «Альдегиды и кетоны: названия + свойства» здесь (откроется в новом окне).
Карбоновые кислоты и сложные эфиры
Запах уксуса обусловлен присутствием в уксусе карбоновой кислоты. Запах спелых бананов и многих других фруктов обусловлен наличием сложных эфиров, соединений, которые могут быть получены реакцией карбоновой кислоты со спиртом. Поскольку сложные эфиры не имеют водородных связей между молекулами, они имеют более низкое давление паров, чем спирты и карбоновые кислоты, из которых они получены (см. Рисунок 2).
Рисунок 2. Сложные эфиры отвечают за запахи, связанные с различными растениями и их плодами.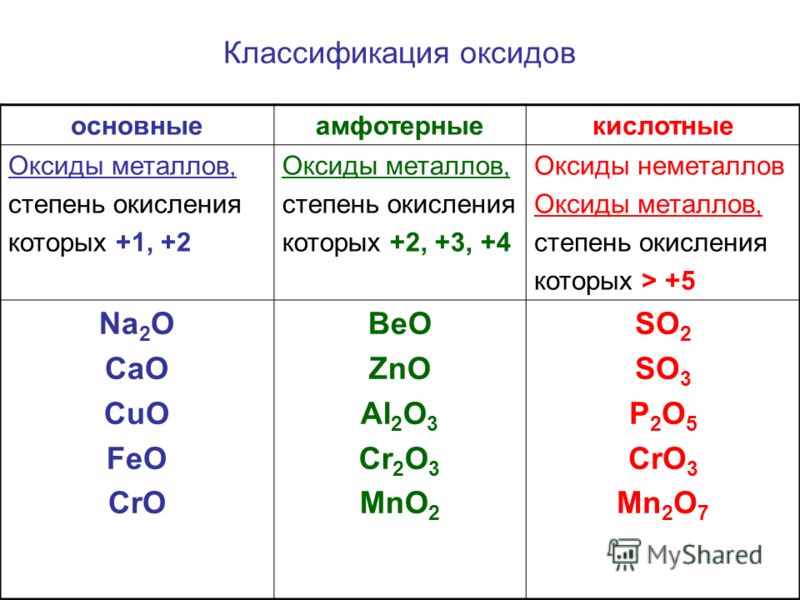
Обе карбоновые кислоты и сложные эфиры содержат карбонильную группу со вторым атомом кислорода, связанным с атомом углерода в карбонильной группе одинарной связью. В карбоновой кислоте второй атом кислорода также связан с атомом водорода. В сложном эфире второй атом кислорода связан с другим атомом углерода. Названия карбоновых кислот и сложных эфиров включают префиксы, которые обозначают длину углеродных цепей в молекулах, и получены в соответствии с правилами номенклатуры, аналогичными правилам для неорганических кислот и солей (см. эти примеры):
Функциональные группы кислоты и сложного эфира показаны в этих формулах красным цветом.
Атом водорода в функциональной группе карбоновой кислоты будет реагировать с основанием с образованием ионной соли:
Карбоновые кислоты являются слабыми кислотами (см. главу о кислотах и основаниях), что означает, что они не ионизированы в воде на 100%. . Обычно только около 1% молекул карбоновой кислоты, растворенной в воде, ионизируется в любой момент времени. Остальные молекулы не диссоциируют в растворе.
Остальные молекулы не диссоциируют в растворе.
Карбоновые кислоты получают окислением альдегидов или спиртов, у которых функциональная группа –ОН расположена на атоме углерода в конце цепочки атомов углерода в спирте:
Сложные эфиры получают реакцией кислот со спиртами. Например, этилацетатный эфир CH 3 CO 2 CH 2 CH 3 образуется при взаимодействии уксусной кислоты с этанолом: известен с 1670 года. Его название происходит от латинского слова formicus , что означает «муравей»; впервые он был выделен путем перегонки красных муравьев. Он частично отвечает за боль и раздражение от укусов муравьев и ос, а также за характерный запах муравьев, который иногда можно обнаружить в их гнездах.
Уксусная кислота, CH 3 CO 2 H, содержит 3–6% уксуса. Яблочный уксус получают, позволяя яблочному соку бродить без присутствия кислорода. Дрожжевые клетки, присутствующие в соке, осуществляют реакции брожения. Реакции брожения превращают сахар, присутствующий в соке, в этанол, а затем в уксусную кислоту. Чистая уксусная кислота имеет резкий запах и вызывает болезненные ожоги. Это отличный растворитель для многих органических и некоторых неорганических соединений, и он необходим для производства ацетата целлюлозы, компонента многих синтетических волокон, таких как искусственный шелк.
Реакции брожения превращают сахар, присутствующий в соке, в этанол, а затем в уксусную кислоту. Чистая уксусная кислота имеет резкий запах и вызывает болезненные ожоги. Это отличный растворитель для многих органических и некоторых неорганических соединений, и он необходим для производства ацетата целлюлозы, компонента многих синтетических волокон, таких как искусственный шелк.
Отличительные и привлекательные запахи и вкусы многих цветов, духов и спелых фруктов обусловлены присутствием одного или нескольких сложных эфиров (рис. 3). Среди наиболее важных природных сложных эфиров жиры (такие как сало, жир и сливочное масло) и масла (такие как льняное, хлопковое и оливковое масла), которые являются сложными эфирами глицерина тригидроксильного спирта, C 3 H 5 (OH) 3 , с большими карбоновыми кислотами, такими как пальмитиновая кислота, CH 3 (CH 2 ) 14 CO 2 H, стеариновая кислота, CH 3 (CH 2 ) 16 CO 2 H, и олеиновая кислота, [латекс] {\ text {CH}}_ {3} \left({\text{CH}}_{2}\right)}_{7}\text{CH}=\text{CH}{\left({\text{CH}}_{2}\right )}_{7}{\text{CO}}_{2}\text{H}[/latex].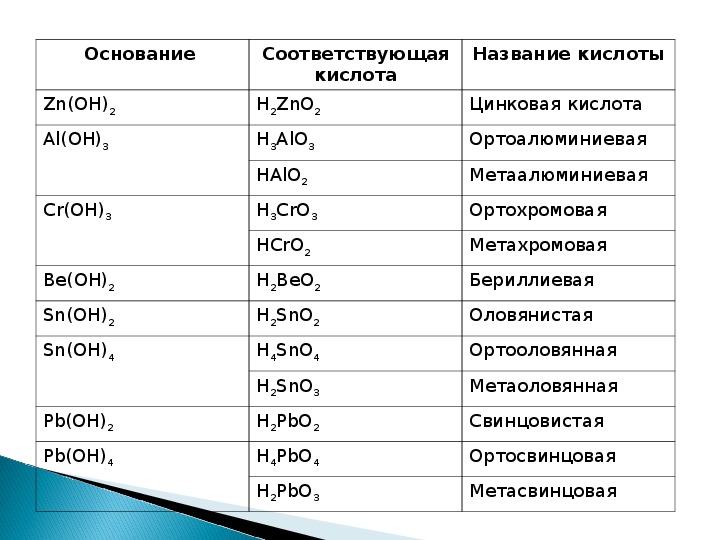 Олеиновая кислота является ненасыщенной кислотой; он содержит двойную связь [латекс]\текст{С}=\текст{С}[/латекс]. Пальмитиновая и стеариновая кислоты представляют собой насыщенные кислоты, не содержащие двойных или тройных связей.
Олеиновая кислота является ненасыщенной кислотой; он содержит двойную связь [латекс]\текст{С}=\текст{С}[/латекс]. Пальмитиновая и стеариновая кислоты представляют собой насыщенные кислоты, не содержащие двойных или тройных связей.
Рисунок 3. В клубнике было обнаружено более 350 различных летучих молекул (многие члены семейства сложных эфиров). (кредит: Ребекка Сигел)
Вы можете просмотреть стенограмму «Карбоновые кислоты: названия + свойства» здесь (откроется в новом окне).
Ключевые понятия и резюме
Функциональные группы, связанные с карбонильной группой, включают группу –CHO альдегида, группу –CO– кетона, группу –CO 2 H группы карбоновой кислоты и –CO 2 R группа сложного эфира. Карбонильная группа, двойная углерод-кислородная связь, является ключевой структурой в этих классах органических молекул: альдегиды содержат по крайней мере один атом водорода, присоединенный к карбонильному атому углерода, кетоны содержат две углеродные группы, присоединенные к карбонильному атому углерода, карбоновые кислоты содержат гидроксильную группу, присоединенную к карбонильному атому углерода, а сложные эфиры содержат атом кислорода, присоединенный к другой углеродной группе, связанной с карбонильным атомом углерода.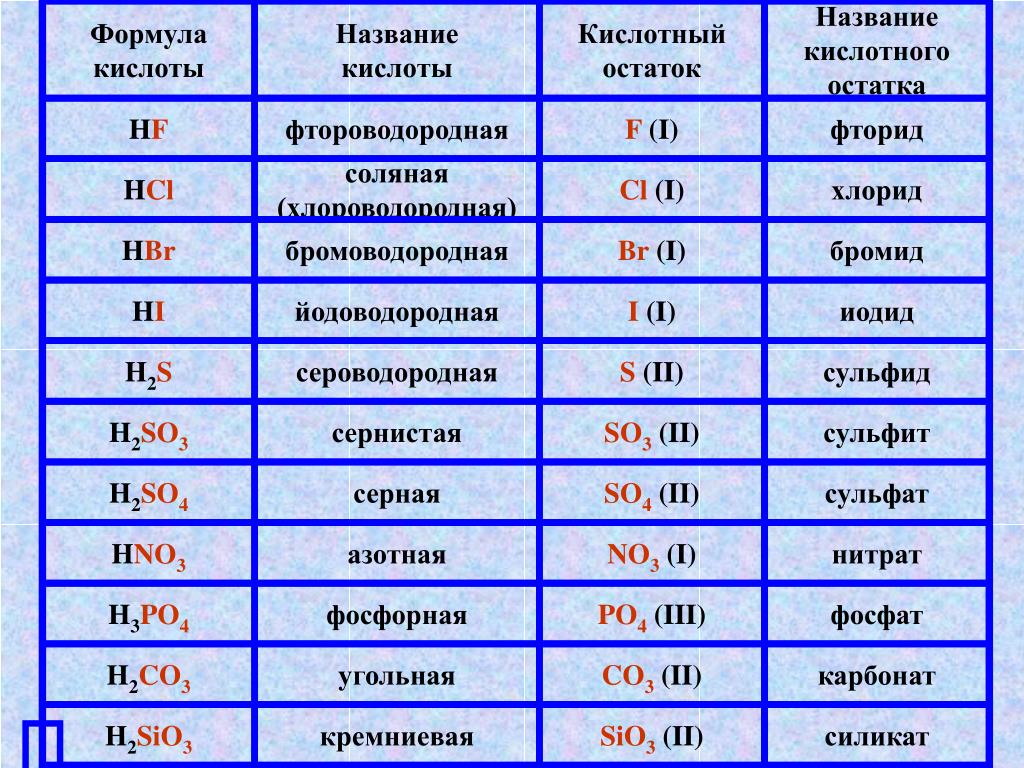 Все эти соединения содержат окисленные атомы углерода по отношению к атому углерода спиртовой группы.
Все эти соединения содержат окисленные атомы углерода по отношению к атому углерода спиртовой группы.
Попробуйте
- Расположите следующие молекулы от наименее до наиболее окисленных в зависимости от отмеченного атома углерода:
- Предскажите продукты окисления молекул, показанных в этой задаче. В каждом случае определите продукт, который будет получен в результате минимального повышения степени окисления выделенного атома углерода:
- Предскажите продукты восстановления следующих молекул. В каждом случае определите продукт, который будет получен в результате минимального уменьшения степени окисления выделенного атома углерода:
- Объясните, почему невозможно получить кетон, содержащий только два атома углерода.
- Как изменяется гибридизация замещенного атома углерода при превращении спирта в альдегид? Альдегид карбоновой кислоты?
- Жирные кислоты представляют собой карбоновые кислоты, которые имеют длинные углеводородные цепи, присоединенные к карбоксилатной группе.
 Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи?
Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи? - Напишите сокращенную структурную формулу, такую как CH 3 CH 3 , и опишите молекулярную геометрию каждого атома углерода.
- пропилен
- 1-бутанол
- этилпропилпропиловый эфир
- цис -4-бром-2-гептен
- 2,2,3-триметилгексан
- формальдегид
- Напишите сокращенную структурную формулу, такую как CH 3 CH 3 , и опишите молекулярную геометрию каждого атома углерода.
- 2-пропанол
- ацетон
- диметиловый эфир
- уксусная кислота
- 3-метил-1-гексен
- Неприятный запах прогорклого масла вызывается масляной кислотой, CH 3 CH 2 CH 2 CO 2 H.
- Изобразите структуру Льюиса и определите степени окисления и гибридизации для каждого атома углерода в молекуле.

- Сложные эфиры, образующиеся из масляной кислоты, представляют собой приятно пахнущие соединения, содержащиеся во фруктах и используемые в парфюмерии. Изобразите структуру Льюиса сложного эфира, образующегося при взаимодействии масляной кислоты с 2-пропанолом.
- Изобразите структуру Льюиса и определите степени окисления и гибридизации для каждого атома углерода в молекуле.
- Напишите двухрезонансные структуры ацетат-иона.
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сокращенных формул, а другое с использованием структур Льюиса:
- этанол реагирует с пропионовой кислотой
- Бензойная кислота, C 6 H 5 CO 2 H, добавляется к раствору гидроксида натрия
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сокращенных формул, а другое с использованием структур Льюиса.
- 1-бутанол реагирует с уксусной кислотой
- пропионовую кислоту наливают на твердый карбонат кальция
- Выходы в органических реакциях иногда низкие.




 Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи?
Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи?

Leave A Comment