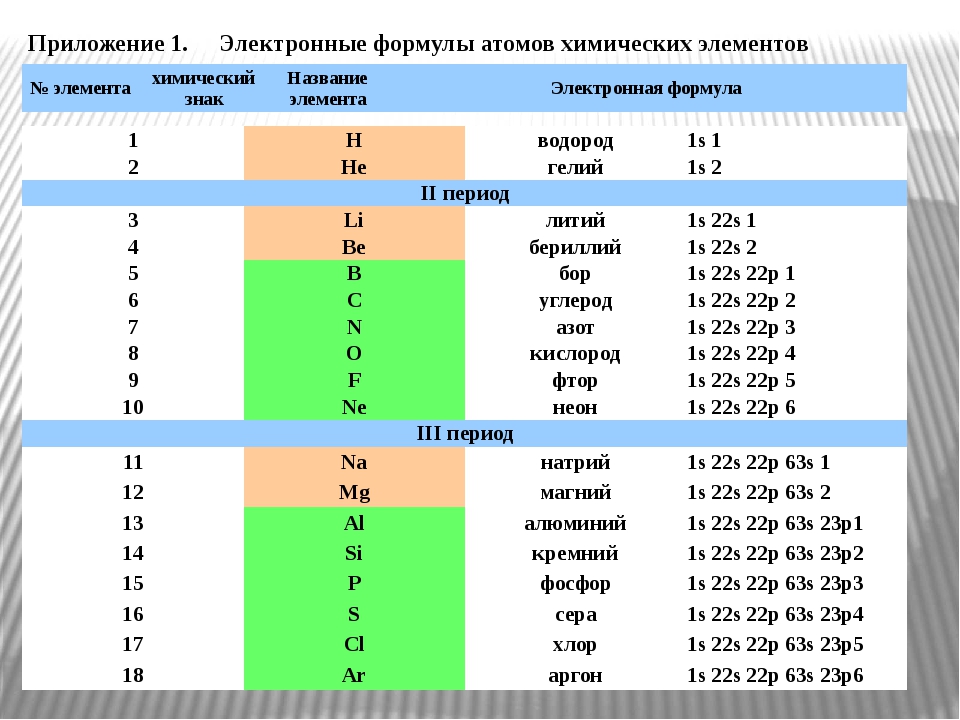
1 Химические элементы расположены в порядке возрастания атомных радиусов в ряду — Документ
№2.
ТЕСТ 1.
1. Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) B,C, N 2) N, P, As 3) Na, Mg, K 4) B, Si, N
2. В атоме железа число свободных 3d – орбиталей равно
1) 0 2) 3 3) 1
3.В ряду химических элементов Li—Be—B—C
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4.Наибольшей восстановительной активностью обладает
1) Ca 2) K 3) AI 4) Si
5. У какого элемента наиболее выражены металлические свойства
1) Li 2) Fe 3) Na 4) Mg
ТЕСТ 2.
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду.
1) K, Rb, Cs 2) Rb, Sr, In 3) AI, Na, Mg 4) O, S, CI
2.В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением числа нейтронов в ядре
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением радиуса атомов
3. В ряду химических элементов Si—P—S—CI
В ряду химических элементов Si—P—S—CI
1) увеличивается число электронных слоев в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) уменьшается радиус атомов
4.Наибольшей восстановительной активностью обладает
1) Si 2) P 3) S 4)CI
5. Высший оксид состава ЭО образуют все элементы
1) IV A группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 3.
1. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Ga, Ge, As 2) AI, Ga, Ge 3) As, P,Ge 4) Se, As, Ge
2. Водородное соединение, окрашивающее раствор лакмуса в синий цвет, образует
1) углерод 2) азот 3) фтор 4) кислород
3.В ряду химических элементов Be—Mg—Ca—Sr
1) увеличивается число валентных электронов в атомах
2)уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
4. Наименьшую энергию ионизации имеет
Наименьшую энергию ионизации имеет
1) In 2) TI 3) Ga
5.Высший оксид состава ЭО2 образуют все элементы
1) IV Ф группы 2) II А группы 3) IV периода 4) II периода
ТЕСТ 4.
1.Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Mn, Fe, Co 2) Mn, Cr, Fe 3) AI, Sc, Ti 4) Ni, Cr, Sc
2. В побочных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением радиуса атомов
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением заряда ядра
3.Соединения состава KH2ЭO4 и K2HЭO4 образует элемент
1) хлор 2) сера 3) азот 4) фосфор
4.Наибольшей восстановительной активностью обладает
1) Br 2) As 3) Ga 4) Ge
5. У какого элемента наиболее выражены металлические свойства
1) K 2) Rb 3) Cs 4) Sr
ТЕСТ 5.
1.Химические элементы расположены в порядке возрастания атомных радиусов в ряду
1) Zn, Cd, Ca 2) Br, CI, F 3)In, Sn, Sb 4) Br, Se, As
2. В атоме титана число свободных 3d орбиталей равно
1) о 2) 4 3) 2 4) 3
3.В ряду оксидов SiO2—P2O5—SO3—CI2O7 кислотные свойства 1)возрастают 2) убывают 3) не изменяются 4) сначала уменьшаются, потом увеличиваются
4. Наибольшей восстановительной активностью обладает
1) Mn 2) Ca 3) K 4) Rb
5. Соединение состава H2Э2 образует
1) углерод 2) кремний 3) бор 4) азот
ТЕСТ 6.
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду.
1) Pb, Sn, Ge 2) Ga, In, TI 3) K, Rb, Cs 4) Li, Na, Ca
2. в Главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
1) увеличении числа энергетических уровней 2) увеличении числа протонов в ядре 3) уменьшении радиуса атома 4) увеличении числа валентных электронов.
3.В ряду S—P—Si—AI
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) увеличивается высшая степень окисления элементов
4) ослабевают металлические свойства элементов.
4.Высшая степень окисления в ряду химических элементов
Галлий—германий—мышьяк – селен
1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5.Высший оксид состава Э2О3 образуют все элементы
1) III А группы 2) IV А группы 3) VI А группы 4) VII А группы
ТЕСТ 7.
1.Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
1) Ba, Cd, Ra 2) In, Pb, Sb 3) Cs, Na,H 4) Br, Se, As
2.В ряду элементов натрий—магний—алюминий возрастает их
1) атомный радиус 2) восстановительная способность 3) химическая активность 4) электроотрицательность
3.В ряду Mg—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4. Высшая степень окисления в ряду химических элементов
Высшая степень окисления в ряду химических элементов
Индий—олово—сурьма—теллур
1) уменьшается 2) не изменяется 3) увеличивается 4) сначала увеличивается, затем уменьшается
5.У какого элемента наиболее выражены металлические свойства
1) Be 2) AI 3) Ca 4)Sr
ТЕСТ 8.
1.Химические элементы расположены в порядке увеличения атомных радиусов в ряду.
1) Zn, Ca, Cd 2) F, CI, Br 3) In, Sn, Sb 4) As, Se, Br
2. Простые вещества расположены в порядке усиления металлических свойств в ряду
1) Ca, K, AI 2) AI, Ga, Sr 3) Ca, Sc, Ti 4) Cr, Mn, Fe
3.В ряду AI—Si—P—S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
4.Высшая степень окисления в ряду химических элементов
Титан—ванадий—хром—марганец 1) увеличивается 2) уменьшается 3) не изменяется 4) сначала уменьшается, затем увеличивается
5. Основные свойства оксидов усиливаются в ряду.
Основные свойства оксидов усиливаются в ряду.
1) Na2O, MgO,AI2O3 2) MgO,AI2O3 3) AI2O3, MgO, Na2O 4) AI2O3, Na2O,MgO
№3. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
ТЕСТ 1.
1.В молекуле CO2 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду представлены вещества только с ионной связью?
1) SiO2, CaO, Na2SO4 2)HCIO4, CO2, NaBr 3) MgO, NaI, CsO2 4) H2O, AICI3, PbI
3. Число σ – связей в молекуле бромбензола равно
1) 8 2) 6 3) 12 4) 7
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе
1) NH3 2) (NH4)2S 3) CCI4 4) SiF4
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) O3 u Na3N 2) O2 u NH3 3) O2 u HBr 4) O2 u S8
ТЕСТ 2.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) NaCI u CI2 2) HCI u O2 3) O3u HF 4) NH3 u H2O
2.Прочность углерод-углеродной связи в ряду
Пропан—пропен—пропин
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле серной кислоты равно
1) 4 2) 2 3) 8 4) 6
4.Химическая связь в молекуле этана и хлориде лития соответственно
1) водородная и ковалентная полярная 2) ковалентная слабополярная и ионная 3) ионная и ковалентная неполярная 4) ковалентная неполярная и ковалентная полярная
5.В оксидах металлов связь
1) ковалентная полярная 2) ковалентная неполярная 3) ионная 4) ковалентная слабополярная
ТЕСТ 3.
1.В хлориде натрия химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2.В каком ряду записаны вещества с ионной связью?
1) TiO2, Ca3N2, Na2S 2) KCIO3, C2H2, NaBr 3)CO, NaIO3, C2H5OH 4) H2S, AICI3, NaHCO3
3. Число σ – связей в молекуле этанола равно
1) 6 2) 8 3) 7
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе
1) OH— 2) SO42- 3) H3O+ 4) CaOH+
5.Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) N2 u O3 2) N2 u NO 3) N2 u NaCI 4) N2 u CaSO4
ТЕСТ 4.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) HI u H2 2) HCI u Ca 3) O3 u PH3 4) P4 u H2Se
2. Прочность углерод — углеродной связи в ряду
Прочность углерод — углеродной связи в ряду
Этин- этилен- этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле оксида углерода (4) равно
1)2 2) 4 3) 1 4) 3
4.Химическая связь в молекулах хлористого метила и азота соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ковалентная полярная и ковалентная неполярная
4) ионная и ковалентная неполярная
5.В гидроксосоединениях неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 5.
1.В молекуле NH3 химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2.Путем соединения атомов одного и того же химического элемента образуется связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3.Число σ- связей в молекуле этина равно
1) 5 2) 4 3) 3
4. По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе.
По донорно-акцепторному механизму образована одна из ковалентных связей в соединении или ионе.
1) AI(OH)2+ 2) NH4+ 3)FeOH+ 4) CH4+
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) P4 u N2O 2) P4 u SO3 3) P4 u LiCI
ТЕСТ 6.
1.Соединениями с ковалентной полярной и ковалентной неполярной связью являются соответственно
1) I2 u H2Те 2) HBr u N2 3) Fe u HF 4) CO u SO2
2.Прочность углерод- углеродной связи в ряду
Этилен — этин – этан
1) увеличивается 2) сначала увеличивается, затем уменьшается 3) уменьшается 4) не изменяется
3.Число π – связей в молекуле фосфорной кислоты равно
1) 8 2) 1 3) 6 4) 2
4.Химическая связь в молекулах водорода и этанола соответственно
1) водородная и ковалентная полярная
2) ковалентная слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5. Соединениями с ковалентной неполярной и ионной связью являются соответственно.
Соединениями с ковалентной неполярной и ионной связью являются соответственно.
1) CO u O3 2) CaO u SO3 3) NH3 u H2 4) S8 u Li4Si
ТЕСТ 7
1.В молекуле HCI химическая связь
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
2. В каком ряду записаны вещества только с ионной связью?
1) CH3COONa, AI4C3, Na2SO4,AI4C3, Na2SO4 2) KCI, CaH2, NaCI 3) CO, NaIO3, C2H5OH 4) S8 AI(NO3)3, O3
3. Число σ – связей в молекуле циклогексана равно
1) 12 2) 14 3) 18 4) 16.
4.По донорно-акцепторному механизму образована одна из ковалентных связей в соединении.
5.В оксидах неметаллов связь
1) ионная 2) ковалентная слабополярная 3) ковалентная полярная 4) ковалентная неполярная
ТЕСТ 8.
1.Между атомами элементов с порядковыми номерами 11 и 17 возникает связь
1) металлическая 2) ионная 3) ковалентная 4) донорно-акцепторная
2.Атом химического элемента, образующего с галогеном соединение с ионной связью, имеет электронную конфигурацию
1) 1s22s22p6 2) 1s22s22p63s1 3) 1s22s22p63s23p3 4) 1s22s22p63s23p5
3.Число π – связей в молекуле этена равно
1) 1 2) 4 3) 2 4) 3
4.Химическая связь в хлориде бария и озоне соответственно
1) водородная и ковалентная полярная
2) Ковалентная и слабополярная и ионная
3) ионная и ковалентная неполярная
4) ковалентная неполярная и ковалентная полярная
5. Ковалентная связь образуется за счет
1) неспаренных электронов с противоположными спинами
2) неспаренных электронов с одинаковыми спинами
3) полной передачи электронов внешнего энергетического уровня
4) полной передачи электронов внешнего и предвнешнего энергетических уровней.
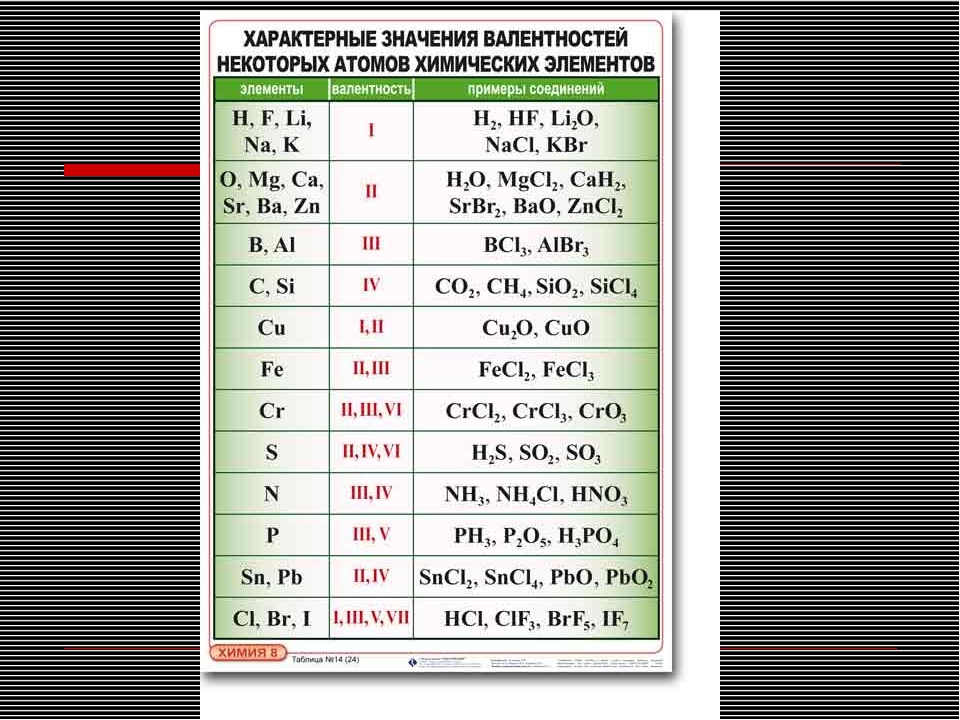
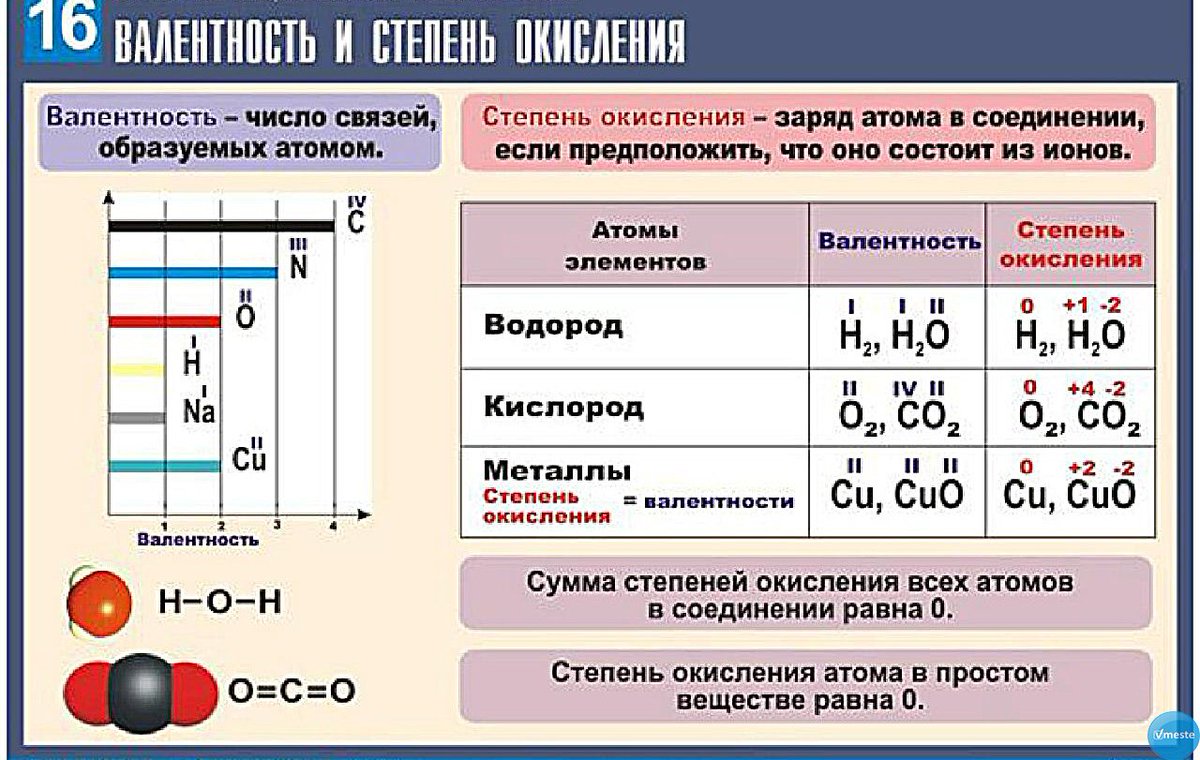
№4 Электроотрицательность. Степень и окисления и валентность химических элементов.
ТЕСТ 1.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) S 3) Br 4)O
2. Степень окисления – 3 фосфор проявляет в соединении.
1) P2O3 2) P2O5 3) Ca3P2 4) Ca(H2PO4)2
3. Степень окисления азота в ионе NH4+ равна 1) +5 2) +3 3) -3 4) +1
4.Валентность III характерна для
1) Сф 2) P 3) O 4) Si
5.Все элементы в каком ряду могут проявлять степени окисления -1 и +5?
1) Rb, Ca, Li 2) H,Si,F 3) CI, I, Br 4) As, N, Te
ТЕСТ 2
1.Наибольшую степень окисления хром проявляет в соединении
1) K2Cr2O7 2) Cr2O3 3) Cr(OH)2 4) NaCrO2
2. В соединении NH3, N2O3, HNO2 степень окисления азота соответственно равна
1) -3, +3, +3 2) +3,+5,+4 3) +4,+3,+1 4) _3, +5,+3
3. Верны ли следующие утверждения?
Верны ли следующие утверждения?
А.Высшая валентность элемента определяется номером группы
Б.Высшая валентность элемента определяется номером периода
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов III А группы наиболее электроотрицательным является
1) AI 2) B 3) In 4) Ga
5.Все элементы в каком ряду могут проявлять степень окисления +5?
1) P, N, CI 2) C, Se, F 3) O,B,I 4) Br, As, Sn
ТЕСТ 3.
1.Наибольшую электроотрицательность имеет элемент
1) Na 2) Li 3) Rb 4) K
2. Степень окисления – 3 азот проявляет в соединении
1) N2O3 2) N2O4 3) NaNO3 4) NH4OH
3.Степень окисления азота в ионе NO2— равна
1) +5 2) +3 3) -3 4) +4
4.Валентность III характерна для
1) Be 2) F 3) AI 4) C
5. Все элементы в каком ряду проявлять степени окисления -3 и +5?
1) AI, Ca, Li 2) B, Sb, Bi 3) CI, I, Br 4)As, N, P
ТЕСТ 4.
1.Наибольшую степень окисления сера проявляет в соединении
1) KHSO3 2)Na2S 3) H2SO4 4) S8
2. В соединениях (NH4)2HPO4, (NH4)3PO3, Ca3P2 степень окисления фосфора соответственно равна
1) -5, +3, -3 2)+3,+5,-3 3) +5, +3,-3 4)-3,+5,+3
3.Верны ли следующие утверждения?
А.Высшая валентность элемента определяется числом неспаренных электронов в возбужденном состоянии и способностью элемента образовать связь по донорно- экцепторному механизму.
Б.Высшая валентность элемента определяется числом неспаренных электронов.
1) верно только А 2) Верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Среди элементов IV группы наиболее электроотрицательным является
1) Si 2) Ge 3) C 4)Sn
5. Все элементы в каком ряду могут проявлять степень окисления -3? 1) Ga, AI, Be 2) C, Se, F 3) S, Br, In 4) P,N,Sb
ТЕСТ 5.
1.Наибольшую электроотрицательность имеет элемент
1) N 2) P 3) As 4)Sb
2.Наибольшую степень окисления железо проявляет в соединении
1) K4[Fe (CN)6] 2) K3[Fe(CN)6] 3)FeO 4) Fe (OH)2
3. Степень окисления – 3 мышьяк проявляет в соединении
1) As2O3 2) Na3AsO4 3) CaAs2 4) As2O5
4. Степень окисления хрома в ионе CrO42- равна
1)+3 2) +4 3) -2 4) +6
5.Валентность III характерна для
1) O 2)In 3) Mg 4) Se
ТЕСТ 6.
1.Наибольшую степень окисления азот проявляет в соединении
1) HNO3 2) Na3N 3)N2O 4) N2H4
2. В соединениях NH4CI, LiCIO4, CI2O степень окисления хлора соответственна равна
1) -1, +7, +3 2) +3,+7,-1 3) -1, +5,-3 4) -1,+7,+1
3. Верны ли следующие утверждения?
Верны ли следующие утверждения?
А.Высшая валентность элемента определяется его порядковым номером
Б.Высшая валентность элемента определяется числом электронов на внешнем электроном уровне.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +7?
1) Sb,AI,Be 2) Sn , Te, F 3) CI,Br,I 4) P,N,O
5. Все элементы, в каком ряду могут проявлять степень окисления -2 +6?
TI, Ca, Sn 2) S, Se, Te 3) Si, Sb,Te 4)C,O,P
ТЕСТ 7.
1.Наибольшую электроотрицательность имеет элемент
1) Ca 2) As 3) Se 4) Br
2. Степень окисления – 2 сера проявляет в соединении
1) S8 2) Na2S 3) CaSO4 4) SO2
3/Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. количество валентных состояний и степеней окисления элемента определяется его природой и положением в периодической системе
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны.
4.Среди элементов 6 А группы наиболее электроотрицательным является
1) O 2) S 3) Se 4) Te
5.Валентность IV характерна для
1) Сa 2) P 3) O 4)Si
ТЕСТ 8.
1.Наибольшую степень окисления фосфор проявляет в соединении
1) KH2PO3 2) Na3P 3) H3PO4 4) P4
2. Степень окисления фосфора в ионе PO3-3 равна
1) +5 2) +3 3) -3 4) -5
3.Верны ли следующие утверждения?
А.Каждый химический элемент имеет единственную степень окисления, равную номеру группы.
Б. Число валентных состояний и степеней окисления элемент может быть разным
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
4.Все элементы в каком ряду могут проявлять степень окисления +2?
1) С, Mg, Be 2) Ga, AI, Fe, 3) CI, Br, S 4) P, N, O
5. Какую валентность имеет железо в соединении, которое образуется при взаимодействии с соляной кислотой?
1) 1 2)2 3)3 4) 8
№5 Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки.
Зависимость свойств веществ от особенностей их кристаллической решетки.
ТЕСТ 1.
1.Молекулярную кристаллическую решетку имеет соединение
1) H2S 2) NaCI 3)SiO2 4)Cu
2. Молекулярное строение имеет каждое из соединений:
1) C2H5OH, H2S 2) CaBr2, NO2 3) Ca (OH)2, NH3 4) KNO3, Na2S
3. Наиболее высокую температуру плавления имеет вещество
1) NaCI 2) H2O 3) C2H5OH 4) Cu
4.Вода имеет кристаллическую решетку
1) атомную 2) ионную 3) металлическую 4) молекулярную
5.Термин «молекула» применим к веществам, имеющими кристаллическую решетку
1) ионную 2) атомную 3)молекулярную 4) металлическую
ТЕСТ 2.
1.Молекулярную кристаллическую решетку имеет соединение
1) Na2SO3 2) CaO 3) S8 4)Mg2Si
2. Молекулярное строение имеет имеет каждое из соединений:
Молекулярное строение имеет имеет каждое из соединений:
1) С6H5ONa, H2Se 2) CH4, NO2 3)BaCI2, NH3 4) NH2CH2COOH, Na2S
3. Наиболее высокую температуру плавления имеет вещество
1) NaOH 2) H2S 3) W 4) C2H5ONa
4.Фенол имеет кристаллическую решетку
1) атомную 2) металлическую 3) ионную 4) молекулярную
5.Вещества молекулярного строения характеризуются
1) низкой температурой плавления и кипения
2) непостоянством состава
3) высокой твердостью
4) электропроводностью
ТЕСТ 3
1.Молекулярную кристаллическую решетку имеет соединение
1) (NH4)2SO4 2) NiZn3 3) NO2 4)A4C3
2. Молекулярное строение имеет каждое из соединений: 1) C2H6, K2SO4 2) HBr, KNO2 3) C2H2, N2H4 4) BaO, Na2CO3
3. Наиболее высокую температуру плавления имеет вещество
Наиболее высокую температуру плавления имеет вещество
1) HCI 2)NaOH 3) O2 4) C6H6
4. Иод имеет кристаллическую решетку
1) ионную 2) атомную 3) молекулярную 4) металлическую
5.Вещества молекулярного строения характеризуются
1) Высокой температурой плавления 2) постоянством состава 3) высокой твердостью 4) электропроводностью
ТЕСТ 4.
1.Молекулярную кристаллическую решетку имеет соединение
1) оксид фосфора (V) 2) хлорид бария 3) алмаз 4) гидроксид калия
2.Молекулярное строение имеет каждое из соединений:
1) H2O, K2SO4 2) C6H12O6, NH3 3) HCI, KNO3 4) BaO, Na2CO3
3.Наиболее высокую температуру плавления имеет вещество
1) HI 2) C12H22O4 3) N2 4) NaOH
4.Стеариновая кислота имеет кристаллическую решетку
А) атомную 2) ионную 3) металлическую 4) молекулярную
5. Вещества молекулярного строения характеризуются
Вещества молекулярного строения характеризуются
1) высокой температурой плавления 2) низкой температурой кипения 3) твердостью 4) электропроводностью
ТЕСТ 5
1.Молекулярную кристаллическую решетку имеет соединение
1) хлорат калия 2) сульфид натрия 3) сухой лед 4) челийская селитра
2.Немолекулярное строение имеют все неметаллы группы
1) углерод,бор, кремний 2) фтор, бром, йод 3) кислород, сера, азот 4) хлор, фосфор, селен
3.Металлы имеют кристаллическую решетку
1) ионную 2) металлическую 3) молекулярную 4) атомную
4.Термин «молекула» применим к веществу
1) H2O 2) NaCI 3) Na2O2 4) AI4C
5. Вещества молекулярного строения не характеризуются
1) низкой температурой плавления и кипения
2) постоянством состава
3) твердостью
4) невысокой электропроводностью
ТЕСТ 6
1.Молекулярную кристаллическую решетку имеет каждое из соединений
1) фтор и иод 2) оксид углерода (4) и золото 3) бром и железо 4) латунь и сульфат натрия
2. Немолекулярное строение имеет каждое из соединений:
Немолекулярное строение имеет каждое из соединений:
1) H2O, H2SO4 2) I2, CO 3) CaO,AI4C3 4) KNO3, O2
3. Кристаллическая сера, имеет кристаллическую решетку
1)атомную 2) ионную 3) молекулярную 4) атомно-ионную
4.Термин «молекула» применим к веществу
1) С6H5ONa 2) CH3COONa 3) CH2O 4) NH2CH2COOK
5.Ионную решетку имеет каждое из двух веществ:
1) NaCI, H2S 2) KF, H2O 3) HNO3, Cs2S 4) Na2CO3, K2S
ТЕСТ 7.
1.Атомную кристаллическую решетку имеет каждое из двух веществ:
1) хлорид натрия и алмаз
2) оксид углерода (4) и кремний
3) алмаз и графит
4) оксид кремния (4) и белый фосфор
2.Немолекулярное строение имеет каждое из соединений:
1) Cu, H2S 2) Ag, CO2 3) LiCIO3, N2O 4) CsCI, K3PO3
3. Кварц имеет, кристаллическую решетку
Кварц имеет, кристаллическую решетку
1) ионную 2) молекулярную 3) атомную 4) металлическую
4.Термин «молекула» не применим к веществу
1) Na3N 2) SO2 3) O3 4) P4
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) O2, BaSO3 2) CO2, Na2S 3) O3, Cs2S 4) KF, K2O
ТЕСТ 8.
1.К веществам с атомной кристаллической решеткой относятся
1) натрий, фтор, оксид серы (4)
2) свинец, азотная кислота, оксид магния
3) бор, алмаз, карбид кремния
4) хлорид калия, белый фосфор, иод
2. Какие из утверждений верны?
А. Вещества с молекулярной решеткой имеют низкие температуры плавления и низкую электропроводность
Б.Вещества с атомной решеткой пластичны и обладают электрической проводимостью.
1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны
3. Атомную кристаллическую решетку имеет каждое из двух веществ:
Атомную кристаллическую решетку имеет каждое из двух веществ:
1) оксид кремния (4) и оксид углерода (4) 2) графит и оксид кремния (4)
3) хлор и иод 4) хлорид калия и фторид натрия
4.Термин «молекула» неприменим к веществу
1) H2O2 2) KCI 3) CH3OH 4) C2H6
5. Ионную кристаллическую решетку имеет каждое из двух веществ:
1) S8, KNO3 2) Na2S, KF 3)NaNO2, H2S 4) F2, H2O2
№6. Классификация неорганических веществ.
Классификация и номенклатура органических веществ
ТЕСТ 1.
1.В перечне веществ
А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е.CO2
Кислотными оксидами являются
1) АБВ 2) ВГД 3)ГДЕ 4)БГЕ
2.В перечне веществ А.ВaO Б. CaO В.Na2O Г.SO3 Д.P2O5 Е. CO2
CO2
Основными оксидами являются
1)АБВ 2) ВГД 3)ГДЕ 4)БГЕ
3.В перечне веществ
А) ZnO Б)CuO В)FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Амфотерными оксидами являются
1) АБВ 2)ВГД 3) АГД 4) БГЕ
4.В перечне веществ
А) Fe(OH)3 Б. NaHCO3 В.H2O Г.H2O2 Д.Ca(OH)2 Е. NaOH
Гидроксидами являются
1) АБГ 2)АДЕ 3) БГД 4) ВДЕ
5.В перечне кислот
А) азотистая Б) ортофосфорная В) серная Г) бромоводородная д) азотная Е) сероводородная сильными кислотами являются
1) ВГД 2) АДЕ 3) АБД г) БГЕ
6.В перечне веществ
А) NH4CI Б)KH2PO4 В)[Zn(NH3)4]SO4 Г)NaHS Д)Ca(HCO3)2 Е)CH3NH3CI
Кислыми солями являются
1) АБВ 2) АБД 3) БГД 4) БГЕ
7.Только соли расположены в ряду
1) HCOOH, (C2H5)NH2Br, NaAI(SO4)3 2) NaH2PO3, NaNO3, KCIO3 3)SrBr2, AIOHCI2, HI 4) CaCO3, H2SO4, KHS
8. Основным оксидом и основной солью соответственно являются 1) СaO u CaOHCI 2)ZnO u NaHCO3 3)SO2 u FeOHCI2 4) BaO u Na2S
Основным оксидом и основной солью соответственно являются 1) СaO u CaOHCI 2)ZnO u NaHCO3 3)SO2 u FeOHCI2 4) BaO u Na2S
9. Основанием и кислой солью соответственно являются
1) HNO3 u NH4AI(SO4)2 2) H2S u NaNO3 3) H2SO3 u CaOHCI 4)KOH u KHCO3
10.Аллотропные модификации кислорода не отличаются
1) физическими свойствами 2) типом химической связи между атомами 3) химическими свойствами 4) числом атомов, входящих в состав молекул
ТЕСТ 2
1.В перечне веществ
А)MgO Б)Na2O В)CO2 Г)CI2O7 Д)CaO Е)CrO3
Кислотными оксидами являются
1) АБВ 2)ВГД 3)АБД 4)ВГЕ
2.В перечне веществ
А) ZnO Б)CuO В) FeO Г)Fe2O3 Д)Cr2O3 Е)CrO
Основными оксидами являются
1)А БВ 2)ВГД 3)ГДЕ 4) БВЕ
3. В перечне веществ
В перечне веществ
1) ВеО 2) Сr2O3 3) SO2 4) CrO3 5)Fe2O3 6) NO2
Амфотерными оксидами являются
1) АБВ 2) АБД 3)ГДЕ 4)БГЕ
4.В перечне веществ
А) Mg(OH)2 Б)RbOH В)Be(OH)2 Г)Zn(OH)2 Д)Ba(OH)2 Е)AI(OH)3
Основаниями являются
1) АБГ 2)АДЕ 3)АБД 4)БГЕ
5.В перечне кислот
А) угольная Б) ортофосфорная В) серная Г) хлорная Д) уксусная Е) сероводородная
Слабыми кислотами являются
1) ВГД 2) АДЕ 3)АБД 4) БГЕ
6.В перечне веществ
А) NH4CI Б)CuOHNO3 В)[Cu(NH3)4]SO4 Г)MgOHCI Д)(FeOH)2SO4 Е)CH3NH3CI
Периодическая система химических элементов
Дидактический материал
Тренировочные тесты ЕГЭ по химии
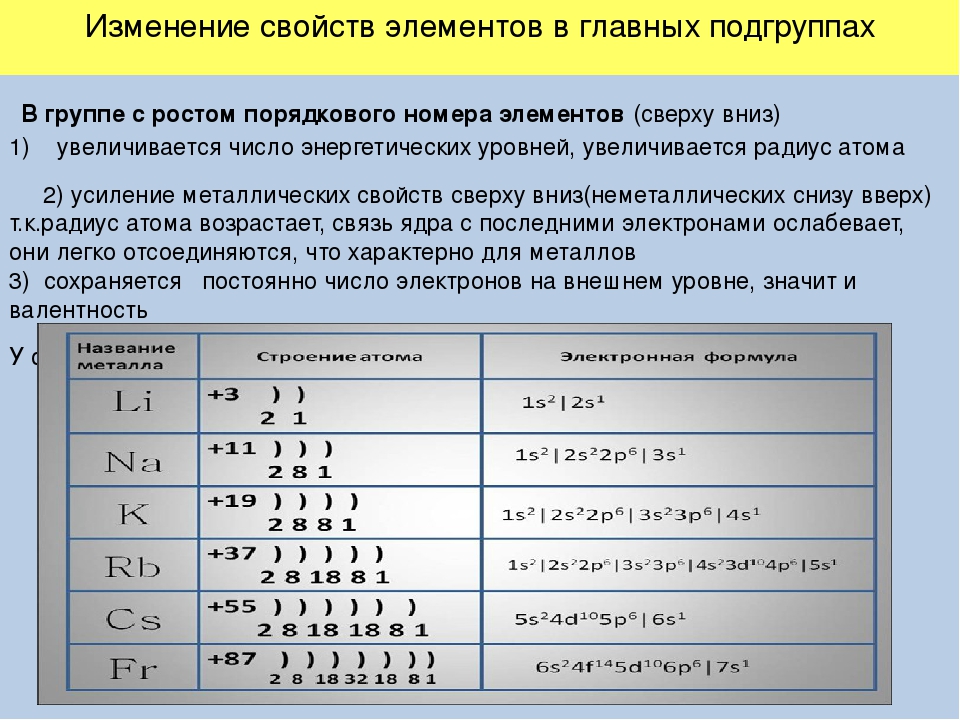
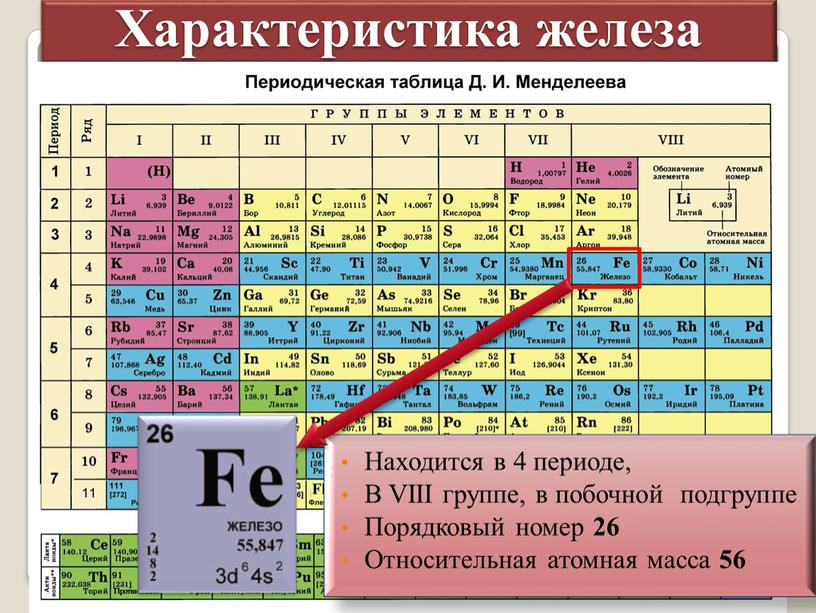
Закономерности изменения свойств химических элементов и их соединений по периодам и группам. Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
Общая характеристика металлов IA-IIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов: меди, цинка, хрома, железа — по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Общая характеристика неметаллов VIA-VIIA групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов.
1. В ряду Na —>Mg —>Al —>Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
2. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус
2) заряд ядра атома
3) число валентных электронов в атомах
4) электроотрицательность
3. В ряду элементов азот — кислород — фтор возрастает
В ряду элементов азот — кислород — фтор возрастает
1) валентность по водороду
2) число энергетических уровней
3) число внешних электронов
4) число неспаренных электронов
4. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
5. Какой элемент имеет более выраженные неметаллические свойства, чем кремний?
1) углерод 2) германий 3) алюминий 4) бор
6. С ростом заряда ядра атомов кислотные свойства оксидов в ряду
N2O5 —> P2O5 —> As2O5 —> Sb2O5
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
7. В порядке возрастания неметаллических свойств элементы расположены в ряду:
1) O,N,C,B
2) Cl,S,P,Si
3) C,Si,Ge,Sn
4) B,C,O,F
8. В порядке усиления металлических свойств элементы расположены в ряду:
В порядке усиления металлических свойств элементы расположены в ряду:
1) А1,Са,К 2) Ca.Ga.Fe 3) K,Al,Mg 4) Li,Be,Mg
9. В каком ряду элементы расположены в порядке возрастания их атомного радиуса?
1) Si,P, S.C1
2) O,S,Se,Te
3) At,I,Br,Cl
4) Mg,Al,Si, P
10. Какой элемент образует газообразное водородное соединен соответствующее общей формуле RH
1) бор 2) калий 3) сера 4) хром
11. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
12. В какой группе периодической системы находится элемент Э, входящий в состав кислоты НЭО4?
1) IV 2) V 3) VI 4) VII
 В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства
В ряду оксидов SiO2 — Р2О5 — SO2 — Cl2O7 кислотные свойства1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
14. В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1) Mg, Ca, Ва
2) Na, Mg, A1
3) K,Ca,Fe
4) Sc, Ca, Mg
15. По периоду слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
16. В порядке увеличения электроотрицательности химические элементы расположены в раду:
1) С, N, О 2) Si.Al.Mg 3) Mg,Ca, Ва 4) Р, S, Si
17. Химический элемент расположен в IV периоде, IA группе. Распределению электронов в атоме этого элемента соответствует ряд чисел:
1) 2,8,8,2
2) 2, 8, 18, 1
3) 2, 8, 8, 1
4) 2,8, 18,2
18. Электроотрицательность химических элементов с возрастанием заряда ядра атома
Электроотрицательность химических элементов с возрастанием заряда ядра атома
1) увеличивается и в периодах, и в группах
2) уменьшается и в периодах, и в группах
3) увеличивается в периодах, а в группах уменьшается
4) уменьшается в периодах, а в группах увеличивается
19. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Rb,K,Na,Li
2) Na,Mg,Al, S
3) F, Cl, Br, I
4) C,N, О, F
20. Среди элементов третьего периода наименьший атомный радиус имеет
1) натрий
2) алюминий
3) фосфор
4) сера
21. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) уменьшением радиуса атомов
2) увеличением числа энергетических уровней в атомах
3) уменьшением числа протонов в ядрах атомов
4) увеличением числа валентных электронов
22. По периоду слева направо уменьшается
По периоду слева направо уменьшается
1) число валентных электронов в атомах
2) атомный радиус элементов
3) электроотрицательность элементов
4) кислотность гидроксидов элементов
23. Наиболее сильное основание образует
1) цезий 2) натрий 3} литий 4) цинк
24. Оксид с наиболее выраженными кислотными свойствами образует
1) кремний 2) фосфор 3) сера 4) хлор
25. Наиболее сильное основание образует
1) магний 2) стронций 3) барий 4) кадмий
26. Кислотный характер наиболее выражен у высшего оксида, образованного элементом:
1) Sn 2) А1 3) С 4) S
27. Кислотный характер наиболее выражен у высшего оксида, образованного
1) бериллием 2) бором 3) фосфором 4) кремнием
28. Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
Сила бескислородных кислот неметаллов VIIА группы соответственно возрастанию заряда ядра атомов элементов
1) | увеличивается |
2) | уменьшается |
3) | не изменяется |
4) | изменяется периодически
|
29. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
1) | хлор |
2) | германий |
3) | мышьяк |
4) | селен |
30. Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
Кислотные свойства оксидов в ряду SiO2 —> P2O5 —>SО3
1) ослабевают
2) усиливаются
3) не изменяются
4) изменяются периодически
31. Газообразные водородные соединения состава ЭН3 образуют
1) Be, Ca, Sr 2) P, As, Sb 3) Ga, Al, B 4) Te, S, Sc
32. В ряду элементов
Cl ® S ® P ® Si
1) уменьшается число электронных слоев в атомах
2) увеличивается число внешних электронов в а томах
3) возрастают радиусы атомов
4) усиливаются неметаллические свойства
33. Неметаллические свойства наиболее выражены у
1) серы 2) кислорода 3) кремния 4) фосфора
34. Наибольший радиус имеет атом
1) олова 2} кремния 3) свинца 4) углерода
35. В ряду химических элементов
В ряду химических элементов
Li —>Be —> B —> C
1) увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев а атомах
3) уменьшается число протонов в ядрах атомов
4) увеличиваются радиусы атомов
36.Наибольший радиус имеет атом
1) брома 2) мышьяка 3) бария 4) олова
37.Электронную конфигурацию 1s22s22р63.s2Зр63d1 имеет ион
1) Са2+ 2) А13+ 3) K+ 4) Sc2+
38. Какую электронную конфигурацию имеет атом наиболее активного металла?
1) | 1s22s22p1 |
2) | 1s22s22p63s1 |
3) | 1s22s2 |
4) | 1s22s22p63s23p1 |
39. В порядке увеличения восстановительной способности металлы расположены в ряду:
В порядке увеличения восстановительной способности металлы расположены в ряду:
1) K,Al,Cr,Sn
2) Sn,Cr,Al,Zn
3) Sn,Ca,Al,K
4) Au,Al,Ca,Li
40. В ряду элементов: натрий —>магний —>алюминий
возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
41. У магния металлические свойства выражены
1) слабее, чем у бериллия
2) сильнее, чем у алюминия
3) сильнее, чем у кальция
4) сильнее, чем у натрия
42. В порядке уменьшения восстановительных свойств металлы расположены в ряду:
1) Al,Zn,Fe
2) Al,Na,K
3) Fе,Zn,Mg
4) Fe,Zn,Al
43. Наибольший радиус имеет атом
1) лития 2) натрия 3) кальция 4) калия
44. У элементов II А группы сверху вниз
1) уменьшаются радиусы атомов,
2) увеличивается число валентных электронов в атоме
3) увеличиваются радиусы атомов
4) уменьшается число валентных электронов в атоме
45. Сила оснований возрастает в ряду:
Сила оснований возрастает в ряду:
1) Ве(ОН)2, Mg(OH)2, Ca(OH)2
2) Ва(ОН)2, Са(ОН)2, Ве(ОН)2
3) Са(ОН)2, Mg(OH)2, Ве(ОН)2
4) Sr(OH)2, Ca(OH)2, Mg(OH)2
46. У элементов I А группы сверху вниз
1) усиливаются окислительные свойства
2) ослабевают восстановительные свойства
3) увеличиваются радиусы атомов
4) уменьшаются радиусы атомов
47. Валентные электроны наиболее легко отдают атомы
1) алюминия 2) натрия 3) бериллия 4) магния
48. Восстановительные свойства наиболее выражены у
1) алюминия 2) магния 3) натрия 4) калия
49. Основные свойства веществ ослабевают в ряду:
1) NaОН —> КОН —>RbOH
2) А1(ОН)3 —>Mg(OH)2 —> NaOH
3) Са(ОН)2 —> Mg(OH)2 —>Be(OH)2
4) В(ОН)3 —>Ве(ОН)2 —> LiOH
50. Верны ли следующие суждения?
Верны ли следующие суждения?
А. И хром, и железо образуют устойчивые оксиды в степени окисления +3.
Б. Оксид хрома (III) является амфотерным.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
51. Верны ли следующие суждения?
А. Только s-элементы содержит IA группа.
Б. Все элементы IA группы взаимодействуют с водой при комнатной температуре.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
52. Оксид хрома (VI) является
1) основным
2) кислотным
3) амфотерным
4) несолеобразующим
53. Только основные свойства проявляет
1) Сr2O3 2) Сr(ОН)2 3) СrO3 4) Сr(ОН)3
54. Сильные окислительные свойства характерны для
1) оксида меди (I)
2) оксида железа (II)
3) оксида хрома (III)
4) оксида хрома (VI)
55.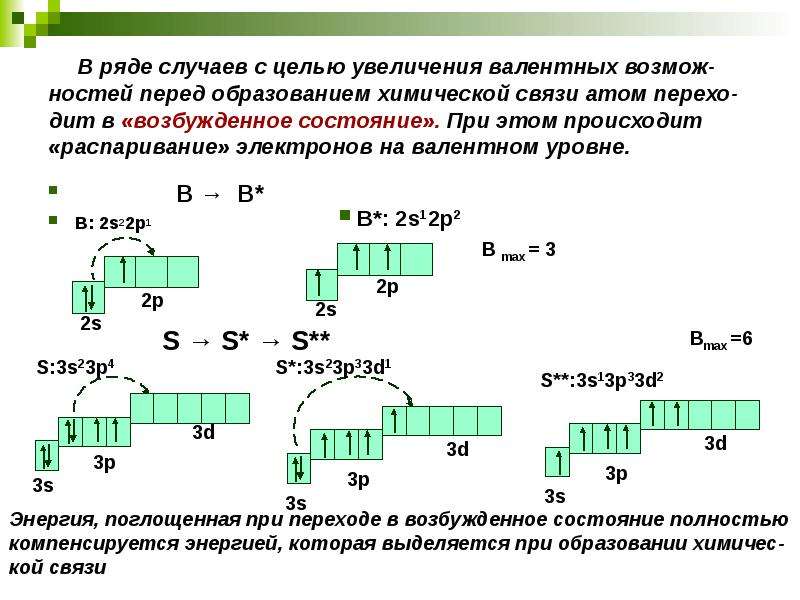 Верны ли следующие суждения об оксидах железа?
Верны ли следующие суждения об оксидах железа?
А. Степень окисления железа в высшем оксиде равна + 3.
Б. Высший оксид железа относится к основным оксидам.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
56. В ряду оксидов
CrO — Сr2О3 — СrОз
происходит
1) уменьшение степени окисления хрома
2) усиление восстановительных свойств
3) увеличение массовой доли хрома
4) усиление кислотных свойств
57. Оцените справедливость суждений о металлах:
А. Чем сильнее атом удерживает валентные электроны, тем ярче
выражены металлические свойства элемента.
Б. Чем сильнее выражены металлические свойства элемента, тем
более основный характер имеет его гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
58. Оцените справедливость суждений о металлах:
Оцените справедливость суждений о металлах:
А. Для атомов металлов характерно малое число валентных
электронов и слабое их притяжение к ядру.
Б. Чем выше степень окисления металла в его гидроксиде, тем
более основными свойствами обладает гидроксид.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
59. Оцените справедливость суждений о металлах:
А. Атомы металла могут образовывать только ионные связи.
Б. Оксиды и гидроксиды металлов всегда имеют основный
характер.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
60. Верны ли следующие суждения о неметаллах?
А. В периодической системе химических элементов Д.И. Менделеева все неметаллы располагаются в главных подгруппах.
Б. Все неметаллы являются р-элементами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
61. У атомов химических элементов, расположенных в ряду: P-S-C1, увеличивается
1) радиус
2) окислительная способность
3) восстановительная способность
4) число неспаренных электронов
62. Соединения состава NaHЭO3 и NaHЭO4 может образовать
1) углерод 2) сера 3) хлор 4) фосфор
63. Наиболее сильными кислотными свойствами обладает
1) НС1О4 2) H2SO3 3) Н3РО4 4) H2SiО3
64 Соединения состава КЭО2 и КЭО3 образует элемент
1) азот 2) фосфор 3) сера 4) марганец
65. Способность атомов химических элементов принимать электроны усиливается в ряду:
1)F —>O —>N
2) N —>F —>О
3) N —>O —>F
4) O —>N —>F
66. Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
Степени окисления хлора, брома и йода в высших оксидах и водородных соединениях соответственно равны:
1)+1и-1 2)+7и-1 3)+7и-7 4)+5и-1
67. Сера проявляет как окислительные, так и восстановительные свойства при взаимодействии с
1) водородом и железом
2) углеродом и цинком
3) хлором и фтором
4) натрием и кислородом
68. В ряду: Si —>Р —> S —> С1
электроотрицательность элементов
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, потом увеличивается
69. В ряду элементов мышьяк —>селен —> бром возрастает
1) атомный радиус
2) число неспаренных электронов в атоме
3) число электронных слоев в атоме
4) электроотрицательность
70. Водородное соединение состава Н2Э2 образует
1) углерод
2) кремний
3) бор
4) азот
71. Высшему гидроксиду элемента VIIA группы соответствует формула
Высшему гидроксиду элемента VIIA группы соответствует формула
1) Н2ЭО3 2) Н2ЭО4 3) НЭО3 4) НЭО4
72. Фосфор проявляет окислительные свойства при реакции с
1) кальцием 2) серой 3) хлором 4) кислородом
73. При взаимодействии высшего оксида хлора с водой образуется кислота
1) НС1O 2) НС1O2 3) НСlO3 4) HClO4
74. Характерными степенями окисления хлора в его соединениях являются:
1) -1, +1, +3, +5, +7
2) — 2, +4, +6, +8
3) -3, +3, +5
4) -1, +2, +5
75. Кислотные свойства наиболее выражены у высшего гидроксида
1) азота
2) фосфора
3) мышьяка
4) сурьмы
76. Только восстановительные свойства азот проявляет в соединении
Только восстановительные свойства азот проявляет в соединении
1) N2
2) NНз
3) NО2
4) НNОз
77. Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s22s22p6 3s2 Зр1 ?
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна (+ 4).
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
78. Верны ли следующие суждения о соединениях натрия и бериллия?
А. Оксид натрия проявляет основные свойства
Б. Гидроксид бериллия проявляет амфотерные свойства
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы 1-4, 2-4, 3-3, 4-2, 5-1, 6-1, 7-4, 8-1, 9-2, 10-3, 11-2, 12-4, 13-1, 14-1, 15-1, 16-1, 17-3, 18-3, 19-3, 20-4, 21-2, 22-2, 23-1, 24-4, 25-3, 26-4, 27-3, 28-1, 29-2, 30-2, 31-2, 32-3, 33-2, 34-3, 35-1, 36-3, 37-4, 38-2, 39-4, 40-4, 41-2, 42-1, 43-4, 44-3, 45-1, 46-3, 47-2, 48-4, 49-3, 50-3, 51-1, 52-2, 53-2, 54-4, 55-1, 56-4, 57-2, 58-1, 59-4, 60-1, 61-2, 62-2, 63-1,64-1, 65-3, 66-2, 67-4, 68-1, 69-4, 70-1, 71-4, 72-1, 73-4, 74-1, 74-3, 76-2, 77-4, 78-3
1) азота 2) кислорода 3) серы 4) кремния 4.
 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?Задания А2 по химии 1. В ряду элементов
Задания А2 по химии 1. В ряду элементов уменьшаются радиусы атомов уменьшается число протонов в ядрах атомов увеличивается число электронных слоёв в атомах уменьшается высшая степень окисления атомов У
ПодробнееЗадания А3 по химии
Задания А3 по химии 1. Верны ли следующие суждения о соединениях металлов? А. Степень окисления алюминия в высшем оксиде равна +3. Б. Оснóвные свойства оксида натрия выражены сильнее, чем у оксида алюминия
ПодробнееЗадания ФИПИ 1 и 2 (страницы базы 1-20)
Page 1 of 17 Задание 184C9A Задания ФИПИ 1 и 2 (страницы базы 1-20) Вещества, формулы которых CO и Zn(OH), соответственно являются 1) кислотным оксидом и основанием 2) несолеобразующим оксидом и амфотерным
Подробнее1) IV 2) V 3) VI 4) VII
2 1. В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
В ряду: Na Mg Al Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3) уменьшается высшая степень окисления элементов 4) ослабевают металлические
Банк заданий химия 9 класс
Банк заданий химия 9 класс 1. Элемент имеет три электрона на 2-м энергетическом уровне. Порядковый номер элемента 3 5 7 13 2. Сколько электронов находится на внешнем уровне элемента с порядковым номером
ПодробнееАТОМ. ХИМИЧЕСКИЙ ЭЛЕМЕНТ
ПРЕДИСЛОВИЕ В этом сборнике предложены задания контрольных и проверочных работ по химии для 8 9 классов. Каждая работа по теме содержит 25 вариантов (приблизительно на один класс) однотипных заданий одинаковой
ПодробнееАвторы: О. С. Габриелян, П. Н. Березкин, А. А. Ушакова, Г. В. Майорова, Н.
 В. Кузьмина, А. Е. Кириллова
В. Кузьмина, А. Е. КирилловаУДК 373.167.1:54 ББК 24.1я72 Г12 Авторы: О. С. Габриелян, П. Н. Березкин, А. А. Ушакова, Г. В. Майорова, Н. В. Кузьмина, А. Е. Кириллова Г12 Габриелян, О. С. Химия. 9 кл. Контрольные и проверочные работы
ПодробнееУДК :54 ББК 24.1я72 Г12
УДК 373.167.1:54 ББК 24.1я72 Г12 Г12 Габриелян, О. С. Химия. 9 класс : учебник / О. С. Габриелян. 6-е изд., стереотип. М. : Дрофа, 2018. 319, [1] с. : ил. IBN 978-5-358-19690-2 Учебник О. С. Габри еляна
ПодробнееАвторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова
УДК 373.167.1:54 12+ ББК 24я72 Я11 Авторы: А. А. Каверина, Ю. Н. Медведев, Г. Н. Молчанова, Н. В. Свириденкова, М. Г. Снастина, С. В. Стаханова Модульный курс «Я сдам ЕГЭ!» создан авторским коллективом
ПодробнееТ-4 вариант 2.
 Т-4 вариант 1
Т-4 вариант 1Т-4 вариант 1 1. Какие частицы входят в состав ядра атома? 1) электроны 3) ионы 2) протоны 4) нейтроны А) Al Б) Br В) Fe Г) Se 1) 34 4) 56 2) 13 5) 35 3) 80 6) 26 А) магний В) водород Б) сера Г) натрий
ПодробнееРабочая программа по химии 9 «а» класс
Рабочая программа по химии 9 «а» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
ПодробнееРабочая программа по химии 9 «в» класс
Рабочая программа по химии 9 «в» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
ПодробнееРабочая программа по химии 9 «б» класс
Рабочая программа по химии 9 «б» класс (базовый уровень) Рабочая программа по химии для 9 класса составлена в соответствии с Федеральным компонентом Государственного стандарта основного общего образования,
ПодробнееХИМИЯ.
 Издание второе. 9 класс
Издание второе. 9 классХИМИЯ Издание второе 9 класс МОСКВА «ВАКО» 2017 УДК 372.854 ББК 74.262.4 К65 6+ Издание допущено к использованию в образовательном процессе на основании приказа Министерства образования и науки РФ от 09.06.2016
Подробнеес. Веселая Лопань, 2015 год
Муниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееРАБОЧАЯ ПРОГРАММА по химии для 8-9 классов
Муниципальное бюджетное общеобразовательное учреждение города Абакана «Средняя общеобразовательная школа 1» РАБОЧАЯ ПРОГРАММА по химии для 8-9 классов. Рабочая программа по химии для 8-9 классов является
ПодробнееКонтрольные материалы по химии ЧАСТЬ 1
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Нижегородский государственный архитектурно-строительный
ПодробнееЭкзаменационная работа
Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
ПодробнееРасписание и структура занятий
Расписание и структура занятий Программа курса рассчитана на 4 недели (май). Занятия проводятся два раза в неделю, вторник и четверг в 18.00(мск). Всего 8 занятий. Этот курс охватывает повторение всех
Занятия проводятся два раза в неделю, вторник и четверг в 18.00(мск). Всего 8 занятий. Этот курс охватывает повторение всех
2 полугодие. Металлы Неметаллы , Практ.
Химия 11 класс Учебник: «Химия. Основы общей химии», Г.Е Рудзитис, Ф.Г. Фельдман. Москва «Просвещение» Тематическое планирование Тема урока Параграфы и задания по учебнику 1. 1 полугодие Химический элемент.
ПодробнееБилеты по химии 6 класс
Билеты по химии 6 класс Билет 1 1. Периодический закон и периодическая система химических элементов Д. И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости
ПодробнееID_589 1/6 neznaika.pro
Вариант 1 Часть 1. При выполнении заданий 1 15 укажите только одну цифру, которая соответствует номеру правильного ответа.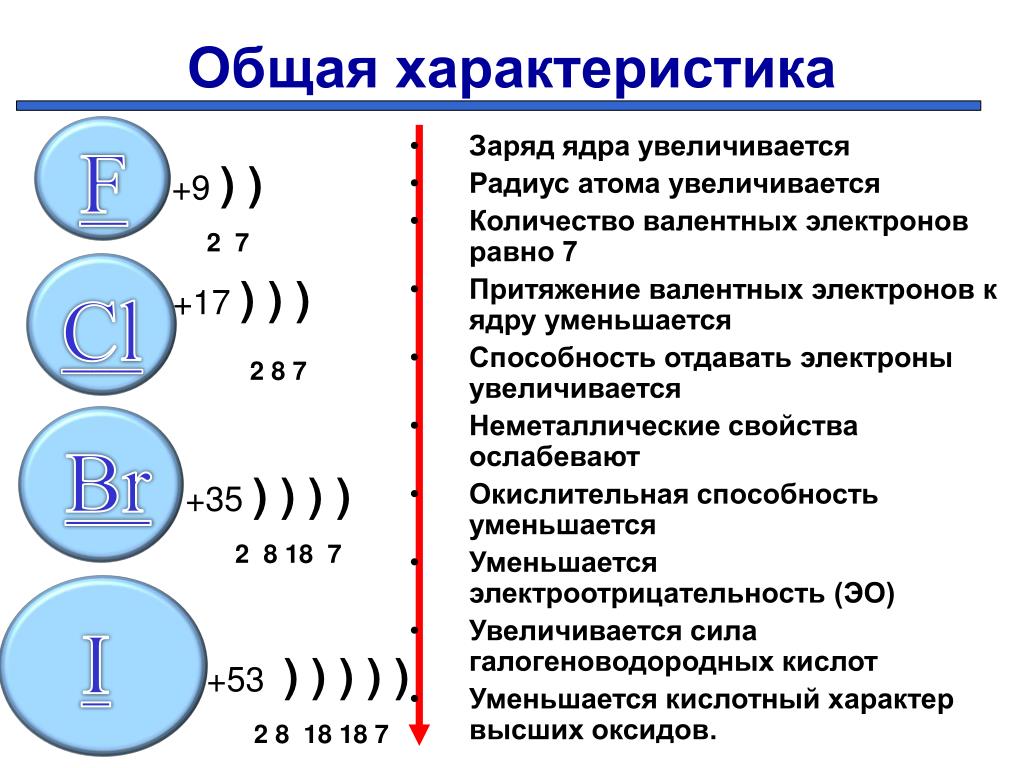 1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
1 Четыре электрона находятся во внешнем электронном слое атомов каждого из химических
ФОНД ОЦЕНОЧНЫХ СРЕДСТВ
Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа 1» Приложение 2 к ООП ООО ФОНД ОЦЕНОЧНЫХ СРЕДСТВ по текущей аттестации предмет: Химия. 9 класс Составители: Домнарева
ПодробнееЗадания №2 с решениями
Рассмотрим задания №2 из вариантов ЕГЭ за 2016 год.
Перед решением рекомендуем повторить темы:
1. Строение атома
2. Металлы и неметаллы
Задания с решением
Задание №1.
В каком ряду химические элементы расположены в порядке возрастания радиуса их атомов:
1. Mg → Al → Si → P
2. At → I → Br → Cl
3. Si → P → S → Cl
Si → P → S → Cl
4. O → S → Se → Te
Объяснение: радиус атома возрастает в группе сверху вниз (с увеличением количества электронных слоев), то есть правильный ответ — 4.
Задание №2.
Верны ли следующие суждения о свойствах кислорода и серы?
А. Максимальная валентность этих элементов в соединениях равна номеру группы
Б. При взаимодействии с водородом кислород и сера проявляют окислительные свойства
1. Верно только А
2. Верно только Б
3. Оба суждения верны
4. Оба суждения неверны
Объяснение: перво утверждение неверно — у кислорода постоянная валентность — 2, а у серы максимальная валентность -6. А вот второе утверждение верно: водород, как неметалл намного слабее, чем сера и кислород, и водород в таких соединениях проявляет восстановительные свойства. Правильный ответ — 2.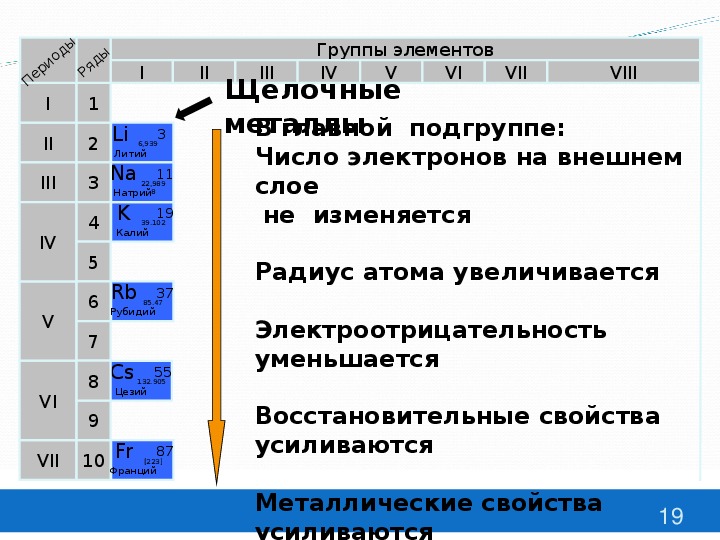
Задание №3.
В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1. C → B → Be
2. P → S → Cl
3. Si → Al → Mg
4. F → O → N
Объяснение: радиус атома уменьшается в группе снизу вверх и в периоде слева направо. Во втором положении у нас находится только один вариант ответа. Правильный ответ — 2.
Задание №4.
Оксиды состава ЭО и Э2О3 образует каждый из двух элементов:
1. Азот и железо
2. Сера и селен
3. Углерод и кремний
4. Медь и хром
Объяснение: оба элемента должны иметь степени окисления +2 и +3. То есть, правильный ответ — 1.
Задание №5.
В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1. Na → Mg → Al
Na → Mg → Al
2. Ca → Mg → Be
3. Na → K → Cs
4. Mg → Al → Si
Объяснение: для определения зависимости изменения металлических свойств, нужно посмотреть периодическую систему и рад напряжения металлов. В периодической системе металлические свойства усиливаются в группе сверху вниз и в периоде справа налево. Под данную закономерность попадает ответ 4. Правильный ответ — 4.
Задание №6.
В ряду химических элементов Mg → Ca → Ba
1. Уменьшается число энергетических уровней в атомах
2. Возрастает число внешних электронов атомов
3. Уменьшается число протонов в ядрах атомов
4. Увеличиваются радиусы атомов
Объяснение: элементы расположены в периодической системе сверху вниз, а значит увеличиваются радиусы атомов. Правильный ответ — 4.
Задание №7.
Верны ли следующие суждения об элементах VA-группы?
А. С возрастанием заряда ядра электроотрицательность увеличивается
Б. Общая формула летучего водородного соединения Rh4
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: первое утверждение неверно, так как с возрастанием заряда ядра в группе электроотрицательность уменьшается (так как неметаллические свойства в гурппе сверху вниз ослабевают). А второе утверждение верно, так как атомы элементов пятой А группы имеют по 3 неспаренных электрона и могут образовывать молекулы с тремя атомами водорода (например, аммиак). Правильный ответ- 2.
Задание №8.
В порядке возрастания неметаллических свойств элементы расположены в ряду:
1. B → C → N → O
2. Cl → S → P → Si
3. O → S → Se → Te
O → S → Se → Te
4. N → P → As → Sb
Объяснение: неметаллические свойства усиливаются в группе снизу вверх и в периоде слева направо. В периоде слева направо расположены элементы в варианте ответа 1. Правильный ответ -1.
Задание №9.
Верны ли следующие суждения о галогенах?
А. Хлор в соединениях проявляет как положительную, так и отрицательную степени окисления
Б. При нормальных условиях йод является жидкостью
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: у хлора на внешнем уровне 7 валентных электронов. Он может отдать все или несколько, либо принять один электрон. Следовательно, А — верно, а вот йод при нормальных условиях является кристаллами фиолетового цвета. Правильный ответ — 1.
Задание №10.
Оксиды состава Э2О3 и Э2О5 образуют
1. Азот и йод
2. Сера и селен
3. Углерод и кремний
4. Бром и бор
Объяснение: атомы искомых элементов должны проявлять степени окисления +3 и +5, то есть должны находиться минимум в пятой группе (или в седьмой, как йод). Правильный ответ — 1.
Автор решения — Лунькова Е.Ю.
Задания для самостоятельной работы.
1. Неметаллические свойства элементов усиливаются в ряду:
1. Cl → S → P → Si
2. N → P → As → Se
3. B → C → N → O
4. C → Si → P → N
2. В ряду элементов Be → B → C → N
1. Уменьшается число электронных слове в атомах
2. Увеличивается число электронов на внешнем энергетическом уровне атома
3. Возрастают радиусы атомов
4. Усиливаются металлические свойства
3. Кислотные свойства водородных соединений усиливаются в ряду
1. HF → HCl → HBr → HI
HF → HCl → HBr → HI
2. HI → HBr → HCl → HF
3. HF → h3O → Nh4 → Ch5
4. HCl → h3S → Ph4 → Sih5
4. Высший оксид состава ЭО2 образуют все элементы
1. 4 периода
2. IIА-группы
3. IVА-группы
4. 2 периода
5. Неметаллические свойства наиболее выражены у
1. Кремния 2. Углерода 3. Кислорода 4. Фосфора
6. Характер оксидов в ряду Na2O → MgO → Al2O3
изменяется от
1. Основного к кислотному
2. Основного к амфотерному
3. Амфотерного к кислотному
4. Кислотного к амфотерному
7. Наиболее ярко выраженные неметаллические свойства проявляет
1. Хлор 2. Бор 3. Фосфор 4. Бром
8. Верны ли следующие суждения о магнии и его соединениях?
А. Высшая степень окисления магния в соединениях равна +2
Б Гидроксид магния проявляет основные свойства
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Оба суждения неверны
9. Соединения состава КЭО2 и КЭО3 образует элемент
1. Азот 2. Фосфор 3. Сера 4. Марганец
10. Соединения состава Na2ЭО4 образует каждый из двух элементов
1. Сера и хлор
2. Сера и хром
3. Хром и азот
4. Фосфор и хлор
В данной заметке использовались задания из сборника ЕГЭ 2016-го года под редакцией А.А. Кавериной.
Неметаллические свойства усиливаются в ряду: 1 n → p → As, 2 n → c → B, 3 n → o → F, 4 c → Si → Ge
Неметаллические свойства усиливаются в ряду: 1) N → P → As, 2) N → C → B, 3) N → O → F, 4) C → Si → Ge
Порядковый номер
химического элемента в Периодической
системе Д.И.Менделеева соответствует:
1) числу электронов в атоме, 2)
значению высшей валентности элемента
по кислороду, 3)числу электронов,
недостающих до завершения внешнего
электронного слоя, 4)
числу электронных слоев в атоме.
Неметаллические свойства серы выражены сильнее, чем неметаллические свойства: 1) селена, 2) фтора, 3) кислорода, 4) хлора.
Номер группы в Периодической системе химических элементов Д.И.Менделеева соответствует: 1) числу электронов в атоме, 2) значению высшей валентности элемента по кислороду, 3)числу электронов, недостающих до завершения внешнего электронного слоя, 4) числу электронных слоев в атоме.
В периоде с увеличением
атомного номера химического элемента
происходит: 1)
уменьшение заряда ядра атома,
3) уменьшение атомного радиуса,
2) усиление
металлических свойств, 4)
уменьшение числа валентных электронов.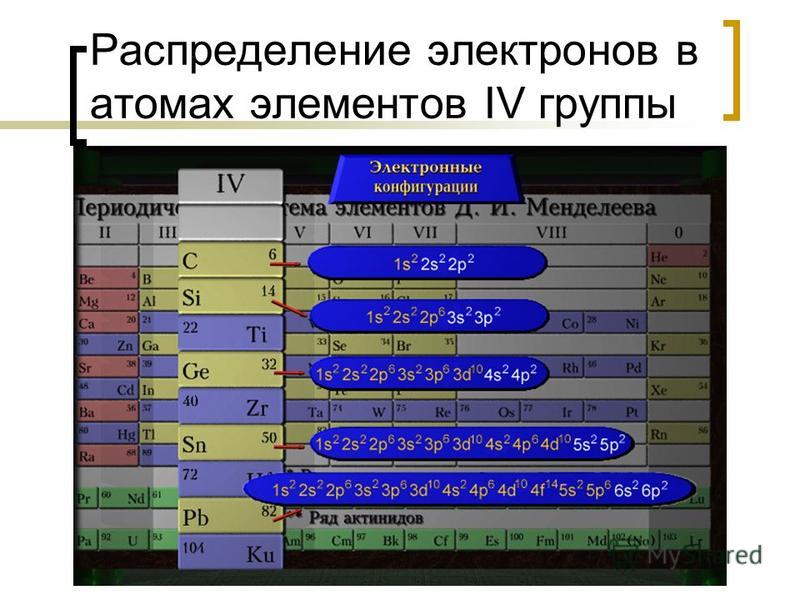
Номер периода в Периодической системе химических элементов Д.И.Менделеева равен числу: 1) числу электронов в атоме, 2) числу электронов во внешнем слое атомов, 3) недостающих электронов до завершения электронного слоя, 4) заполняемых электронных слоев в атоме.
В подгруппах Периодической системы с увеличением заряда ядра атомов происходит: 1) усиление неметаллических свойств элементов, 3) увеличение радиуса атома, 2) уменьшение числа протонов в ядре, 4) увеличение электроотрицательности.
Кислотные свойства
высших оксидов ослабевают в ряду:
1) P2O5 → SiO2 → Al2O3,
2) P2O5 → SO3 → Cl2O7,
3) Al2O3 → P2O5 → N2O5,
4) SiO2 → P2O5 → SO3.
В главных подгруппах Периодической системы с увеличением заряда ядра атомов химических элементов: 1) усиливаются неметаллические свойства, 2) уменьшаются металлические свойства, 3) изменяется валентность в водородных соединениях, 4) остается постоянной высшая валентность.
Амфотерным является высший оксид каждого из химических элементов, имеющих в Периодической системе Д.И.Менделеева порядковые номера: 1) 4, 13, 30, 2) 6, 11, 16, 3) 19, 12, 3, 4) 6, 14, 17.
В каком ряду химических элементов усиливаются неметаллические свойства
1) алюминий → фосфор → хлор 3) хлор → бром → иод
2) фтор → азот → углерод 4) кремний → сера → фосфор
В каком ряду химические элементы расположены в порядке усиления неметаллических свойств? 1) O → S → Se 2) Si → P → S 3) S → P → Si 4) O → N → C
В каком ряду химические элементы расположены в порядке увеличения металлических свойств? 1) Li → Be → B 2) Li → Na → K 3) Mg → Al → Si 4) Ca → Mg → Be
В каком ряду химические элементы расположены в порядке уменьшения атомного радиуса? 1) P → S → Cl 2) А → O → N 3) Be → Mg → Ca 4) Li → Na → K
В ряду оксидов MgO
→ Al2O3 → SiO2 свойства
изменяются от :
1) основных к амфотерным и кислотным,
3) кислотных к амфотерным,
2) кислотных к основным,
4) основных к
амфотерным.
В ряду гидроксидов H2SiO3 → H3PO4 → H2SO4 1) кислоты становятся слабее, 3) усиливаются амфотерные свойства, 2) кислоты становятся сильнее, 4) кислотные и основные свойства не изменяются.
В ряду гидроксидов Mg(OH)2 → Ca(OH)2 → Sr(OH)2: 1) основания становятся слабее, 3) усиливаются амфотерные свойства, 2) основания становятся сильнее, 4) основные свойства не изменяются.
В каком ряду элементы расположены в порядке уменьшения неметаллических свойств? 1) B → C → N, 2) Se → S → O, 3) F → Cl → Br, 4) Na → Mg → Al
В каком ряду элементы расположены в порядке увеличения числа валентных электронов? 1) P → S → Cl, 2) Na → K → Rb, 3) O → N → C, 4) C → Si → Ge
Наиболее ярко выражены
металлические свойства у: 1) Na,
2) Li, 3) Rb,
4) Mg.
С увеличением зарядов ядер атомов Са → Sr → Ba металлические свойства: 1) ослабевают, 2) не изменяются, 3) изменяются периодически, 4) усиливаются.
Наименьший радиус у атома: 1) бария, 2) кальция, 3) магния, 4) стронция.
Выберите общие формулы, соответствующие высшим оксиду и гидроксиду азота: 1) R2O5, RH3, 2) R3O3, HRO3, 3) R2O5, HRO2, 4) R2O5, HRO3.
Выберите общие формулы, соответствующие высшим оксиду и летучему водородному соединению кремния: 1) RO2, H2RO3, 2) RO, RH4, 3) RO2, RH4, 4) RO3, RH3.
В ряду элементов Na
→ Mg → Al →
Si металлические свойства
и радиус атома соответственно:
1)
ослабевают и уменьшается,
3) ослабевают и увеличивается,
2) возрастают и увеличивается,
4) усиливаются и уменьшается.
В ряду элементов Na → Mg → Al → Si: 1) металлические свойства усиливаются, 3) свойства не изменяются, 2) неметаллические свойства усиливаются, 4) металлические и неметаллические свойства изменяются периодически.
В главных подгруппах Периодической системы химических элементов с увеличением зарядов ядер радиус атомов: 1) увеличивается, 2) уменьшается, 3) не изменяется, 4) изменяется периодически.
Атомные радиусы уменьшаются в ряду: 1) Li → Na → K, 2) F → O → N, 3) Li → Be → B, 4) F → Сl → Br.
Кислотные свойства
оксидов усиливаются в ряду:
1)
P → S → Cl,
2) C → Si
→ Ge, 3) P
→ Si → Al,
4) C → N →
P.
Неметаллические свойства усиливаются в ряду: 1) C → N → P, 2) P → S → О, 3) Cl → S → P, 4) Cl → F → O.
Наименьший радиус имеет атом: 1) F, 2) Cl, 3) O, 4) S.
Основные свойства наиболее выражены у оксида:
И их соединений по периодам и группам
1. Наименьшим атомным радиусом обладает
1) фтор 2) неон 3) йод 4) ксенон
2. Кислотные свойства в ряду высших оксидов бора — углерода — кремния
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
3. Атомный радиус элементов увеличивается в ряду:
1) кислород, фтор, неон
2) хлор, сера, фосфор
3) сера, хлор, бром
4) сера, хлор, фтор
4. Кислотность оксидов, образованных элементами IVА-группы, сверху вниз
1) не изменяется
2) изменяется периодически
3) увеличивается
4) уменьшается
5. В каком ряду химические элементы расположены в порядке возрастания атомного радиуса?
В каком ряду химические элементы расположены в порядке возрастания атомного радиуса?
1) С, N, О 2) Na, Mg, Al 3) F, О, N 4) Br, Cl, As
6. Наименьшим атомным радиусом обладает
1) алюминий 2) аргон 3) натрий 4) магний
7. Кислотные свойства в ряду высших гидроксидов серы — хлора — йода
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
8. Кислотные свойства в ряду высших оксидов углерода — кремния -фосфора
1) возрастают
2) ослабевают
3) сначала возрастают, затем ослабевают
4) сначала ослабевают, затем возрастают
9. Среди элементов четвертого периода максимальный радиус атома имеет
1) медь 2) калий 3) никель 4) криптон
10. Среди элементов второй группы максимальный радиус атома имеет
1) бериллий 2) барий 3) кадмий 4) цинк
11. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
1) Na, Mg, Al, Si 2) Li, Be, В, С 3) P, S, Cl, Ar 4) F, O, N, С
12. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
В порядке возрастания атомного радиуса химические элементы расположены в ряду:
1) Be, В, С, N 2) Rb, К, Na, Li 3) О, S, Se, Те 4) Mg, Al, Si, P
13. У элементов подгруппы углерода с увеличением атомного номера уменьшается
1) атомный радиус 3) число валентных электронов в атомах
2) заряд ядра атома 4) электроотрицательность
14. Наибольшей восстановительной активностью обладает
1) Li 2) Be 3) В 4) S
15. В ряду химических элементов: Na – Mg – Al – Si
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
16. В ряду химических элементов: Na – К – Rb – Cs способность металлов отдавать электроны
1) ослабевает 3) не изменяется
2) усиливается 4) изменяется периодически
17. Легче всего присоединяет электроны атом
1) серы 2) хлора 3) селена 4) брома
18. В порядке увеличения атомного радиуса расположены элементы
В порядке увеличения атомного радиуса расположены элементы
1) Na, Mg, Al 2) О, S, Se 3) N, О, F 4) Ar, Ne, He
19. В порядке уменьшения атомного радиуса расположены элементы
1) бор, алюминий, галлий 3) бор, углерод, кремний
2) калий, натрий, литий 4) криптон, ксенон, радон
20. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
1) Li — Be — B — C 3) Si — Al — Mg — Na
2) Ar — Cl — S — P 4) Ne — F — O-N
21. Наиболее выражены металлические свойства у
1) натрия 2) магния 3) кальция 4) рубидия
22. Наиболее выражены неметаллические свойства у
1) селена 2) брома 3) йода 4) теллура
23. Наибольшую энергию надо затратить на отрыв электрона от атома
1) серы 2) кремния 3) кальция 4) мышьяка
24. Слабее всего притягивает валентные электроны атом
1) Li 2) At 3) F 4) Cs
25. В ряду Li→ Be→В→С
1) увеличивается число энергетических уровней в атомах
2) уменьшается высшая степень окисления элементов
3) усиливаются металлические свойства элементов
4) ослабевают металлические свойства элементов
26. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) В, С, N 2) N, Р, As 3) Na, Mg, К 4) В, Si, N
27. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) К, Rb, Cs 2) Rb, Sr, In 3) Al, Na, Mg 4) O, S, Cl
28. В главных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением числа нейтронов в ядре
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением радиуса атомов
29. В ряду химических элементов Si – Р – S – О
1) увеличивается число электронных слоев в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) уменьшается радиус атомов
30. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Ga, Ge, As 2) Al, Ga, Ge 3) As, P, Ge 4) Se, As, Ge
31. В ряду химических элементов Be – Mg – Са – Sr
В ряду химических элементов Be – Mg – Са – Sr
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается число протонов в ядрах атомов
4) увеличивается радиус атомов
32. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Mn, Fe, Со 2) Mn, Cr, Fe 3) Al, Sc, Ti 4) Ni, Cr, Sc
33. В побочных подгруппах периодической системы восстановительная способность атомов химических элементов растет с
1) увеличением радиуса атомов
2) уменьшением радиуса атомов
3) увеличением числа электронов на внешнем энергетическом уровне
4) увеличением заряда ядра
34. Химические элементы расположены в порядке возрастания их атомных радиусов в ряду
1) Zn, Cd, Са 2) Br, Cl, F 3) In, Sn, Sb 4) Br, Se, As
35. В ряду оксидов SiO2 – Р2O5 – SO3 – Сl2O7 кислотные свойства
1) возрастают
2) убывают
3) не изменяются
4) сначала уменьшаются, потом увеличиваются
36 Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
1) Pb, Sn, Ge 2) Ga, In, Tl 3) К, Rb, Cs 4) Li, Na, Ca
37. В главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
В главных подгруппах периодической системы окислительная способность атомов химических элементов растет при
1) увеличении числа энергетических уровней
2) увеличении числа протонов в ядре
3) уменьшении радиуса атома
4) увеличении числа валентных электронов
38. В раду S – Р – Si – Аl
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) увеличивается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
39. Высшая степень окисления в ряду химических элементов галлий – германий – мышьяк – селен
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, затем увеличивается
40. Химические элементы расположены в порядке уменьшения их атомных радиусов в ряду
1) Ва, Cd, Ra 2) In, Pb, Sb 3) Cs, Na, H 4) Br, Se, As
41. В ряду элементов натрий – магний – алюминий возрастает их
1) атомный радиус
2) восстановительная способность
3) химическая активность
4) электроотрицательность
42. В ряду Mg – Si – Р – S
В ряду Mg – Si – Р – S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
43. Высшая степень окисления в ряду химических элементов индий – олово – сурьма – теллур
1) уменьшается
2) не изменяется
3) увеличивается
4) сначала увеличивается, затем уменьшается
44. Химические элементы расположены в порядке увеличения их атомных радиусов в ряду
1) Zn, Са, Cd 2) F, Cl, Вr 3) In, Sn, Sb 4) As, Se, Br
45. Простые вещества расположены в порядке усиления металлических свойств в ряду
1) Са, К, Аl 2) Al, Ga, Sr 3) Са, Sc, Ti 4) Cr, Mn, Fe
46. В ряду Аl – Si – Р – S
1) увеличивается число энергетических уровней в атомах
2) усиливаются металлические свойства элементов
3) уменьшается высшая степень окисления элементов
4) ослабевают металлические свойства элементов
47. Высшая степень окисления в ряду химических элементов титан – ванадий – хром – марганец
Высшая степень окисления в ряду химических элементов титан – ванадий – хром – марганец
1) увеличивается
2) уменьшается
3) не изменяется
4) сначала уменьшается, затем увеличивается
48. В периоде слева направо уменьшается(-ются)
1) атомный радиус элементов
2) число валентных электронов в атомах
3) электроотрицательность элементов
4) кислотные свойства гидроксидов
49. В порядке возрастания неметаллических свойств элементы расположены в ряду
1) В, С, О, F 3) C, Si, Ge, Sn
2) Cl, S, P, Si 4) O, N, С, В
50. В ряду химических элементов бор — углерод — азот возрастает
1) способность атома отдавать электроны
2) высшая степень окисления
3) низшая степень окисления
4) радиус атома
ГИА. Вопрос А2. ПЗ и ПСХЭ
ВыходГИА
А2 ПЗ и ПСХЭ
Автор: Грачёва
Ирина
Александровна
29.04.2018
Баженов А.А.
Класс: 9
Пуск
Выход
• 1. В каком ряду химические элементы
расположены в порядке увеличения радиуса
атома?
• K, Na, Li
• F, O, N
• P, S, Cl
• Ca, Mg, Be
29.
 04.2018
04.2018Баженов А.А.
Далее
Выход
• 2. В порядке увеличения зарядов ядер атомов
химические элементы расположены в ряду:
• Br, Cl, F
• O, N, C
• Si, P, S
• Al, Mg, Na
29.04.2018
Баженов А.А.
Далее
Выход
• 3. В каком ряду химические элементы
расположены в порядке увеличения радиуса
атомов?
• B, C, N
• Br, Cl, F
• O, S, Se
• Ca, Mg, Be
29.04.2018
Баженов А.А.
Далее
Выход
• 4. В каком ряду химические элементы
расположены в порядке увеличения числа
валентных электронов?
• Be, B, C
• K, Na, Li
• S, P, C
• C, Si, Ge
29.04.2018
Баженов А.А.
Далее
Выход
• 5. В каком ряду химические элементы
расположены в порядке усиления
неметаллических свойств?
• P → S → Cl
• N → P → As
• O → S → Se
• S → P → Si
29.04.2018
Баженов А.А.
Далее
Выход
• 6. В каком ряду химические элементы
расположены в порядке усиления
неметаллических свойств?
• N → P → As
• Al → Si → P
• O → S → Se
• Cl → S → P
29.
 04.2018
04.2018Баженов А.А.
Далее
Выход
• 7. В каком ряду химические элементы
расположены в порядке усиления
металлических свойств?
• Na → Mg → Al
• K → Na → Li
• Ca → Mg → Be
• AL → Mg → Na
29.04.2018
Баженов А.А.
Далее
Выход
• 8. В каком ряду химические элементы
расположены в порядке услабления
неметаллических свойств?
• K → Na → Li
• Mg → Al → Si
• Si → P → S
• Cl → S → P
29.04.2018
Баженов А.А.
Далее
Выход
• 9. В каком ряду химические элементы
расположены в порядке усиления
металлических свойств?
• Al → Si → P
• B → Be → Li
• Ca → Mg → Be
• K → Na → Li
29.04.2018
Баженов А.А.
Далее
Выход
• 10. В каком ряду химические элементы
расположены в порядке услабления
неметаллических свойств?
• Si → Al → Mg
• Al → C → N
• Na → Mg → Al
• K → Na → Li
29.04.2018
Баженов А.А.
Далее
Выход
• 11.
 Свойства оксидов в ряду
Свойства оксидов в рядуAl2O3 → SiO2 → P2O5 изменяются от:
• Амфотерных к кислотным
• Основных к кислотным
• Амфотерных к основным
• Кислотных к основным
29.04.2018
Баженов А.А.
Далее
Выход
• 12. Свойства оксидов в ряду
СO2 → B2O3 → BeO изменяются от:
• Кислотных к амфотерным
• Основных к кислотным
• Амфотерных к основным
• Основных к амфотерным
29.04.2018
Баженов А.А.
Далее
Выход
• 13. В ряду химических элементов
Rb → K → Na
• Усиливаются металлические свойства
• Ослабевают восстановительные свойства
• Уменьшается электроотрицательность атомов
• Возрастает высшая степень окисления в оксидах
29.04.2018
Баженов А.А.
Далее
Выход
• 14. В ряду химических элементов
Mg → Al → Si
• Усиливаются металлические свойства
• Ослабевают восстановительные свойства
• Уменьшается электроотрицательность атомов
• Уменьшается высшая степень окисления в оксидах
29.
 04.2018
04.2018Баженов А.А.
Далее
Выход
• 15. В ряду оксидов
MgO → Al2O3 → SiO2 свойства изменяются от:
• Кислотных к амфотерным
• Амфотерных к основным
• Основных к кислотным
• Кислотных к основным
29.04.2018
Баженов А.А.
Далее
Выход
• 16. В ряду оксидов
Li2O → BeO → B2O3 свойства изменяются от:
• Кислотных к амфотерным
• Амфотерных к основным
• Основных к кислотным
• Кислотных к основным
29.04.2018
Баженов А.А.
Далее
Анализ работы с тестом
Количество правильных ответов
Количество ошибочных ответов
Процент правильных ответов
Ваша оценка
Повторить
29.04.2018
Выход
Баженов А.А.
Периодическая таблица | Безграничная химия
Периодическая таблица
Таблица Менделеева показывает все элементы и их физические свойства; он устроен на основе атомных номеров и электронных конфигураций.
Цели обучения
Определите общие периодические тенденции, которые можно вывести из периодической таблицы элементов
Основные выводы
Ключевые моменты
- В периодической таблице перечислены все элементы с информацией об их атомном весе, химических символах и атомных номерах.

- Расположение таблицы Менделеева позволяет нам визуализировать определенные тенденции среди атомов.
- Вертикальные столбцы (группы) таблицы Менделеева расположены так, что все ее элементы имеют одинаковое количество валентных электронов. Таким образом, все элементы в определенной группе обладают схожими свойствами.
Ключевые термины
- атомный номер : Число, равное количеству протонов в атоме, которое определяет его химические свойства. Символ: Z .
- группа : вертикальный столбец в периодической таблице, который обозначает количество электронов валентной оболочки в атоме элемента.
- период : горизонтальная строка в периодической таблице, которая обозначает общее количество электронных оболочек в атоме элемента.
Символы элементов
Периодическая таблица представляет собой сетку 18 X 7, расположенную над меньшим двойным рядом элементов. В периодической таблице перечислены только химические элементы, включая каждый изотоп каждого элемента в одной ячейке. В типичной периодической таблице каждый элемент указан по его символу элемента и атомному номеру.Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой или двумя первыми буквами своего английского названия, но есть некоторые исключения. Два заметных исключения включают серебро и ртуть. Символ серебра — «Ag» от латинского « argentum», «», что означает «серый» или «сияющий». Символ ртути — «Hg» от латинизированного греческого hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое тело, жидкость или газ).
В типичной периодической таблице каждый элемент указан по его символу элемента и атомному номеру.Например, «H» обозначает водород, «Li» обозначает литий и так далее. Большинство элементов представлены первой или двумя первыми буквами своего английского названия, но есть некоторые исключения. Два заметных исключения включают серебро и ртуть. Символ серебра — «Ag» от латинского « argentum», «», что означает «серый» или «сияющий». Символ ртути — «Hg» от латинизированного греческого hydrargyrum, , что означает «вода-серебро». Многие периодические таблицы также включают полное название элемента и цветовую кодировку элементов в зависимости от их фазы при комнатной температуре (твердое тело, жидкость или газ).
Периодическая таблица : Таблица Менделеева представляет собой табличное отображение всех химических элементов. Атомы сгруппированы в порядке возрастания атомного номера.
Строки и периоды
Символ элемента почти всегда сопровождается другой информацией, такой как атомный номер и атомный вес. Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо.Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семьей). У некоторых групп есть особые названия, такие как галогены или благородные газы. Элементы в пределах одного периода или группы имеют похожие свойства.
Атомный номер описывает количество протонов в одном атоме этого элемента. Например, атом кислорода содержит 8 протонов. Элементы перечислены в порядке возрастания атомного номера слева направо.Каждая строка периодической таблицы называется периодом, а каждый столбец периодической таблицы называется группой (или семьей). У некоторых групп есть особые названия, такие как галогены или благородные газы. Элементы в пределах одного периода или группы имеют похожие свойства.
Определение химических свойств с помощью таблицы Менделеева
Химические свойства каждого элемента определяются его электронной конфигурацией и, в частности, его внешними валентными электронами. Расположение элемента в периодической таблице в значительной степени зависит от его электронов; количество электронов валентной оболочки определяет ее группу, а тип орбитали, на которой находятся валентные электроны, определяет блок элемента.Кроме того, общее количество электронных оболочек атома определяет, какому периоду он принадлежит. Из-за своей структуры периодическая таблица стала чрезвычайно полезным инструментом для оценки и прогнозирования тенденций изменения содержания элементов и химии.
Из-за своей структуры периодическая таблица стала чрезвычайно полезным инструментом для оценки и прогнозирования тенденций изменения содержания элементов и химии.
Химия 3.1 Введение в Периодическую таблицу — YouTube : Введение в таблицу Менделеева, которая определяет металлы, неметаллы и металлоиды по местоположению, а также сравнивает и сравнивает физические свойства металлов и неметаллов.
Молекулы
Молекулы — это электрически нейтральные соединения, состоящие из нескольких атомов, связанных друг с другом химическими связями.
Цели обучения
Узнавать общие свойства молекул
Основные выводы
Ключевые моменты
- Молекулы нейтральны и не несут заряда.
- Молекула может состоять из неметаллических атомов одного химического элемента, как в случае кислорода (O 2 ), или из различных элементов, как в случае воды (H 2 O).

- Геометрия и состав молекулы определяют ее химические и физические свойства.
- Изомеры — это молекулы с одинаковыми атомами в разном геометрическом расположении.
Ключевые термины
- ковалентный : когда 2 или более неметаллических атома связаны вместе за счет общих электронов.
- изомер : молекулы с одинаковым числом атомов в различных геометрических формах.
- соединение : когда два или более разных атома удерживаются вместе ковалентной связью.Все соединения являются молекулами, но не все молекулы являются соединениями.
- молекула : два или более атома, которые удерживаются вместе химической ковалентной связью.
Атомы и молекулы
Атом определяется как базовая единица материи, которая содержит централизованное плотное ядро, окруженное электронным облаком. Когда два или более атома удерживаются вместе химической ковалентной связью, эта новая сущность известна как молекула. Слово «молекула» — это расплывчатый термин, который в разговорной речи имеет разные значения в разных областях исследований.Например, термин «молекулы» используется в кинетической теории газов и относится к любой газовой частице независимо от ее состава.
Слово «молекула» — это расплывчатый термин, который в разговорной речи имеет разные значения в разных областях исследований.Например, термин «молекулы» используется в кинетической теории газов и относится к любой газовой частице независимо от ее состава.
Чаще всего термин «молекулы» относится к нескольким атомам; молекула может состоять из одного химического элемента, например кислорода (O 2 ), или из нескольких элементов, таких как вода (H 2 O). Молекулы нейтральны и не несут заряда; это свойство отличает их от многоатомных ионов, например нитрата (NO 3 — ).
молекула кофеина : Кофеин — сложная молекула, состоящая из множества атомов, связанных друг с другом определенным образом.
Размер молекулы варьируется в зависимости от количества атомов, составляющих молекулу. Большинство молекул слишком малы, чтобы их можно было увидеть невооруженным глазом. Самая маленькая молекула — двухатомный водород (H 2 ) с длиной связи 0,74 ангстрем.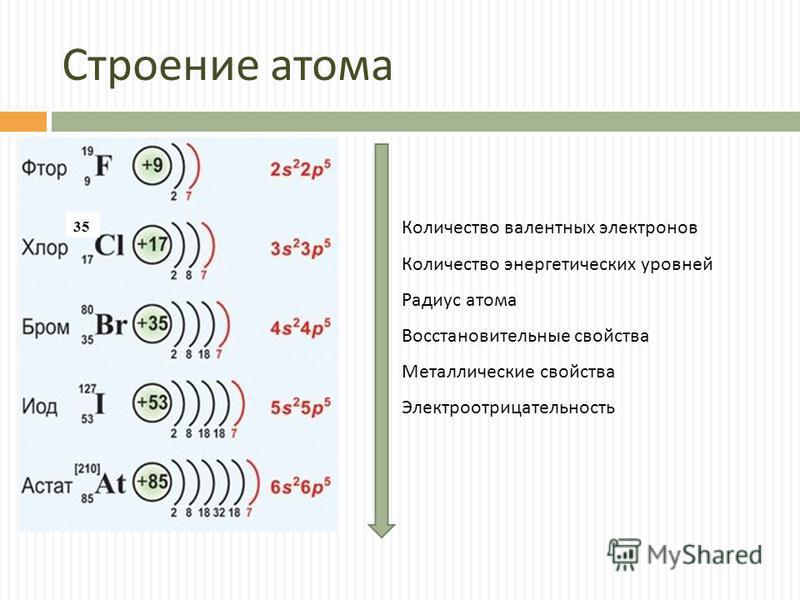 Макромолекулы — это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам.Некоторые макромолекулы можно наблюдать с помощью специализированных микроскопов.
Макромолекулы — это большие молекулы, состоящие из более мелких субъединиц; этот термин из биохимии относится к нуклеиновым кислотам, белкам, углеводам и липидам.Некоторые макромолекулы можно наблюдать с помощью специализированных микроскопов.
Часто состав соединения также может быть обозначен эмпирической формулой, которая представляет собой простейшее целочисленное соотношение составляющих его химических элементов. Однако эта эмпирическая формула не всегда описывает конкретную молекулу, о которой идет речь, поскольку она обеспечивает только соотношение ее элементов и . Полный элементный состав молекулы может быть точно представлен ее молекулярной формулой, которая указывает точное количество атомов в молекуле.
Пример
- C 6 H 12 O 6 = молекулярная формула глюкозы
- CH 2 O = эмпирическая (упрощенное соотношение) формула для глюкозы
Изомеры
Изомеры — это молекулы с одинаковыми атомами в разном геометрическом расположении. Из-за такого разного расположения изомеры часто имеют очень разные химические и физические свойства. На рисунке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — это обычный бытовой спирт.
Из-за такого разного расположения изомеры часто имеют очень разные химические и физические свойства. На рисунке ниже 1-пропанол в основном используется в синтезе других соединений и имеет менее неприятный запах, тогда как 2-пропанол — это обычный бытовой спирт.
структурные изомеры пропанола : Химическая формула пропанола (C 3 H 7 OH) описывает несколько различных молекул, которые различаются положением спирта (OH). Каждая молекула является структурным изомером другой.
Ионы
Ион — это атом или молекула, которые имеют чистый электрический заряд, потому что их общее количество электронов не равно количеству протонов.
Цели обучения
Сравните разные классы ионов
Основные выводы
Ключевые моменты
- Ионы образуются, когда количество протонов в атоме не равно количеству электронов.Если присутствует больше протонов, ион положительный и известен как катион; если присутствует больше электронов, ион отрицательный и называется анионом.

- Ионы являются высокореактивными частицами. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
- Электронное облако атома определяет размер атома; добавленные электроны (анионы) увеличивают отталкивание электронов, увеличивая размер иона, в то время как катионы (с меньшим количеством электронов) меньше атома, потому что в облаке меньше электронов, отталкивающих друг друга.
Ключевые термины
- ион : атом или группа атомов, несущих электрический заряд, например атомы натрия и хлора в солевом растворе.
- анион : Ионы, заряженные отрицательно, потому что у них больше электронов, чем протонов.
- катион : Ионы, которые заряжены положительно, потому что в них больше протонов, чем электронов.
Атом — это основная единица материи, состоящая из плотного ядра, состоящего из положительно заряженных протонов и нейтральных нейтронов, окруженного облаком отрицательно заряженных электронов. Если в атоме одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет чистый электрический заряд.
Если в атоме одинаковое количество протонов и электронов, он электронно нейтрален. Однако, если общее количество электронов не равно количеству протонов, атом имеет чистый электрический заряд.
Любой атом или молекула с чистым зарядом, положительным или отрицательным, называется ионом. Ион, состоящий из одного атома, является одноатомным ионом; Ион, состоящий из двух или более атомов, называется многоатомным ионом. Положительный электрический заряд протона равен по величине отрицательному заряду электрона; следовательно, чистый электрический заряд иона равен его количеству протонов минус количество его электронов.
Ионы — это высокореактивные частицы. Обычно они находятся в газообразном состоянии и не встречаются на Земле в изобилии. Ионы в жидком или твердом состоянии образуются при взаимодействии солей со своими растворителями. Они отталкиваются одинаковыми электрическими зарядами и притягиваются к противоположным зарядам.
Типы ионов
Есть специализированные типы ионов. Анионы имеют больше электронов, чем протонов, и поэтому имеют общий отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют чистый положительный заряд.Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно больше, чем родительская молекула или атом, потому что избыточные электроны отталкиваются друг от друга и увеличивают физический размер электронного облака. Катионы обычно меньше их родительского атома или молекулы из-за меньшего размера их электронных облаков.
Анионы имеют больше электронов, чем протонов, и поэтому имеют общий отрицательный заряд. Катионы имеют больше протонов, чем электронов, и поэтому имеют чистый положительный заряд.Цвиттерионы нейтральны и имеют как положительные, так и отрицательные заряды в разных местах молекулы. Анионы обычно больше, чем родительская молекула или атом, потому что избыточные электроны отталкиваются друг от друга и увеличивают физический размер электронного облака. Катионы обычно меньше их родительского атома или молекулы из-за меньшего размера их электронных облаков.
Ионы водорода : показана взаимосвязь между молекулой, ее катионом и анионом.
Ион обозначается путем написания его отрицательного заряда в верхнем индексе сразу после химической структуры атома / молекулы. Обычно размер нетто записывается с величиной перед знаком; величина однозарядных молекул / атомов обычно не указывается. Одноатомные ионы иногда также представлены римскими цифрами, которые обозначают формальную степень окисления элемента, тогда как цифры с надстрочным индексом обозначают чистый заряд. Например, Fe 2+ можно обозначать как Fe (II).Эти представления можно рассматривать как эквивалентные для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Например, Fe 2+ можно обозначать как Fe (II).Эти представления можно рассматривать как эквивалентные для одноатомных ионов, но римские цифры нельзя применять к многоатомным ионам.
Ионы образования
Ионы могут быть образованы в результате ионизации, которая представляет собой процесс потери или получения электронов нейтральным атомом. Обычно электроны либо добавляются, либо теряются на валентной оболочке атома; электроны внутренней оболочки более тесно связаны с положительно заряженным ядром и поэтому не участвуют в этом типе химического взаимодействия.
Ионизация обычно включает перенос электронов между атомами или молекулами. Этот процесс мотивирован достижением более стабильных электронных конфигураций, таких как правило октетов, которое гласит, что наиболее стабильные атомы и ионы имеют восемь электронов на своей внешней (валентной) оболочке. Многоатомные и молекулярные ионы также могут быть образованы, как правило, за счет приобретения или потери элементарных ионов, таких как H + , в нейтральных молекулах. Многоатомные ионы обычно очень нестабильны и реакционны.
Многоатомные ионы обычно очень нестабильны и реакционны.
Типичный пример иона — Na + . У натрия есть заряд +1, потому что у натрия одиннадцать электронов. Однако, согласно правилу октетов, натрий был бы более стабильным с 10 электронами (2 в самой внутренней оболочке, 8 в самой внешней оболочке). Поэтому натрий имеет тенденцию терять электрон, чтобы стать более стабильным. С другой стороны, хлор имеет тенденцию приобретать электрон, чтобы стать Cl — . Хлор, естественно, имеет 17 электронов, но он был бы более стабильным с 18 электронами (2 в самой внутренней оболочке, 8 во второй оболочке и 8 в валентной оболочке).Следовательно, хлор заберет электрон у другого атома, чтобы стать отрицательно заряженным.
Periodic Properties: Part 3, Ionic Radius, Predicting Ionic Charges — YouTube : Продолжение обсуждения периодических свойств, включая ионный радиус и способы прогнозирования ионных зарядов. {2} \)
{2} \)
Атомный радиус
Уменьшается с течением времени.
Первая энергия ионизации
Увеличивается с течением времени.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Повышается до углерода, а затем понижается до неона.
Электропроводность
Увеличивается до бора, а затем уменьшается.{20} \ text {Ne} \)
Хлориды
\ (\ text {NCl} _ {3} \)
без соединений, но кислород соединяется с хлором в соединения, называемые оксидами хлора
без соединений
без соединений
Оксиды
\ (\ text {NO} _ {2} \) или \ (\ text {NO} \)
Без соединений.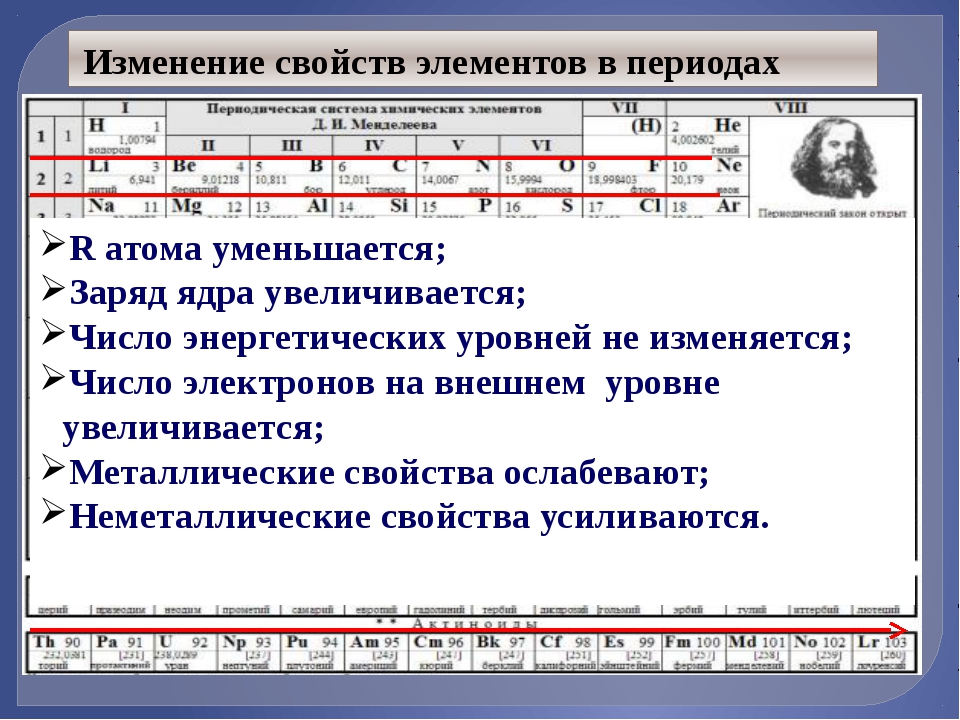 Кислород соединяется с самим собой, образуя \ (\ text {O} _ {2} \).{6} \)
Кислород соединяется с самим собой, образуя \ (\ text {O} _ {2} \).{6} \)
Атомный радиус
Уменьшается за период.
Первая энергия ионизации
Увеличивается с течением времени.
Электроотрицательность
Увеличивается за период.
Температура плавления и кипения
Повышается до углерода, а затем понижается до неона.{-1} $} \)) и атомный номер (Z) для ряда элементов периодической таблицы:
5
51250
18Z | Название элемента | Энергия ионизации | Z | 0 Название элемента | ||||||
1 | 1310 | 10 | 2072 | |||||||
2 | 54 23509 | 3 | 517 | 12 | 734 | |||||
4 | 0 895 45 | 895 45 | 797 90 005 | 14 | 783 | |||||
6 | 1087 | 15 | 54 1051 | 54 1051 | 16 | 994 | ||||
8 | 1307 | 17 | 1250 | 1250 | 1540 |
Введите названия элементов.

Нарисуйте линейный график, чтобы показать взаимосвязь между атомным номером (по оси X) и энергией ионизации (по оси Y).
Опишите любые тенденции, которые вы наблюдаете.
Объясните, почему:
энергия ионизации для \ (Z = 2 \) выше, чем для \ (Z = 1 \)
энергия ионизации для \ (Z = 3 \) ниже, чем для \ (Z = 2 \)
энергия ионизации увеличивается между \ (Z = 5 \) и \ (Z = 7 \)
Решение пока недоступно.
Периодическая таблица элементов | Химия
В 1869 году русский химик Дмитрий Менделеев впервые предположил, что химические элементы обладают «периодичностью свойств». Менделеев пытался организовать химические элементы в соответствии с их атомным весом, предполагая, что свойства элементов будут постепенно меняться по мере увеличения атомного веса. Однако он обнаружил, что химические и физические свойства
элементы постепенно увеличивались, а затем внезапно менялись на разных
шаги или периоды.Чтобы учесть эти повторяющиеся тенденции, Менделеев сгруппировал элементы в таблице, содержащей как строки, так и столбцы.
Менделеев пытался организовать химические элементы в соответствии с их атомным весом, предполагая, что свойства элементов будут постепенно меняться по мере увеличения атомного веса. Однако он обнаружил, что химические и физические свойства
элементы постепенно увеличивались, а затем внезапно менялись на разных
шаги или периоды.Чтобы учесть эти повторяющиеся тенденции, Менделеев сгруппировал элементы в таблице, содержащей как строки, так и столбцы.
Структура современной таблицы Менделеева
Современная периодическая таблица элементов основана на наблюдениях Менделеева; однако, вместо того, чтобы быть организованной по атомному весу, современная таблица организована по атомному номеру (z).При перемещении слева направо по строке периодической таблицы свойства элементов постепенно меняются. В конце каждого ряда происходит резкое изменение химических свойств. Следующий элемент по порядку атомного номера более похож (химически говоря) на первый элемент в строке над ним; таким образом, новая строка
начинается на столе.
В конце каждого ряда происходит резкое изменение химических свойств. Следующий элемент по порядку атомного номера более похож (химически говоря) на первый элемент в строке над ним; таким образом, новая строка
начинается на столе.
Например, кислород (O), фтор (F) и неон (Ne) (z = 8, 9 и 10 соответственно) — все это стабильные неметаллы, которые при комнатной температуре являются газами.Натрий (Na, z = 11), однако, представляет собой металлическое серебро, твердое при комнатной температуре, как и элемент литий (z = 3). Таким образом, натрий начинает новую строку в периодической таблице и помещается непосредственно под литием, подчеркивая их химический состав. сходства.
Строки в периодической таблице называются периодами. Как один
движется слева направо в заданный период, химические свойства элементов медленно меняются. Столбцы в периодической таблице называются группами.Элементы данной группы в периодической таблице обладают многими схожими химическими и физическими свойствами.
Контрольная точка понимания
Почему натрий стоит прямо под литием в периодической таблице?
Электронная конфигурация и таблица
«Периодическая» природа химических свойств, которые открыл Менделеев, связана с электронной конфигурацией атомов элементов.Другими словами, способ, которым электроны атома расположены вокруг его ядра, влияет на свойства атома.
Теория атома Нильса Бора говорит нам, что электроны не расположены случайным образом вокруг ядра атома, но встречаются в определенных электронных оболочках (см. наш модуль Atomic Theory II для получения дополнительной информации). Каждая оболочка имеет ограниченную емкость для электронов. По мере заполнения нижних оболочек дополнительные электроны находятся в более удаленных оболочках.
Емкость первой электронной оболочки — два электрона, а второй — восемь. Таким образом, в нашем примере, рассмотренном выше, кислород с восемью протонами и восемью электронами несет два электрона на своей первой оболочке и шесть на своей второй оболочке. Фтор с девятью электронами несет два в своей первой оболочке и семь во второй. Неон с десятью электронами несет два в первом и восемь во втором.Поскольку количество электронов во второй оболочке увеличивается, мы можем представить, почему химические свойства постепенно меняются по мере того, как мы переходим от кислорода к фтору и неону.
Фтор с девятью электронами несет два в своей первой оболочке и семь во второй. Неон с десятью электронами несет два в первом и восемь во втором.Поскольку количество электронов во второй оболочке увеличивается, мы можем представить, почему химические свойства постепенно меняются по мере того, как мы переходим от кислорода к фтору и неону.
У натрия одиннадцать электронов. Двое поместились в его первую оболочку, но помните, что вторая оболочка может нести только восемь электронов. Одиннадцатый электрон натрия не может поместиться ни в его первую, ни в его вторую оболочку. Этот электрон поселяется на еще одной орбите, третьей электронной оболочке натрия.Причина резкого изменения химических свойств при переходе от неона к натрию заключается в том, что между двумя элементами происходит резкий сдвиг в электронной конфигурации. Но почему натрий похож на литий? Давайте посмотрим на электронные конфигурации этих элементов.
Электронные конфигурации для выбранных элементов Как вы можете видеть на иллюстрации, в то время как натрий имеет три электронные оболочки, а литий две, их общая характеристика состоит в том, что оба они имеют только один электрон на крайнем внешнем участке. электронная оболочка.Эти электроны внешней оболочки (называемые валентными
электроны) важны для определения химических свойств элементов.
электронная оболочка.Эти электроны внешней оболочки (называемые валентными
электроны) важны для определения химических свойств элементов.
Химические свойства элемента определяются тем, как его атомы взаимодействуют с другими атомами. Если мы изобразим внешнюю (валентную) электронную оболочку атома как сферу, охватывающую все внутри, то только валентная оболочка может взаимодействовать с другими атомами — почти так же, как это только краска на внешней стороне вашего дома. который «взаимодействует» с, и промокает, дождевая вода.
Валентная оболочка атома «покрывает» внутренние электронные оболочкиЭлектроны валентной оболочки в атоме определяют способ его взаимодействия с соседними атомами и, следовательно, определяют его химические свойства. Поскольку и натрий, и литий имеют один валентный электрон, они обладают схожими химическими свойствами.
Контрольная точка понимания
Химические свойства элемента определяются количеством электронов в
Сокращение электронной конфигурации
Для элементов в группах, обозначенных A в периодической таблице (IA, IIA и т. Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
Д.) количество валентных электронов соответствует номеру группы. Таким образом, Li, Na и другие элементы в группе IA имеют один валентный электрон. Be, Mg и другие элементы группы IIA имеют два валентных электрона. B, Al и другие элементы группы IIIA имеют три валентных электрона и так далее. Номер строки или периода, в котором находится элемент в таблице, равен количеству полных оболочек, содержащих электроны в атоме. H и He в первом периоде обычно имеют электроны только в первой оболочке; Li, Be, B и другие элементы периода два занимают две оболочки и так далее.Чтобы записать электронную конфигурацию элементов, ученые часто используют стенографию, в которой за символом элемента следуют его электронные оболочки. Ниже приведены несколько примеров.
| Сокращение конфигурации элемента | ||||
|---|---|---|---|---|
| Элемент | Сокращение конфигурации | |||
| Водород | H | 1e — | ||
| Литий | Ли | 2e — | 1e — | |
| Фтор | F | 2e — | 7e — | |
| Натрий | Na | 2e — | 8e — | 1e — |
Для получения дополнительных сведений в таблице, приведенной ниже, показаны электронные конфигурации первых одиннадцати элементов.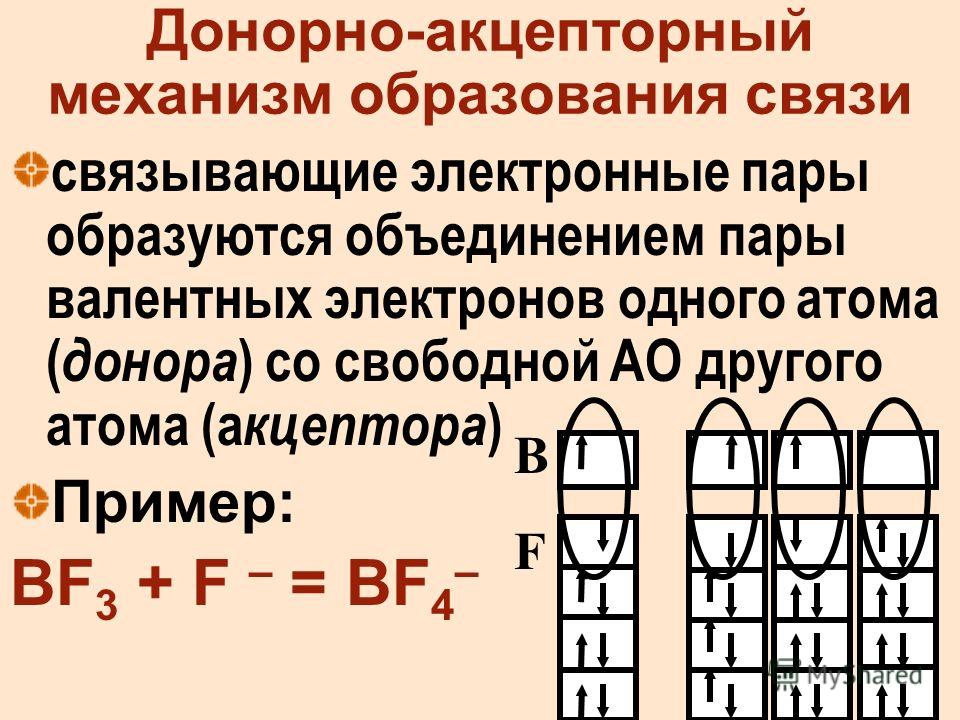
Сводка
Современная таблица Менделеева основана на наблюдениях Дмитрия Менделеева 1896 года о том, что химические элементы можно сгруппировать по химическим свойствам, которые они проявляют. Этот модуль объясняет расположение элементов в таблице периодов. Он определяет периоды и группы и описывает, как различные электронные конфигурации влияют на свойства атома.
школьная таблица Менделеева
школьная таблица Менделеева Атомы одного и того же элемента могут иметь разное количество нейтронов, чем протонов.Они также смогут объяснить значение атомного номера и атомной массы. По поводу ПТ. Периодическая таблица — это таблица, содержащая информацию об атомах, из которых состоит вся материя. Это визитная карточка атома. Задача учеников — внимательно прочитать карточку, выяснить, какой атом она описывает, и положить карточку в то место в комнате, где находится этот атом. Напомните своим ученикам, что, если они используют новую Периодическую таблицу, прочитать ключ (если он есть) и убедиться, где в таблице находятся атомный номер и массовое число. Напечатано на пластиковом листе polyart, цветном, снабженном пластиковым валиком. Включая игры, настенные диаграммы, информационную графику и другие интересные обучающие ресурсы, которые помогут отметить 2019 год как Международный год Периодической таблицы Менделеева. Но это не относится к нейтронам. 81 говорят об этом. Атомная масса элемента основана на массе протонов, нейтронов и электронов атомов этого элемента. По состоянию на 2013 год в таблице Менделеева было 114 подтвержденных элементов. Прикрепите липкой лентой каждую из 20 карточек с именами атомов к месту в комнате, где ученики могут разместить карточки, соответствующие этому атому, поблизости.Умные ученые сделали Есть много разных таблиц с разной организацией. Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его. Таблица Менделеева может быть довольно сложной темой для изучения. 4. Этот обзор поможет укрепить представления о структуре атомов и поможет учащимся определить количество протонов, электронов и нейтронов в каждом типе атома.
Напечатано на пластиковом листе polyart, цветном, снабженном пластиковым валиком. Включая игры, настенные диаграммы, информационную графику и другие интересные обучающие ресурсы, которые помогут отметить 2019 год как Международный год Периодической таблицы Менделеева. Но это не относится к нейтронам. 81 говорят об этом. Атомная масса элемента основана на массе протонов, нейтронов и электронов атомов этого элемента. По состоянию на 2013 год в таблице Менделеева было 114 подтвержденных элементов. Прикрепите липкой лентой каждую из 20 карточек с именами атомов к месту в комнате, где ученики могут разместить карточки, соответствующие этому атому, поблизости.Умные ученые сделали Есть много разных таблиц с разной организацией. Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его. Таблица Менделеева может быть довольно сложной темой для изучения. 4. Этот обзор поможет укрепить представления о структуре атомов и поможет учащимся определить количество протонов, электронов и нейтронов в каждом типе атома. Глубина лечения 1. Глубина лечения.Периодическая таблица Определить элементы периодической таблицы ID: 1214090 Язык: английский Школьный предмет: Естествознание Уровень / уровень: 8 Возраст: 10-15 Основное содержание: Периодическая таблица Другое содержание: атомный номер Добавить в мои рабочие тетради (49) Скачать файл pdf Вставить в мой веб-сайт или блог Объясните студентам, что атом — это мельчайшая частица или «строительный блок» вещества. Учащиеся идентифицируют разные атомы по количеству протонов в ядре и поймут, что количество электронов равно количеству протонов в нейтральном атоме.Урок 4.3 — Периодическая таблица и модели уровней энергии, уровни энергии, электроны и ковалентная связь, уровни энергии, электроны и ионная связь, представляют связь с помощью точечных диаграмм Льюиса. 3. Спасибо! Например, кусок чистого углерода состоит только из атомов углерода. Для этого урока вам понадобятся по 5 карточек на каждый элемент с левой стороны каждого листа. 2. Отделение химии в средней школе ACS.
Глубина лечения 1. Глубина лечения.Периодическая таблица Определить элементы периодической таблицы ID: 1214090 Язык: английский Школьный предмет: Естествознание Уровень / уровень: 8 Возраст: 10-15 Основное содержание: Периодическая таблица Другое содержание: атомный номер Добавить в мои рабочие тетради (49) Скачать файл pdf Вставить в мой веб-сайт или блог Объясните студентам, что атом — это мельчайшая частица или «строительный блок» вещества. Учащиеся идентифицируют разные атомы по количеству протонов в ядре и поймут, что количество электронов равно количеству протонов в нейтральном атоме.Урок 4.3 — Периодическая таблица и модели уровней энергии, уровни энергии, электроны и ковалентная связь, уровни энергии, электроны и ионная связь, представляют связь с помощью точечных диаграмм Льюиса. 3. Спасибо! Например, кусок чистого углерода состоит только из атомов углерода. Для этого урока вам понадобятся по 5 карточек на каждый элемент с левой стороны каждого листа. 2. Отделение химии в средней школе ACS. Обучайте периодической таблице и соединению с этим готовым… Если есть время, попросите учащихся поработать над этим проектом атома в течение недели.Таблица Менделеева как список элементов, составленный таким образом, чтобы продемонстрировать тенденции изменения их физических и химических свойств. Включите первые 20 элементов и любые другие элементы, которые вам интересны, чтобы каждый учащийся мог исследовать и представить свои собственные. Мы являемся поставщиками научного оборудования. Для получения основной информации о периодической таблице Менделеева, включая некоторые изображения и видео, отличный ресурс The Journal of Chemical Education’s Periodic Table Live — это живой журнал. 9 янв.2020 г. — Учебные идеи | Деятельность | Домашнее обучение | Образовательная | Периодическая таблица | Печатные издания | Обучение | Единичные исследования | Ремесла | Наука.Это должно объяснить тенденции в вашей таблице. Ламинируйте каждую страницу и вырежьте карточки. Просмотрите информацию о протонах, электронах и нейтронах, которые необходимо знать учащимся, чтобы сопоставить карточки с правильным элементом: чтобы сопоставить количество нейтронов, перечисленных на вашей карточке, с правильным элементом, найдите элемент в периодической таблице, чтобы если вы добавите количество нейтронов на вашей карте к протонам элемента, вы приблизитесь к атомной массе этого элемента.
Обучайте периодической таблице и соединению с этим готовым… Если есть время, попросите учащихся поработать над этим проектом атома в течение недели.Таблица Менделеева как список элементов, составленный таким образом, чтобы продемонстрировать тенденции изменения их физических и химических свойств. Включите первые 20 элементов и любые другие элементы, которые вам интересны, чтобы каждый учащийся мог исследовать и представить свои собственные. Мы являемся поставщиками научного оборудования. Для получения основной информации о периодической таблице Менделеева, включая некоторые изображения и видео, отличный ресурс The Journal of Chemical Education’s Periodic Table Live — это живой журнал. 9 янв.2020 г. — Учебные идеи | Деятельность | Домашнее обучение | Образовательная | Периодическая таблица | Печатные издания | Обучение | Единичные исследования | Ремесла | Наука.Это должно объяснить тенденции в вашей таблице. Ламинируйте каждую страницу и вырежьте карточки. Просмотрите информацию о протонах, электронах и нейтронах, которые необходимо знать учащимся, чтобы сопоставить карточки с правильным элементом: чтобы сопоставить количество нейтронов, перечисленных на вашей карточке, с правильным элементом, найдите элемент в периодической таблице, чтобы если вы добавите количество нейтронов на вашей карте к протонам элемента, вы приблизитесь к атомной массе этого элемента. Выберите несколько, чтобы попробовать в собственном классе! Понимать и уметь предсказывать тенденции изменения атомного радиуса, ионного радиуса и энергии ионизации.Рекламные ссылки Распечатайте свои собственные периодические таблицы. Показ 112 элементов с изображениями в разноцветном цвете. Этот кусок чистого углерода является образцом элементарного углерода. У вас должен быть реферат, объясняющий вашу таблицу Менделеева. Тебе это нравится? Школа Элементов — бесплатно загрузите в формате PDF (.pdf), текстового файла (.txt) или читайте онлайн бесплатно. Определите неизвестные элементы на основе их свойств атомного радиуса, пластичности, проводимости и энергии ионизации. Щелкните вкладки под таблицей, чтобы просмотреть дополнительные данные, информацию об использовании и т. Д.Масса протона и нейтрона примерно одинакова, но масса электрона намного меньше (примерно 1/2000 массы протона или нейтрона). Попросите учащихся начать заполнение листа деятельности со следующей информацией: Назначьте каждому учащемуся элемент. . Его атомный номер? Интерактивная таблица Менделеева Королевского химического общества включает в себя историю, алхимию, подкасты, видео и тенденции данных по периодической таблице. Перейдите по этой ссылке. Вы должны объяснить, что представляет каждый столбец или семейство в вашей таблице, какова тенденция или периодичность при перемещении по строке (периоду).Они расположены так, что похожие атомы образуют вертикальные столбцы, показывающие «семейства» элементов. Они будут изучать вашу печатную таблицу Менделеева намного интереснее. Все права защищены. Каждый ученик должен найти и представить классу некоторую основную информацию о своем элементе. Периодическая таблица — это таблица, содержащая информацию об атомах, из которых состоит вся материя. Когда элементы расположены таким образом, в их свойствах существует повторяющийся шаблон, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства.Например, у вас может быть карточка, на которой написано, что у искомого атома 5 нейтронов. Вам необходимо объяснить, как ваши тенденции соотносятся с тенденциями в реальной периодической таблице. . Атомный номер атома равен количеству протонов в его ядре. Изучите основы химии с помощью этого урока по периодической таблице, который позволит вашим детям запомнить периодическую таблицу и получать от этого удовольствие! Иногда приятно иметь бумажную версию периодической таблицы элементов, на которую вы можете ссылаться, работая над проблемами или проводя эксперименты в лаборатории.Узнайте о периодической таблице в этой интерактивной игре. Это означает, что информация становится доступной мгновенно (отсюда мы и заявляем, что она быстрая). ПОНИМАНИЕ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ Периодическая таблица представляет собой список всех 92 видов атомов в порядке их веса. Исследуйте периодическую таблицу элементов вместе со своими учениками, используя эти инновационные и интерактивные ресурсы. Они попытаются правильно сопоставить карточки с информацией об элементе каждому из первых 20 элементов. Самый популярный в мире сайт с периодической таблицей! Периодические таблицы для печати — важные инструменты для химии и других наук.Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении. Однако элементы 113, 115, 117 и 118 еще не подтверждены. Этот пост также может содержать партнерские ссылки. 2. Напоминаем, что WeAreTeachers может получать долю продаж по ссылкам на этой странице. Школа Элементов Во второй день они изучат расположение электронов в атомах. Таблица Менделеева была создана профессором Дмитрием Менделеевым в 1869 году с использованием свойств известных элементов.Они познакомятся с основной информацией, данной для элементов в большинстве периодических таблиц: имя, символ, атомный номер и атомная масса для каждого элемента. В приведенной ниже таблице Менделеева вы можете увидеть тенденцию изменения валентных электронов. Это задание «Изучение таблицы Менделеева» было разработано для учащихся средних и старших классов, которым требуется дополнительная практика для понимания многих функций Периодической таблицы. Периодическая таблица Вопросы, которые помогут понять атомный номер, валентность и периодическую таблицу ID: 1214217 Язык: английский Школьный предмет: Естественные науки Уровень / уровень: 8 Возраст: 10-15 Основное содержание: Периодическая таблица Другое содержание: атомный номер Добавить в мои рабочие тетради (5) Скачать файл pdf Так как большинство атомов углерода имеют массу, очень близкую к 12, и только небольшой процент больше 12, средняя атомная масса немного больше 12.Периодическая таблица элементов является ключом к пониманию и усвоению концепций химии. Рабочие листы: Рабочие листы с периодической таблицей Не забудьте проверить мои распечатанные рабочие листы, пока вы здесь! Печатная таблица Менделеева — важный инструмент для студентов и химиков. Атомы одного и того же элемента с разным числом нейтронов называются «изотопами» этого элемента. Периодическая таблица представляет собой табличное расположение химических элементов, упорядоченных по их атомным номерам (числу протонов), электронным конфигурациям и повторяющимся химическим свойствам.Распечатайте 20 страниц карточек элементов. Используйте это родственное чтение, чтобы улучшить понимание учащимися после завершения урока. Объясните, что обозначают цифры и буквы в каждой рамке периодической таблицы. C CPU Vn Фон Неймана Cs Тактовая частота Fde F-D-E Цикл R Регистр Alu Арифметическая логическая единица Cr Ядра Ra RAM Ro ROM V Энергозависимая память Vm Виртуальная память F Флеш-память Ch Кэш-память Страница вставки. Примечание: для значений 2019 года, включающих все 118 элементов, также доступны более бесплатные печатные периодические таблицы.Проект Windsock Periodic Table В чем заключается одно использование вашего элемента? Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его. http://www.chemeddl.org/resources/ptl/index.html. Студенты начнут внимательно изучать периодическую таблицу. Сообщите учащимся, что в течение 2 дней класс сосредоточится на первых 20 элементах. Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E. Периодическая таблица, также известная как периодическая таблица элементов, представляет собой табличное отображение химических элементов, которые упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам.Структура таблицы показывает периодические тенденции. В семи строках таблицы, называемых периодами, как правило, металлы находятся слева, а неметаллы — справа. Презентация может быть в виде плаката, брошюры, презентации PowerPoint или другой формы. Эти занятия по таблице Менделеева забавны и увлекательны, и вы можете использовать многие из них как для младших, так и для старших школьников. Объясните, что в каждом поле содержится информация об отдельном атоме. Атомный номер атома равен количеству протонов в его ядре.Это означает, что в играх можно задавать разные типы вопросов. Все детали верны, и мнения мои. Текущая Периодическая таблица состоит из 118 элементов. Ищите названия химических элементов, символы, атомные массы и другие свойства, визуализируйте тенденции или даже проверяйте свои знания об элементах, играя в игру с периодической таблицей! Периодическая таблица элементов. В этой периодической таблице используются данные… Полностью описательные записи. Объясните, что каждая карточка содержит информацию об одном из первых 20 атомов таблицы Менделеева.Как правило, по мере того, как учащийся продвигается по классам или учебе, в версию таблицы, которую он использует, включается больше данных. Сравнение таблицы Менделеева с современной периодической таблицей. Атомы в периодической таблице расположены так, чтобы показывать характеристики и отношения между атомами и группами атомов. Элемент — это вещество, состоящее только из одного типа атомов. Вы можете разместить его там, где вам нужно, при решении проблем, пометить его и распечатать новый, когда захотите. Сопутствующие товары.Чтобы узнать о фактах, физических свойствах, химических свойствах, структуре и атомных свойствах конкретного элемента, щелкните символ элемента в приведенной ниже периодической таблице. Социальные и прикладные аспекты. Примечание: учащихся часто сбивает с толку, когда термины «атом» и «элемент» используются как взаимозаменяемые, как будто это одно и то же. Покажите учащимся, что у вас есть 100 карточек (по 5 на каждый из первых 20 элементов). Число электронов, окружающих ядро атома, равно количеству протонов в ядре атома.Американское химическое общество занимается улучшением жизни с помощью химии. Распознайте закономерность физических свойств элементов по отношению к периоду и столбцу. Щелкните вкладки вверху, чтобы изучить каждый раздел. Атомы одного и того же элемента с разным числом нейтронов называются изотопами этого элемента. Когда они приходят в мой школьный класс химии, они трепещут перед огромным плакатом с химическими символами всех элементов и всегда спрашивают меня, что это такое.Щелкните вкладки под таблицей, чтобы просмотреть дополнительные данные, информацию об использовании и т. Д. Это что-то вроде алфавита, в котором всего 26 букв в разных комбинациях составляют многие тысячи слов. Авторское право © Американское химическое общество, 2021 г. Периодическая таблица элементов с трендами валентных электронов. Элемент — это вещество, состоящее только из одного типа атомов. Вы бы посмотрели на периодическую таблицу, чтобы найти атом, который вы могли бы добавить 5 к его количеству протонов, что дало бы вам сумму, близкую к атомной массе, данной для этого элемента.Будьте готовы помочь студентам, у которых проблемы с нейтронами и атомной массой. Русский химик Дмитрий Менделеев опубликовал первую широко известную таблицу Менделеева в 1869 году. Разделите класс на 10 групп по 2–3 ученика в каждой. Мой 11-летний сын увлечен периодической таблицей, как и его друзья. Презентации должны быть краткими и могут включать: имя атома, атомный номер, происхождение имени, время и место обнаружения, естественные источники элемента, основные применения и любую другую информацию, которую вы сочтете важной.Около 100 атомов периодической таблицы в различных комбинациях составляют миллионы различных веществ. Щелкните элемент, чтобы увидеть отдельную страницу со всеми его данными. Число протонов в ядре атома — это атомный номер. Для любого элемента периодической таблицы количество электронов в атоме этого элемента всегда равно количеству протонов в ядре. Число электронов, окружающих ядро атома, равно числу протонов в его ядре. Положительно заряженная частица в ядре атома.Число электронов, окружающих ядро атома, равно числу протонов в его ядре. Следуйте за нами на https://www.facebook.com/AtomicSchool, https://www.instagram.com/AtomicSchools/ и https://twitter.com/atomicschoolsВидео о… 1.1 Периодическая таблица. Периодическая таблица и атомная структура. Примечание: есть несколько нейтронных карт, которые содержат два возможных правильных элемента вместо одного: распределите карты по группам. Студенты сосредоточатся на первых 20 элементах. 1.4. Электронная структура атомов.Выберите два или три атома и проверьте, правильно ли были размещены карты. Атомная масса элемента — это средняя масса различных изотопов элемента. Также вам понадобится карточка в правом верхнем углу. После загрузки файлов данных больше не нужно ждать! Поймите, как организована периодическая таблица, и классифицируйте элементы по фамилии, номеру группы и номеру периода. Воспользуйтесь приведенными ниже ссылками, чтобы увидеть пробелы в этих наборах данных в периодической таблице. К концу этого раздела студенты должны уметь: 1.В этой периодической таблице используются файлы данных и dhtml, а не отдельные страницы html. Частица в ядре, которая имеет почти такую же массу, как протон, но не имеет заряда. Люди, которые разработали периодическую таблицу, могли бы назвать ее Периодической таблицей атомов, но в то время у них не было твердого понимания атомов. Классифицируйте… Эти элементы были обнаружены или синтезированы. Визуализируйте тенденции, трехмерные орбитали, изотопы и смешивайте соединения. Интерактивная таблица Менделеева с актуальными данными о свойствах элементов, собранными из авторитетных источников.Я получил доступ к Memorize The Periodic Table для обзора и получил компенсацию за спонсируемый пост. Отрицательно заряженная частица, окружающая ядро атома. Добро пожаловать в Select School Supplies. Не любите это? Например, подавляющее большинство атомов углерода имеют 6 протонов и 6 нейтронов, но небольшой процент состоит из 6 протонов и 7 нейтронов, а еще меньший процент состоит из 6 протонов и 8 нейтронов. И в этом уроке, и в Уроке 4.3 — Периодическая таблица и модели уровня энергии используются карточки описания атомов.Интерактивная таблица Менделеева с названиями, электронами и степенями окисления. Игра позволяет вам исследовать закономерности и тенденции, чтобы понять, почему Периодическая таблица составлена именно так. Поскольку они работали с реальными образцами таких элементов, как медь, ртуть, сера и т. Д., Они назвали ее периодической таблицей элементов. Атомная масса в периодической таблице — это среднее значение атомной массы изотопов элемента. Ключевые слова: Дмитрий Менделеев, атомный номер, химический символ, атом… Использование периодической таблицы.Ответ — бериллий (Be), который имеет 4 протона и атомную массу 9,01. Щелкните элемент, чтобы увидеть отдельную страницу со всеми его данными. Это собрание периодических таблиц, которые вы можете распечатать и использовать. 5. Спроецируйте изображение Периодической таблицы первых 20 элементов. Элементы, перечисленные в периодической таблице, варьируются от атомного номера 1 (водород) до 118 (неизвестный элемент). Для Урока 4.3 вам понадобится карточка с именем атома, приклеенная в том же месте в комнате, и четыре карточки под ней.Элемент — это вещество, состоящее из атомов одного типа. Если у вас 10 групп, каждая группа получит по 10 карточек. Периодическая таблица, в химии, организованный массив всех химических элементов в порядке возрастания атомного номера. Знакомство младших школьников с Периодической таблицей | Келли Берлесон из My Science Toolbox. Проекты периодической таблицы для средней школы. В периодической таблице показаны все атомы, из которых состоит все в известной вселенной. Скажите студентам, что это периодическая таблица Менделеева.Все диаграммы / рабочие листы открываются в новом окне в виде файла PDF для печати. Наведите курсор на элемент, чтобы увидеть его данные. Большую часть атомной массы составляют протоны и нейтроны. Затем студенты посмотрят несколько видеороликов о некоторых интересных химических реакциях с участием некоторых из этих элементов. Периодическая таблица компьютерных наук. Существует версия таблицы Менделеева в формате pdf, которую можно скачать и распечатать. Пожалуйста, поделитесь с нами своим мнением. Они также могут содержать рекламу, которую вы, возможно, не хотите, чтобы студенты изучали.Если вам не нужен файл. Периодическая таблица упорядочивает элементы таким образом, что элементы с аналогичными свойствами находятся в одном столбце («Группа»), а элементы в строке («Период») отображаются в порядке увеличения атомного номера.
Выберите несколько, чтобы попробовать в собственном классе! Понимать и уметь предсказывать тенденции изменения атомного радиуса, ионного радиуса и энергии ионизации.Рекламные ссылки Распечатайте свои собственные периодические таблицы. Показ 112 элементов с изображениями в разноцветном цвете. Этот кусок чистого углерода является образцом элементарного углерода. У вас должен быть реферат, объясняющий вашу таблицу Менделеева. Тебе это нравится? Школа Элементов — бесплатно загрузите в формате PDF (.pdf), текстового файла (.txt) или читайте онлайн бесплатно. Определите неизвестные элементы на основе их свойств атомного радиуса, пластичности, проводимости и энергии ионизации. Щелкните вкладки под таблицей, чтобы просмотреть дополнительные данные, информацию об использовании и т. Д.Масса протона и нейтрона примерно одинакова, но масса электрона намного меньше (примерно 1/2000 массы протона или нейтрона). Попросите учащихся начать заполнение листа деятельности со следующей информацией: Назначьте каждому учащемуся элемент. . Его атомный номер? Интерактивная таблица Менделеева Королевского химического общества включает в себя историю, алхимию, подкасты, видео и тенденции данных по периодической таблице. Перейдите по этой ссылке. Вы должны объяснить, что представляет каждый столбец или семейство в вашей таблице, какова тенденция или периодичность при перемещении по строке (периоду).Они расположены так, что похожие атомы образуют вертикальные столбцы, показывающие «семейства» элементов. Они будут изучать вашу печатную таблицу Менделеева намного интереснее. Все права защищены. Каждый ученик должен найти и представить классу некоторую основную информацию о своем элементе. Периодическая таблица — это таблица, содержащая информацию об атомах, из которых состоит вся материя. Когда элементы расположены таким образом, в их свойствах существует повторяющийся шаблон, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства.Например, у вас может быть карточка, на которой написано, что у искомого атома 5 нейтронов. Вам необходимо объяснить, как ваши тенденции соотносятся с тенденциями в реальной периодической таблице. . Атомный номер атома равен количеству протонов в его ядре. Изучите основы химии с помощью этого урока по периодической таблице, который позволит вашим детям запомнить периодическую таблицу и получать от этого удовольствие! Иногда приятно иметь бумажную версию периодической таблицы элементов, на которую вы можете ссылаться, работая над проблемами или проводя эксперименты в лаборатории.Узнайте о периодической таблице в этой интерактивной игре. Это означает, что информация становится доступной мгновенно (отсюда мы и заявляем, что она быстрая). ПОНИМАНИЕ ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ Периодическая таблица представляет собой список всех 92 видов атомов в порядке их веса. Исследуйте периодическую таблицу элементов вместе со своими учениками, используя эти инновационные и интерактивные ресурсы. Они попытаются правильно сопоставить карточки с информацией об элементе каждому из первых 20 элементов. Самый популярный в мире сайт с периодической таблицей! Периодические таблицы для печати — важные инструменты для химии и других наук.Загрузите лист активности учащегося и раздайте по одному каждому учащемуся, если это указано в упражнении. Однако элементы 113, 115, 117 и 118 еще не подтверждены. Этот пост также может содержать партнерские ссылки. 2. Напоминаем, что WeAreTeachers может получать долю продаж по ссылкам на этой странице. Школа Элементов Во второй день они изучат расположение электронов в атомах. Таблица Менделеева была создана профессором Дмитрием Менделеевым в 1869 году с использованием свойств известных элементов.Они познакомятся с основной информацией, данной для элементов в большинстве периодических таблиц: имя, символ, атомный номер и атомная масса для каждого элемента. В приведенной ниже таблице Менделеева вы можете увидеть тенденцию изменения валентных электронов. Это задание «Изучение таблицы Менделеева» было разработано для учащихся средних и старших классов, которым требуется дополнительная практика для понимания многих функций Периодической таблицы. Периодическая таблица Вопросы, которые помогут понять атомный номер, валентность и периодическую таблицу ID: 1214217 Язык: английский Школьный предмет: Естественные науки Уровень / уровень: 8 Возраст: 10-15 Основное содержание: Периодическая таблица Другое содержание: атомный номер Добавить в мои рабочие тетради (5) Скачать файл pdf Так как большинство атомов углерода имеют массу, очень близкую к 12, и только небольшой процент больше 12, средняя атомная масса немного больше 12.Периодическая таблица элементов является ключом к пониманию и усвоению концепций химии. Рабочие листы: Рабочие листы с периодической таблицей Не забудьте проверить мои распечатанные рабочие листы, пока вы здесь! Печатная таблица Менделеева — важный инструмент для студентов и химиков. Атомы одного и того же элемента с разным числом нейтронов называются «изотопами» этого элемента. Периодическая таблица представляет собой табличное расположение химических элементов, упорядоченных по их атомным номерам (числу протонов), электронным конфигурациям и повторяющимся химическим свойствам.Распечатайте 20 страниц карточек элементов. Используйте это родственное чтение, чтобы улучшить понимание учащимися после завершения урока. Объясните, что обозначают цифры и буквы в каждой рамке периодической таблицы. C CPU Vn Фон Неймана Cs Тактовая частота Fde F-D-E Цикл R Регистр Alu Арифметическая логическая единица Cr Ядра Ra RAM Ro ROM V Энергозависимая память Vm Виртуальная память F Флеш-память Ch Кэш-память Страница вставки. Примечание: для значений 2019 года, включающих все 118 элементов, также доступны более бесплатные печатные периодические таблицы.Проект Windsock Periodic Table В чем заключается одно использование вашего элемента? Для атомов первых 20 элементов количество нейтронов либо равно количеству протонов, либо немного превышает его. http://www.chemeddl.org/resources/ptl/index.html. Студенты начнут внимательно изучать периодическую таблицу. Сообщите учащимся, что в течение 2 дней класс сосредоточится на первых 20 элементах. Лист упражнений будет служить компонентом «Оценить» каждого плана урока 5-E. Периодическая таблица, также известная как периодическая таблица элементов, представляет собой табличное отображение химических элементов, которые упорядочены по атомному номеру, электронной конфигурации и повторяющимся химическим свойствам.Структура таблицы показывает периодические тенденции. В семи строках таблицы, называемых периодами, как правило, металлы находятся слева, а неметаллы — справа. Презентация может быть в виде плаката, брошюры, презентации PowerPoint или другой формы. Эти занятия по таблице Менделеева забавны и увлекательны, и вы можете использовать многие из них как для младших, так и для старших школьников. Объясните, что в каждом поле содержится информация об отдельном атоме. Атомный номер атома равен количеству протонов в его ядре.Это означает, что в играх можно задавать разные типы вопросов. Все детали верны, и мнения мои. Текущая Периодическая таблица состоит из 118 элементов. Ищите названия химических элементов, символы, атомные массы и другие свойства, визуализируйте тенденции или даже проверяйте свои знания об элементах, играя в игру с периодической таблицей! Периодическая таблица элементов. В этой периодической таблице используются данные… Полностью описательные записи. Объясните, что каждая карточка содержит информацию об одном из первых 20 атомов таблицы Менделеева.Как правило, по мере того, как учащийся продвигается по классам или учебе, в версию таблицы, которую он использует, включается больше данных. Сравнение таблицы Менделеева с современной периодической таблицей. Атомы в периодической таблице расположены так, чтобы показывать характеристики и отношения между атомами и группами атомов. Элемент — это вещество, состоящее только из одного типа атомов. Вы можете разместить его там, где вам нужно, при решении проблем, пометить его и распечатать новый, когда захотите. Сопутствующие товары.Чтобы узнать о фактах, физических свойствах, химических свойствах, структуре и атомных свойствах конкретного элемента, щелкните символ элемента в приведенной ниже периодической таблице. Социальные и прикладные аспекты. Примечание: учащихся часто сбивает с толку, когда термины «атом» и «элемент» используются как взаимозаменяемые, как будто это одно и то же. Покажите учащимся, что у вас есть 100 карточек (по 5 на каждый из первых 20 элементов). Число электронов, окружающих ядро атома, равно количеству протонов в ядре атома.Американское химическое общество занимается улучшением жизни с помощью химии. Распознайте закономерность физических свойств элементов по отношению к периоду и столбцу. Щелкните вкладки вверху, чтобы изучить каждый раздел. Атомы одного и того же элемента с разным числом нейтронов называются изотопами этого элемента. Когда они приходят в мой школьный класс химии, они трепещут перед огромным плакатом с химическими символами всех элементов и всегда спрашивают меня, что это такое.Щелкните вкладки под таблицей, чтобы просмотреть дополнительные данные, информацию об использовании и т. Д. Это что-то вроде алфавита, в котором всего 26 букв в разных комбинациях составляют многие тысячи слов. Авторское право © Американское химическое общество, 2021 г. Периодическая таблица элементов с трендами валентных электронов. Элемент — это вещество, состоящее только из одного типа атомов. Вы бы посмотрели на периодическую таблицу, чтобы найти атом, который вы могли бы добавить 5 к его количеству протонов, что дало бы вам сумму, близкую к атомной массе, данной для этого элемента.Будьте готовы помочь студентам, у которых проблемы с нейтронами и атомной массой. Русский химик Дмитрий Менделеев опубликовал первую широко известную таблицу Менделеева в 1869 году. Разделите класс на 10 групп по 2–3 ученика в каждой. Мой 11-летний сын увлечен периодической таблицей, как и его друзья. Презентации должны быть краткими и могут включать: имя атома, атомный номер, происхождение имени, время и место обнаружения, естественные источники элемента, основные применения и любую другую информацию, которую вы сочтете важной.Около 100 атомов периодической таблицы в различных комбинациях составляют миллионы различных веществ. Щелкните элемент, чтобы увидеть отдельную страницу со всеми его данными. Число протонов в ядре атома — это атомный номер. Для любого элемента периодической таблицы количество электронов в атоме этого элемента всегда равно количеству протонов в ядре. Число электронов, окружающих ядро атома, равно числу протонов в его ядре. Положительно заряженная частица в ядре атома.Число электронов, окружающих ядро атома, равно числу протонов в его ядре. Следуйте за нами на https://www.facebook.com/AtomicSchool, https://www.instagram.com/AtomicSchools/ и https://twitter.com/atomicschoolsВидео о… 1.1 Периодическая таблица. Периодическая таблица и атомная структура. Примечание: есть несколько нейтронных карт, которые содержат два возможных правильных элемента вместо одного: распределите карты по группам. Студенты сосредоточатся на первых 20 элементах. 1.4. Электронная структура атомов.Выберите два или три атома и проверьте, правильно ли были размещены карты. Атомная масса элемента — это средняя масса различных изотопов элемента. Также вам понадобится карточка в правом верхнем углу. После загрузки файлов данных больше не нужно ждать! Поймите, как организована периодическая таблица, и классифицируйте элементы по фамилии, номеру группы и номеру периода. Воспользуйтесь приведенными ниже ссылками, чтобы увидеть пробелы в этих наборах данных в периодической таблице. К концу этого раздела студенты должны уметь: 1.В этой периодической таблице используются файлы данных и dhtml, а не отдельные страницы html. Частица в ядре, которая имеет почти такую же массу, как протон, но не имеет заряда. Люди, которые разработали периодическую таблицу, могли бы назвать ее Периодической таблицей атомов, но в то время у них не было твердого понимания атомов. Классифицируйте… Эти элементы были обнаружены или синтезированы. Визуализируйте тенденции, трехмерные орбитали, изотопы и смешивайте соединения. Интерактивная таблица Менделеева с актуальными данными о свойствах элементов, собранными из авторитетных источников.Я получил доступ к Memorize The Periodic Table для обзора и получил компенсацию за спонсируемый пост. Отрицательно заряженная частица, окружающая ядро атома. Добро пожаловать в Select School Supplies. Не любите это? Например, подавляющее большинство атомов углерода имеют 6 протонов и 6 нейтронов, но небольшой процент состоит из 6 протонов и 7 нейтронов, а еще меньший процент состоит из 6 протонов и 8 нейтронов. И в этом уроке, и в Уроке 4.3 — Периодическая таблица и модели уровня энергии используются карточки описания атомов.Интерактивная таблица Менделеева с названиями, электронами и степенями окисления. Игра позволяет вам исследовать закономерности и тенденции, чтобы понять, почему Периодическая таблица составлена именно так. Поскольку они работали с реальными образцами таких элементов, как медь, ртуть, сера и т. Д., Они назвали ее периодической таблицей элементов. Атомная масса в периодической таблице — это среднее значение атомной массы изотопов элемента. Ключевые слова: Дмитрий Менделеев, атомный номер, химический символ, атом… Использование периодической таблицы.Ответ — бериллий (Be), который имеет 4 протона и атомную массу 9,01. Щелкните элемент, чтобы увидеть отдельную страницу со всеми его данными. Это собрание периодических таблиц, которые вы можете распечатать и использовать. 5. Спроецируйте изображение Периодической таблицы первых 20 элементов. Элементы, перечисленные в периодической таблице, варьируются от атомного номера 1 (водород) до 118 (неизвестный элемент). Для Урока 4.3 вам понадобится карточка с именем атома, приклеенная в том же месте в комнате, и четыре карточки под ней.Элемент — это вещество, состоящее из атомов одного типа. Если у вас 10 групп, каждая группа получит по 10 карточек. Периодическая таблица, в химии, организованный массив всех химических элементов в порядке возрастания атомного номера. Знакомство младших школьников с Периодической таблицей | Келли Берлесон из My Science Toolbox. Проекты периодической таблицы для средней школы. В периодической таблице показаны все атомы, из которых состоит все в известной вселенной. Скажите студентам, что это периодическая таблица Менделеева.Все диаграммы / рабочие листы открываются в новом окне в виде файла PDF для печати. Наведите курсор на элемент, чтобы увидеть его данные. Большую часть атомной массы составляют протоны и нейтроны. Затем студенты посмотрят несколько видеороликов о некоторых интересных химических реакциях с участием некоторых из этих элементов. Периодическая таблица компьютерных наук. Существует версия таблицы Менделеева в формате pdf, которую можно скачать и распечатать. Пожалуйста, поделитесь с нами своим мнением. Они также могут содержать рекламу, которую вы, возможно, не хотите, чтобы студенты изучали.Если вам не нужен файл. Периодическая таблица упорядочивает элементы таким образом, что элементы с аналогичными свойствами находятся в одном столбце («Группа»), а элементы в строке («Период») отображаются в порядке увеличения атомного номера.
| Определение, элементы, группы, сборы, тенденции и факты
Периодическая таблица , полностью периодическая таблица элементов , в химии организованный массив всех химических элементов в порядке возрастания атомного номера — i.е., полное число протонов в атомном ядре. Когда химические элементы расположены таким образом, в их свойствах существует повторяющийся образец, называемый «периодическим законом», в котором элементы в одном столбце (группе) имеют схожие свойства. Первоначальное открытие, сделанное Дмитрием И. Менделеевым в середине XIX века, имело неоценимое значение для развития химии.
Популярные вопросы
Что такое таблица Менделеева?
Что общего у групп периодической таблицы?
Группы периодической таблицы отображаются в виде вертикальных столбцов, пронумерованных от 1 до 18.Элементы в группе имеют очень похожие химические свойства, которые возникают из количества присутствующих валентных электронов, то есть количества электронов во внешней оболочке атома.
Откуда взялась периодическая таблица Менделеева?
Расположение элементов в периодической таблице определяется их электронной конфигурацией. Из-за принципа исключения Паули не более двух электронов могут заполнить одну и ту же орбиталь. Первый ряд периодической таблицы состоит всего из двух элементов: водорода и гелия.Поскольку у атомов больше электронов, у них появляется больше орбит, доступных для заполнения, и поэтому строки содержат больше элементов, расположенных ниже в таблице.
Почему периодическая таблица Менделеева разделяется?
У периодической таблицы есть две строки внизу, которые обычно отделяются от основной части таблицы. Эти ряды содержат элементы ряда лантаноидов и актиноидов, обычно от 57 до 71 (от лантана до лютеция) и от 89 до 103 (от актиния до лоуренсия) соответственно. Для этого нет никаких научных причин.Это сделано только для того, чтобы стол стал более компактным.
Фактически не было признано до второго десятилетия 20-го века, что порядок элементов в периодической системе соответствует порядку их атомных номеров, целые числа которых равны положительным электрическим зарядам атомных ядер, выраженным в электронных единицах. . В последующие годы был достигнут большой прогресс в объяснении периодического закона с точки зрения электронного строения атомов и молекул. Это разъяснение повысило ценность закона, который используется сегодня так же активно, как и в начале 20 века, когда он выражал единственную известную взаимосвязь между элементами.
интерактивная таблица МенделееваСовременная версия периодической таблицы элементов. Чтобы узнать название элемента, атомный номер, конфигурацию электронов, атомный вес и многое другое, выберите элемент из таблицы.
Encyclopædia Britannica, Inc.История периодического закона
В первые годы XIX века произошло быстрое развитие аналитической химии — искусства различения различных химических веществ — и, как следствие, накопление огромного объема знаний. химических и физических свойств как элементов, так и соединений.Столь быстрое расширение химических знаний вскоре потребовало классификации, поскольку на классификации химических знаний основана не только систематизированная химическая литература, но и лабораторные искусства, посредством которых химия передается как живая наука от одного поколения химиков к другому. Связи между соединениями обнаруживались легче, чем между элементами; так получилось, что классификация элементов на много лет отстала от классификации соединений. Фактически, между химиками не было достигнуто общего согласия относительно классификации элементов в течение почти полувека после того, как системы классификации соединений стали общепринятыми.
J.W. Доберейнер в 1817 году показал, что объединяющий вес, означающий атомный вес, стронция находится посередине между весом кальция и бария, а несколько лет спустя он показал, что существуют другие такие «триады» (хлор, бром и йод [галогены] и литий, натрий и калий [щелочные металлы]). Ж.-Б.-А. Дюма, Л. Гмелин, Э. Ленссен, Макс фон Петтенкофер и Дж. П. Кук расширили предложения Доберейнера между 1827 и 1858 годами, показав, что аналогичные отношения простираются дальше, чем триады элементов: фтор добавляется к галогенам, а магний — к щелочноземельным элементам. металлы, тогда как кислород, сера, селен и теллур были классифицированы как одно семейство, а азот, фосфор, мышьяк, сурьма и висмут — как другое семейство элементов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасПозднее были предприняты попытки показать, что атомные веса элементов могут быть выражены арифметической функцией, и в 1862 году А.-Э.-Б. де Шанкуртуа предложил классификацию элементов, основанную на новых значениях атомных весов, данных системой Станислао Канниццаро 1858 года. Де Шанкуртуа нанес атомные веса на поверхность цилиндра с окружностью 16 единиц, что соответствует приблизительному атомному весу кислород.Получившаяся спиральная кривая привела близко связанные элементы к соответствующим точкам выше или ниже друг друга на цилиндре, и, как следствие, он предположил, что «свойства элементов являются свойствами чисел», что является замечательным предсказанием в свете современных знаний.
Классификация элементов
В 1864 году J.A.R. Ньюлендс предложил классифицировать элементы в порядке возрастания атомного веса, при этом элементам присваиваются порядковые номера от единицы и выше и разделены на семь групп, обладающих свойствами, тесно связанными с первыми семью из известных на тот момент элементов: водород, литий, бериллий, бор, углерод. , азот и кислород.Это соотношение было названо законом октав по аналогии с семью интервалами музыкальной гаммы.
Затем в 1869 году, в результате обширной корреляции свойств и атомных весов элементов, уделяя особое внимание валентности (то есть количеству одинарных связей, которые может образовывать элемент), Менделеев предложил периодический закон: посредством которого «элементы, расположенные в соответствии с величиной атомного веса, демонстрируют периодическое изменение свойств». Лотар Мейер независимо пришел к аналогичному выводу, опубликованному после появления статьи Менделеева.
Менделеев расположил известные химические элементы в таблице по возрастанию атомный номер.
1.
Ответ ;Масса
Менделеев расположил известные химические элементы в таблице в соответствии с увеличением массы .
Пояснение ;- Менделеев расположил элементы в ряды в порядке увеличения массы так, чтобы элементы с одинаковыми свойствами находились в одном столбце.Он представил организационный принцип, который работал со всеми известными элементами.
- Тесное совпадение предсказаний Менделеева с реальными свойствами новых элементов показало, насколько полезной может быть его таблица Менделеева. Он также оставил места для неоткрытых элементов, чтобы разместить элементы с аналогичными свойствами в одном столбце.
- Периодическая таблица Менделеева была полезна, потому что позволяла ученым предсказывать свойства неизвестных элементов.
2.
Ответ;Атомная единица массы.
Одна двенадцатая массы атома углерода-12 используется для определения единицы атомной массы
Пояснение ;- Атомная единица массы (AMU) соответствует точно 1/12 массы атома углерода-12. В ядре атома углерода-12 шесть протонов и шесть нейтронов. Одна AMU — это среднее значение массы покоя протона и массы покоя нейтрона.
- Масса атома в атомных единицах массы приблизительно равна сумме количества протонов и нейтронов в ядре.
- Атомная единица массы выражает относительные массы различных изотопов элементов.
3.
Ответ ;Пять электронов
Член семейства бора имеет три валентных электрона, а член семейства азота имеет пять электронов .
Пояснение ;- Число валентных электронов — это число электронов на внешнем энергетическом уровне атома.
- Семейство азота включает неметаллы, металлоиды и металлы. Атомы этих элементов в семействе азота имеют 5 валентных электронов. Семейство включает элементы, фосфор, висмут, мышьяк и сурьму. Они образуют связи за счет обмена электронами.
4.
Ответ;Li2O
Пояснение;- Ионные соединения — это соединения, состоящие из ионов.Они образуются в результате переноса электронов от одного атома к другому. Один атом теряет электроны, в то время как другой атом приобретает электроны, что приводит к образованию отрицательно заряженного иона (аниона) и положительно заряженного иона (катиона), которые соединяются посредством ионной связи с образованием ионного соединения.
- Оксид лития является примером ионного соединения, образованного из атомов лития и кислорода. Литий имеет валентность, равную единице, а кислород — валентность, равную двум, поэтому химическая формула оксида лития будет Li2O.
5.
Ответ ;Из сильного притяжения между полярными молекулами воды
Вода имеет более высокую температуру кипения, чем ожидалось, из-за сильного притяжения между полярными молекулами.
Пояснение;- Вода имеет высокую температуру кипения из-за межмолекулярных сил притяжения, называемых водородными связями. Водородная связь — это форма диполь-дипольного взаимодействия, при которой частично положительная молекула притягивается к другой молекуле, которая частично отрицательна.
- Водородная связь, являющаяся мощной межмолекулярной силой, заставляет воду иметь высокую температуру кипения, поскольку для разрыва связи требуется больше энергии.
Периодическая таблица
В 19 веке были обнаружены многие ранее неизвестные элементы, и ученые отметили, что определенные наборы элементов имеют схожие химические свойства. Например, хлор, бром и йод реагируют с другими элементами (такими как натрий) с образованием подобных соединений.Точно так же литий, натрий и калий реагируют с другими элементами (такими как кислород) с образованием подобных соединений. Почему это так?
В 1864 году немецкий химик Юлиус Лотар Мейер организовал элементы по атомной массе и сгруппировал их по химическим свойствам. Позже в том же десятилетии русский химик Дмитрий Менделеев организовал все известные элементы по сходным свойствам. Он оставил пробелы в своей таблице для того, что считал неоткрытыми элементами, и сделал несколько смелых прогнозов относительно свойств этих неоткрытых элементов.Когда позже были обнаружены элементы, свойства которых полностью соответствовали предсказаниям Менделеева, его версия таблицы завоевала признание научного сообщества. Поскольку определенные свойства элементов повторяются на регулярной основе по всей таблице (то есть они периодические), она стала известна как периодическая таблица — таблица элементов, в которой элементы группируются по некоторым из их свойств.
один из краеугольных камней химии, потому что он организует все известные элементы на основе их химических свойств.Современная версия показана на рисунке 2.7 «Современная периодическая таблица». Большинство периодических таблиц предоставляют дополнительные данные (например, атомную массу) в поле, содержащем символ каждого элемента. Элементы перечислены в порядке их атомного номера.
Особенности периодической таблицы
Элементы, которые имеют аналогичные химические свойства, сгруппированы в столбцы, называемые группами (или семействами). Столбец элементов в периодической таблице. Некоторые из этих групп не только пронумерованы, но и имеют названия, например, щелочные металлы (первый столбец элементов), щелочноземельные металлы, (второй столбец элементов), галогены, (предпоследний столбец элементов) и благородные газы, (последний столбец элементов).
Примечание
Слово галоген происходит от греческого слова «производитель соли», потому что эти элементы объединяются с другими элементами, образуя группу соединений, называемых солями.
На ваше здоровье: радон
Радон — это невидимый благородный газ без запаха, который медленно выделяется из-под земли, особенно из горных пород и почв с высоким содержанием урана. Поскольку это благородный газ, радон химически неактивен.К сожалению, он радиоактивен, и повышенное его воздействие коррелирует с повышенным риском рака легких.
Поскольку радон исходит из земли, мы не можем полностью его избежать. Более того, поскольку он плотнее воздуха, радон имеет тенденцию накапливаться в подвалах, которые при неправильной вентиляции могут быть опасны для жителей здания. К счастью, специализированная вентиляция сводит к минимуму количество собираемого радона. Доступны специальные вентиляционные системы, которые забирают воздух из-под цокольного этажа, прежде чем он попадет в жилое пространство, и вентилируют его над крышей дома.
Считается, что радон является второй по значимости предотвратимой причиной рака легких в Соединенных Штатах после курения. По оценкам Американского онкологического общества, 10% всех случаев рака легких связаны с облучением радоном. Существует неуверенность в том, какие уровни воздействия вызывают рак, а также то, что может быть точным возбудителем (радон или один из продуктов его распада, многие из которых также радиоактивны и, в отличие от радона, не являются газами). Агентство по охране окружающей среды США рекомендует проверять каждый этаж ниже третьего этажа на уровень радона, чтобы предотвратить долгосрочные последствия для здоровья.
Каждая строка элементов в периодической таблице называется периодом. Строка элементов в периодической таблице. Периоды имеют разную длину; в первом периоде всего 2 элемента (водород и гелий), а во втором и третьем периодах по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов каждый, а более поздние периоды настолько длинные, что сегмент из каждого удаляется и помещается под основной частью таблицы.
Определенные свойства элементов становятся очевидными при обзоре таблицы Менделеева в целом.Каждый элемент можно классифицировать как металл, неметалл или полуметалл, как показано на Рисунке 2.8 «Типы элементов». Металл — это блестящий элемент серебристого цвета, отличный проводник тепла и электричества, податливый и пластичный. представляет собой блестящее вещество, обычно (но не всегда) серебристого цвета, которое отлично проводит электричество и тепло. Металлы бывают также пластичными (их можно раскалывать на тонкие листы) и пластичными (их можно вытягивать в тонкую проволоку). Неметалл — это элемент, который обычно тусклый, плохо проводит тепло и электричество и хрупок.обычно унылый и плохо проводит электричество и тепло. Твердые неметаллы также очень хрупкие. Как показано на рис. 2.8 «Типы элементов», металлы занимают три левых четверти таблицы Менделеева, а неметаллы (кроме водорода) сгруппированы в верхнем правом углу таблицы Менделеева. Элементы со свойствами, промежуточными между свойствами металлов и неметаллов, называются полуметаллами (или металлоидами). Элемент, свойства которого являются промежуточными между металлами и неметаллами.. Элементы, примыкающие к жирной линии в правой части таблицы Менделеева, обладают полуметаллическими свойствами.
Рисунок 2.8 Типы элементов
Элементы бывают металлы, неметаллы или полуметаллы. Каждая группа находится в разных частях периодической таблицы.
Другой способ категоризации элементов периодической таблицы показан на рисунке 2.9 «Специальные имена для частей периодической таблицы». Первые два столбца слева и последние шесть столбцов справа называются элементами основной группы — элементом первых двух или последних шести столбцов периодической таблицы.. Блок из десяти столбцов между этими столбцами содержит переходные металлы. Элемент между элементами основной группы периодической таблицы. Две строки под основной частью таблицы Менделеева содержат внутренние переходные металлы. Элемент в двух строках под основной частью таблицы Менделеева. периодическая таблица. Такие металлы также называют элементами лантаноидов и актинидов. Элементы в этих двух рядах также называются, соответственно, металлами-лантанидами и металлами-актинидами .
Рисунок 2.9 Специальные имена для разделов периодической таблицы
Некоторые разделы периодической таблицы имеют особые названия. Элементы литий, натрий, калий, рубидий, цезий и франций вместе известны как щелочные металлы.
Для вашего здоровья: переходные металлы в организме
Согласно Таблице 2.2 «Элементный состав человеческого тела», большая часть элементного состава человеческого тела состоит из основных групповых элементов.Первым элементом в списке, который не является элементом основной группы, является железо с массовой долей 0,006%. Поскольку железо имеет относительно массивные атомы, оно могло бы оказаться еще ниже в списке, организованном с точки зрения процента по атомам и , а не процента по массе.
Железо — переходный металл. Переходные металлы обладают интересными химическими свойствами, отчасти потому, что некоторые из их электронов находятся в подоболочках d . (Дополнительную информацию об электронных оболочках см. В разделе 2.6 «Устройство электронов».) Химический состав железа делает его ключевым компонентом правильного функционирования красных кровяных телец.
Красные кровяные тельца — это клетки, которые переносят кислород от легких к клеткам тела, а затем переносят углекислый газ от клеток к легким. Без красных кровяных телец дыхание животных, каким мы его знаем, не существовало бы. Важнейшей частью эритроцита является белок, называемый гемоглобином . Гемоглобин соединяется с кислородом и углекислым газом, транспортируя эти газы из одного места в другое в организме.Гемоглобин — это относительно большая молекула с массой около 65000 единиц.
Решающим атомом в белке гемоглобина является железо. Каждая молекула гемоглобина имеет четыре атома железа, которые действуют как центры связывания кислорода. Именно присутствие этого переходного металла в красных кровяных тельцах позволяет вам использовать вдыхаемый кислород.
Другие переходные металлы выполняют важные функции в организме, несмотря на их небольшие количества. Цинк необходим для правильного функционирования иммунной системы организма, а также для синтеза белка и роста тканей и клеток.Медь также необходима для правильного функционирования некоторых белков в организме. Марганец необходим организму для правильного метаболизма кислорода. Кобальт является необходимым компонентом витамина B-12, жизненно важного питательного вещества. (Для получения дополнительной информации о белках и витаминах см. Главу 18 «Аминокислоты, белки и ферменты».) Эти последние три металла не указаны явно в таблице 2.2 «Элементный состав человеческого тела», поэтому они присутствуют в организме. в очень небольших количествах. Однако даже эти небольшие количества необходимы для правильного функционирования организма.
Периодическая таблица составлена на основе сходства свойств элементов, но чем объясняется это сходство? Оказывается, форма периодической таблицы отражает заполнение подоболочек электронами, как показано на рисунке 2.10 «Форма периодической таблицы». Начиная с первого периода слева направо в таблице воспроизводится порядок заполнения электронных подоболочек в атомах. Кроме того, элементы в одном столбце имеют одинаковую электронную конфигурацию валентной оболочки.Например, все элементы в первом столбце имеют один электрон s в их валентных оболочках, поэтому их электронные конфигурации можно описать как ns 1 (где n представляет собой номер оболочки). Это последнее наблюдение очень важно. Химия в значительной степени является результатом взаимодействия валентных электронов разных атомов. Таким образом, атомы с одинаковой электронной конфигурацией валентной оболочки будут иметь схожий химический состав.
Рисунок 2.10 Форма периодической таблицы
Форма таблицы Менделеева отражает порядок, в котором электронные оболочки и подоболочки заполняются электронами.
Пример 9
Используя переменную n для обозначения номера валентной электронной оболочки, запишите электронную конфигурацию валентной оболочки для каждой группы.
- металлы щелочноземельные
- Колонна элементов, возглавляемая углеродом
Решение
- Щелочноземельные металлы находятся во втором столбце периодической таблицы.Этот столбец соответствует подоболочке s , заполненной 2 электронами. Следовательно, электронная конфигурация валентной оболочки равна нс 2 .
- Электронная конфигурация углерода 1 с 2 2 с 2 2 p 2 . Электронная конфигурация его валентной оболочки: 2 s 2 2 p 2 . Каждый элемент в одном столбце должен иметь аналогичную конфигурацию электронов валентной оболочки, которую мы можем представить как нс 2 нп 2 .
Упражнение по развитию навыков
столбик элементов во главе с кислородом
Используя переменную n для обозначения номера валентной электронной оболочки, запишите электронную конфигурацию валентной оболочки для каждой группы.
Атомный радиус
Периодическая таблица Менделеева полезна для понимания свойств атомов, которые показывают периодические тенденции.Одним из таких свойств является атомный радиус — приблизительный размер атома. (Рисунок 2.11 «Тенденции периодической таблицы»). Как упоминалось ранее, чем выше номер оболочки, тем дальше от ядра, вероятно, будут находиться электроны в этой оболочке. Другими словами, размер атома обычно определяется номером валентной электронной оболочки. Следовательно, по мере того, как мы спускаемся по столбцу в периодической таблице, атомный радиус увеличивается. Однако, когда мы проходим через период периодической таблицы, электроны добавляются к той же валентной оболочке ; тем временем к ядру добавляется больше протонов, поэтому положительный заряд ядра увеличивается.Увеличивающийся положительный заряд сильнее притягивает электроны, притягивая их ближе к ядру. Следовательно, по мере прохождения периода атомный радиус уменьшается. Эти тенденции четко видны на Рисунке 2.11 «Тенденции Периодической таблицы».
Рисунок 2.11 Тенденции в Периодической таблице
Относительные размеры атомов показывают несколько тенденций в отношении структуры периодической таблицы. Атомы становятся крупнее по столбцу и меньше по периоду.
Пример 10
Используя периодическую таблицу (а не рисунок 2.11 «Тенденции периодической таблицы»), какой атом больше?
- N или Bi
- мг или Cl
Решение
- Поскольку Bi находится ниже N в периодической таблице и имеет электроны в оболочках с более высокими номерами, мы ожидаем, что атомы Bi больше N атомов.
- И Mg, и Cl находятся в периоде 3 периодической таблицы, но Cl находится дальше вправо.Поэтому мы ожидаем, что атомы Mg будут больше, чем атомы Cl.
Карьера: клинический химик
Клиническая химия — это область химии, связанная с анализом биологических жидкостей для определения состояния здоровья человеческого тела. Клинические химики измеряют множество веществ, от простых элементов, таких как натрий и калий, до сложных молекул, таких как белки и ферменты, в крови, моче и других жидкостях организма.Отсутствие или присутствие, либо аномально низкие или высокие количества вещества могут быть признаком какого-либо заболевания или признаком здоровья. Многие химики-клиницисты используют в своей работе сложное оборудование и сложные химические реакции, поэтому им необходимо не только понимать основы химии, но и знать специальные приборы и способы интерпретации результатов испытаний.
Упражнения по обзору концепции
Как элементы организованы в периодическую таблицу?
Если посмотреть на таблицу Менделеева, где появляются следующие элементы?
- металлы
- неметаллы
- галогены
- переходные металлы
Опишите тенденции изменения атомных радиусов в зависимости от положения элемента в периодической таблице.
ответов
Элементы организованы по атомным номерам.
- левые три четверти таблицы Менделеева
- правая четверть таблицы Менделеева
- предпоследний столбец таблицы Менделеева
- средняя часть таблицы Менделеева
По мере того, как вы пересекаете периодическую таблицу, атомные радиусы уменьшаются; по мере того как вы спускаетесь по таблице Менделеева, атомные радиусы увеличиваются.
Основные выводы
- Химические элементы расположены в таблице, называемой периодической таблицей.
- Некоторые характеристики элементов связаны с их положением в таблице Менделеева.
Упражнения
Какие элементы имеют химические свойства, аналогичные свойствам магния?
- натрий
- фтор
- кальций
- барий
- селен
Какие элементы имеют химические свойства, аналогичные свойствам лития?
- натрий
- кальций
- бериллий
- барий
- калий
Какие элементы имеют химические свойства, аналогичные свойствам хлора?
- натрий
- фтор
- кальций
- йод
- сера
Какие элементы имеют химические свойства, аналогичные свойствам углерода?
- кремний
- кислород
- германий
- барий
- аргон
Какие элементы являются щелочными металлами?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы относятся к щелочноземельным металлам?
- натрий
- магний
- алюминий
- калий
- кальций
Какие элементы являются галогенами?
- кислород
- фтор
- хлор
- сера
- углерод
Какие элементы являются благородными газами?
- гелий
- водород
- кислород
- неон
- хлор
Какие пары элементов находятся в одном периоде?
- H и Li
- H и He
- Na и S
- Na и руб.
Какие пары элементов находятся в одном периоде?
- В и Nb
- К и Br
- Na и P
- Li и Mg
Какой атом имеет больший атомный радиус в каждой паре атомов?
- H и Li
- N и P
- Cl и Ar
- Al и Cl
Какой атом имеет больший атомный радиус в каждой паре атомов?
- H и He
- N и F
- Cl и Br
- Al и B
Скандий (металл, неметалл, полуметалл) и входит в (элементы основной группы, переходные металлы).





Leave A Comment