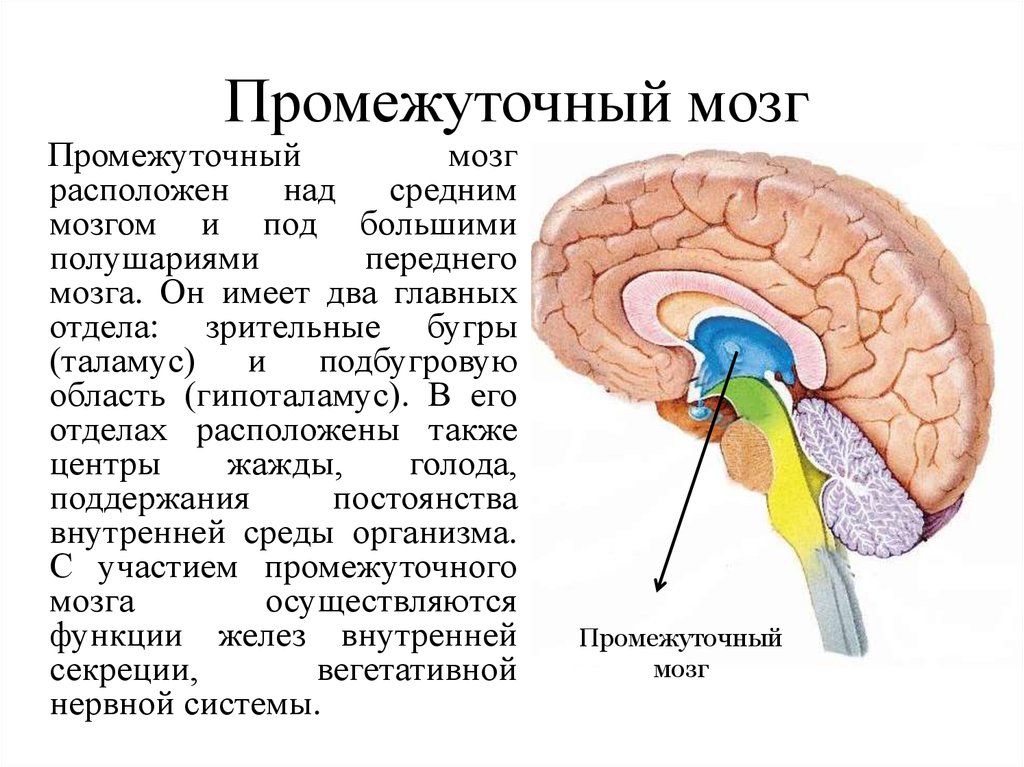
Роль гипоталамуса в терморегуляции организма
Что такое гипоталамус и какова его роль в организме человека?
Гипоталамус – это небольшая область в промежуточном мозге, он расположен в основании переднего мозга непосредственно под таламусом и над гипофизом. Его вес составляет примерно 5 грамм. Гипоталамус не имеет чётких границ, его можно рассматривать как часть сети нейронов, протягивающейся от среднего мозга через гипоталамус к глубинным отделам переднего мозга. Обширные анатомо-функциональные связи гипоталамуса обеспечивают широкий диапазон его деятельности.
Гипоталамус – это главный координирующий и регулирующий центр вегетативной нервной системы человека. Гипоталамус связан нервными путями практически со всеми отделами центральной нервной системы, включая кору, гиппокамп, миндалину, мозжечок, ствол мозга и спинной мозг. К нему подходят волокна сенсорных нейронов от всех висцеральных, вкусовых и обонятельных рецепторов. Отсюда через продолговатый и спинной мозг происходит регуляция сердечного ритма, кровяного давления, дыхания и перистальтики. В других участках гипоталамуса лежат специальные центры, от которых зависят голод, жажда, сон, бодрствование, а также поведенческие реакции, связанные с агрессивностью, размножением и др. Гипоталамус контролирует концентрацию метаболитов и температуру крови, вместе с гипофизом регулирует секрецию большинства гормонов и поддерживает постоянство состава крови и тканей.
В других участках гипоталамуса лежат специальные центры, от которых зависят голод, жажда, сон, бодрствование, а также поведенческие реакции, связанные с агрессивностью, размножением и др. Гипоталамус контролирует концентрацию метаболитов и температуру крови, вместе с гипофизом регулирует секрецию большинства гормонов и поддерживает постоянство состава крови и тканей.
Гипоталамус включает в себя большое число групп клеток (свыше 30 ядер), которые регулируют нейроэндокринную деятельность мозга и гомеостаз организма (способность сохранять постоянство своего внутреннего состояния). Роль гипоталамуса особенно ярко проявляется в условиях каких-либо чрезвычайных, так называемых стрессовых, воздействий на организм, в том числе травм, сильных эмоций, низкой и высокой температуры внешней среды, инфекций. Так, например, под воздействием гипоталамуса в передней доле гипофиза выделяется адренокортикотропный гормон (АКТГ), а он, в свою очередь, стимулирует секрецию гормонов коры надпочечников, имеющих адаптивное (приспособительное) значение в стрессовой ситуации.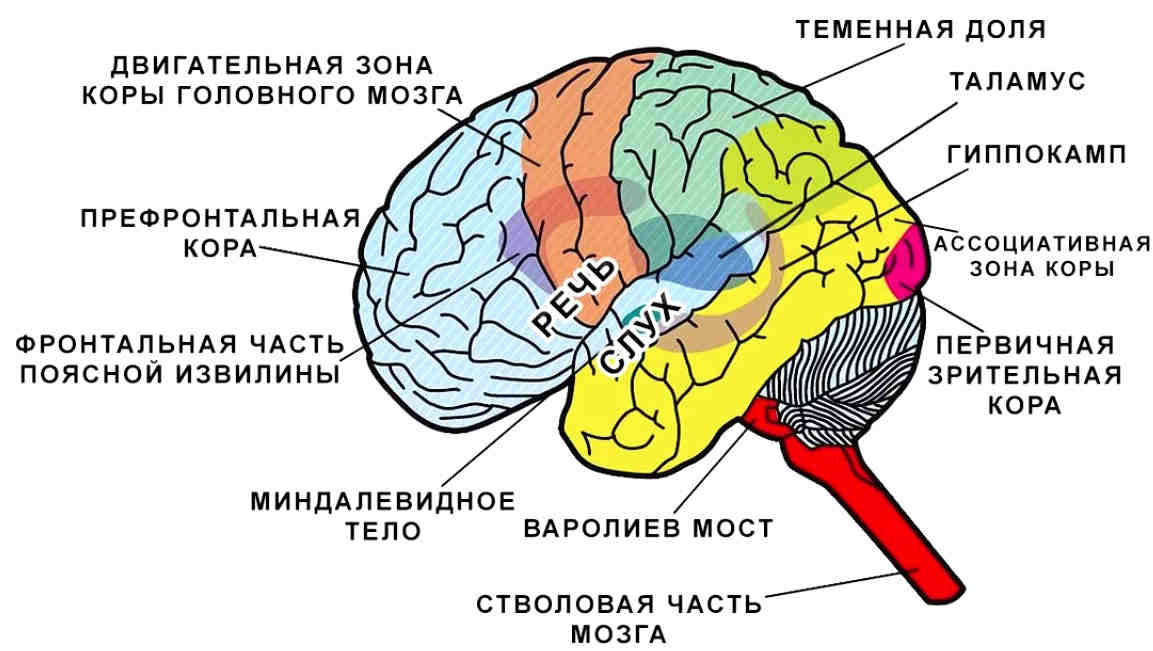
Гипоталамус обеспечивает постоянство внутренней среды человека (гомеостаз), помогает организму регулировать температуру и отвечает за контроль потоотделения. Например, в случае резкого изменения температуры воздуха вступают в действие адаптационные механизмы, направленные на поддержание постоянной температуры тела, а «запускаются» они, в основном, гипоталамусом, имеющим специальные термочувствительные аппараты.
При высокой температуре окружающей среды под контролем гипоталамуса периферические кожные сосуды расширяются, усиливается потоотделение и понижается метаболический обмен веществ в организме. За счёт этого возрастает теплоотдача.
При низкой температуре для уменьшения теплоотдачи периферические кожные сосуды, наоборот, суживаются, учащается ритм сердца, возникает дрожь мышц – асинхронные мышечные сокращения, увеличивающие теплопродукцию, повышается обмен веществ, что усиливает метаболические процессы теплообразования.
Иными словами, гипоталамус действует как весьма эффективный термостат.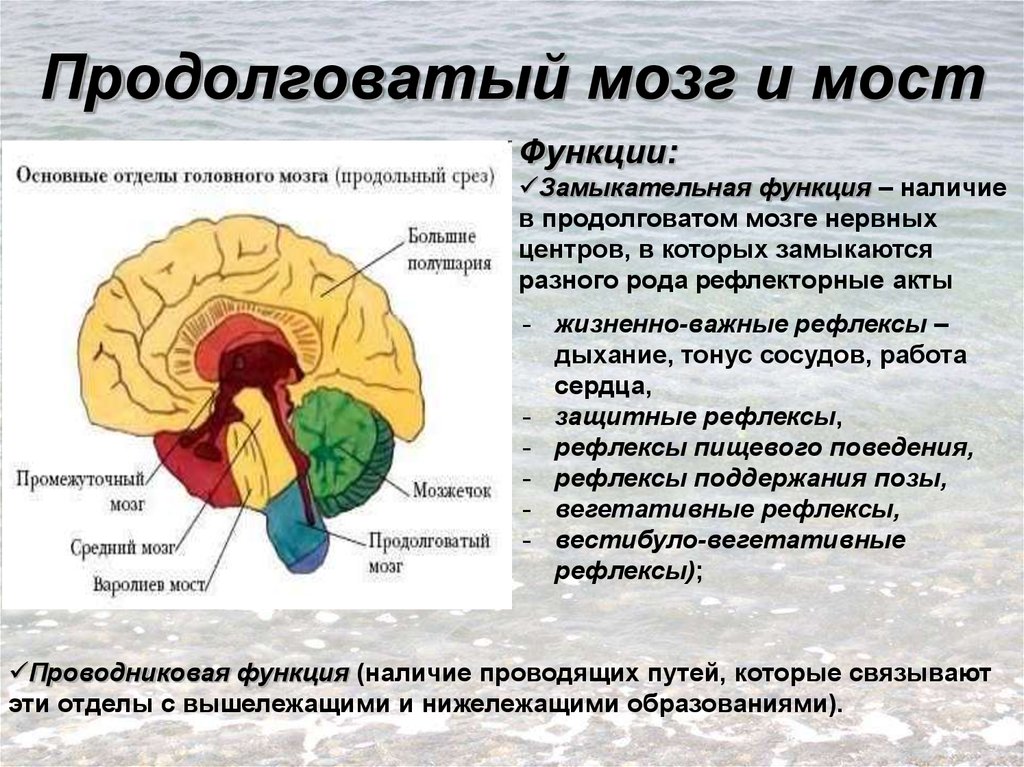 Естественно, при изменении температуры окружающей среды мы отчётливо осознаем это, потому что нам становится либо холодно, либо жарко, и мы начинаем бороться с этим, например, меняя одежду, включая обогреватель, газовый котёл или кондиционер. Приблизительно так же работает и гипоталамус, но он делает это более тонко с помощью встроенных в организм механизмов.
Естественно, при изменении температуры окружающей среды мы отчётливо осознаем это, потому что нам становится либо холодно, либо жарко, и мы начинаем бороться с этим, например, меняя одежду, включая обогреватель, газовый котёл или кондиционер. Приблизительно так же работает и гипоталамус, но он делает это более тонко с помощью встроенных в организм механизмов.
Разрушение центров гипоталамуса или нарушение нервных связей ведёт к утрате способности регулировать температуру тела. Некоторые травмы и опухоли мозга могут нарушить нормальное функционирование гипоталамуса, спровоцировав обильное потоотделение.
Гипоталамус – регулятор терморегуляции тела.
Роль гипоталамуса в приспособлении организма к постоянству
своего внутреннего состояния (гомеостазу).
Терморегуляция – это совокупность физиологических процессов, направленных на поддержание относительного постоянства температуры ядра (внутренняя часть) организма в условиях изменения температуры внешней среды с помощью регуляции теплопродукции и теплоотдачи. Терморегуляция направлена на предупреждение нарушений теплового баланса организма или на его восстановление, если подобные нарушения уже произошли, и осуществляется нервно-гуморальным путём.
Терморегуляция направлена на предупреждение нарушений теплового баланса организма или на его восстановление, если подобные нарушения уже произошли, и осуществляется нервно-гуморальным путём.
Система терморегуляции организма человека состоит из ряда элементов с взаимосвязанными функциями. Информация о температуре поступает от терморецепторов и при помощи нервной системы попадает в мозг. Температура разных участков ядра человека (внутренние органы) различна. Например, в печени: 37.8-38.0°С, в мозге: 36.9-37.8°С. В целом же температура ядра тела человека составляет 37.0°С. Это достигается с помощью процессов эндогенной терморегуляции, результатом которой является устойчивое равновесие между количеством продуцируемого в организме в единицу времени тепла (теплопродукцией) и количеством тепла, рассеиваемого организмом за то же время в окружающую среду (теплоотдачей).
Основную роль в механизме терморегуляции играет именно гипоталамус. В нём расположены основные центры терморегуляции, которые координируют многочисленные и сложные процессы, обеспечивающие сохранение температуры тела на постоянном уровне.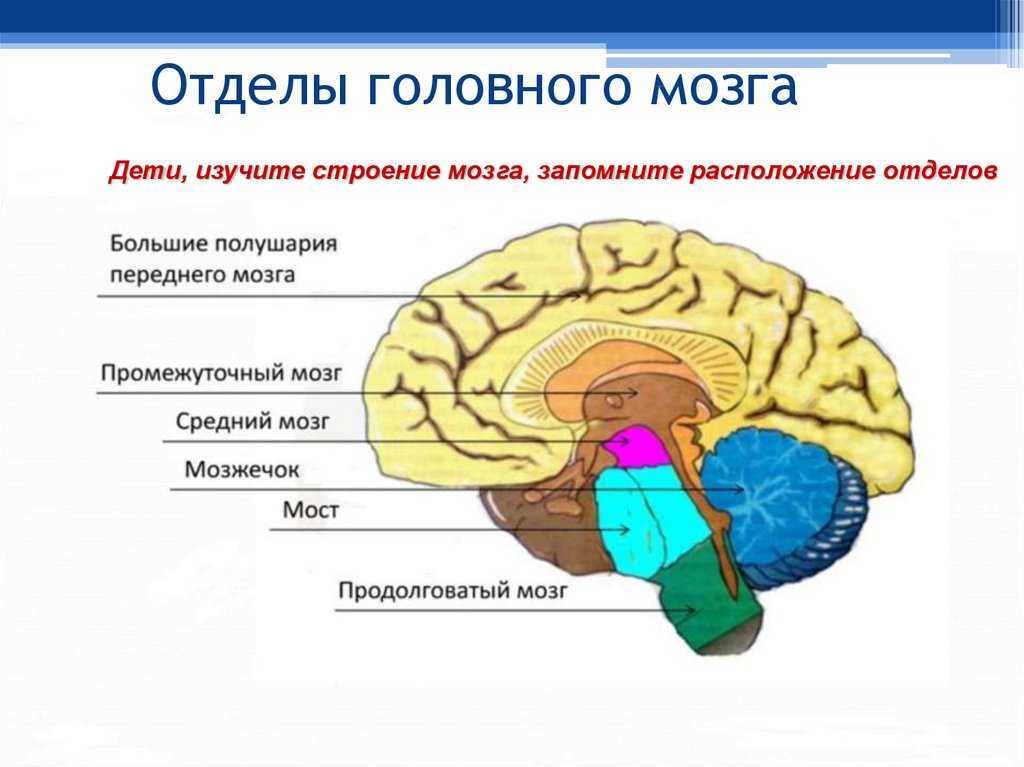
В переднем гипоталамусе расположены нейроны, управляющие процессами теплоотдачи (они обеспечивают физическую терморегуляцию – сужение сосудов, потоотделение). При разрушении нейронов переднего гипоталамуса организм плохо переносит высокие температуры, но физиологическая активность в условиях холода сохраняется.
Нейроны заднего гипоталамуса управляют процессами теплообразования (они обеспечивают химическую терморегуляцию – усиление теплообразования, мышечную дрожь). При их повреждении нарушается способность к усилению энергообмена, поэтому организм плохо переносит холод.
Термочувствительные нервные клетки преоптической области гипоталамуса непосредственно «измеряют» температуру артериальной крови, протекающей через мозг, и обладают высокой чувствительностью к температурным изменениям (способны различать разницу температуры крови в 0,011°С). Отношение холодо- и теплочувствительных нейронов в гипоталамусе составляет 1:6, поэтому центральные терморецепторы преимущественно активируются при повышении температуры «ядра» тела человека.
На основе анализа информации о значении температуры крови и периферических тканей, в преоптической области гипоталамуса непрерывно определяется среднее значение температуры тела. Эти данные передаются через вставочные нейроны в группу нейронов переднего отдела гипоталамуса, задающих в организме определённый уровень температуры тела – «установочную точку» терморегуляции. На основе анализа и сравнений значений средней температуры тела и заданной величины температуры, подлежащей регулированию, механизмы «установочной точки» через эффекторные нейроны заднего гипоталамуса воздействуют на процессы теплоотдачи или теплопродукции, чтобы привести в соответствие фактическую и заданную температуру.
Информацию о внешней температуре поставляют терморецепторы кожи. Внутреннюю температуру тела отслеживают центральные терморецептивные нейроны переднего гипоталамуса, реагирующие на температуру крови. Это сервомеханизм (система, управляющая другой системой с помощью отрицательной обратной связи), для которого заданным значением (контрольной точкой) служит нормальная температура тела.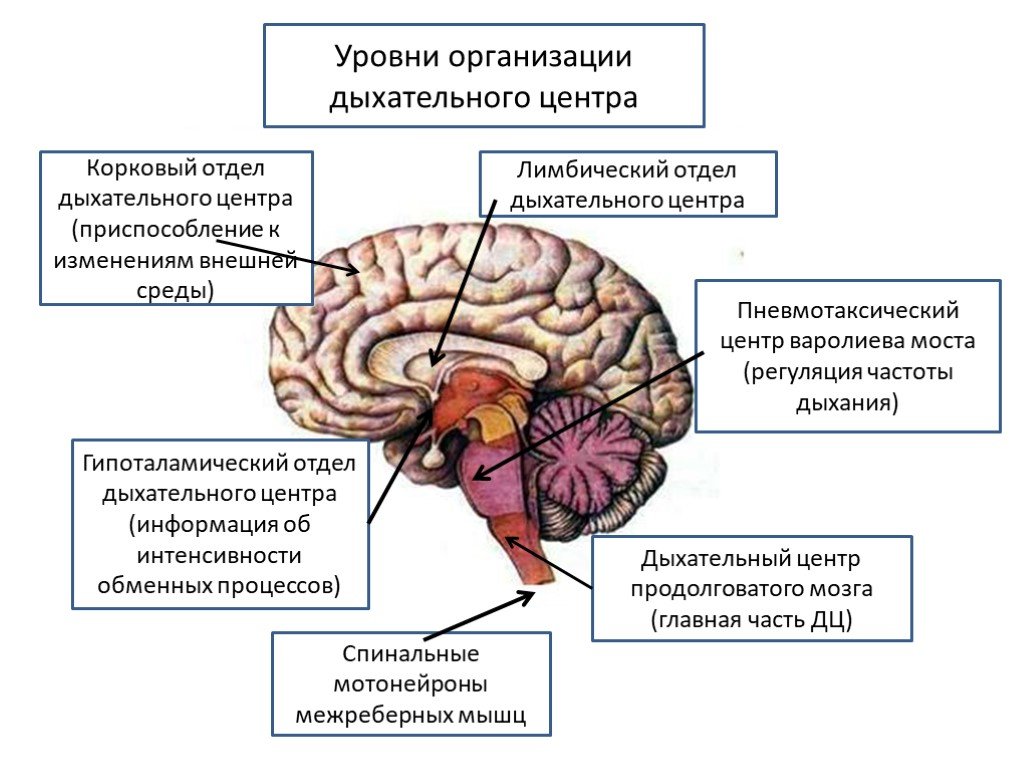 В ответ на сигналы ошибки (рассогласования) возникают реакции, направленные на возвращение температуры тела к контрольной точке.
В ответ на сигналы ошибки (рассогласования) возникают реакции, направленные на возвращение температуры тела к контрольной точке.
Таким образом, за счёт автономной функции центра терморегуляции – гипоталамуса, в организме человека устанавливается постоянное равновесие между теплопродукцией и теплоотдачей, позволяющее поддерживать температуру тела в оптимальных для жизнедеятельности организма пределах.
Гипоталамус и эндокринная система.
Как гипоталамус управляет терморегуляцией с помощью гормонального механизма.
Вместе с гипофизом гипоталамус образует гипоталамо-гипофизарную систему, в которой гипоталамус управляет выделением гормонов гипофиза и является центральным связующим звеном между нервной и эндокринной системой.
Гипоталамус управляет процессами теплопродукции и теплоотдачи, посылая нервные импульсы к железам внутренней секреции, главным образом щитовидной, и надпочечникам.
Участие щитовидной железы в терморегуляции обусловлено тем, что влияние пониженной температуры приводит к усиленному выделению её гормонов (тироксин, трийодтиронин), ускоряющих обмен веществ и, следовательно, теплообразование.
Роль надпочечников связана с выделением ими в кровь катехоламинов (адреналин, норадреналин, дофамин), которые, усиливая или уменьшая окислительные процессы в тканях (например, мышечной), увеличивают или уменьшают теплопродукцию и сужают или увеличивают кожные сосуды, меняя уровень теплоотдачи.
Гормональный дисбаланс и повышенное потоотделение.
Как в этом случае работает гипоталамус?
Гормональный дисбаланс – это одна из причин повышенного потоотделения. Подростковые гормональные бури, беременность, климактерический период, заболевания гормональной сферы – всё это приводит к гипергидрозу. Гормональный дисбаланс есть не что иное, как нарушение работы эндокринной системы, сбои которой не менее опасны, чем, к примеру, нарушение работы сердечно-сосудистой или пищеварительной системы, потому что могут привести к таким серьёзным последствиям как развитие сахарного диабета, ухудшение зрения и др.
Эндокринная система – очень сложная и важная часть человеческого организма, в её состав входит гипоталамус, который влияет на функционирование гипофиза (это главная железа в эндокринной системе), а тот, в свою очередь, на все остальные железы внутренней секреции, продуцирующие гормоны (яичники, надпочечники, щитовидная и поджелудочная железа др.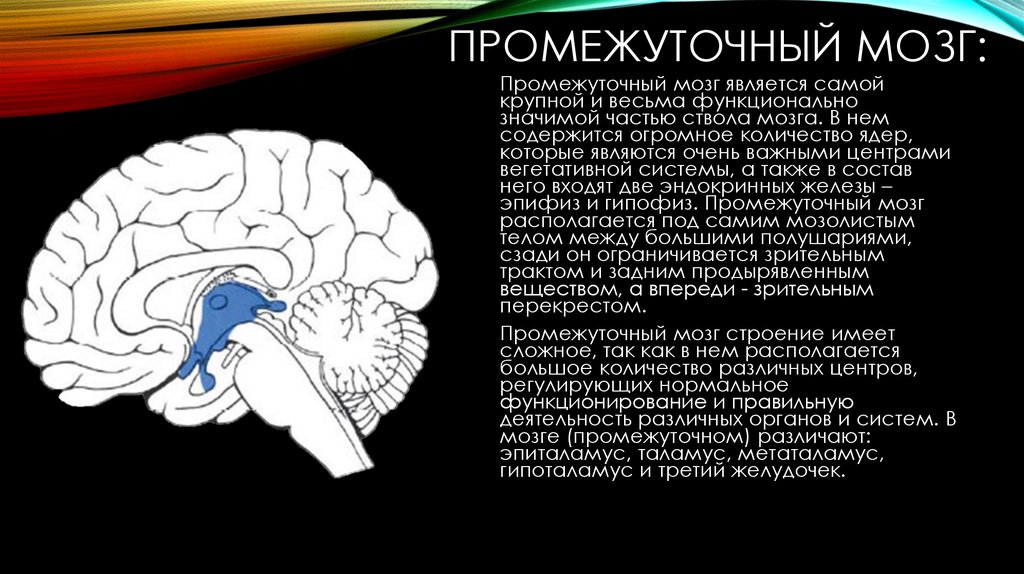 ). Гормональный дисбаланс проявляется нарушением выработки гормонов, их пониженной, или, напротив, повышенной секрецией.
). Гормональный дисбаланс проявляется нарушением выработки гормонов, их пониженной, или, напротив, повышенной секрецией.
Гормональный дисбаланс у женщин. Эстроген и прогестерон являются женскими гормонами. Они управляют процессами в организме женщины. Гормональный дисбаланс возникает, когда соотношение этих двух гормонов отклоняется от своего нормального уровня. Чаще всего повышается уровень эстрогена. Гормональные бури в женском организме наблюдаются в период полового созревания, после аборта, в период беременности, при грудном вскармливании, при наступлении менопаузы.
Причина потливости у женщин во время беременности очевидна – это всё те же гормоны. Пониженный уровень эстрогена влияет на нарушение работы гипоталамуса, который отвечает за регуляцию температурного режима нашего организма. Если на улице жарко, то благодаря потоотделению он охлаждает наше тело. Изменение уровня эстрогена воспринимается гипоталамусом ошибочно – организм начнет вырабатывать больше тепла, а освобождается от него путём потовыделения, что и становится причиной гипергидроза у беременных.
Причина приливов жара у женщин при климаксе. Основной причиной возникновения приливов при климаксе является естественное изменение гормонального фона женщины, главным образом, сниженная продукция эстрогенов, которые оказывают прямое воздействие на центр терморегуляции, расположенный в гипоталамусе. При дефиците эстрогенов гипоталамус получает ложные сигналы о том, что организм перегревается, вследствие чего подключаются механизмы сброса лишнего тепла – учащенное сердцебиение, расширение периферических сосудов (воспринимающееся как прилив жара) и выделение пота. Данный механизм высвобождения тепла помогает защитить организм от перегрева в жару, например, летом, но в данном случае он вызван именно снижением уровня эстрогенов в крови. Самое неприятное это то, что приливы жара могут возникнуть в самые неожиданные моменты – во время работы, встречи с друзьями и коллегами или в середине ночи.
Влияние функций гипоталамуса на наше здоровье
Гипоталамус — это маленький участок, расположенный в центре нашего головного мозга. Он отвечает за функционирование огромного числа систем процесса жизнедеятельности человека. Далее мы рассмотрим подробнее функции и структуру гипоталамуса и обсудим причины нарушений в его работе?
Он отвечает за функционирование огромного числа систем процесса жизнедеятельности человека. Далее мы рассмотрим подробнее функции и структуру гипоталамуса и обсудим причины нарушений в его работе?
Вес гипоталамуса человека всего 3-5 грамм, к слову, это невероятно маленькая частичка от массы мозга, ведь он может весить до двух килограмм. Гипоталамус тесно связывается нервными волокнами со всеми мозговыми отделами и железой, которая отвечает за рост, размножение и выживание.
Гипоталамус — часть лимбической системы, в паре с таламусом эти органы образуют промежуточный мозг. Состоит гипоталамус из отдельных ядер, соединенных с разными участками нашего мозга. Имеет гипоталамус передний, средний и задний отдел. Расположенные в гипоталамусе нейронные связи полностью контролируют функциональность человеческого организма. Этой крошечной части мозга приходится постоянно обрабатывать большой объем информации, которая поступает со всех отделов нашего организма.
О функциях гипоталамуса
Главная функция гипоталамуса — управление вегетативной нервной системой, состоящей из значительного числа нервных волокон и рецепторами, которые подают сигналы от головного мозга к остальным органам. Далее афферентные волокна посылают информацию в мозг от всех систем о происходящем в окружающей среде.
Далее афферентные волокна посылают информацию в мозг от всех систем о происходящем в окружающей среде.
Поступающая в гипоталамус информация, проходит тщательный анализ, после чего, в случае необходимости, подается сигнал для устранения проблемы. К примеру, когда нам очень жарко, в головном мозге запускается информация о возможном перегреве и в ответ человеческий организм приступает к выработке пота. Таким образом тело начинает слегка остывать, для поддержания оптимальной температуры.
Вегетативная нервная система подразделяют на: симпатическую, парасимпатическую. Симпатическая воздействует на активацию органов, парасимпатическая-антипод, она тормозит работу наших органов. Так вот, именно гипоталамус управляет функцией поддержания баланса в организме всех процессов, что и позволяет человеку выживать в сложных условиях.
Кроме этого, гипоталамус осуществляет регулировку работы эндокринной системы, а также способствует выработке гормонов. И поэтому с нарушениями в работе гипоталамуса часто сталкивается врач-эндокринолог.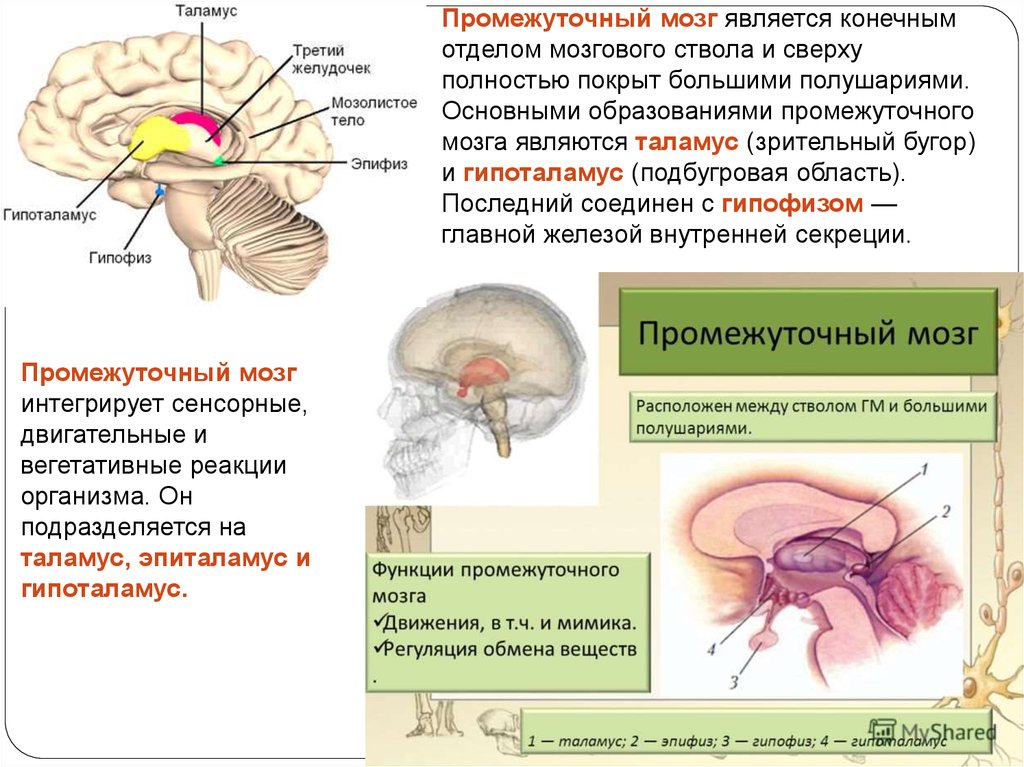
Многообразие функций гипоталамуса:
- контроль режимов сна и бодрствования;
- регулировка теплообмена, поддержание нормальной работы организма;
- контроль работы репродуктивной системы;
- отвечает за удовольствие;
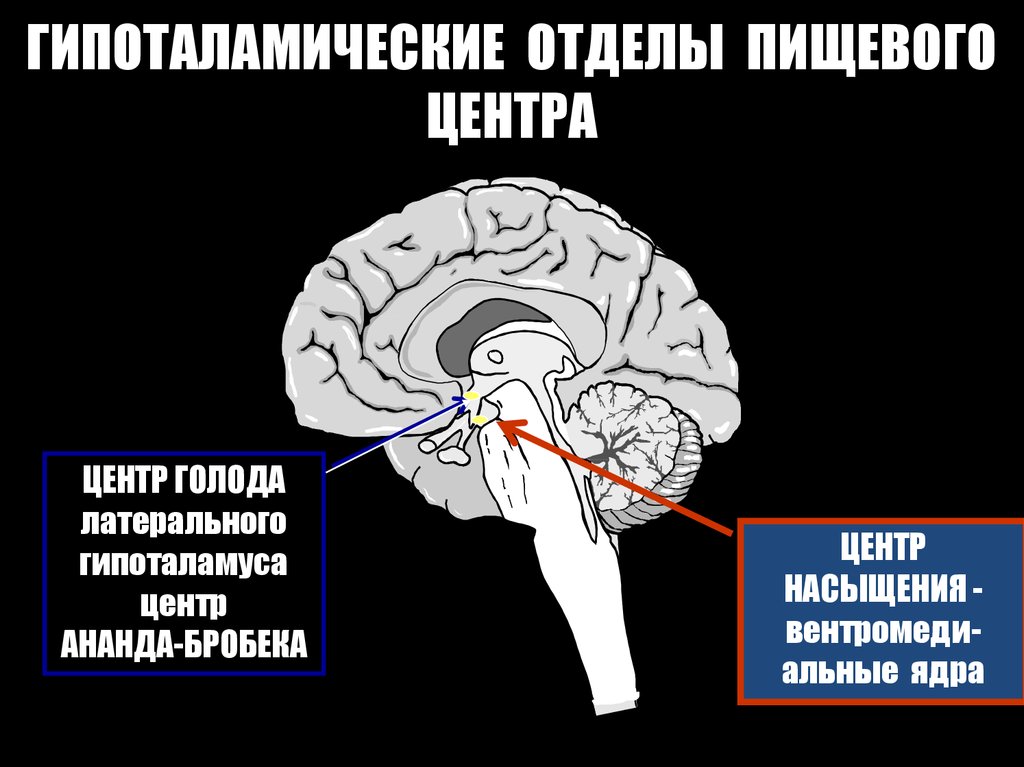
- контроль чувство жажды и голода;
- управление эмоциями.
Последствия нарушений в работе
Любое из нарушений в работе головного мозга относят к тяжелым, ведь последствия могут оказаться весьма неприятными. К чему может привести нарушения в работе гипоталамуса? В зависимости от сферы поражения ядер возможно проявление следующих симптомов:
- нарушение в работе внутренних органов;
- сложности с терморегуляцией, а именно, скачки температуры и усиленное потоотделение;
- нарушения в пищевом поведении, к примеру, человек может отказываться от еды либо употреблять ее без остановки;
- психозы и неврозы;
- сексуальные расстройства;
- сложности с репродуктивной системой;
- удушье, тяжелое дыхание;
- мышечная слабость.

Кроме этого, можно столкнуться с проблемами в работе желез внутренней секреции. А когда организм атакуют гормональные нарушения, чревато это развитием серьезных заболеваний, к примеру, сахарного диабета.
По мнению медиков, если вовремя обнаружить проблемы с гипоталамусом, то возможно избежать непоправимых последствий.
Рекомендуем также ознакомиться с советами эндокринологов для сохранения здоровья.
Отделение жажды от голода — нейробиология гомеостаза жидкостей организма
Джина Л. С. Йостен и Уиллис К. Самсон.
6.1. ВВЕДЕНИЕ
Классические стимулы жажды могут быть изменены другими текущими физиологическими состояниями. Кроме того, хотя прием пищи и питье воды традиционно рассматриваются как одновременные действия, стимулы для приема пищи могут быть отделены от питья воды и наоборот. В этой главе мы рассматриваем два вопроса: независимость двух видов поведения и влияние стимулов, не связанных с жаждой, на поведение при питье воды.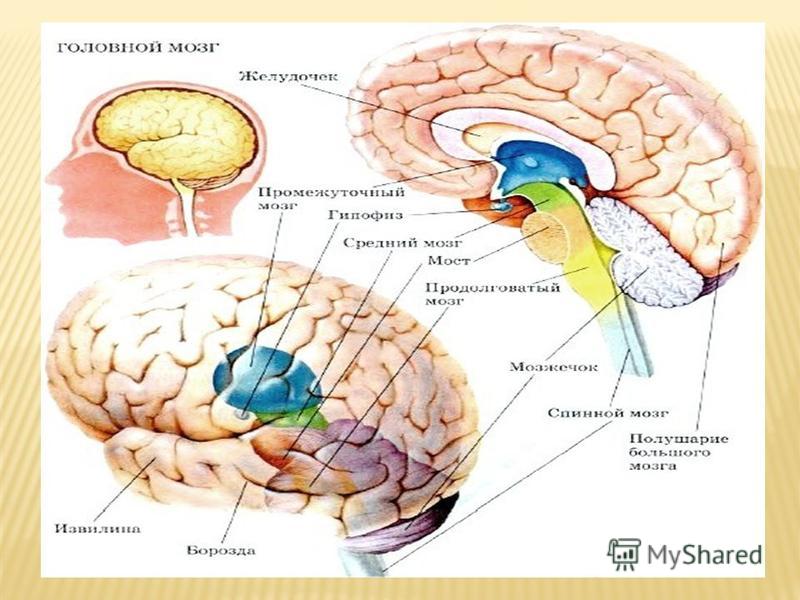
Все ли стимулы для приема пищи вызывают сопутствующее питье воды? Хотя анализ моделей потребления пищи и воды ad libitum окончательно продемонстрировал координацию этих двух видов поведения (de Castro 1988; Fitzsimons and LeMagnen 1969; Kissileff 1969), ясно, что питье воды может происходить в физиологических условиях в отсутствие пищи. потребление пищи (Zorilla et al. 2005), и даже в условиях ограничения воды происходит некоторое потребление пищи (Fitzsimons and LeMagnen 19).69; Зорилла и др. 2005). Однако более физиологичным подходом к согласованию двух моделей поведения является изучение интервалов питья воды в течение 24 часов, периодов ad libitum , и в этих условиях значительное количество воды потребляется независимо от приема пищи (Zorilla et al. др. 2005). Это может показаться очевидным, если принять во внимание важность осмотических и волемических стимулов для питья; однако, когда кто-то рассматривает питье воды в присутствии приема пищи, определенная необходимость совпадающего поведения перевешивает их независимость. Это в немалой степени связано со смазывающей функцией жидкости, принимаемой с твердой пищей, и результирующими осмотическими стимулами после всасывания растворенных веществ в желудке и кишечнике. Но все ли стимулы для приема пищи также стимулируют употребление алкоголя? Данные лаборатории Дэниэлса (Mietlicki et al., 2009).) дает четкий отрицательный ответ.
Это в немалой степени связано со смазывающей функцией жидкости, принимаемой с твердой пищей, и результирующими осмотическими стимулами после всасывания растворенных веществ в желудке и кишечнике. Но все ли стимулы для приема пищи также стимулируют употребление алкоголя? Данные лаборатории Дэниэлса (Mietlicki et al., 2009).) дает четкий отрицательный ответ.
6.2. ПИТЬЕ, ОТДЕЛЕННОЕ ОТ КОРМЛЕНИЯ
Одним из самых мощных стимулов для приема пищи является грелин, действующий в гипоталамических центрах, чтобы стимулировать потребление пищи (Wren et al. 2000). Однако при изучении в условиях, более подходящих для изучения питьевого поведения, таких как фармакологические (ангиотензин II) или физиологические (гиперосмолярные) нагрузки, наблюдается прямо противоположное. В самом деле, введение грелина, стимулируя прием пищи, ингибирует вызванное ангиотензином II употребление алкоголя, а также употребление алкоголя в ответ на гиперосмолярную нагрузку (Mietlicki et al. 2009).). Точно так же, когда основное внимание уделяется потреблению алкоголя, прием пищи может быть диссоциирован. Действительно, дипсогенные дозы ангиотензина II ингибируют, а не стимулируют прием пищи (Porter and Potratz, 2004).
Действительно, дипсогенные дозы ангиотензина II ингибируют, а не стимулируют прием пищи (Porter and Potratz, 2004).
6.3. КОРМЛЕНИЕ КАК ПОСЛЕДСТВИЕ ПИТЬЯ
Может ли снижение потребления алкоголя быть причиной снижения потребления пищи? Мы так считаем. Первоначально обестатин был идентифицирован как посттрансляционный продукт препрохромона грелина (Zhang et al. 2005). Он был назван на основании его очевидной способности ингибировать кормление, действие, которое почти сразу же было оспорено другими исследователями (Seone et al. 2006). В наших руках центральное введение обестатина действительно снижало потребление пищи до незначительной, но не существенной степени; однако более впечатляющим был эффект подавления питья воды у тех же животных в течение 24 часов после центрального введения до наступления темновой фазы (Samson et al. 2006). Это ингибирование потребления воды, но не пищи, приводило к значительной потере массы тела в течение 24-часового периода. Тот факт, что ни прием пищи, ни локомоторное поведение в открытом поле не изменились при этих же дозах обестатина, позволили нам предположить, что действие пептида было селективным в отношении жажды.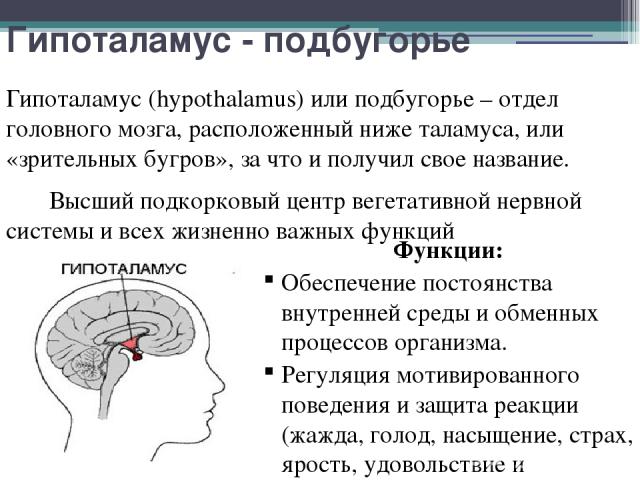 Чтобы проверить эту возможность более непосредственно, мы изучили действие обестатина на фармакологически вызванную жажду и наблюдали значительный ингибирующий эффект обестатина на питье воды, вызванное ангиотензином II (Samson et al. 2006). Употребление воды в ответ на гиповолемическую провокацию также ингибировалось интрацеребровентикулярным (icv) введением обестатина (Samson et al. 2008a). Наконец, мы идентифицировали субфорникальный орган как потенциальное место действия обестатина (Samson et al. 2006), снова предполагая уникальное действие пептида на механизмы жажды, независимое от какого-либо значительного воздействия на прием пищи.
Чтобы проверить эту возможность более непосредственно, мы изучили действие обестатина на фармакологически вызванную жажду и наблюдали значительный ингибирующий эффект обестатина на питье воды, вызванное ангиотензином II (Samson et al. 2006). Употребление воды в ответ на гиповолемическую провокацию также ингибировалось интрацеребровентикулярным (icv) введением обестатина (Samson et al. 2008a). Наконец, мы идентифицировали субфорникальный орган как потенциальное место действия обестатина (Samson et al. 2006), снова предполагая уникальное действие пептида на механизмы жажды, независимое от какого-либо значительного воздействия на прием пищи.
Является ли избирательное действие обестатина на жажду физиологически значимым? Поскольку обестатин образуется из того же препрогормона, что и грелин, нокаут гена (удаление эмбрионального гена) или компрометация трансляции (антисмысловые олигонуклеотиды, малая интерферирующая РНК, рибозимы) могут отменить продукцию обоих пептидов. Как тогда вы интерпретируете полученный поведенческий фенотип? Будет ли это вызвано исключительно потерей обестатина или потерей грелина, или даже потерей того и другого? Кроме того, не существует консенсуса относительно идентичности рецептора обестатина (Lauwers et al. 2006; Moechars et al. 2006), и не было разработано селективного антагониста рецептора обестатина. Поэтому мы обратились к пассивной иммунонейтрализации как подходу к изучению вопроса о физиологической значимости. Действительно, предварительная обработка селективной антисывороткой к обестатину привела к очень значительному увеличению потребления воды в 9 группах.0009 ad libitum кормили и поили крыс (Samson et al. 2008a). Потребление пищи также было повышено у животных, получавших антисыворотку, хотя это увеличение не достигло статистической значимости. Эти результаты вместе с нашим наблюдением прямого действия пептида на нейроны субфорникальных органов указывают на физиологически значимое действие обестатина на водно-электролитный гомеостаз. Это стало еще более очевидным, когда мы продемонстрировали, что в дополнение к ингибированию потребления воды обестатин, введенный внутривенно, ингибировал секрецию вазопрессина, но не окситоцина, секрецию вазопрессина у животных с ограничением воды в течение ночи и секрецию вазопрессина в ответ на центральное введение ангиотензина II (Samson et al.
2006; Moechars et al. 2006), и не было разработано селективного антагониста рецептора обестатина. Поэтому мы обратились к пассивной иммунонейтрализации как подходу к изучению вопроса о физиологической значимости. Действительно, предварительная обработка селективной антисывороткой к обестатину привела к очень значительному увеличению потребления воды в 9 группах.0009 ad libitum кормили и поили крыс (Samson et al. 2008a). Потребление пищи также было повышено у животных, получавших антисыворотку, хотя это увеличение не достигло статистической значимости. Эти результаты вместе с нашим наблюдением прямого действия пептида на нейроны субфорникальных органов указывают на физиологически значимое действие обестатина на водно-электролитный гомеостаз. Это стало еще более очевидным, когда мы продемонстрировали, что в дополнение к ингибированию потребления воды обестатин, введенный внутривенно, ингибировал секрецию вазопрессина, но не окситоцина, секрецию вазопрессина у животных с ограничением воды в течение ночи и секрецию вазопрессина в ответ на центральное введение ангиотензина II (Samson et al. 2008а). Это действие обестатина также имело физиологическое значение, поскольку центральное введение антисыворотки против обестатина приводило к повышенной секреции вазопрессина, но не окситоцина, в ответ на ограничение воды в течение ночи (Samson et al. 2008a). Таким образом, здесь представлен пример эндогенного нейропептида, который контролирует гомеостаз жидкости и электролитов, действуя в первую очередь для подавления питья воды, и если наблюдаются какие-либо эффекты на прием пищи, то они, по всей вероятности, вторичны по отношению к его антидипсогенным действиям.
2008а). Это действие обестатина также имело физиологическое значение, поскольку центральное введение антисыворотки против обестатина приводило к повышенной секреции вазопрессина, но не окситоцина, в ответ на ограничение воды в течение ночи (Samson et al. 2008a). Таким образом, здесь представлен пример эндогенного нейропептида, который контролирует гомеостаз жидкости и электролитов, действуя в первую очередь для подавления питья воды, и если наблюдаются какие-либо эффекты на прием пищи, то они, по всей вероятности, вторичны по отношению к его антидипсогенным действиям.
6.4. ЖАЖДА НЕЗАВИСИМА ОТ ГОЛОДА: РОЛЬ БАРОРЕФЛЕКСА
Влияют ли на питьевое поведение сигналы, не связанные с жаждой, в дополнение к тем, которые связаны с приемом пищи? Конечно, да. Наиболее очевидным было бы влияние тошнотворных раздражителей на употребление алкоголя. Вторым может быть употребление алкоголя, связанное с тревогой, также известное как психогенная полидипсия. Тем не менее, более тонкие факторы также могут изменить поведение при употреблении алкоголя, не последним из которых является атмосферное циркуляторное давление.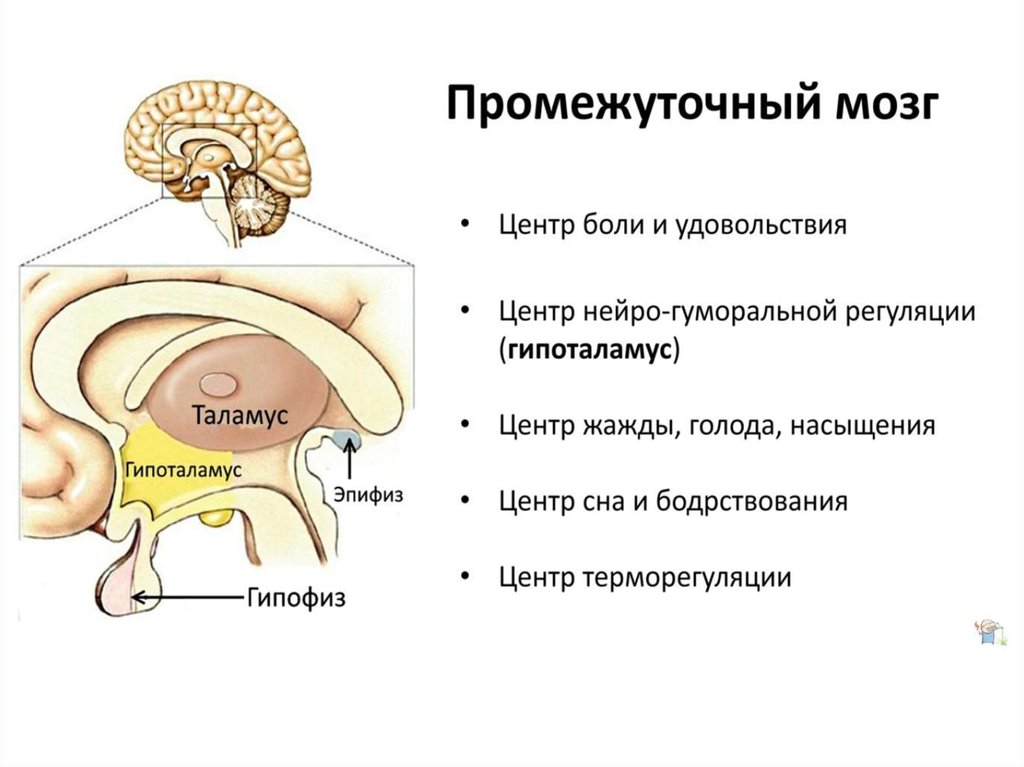 Несколько исследовательских групп продемонстрировали способность изменений среднего артериального давления модулировать фармакологически обусловленное питье воды (Evered et al. 19).88; Хосутт и др. 1978 год; Робинсон и Эверед, 1987 г.; Тунхорст и Джонсон, 1993 г.; Тунхорст и др. 1993). Тогда должно быть понятно, что повышенное артериальное давление посредством барорецептивных механизмов высокого и низкого давления может не только снижать секрецию вазопрессина, но и снижать потребность в потреблении жидкости. В противоположном направлении гипотензивные стимулы, в частности гиповолемия, стимулируют как выброс вазопрессина, так и питье воды, а также усиливают вегетативную функцию, что приводит к восстановлению нормоволемии. Но может ли перфузионное давление упасть еще ниже, превысив некоторый порог для употребления алкоголя? Безусловно, работа группы Стрикера подтвердила эту возможность (Hosutt et al. 19).78). Является ли эффект гипотензии достаточно сильным, чтобы изменить ad libitum питьевое поведение, такое как поведение, связанное с наступлением темновой фазы?
Несколько исследовательских групп продемонстрировали способность изменений среднего артериального давления модулировать фармакологически обусловленное питье воды (Evered et al. 19).88; Хосутт и др. 1978 год; Робинсон и Эверед, 1987 г.; Тунхорст и Джонсон, 1993 г.; Тунхорст и др. 1993). Тогда должно быть понятно, что повышенное артериальное давление посредством барорецептивных механизмов высокого и низкого давления может не только снижать секрецию вазопрессина, но и снижать потребность в потреблении жидкости. В противоположном направлении гипотензивные стимулы, в частности гиповолемия, стимулируют как выброс вазопрессина, так и питье воды, а также усиливают вегетативную функцию, что приводит к восстановлению нормоволемии. Но может ли перфузионное давление упасть еще ниже, превысив некоторый порог для употребления алкоголя? Безусловно, работа группы Стрикера подтвердила эту возможность (Hosutt et al. 19).78). Является ли эффект гипотензии достаточно сильным, чтобы изменить ad libitum питьевое поведение, такое как поведение, связанное с наступлением темновой фазы?
6.
 4.1. Может ли Барорефлекс также представлять сбивающие с толку сигналы жажды и голода?
4.1. Может ли Барорефлекс также представлять сбивающие с толку сигналы жажды и голода? В 2008 году наша группа обнаружила новый нейропептид, закодированный в препрогормоне соматостатина, который при внутривенном введении, в отличие от соматостатина, ингибировал потребление пищи и воды в значительной степени и в зависимости от дозы (Samson et al. 2008b). Антидипсогенное и анорексигенное действие этого пептида, названного нейроностатином, может быть заблокировано предварительной обработкой антагонистом меланокортиновых рецепторов SHU9.119. Это предполагало взаимодействие нейроностатина с нейронами, продуцирующими проопиомеланокортин (POMC) (Yosten and Samson 2010), что мы установили в сотрудничестве с Аластером Фергюсоном с помощью электрофизиологических подходов (Samson et al. 2008b). В этот момент оказалось, что влияние нейроностатина на потребление воды может быть в основном отражением его анорексигенной активности, поскольку пептид не только активировал нейроны POMC, но и ингибировал нейроны, продуцирующие NPY (Samson et al. 2008b). Но являются ли эти анорексигенные и антидипсогенные действия физиологически значимыми? Поскольку нейроностатин является продуктом посттрансляционного процессинга препрогормона соматостатина, любая попытка поставить под угрозу выработку пептида также поставит под угрозу выработку соматостатина, и поэтому наблюдаемые эффекты не поддаются интерпретации. Фактически, отсутствие измененного фенотипа роста или секреции гормона роста у животных с нокаутом гена соматостатина доказывает это (Low et al. 2001).
2008b). Но являются ли эти анорексигенные и антидипсогенные действия физиологически значимыми? Поскольку нейроностатин является продуктом посттрансляционного процессинга препрогормона соматостатина, любая попытка поставить под угрозу выработку пептида также поставит под угрозу выработку соматостатина, и поэтому наблюдаемые эффекты не поддаются интерпретации. Фактически, отсутствие измененного фенотипа роста или секреции гормона роста у животных с нокаутом гена соматостатина доказывает это (Low et al. 2001).
Нейроностатиновый рецептор не был идентифицирован, поэтому мы не могли поставить под угрозу действие пептида путем делеции его рецептора. Точно так же селективные антагонисты нейроностатина в настоящее время недоступны; поэтому мы стремились выборочно скомпрометировать действие нейроностатина in vivo путем пассивной иммунонейтрализации. Взрослых самцов крыс с латеральными церебровентрикулярными канюлями приучали к метаболическим клеткам, как описано ранее (Yosten and Samson 2010). Ежедневно ad libitum Потребление пищи и воды контролировали в течение как минимум 3 дней перед введением 3 мкл преиммунной кроличьей сыворотки (NRS) или 3 мкл кроличьей антисыворотки против крысиного нейроностатина (Phoenix Pharmaceuticals, Burlingame, CA, USA) за 1 час до выключения света. (свет включается с 06:00 до 18:00). Затем потребление пищи и воды контролировали ежечасно до 21:00 и снова через 24 и 48 часов. Мы предположили, что компрометация действия нейроностатина (т. е. нейтрализация антисывороткой) приведет к чрезмерному приему пищи и питью, поскольку фармакологический эффект пептида заключался в ингибировании того и другого. Удивительно, но крысы, получавшие антинейроностатин, на самом деле ели меньше пищи и пили меньше воды, чем контрольные крысы, получавшие NRS. Поскольку они реагировали соответствующей реакцией вздрагивания, мы не считали снижение поведения связанным с нарушением общей двигательной функции. Между двумя группами не наблюдалось различий в отношении потребления пищи и воды или увеличения массы тела через 24 часа.
Ежедневно ad libitum Потребление пищи и воды контролировали в течение как минимум 3 дней перед введением 3 мкл преиммунной кроличьей сыворотки (NRS) или 3 мкл кроличьей антисыворотки против крысиного нейроностатина (Phoenix Pharmaceuticals, Burlingame, CA, USA) за 1 час до выключения света. (свет включается с 06:00 до 18:00). Затем потребление пищи и воды контролировали ежечасно до 21:00 и снова через 24 и 48 часов. Мы предположили, что компрометация действия нейроностатина (т. е. нейтрализация антисывороткой) приведет к чрезмерному приему пищи и питью, поскольку фармакологический эффект пептида заключался в ингибировании того и другого. Удивительно, но крысы, получавшие антинейроностатин, на самом деле ели меньше пищи и пили меньше воды, чем контрольные крысы, получавшие NRS. Поскольку они реагировали соответствующей реакцией вздрагивания, мы не считали снижение поведения связанным с нарушением общей двигательной функции. Между двумя группами не наблюдалось различий в отношении потребления пищи и воды или увеличения массы тела через 24 часа. Таким образом, ингибирующие эффекты, наблюдаемые в день лечения, были обратимы.
Таким образом, ингибирующие эффекты, наблюдаемые в день лечения, были обратимы.
РИСУНОК 6.1
Ad libitum Потребление пищи (a) и воды (b) самцами крыс после внутривенного введения нормальной кроличьей сыворотки (NRS) или антинейроностатиновой (NST) антисыворотки. Потребление у крыс, получавших НРС, существенно не отличалось от такового у крыс, которым ранее вводили физиологический раствор (подробнее…)
Затем мы предположили, что отказ животных от еды или питья не был в первую очередь связан с потерей действия эндогенного нейростатина при кормлении. и питьевых цепей в головном мозге, но вместо этого был вторичным по отношению к потере действия эндогенного пептида на вегетативные центры в мозговом веществе. Мы продемонстрировали, что центральное введение экзогенного нейроностатина повышает среднее артериальное давление за счет двух механизмов: повышения симпатического эфферентного тонуса и увеличения высвобождения вазопрессина (Yosten et al., 2011). Возможно ли, что в отсутствие эндогенного нейроностатина артериальное давление было достаточно низким, чтобы поставить под угрозу барорефлекторную функцию, и, таким образом, крысы испытывали ортостатическую гипотензию, когда они вставали, чтобы получить доступ к пище и воде? Чтобы проверить эту гипотезу, мы отслеживали среднее артериальное давление у находящихся в сознании, не пристегнутых крыс до и после центрального введения NRS или антисыворотки против нейроностатина.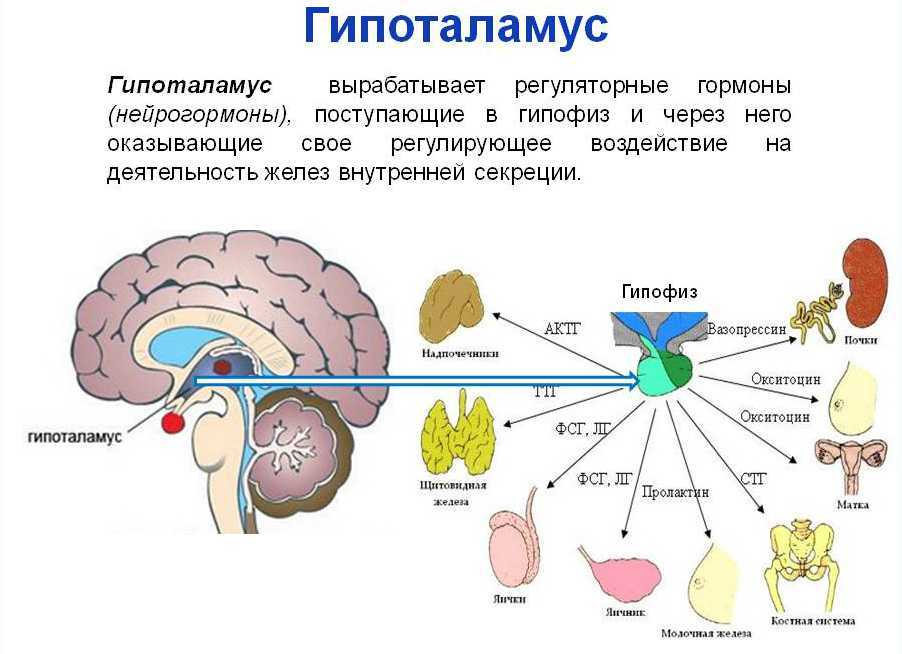 Действительно, артериальное давление значительно снизилось у крыс, получавших антинейроностатин, было нестабильным и упало еще больше, когда животные вставали, чтобы передвигаться по клеткам.
Действительно, артериальное давление значительно снизилось у крыс, получавших антинейроностатин, было нестабильным и упало еще больше, когда животные вставали, чтобы передвигаться по клеткам.
6.4.2. Изменяет ли потеря барорефлекса жажду и голод?
Для проверки гипотезы о том, что ортостаз был потенциальной причиной неспособности крыс, получавших антисыворотку, есть и пить в начале темновой фазы, мы оснастили животных латеральными церебровентрикулярными канюлями, а через 5 дней в каротидную артерию поместили катетеры. артерия и яремная вена, как описано ранее (Yosten and Samson 2010). На следующий день животных приучили к комнате для испытаний, каротидный катетер подсоединили к датчику давления, а яремный катетер подсоединили к удлинительной трубке для облегчения внутривенного введения нитропруссида натрия (2,5, 7,5 и 15 мкг/сут). кг массы тела) для снижения артериального давления или фенилэфрин (5,0, 25 и 50 мкг/кг массы тела) для повышения давления. Частоту сердечных сокращений и артериальное давление контролировали в течение не менее 20 мин до и непрерывно во время тестирования. Как видно из рисунка, предварительная обработка антинейроностатиновой сывороткой приводила к значительному изменению барорефлекторной функции (сравнение наклонов линий регрессии, t α (2), 73 = 29,2, p < 0,001), так что эти животные реагировали меньшей сердечной реакцией либо на падение, либо на повышение среднего артериального давления. Таким образом, мы пришли к выводу, что ингибирующий эффект предварительного лечения антинейроностатином на потребление пищи и воды, по всей вероятности, был вторичным по отношению к нарушению вегетативной функции, которое привело к ортостазу и, следовательно, к дефициту двигательной активности. Эти данные, а также текущие исследования в нашей лаборатории с использованием молекулярных подходов к нарушению функции нейроностатина путем отмены продукции рецептора, связанного с G-белком, который мы предлагаем использовать в качестве родственного рецептора для пептида, указывают на физиологически значимую роль эндогенного нейроностатина в центральный контроль вегетативной функции, но не прямая роль в жажде или голоде.
Как видно из рисунка, предварительная обработка антинейроностатиновой сывороткой приводила к значительному изменению барорефлекторной функции (сравнение наклонов линий регрессии, t α (2), 73 = 29,2, p < 0,001), так что эти животные реагировали меньшей сердечной реакцией либо на падение, либо на повышение среднего артериального давления. Таким образом, мы пришли к выводу, что ингибирующий эффект предварительного лечения антинейроностатином на потребление пищи и воды, по всей вероятности, был вторичным по отношению к нарушению вегетативной функции, которое привело к ортостазу и, следовательно, к дефициту двигательной активности. Эти данные, а также текущие исследования в нашей лаборатории с использованием молекулярных подходов к нарушению функции нейроностатина путем отмены продукции рецептора, связанного с G-белком, который мы предлагаем использовать в качестве родственного рецептора для пептида, указывают на физиологически значимую роль эндогенного нейроностатина в центральный контроль вегетативной функции, но не прямая роль в жажде или голоде.
РИСУНОК 6.2
Интрацеребровентрикулярное введение антисыворотки против нейроностатина (NST) изменяет барорефлекторную функцию у находящихся в сознании самцов крыс без ограничений (наклоны сравниваются с помощью линейного регрессионного анализа). Давление было понижено или повышено внутриартериальным введением (подробнее…)
6.5. РЕЗЮМЕ И ВЫВОДЫ
Таким образом, повышение среднего артериального давления может смягчить питьевую реакцию на стимулы жажды, возможно, за счет активации барорефлекса, а гипотония может аналогичным образом изменить питьевое поведение, когда центры жажды в головном мозге не реагируют на падение давления, потому что нарушения барорефлекса. Исследователи, хорошо знакомые с литературой о жажде, хорошо осведомлены об этих потенциальных ловушках, когда сообщаются данные исследований питания, но можно ли то же самое сказать о тех, кто менее сведущ в этой литературе? Очевидно, что литература по обестатину содержит предостережения (Zhang et al. , 2007). Кроме того, когда новые пептиды впервые тестируются на потенциальное влияние на потребление пищи и воды, следует разработать эксперименты, которые потенциально разделят два поведения, и необходимо изучить возможность того, что любое из этих двух поведений является результатом изменений в вегетативной функции. Наш опыт, безусловно, преподал нам этот ценный урок.
, 2007). Кроме того, когда новые пептиды впервые тестируются на потенциальное влияние на потребление пищи и воды, следует разработать эксперименты, которые потенциально разделят два поведения, и необходимо изучить возможность того, что любое из этих двух поведений является результатом изменений в вегетативной функции. Наш опыт, безусловно, преподал нам этот ценный урок.
БЛАГОДАРНОСТЬ
Др. Йостен и Самсон поддерживаются Национальным институтом здравоохранения (HL66023) и Американской кардиологической ассоциацией (10GRNT4470043).
ССЫЛКИ
de Castro J. Микрорегуляторный анализ спонтанного потребления жидкости у людей: Доказательства того, что количество проглатываемой жидкости и ее время в основном регулируются кормлением. Физиол Поведение. 1988; 3: 705–14. [PubMed: 3237784]
Эверед М.Д., Робинсон М.М., Роуз П.А. Влияние артериального давления на реакцию питья и мочи на ангиотензин II. Am J Physiol Regul Integr Comp Physiol.
 1988;254:R69–74. [PubMed: 3337271]
1988;254:R69–74. [PubMed: 3337271]Фитцсимонс Дж. Т., Ле Магнен Дж. Еда как регулирующий контроль питья у крыс. J Comp Physiol Psychol. 1969; 67: 273–83. [PubMed: 5787378]
Хосутт Дж. А., Роуленд Н., Стрикер Э. М. Гипотензия и жажда у крыс после лечения изопротеренолом. Физиол Поведение. 1978; 21: 593–598. [PubMed: 740778]
Kissileff HR. Пьянство у крыс, связанное с пищей. J Comp Physiol Psychol. 1969; 67: 284–300. [В паблике: 5787379]
Lauwers E, Landuyt B, Arckens L, Schoof L, Luyten W. Обестатин не активирует орфанный G-белок-связанный рецептор GPR39. BiochemBiophys Res Commun. 2006; 351:21–25. [PubMed: 17054911]
Лоу М.Дж., Отеро-Коршон В., Парлоу А.Ф. и др. Соматостатин необходим для маскулинизации гормона роста – он регулирует экспрессию печеночных генов, но не рост. Джей Клин Инвест. 2001; 107:1571–80. [Бесплатная статья PMC: PMC200191] [PubMed: 11413165]
Mietlicki E.
 G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]
G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]Moechars D, Depoortere I, Moreaux B. et al. Измененная желудочно-кишечная и метаболическая функция у мышей с нокаутом рецептора GPR39-обестатина. Гастроэнтерология. 2006; 131:1131–41. [PubMed: 17030183]
Портер Дж.П., Потрац К.Р. Влияние интрацеребровентрикулярного ангиотензина II на массу тела и потребление пищи у взрослых крыс. Am J Physiol Regul Integr Comp Physiol. 2004; 287: R422–8. [В паблике: 15117728]
Робинсон М.М., Эверед М.Д. Прессорное действие внутривенного ангиотензина II снижает реакцию на питье у крыс. Am J Physiol Regul Integr Comp Physiol. 1987; 252: R754–9. [PubMed: 3551636]
Самсон В.К., Уайт М.М., Прайс С., Фергюсон А.В. Обестатин действует на мозг, подавляя жажду. Am J Physiol Regul Integr Comp Physiol. 2006; 292: R637–43.
 [PubMed: 16931650]
[PubMed: 16931650]Самсон В.К., Йостен Г.Л.К., Чанг Дж.К., Фергюсон А.В., Уайт М.М. Обестатин ингибирует секрецию вазопрессина: доказательства физиологического действия в контроле гомеостаза жидкости. J Эндокринол. 2008а;196:1–7. [PubMed: 18310451]
Самсон В.К., Чжан Дж.В., Авсиан-Кретчмер О. и соавт. Нейроностатин, кодируемый геном соматостатина, регулирует нейрональные, эндокринные и метаболические функции. Дж. Биол. Хим. 2008б; 283:31949–59. [Бесплатная статья PMC: PMC2581552] [PubMed: 18753129]
Seone LM, Al-Massadi O, Pazoz Y, Pagotto U, Casaneuva F.F. Центральное введение обестатина не влияет ни на спонтанное, ни на индуцированное грелином потребление пищи у крыс. Дж Эндокринол Инвест. 2006;29:RC13–15. [PubMed: 17033253]
Тунхорст Р.Л., Джонсон А.К. Влияние артериального давления на реакцию питья и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 264: R211–7. [PubMed: 8430881]
Тунхорст Р.
 Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]
Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]Рен А. М., Смолл К. Дж., Уорд Х. Л. и др. Новый гипоталамический пептид грелин стимулирует потребление пищи и секрецию гормона роста. Эндокринология. 2000; 141:4325–8. [В паблике: 11089570]
Йостен Г.Л., Самсон В.К. Меланокортины, а не окситоцин, опосредуют анорексигенное и антидипсогенное действие нейроностатина. Пептиды. 2010;31:1711–4. [Бесплатная статья PMC: PMC2935629] [PubMed: 20600426]
Йостен Г.Л., Пейт А.Т., Самсон В.К. Нейроностатин действует в головном мозге, повышая среднее артериальное давление в два этапа за счет симпато-активации с последующей секрецией вазопрессина: роль рецепторов меланокортина. Am J Physiol. 2011;300:R1194–9. [Бесплатная статья PMC: PMC3094032] [PubMed: 21325646]
Чжан Дж.В., Рен П.-Г., Авсиан-Кретчмер О.
 и др. Обестатин, пептид, кодируемый геном грелина, препятствует влиянию грелина на прием пищи. Наука. 2005; 310:996–9. [PubMed: 16284174]
и др. Обестатин, пептид, кодируемый геном грелина, препятствует влиянию грелина на прием пищи. Наука. 2005; 310:996–9. [PubMed: 16284174]Чжан Дж.В., Кляйн С., Рен П.-Г. и другие. Ответ на комментарий к статье «Обестатин, пептид, кодируемый геном грелина, противодействует влиянию приема пищи». Наука. 2007; 315:766. [PubMed: 17289961]
Зорилла Э.П., Иноуэ К., Фекете Э.М., Табарин А., Вальдес Г.Р., Кооб Г.Ф. Измерение приемов пищи: Структура приемов пищи и воды крысами. Am J Physiol. 2005; 288: R1450–67. [В паблике: 15637168]
Отделение жажды от голода — нейробиология гомеостаза жидкостей организма
Джина Л. С. Йостен и Уиллис К. Самсон.
6.1. ВВЕДЕНИЕ
Классические стимулы жажды могут быть изменены другими текущими физиологическими состояниями. Кроме того, хотя прием пищи и питье воды традиционно рассматриваются как одновременные действия, стимулы для приема пищи могут быть отделены от питья воды и наоборот. В этой главе мы рассматриваем два вопроса: независимость двух видов поведения и влияние стимулов, не связанных с жаждой, на поведение при питье воды.
В этой главе мы рассматриваем два вопроса: независимость двух видов поведения и влияние стимулов, не связанных с жаждой, на поведение при питье воды.
Все ли стимулы для приема пищи вызывают сопутствующее питье воды? Хотя анализ моделей потребления пищи и воды ad libitum окончательно продемонстрировал координацию этих двух видов поведения (de Castro 1988; Fitzsimons and LeMagnen 1969; Kissileff 1969), ясно, что питье воды может происходить в физиологических условиях в отсутствие пищи. потребление пищи (Zorilla et al. 2005), и даже в условиях ограничения воды происходит некоторое потребление пищи (Fitzsimons and LeMagnen 19).69; Зорилла и др. 2005). Однако более физиологичным подходом к согласованию двух моделей поведения является изучение интервалов питья воды в течение 24 часов, периодов ad libitum , и в этих условиях значительное количество воды потребляется независимо от приема пищи (Zorilla et al. др. 2005). Это может показаться очевидным, если принять во внимание важность осмотических и волемических стимулов для питья; однако, когда кто-то рассматривает питье воды в присутствии приема пищи, определенная необходимость совпадающего поведения перевешивает их независимость. Это в немалой степени связано со смазывающей функцией жидкости, принимаемой с твердой пищей, и результирующими осмотическими стимулами после всасывания растворенных веществ в желудке и кишечнике. Но все ли стимулы для приема пищи также стимулируют употребление алкоголя? Данные лаборатории Дэниэлса (Mietlicki et al., 2009).) дает четкий отрицательный ответ.
Это в немалой степени связано со смазывающей функцией жидкости, принимаемой с твердой пищей, и результирующими осмотическими стимулами после всасывания растворенных веществ в желудке и кишечнике. Но все ли стимулы для приема пищи также стимулируют употребление алкоголя? Данные лаборатории Дэниэлса (Mietlicki et al., 2009).) дает четкий отрицательный ответ.
6.2. ПИТЬЕ, ОТДЕЛЕННОЕ ОТ КОРМЛЕНИЯ
Одним из самых мощных стимулов для приема пищи является грелин, действующий в гипоталамических центрах, чтобы стимулировать потребление пищи (Wren et al. 2000). Однако при изучении в условиях, более подходящих для изучения питьевого поведения, таких как фармакологические (ангиотензин II) или физиологические (гиперосмолярные) нагрузки, наблюдается прямо противоположное. В самом деле, введение грелина, стимулируя прием пищи, ингибирует вызванное ангиотензином II употребление алкоголя, а также употребление алкоголя в ответ на гиперосмолярную нагрузку (Mietlicki et al. 2009).). Точно так же, когда основное внимание уделяется потреблению алкоголя, прием пищи может быть диссоциирован.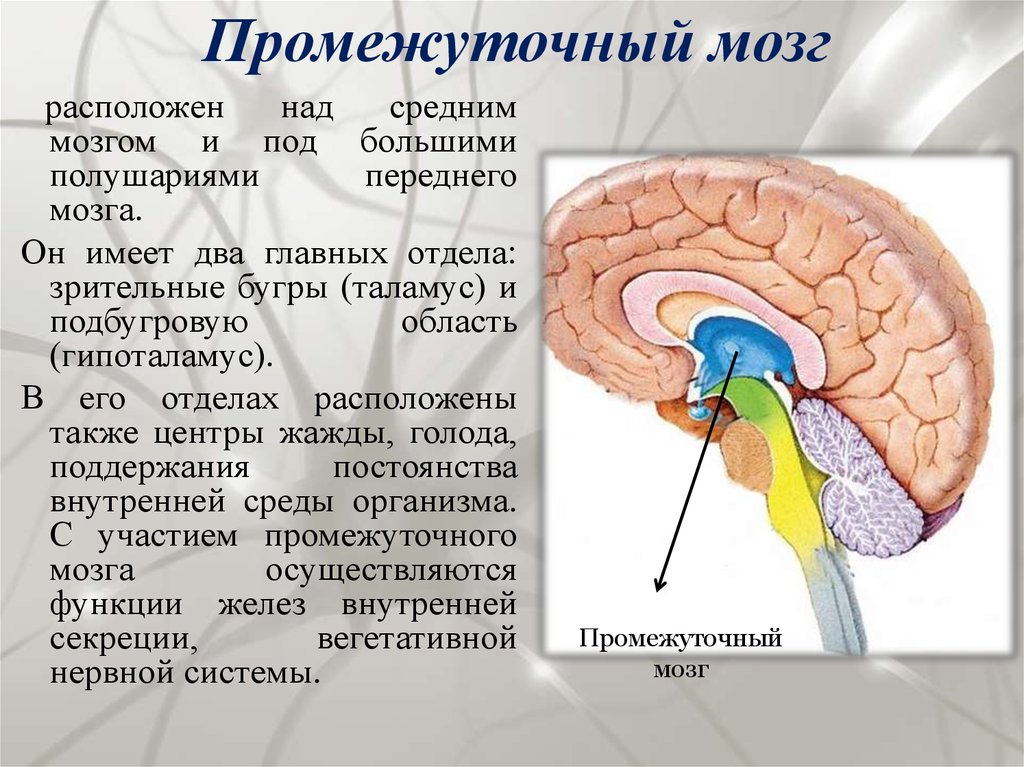 Действительно, дипсогенные дозы ангиотензина II ингибируют, а не стимулируют прием пищи (Porter and Potratz, 2004).
Действительно, дипсогенные дозы ангиотензина II ингибируют, а не стимулируют прием пищи (Porter and Potratz, 2004).
6.3. КОРМЛЕНИЕ КАК ПОСЛЕДСТВИЕ ПИТЬЯ
Может ли снижение потребления алкоголя быть причиной снижения потребления пищи? Мы так считаем. Первоначально обестатин был идентифицирован как посттрансляционный продукт препрохромона грелина (Zhang et al. 2005). Он был назван на основании его очевидной способности ингибировать кормление, действие, которое почти сразу же было оспорено другими исследователями (Seone et al. 2006). В наших руках центральное введение обестатина действительно снижало потребление пищи до незначительной, но не существенной степени; однако более впечатляющим был эффект подавления питья воды у тех же животных в течение 24 часов после центрального введения до наступления темновой фазы (Samson et al. 2006). Это ингибирование потребления воды, но не пищи, приводило к значительной потере массы тела в течение 24-часового периода. Тот факт, что ни прием пищи, ни локомоторное поведение в открытом поле не изменились при этих же дозах обестатина, позволили нам предположить, что действие пептида было селективным в отношении жажды.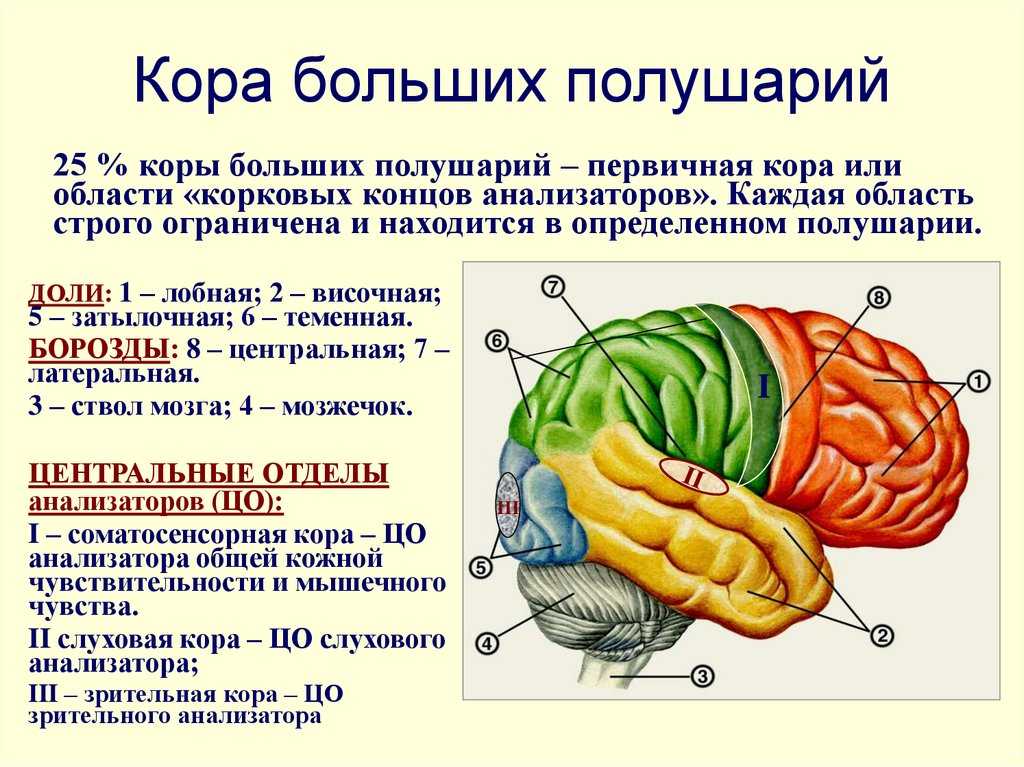 Чтобы проверить эту возможность более непосредственно, мы изучили действие обестатина на фармакологически вызванную жажду и наблюдали значительный ингибирующий эффект обестатина на питье воды, вызванное ангиотензином II (Samson et al. 2006). Употребление воды в ответ на гиповолемическую провокацию также ингибировалось интрацеребровентикулярным (icv) введением обестатина (Samson et al. 2008a). Наконец, мы идентифицировали субфорникальный орган как потенциальное место действия обестатина (Samson et al. 2006), снова предполагая уникальное действие пептида на механизмы жажды, независимое от какого-либо значительного воздействия на прием пищи.
Чтобы проверить эту возможность более непосредственно, мы изучили действие обестатина на фармакологически вызванную жажду и наблюдали значительный ингибирующий эффект обестатина на питье воды, вызванное ангиотензином II (Samson et al. 2006). Употребление воды в ответ на гиповолемическую провокацию также ингибировалось интрацеребровентикулярным (icv) введением обестатина (Samson et al. 2008a). Наконец, мы идентифицировали субфорникальный орган как потенциальное место действия обестатина (Samson et al. 2006), снова предполагая уникальное действие пептида на механизмы жажды, независимое от какого-либо значительного воздействия на прием пищи.
Является ли избирательное действие обестатина на жажду физиологически значимым? Поскольку обестатин образуется из того же препрогормона, что и грелин, нокаут гена (удаление эмбрионального гена) или компрометация трансляции (антисмысловые олигонуклеотиды, малая интерферирующая РНК, рибозимы) могут отменить продукцию обоих пептидов. Как тогда вы интерпретируете полученный поведенческий фенотип? Будет ли это вызвано исключительно потерей обестатина или потерей грелина, или даже потерей того и другого? Кроме того, не существует консенсуса относительно идентичности рецептора обестатина (Lauwers et al.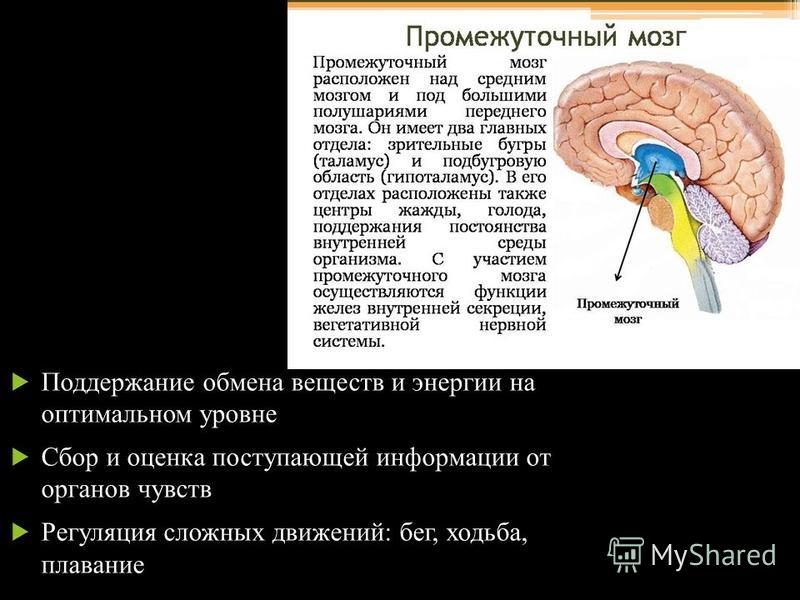 2006; Moechars et al. 2006), и не было разработано селективного антагониста рецептора обестатина. Поэтому мы обратились к пассивной иммунонейтрализации как подходу к изучению вопроса о физиологической значимости. Действительно, предварительная обработка селективной антисывороткой к обестатину привела к очень значительному увеличению потребления воды в 9 группах.0009 ad libitum кормили и поили крыс (Samson et al. 2008a). Потребление пищи также было повышено у животных, получавших антисыворотку, хотя это увеличение не достигло статистической значимости. Эти результаты вместе с нашим наблюдением прямого действия пептида на нейроны субфорникальных органов указывают на физиологически значимое действие обестатина на водно-электролитный гомеостаз. Это стало еще более очевидным, когда мы продемонстрировали, что в дополнение к ингибированию потребления воды обестатин, введенный внутривенно, ингибировал секрецию вазопрессина, но не окситоцина, секрецию вазопрессина у животных с ограничением воды в течение ночи и секрецию вазопрессина в ответ на центральное введение ангиотензина II (Samson et al.
2006; Moechars et al. 2006), и не было разработано селективного антагониста рецептора обестатина. Поэтому мы обратились к пассивной иммунонейтрализации как подходу к изучению вопроса о физиологической значимости. Действительно, предварительная обработка селективной антисывороткой к обестатину привела к очень значительному увеличению потребления воды в 9 группах.0009 ad libitum кормили и поили крыс (Samson et al. 2008a). Потребление пищи также было повышено у животных, получавших антисыворотку, хотя это увеличение не достигло статистической значимости. Эти результаты вместе с нашим наблюдением прямого действия пептида на нейроны субфорникальных органов указывают на физиологически значимое действие обестатина на водно-электролитный гомеостаз. Это стало еще более очевидным, когда мы продемонстрировали, что в дополнение к ингибированию потребления воды обестатин, введенный внутривенно, ингибировал секрецию вазопрессина, но не окситоцина, секрецию вазопрессина у животных с ограничением воды в течение ночи и секрецию вазопрессина в ответ на центральное введение ангиотензина II (Samson et al.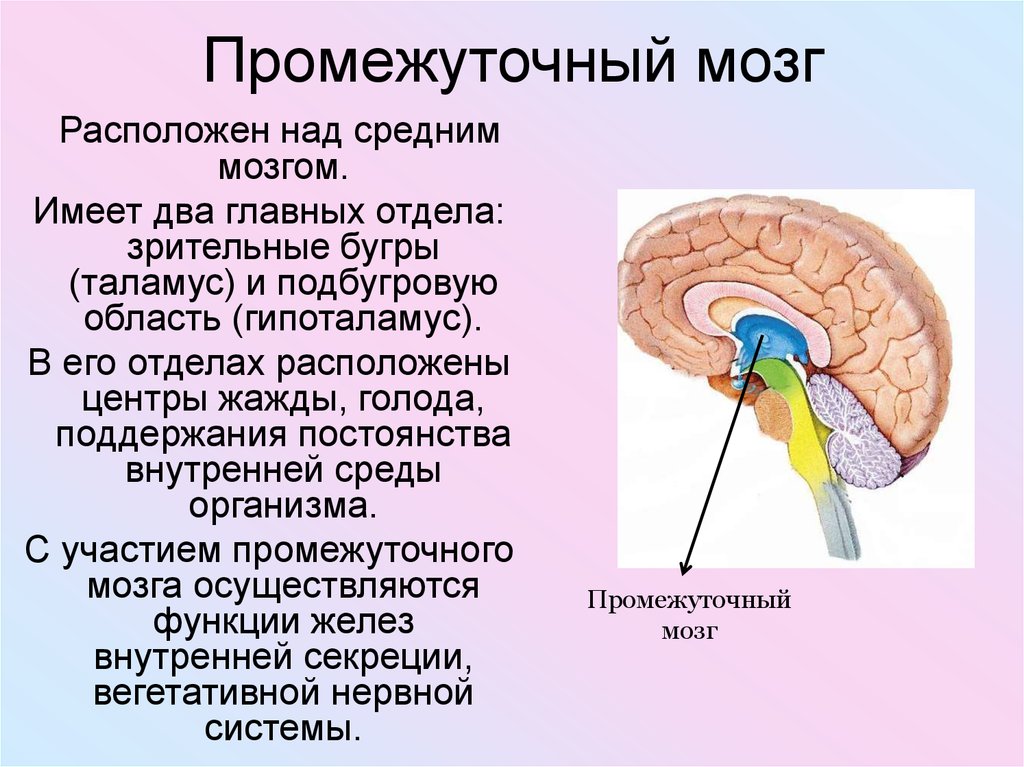 2008а). Это действие обестатина также имело физиологическое значение, поскольку центральное введение антисыворотки против обестатина приводило к повышенной секреции вазопрессина, но не окситоцина, в ответ на ограничение воды в течение ночи (Samson et al. 2008a). Таким образом, здесь представлен пример эндогенного нейропептида, который контролирует гомеостаз жидкости и электролитов, действуя в первую очередь для подавления питья воды, и если наблюдаются какие-либо эффекты на прием пищи, то они, по всей вероятности, вторичны по отношению к его антидипсогенным действиям.
2008а). Это действие обестатина также имело физиологическое значение, поскольку центральное введение антисыворотки против обестатина приводило к повышенной секреции вазопрессина, но не окситоцина, в ответ на ограничение воды в течение ночи (Samson et al. 2008a). Таким образом, здесь представлен пример эндогенного нейропептида, который контролирует гомеостаз жидкости и электролитов, действуя в первую очередь для подавления питья воды, и если наблюдаются какие-либо эффекты на прием пищи, то они, по всей вероятности, вторичны по отношению к его антидипсогенным действиям.
6.4. ЖАЖДА НЕЗАВИСИМА ОТ ГОЛОДА: РОЛЬ БАРОРЕФЛЕКСА
Влияют ли на питьевое поведение сигналы, не связанные с жаждой, в дополнение к тем, которые связаны с приемом пищи? Конечно, да. Наиболее очевидным было бы влияние тошнотворных раздражителей на употребление алкоголя. Вторым может быть употребление алкоголя, связанное с тревогой, также известное как психогенная полидипсия. Тем не менее, более тонкие факторы также могут изменить поведение при употреблении алкоголя, не последним из которых является атмосферное циркуляторное давление. Несколько исследовательских групп продемонстрировали способность изменений среднего артериального давления модулировать фармакологически обусловленное питье воды (Evered et al. 19).88; Хосутт и др. 1978 год; Робинсон и Эверед, 1987 г.; Тунхорст и Джонсон, 1993 г.; Тунхорст и др. 1993). Тогда должно быть понятно, что повышенное артериальное давление посредством барорецептивных механизмов высокого и низкого давления может не только снижать секрецию вазопрессина, но и снижать потребность в потреблении жидкости. В противоположном направлении гипотензивные стимулы, в частности гиповолемия, стимулируют как выброс вазопрессина, так и питье воды, а также усиливают вегетативную функцию, что приводит к восстановлению нормоволемии. Но может ли перфузионное давление упасть еще ниже, превысив некоторый порог для употребления алкоголя? Безусловно, работа группы Стрикера подтвердила эту возможность (Hosutt et al. 19).78). Является ли эффект гипотензии достаточно сильным, чтобы изменить ad libitum питьевое поведение, такое как поведение, связанное с наступлением темновой фазы?
Несколько исследовательских групп продемонстрировали способность изменений среднего артериального давления модулировать фармакологически обусловленное питье воды (Evered et al. 19).88; Хосутт и др. 1978 год; Робинсон и Эверед, 1987 г.; Тунхорст и Джонсон, 1993 г.; Тунхорст и др. 1993). Тогда должно быть понятно, что повышенное артериальное давление посредством барорецептивных механизмов высокого и низкого давления может не только снижать секрецию вазопрессина, но и снижать потребность в потреблении жидкости. В противоположном направлении гипотензивные стимулы, в частности гиповолемия, стимулируют как выброс вазопрессина, так и питье воды, а также усиливают вегетативную функцию, что приводит к восстановлению нормоволемии. Но может ли перфузионное давление упасть еще ниже, превысив некоторый порог для употребления алкоголя? Безусловно, работа группы Стрикера подтвердила эту возможность (Hosutt et al. 19).78). Является ли эффект гипотензии достаточно сильным, чтобы изменить ad libitum питьевое поведение, такое как поведение, связанное с наступлением темновой фазы?
6.
 4.1. Может ли Барорефлекс также представлять сбивающие с толку сигналы жажды и голода?
4.1. Может ли Барорефлекс также представлять сбивающие с толку сигналы жажды и голода? В 2008 году наша группа обнаружила новый нейропептид, закодированный в препрогормоне соматостатина, который при внутривенном введении, в отличие от соматостатина, ингибировал потребление пищи и воды в значительной степени и в зависимости от дозы (Samson et al. 2008b). Антидипсогенное и анорексигенное действие этого пептида, названного нейроностатином, может быть заблокировано предварительной обработкой антагонистом меланокортиновых рецепторов SHU9.119. Это предполагало взаимодействие нейроностатина с нейронами, продуцирующими проопиомеланокортин (POMC) (Yosten and Samson 2010), что мы установили в сотрудничестве с Аластером Фергюсоном с помощью электрофизиологических подходов (Samson et al. 2008b). В этот момент оказалось, что влияние нейроностатина на потребление воды может быть в основном отражением его анорексигенной активности, поскольку пептид не только активировал нейроны POMC, но и ингибировал нейроны, продуцирующие NPY (Samson et al.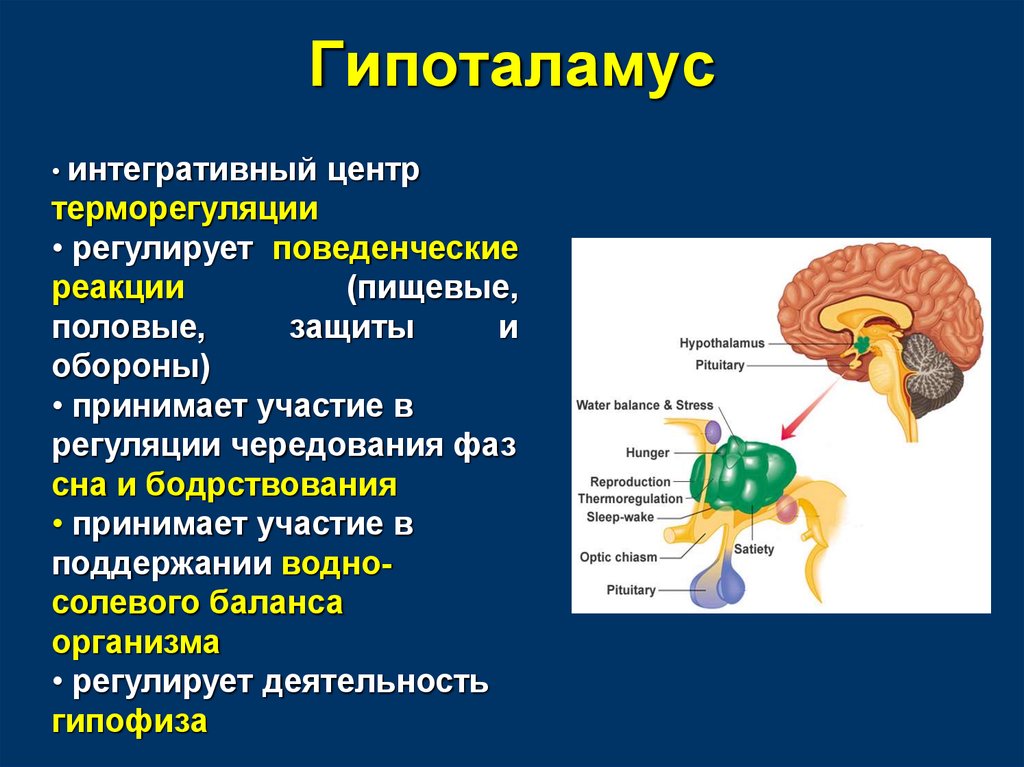 2008b). Но являются ли эти анорексигенные и антидипсогенные действия физиологически значимыми? Поскольку нейроностатин является продуктом посттрансляционного процессинга препрогормона соматостатина, любая попытка поставить под угрозу выработку пептида также поставит под угрозу выработку соматостатина, и поэтому наблюдаемые эффекты не поддаются интерпретации. Фактически, отсутствие измененного фенотипа роста или секреции гормона роста у животных с нокаутом гена соматостатина доказывает это (Low et al. 2001).
2008b). Но являются ли эти анорексигенные и антидипсогенные действия физиологически значимыми? Поскольку нейроностатин является продуктом посттрансляционного процессинга препрогормона соматостатина, любая попытка поставить под угрозу выработку пептида также поставит под угрозу выработку соматостатина, и поэтому наблюдаемые эффекты не поддаются интерпретации. Фактически, отсутствие измененного фенотипа роста или секреции гормона роста у животных с нокаутом гена соматостатина доказывает это (Low et al. 2001).
Нейроностатиновый рецептор не был идентифицирован, поэтому мы не могли поставить под угрозу действие пептида путем делеции его рецептора. Точно так же селективные антагонисты нейроностатина в настоящее время недоступны; поэтому мы стремились выборочно скомпрометировать действие нейроностатина in vivo путем пассивной иммунонейтрализации. Взрослых самцов крыс с латеральными церебровентрикулярными канюлями приучали к метаболическим клеткам, как описано ранее (Yosten and Samson 2010). Ежедневно ad libitum Потребление пищи и воды контролировали в течение как минимум 3 дней перед введением 3 мкл преиммунной кроличьей сыворотки (NRS) или 3 мкл кроличьей антисыворотки против крысиного нейроностатина (Phoenix Pharmaceuticals, Burlingame, CA, USA) за 1 час до выключения света. (свет включается с 06:00 до 18:00). Затем потребление пищи и воды контролировали ежечасно до 21:00 и снова через 24 и 48 часов. Мы предположили, что компрометация действия нейроностатина (т. е. нейтрализация антисывороткой) приведет к чрезмерному приему пищи и питью, поскольку фармакологический эффект пептида заключался в ингибировании того и другого. Удивительно, но крысы, получавшие антинейроностатин, на самом деле ели меньше пищи и пили меньше воды, чем контрольные крысы, получавшие NRS. Поскольку они реагировали соответствующей реакцией вздрагивания, мы не считали снижение поведения связанным с нарушением общей двигательной функции. Между двумя группами не наблюдалось различий в отношении потребления пищи и воды или увеличения массы тела через 24 часа.
Ежедневно ad libitum Потребление пищи и воды контролировали в течение как минимум 3 дней перед введением 3 мкл преиммунной кроличьей сыворотки (NRS) или 3 мкл кроличьей антисыворотки против крысиного нейроностатина (Phoenix Pharmaceuticals, Burlingame, CA, USA) за 1 час до выключения света. (свет включается с 06:00 до 18:00). Затем потребление пищи и воды контролировали ежечасно до 21:00 и снова через 24 и 48 часов. Мы предположили, что компрометация действия нейроностатина (т. е. нейтрализация антисывороткой) приведет к чрезмерному приему пищи и питью, поскольку фармакологический эффект пептида заключался в ингибировании того и другого. Удивительно, но крысы, получавшие антинейроностатин, на самом деле ели меньше пищи и пили меньше воды, чем контрольные крысы, получавшие NRS. Поскольку они реагировали соответствующей реакцией вздрагивания, мы не считали снижение поведения связанным с нарушением общей двигательной функции. Между двумя группами не наблюдалось различий в отношении потребления пищи и воды или увеличения массы тела через 24 часа. Таким образом, ингибирующие эффекты, наблюдаемые в день лечения, были обратимы.
Таким образом, ингибирующие эффекты, наблюдаемые в день лечения, были обратимы.
РИСУНОК 6.1
Ad libitum Потребление пищи (a) и воды (b) самцами крыс после внутривенного введения нормальной кроличьей сыворотки (NRS) или антинейроностатиновой (NST) антисыворотки. Потребление у крыс, получавших НРС, существенно не отличалось от такового у крыс, которым ранее вводили физиологический раствор (подробнее…)
Затем мы предположили, что отказ животных от еды или питья не был в первую очередь связан с потерей действия эндогенного нейростатина при кормлении. и питьевых цепей в головном мозге, но вместо этого был вторичным по отношению к потере действия эндогенного пептида на вегетативные центры в мозговом веществе. Мы продемонстрировали, что центральное введение экзогенного нейроностатина повышает среднее артериальное давление за счет двух механизмов: повышения симпатического эфферентного тонуса и увеличения высвобождения вазопрессина (Yosten et al., 2011). Возможно ли, что в отсутствие эндогенного нейроностатина артериальное давление было достаточно низким, чтобы поставить под угрозу барорефлекторную функцию, и, таким образом, крысы испытывали ортостатическую гипотензию, когда они вставали, чтобы получить доступ к пище и воде? Чтобы проверить эту гипотезу, мы отслеживали среднее артериальное давление у находящихся в сознании, не пристегнутых крыс до и после центрального введения NRS или антисыворотки против нейроностатина.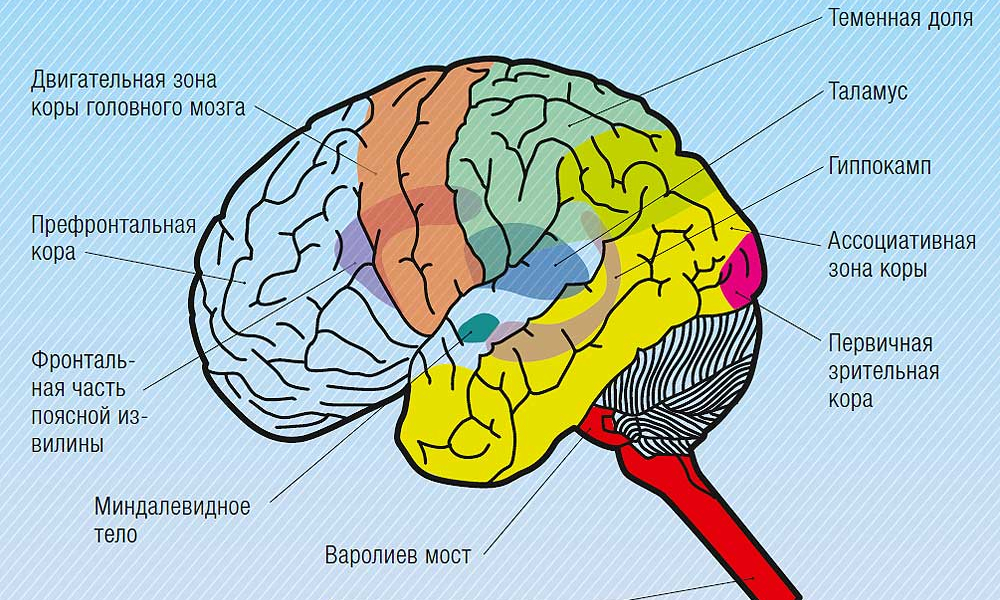 Действительно, артериальное давление значительно снизилось у крыс, получавших антинейроностатин, было нестабильным и упало еще больше, когда животные вставали, чтобы передвигаться по клеткам.
Действительно, артериальное давление значительно снизилось у крыс, получавших антинейроностатин, было нестабильным и упало еще больше, когда животные вставали, чтобы передвигаться по клеткам.
6.4.2. Изменяет ли потеря барорефлекса жажду и голод?
Для проверки гипотезы о том, что ортостаз был потенциальной причиной неспособности крыс, получавших антисыворотку, есть и пить в начале темновой фазы, мы оснастили животных латеральными церебровентрикулярными канюлями, а через 5 дней в каротидную артерию поместили катетеры. артерия и яремная вена, как описано ранее (Yosten and Samson 2010). На следующий день животных приучили к комнате для испытаний, каротидный катетер подсоединили к датчику давления, а яремный катетер подсоединили к удлинительной трубке для облегчения внутривенного введения нитропруссида натрия (2,5, 7,5 и 15 мкг/сут). кг массы тела) для снижения артериального давления или фенилэфрин (5,0, 25 и 50 мкг/кг массы тела) для повышения давления. Частоту сердечных сокращений и артериальное давление контролировали в течение не менее 20 мин до и непрерывно во время тестирования. Как видно из рисунка, предварительная обработка антинейроностатиновой сывороткой приводила к значительному изменению барорефлекторной функции (сравнение наклонов линий регрессии, t α (2), 73 = 29,2, p < 0,001), так что эти животные реагировали меньшей сердечной реакцией либо на падение, либо на повышение среднего артериального давления. Таким образом, мы пришли к выводу, что ингибирующий эффект предварительного лечения антинейроностатином на потребление пищи и воды, по всей вероятности, был вторичным по отношению к нарушению вегетативной функции, которое привело к ортостазу и, следовательно, к дефициту двигательной активности. Эти данные, а также текущие исследования в нашей лаборатории с использованием молекулярных подходов к нарушению функции нейроностатина путем отмены продукции рецептора, связанного с G-белком, который мы предлагаем использовать в качестве родственного рецептора для пептида, указывают на физиологически значимую роль эндогенного нейроностатина в центральный контроль вегетативной функции, но не прямая роль в жажде или голоде.
Как видно из рисунка, предварительная обработка антинейроностатиновой сывороткой приводила к значительному изменению барорефлекторной функции (сравнение наклонов линий регрессии, t α (2), 73 = 29,2, p < 0,001), так что эти животные реагировали меньшей сердечной реакцией либо на падение, либо на повышение среднего артериального давления. Таким образом, мы пришли к выводу, что ингибирующий эффект предварительного лечения антинейроностатином на потребление пищи и воды, по всей вероятности, был вторичным по отношению к нарушению вегетативной функции, которое привело к ортостазу и, следовательно, к дефициту двигательной активности. Эти данные, а также текущие исследования в нашей лаборатории с использованием молекулярных подходов к нарушению функции нейроностатина путем отмены продукции рецептора, связанного с G-белком, который мы предлагаем использовать в качестве родственного рецептора для пептида, указывают на физиологически значимую роль эндогенного нейроностатина в центральный контроль вегетативной функции, но не прямая роль в жажде или голоде.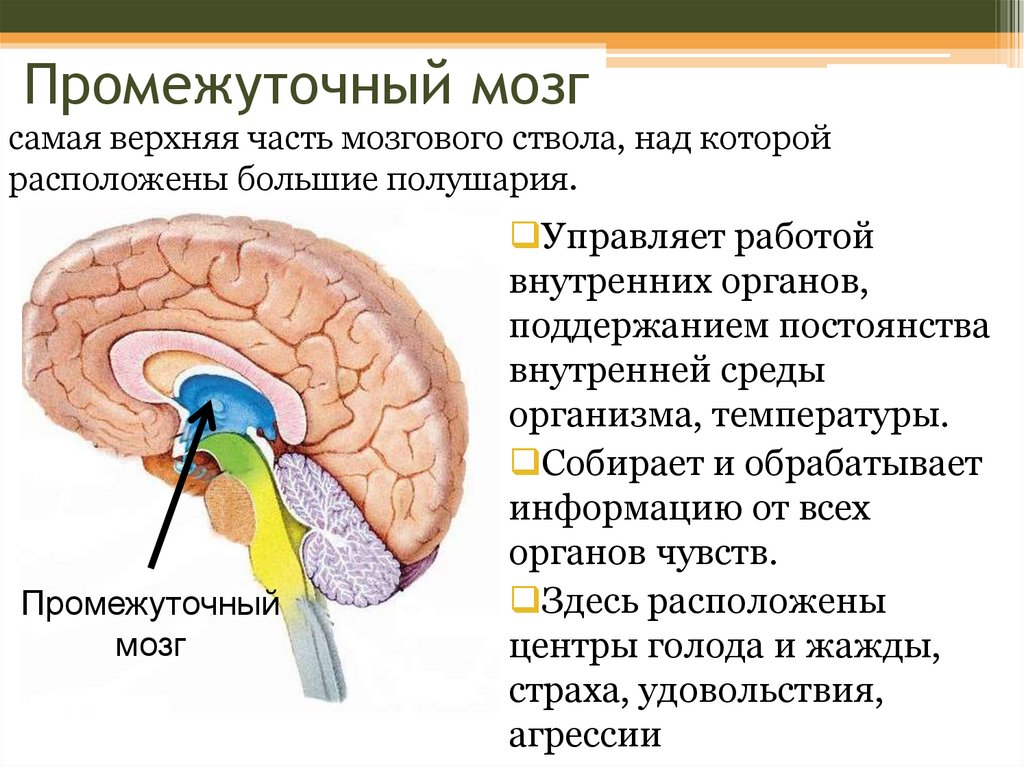
РИСУНОК 6.2
Интрацеребровентрикулярное введение антисыворотки против нейроностатина (NST) изменяет барорефлекторную функцию у находящихся в сознании самцов крыс без ограничений (наклоны сравниваются с помощью линейного регрессионного анализа). Давление было понижено или повышено внутриартериальным введением (подробнее…)
6.5. РЕЗЮМЕ И ВЫВОДЫ
Таким образом, повышение среднего артериального давления может смягчить питьевую реакцию на стимулы жажды, возможно, за счет активации барорефлекса, а гипотония может аналогичным образом изменить питьевое поведение, когда центры жажды в головном мозге не реагируют на падение давления, потому что нарушения барорефлекса. Исследователи, хорошо знакомые с литературой о жажде, хорошо осведомлены об этих потенциальных ловушках, когда сообщаются данные исследований питания, но можно ли то же самое сказать о тех, кто менее сведущ в этой литературе? Очевидно, что литература по обестатину содержит предостережения (Zhang et al.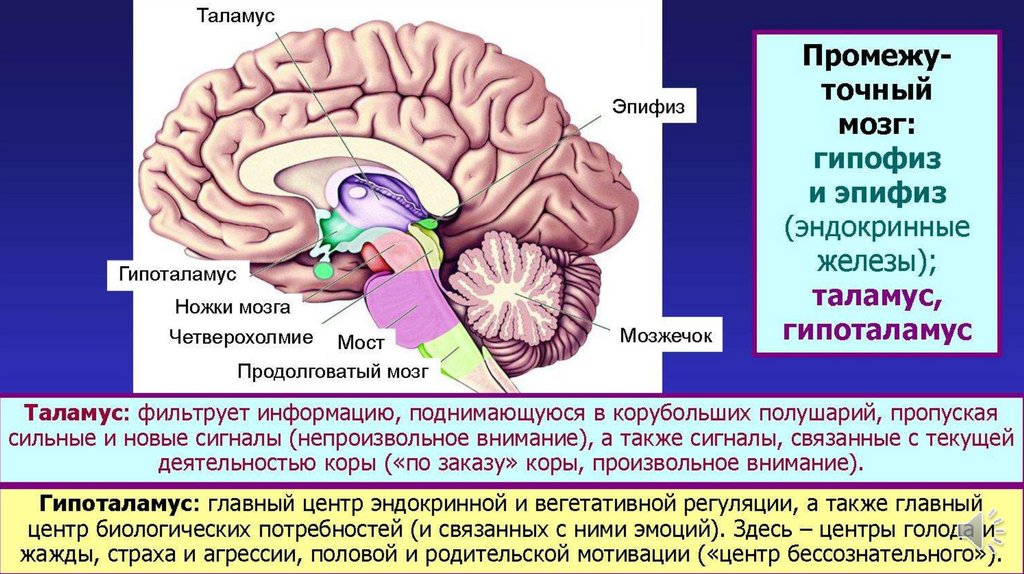 , 2007). Кроме того, когда новые пептиды впервые тестируются на потенциальное влияние на потребление пищи и воды, следует разработать эксперименты, которые потенциально разделят два поведения, и необходимо изучить возможность того, что любое из этих двух поведений является результатом изменений в вегетативной функции. Наш опыт, безусловно, преподал нам этот ценный урок.
, 2007). Кроме того, когда новые пептиды впервые тестируются на потенциальное влияние на потребление пищи и воды, следует разработать эксперименты, которые потенциально разделят два поведения, и необходимо изучить возможность того, что любое из этих двух поведений является результатом изменений в вегетативной функции. Наш опыт, безусловно, преподал нам этот ценный урок.
БЛАГОДАРНОСТЬ
Др. Йостен и Самсон поддерживаются Национальным институтом здравоохранения (HL66023) и Американской кардиологической ассоциацией (10GRNT4470043).
ССЫЛКИ
de Castro J. Микрорегуляторный анализ спонтанного потребления жидкости у людей: Доказательства того, что количество проглатываемой жидкости и ее время в основном регулируются кормлением. Физиол Поведение. 1988; 3: 705–14. [PubMed: 3237784]
Эверед М.Д., Робинсон М.М., Роуз П.А. Влияние артериального давления на реакцию питья и мочи на ангиотензин II. Am J Physiol Regul Integr Comp Physiol.
 1988;254:R69–74. [PubMed: 3337271]
1988;254:R69–74. [PubMed: 3337271]Фитцсимонс Дж. Т., Ле Магнен Дж. Еда как регулирующий контроль питья у крыс. J Comp Physiol Psychol. 1969; 67: 273–83. [PubMed: 5787378]
Хосутт Дж. А., Роуленд Н., Стрикер Э. М. Гипотензия и жажда у крыс после лечения изопротеренолом. Физиол Поведение. 1978; 21: 593–598. [PubMed: 740778]
Kissileff HR. Пьянство у крыс, связанное с пищей. J Comp Physiol Psychol. 1969; 67: 284–300. [В паблике: 5787379]
Lauwers E, Landuyt B, Arckens L, Schoof L, Luyten W. Обестатин не активирует орфанный G-белок-связанный рецептор GPR39. BiochemBiophys Res Commun. 2006; 351:21–25. [PubMed: 17054911]
Лоу М.Дж., Отеро-Коршон В., Парлоу А.Ф. и др. Соматостатин необходим для маскулинизации гормона роста – он регулирует экспрессию печеночных генов, но не рост. Джей Клин Инвест. 2001; 107:1571–80. [Бесплатная статья PMC: PMC200191] [PubMed: 11413165]
Mietlicki E.
 G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]
G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]Moechars D, Depoortere I, Moreaux B. et al. Измененная желудочно-кишечная и метаболическая функция у мышей с нокаутом рецептора GPR39-обестатина. Гастроэнтерология. 2006; 131:1131–41. [PubMed: 17030183]
Портер Дж.П., Потрац К.Р. Влияние интрацеребровентрикулярного ангиотензина II на массу тела и потребление пищи у взрослых крыс. Am J Physiol Regul Integr Comp Physiol. 2004; 287: R422–8. [В паблике: 15117728]
Робинсон М.М., Эверед М.Д. Прессорное действие внутривенного ангиотензина II снижает реакцию на питье у крыс. Am J Physiol Regul Integr Comp Physiol. 1987; 252: R754–9. [PubMed: 3551636]
Самсон В.К., Уайт М.М., Прайс С., Фергюсон А.В. Обестатин действует на мозг, подавляя жажду. Am J Physiol Regul Integr Comp Physiol. 2006; 292: R637–43.
 [PubMed: 16931650]
[PubMed: 16931650]Самсон В.К., Йостен Г.Л.К., Чанг Дж.К., Фергюсон А.В., Уайт М.М. Обестатин ингибирует секрецию вазопрессина: доказательства физиологического действия в контроле гомеостаза жидкости. J Эндокринол. 2008а;196:1–7. [PubMed: 18310451]
Самсон В.К., Чжан Дж.В., Авсиан-Кретчмер О. и соавт. Нейроностатин, кодируемый геном соматостатина, регулирует нейрональные, эндокринные и метаболические функции. Дж. Биол. Хим. 2008б; 283:31949–59. [Бесплатная статья PMC: PMC2581552] [PubMed: 18753129]
Seone LM, Al-Massadi O, Pazoz Y, Pagotto U, Casaneuva F.F. Центральное введение обестатина не влияет ни на спонтанное, ни на индуцированное грелином потребление пищи у крыс. Дж Эндокринол Инвест. 2006;29:RC13–15. [PubMed: 17033253]
Тунхорст Р.Л., Джонсон А.К. Влияние артериального давления на реакцию питья и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 264: R211–7. [PubMed: 8430881]
Тунхорст Р.
 Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]
Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]Рен А. М., Смолл К. Дж., Уорд Х. Л. и др. Новый гипоталамический пептид грелин стимулирует потребление пищи и секрецию гормона роста. Эндокринология. 2000; 141:4325–8. [В паблике: 11089570]
Йостен Г.Л., Самсон В.К. Меланокортины, а не окситоцин, опосредуют анорексигенное и антидипсогенное действие нейроностатина. Пептиды. 2010;31:1711–4. [Бесплатная статья PMC: PMC2935629] [PubMed: 20600426]
Йостен Г.Л., Пейт А.Т., Самсон В.К. Нейроностатин действует в головном мозге, повышая среднее артериальное давление в два этапа за счет симпато-активации с последующей секрецией вазопрессина: роль рецепторов меланокортина. Am J Physiol. 2011;300:R1194–9. [Бесплатная статья PMC: PMC3094032] [PubMed: 21325646]
Чжан Дж.В., Рен П.-Г., Авсиан-Кретчмер О.



 1988;254:R69–74. [PubMed: 3337271]
1988;254:R69–74. [PubMed: 3337271] G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]
G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029] [PubMed: 16931650]
[PubMed: 16931650]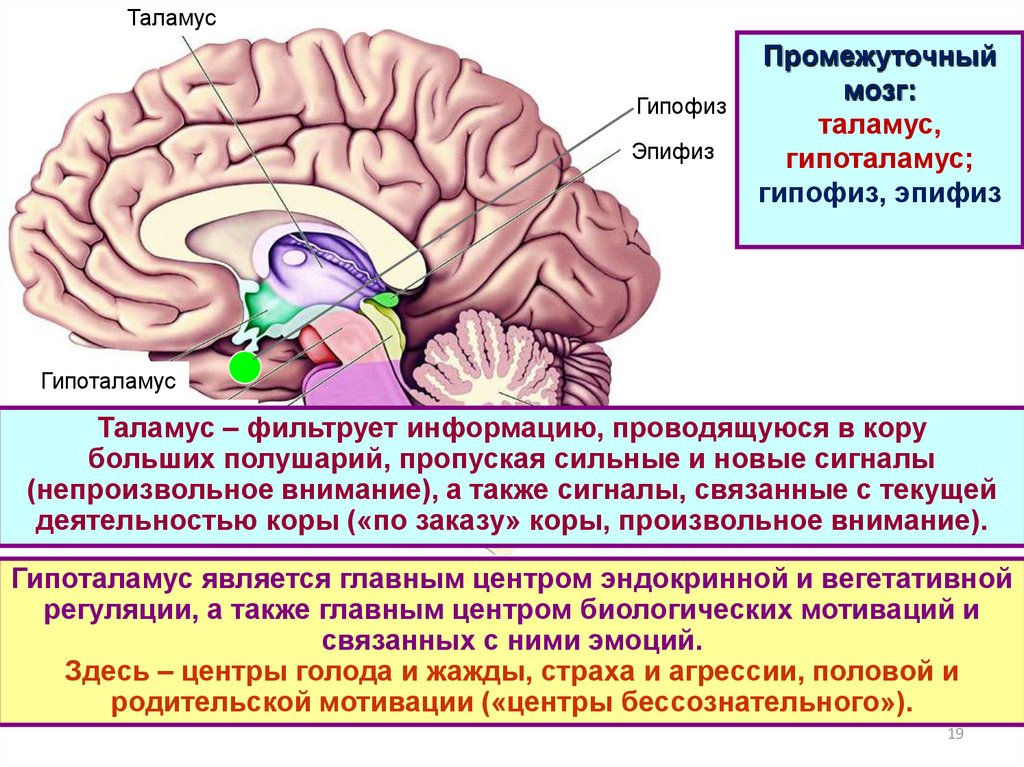 Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]
Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151] и др. Обестатин, пептид, кодируемый геном грелина, препятствует влиянию грелина на прием пищи. Наука. 2005; 310:996–9. [PubMed: 16284174]
и др. Обестатин, пептид, кодируемый геном грелина, препятствует влиянию грелина на прием пищи. Наука. 2005; 310:996–9. [PubMed: 16284174]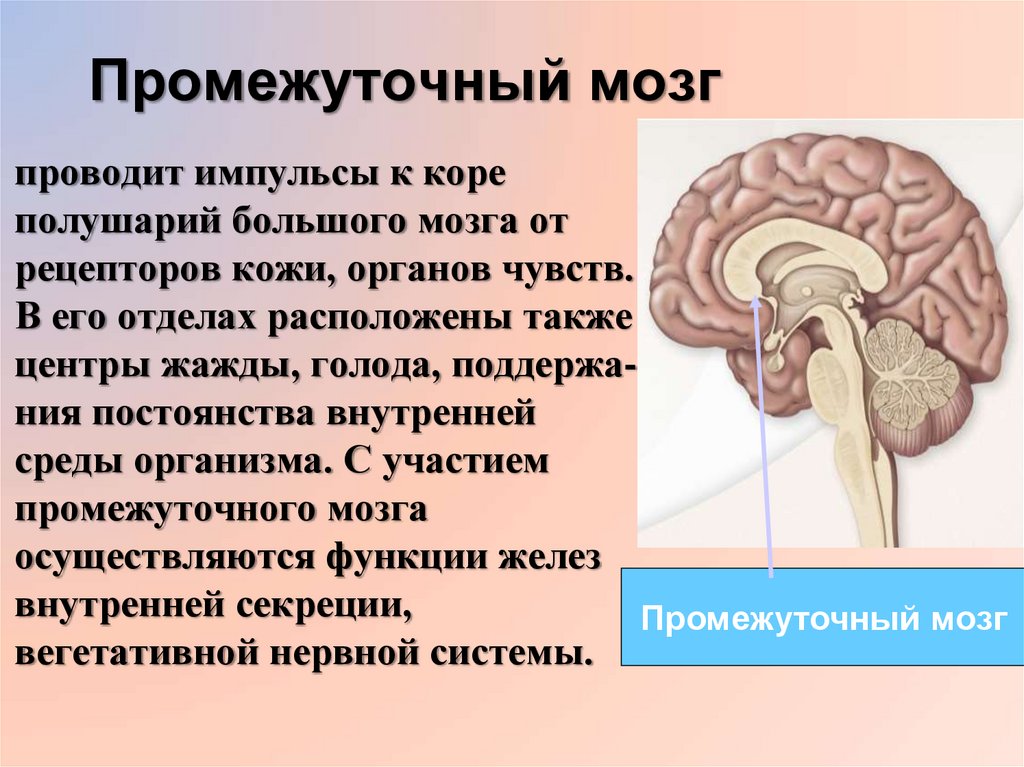 1988;254:R69–74. [PubMed: 3337271]
1988;254:R69–74. [PubMed: 3337271]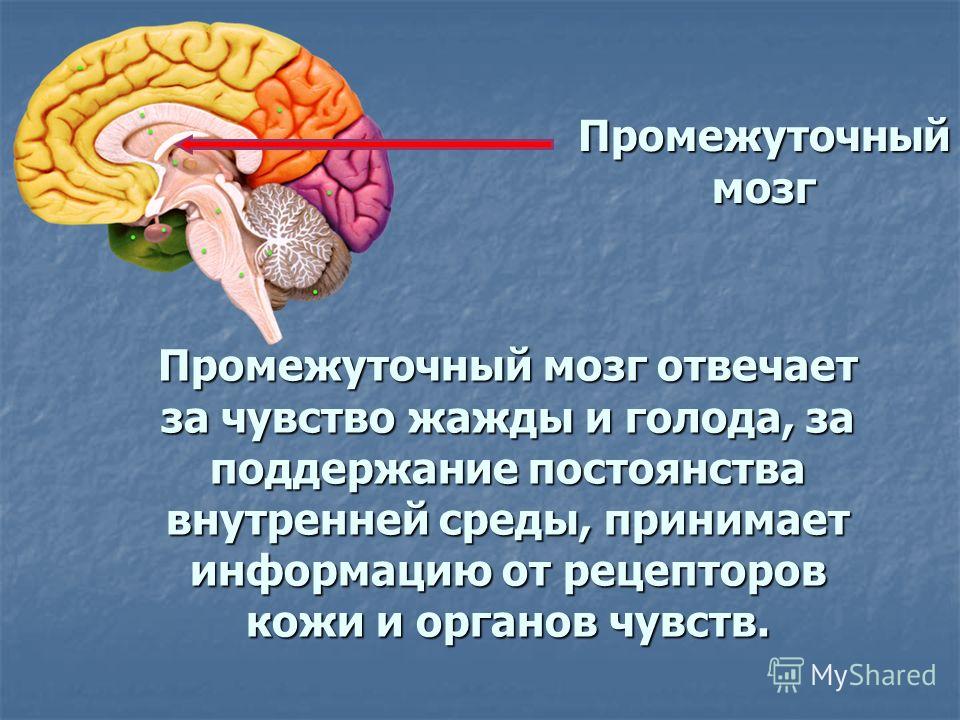 G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]
G, Nowak E.L, Daniels D. Влияние грелина на потребление воды в дипсогенных условиях. Физиол Поведение. 2009;96:37–43. [Бесплатная статья PMC: PMC2635884] [PubMed: 18761029]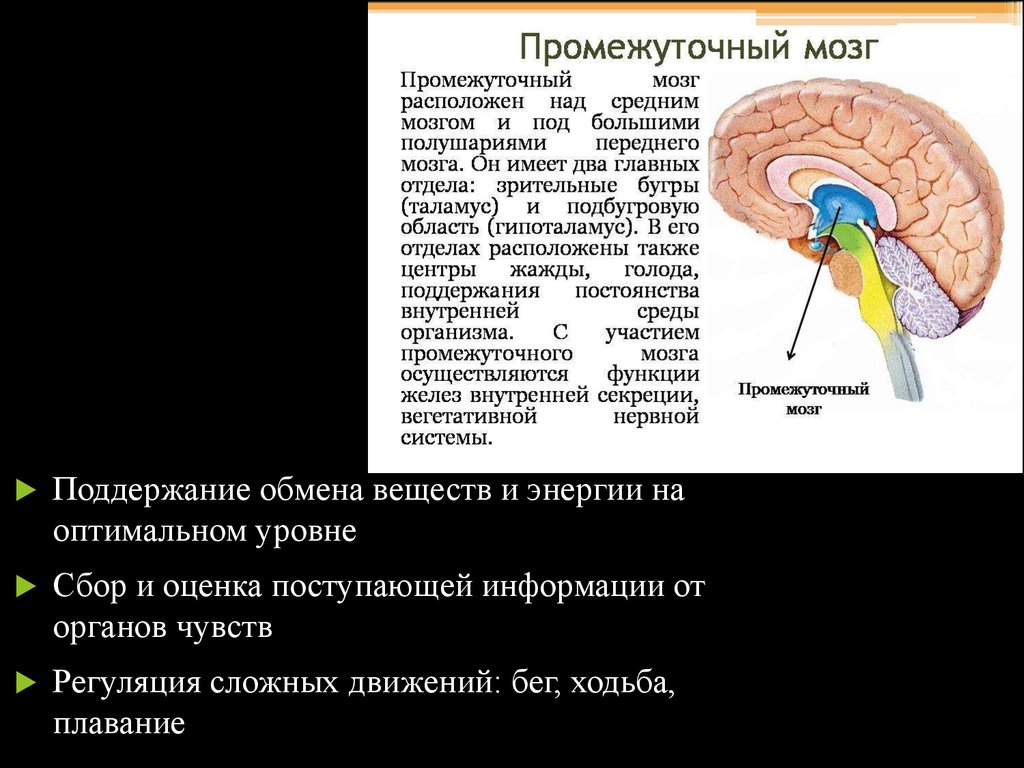 [PubMed: 16931650]
[PubMed: 16931650] Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]
Л., Льюис С.Дж., Джонсон А.К. Роль входа артериальных барорецепторов в реакцию жажды и мочи на интрацеребровентрикулярный ангиотензин II. Am J Physiol. 1993; 265: R591–95. [PubMed: 8214151]
Leave A Comment