Реакция Лебедева
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
формула, механизм реакции. Получение бутадиена
От Masterweb
07.05.2018 22:00
Реакция Лебедева Сергея Васильевича стала отправной точкой в исследованиях способов получения диеновых непредельных углеводородов, которые хорошо применяются до сих пор при создании синтетических каучуков. Данное открытие позволило использовать относительно дешевый и рентабельный метод синтеза искусственной резины для военного и технического назначения, что обеспечило в советские времена выпуск качественной и прочной замены натуральных каучуков.
Принцип реакции
По принципу протекания данный синтез относят к каталитическому пиролизу (термическому разложению), который проходит в присутствии алюмо-цинковых оксидных катализаторов при температуре около 450 °С.
В химии реакция Лебедева примечательна тем, что она проходит в одну стадию, но при этом внутри нее происходит сразу три изменения:
- отщепляется вода;
- отрывается водород;
- происходит присоединение между алкильными остатками.

Синтез неоднократно совершенствовался, применялись новые алюминиевые катализаторы с добавлением солей марганца и других металлов, а также варьировались условия проведения, что позволило снизить энергозатратность при поддержании температуры (360–370 °С) и увеличить степень превращения спирта в ходе реакции (до 50%, выход бутадиена–1,3 составляет 42%).
Реагенты и продукты
В ранних исследованиях С. В. Лебедев прибегал к созданию бутадиена из нефтяных фракций. Однако впоследствии он стал получать данный диен из этилового спирта, полученного путем брожения картофеля. Для получения одной лишь автомобильной шины требовалось переработать до 500 кг картофеля, что, естественно, было экономически невыгодно.
Позже, в период 1926-928 гг., С.В. Лебедев вместе со своей командой из учеников и вольных слушателей усовершенствовал способ получения бутадиена из этилового спирта. Выход диена на момент демонстрации результатов был 22%. Благодаря стараниям, ученые одержали победу на конкурсе, организованном И. В. Сталиным среди сейчас уже бывших стран Советского Союза, по предложениям способов производства синтетического каучука.
В. Сталиным среди сейчас уже бывших стран Советского Союза, по предложениям способов производства синтетического каучука.
Так, теперь в конечном варианте синтеза, в основных продуктах получают бутадиен‒1,3 Ch3=CH‒CH=Ch3, воду h3O и свободный водород h3. Дополнительно могут образоваться некоторые ароматические соединения, этилен, пропилен, бутилены, высшие спирты и ацетальдегид, но в основном уравнении реакции Лебедева формулы этих веществ не указываются. Поскольку этот диен является газообразным веществом, нерастворимым в воде, его от всех других углеводородов отделяют конденсацией, адсорбцией спиртом, отмывкой h3O или же ректификацией.
Механизм реакции
В синтезе при расщеплении (разложении) 2 молекул этилового спирта, благодаря дегидратирующе-дегидрирующим катализаторам, от них отрываются 2 молекулы воды и 1 молекула газообразного водорода. Согласно механизму реакции Лебедева, алкильные остатки присоединяются друг другу, образуя две непредельные сопряженные двойные связи в 1,3–положениях (пример 1).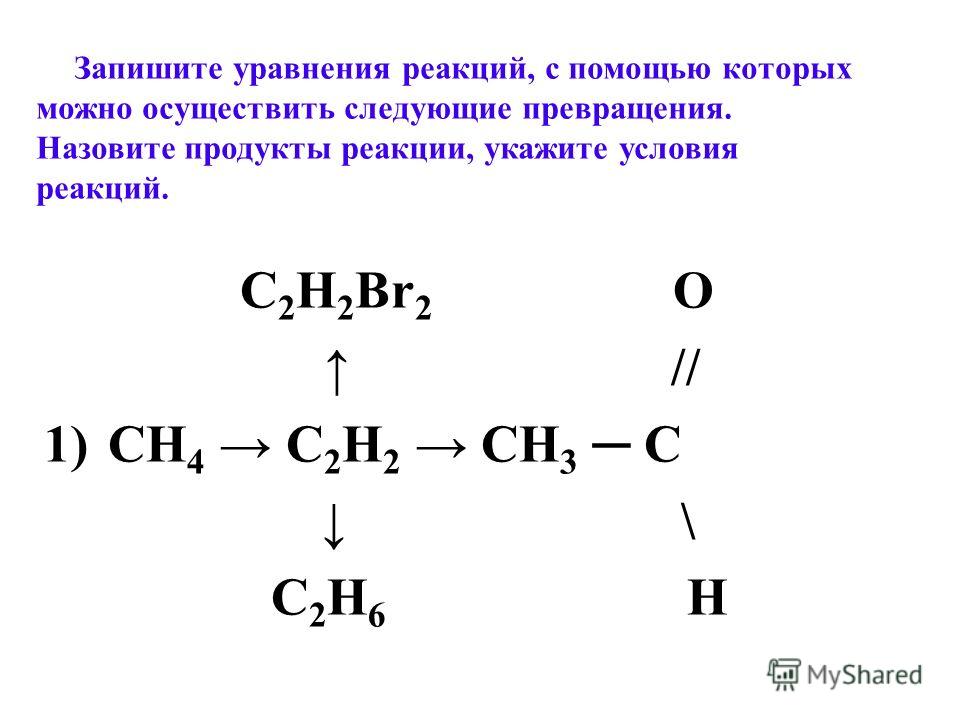
Использование в промышленности
После триумфальной победы на международном конкурсе ученому дали возможность осуществить производство синтетического каучука в промышленном масштабе. Так как получение бутадиена по реакции Лебедева было признано очень ценным, его профинансировали, и в 1930 году в Ленинграде был построен опытный завод «Литер «Б»», который вплоть до 1990 года занимал первое место в мире по производству искусственного каучука. На базе этого предприятия впоследствии был создан Всесоюзный научно-исследовательский институт синтетического каучука, который продолжает заниматься изучением полимерных соединений.
Дальнейшее изучение
Открытия С. В. Лебедева послужили началом изучения свойств диеновых углеводородов, благодаря которым был открыт так называемый «диеновый синтез». Существуют три версии, по которым он в ходе научной деятельности изучил реакцию димеризации диенов. Первая предполагает, что в результате синтеза ученый получил димер циклопентадиена. Вторая версия говорит о димеризации изопрена с получением дипентена. А третья описывает получение винилциклогексена из двух молекул бутадиена‒1,3. Во всяком случае этот синтез лег в основу дальнейшего изучения свойств сопряженных диенов, которые развивали Отто Дильс и Курт Адлер, удостоенные Нобелевской премии в 1950 году.
Вторая версия говорит о димеризации изопрена с получением дипентена. А третья описывает получение винилциклогексена из двух молекул бутадиена‒1,3. Во всяком случае этот синтез лег в основу дальнейшего изучения свойств сопряженных диенов, которые развивали Отто Дильс и Курт Адлер, удостоенные Нобелевской премии в 1950 году.
Диеновый синтез
Реакция Дильса-Адлера позволила получать циклосоединения по довольно простым механизмам, не прибегая к сложным многостадийным реакциям. Суть реакции сводится к взаимодействию сопряженного диена и диенофила, который может быть представлен алкенами и алкинами с электроакцепторными заместителями, а также соединениями, содержащими двойные связи с гетероатомом, например –C=O, ‒C=N и др. В результате образуется циклический углеводород, поэтому эту реакцию еще называют «циклоприсоединением».
Синтез по Дильсу-Адлеру может проходить в присутствии кислот Льюиса, которые значительно ускоряют ход реакции и чаще всего способствуют хорошему выходу основного продукта, а также влияет на образование энантиомеров и цис-/транс- изомерии.
Примером такой реакции без катализатора может служить присоединение бутадиена–1,3 к пара-бензохинону в среде бензола при температуре 35 °С, в результате которого выход продукта достигает 100%. Синтез проходит с переходом протонов водорода между углеродными атомами для образования второго цикла и создания прочного соединения. В конце реакции образуется производное 1,4–нафтохинона, который может дальше реагировать с бутадиеном‒1,3 при 100 °С с образованием цикла на противоположной стороне. Из конечного продукта реакции путем дегидрирования можно получить антрахинон, производные которого используются в качестве красителей, например ализарин.
А примером каталитического синтеза может являться реакция 1,4–дифенилбутадиена с β-нитростиролом, где в присутствии кислоты Льюиса образуется только эндо-нитроаддукт (пример 2). Без участия катализатора эта реакция проходит с образованием эндо-нитросоединения и эндо-дифениловых продуктов в соотношении 1:1 (пример 3).
Такие реакции подтверждают целесообразность использования каталитически активных веществ в диеновом синтезе, так как они существенно ускоряют процесс и значительно влияют на регио- (орто-, пара- и мета-положения) и стереоселективность (оптические и эндо-/экзо-положения заместителей).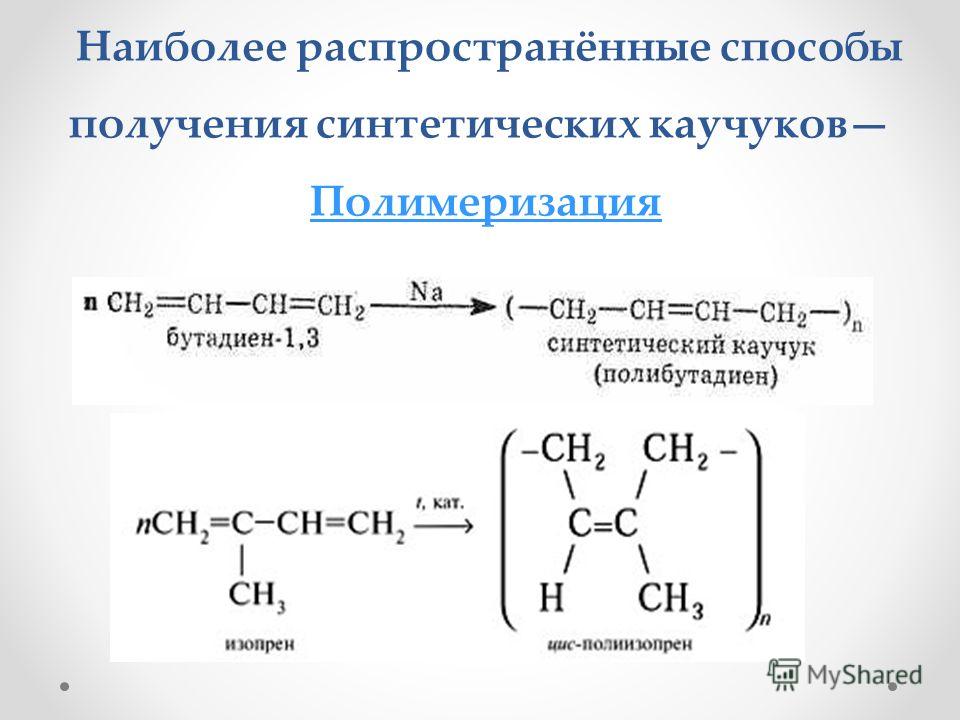
Важность термической обработки кремний-магниевого катализатора влажного замешивания и процесс превращения этанола в бутадиен по Лебедеву
1. Bruijnincx PCA, Weckhuysen B.M. Сланцевая революция: возможность для производства химикатов на биологической основе? Ангью. Чеми Инт. Эд. 2013;52:11980–11987. doi: 10.1002/anie.201305058. [PubMed] [CrossRef] [Google Scholar]
2. Angelici C., Weckhuysen B.M., Bruijnincx PCA. Хемокаталитическая конверсия этанола в бутадиен и другие сыпучие химикаты. ХимСусХим. 2013;6:1595–1614. doi: 10.1002/cssc.201300214. [PubMed] [CrossRef] [Google Scholar]
3. Чеспи Д., Пассарини Ф., Вассура И., Кавани Ф. Бутадиен из биомассы, перспектива жизненного цикла для обеспечения устойчивости в химической промышленности. Зеленый хим. 2016;18:1625–1638. doi: 10.1039/C5GC02148K. [CrossRef] [Google Scholar]
4. Макшина Е.В., Дюсселье М., Янссенс В., Дегрев Дж., Якобс П.А., Селс Б.Ф. Обзор старой химии и новых каталитических достижений в целевом синтезе бутадиена. хим. соц. Ред. 2014; 43:7917–7953. doi: 10.1039/C4CS00105B. [PubMed] [CrossRef] [Google Scholar]
хим. соц. Ред. 2014; 43:7917–7953. doi: 10.1039/C4CS00105B. [PubMed] [CrossRef] [Google Scholar]
5. Shylesh S., Gokhale A.A., Scown C.D., Kim D., Ho C.R., Bell A.T. От сахаров к колесам: преобразование этанола в 1,3-бутадиен на магнезиально-силикатных катализаторах, промотированных металлом. ХимСусХим. 2016; 9: 1462–1472. doi: 10.1002/cssc.201600195. [PubMed] [CrossRef] [Google Scholar]
6. Pomalaza G., Arango Ponton P., Capron M., Dumeignil F. Преобразование этанола в бутадиен: реакция и ее катализаторы. Катал. науч. Технол. 2020;10:4860–4911. doi: 10.1039/D0CY00784F. [CrossRef] [Google Scholar]
7. Шарма Б., Ларрош К., Дюссап К.-Г. Комплексная оценка производства биоэтанола 2G. Биоресурс. Технол. 2020;313:123630. doi: 10.1016/j.biortech.2020.123630. [PubMed] [CrossRef] [Google Scholar]
8. Quattlebaum W.M., Toussaint W.J., Dunn J.T. Деоксигенация некоторых альдегидов и кетонов: получение бутадиена и стирола. Варенье. хим. соц. 1947; 69: 593–599. doi: 10. 1021/ja01195a040. [Перекрестная ссылка] [Академия Google]
1021/ja01195a040. [Перекрестная ссылка] [Академия Google]
9. Кириенко П.И., Ларина О.В., Соловьев С.О., Орлик С.М., Калерс С., Двигай С. Конверсия этанола в 1,3-бутадиен по методу Лебедева на цеолитах MTaSiBEA (M = Ag, Cu, Zn) ACS Sustain. хим. англ. 2017;5:2075–2083. doi: 10.1021/acssuschemeng.6b01728. [CrossRef] [Google Scholar]
10. Yan T., Dai W., Wu G., Lang S., Hunger M., Guan N., Li L. Mechanistic Insights of One Step Catalytic Conversion of Ethanol to Butadiene на бифункциональном Zn-Y/бета-цеолите. Катал. 2018; 8: 2760–2773. doi: 10.1021/acscatal.8b00014. [Перекрестная ссылка] [Академия Google]
11. Taifan W.E., Li Y., Baltrus J.P., Zhang L., Frenkel A.I., Baltrusaitis J. Определение структуры Cu и Zn на нанесенных катализаторах MgO/SiO2 в процессе превращения этанола в 1,3-бутадиен. Катал. 2019;9:269–285. doi: 10.1021/acscatal.8b03515. [CrossRef] [Google Scholar]
12. Кабельо Гонсалес Г.М., Консепсьон П., Вильянуэва Пералес А.Л., Мартинес А., Кампой М. , Видаль-Барреро Ф. Преобразование этанола в 1,3-бутадиен на смешанном Hf-Zn катализатор: влияние условий реакции и содержания воды в этаноле. Топливный процесс. Технол. 2019;193:263–272. doi: 10.1016/j.fuproc.2019.04.036. [CrossRef] [Google Scholar]
, Видаль-Барреро Ф. Преобразование этанола в 1,3-бутадиен на смешанном Hf-Zn катализатор: влияние условий реакции и содержания воды в этаноле. Топливный процесс. Технол. 2019;193:263–272. doi: 10.1016/j.fuproc.2019.04.036. [CrossRef] [Google Scholar]
13. Очоа Дж. В., Мальмузи А., Рекки К., Кавани Ф. Понимание роли галлия как промотора магниево-силикатных катализаторов для превращения этанола в бутадиен. ChemCatChem. 2017;9:2128–2135. doi: 10.1002/cctc.201601630. [CrossRef] [Google Scholar]
14. Angelici C., Velthoen M.E.Z., Weckhuysen B.M., Bruijnincx PCA. Влияние способа приготовления и промотирования CuO на превращение этанола в 1,3-бутадиен на катализаторах SiO2-MgO. ХимСусХим. 2014: 1–12. doi: 10.1002/cssc.201402361. [PubMed] [CrossRef] [Академия Google]
15. Angelici C., Velthoen M.E.Z., Weckhuysen B.M., Bruijnincx P.C.A. Влияние кислотно-основных свойств на процесс превращения этанола в бутадиен по Лебедеву, катализируемый материалами SiO2–MgO. Катал. науч. Технол. 2015;5:2869–2879. doi: 10.1039/C5CY00200A. [CrossRef] [Google Scholar]
Технол. 2015;5:2869–2879. doi: 10.1039/C5CY00200A. [CrossRef] [Google Scholar]
16. Taifan W.E., Bučko T., Baltrusaitis J. Каталитическая конверсия этанола в 1,3-бутадиен на MgO: всестороннее объяснение механизма с использованием расчетов DFT. Дж. Катал. 2017; 346:78–91. doi: 10.1016/j.jcat.2016.11.042. [Перекрестная ссылка] [Академия Google]
17. Абдулраззак Х.Т., Рахмани Чоканлу А., Фредерик Б.Г., Шварц Т.Дж. Анализ кинетики реакции дегидрирования этанола, катализируемого MgO–SiO 2 . Катал. 2020;10:6318–6331. doi: 10.1021/acscatal.0c00811. [CrossRef] [Google Scholar]
18. Натта Г., Ригамонти Р. Студия рентгенографии и химии катализаторов, использующих производство бутадиена и спирта. Чим. Инд., 1947; 29:239–243. [Google Scholar]
19. Chung S.-H., Angelici C., Hinterding S.O.M., Weingarth M., Baldus M., Houben K., Weckhuysen B.M., Bruijnincx P.C.A. Роль силикатов магния в кремний-магнезиальных катализаторах влажного смешения для процесса превращения этанола в бутадиен по Лебедеву. Катал. 2016;6:4034–4045. doi: 10.1021/acscatal.5b02972. [CrossRef] [Google Scholar]
Катал. 2016;6:4034–4045. doi: 10.1021/acscatal.5b02972. [CrossRef] [Google Scholar]
20. Janssens W., Makshina E.V., Vanelderen P., De Clippel F., Houthoofd K., Kerkhofs S., Martens J.A., Jacobs P.A., Sels B.F. Ternary Ag/MgO- Катализаторы SiO2 для превращения этанола в бутадиен. ХимСусХим. 2015; 8: 994–1008. doi: 10.1002/cssc.201402894. [PubMed] [CrossRef] [Google Scholar]
21. Веласкес Очоа Дж., Бандинелли К., Вознюк О., Чиерегато А., Мальмузи А., Рекки К., Кавани Ф. Анализ химических, физических и Особенности реакционной способности MgO-SiO2-катализаторов синтеза бутадиена по процессу Лебедева. Зеленый хим. 2016;18:1653–1663. дои: 10.1039/C5GC02194D. [CrossRef] [Google Scholar]
22. Ван Россум Б.-Дж., Фёрстер Х., де Гроот Х.Дж.М. Высокопольная и высокоскоростная гетероядерная диполярно-корреляционная спектроскопия ЯМР CP-MAS13C твердых тел с гомоядерной развязкой Ли-Голдбурга с переключением частоты. Дж. Магн. Резон. 1997; 124: 516–519. doi: 10.1006/jmre.1996. 1089. [CrossRef] [Google Scholar]
1089. [CrossRef] [Google Scholar]
23. Li S., Men Y., Wang J., Liu S., Wang X., Ji F., Chai S., Song Q. Морфологический контроль инвертированного MgO-SiO 2 Композитные катализаторы для эффективной конверсии этанола в 1,3-бутадиен. заявл. Катал. Ген. 2019;577:1–9. doi: 10.1016/j.apcata.2019.03.007. [CrossRef] [Google Scholar]
24. Ван Акен П.А., Лангенхорст Ф. Нанокристаллические пористые агрегаты периклаза как продукт дегидратации брусита. Евро. Дж. Минерал. 2001; 13: 329–341. doi: 10.1127/0935-1221/01/0013-0329. [CrossRef] [Google Scholar]
25. Ball M.C., Taylor H.F.W. Дегидратация брусита. Минеральная. Маг. Дж. Минерал. соц. 1961; 32: 754–766. doi: 10.1180/minmag.1961.032.253.02. [CrossRef] [Google Scholar]
26. Ямагучи Г., Токуда Т. Электронно-микроскопическое исследование дегидратации брусита и рекристаллизации периклаза при дальнейшем нагревании. Бык. хим. соц. Япония. 1964;37:399–403. doi: 10.1246/bcsj.37.399. [CrossRef] [Google Scholar]
27. Sing K.S.W., Everett D.H., Haul R.A.W., Moscou L., Pierotti R.A., Rouquerol J., Siemeniewska T. Представление данных по физикосорбции для газовых/твердых систем со специальной ссылкой на определение поверхности площадь и пористость. Чистое приложение хим. 1985; 57: 603–619. doi: 10.1351/pac198557040603. [CrossRef] [Google Scholar]
Sing K.S.W., Everett D.H., Haul R.A.W., Moscou L., Pierotti R.A., Rouquerol J., Siemeniewska T. Представление данных по физикосорбции для газовых/твердых систем со специальной ссылкой на определение поверхности площадь и пористость. Чистое приложение хим. 1985; 57: 603–619. doi: 10.1351/pac198557040603. [CrossRef] [Google Scholar]
28. Ким Х.Н., Ли С.К. Атомная структура и механизм дегидратации аморфного кремнезема: выводы из 29 Si и 1 H твердотельный MAS ЯМР-исследование наночастиц SiO2. Геохим. Космохим. Акта. 2013; 120:39–64. doi: 10.1016/j.gca.2013.05.047. [CrossRef] [Google Scholar]
29. Сорте Э.Г., Римша Дж.М., Алам Т.М. Расчетное и экспериментальное исследование 1H-ЯМР гидратированных минералов на основе Mg. Молекулы. 2020;25:933. doi: 10,3390/молекулы25040933. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Дюма А., Мартин Ф., Ле Ру С., Мику П., Пети С., Ферраж Э., Брендле Дж., Грауби О. ., Гринхилл-Хупер М. Синтез филлосиликатов: способ получения доступа к краевым вкладам в спектроскопии ЯМР и ИК-Фурье. Пример синтетического талька. физ. хим. Шахтер. 2013;40:361–373. дои: 10.1007/s00269-013-0577-5. [CrossRef] [Google Scholar]
Пример синтетического талька. физ. хим. Шахтер. 2013;40:361–373. дои: 10.1007/s00269-013-0577-5. [CrossRef] [Google Scholar]
31. Филлипс Б.Л., Бернли П.С., Вормингхаус К., Навроцкий А. Спектроскопия 29 Si и 1 H ЯМР гидросиликатов магния под высоким давлением. физ. хим. Шахтер. 1997; 24: 179–190. doi: 10.1007/s0026031. [CrossRef] [Google Scholar]
32. Grüninger H., Liu Z., Brauckmann J.O., Fei H., Ballaran T.B., Martin T., Siegel R., Kentgens A.P.M., Frost D.J., Senker J. Гидроксильные дефекты и оксиды Вакансии в Ringwoodite — к пониманию химии дефектов оксидов типа шпинели. Дж. Физ. хим. К. 2020; 124:12001–12009. doi: 10.1021/acs.jpcc.0c03016. [CrossRef] [Google Scholar]
33. Ву С., Пэн Ю.-К., Чен Т.-Ю., Мо Дж., Лардж А., Макферсон И., Чжоу Х.-Л., Уилкинсон И. ., Вентурини Ф., Гринтер Д. и др. Удаление отравления водородом с помощью электростатически полярного носителя MgO для синтеза Nh4 при низком давлении с высокой скоростью на катализаторе Ru. Катал. 2020;10:5614–5622.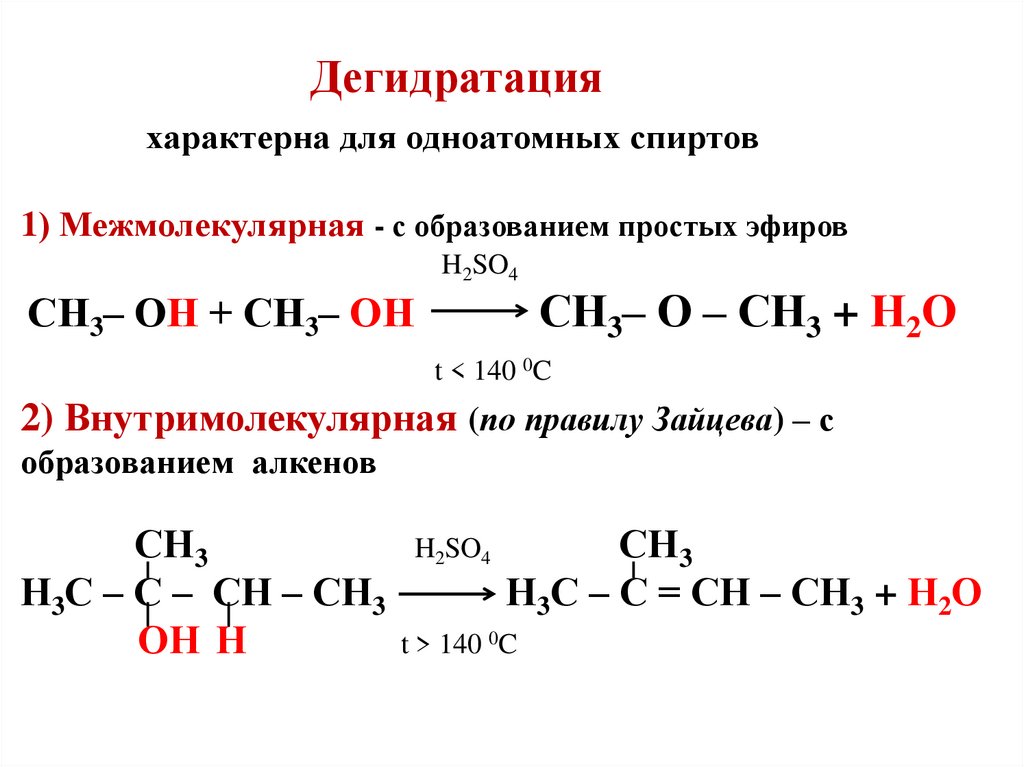 doi: 10.1021/acscatal.0c00954. [CrossRef] [Google Scholar]
doi: 10.1021/acscatal.0c00954. [CrossRef] [Google Scholar]
34. Нисидзава Дж., Икеда-Фуказава Т. Структуры поверхности и свойства форстерита в кристаллическом и стекловидном состояниях. хим. физ. лат. 2019;714:197–201. doi: 10.1016/j.cplett.2018.11.014. [CrossRef] [Google Scholar]
35. Лю Т., Гаутам С., Ван Х.-В., Ановиц Л.М., Мамонтов Э., Аллард Л.Ф., Коул Д.Р. Структура и динамика воды на поверхности форстерита. физ. хим. хим. физ. 2018;20:27822–27829. doi: 10.1039/C8CP05075A. [PubMed] [CrossRef] [Google Scholar]
36. Poirier M., Millot Y., Silva Gomes E., Jaber M., Herledan V., Laugel G., Micoud P., Martin F., Lauron-Pernot Х., Тулхоат Х. Комплементарность теории функционала плотности и инструментов ядерного магнитного резонанса для исследования химии и морфологии поверхности нанослоистых силикатов. Дж. Физ. хим. К. 2020; 124: 267–286. doi: 10.1021/acs.jpcc.9б05903. [CrossRef] [Google Scholar]
37. Темуджин Дж., Окада К., Маккензи К.Дж.Д. Роль воды в механохимических реакциях систем MgO–SiO2. J. Химия твердого тела. 1998; 138:169–177. doi: 10.1006/jssc.1998.7768. [CrossRef] [Google Scholar]
J. Химия твердого тела. 1998; 138:169–177. doi: 10.1006/jssc.1998.7768. [CrossRef] [Google Scholar]
38. Д’Эспиноз де ла Кайлери Ж.-Б., Кермарек М., Клаус О., де ла Кайлери Э., Кермарек М., Клаус О. Наблюдение ЯМР 29Si аморфного Силикат магния, образующийся при пропитке кремнезема Mg(I1) в водном растворе. Дж. Физ. хим. 1995;99:17273–17281. doi: 10.1021/j100047a036. [CrossRef] [Google Scholar]
39. Chen L., Ye G., Zhou W., Dijkmans J., Sels B., Malfliet A., Guo M. Влияние предшественников MgO на механически активированный синтез форстерита. Керам. Междунар. 2015;41:12651–12657. doi: 10.1016/j.ceramint.2015.06.096. [CrossRef] [Google Scholar]
40. Walling S.A., Kinoshita H., Bernal S.A., Collier N.C., Provis J.L. Структура и свойства связующих гелей, образующихся в системе Mg(OH)2–SiO2–h3O для иммобилизации шлама Magnox . Дальт. Транс. 2015;44:8126–8137. дои: 10.1039/C5DT00877H. [PubMed] [CrossRef] [Google Scholar]
41. Davis M.C., Brouwer W.J., Wesolowski D. J., Anovitz L.M., Lipton A.S., Mueller K.T. Растворение силиката магния исследовано методами 29Si MAS, 1H-29Si CPMAS, 25Mg QCPMG и 1H-25Mg CP QCPMG ЯМР. физ. хим. хим. физ. 2009;11:7013. doi: 10.1039/b907494e. [PubMed] [CrossRef] [Google Scholar]
J., Anovitz L.M., Lipton A.S., Mueller K.T. Растворение силиката магния исследовано методами 29Si MAS, 1H-29Si CPMAS, 25Mg QCPMG и 1H-25Mg CP QCPMG ЯМР. физ. хим. хим. физ. 2009;11:7013. doi: 10.1039/b907494e. [PubMed] [CrossRef] [Google Scholar]
42. Шаброль К., Грессье М., Пебере Н., Меню М.-Дж., Мартин Ф., Бонино Дж.-П., Маричал К., Брендл Дж. , Функционализация синтетических талькоподобных филлосиликатов путем прививки алкоксиорганосилана. Дж. Матер. хим. 2010;20:9695. doi: 10.1039/c0jm01276a. [CrossRef] [Google Scholar]
43. MacKenzie K.J.D., Bradley S., Hanna J.V., Smith M.E. Магниевые аналоги алюмосиликатных неорганических полимеров (геополимеров) из минералов магния. Дж. Матер. науч. 2013; 48: 1787–1793. doi: 10.1007/s10853-012-6940-y. [CrossRef] [Google Scholar]
44. Bernard E., Lothenbach B., Chlique C., Wyrzykowski M., Dauzères A., Pochard I., Cau-Dit-Coumes C. Характеристика гидрата силиката магния (M-S-H) Цем. Конкр. Рез. 2019;116:309–330. doi: 10.1016/j. cemconres.2018.09.007. [CrossRef] [Google Scholar]
cemconres.2018.09.007. [CrossRef] [Google Scholar]
45. Маги М., Липпмаа Э., Самосон А., Энгельхардт Г., Гриммер А.Р. Твердотельные химические сдвиги кремния-29 с высоким разрешением в силикатах. Дж. Физ. хим. 1984; 88: 1518–1522. doi: 10.1021/j150652a015. [CrossRef] [Google Scholar]
46. Стеббинс Дж.Ф., Панеро В.Р., Смит Дж.Р., Фрост Д.Дж. Форстерит, вадслеит и рингвудит (Mg2SiO4): ограничения ЯМР 29Si на структурный беспорядок и влияние парамагнитных примесных ионов. Являюсь. Минеральная. 2009 г.;94:626–629. doi: 10.2138/am.2009.3140. [CrossRef] [Google Scholar]
47. Сабо Б., Новодарски Г., Пасти З., Домьян А., Валион Дж., Ханчок Дж., Бартос Р. Катализаторы MgO-SiO2 для реакции этанола в бутадиен: Эффект промоторов кислоты Льюиса. ChemCatChem. 2020;12:5686–5696. doi: 10.1002/cctc.202001007. [CrossRef] [Google Scholar]
48. Chabanas M., Quadrelli E.A., Fenet B., Copéret C., Thivolle-Cazat J., Basset J.-M., Lesage A., Emsley L. Molecular Insight Into Surface Металлоорганическая химия с помощью комбинированного использования твердотельной ЯМР-спектроскопии 2D HETCOR и аналогов силсесквиоксана. Ангью. Чеми Инт. Эд. 2001;40:4493. doi: 10.1002/1521-3773(20011203)40:23<4493::AID-ANIE4493>3.0.CO;2-X. [PubMed] [CrossRef] [Google Scholar]
Ангью. Чеми Инт. Эд. 2001;40:4493. doi: 10.1002/1521-3773(20011203)40:23<4493::AID-ANIE4493>3.0.CO;2-X. [PubMed] [CrossRef] [Google Scholar]
49. Квисле С., Агуэро А., Сниден Р.П.А. Превращение этанола в 1,3-бутадиен на катализаторах оксид магния/диоксид кремния. заявл. Катал. 1988; 43: 117–131. doi: 10.1016/S0166-9834(00)80905-7. [CrossRef] [Google Scholar]
50. Ларина О.В., Кириенко П.И., Трачевский В.В., Власенко Н.В., Соловьев С.О. Влияние механохимической обработки на кислотные и каталитические свойства композиции MgO-SiO2 при конверсии этанола в 1,3-бутадиен. Теор. Эксп. хим. 2016; 51: 387–393. doi: 10.1007/s11237-016-9440-3. [CrossRef] [Google Scholar]
51. Zhu Q., Wang B., Tan T. Превращение этанола и ацетальдегида в бутадиен на MgO-SiO 2 Катализаторы: влияние параметров реакции и взаимодействие между MgO и SiO 2 по каталитическим характеристикам. ACS Sustain. хим. англ. 2017;5:722–733. doi: 10.1021/acssuschemeng.6b02060. [CrossRef] [Google Scholar]
52. Taifan W.E., Baltrusaitis J. In situ Spectroscopic Insights on the Molecular Structure of MgO/SiO 2 Каталитические активные центры при превращении этанола в 1,3-бутадиен. Дж. Физ. хим. C. 2018; 122:20894–20906. doi: 10.1021/acs.jpcc.8b06767. [CrossRef] [Google Scholar]
Taifan W.E., Baltrusaitis J. In situ Spectroscopic Insights on the Molecular Structure of MgO/SiO 2 Каталитические активные центры при превращении этанола в 1,3-бутадиен. Дж. Физ. хим. C. 2018; 122:20894–20906. doi: 10.1021/acs.jpcc.8b06767. [CrossRef] [Google Scholar]
53. Канезаши М., Ямамото А., Йошиока Т., Цуру Т. Характеристики проникновения аммиака через пористые кварцевые мембраны. Айше Дж. 2009; 59:1204–1212. doi: 10.1002/aic.12059. [CrossRef] [Google Scholar]
54. Bräuer P., Ng P.L., Situmorang O., Hitchcock I., D’Agostino C. Влияние содержания Al на количество и расположение видов гидроксильных кислот в цеолитах: количественный протокол DRIFTS. без необходимости молярных коэффициентов экстинкции. RSC Adv. 2017;7:52604–52613. дои: 10.1039/C7RA10699H. [CrossRef] [Google Scholar]
55. Карминьяно О., Виейра С., Брандао П.Р., Бертоли А., Лаго Р. Серпентиниты: структура минералов, свойства и технологические применения. Дж. Браз. хим. соц. 2020; 31: 2–14. doi: 10.21577/0103-5053.201
doi: 10.21577/0103-5053.201
56. Лайне М., Балан Э., Аллард Т., Пено Э., Женесс П., Мостафави М., Роберт Дж.-Л., Ле Каер С. Механизмы реакции при набухании глины под действием ионизирующего излучения: влияние количества воды и природы глинистого минерала. RSC Adv. 2017; 7: 526–534. дои: 10.1039/C6RA24861F. [CrossRef] [Google Scholar]
57. Huang X., Men Y., Wang J., An W., Wang Y. Высокоактивные и селективные бинарные MgO–SiO 2 катализаторы для получения 1,3- бутадиена из этанола. Катал. науч. Технол. 2017;7:168–180. doi: 10.1039/C6CY02091G. [CrossRef] [Google Scholar]
58. Yang J., Zhao Q., Xu H., Li L., Dong J., Li J. Адсорбция CO 2 , CH 4 и N 2 на ионообменных мелкопористых цеолитах класса диаметра газа. Дж. Хим. англ. Данные. 2012;57:3701–3709. дои: 10.1021/je300940m. [CrossRef] [Google Scholar]
59. Сато К., Хангер М. Адсорбция углекислого газа в открытых нанопространствах, образованных перекрытием нанолистов сапонитовой глины. коммун. хим. 2020;3:91. doi: 10.1038/s42004-020-00346-5. [CrossRef] [Google Scholar]
коммун. хим. 2020;3:91. doi: 10.1038/s42004-020-00346-5. [CrossRef] [Google Scholar]
Сергей Васильевич Лебедев | Русский химик
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- В этот день в истории
- Викторины
- Подкасты
- Словарь
- Биографии
- Резюме
- Популярные вопросы
- Обзор недели
- Инфографика
- Демистификация
- Списки
- #WTFact
- Товарищи
- Галереи изображений
- Прожектор
- Форум
- Один хороший факт
- Развлечения и поп-культура
- География и путешествия
- Здоровье и медицина
- Образ жизни и социальные вопросы
- Литература
- Философия и религия
- Политика, право и правительство
- Наука
- Спорт и отдых
- Технология
- Изобразительное искусство
- Всемирная история
- Britannica объясняет
В этих видеороликах Britannica объясняет различные темы и отвечает на часто задаваемые вопросы.
- Britannica Classics
Посмотрите эти ретро-видео из архивов Encyclopedia Britannica. - #WTFact Видео
В #WTFact Britannica делится некоторыми из самых странных фактов, которые мы можем найти. - На этот раз в истории
В этих видеороликах узнайте, что произошло в этом месяце (или любом другом месяце!) в истории. - Demystified Videos
В Demystified у Britannica есть все ответы на ваши животрепещущие вопросы.
- Студенческий портал
Britannica — это лучший ресурс для учащихся по ключевым школьным предметам, таким как история, государственное управление, литература и многое другое. - Портал COVID-19
Хотя этот глобальный кризис в области здравоохранения продолжает развиваться, может быть полезно обратиться к прошлым пандемиям, чтобы лучше понять, как реагировать сегодня. - 100 женщин
Britannica празднует столетие Девятнадцатой поправки, выделяя суфражисток и политиков, творящих историю.




Leave A Comment