Готовимся к ЕГЭ по химии
Задание 27( ЕГЭ,11 класс)
1.Вычислите массу нитрата калия (в граммах), которую следует растворить в 150,0 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%.
Ответ:___________________ г. (Запишите число с точностью до десятых.)(3,4 г.)
2.Смешали 80 г раствора с массовой долей нитрата натрия 25 % и 20 г раствора этой же соли с массовой долей 40 %. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.(28 г.)
3. Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11 %-ного раствора с 3 кг 15 %-ного раствора соли. Ответ дайте в процентах с точностью до целых.(14%)
4. Смешали 200 г 11 %-ного раствора нашатыря и 350 г 17 %-ного раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.(14,8%)
5. Упариванием 500 г раствора с массовой долей соли 10 % получен раствор с массовой долей соли 14 %. Вычислите массу выпаренной при этом воды. Ответ укажите в граммах с точностью до целых.(143г.)
6. Вычислите массу едкого натра, который следует растворить в 300 г 5 %-ного раствора для получения 10 %-ного раствора. Ответ укажите в граммах с точностью до десятых.(16,7 г.)
7. К 250 г 10%-ного раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Вычислите массовую долю нитрата натрия в полученном растворе. Ответ дайте в процентах с точностью до десятых.(11,3 г.)
8. К 200 г 5%-ного раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды. Вычислите массовую долю хлорида аммония в полученном растворе. Ответ дайте в процентах с точностью до целых.(11%)
9. К 250 г 20 %-ной серной кислоты добавили 50 мл 60 %-ной кислоты (плотностью 1,6 г/мл). Вычислите массовую долю кислоты в полученном растворе. Ответ дайте в процентах с точностью до целых.(30%)
10. Вычислите массу уксусной кислоты в растворе, полученном при смешивании 155 г 5 %-ного и 207 г 11 %-ного растворов кислоты. Ответ дайте в граммах с точностью до десятых.(30,5г.)
Ответ дайте в граммах с точностью до десятых.(30,5г.)
11. Вычислите массу воды, которую следует добавить к 300 г 22 %-ного раствора уксусной кислоты, чтобы получить 9 %-ный раствор. Ответ дайте в граммах с точностью до целых.(433 г.)
12. При упаривании 300 г 5 %-ного раствора сахарозы получены 245 г раствора. Вычислите массовую долю сахарозы в нём. Ответ дайте в процентах с точностью до целых.(6%)
13. Из 400 г горячего 50 %-ного раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до десятых.(37,5)
Массовая доля — презентация онлайн
Похимичим!Казань, 2019
Мы счастливы!
ЕГЭ по химии
1 часть
С выбором ответа
29 заданий
40 первичных баллов
66,7% вторичных баллов
2 часть
С развернутым ответом
6 заданий
20 первичных баллов
33,3 вторичных балла
«Массовая доля»
Запомнить!
Порешаем!
Смешали 80 г раствора с
массовой долей нитрата
натрия 25 % и 20 г раствора
этой же соли с массовой
долей 40 %. Вычислите
массовую долю соли в
полученном растворе. Ответ
дайте в процентах с точностью до целых
Вариант 2
Вычислите массу нитрата калия (в
граммах), который следует растворить в
150 г раствора с массовой долей этой
соли 10 % для получения раствора с массовой долей 12 %. Ответ дайте точностью
до десятых.
Вариант 3
Упариванием 500 г раствора с массовой долей соли
10 % получен раствор с массовой долей соли 14 %.
Вычислите массу выпаренной при этом воды. Ответ
укажите в граммах с точностью до целых.
Вычислите массу воды, которую нужно добавить к 30 г
20%-го раствора гидроксида натрия, чтобы понизить
его концентрацию до 15 %. Ответ укажите в граммах с
точностью до целых.
Вариант 6
Вычислите массу воды, которую нужно испарить
из 500 г 10%-го раствора гидроксида натрия,
чтобы увеличить его концентрацию в 1,5 раза.

Ответ укажите в граммах с точностью до целых.
Вариант 7
При охлаждении 100 г горячего 55%-го раствора
нитрата натрия выпал осадок, не содержащий
кристаллизационной воды. Чему равна масса осадка
(в г), если раствор над осадком содержал 47%
нитрата натрия по массе? Ответ округлите до
Вариант 8
Сколько граммов 98%-ной серной кислоты
надо добавить к 300 г воды, чтобы получить
10%-ный раствор кислоты? Ответ округлите
до ближайшего целого числа.
Вариант 9
Сколько граммов 68%-ной азотной
кислоты надо добавить к 400 г воды,
чтобы получить 10%-ный раствор
кислоты? Ответ округлите до
ближайшего целого числа.
СуперВариант 10
Сколько граммов 40%-го раствора
гидроксида калия надо смешать с 200 г
10%-го раствора этого вещества, чтобы
получить 15%-й раствор? Ответ
выразите в виде целого числа.
* со звездочкой *
Сколько граммов 65%-го раствора азотной кислоты
вещества, чтобы получить 20%-й раствор? Ответ
выразите в виде целого числа
Я жду Вас !
Спасибо за внимание!
Решение задач на вычисление массовой доли вещества в растворе
ПОДГОТОВКА К ЭКЗАМЕНУ
«Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей»
Алгоритмы решения задач:
Пример 1. Вычисление массовой доли растворенного вещества
Определите массовую долю нитрата калия в растворе, полученном растворением 50 г нитрата калия в 200 г воды.
Дано: m(KNO3 ) = 50 г, m(Н2О) = 200 г. | Решение ω(в-ва) = m(в-ва) / m(р-ра)*100 (%). m(р-ра) = m(в-ва) + m(Н2 О) = = 50 (г) + 200 (г) = 250 г. ω(KNO3 ) = = 50 (г) / 250 (г) * 100 (%) = 20 %. Ответ. ω(KNO3) = 20 %. |
ω(KNO3 ) – ? |
Пример 2. Вычисление массы растворенного вещества
Вычислите массу гидроксида калия в растворе объемом 600 мл и плотностью 1,082 г/мл, если массовая доля гидроксида калия составляет 10 %.
Дано: V(р-ра) = 600 мл, ρ = 1,082 г/мл, ω(KОН) = 10 %, или 0,1. | Решение m(в-ва) = ω(в-ва)*m(р-ра). m(р-ра) = ρ*V(р-ра) = = 1,082 (г/мл)*600 (мл) = 649,2 г. m(KОН) = 649,2 (г)*0,1 = 64,92 г. Ответ. m(KОН) = 64,92 г. |
m(KОН) – ? |
Пример 3. Смешивание растворов с разными концентрациями одного вещества Смешали 300 г раствора с массовой долей хлорида натрия 20 % и 500 г раствора того же вещества с массовой долей 40 %. Вычислите массовую долю хлорида натрия в полученном растворе.
Дано: m1 = 300 г, ω1 = 20 %, или 0,2, m2 = 500 г, ω2 = 40 %, или 0,4. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 , где m1 , m2 , m3 – массы растворов. 300 (г)*0,2 + 500 (г)*0,4 = = 800 (г)*ω3 , 60 (г) + 200 (г) = 800 (г)*ω3 , 260 (г) = 800 (г)*ω3 , ω3 = 260 (г) / 800 (г) = 0,325, или 32,5 %. Ответ. |
ω3 – ? |
Пример 4. Разбавление водой
ω2 = 0, т.к. в воде не содержится вещество, находящееся в первом растворе.
Какую массу воды надо добавить к раствору гидроксида натрия массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 2 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 0, ω3 = 2 %, или 0,02. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *0 = = (150 (г) + m2 )*0,02, 15 (г) + 0 = 3 (г) + 0,02m2 , 0,02m2 = 12 г, m2 = 12 (г) / 0,02 = 600 г. Ответ. m(Н2О) = 600 г. |
m2 – ? |
Пример 5. Концентрирование (добавление твердого вещества)
ω2 = 100 %, или 1, т.к. добавляемое вещество чистое.
Какую массу хлорида бария надо добавить к раствору хлорида бария массой 150 г с массовой долей 10 %, чтобы получить раствор с массовой долей 25 %?
Дано: m1 = 150 г, ω1 = 10 %, или 0,1, ω2 = 100 %, или 1, ω3 = 25 %, или 0,25. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 150 (г)*0,1 + m2 *1 = = (150 (г) + m2 )*0,25, 15 (г) + 1*m2 = 37,5 (г) + 0,25m2 , 0,75m2 = 22,5 г, m2 = 22,5 (г) / 0,75 = 30 г. Ответ. m(BaCl2 ) = 30 г. |
m2 – ? |
Пример 6. Упаривание раствора (частичное выпаривание воды)
Вычислите массовую долю хлорида натрия в растворе, если из 200 г 30 %-го раствора испарилось 50 г воды.
Дано: m1 = 200 г, ω1 = 30 %, или 0,3, m2 = 50 г, ω2 = 0. | Решение m1 *ω1 + m2 *ω2 = m3 *ω3 . 200 (г)*0,3 + 50 (г)*0 = = 150 (г)*ω3 , 60 (г) = 150 (г)*ω3 , ω3 = 60 (г) / 150 (г) = 0,4, или 40 %. Ответ. ω3 (NaCl) = 40 % |
ω3 – ? |
ПРИМЕРЫ ЗАДАЧ
1. Какая масса карбоната натрия (в граммах) потребуется для приготовления 0,5 л 13%-го раствора плотностью 1,13 г/мл?
а) 73,45; б) 50; в) 72; г) 75.
2. Из раствора хлорида бария массой 100 г с массовой долей соли 3 % выпарили 25 г воды и до- бавили в него 15 г соли. Массовая доля соли (в %) в полученном растворе равна:
а) 12; б) 15; в) 18; г) 20.
3. Смешали 120 г раствора серной кислоты с массовой до лей 20 % и 40 г 50%-го раствора того же вещества. Определите массовую долю кислоты (в %) в полученном растворе.
а) 25; б) 27,5; в) 27; г) 29,5.
4. Какая масса азотной кислоты (в граммах) содержится в 1 л ее 20%-го раствора с плотностью 1,05 г/мл?
а) 105; б) 63; в) 210; г) 176.
5. Какая масса соли (в граммах) вводится в организм человека при вливании 353 г 0,85%-го физиологического раствора?
а) 3; б) 6; в) 4; г) 2 г.
6. К 180 г 8%-го раствора хлорида натрия добавили 20 г NaCl. Найдите массовую долю (в %) хлорида натрия в образовавшемся растворе.
а) 17,2; б) 17,4; в) 18; г) 12,7.
7. К раствору хлорида кальция массой 140 г с массовой долей соли 5 % добавили 10 г этой же соли. Определите массовую долю (в %) хлорида кальция в полученном растворе.
а) 13,1; б) 14; в) 11,3; г) 25.
8. Какую массу соли (в граммах) надо добавить к 60 г раствора с массовой долей этой соли 10 %, чтобы получить раствор с массовой долей 40 %?
а) 15; б) 22; в) 17; г) 30.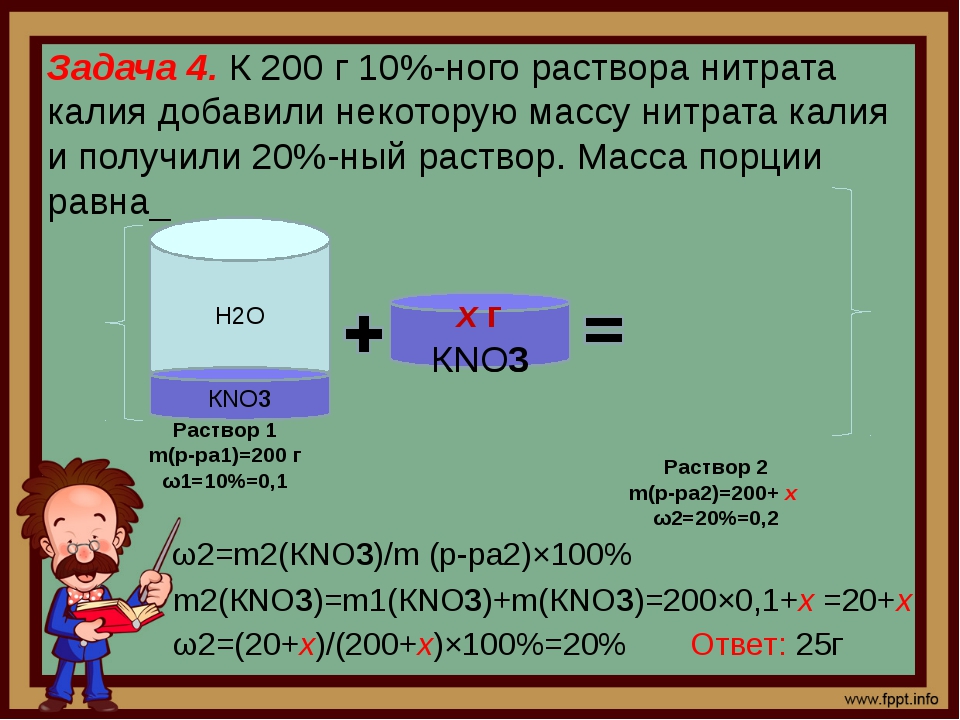
9. Смешали 200 г 15%-го раствора нитрата хрома(III) и 300 г 20%-го раствора той же соли. Вычислите массовую долю (в %) ни- трата хрома(III) в полученном растворе.
а) 24; б) 18; в) 17,9; г) 18,1.
10. Из 150 г раствора хлорида натрия с массовой долей 5 % выпарили 10 г воды и добавили 5 г той же соли. Вычислите массовую долю (в %) соли в полученном растворе.
а) 8,4; б) 8,6; в) 9; г) 11,2.
11. Смешали 200 г 5%-го и 400 г 12,5%-го растворов серной кислоты. Найдите массу кислоты в полученном растворе (в граммах).
а) 60; б) 98; в) 49; г) 58.
12. При растворении 16 г гидроксида натрия получили 10%- й раствор. Определите массу (в граммах) взятой для этого воды.
а) 126; б) 144; в) 151; г) 164.
13. К 200 г 10%-го раствора ни- трата калия добавили некоторую порцию нитрата калия и получи- ли 20%-й раствор. Найдите массу (в граммах) добавленной порции твердого вещества. а) 2,5; б) 5; в) 25; г) 15.
14. Найдите массу воды (в граммах), которую нужно добавить к 300 г 8%-го раствора сульфата натрия для получения 5%-го раствора.
а) 90; б) 45; в) 18; г) 180.
15. Какая масса раствора (в граммах) получится при упаривании 200 г 5%-го раствора гидроксида калия до 20%-го раствора?
а) 10; б) 45; в) 100; г) 50.
16. 92 мл 10%-го раствора серной кислоты (плотность 1,066 г/мл) полностью нейтрализовали 40%-м раствором гидроксида натрия. Найдите массу затраченного на нейтрализацию раствора гидроксида натрия (в граммах).
а) 10; б) 55; в) 20; г) 30.
17. Определите, какую массу гидроксида калия (в граммах) нужно добавить к 150 г 20%-го раствора гидроксида калия для получения 40%-го раствора.
а) 5; б) 50; в) 56; г) 78.
18. К 200 г 8%-го раствора хлорида натрия добавили 50 г воды. Вычислите массовую долю (в %) соли в образовавшемся растворе.
а) 6,4; б) 6,5; в) 6,1; г) 6,2.
19. Определите массу воды (в граммах), которую надо добавить к 20 г 70%-го раствора уксусной кислоты для получения 5%-го раствора уксуса.
а) 260; б) 130; в) 26; г) 258.
20. Определите массу сахара (в граммах), необходимую для приготовления 0,5 кг 45%-го раствора.
а) 245; б) 225; в) 345; г) 500.
21. Вычислите массовую долю соляной кислоты (в %) в растворе, полученном при растворении 11,2 л (н.у.) хлороводорода в 1 л воды.
а) 1,3; б) 1,6; в) 1,8; г) 3,6.
22. Вычислите массу 40%-го раствора уксусной кислоты (в граммах), которую необходимо добавить к 500 г воды для получения 15%-го раствора.
а) 29; б) 32; в) 48; г) 300.
23. Массовая доля соли в морской воде составляет 3,5 %. Найдите массу соли (в граммах), которая останется после выпаривания 5 кг морской воды.
а) 175; б) 170; в) 167; г) 163.
24. Смешали 250 г раствора гидроксида натрия с массовой долей 16 % и 300 мл раствора (ρ = 1,2 г/мл) с массовой долей того же вещества 20 %. Рассчитайте массу гидроксида натрия (в граммах) в полученном растворе:
а) 120; б) 112; в) 11; г) 115.
25. Какова масса поваренной соли (в граммах), которую следует растворить в 250 г раствора этой соли с массовой долей 10 % для получения раствора с массовой долей 18 %?
а) 22; б) 42,4; в) 24,4; г) 44.
26. К 50 г раствора хлорида кальция с массовой долей 3,5 % добавили 5 г этой же соли и 20 г воды. Определите массовую долю (в %) соли в полученном растворе.
а) 6; б) 7; в) 8; г) 9.
27. Какая масса серной кисло ты (в граммах) содержится в 0,6 л ее 40%-го раствора с плотностью 1,3 г/мл?
а) 63; б) 26; в) 60; г) 312.
28. Найдите массу хлорида натрия (в граммах), который необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %.
а) 20; б) 12,5; в) 5; г) 24.
29. К 350 г водного раствора этанола с массовой долей 20 % добавили 120 мл спирта (плотность 0,8 г/мл). Рассчитайте массу спирта (в граммах) в полученном растворе.
а) 167; б) 156; в) 166; г) 170.
30. Из 50 г раствора хлорида натрия с массовой долей 2 % выпарили 10 г воды и добавили 5 г этой же соли. Определите массовую долю соли (в %) в полученном растворе.
а) 6,3; б) 13,3; в) 8,9; г) 9,4
Ответы. 1–а, 2–г, 3–б, 4–в, 5–а, 6–а, 7–в, 8–г, 9–б, 10–б, 11–а, 12–б, 13–в, 14–г, 15–г, 16–в, 17–б, 18–а, 19–а, 20–б, 21–в, 22–г, 23–а, 24–б, 25–в, 26–г, 27–г, 28–б, 29–в, 30–б.
Многовариантная проверочная работа по химии в 11 классе «Массовая доля растворенного вещества в растворе» 10 вариантов
Многовариантная проверочная работа по теме «Расчет массовой доли вещества в растворе»
1. Сколько граммов 10 %-й серной кислоты можно получить из 150 г 98 %-го раствора (с точностью до целых)?
2. Из 400 г горячего 50%-ного раствора соли при охлаждении выпало 80 г кристаллов соли. Чему равна массовая доля соли в растворе над осадком (в %)? Ответ запишите с точностью до десятых.
3. Смешали 250 г раствора с массовой долей соли 12% и 300 г раствора с массовой долей этой же соли 8%. Масса соли в полученном растворе равна с точностью до целых…
4. Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна с точностью до десятых…
5. Масса кальция, содержащегося в 820 г раствора нитрата кальция с массовой долей 4%, равна с точностью до целых…
6. Объём (н.у.) формальдегида, который потребуется для получения 1 л формалина (р = 1,11 г/мл) с массовой долей формальдегида 40%, равен (с точностью до десятых)
7. К 150 г 20 %-го раствора соли добавили 50 г воды. Массовая доля соли в полученном растворе равна с точностью до целых…
К 150 г 20 %-го раствора соли добавили 50 г воды. Массовая доля соли в полученном растворе равна с точностью до целых…
8. К раствору, состоящему из 45 г воды и 15 г соли, добавили 65 г воды и 10 г той же соли. Вычислите массовую долю соли в полученном растворе с точностью до десятых…
9. Массовая доля серной кислоты в растворе, полученном после добавления 20 г воды к 80 г её 10%-ного раствора, равна с точностью до целых…
10. К 100 г раствора с массовой долей нитрата магния 15% добавили 5 г этой же соли и затем выпарили из него 25 мл воды. Массовая доля соли в полученном растворе равна с точностью до целых…
11. К 150 г раствора с массовой долей нитрата магния 10% добавили 15 г этой же соли и выпарили 45 мл воды. Массовая доля соли в полученном растворе равна ___________ %. (Запишите число с точностью до целых.)
12. Количество вещества нитрата кальция, необходимого для приготовления 820 г раствора с массовой долей 4%, равно(с точностью до десятых)
13. Из раствора хлорида алюминия массой 110 г и массовой долей соли 10% выпарили 10 г воды и добавили 5 г той же соли. Массовая доля соли в полученном растворе равна _____%. (Запишите ответ с точностью до десятых.)
14. Из 200 г 15%-го раствора хлорида калия выпарили 50 г воды. Массовая доля соли в оставшемся растворе равна с точностью до целых…
15. Сколько граммов карбоната калия надо прибавить к 100 г 16%-го раствора, чтобы получить 30%-й раствор? Ответ представьте с точностью до целых.
16. Сколько граммов 10%-го раствора соли надо добавить к 300 г 30%-го раствора этой же соли, чтобы получить 14%-ный раствор? Ответ запишите в виде целого числа.
17. Смешали два раствора: один массой 130 г и с массовой долей соли 6%, второй массой 70 г и с массовой долей этой же соли 2%. Масса соли, содержащейся в образовавшемся растворе, равна с точностью до десятых…
18. Масса глицерина, которую необходимо добавить к 100 г 10%-го раствора глицерина, чтобы получить раствор с массовой долей 15%, равна ________г. (Запишите ответ с точностью до целых.)
19. Чему равна массовая доля соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-ного раствора соли? Ответ запишите в процентах с точностью до целых.
20. К 90 г раствора с массовой долей хлорида магния 10% добавили 40 мл воды и 21 г этой же соли. Массовая доля соли в полученном растворе равна ____________%. (Запишите число с точностью до целых.)
21. Смешали два раствора: один массой 90 г и с массовой долей соли 5%, другой массой 125 г и с массовой долей этой же соли 4%. Масса соли, содержащейся в образовавшемся растворе, равна _______г. (Запишите число с точностью до десятых.)
22. Вычислите массу нитрата калия (в граммах с точностью до десятых…), которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%.
23. К 110 г раствора с массовой долей хлорида магния 10% добавили 21 мл воды и 21 г этой же соли. Массовая доля соли в полученном растворе равна __________%. (Запишите число с точностью до целых.)
24. К 100 г 10-процентного раствора соли добавили 20 г этой же соли. Чему равна массовая доля соли в полученном растворе с точностью до целых…?
25. К раствору хлорида бария массой 120 г с массовой долей 2% добавили 1,6 г этой же соли. Массовая доля соли в полученном растворе равна (с точностью до десятых)
К раствору хлорида бария массой 120 г с массовой долей 2% добавили 1,6 г этой же соли. Массовая доля соли в полученном растворе равна (с точностью до десятых)
26. Смешали два раствора: один массой 120 г и с массовой долей соли 15%, другой массой 125 г и с массовой долей этой же соли 10%. Масса соли, содержащейся в образовавшемся растворе, равна с точностью до десятых…
27. Для приготовления 250 г 20-процентного раствора нитрата калия требуется взять с точностью до целых…
28. В результате гидратации 89,6 л (н.у.) ацетилена получили раствор ацетальдегида с массовой долей 20%. Масса полученного раствора равна с точностью до целых…
29. Из 200 г 12-процентного раствора нелетучего вещества выпарили 40 г воды. Чему равна массовая доля вещества в полученном растворе с точностью до целых… ?
30. Смешали два раствора: один массой 180 г и с массовой долей соли 2,5%, другой массой 250 г и с массовой долей этой же соли 2%. Масса соли, содержащейся в образовавшемся растворе, равна с точностью до десятых…
31. К 70 г раствора с массовой долей хлорида кальция 40% добавили 18 мл воды и 12 г этой же соли. Массовая доля соли в полученном растворе равна ____________%. (Запишите число с точностью до целых.)
32. Смешали 300 г раствора с массовой долей соли 20% и 500 г раствора с массовой долей 40%. Массовая доля соли в полученном растворе равна с точностью до десятых…
33. К 150 г раствора с массовой долей нитрата магния 10% добавили 15 г этой же соли и выпарили 45 мл воды. Массовая доля соли в полученном растворе равна ___________ %. (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.)
34. Из 200 г 15 %-го раствора соли испарили 50 г воды. Массовая доля соли в полученном растворе равна с точностью до целых…
35. Какую массу воды надо добавить к 120 г раствора с массовой долей этой соли 20%, чтобы получить раствор с массовой долей 15% с точностью до целых…?
36. Масса 5%-го спиртового раствора иода, приготовленного из 7 г кристаллического иода, равна __________г. (Запишите ответ с точностью до целых.)
37. При смешивании 50%-ного и 10%-ного растворов одного и того же вещества получили 15%-ный раствор. Во сколько раз взяли больше по массе 10%-ного раствора, чем 50%-ного? Ответ запишите в виде целого числа.
38. К 200 г 12-процентного раствора соли добавили 40 г воды. Чему равна массовая доля соли в полученном растворе с точностью до целых…?
39. Сколько граммов 40%-ной щёлочи надо взять для получения 300 г 8%-ной щёлочи с точностью до целых…?
40. Какую массу воды нужно добавить к 30 г 20%-ного раствора гидроксида натрия, чтобы понизить его концентрацию до 15%? Ответ укажите в граммах с точностью до целых.
41. При смешивании 40%-ного и 15%-ного растворов одного и того же вещества получили 20%-ный раствор. Во сколько раз взяли больше по массе 15%-ного раствора, чем 40%-ного? Ответ запишите в виде целого числа.
42. Смешали 600 г раствора с массовой долей соли 10% и 1000 г раствора с массовой долей 20%. Массовая доля соли в полученном растворе равна (с точностью до десятых)
43. Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? Ответ укажите в граммах с точностью до целых.
Какова масса выпаренной при этом воды? Ответ укажите в граммах с точностью до целых.
44. Смешали 120 г раствора серной кислоты с массовой долей 20% и 40 г 50% раствора того же вещества. Массовая доля кислоты в полученном растворе равна (с точностью до десятых)
45. Объём (н.у.) формальдегида, который потребуется для получения 1 л формалина(р = 1,11 г/мл) с массовой долей формальдегида 10%, равен (с точностью до десятых)
46. К 150 г раствора сульфата меди(II) с массовой долей 8% добавили ещё 8 г этой же соли. Массовая доля соли в полученном растворе равна с точностью до сотых…
47. Масса нитрата натрия, которую необходимо растворить в 200 г воды для получения раствора с массовой долей 20%, равна с точностью до целых…
48. Из 600 г 10%-го раствора соли необходимо приготовить 12%-й раствор. Для этого потребуется выпарить ______________г воды. (Ответ укажите с точностью до целых.)
49. Из 200 г 30-процентного раствора соли при охлаждении выпало 40 г соли. Чему равна массовая доля соли в оставшемся растворе с точностью до десятых…?
50. К 300 г раствора нитрата калия с массовой долей 20% добавили 100 г той же соли. Массовая доля нитрата калия в полученном растворе составит с точностью до целых…
Многовариантная самостоятельная работа (№ задач)
Вар.1 | Вар.2 | Вар.3 | Вар.4 | Вар.5 | Вар. | Вар.7 | Вар.8 | Вар.9 | Вар.10 |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 |
31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 |
41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 |
Ответы
Вар. | Вар.2 | Вар.3 | Вар.4 | Вар.5 | Вар.6 | Вар.7 | Вар.8 | Вар.9 | Вар.10 |
1470 | 37,5 | 54 | 3,4 | 8 | 331,5 | 15 | 18,5 | 8 | 25 |
25 | 0,2 | 15,2 | 20 | 20 | 1200 | 9,2 | 6 | 14 | 20 |
9,5 | 3,4 | 21 | 25 | 3,3 | 30,5 | 50и200 | 880 | 15 | 9,5 |
40 | 32,5 | 25 | 20 | 40 | 140 | 7 | 10 | 60 | 10 |
4 | 16,3 | 143 | 27,5 | 82,9 | 12,66 | 50 | 100 | 12,5 | 40 |
Задачи взяты с сайта https://ege. sdamgia.ru/
sdamgia.ru/
Вариант ___ ФИ______________________
№ задачи | Расчеты | Ответ |
Вариант ___ ФИ______________________
№ задачи | Расчеты | Ответ |
Вариант ___ ФИ______________________
№ задачи | Расчеты | Ответ |
Вариант ___ ФИ______________________
№ задачи | Расчеты | Ответ |
Информио
×Неверный логин или пароль
×Все поля являются обязательными для заполнения
×Сервис «Комментарии» — это возможность для всех наших читателей дополнить опубликованный на сайте материал фактами или выразить свое мнение по затрагиваемой материалом теме.
Редакция Информио.ру оставляет за собой право удалить комментарий пользователя без предупреждения и объяснения причин. Однако этого, скорее всего, не произойдет, если Вы будете придерживаться следующих правил:
- Не стоит размещать бессодержательные сообщения, не несущие смысловой нагрузки.
- Не разрешается публикация комментариев, написанных полностью или частично в режиме Caps Lock (Заглавными буквами). Запрещается использование нецензурных выражений и ругательств, способных оскорбить честь и достоинство, а также национальные и религиозные чувства людей (на любом языке, в любой кодировке, в любой части сообщения — заголовке, тексте, подписи и пр.)
- Запрещается пропаганда употребления наркотиков и спиртных напитков. Например, обсуждать преимущества употребления того или иного вида наркотиков; утверждать, что они якобы безвредны для здоровья.
- Запрещается обсуждать способы изготовления, а также места и способы распространения наркотиков, оружия и взрывчатых веществ.
- Запрещается размещение сообщений, направленных на разжигание социальной, национальной, половой и религиозной ненависти и нетерпимости в любых формах.
- Запрещается размещение сообщений, прямо либо косвенно призывающих к нарушению законодательства РФ. Например: не платить налоги, не служить в армии, саботировать работу городских служб и т.д.
- Запрещается использование в качестве аватара фотографии эротического характера, изображения с зарегистрированным товарным знаком и фотоснимки с узнаваемым изображением известных людей. Редакция оставляет за собой право удалять аватары без предупреждения и объяснения причин.
- Запрещается публикация комментариев, содержащих личные оскорбления собеседника по форуму, комментатора, чье мнение приводится в статье, а также журналиста.
Претензии к качеству материалов, заголовкам, работе журналистов и СМИ в целом присылайте на адрес
×Информация доступна только для зарегистрированных пользователей.
Уважаемые коллеги. Убедительная просьба быть внимательнее при оформлении заявки. На основании заполненной формы оформляется электронное свидетельство. В случае неверно указанных данных организация ответственности не несёт.
Проверочная работа по химии 8 класс на тему «Основные химические понятия» с элементами ВПР.
Вариант 1
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) муки от попавших в неё железных опилок;
2) воды от растворённых в ней неорганических солей?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Смесь | Номер рисунка | Способ разделения смеси |
Мука и попавшие в неё железные опилки | ||
Вода с растворёнными в ней неорганическими солями |
Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: Cl, P, Ba, Al, Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества фтор и соль фосфата
натрия. Запишите ответ в отведённом месте:
Запишите ответ в отведённом месте:
1) фтор
2) соль фосфата натрия
Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ, упоминаемых в приведённом выше тексте.
Сложные вещества
оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задание 4
Оксид серы (IV) используют в пищевой промышленности в качестве консерванта (пищевая добавка Е220). Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Это вещество также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например взаимодействием серной кислоты с сульфитом натрия.
При взаимодействии оксида серы (IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в промышленности как пищевая добавка Е226, консервант, для приготовления желе, мармелада, мороженого, напитков и фруктовых соков.
Физиологическим раствором в медицине называют 0,9%-ный раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия и массу воды, которые необходимы для приготовления 500 г физиологического раствора. Запишите подробное решение задачи.
Атом углерода проявляет валентность, не равную IV, в молекуле
1) углекислого газа
2) угольной кислоты
3) метана
4) угарного газа
Азот и аммиак являются соответственно
1) простыми веществами
2) простым и сложным веществами
3) сложными веществами
4) сложным и простым веществами
Какой из указанных металлов вступает в реакцию с соляной кислотой?
1) серебро
2) золото
3) медь
4) алюминий
Признаком химической реакции между растворами сульфата меди (II) и гидроксида калия является
1) выделение газа
2) появление запаха
3) выпадение осадка
4) поглощение теплоты
Верны ли следующие суждения о правилах безопасной работы в химической лаборатории и хранения веществ в быту?
А. При попадании раствора кислоты на кожу, её следует промыть водой и обработать раствором питьевой соды.
При попадании раствора кислоты на кожу, её следует промыть водой и обработать раствором питьевой соды.
Б. Легковоспламеняющиеся жидкости, например ацетон, разрешается хранить только в холодильнике.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Вариант 2
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) воды и хлорида калия;
2) метанола и кусочков серы?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Смесь | Номер рисунка | Способ разделения смеси |
Вода и хлорид калия | ||
Метанол и кусочки серы |
Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: Br, Ge, F, Cs.Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
Характерные свойства веществ
Молекулярного строения | Атомного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — очень твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — нерастворимы в воде |
Используя данную информацию, определите, какое строение имеют вещества хлороводород и оксид кремния. Запишите ответ в отведённом месте:
Запишите ответ в отведённом месте:
1) хлороводород
2) оксид кремния
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Сложные вещества
оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задание 4
Сульфат меди (II) CuSO4— важнейшая из солей меди. Кристаллогидрат сульфата меди (II) называют медным купоросом. В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. В промышленности эту соль применяют в производстве ацетатного волокна, а также используют в качестве фиксатора окраски и консерванта. Сульфат меди (II) в промышленности получают различными способами, например растворением оксида меди (II) CuOв серной кислоте h3SO4. Эта соль часто служит исходным сырьём для получения других соединений, например гидроксида меди (II) Cu(OH)2. Для водного раствора сульфата меди (II) возможна реакция с металлами активнее меди, например с цинком. Сульфат меди (II) является соединением с умеренной токсичностью. Однако работать с порошком или пудрой сульфата меди (II) следует осторожно, не допуская их пыления.
Сахароза применяется в пищевой промышленности, чаще всего для изготовления кондитерских изделий из сиропа- концентрированного раствора сахарозы. При упаривании 300 г 5%-ного раствора сахарозы получено 245 г раствора. Какова массовая доля сахарозы в нём? (Запишите число с точностью до десятых).
Валентность каждого из элементов равна II в веществе
ALN
h3O2
h3S
MgS
Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
Среди них к простым веществам относится(-ятся)
1) сера и белый фосфор
2) только белый фосфор
3) белый фосфор и азотная кислота
4) только сера
Алюминий образует сульфат алюминия при взаимодействии с
1) серой
2) сероводородом
3) сернистой кислотой
4) серной кислотой
Признаком протекания химической реакции между растворами нитрата серебра и хлорида кальция является
1) растворение осадкa 2) образование осадка
3) выделение газа 4) появление запаха
Верны ли суждения о назначении лабораторной посуды и оборудования?
А. Для измерения объёма жидкости используют мерный цилиндр.
Б. Ступка с пестиком предназначены для измельчения твёрдых веществ.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Вариант 3
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) смеси железного и натриевого порошка;
2) ацетона и угольного порошка?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Смесь | Номер рисунка | Способ разделения смеси |
Смеси железного и натриевого порошка | ||
Ацетон и угольный порошок |
Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: B, Se F, C. Запишите обозначения элементов в нужной последовательности.
Расположите в порядке увеличения металлических свойств, следующие элементы: B, Se F, C. Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и ионное строение.
Характерные свойства веществ
Молекулярного строения | Ионного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — в расплавах и растворах проводят электрический ток |
Используя данную информацию, определите, какое строение имеют вещества углекислый газ и соль хлорида цезия. Запишите ответ в отведённом месте:
1) углекислый газ
2) соль хлорида цезия
4. Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Сложные вещества
оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задание 4
Железо — это блестящий, серебристо-белый, мягкий металл, с давних пор широко применяемый человеком. Известно большое количество руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк Fe2O3, магнитный железняк Fe3o4, сидеритFeCO3, мелантерит FeSO4, вивианит Fe3(PO4)2. Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +2 железо образует оксид FeO, который проявляет основные свойства, ему соответствует гидроксид Fe(OH)2. Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (HCl) с образование хлорида железа (II) FeCl2.
Так, в степени окисления +2 железо образует оксид FeO, который проявляет основные свойства, ему соответствует гидроксид Fe(OH)2. Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (HCl) с образование хлорида железа (II) FeCl2.
Железо один из самых используемых металлов, на него приходится до 95% мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Концентрированные солевые растворы часто советуются врачами для полоскания носоглотки при разных заболеваниях. Упариванием 500 г раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%. Какова масса выпаренной при этом воды? (Запишите число с точностью до десятых).
6. Валентность каждого элемента равна III в веществе
1. Ph4 2. SiC 3. AlCl3 4. AlP
7. Даны вещества: вода, кислород и аммиак. Среди них к сложным веществам относится(-ятся):
1) вода и аммиак
2) только кислород
3) кислород и аммиак
4) только вода
8. Натрий образует нитрат натрия при взаимодействии с
1) азотом
2) аммиаком
3) оксидом азота(I)
4) азотной кислотой
9. При нагревании гидроксид меди(II) вступает в реакцию
1) соединения
2) замещения
3) разложения
4) горения
10. Верны ли суждения о правилах применения и опасности для здоровья препаратов бытовой химии?
А. Стиральные порошки нельзя использовать для мытья посуды.
Б. Работать с хлорсодержащими дезинфицирующими средствами следует при плотно закрытой двери в помещении.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Вариант 4
Из курса химии Вам известны следующие способы разделения смесей: отстаивание, фильтрование, дистилляция (перегонка), действие магнитом, выпаривание, кристаллизация. На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
На рисунках 1–3 представлены примеры использования некоторых из перечисленных способов.
Какие из названных способов разделения смесей можно применить для очищения:
1) смеси сульфата бария и воды;
2) воды и пропанола?
Запишите в таблицу номер рисунка и название соответствующего способа разделения смеси.
Смесь | Номер рисунка | Способ разделения смеси |
Смеси сульфата бария и воды | ||
Вода и пропанол |
Известно, что с увеличением порядкового номера элемента в периодах металлические свойства атомов уменьшаются, а в группах увеличиваются. Расположите в порядке увеличения металлических свойств, следующие элементы: P, O, S, Ga. Запишите обозначения элементов в нужной последовательности.
В приведённой ниже таблице перечислены характерные свойства веществ, которые имеют молекулярное и атомное строение.
Характерные свойства веществ
Молекулярного строения | Атомного строения |
— при обычных условиях имеют жидкое, газообразное и твёрдое агрегатное состояние; — имеют низкие значения температур кипения и плавления; — неэлектропроводные; — имеют низкую теплопроводность | — очень твёрдые при обычных условиях; — хрупкие; — тугоплавкие; — нелетучие; — нерастворимы в воде |
Используя данную информацию, определите, какое строение имеют вещества хлор и кремний
Запишите ответ в отведённом месте:
1) хлор
2) кремний
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Сложные вещества
оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задание 4
Литий — мягкий лёгкий металл серебристо-белого цвета, наименее активный среди щелочных металлов. При окислении лития кислородом образуется соединение, которое активно взаимодействует с водой с образованием гидроксида лития. Гидроксид лития проявляет свойства, характерные для щелочей: взаимодействует с кислотами и кислотными оксидами. Примерно половина всего промышленно выпускаемого лития используется для изготовления литий-ионных аккумуляторов. Ячейка такого аккумулятора состоит из двух электродов, разделённых пористым материалом, пропитанным раствором электролита. Один из электродов изготавливают из лития, а другой — из соединений кобальта или железа. Для приготовления растворов электролитов обычно используют сульфат лития и органические растворители, например некоторые простые и сложные эфиры. Сульфат лития можно получить в результате взаимодействия гидроксида лития с серной кислотой.
5%-ный раствор иода в спирте применяют в качестве антисептического средства при воспалительных и прочих заболеваниях кожи и слизистых оболочек. Чему равна масса 5%-го спиртового раствора иода, приготовленного из 7 г кристаллического иода? (Запишите ответ с точностью до целых).
6. Валентность хлора в соединениях Cl2O7 и FeCl2 соответственно, равна
1) I и II
2) VII и II
3) VII и III
4) VII и I
7. К сложным веществам относится
1) сода
2) графит
3) воздух
4) иод
8. Цинк быстро взаимодействует с водным раствором
Nh4
CO2
CO
h3SO4
9. Взаимодействие раствора сульфата меди(II) с железом относится к реакциям
Взаимодействие раствора сульфата меди(II) с железом относится к реакциям
1) замещения
2) соединения
3) обмена
4) разложения
10. Верны ли суждения о способах разделения смесей?
А. Выпаривание относят к физическим способам разделения смесей.
Б. Разделение смеси воды и этанола возможно способом фильтрования.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Ответы
1 вариант | 2 вариант | 3 вариант | 4 вариант |
1Железо, в отличие от муки, притягивается магнитом, поэтому железные опилки можно отделить магнитом. Чтобы отделить воду от растворенных в ней солей, раствор нужно перегнать — процесс дистилляции. | 1Если испарить воду мы получим чистую соль хлорида калия. Кусочки серы отделаются фильтрованием. | 1Железо можно отделить магнитом. Смесь ацетона и угольного порошка можно отстоять и отделить декантацией. | 1Сульфат бария можно отделить от воды фильтрование. Смесь воды с пропанолом отделяется перегонкой. |
2 Cl, P, Al, Ba. | 2 F, Br, Ge, Cs. | 2F, C, B, Se. | 2 O, S, P, Ga. |
3Фтор имеет молекулярное строение, так как он при обычных условиях летучий, не проводит ток, кипит при низкой температуре (т. к. 85 К). Фосфат натрия имеет ионное строение, так как он твердый при обычных условиях, тугоплавкий (т. п. 1613,2 K), и в растворах и расплавах проводит электрический ток. | 3Хлороводород имеет молекулярное строение, так как он при обычных условиях летучий, не проводит ток, кипит при низкой температуре (т. к. 188,2 К). Оксид кремния имеет атомное строение, так как он очень твердый при обычных условиях, хрупкий, не растворим в воде, тугоплавкий (т. | 3Углекислый газ имеет молекулярное строение, так как он при обычных условиях летучий, не проводит ток, сублимирует при низкой температуре (т. к. 194,7К). Хлорид цезия имеет ионное строение, так как он твердый при обычных условиях, тугоплавкий (т. п. 919,2K), и в растворах и расплавах проводит электрический ток. | 3Хлор имеет молекулярное строение, так как он при обычных условиях летучий, не проводит ток, кипит при низкой температуре (т. к. 172,2К). Кремний имеет атомное строение, так как он очень твердый при обычных условиях, хрупкий, не растворим в воде, тугоплавкий (т. п. 1688K). |
4 | 4 | 4 | 4 |
5 4,5. м воды 495,5 | 5.Элементы ответа: ω = m(вещества)/m(раствора), откуда: ω = 300 · 0,05 · 100/245 = 6,1%
Ответ: 6,1%. | 51) Найдем массу чистого вещества в 10%-ом растворе: 10% = (m1 · 100%) / 500 m1 = 50г
2) 14% = (50 · 100%) / (500 — m2) m2 = 500 — (5000/14) = 142.9г
Ответ: 142,9 | 5.7 г иода составляют 5% от массы раствора, значит масса раствора равна 7 / 0,05 = 140 (г).
Ответ: 140 г. |
6.4 | 6.4 | 6.4 | 6.4 |
7.2 | 7.1 | 7.1 | 7.1 |
8.4 | 8.4 | 8.4 | 8.4 |
9.3 | 9.1 | 9.3 | 9.1 |
10.1 | 10.3 | 10.1 | 10.1 |
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/387460-proverochnaja-rabota-po-himii-8-klass-na-temu
Сайт учителя химии Сай Н.С. — My Chemistry AcadeMy
«Учитель — человек, который может делать трудные вещи легкими. »
»
Ральф Уолдо Эмерсон
Незаметно проходит время, меняются дети, меняются родители, меняется само общество и отношения между людьми. Но неизменной остаётся роль учителя, который понимает, что в любом времени надо учить детей.Каким же всё-таки должен быть современный учитель?
Хороший учитель должен любить свое дело, любить детей, именно это поможет ему справиться с трудностями в профессиональной деятельности. Основная миссия учителя- делать трудные вещи легкими. Современный учитель не только должен идти в ногу со временем, он должен работать на будущее. Будущее своих учеников.
Я работаю учителем химии в МАОУ СОШ №22 с углубленным изучением отдельных предметов города Тамбова, аттестована на высшую квалификационную категорию. Более 10 лет преподаю в профильных классах, в том числе и химико-биологических. Мои ученики являются призерами и победителями олимпиад по химии различного уровня, после окончания школы поступают в ВУЗы Москвы, Санкт-Петербурга, Саратова, Воронежа, Рязани. В школе являюсь руководителем научного общества школьников, занимаюсь с обучающимися исследовательской деятельностью, результатом которой являются призовые места в конкурсах различного уровня. Исследовательская работа – деятельность творческая, как для учителя, так и для ученика. Очень важно привить учащимся умения самостоятельной творческой деятельности. Только при самостоятельной работе воспринятая информация перерабатывается в знания, а знания в умения и навыки. Привлечение учащихся к выполнению творческих учебно-
Концентрация с примерами | Интернет-уроки химии
Концентрация
Концентрация — это количество растворенного вещества в данном растворе. Мы можем выразить концентрацию по-разному, например, в процентах или молях.
1) Концентрация в процентах:
Это количество растворенного вещества, растворенного в 100 г растворителя. Если концентрация раствора составляет 20%, мы понимаем, что в 100 г раствора содержится 20 г растворенного вещества.
Пример: Смешивают 10 г соли и 70 г воды и готовят раствор. Найдите концентрацию раствора в процентах по массе.
Решение:
Масса растворенного вещества: 10 г
Масса раствора: 10 + 70 = 80 г
80 г раствора включает 10 г растворенного вещества
100 г раствора включает X г растворенного вещества
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯
X = 12,5 г%
Или по формуле;
Массовый процент = 10.100/80 = 12,5%
Пример: Если концентрация 600 г раствора NaCl по массе составляет 40%, найдите количество растворенного вещества по массе в этом растворе.
Решение:
100 г раствора включает 40 г растворенного вещества
600 г раствора включает X г растворенного вещества
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯
X = 240 г соли NaCl растворяется в растворе.
Пример: Если мы добавим 68 г сахара и 272 г воды к 160 г раствора с концентрацией 20%, найдите конечную концентрацию этого раствора.
Решение:
Масса раствора до добавления сахара и воды 160 г.
В 100 г раствора входит 20 г сахара
Раствор 160 г включает X г сахара
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯
X = 32 г сахара
Масса растворенного вещества после добавления = 32 + 68 = 100 г сахара
Масса раствора после добавления = 272 +68 + 160 = 500 г
В 500 г раствора содержится 100 г сахара
100 г раствора включает X г сахара
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯
X = 20% — концентрация конечного раствора.
2) Концентрация по молям:
Мы можем выразить концентрацию растворов молями. Число молей на литр называется , молярность , обозначенная буквой M.
Пример: Из 16 г NaOH готовят 200 мл раствора. Какие из следующих утверждений верны для этого раствора? (Молярная масса NaOH составляет 40 г)
I. Концентрация раствора 2 молярная
II. Объем воды в растворе 200 мл
III. Если мы добавляем воду в раствор, количество молей растворенного вещества уменьшается.
Раствор: молей NaOH
I. n NaOH = 16/40 = 0,4 моль
V = 200 мл = 0,2 литра
Молярность = 0,4 / 0,2 = 2 моляр
Я правда
II. Поскольку объем раствора составляет 200 мл, объем воды меньше 200 мл. II ложно.
III. Если мы добавляем воду в раствор, объем раствора увеличивается, но количество молей растворенного вещества не изменяется.
Пример: 4,4 г соли XCl 2 растворяется в воде и образует 100 мл 0,4 молярного раствора XCl 2 . Найдите молярную массу X. (CL = 35)
Решение:
Молярность = n / V
n = M.V, где V = 100 мл = 0,1 л и M = 0,4 молярный
n = 0,1,0,4 = 0,04 моль
Если 0,04 моль XCl2 составляет 4,4 г
1 моль XCl2 составляет? г
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯ ¯
? = 110 г XCl2
Молярная масса of XCl2 = X + 2. o_ {растворитель} \ label {RLaw} \]
o_ {растворитель} \ label {RLaw} \]
Введение
В 1880-х годах французский химик Франсуа-Мари Рауль обнаружил, что когда вещество растворяется в растворе, давление пара в растворе обычно уменьшается.Это наблюдение зависит от двух переменных:
- мольная доля количества растворенного растворенного вещества и
- исходное давление пара (чистый растворитель).
При любой заданной температуре для конкретного твердого вещества или жидкости существует давление, при котором пар, образующийся над веществом, находится в динамическом равновесии с его жидкой или твердой формой. Это давление пара вещества при данной температуре. В состоянии равновесия скорость испарения твердого вещества или жидкости равна скорости конденсации газа до его первоначальной формы.Все твердые и жидкие вещества имеют давление пара, и это давление постоянно, независимо от того, сколько вещества присутствует.
Идеальные и неидеальные решения
Закон Рауля работает только для идеальных решений. «Идеальное решение показывает термодинамические характеристики смешивания, идентичные характеристикам идеальных газовых смесей, [за исключением того, что] идеальные растворы имеют межмолекулярные взаимодействия, равные таковым чистых компонентов». 2 Как и многие другие концепции, исследуемые в химии, закон Рауля применим только в идеальных условиях в идеальном растворе.Однако он по-прежнему довольно хорошо работает с растворителем в разбавленных растворах. Однако в действительности снижение давления пара будет больше, чем рассчитанное по закону Рауля для чрезвычайно разбавленных растворов. 3
Рисунок \ (\ PageIndex {1} \): Положительное неидеальное поведение давления пара раствора следует закону Генри при низких концентрациях и закону Рауля при высоких концентрациях (чистый).Почему закон Рауля работает
Если вы посмотрите на концепцию коллигативных свойств, вы обнаружите, что добавление растворенного вещества снижает давление пара, поскольку дополнительные частицы растворенного вещества заполняют промежутки между частицами растворителя и занимают место. Это означает, что меньше растворителя будет на поверхности и меньше будет способно вырваться наружу, чтобы войти в газовую фазу, что приведет к более низкому давлению пара. Есть два способа объяснить, почему работает закон Рауля — простой визуальный способ и более сложный способ, основанный на энтропии. Ниже представлен простой подход.
Это означает, что меньше растворителя будет на поверхности и меньше будет способно вырваться наружу, чтобы войти в газовую фазу, что приведет к более низкому давлению пара. Есть два способа объяснить, почему работает закон Рауля — простой визуальный способ и более сложный способ, основанный на энтропии. Ниже представлен простой подход.
Помните, что давление насыщенного пара — это то, что вы получаете, когда жидкость находится в запечатанном контейнере. Устанавливается равновесие, при котором количество частиц, оторвавшихся от поверхности, точно такое же, как количество снова прилипших к поверхности.
Рисунок \ (\ PageIndex {2} \): Динамическое равновесие между летучими молекулами в жидкой и газовой фазах.Теперь предположим, что молекулы растворенного вещества были добавлены так, что молекулы растворителя занимали только 50% поверхности раствора.
Рисунок \ (\ PageIndex {1} \).Определенная часть молекул растворителя будет обладать достаточной энергией, чтобы покинуть поверхность (например, 1 на 1000 или 1 на миллион). Если вы уменьшите количество молекул растворителя на поверхности, вы уменьшите количество, которое может ускользнуть в любой момент времени.Но это не повлияет на способность молекул пара снова прилипать к поверхности. Если молекула растворителя в паре ударяется о поверхность, занятую частицами растворенного вещества, она может прилипнуть. Очевидно, что между растворителем и растворенным веществом существует взаимосвязь, иначе у вас вообще не было бы решения.
Чистый эффект этого заключается в том, что, когда равновесие установлено, в паровой фазе будет на меньше молекул растворителя на — вероятность их отрыва маловероятна, но с их возвращением проблем не возникает.Однако, если в паре в состоянии равновесия меньше частиц, давление насыщенного пара ниже.
Ограничения по закону Рауля
На практике идеального решения не существует! Однако характеристики одного из них включают:
- Идеальные решения удовлетворяют закону Рауля.
 Решение на последней диаграмме рисунка \ (\ PageIndex {3} \) выше на самом деле не подчиняется закону Рауля — оно слишком сконцентрировано, но нарисовано так сконцентрировано, чтобы подчеркнуть суть.
Решение на последней диаграмме рисунка \ (\ PageIndex {3} \) выше на самом деле не подчиняется закону Рауля — оно слишком сконцентрировано, но нарисовано так сконцентрировано, чтобы подчеркнуть суть. - В идеальном растворе молекуле растворителя требуется точно такое же количество энергии, чтобы оторваться от поверхности раствора, как и в чистом растворителе. Силы притяжения между растворителем и растворенным веществом точно такие же, как между исходными молекулами растворителя — маловероятное событие!
Предположим, что в чистом растворителе 1 из 1000 молекул имеет достаточно энергии, чтобы преодолеть межмолекулярные силы и оторваться от поверхности в любой момент времени.В идеальном решении это будет точно такая же пропорция. Конечно, оторвалось бы меньше, потому что теперь на поверхности меньше молекул растворителя, но из тех, что находятся на поверхности, отколется та же пропорция. Если бы было сильное притяжение растворителей к растворенным веществам, это соотношение можно было бы уменьшить до 1 из 2000, до 1 из 5000 или чего-то еще.
В любом реальном растворе, например, соли в воде, существует сильное притяжение между молекулами воды и ионами. Это замедлит потерю молекул воды с поверхности.Однако, если раствор достаточно разбавлен, на поверхности будут большие участки, на которых все еще будут находиться сами по себе молекулы воды. Тогда решение приблизится к идеальному поведению.
Природа растворенного вещества
Есть еще одна вещь, с которой вы должны быть осторожны, если собираетесь производить какие-либо вычисления по закону Рауля. Возможно, вы заметили в небольшом вычислении мольной доли далее на странице, что сахар был как растворенное вещество, а не соль. На самом деле важно не количество молей вещества, которое вы добавляете в раствор, а , число молей образовавшихся частиц.На каждый моль растворенного хлорида натрия вы получаете 1 моль ионов натрия и 1 моль хлорид-ионов — другими словами, вы получаете вдвое больше молей частиц, чем исходная соль.
Итак, если вы добавите 0,1 моль хлорида натрия, в растворе фактически будет 0,2 моля частиц — и это число, которое вам нужно будет использовать при вычислении мольной доли. Если вы не вдумаетесь, закон Рауля работает только для растворенных веществ, которых не изменяет свою природу при растворении .Например, они не должны ионизироваться или связываться (например, если вы добавляете вещество A, оно не должно образовывать раствор A 2 ). Если это произойдет, вы должны очень осторожно отнестись к закону Рауля.
На самом деле важно не количество молей вещества, которое вы добавляете в раствор, а число молей образовавшихся частиц.
Закон Рауля и коллигативные свойства
Эффект закона Рауля состоит в том, что давление насыщенного пара раствора будет ниже, чем у чистого растворителя при любой конкретной температуре.Это оказывает важное влияние на фазовую диаграмму растворителя. На следующей диаграмме показана фазовая диаграмма чистой воды в области ее нормальных точек плавления и кипения. Линия в 1 атмосферу показывает условия для измерения нормальных точек плавления и кипения.
Рисунок \ (\ PageIndex {5} \): Фазовая диаграмма чистого растворителяЛиния, разделяющая жидкую и паровую области, представляет собой набор условий, при которых жидкость и пар находятся в равновесии. Это можно рассматривать как влияние давления на точку кипения воды, но это также кривая, показывающая влияние температуры на давление насыщенного пара воды.Эти два способа взглянуть на одну и ту же линию кратко обсуждаются в примечании примерно в середине страницы о фазовых диаграммах (перейдите по последней ссылке выше).
Если вы построите кривую давления насыщенного пара для раствора нелетучего растворенного вещества в воде, она всегда будет ниже кривой для чистой воды.
Рисунок \ (\ PageIndex {6} \): Если вы внимательно посмотрите на последнюю диаграмму, вы увидите, что точка, в которой кривая равновесия жидкость-пар встречается с кривой твердого тела-пара, сместилась. Эта точка является тройной точкой системы — уникальным набором условий температуры и давления, при которых можно одновременно получить твердое тело, жидкость и пар в равновесии друг с другом. Поскольку тройная точка имеет равновесие твердое тело-жидкость (среди других равновесий), она также является точкой плавления системы, хотя и не нормальной точкой плавления, поскольку давление не равно одной атмосфере.
Эта точка является тройной точкой системы — уникальным набором условий температуры и давления, при которых можно одновременно получить твердое тело, жидкость и пар в равновесии друг с другом. Поскольку тройная точка имеет равновесие твердое тело-жидкость (среди других равновесий), она также является точкой плавления системы, хотя и не нормальной точкой плавления, поскольку давление не равно одной атмосфере.
Кривые для чистой воды и для раствора часто проводят параллельно друг другу.Это должно быть неправильно! Предположим, у вас есть раствор, в котором мольная доля воды составляет 0,99, а давление пара чистой воды при этой температуре составляет 100 кПа. Давление паров раствора составит 99 кПа — падение на 1 кПа. При более низкой температуре, когда давление пара чистой воды составляет 10 кПа, падение составит всего 0,1 кПа. Чтобы кривые были параллельны, водопады должны быть одинаковыми во всем температурном диапазоне. Это не так!
Это должно означать, что фазовая диаграмма нуждается в новой линии точки плавления (линии равновесия твердое тело-жидкость), проходящей через новую тройную точку.Это показано на следующей диаграмме.
Рисунок \ (\ PageIndex {7} \):Теперь мы наконец можем увидеть, какое влияние нелетучие растворенные вещества оказывают на точки плавления и замерзания раствора. Посмотрите, что происходит, когда вы проводите линию давления в 1 атмосферу, которая позволяет вам измерять точки плавления и кипения. Диаграмма также включает точки плавления и кипения чистой воды из исходной диаграммы состояния чистой воды (черные линии).
Рисунок \ (\ PageIndex {8} \):Из-за изменений в фазовой диаграмме вы можете увидеть, что:
- точка кипения растворителя в растворе выше, чем у чистого растворителя;
- точка замерзания (точка плавления) растворителя в растворе ниже, чем у чистого растворителя.
Мы рассмотрели это с водой в качестве растворителя, но использование другого растворителя не повлияет на аргументы или выводы. Единственное отличие состоит в наклоне линий равновесия твердое тело-жидкость. Для большинства растворителей они наклонены вперед, а линия ватерлинии — назад. Вы можете доказать себе, что это не влияет на то, на что мы смотрели, перерисовав все эти диаграммы с измененным наклоном этой конкретной линии. Вы обнаружите, что это не имеет никакого значения.
Единственное отличие состоит в наклоне линий равновесия твердое тело-жидкость. Для большинства растворителей они наклонены вперед, а линия ватерлинии — назад. Вы можете доказать себе, что это не влияет на то, на что мы смотрели, перерисовав все эти диаграммы с измененным наклоном этой конкретной линии. Вы обнаружите, что это не имеет никакого значения.
Как рассчитать давление пара раствора
Мы можем рассчитать давление пара раствора двумя способами, в зависимости от летучести растворенного вещества. Если растворенное вещество является летучим, оно будет оказывать собственное давление пара, и это количество является значительным вкладом в общее давление пара раствора и, следовательно, должно быть включено в расчеты. С другой стороны, если он нелетуч, растворенное вещество не будет создавать давление пара в растворе при этой температуре.
Нелетучие растворенные вещества
Эти вычисления довольно просты, если вам удобны стехиометрические преобразования. Поскольку растворенное вещество нелетучо, вам нужно только определить изменение давления паров растворителя. Используя уравнение для закона Рауля, вам нужно будет найти мольную долю растворителя, и обычно указывается давление пара чистого растворителя.
Пример \ (\ PageIndex {1} \): Kool-Aid
1,5 моля вишневого Kool-Aid добавляют в кувшин, содержащий 2 литра воды, в хороший день при температуре 25 o C.Давление паров одной воды составляет 23,8 мм рт. Ст. При температуре 25 o ° C. Каково новое давление паров Kool-Aid?
Решение
\ (P_ {H_2O} \) = 23,8 мм рт. Ст.
Чтобы найти мольную долю, необходимо сначала преобразовать 2 л воды в моль:
1 л = 1000 мл = 1000 г
Зная это, вы можете преобразовать массу воды (2000 г) в моль:
2000 г / 18,02 г (молярная масса воды) = 110,9 моль H 2 O
Найдите мольную долю, \ (\ chi_ {H_2O} \):
\ (\ chi_ {H_2O} \) = моль H 2 O / общее количество моль
= 110. 9 моль / 110,9 + 1,5 моль = 0,979
9 моль / 110,9 + 1,5 моль = 0,979
Наконец, примените закон Рауля
\ (P_ {Kool-Aid} = \ chi_ {H_2O} \, P_ {H_2O} \) = (0,979) (23,8 мм рт. Ст.) = 23,3 мм рт. Ст.
Пример \ (\ PageIndex {2A} \): неэлектролит
Рассчитайте давление пара раствора, полученного растворением 50,0 г глюкозы, \ (C_6H_ {12} O_6 \) в 500 г воды. Давление пара чистой воды 47,1 торр при 37 ° C
Решение
Чтобы использовать закон Рауля (уравнение \ (\ ref {RLaw} \)), нам нужно вычислить мольную долю воды (растворителя) в этом растворе сахар-вода.
\ [\ chi_ {растворитель} = \ dfrac {\ text {моль воды}} {\ text {моль растворенного вещества} + \ text {моль растворителя}} \ nonumber \]
\ [\ chi_ {растворитель} = \ dfrac {n_ {вода}} {n_ {глюкоза} + n_ {вода}} \ nonumber \]
Молярная масса глюкозы 180,2 г / моль и воды 18 г / моль. Итак
\ [n_ {вода} = \ dfrac {500 \, г} {18 \, г / моль} = 27,7 \, моль \ nonumber \]
и
\ [n_ {глюкоза} = \ dfrac {50 \, г} {180,2 \, г / моль} = 0,277 \, моль \ nonumber \]
и
\ [\ chi_ {растворитель} = \ dfrac {27.7 \, моль} {0,277 \, моль + 27,7 \, моль} = 0,99 \ nonumber \]
Обратите внимание, что это все еще относительно разбавленный.
\ [P_ {решение} = 0,99 \ times 47,1 = 46,63 \, торр \ nonumber \]
не сильно изменился.
Пример \ (\ PageIndex {2B} \): Электролит
Рассчитайте давление пара раствора, полученного растворением 50,0 г CaCl 2 , \ (C_6H_ {12} O_6 \) в 500 г воды. Давление пара чистой воды 47,1 торр при 37 ° C
Решение
Чтобы использовать закон Рауля (уравнение \ (\ ref {RLaw} \)), нам нужно вычислить мольную долю воды (растворителя) в этом растворе соленой воды.
\ [\ chi_ {растворитель} = \ dfrac {\ text {моль воды}} {\ text {моль растворенного вещества} + \ text {моль растворителя}} \ nonumber \]
\ [\ chi_ {растворитель} = \ dfrac {n_ {вода}} {n_ {растворенные вещества} + n_ {вода}} \ nonumber \]
Молярная масса \ (\ ce {CaCl_2} \) для 111 г / моль и воды 18 г / моль. +} = 0.-} = 0,9 \, моль \)
+} = 0.-} = 0,9 \, моль \)
и
\ [\ chi_ {растворитель} = \ dfrac {27,7 \, моль} {0,45 \, моль + 0,9 \, моль + 27,7 \, моль} = 0,953 \ nonumber \]
Обратите внимание, что это все еще относительно разбавленный.
\ [P_ {решение} = 0,953 \ times 47,1 = 44,88 \, торр \ nonumber \]
Более крупное изменение, чем в примере с глюкозой выше.
Летучие растворенные вещества
Единственное различие между летучими и нелетучими растворенными веществами состоит в том, что необходимо учитывать парциальное давление, создаваемое давлением пара летучего растворенного вещества и давлением пара растворителя.Сумма этих двух даст вам общее давление паров раствора.
Пример \ (\ PageIndex {3} \)
Каковы парциальные давления бензола и толуола в растворе с мольной долей бензола 0,6? Какое полное давление пара? Давление паров чистого бензола составляет 95,1 мм рт. Ст., А давление паров чистого толуола 28,4 мм рт. Ст. При температуре 25 o ° C.
Решение
Если \ (\ chi_ {бензол} = 0,6 \), то \ (\ chi_ {toluene} = 0.4 \), потому что \ (1 — 0,6 = 0,4 \).
Теперь, когда мы знаем мольные доли и давление пара, эта проблема решена.
P бензол = x бензол P бензол = (0,6) (95,1 мм рт. Ст.) = 57,1 мм рт. Ст.
P толуол = x толуол P толуол = (0,4) (28,4 мм рт. Ст.) = 11,4 мм рт. Ст.
Полное давление пара — это просто сумма парциальных давлений:
P всего = P бензол + P туолен = 57.1 мм рт. Ст. + 11,4 мм рт. Ст. = 68,5 мм рт. Ст.
Упражнения
* MM = молярная масса
- Каково давление паров раствора при 25 o C, содержащего 78,0 граммов глюкозы (MM = 180,16 г / моль) в 500 граммах воды? Давление пара чистой воды при этой температуре составляет 23,8 мм рт.
- 25 граммов циклогексана (P o = 80,5 торр, MM = 84,16 г / моль) и 30 граммов этанола (P o = 52,3 торр, MM = 92,14 г / моль) являются летучими компонентами, присутствующими в растворе.
 .Какое парциальное давление этанола?
.Какое парциальное давление этанола? - Каково давление паров чистого бутана при 20 o ° C, если его парциальное давление составляет 698 мм рт. Ст. В смеси бутан-ацетон, где мольная доля ацетона равна x = 0,577?
Решение
1.
Решить относительно x h3O .
моль H 2 O = 500 г / 18,02 г / моль = 27,7 моль H 2 O
моль глюкозы = 78 г / 180,16 г / моль = 0,433 моль глюкозы
x h3O = 27.о = (0,985) (23,8 мкм; рт. ст.) = 23,4 мкм; мм рт. ст. \]
2.
Рассчитайте количество молей каждого компонента.
- моль циклогексана: \ (\ dfrac {25 \; g} {84,16 \; г / моль} = 0,297 \; \ text {моль циклогексана} \)
- моль этанола: \ (\ dfrac {30 \; g} {92,14 \; г / моль} = 0,326 \; \ text {моль этанола} \)
Определите мольную долю этанола и примените закон Рауля.
Ксэтанол = 0,326 моль / (0,326 + 0,297) моль = 0.o = \ dfrac {P} {X} = \ dfrac {698 \; мм рт. ст.} {0,423} = 1650 \; мм рт. ст. \]
Авторы и авторство
Испарение раствора хлорида натрия из насыщенной пористой среды с образованием высолов
% PDF-1.4 % 1 0 объект > эндобдж 6 0 obj /Заголовок /Предмет / Автор /Режиссер / Ключевые слова / CreationDate (D: 20210304145539-00’00 ‘) / ModDate (D: 20140605165249 + 02’00 ‘) >> эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 объект > эндобдж 5 0 obj > транслировать GPL Ghostscript 9.10 Испарение — Поле случайных скоростей — Перенос ионов — Пористая среда — Кристаллизация2014-06-05T16: 52: 49 + 02: 002014-06-05T16: 52: 49 + 02: 00LaTeX с гиперссылкой
 -nKN Ք \ Z>; &]] N & tlb [
r9LpI-] qcKOZe «=? ~] ~ | zELJb * I @ 2og» yidoQ@Ji!JH|ni.2!aqT [[? Eѡњ
-nKN Ք \ Z>; &]] N & tlb [
r9LpI-] qcKOZe «=? ~] ~ | zELJb * I @ 2og» yidoQ@Ji!JH|ni.2!aqT [[? EѡњChem II Homework Exam 2
Chem II Homework Exam 2Домашнее задание Chem II, Материал для экзамена 2
Домашняя страница с видимыми ответами
На этой странице есть все необходимые домашние задания для материала, охваченного вторым экзаменом второго семестра по общей химии. Учебник, связанный с этим домашним заданием: CHEMISTRY The Central Science , автор: Brown, LeMay, et.al. Последним изданием, которое я потребовал от студентов купить, было издание 12 th (CHEMISTRY The Central Science, 12-е изд. Брауна, ЛеМэя, Берстена, Мерфи и Вудворда), но для этого курса подойдет любое издание этого текста.
Примечание. Ожидается, что дойдут до конца главы в вашем учебнике, найдут похожие вопросы и решат эти задачи. Это всего лишь необходимых задач для целей викторины. Вам также следует изучить Упражнения по главам.В упражнениях проработаны примеры вопросов в конце главы. В учебном пособии также проработаны примеры.
Это простые вопросы. Вопросы из учебника будут содержать дополнительную информацию, которая может быть полезной и которая связывает проблемы с практическими приложениями, многие из которых связаны с биологией.
Свойства растворов (Глава тринадцатая)
- Плотность этанола 0,789 г / мл, плотность воды 1.0 г / мл. Готовят раствор, в котором 58,3 мл этанола, C 2 H 5 OH, растворяют в 500 мл воды. Предположим, что объемы складываются.
- Какова мольная доля этанола в этом растворе?
( 58,3 мл ) ( ) ( ) = 1 моль C 2 H 5 OH ( 500 мл H 2 O ) ( ) ( ) = 27.  8 моль H 2 O
8 моль H 2 OВсего молей = 1 моль C 2 H 5 OH + 27,8 моль H 2 O = 28,8 моль
Мольная доля = моль C 2 H 5 OH общие родинки = 1 моль C 2 H 5 OH 28.Всего 8 родинок = 0,035 Молярный процент будет 3,5%.
- Что такое массовая доля?
( 58,3 мл ) ( ) = 46 г C 2 H 5 OH ( 500 мл H 2 O ) ( ) = 500 г H 2 O Общая масса = 46 г C 2 H 5 OH + 500 г H 2 O = 546 г
Массовая доля = масса C 2 H 5 OH полная масса = 46 г C 2 H 5 OH 546 грамм = 0.  084
084 Массовый процент будет 8,4%.
- Какая молярность?
Молярность = моль C 2 H 5 OH Л раствора = = 1.79 млн - Что такое молярность?
Моляльность = моль C 2 H 5 OH кг растворителя = 1 моль C 2 H 5 OH 0.5 кг H 2 O = 2 м
- Ответ
- Ответ
- Ответ
- Ответ
- Изопропиловый спирт в аптеке обычно состоит из 70% изопропилового спирта, C 3 H 7 OH и 30% воды по объему. Это соответствует 54,94 г C 3 H 7 OH и 30 г H 2 O в 100 мл. Плотность этого раствора 0,8494 г / мл. В этой задаче предполагается, что растворенным веществом является вода, а растворителем — спирт.
- Какова мольная доля и мольный процент воды в этом растворе?
( 54,94 г C 3 H 7 OH ) ( 1 моль C 3 H 7 OH 60 г C 3 H 7 OH ) = 0.  916 моль C 3 H 7 OH
916 моль C 3 H 7 OH( 30 г H 2 O ) ( ) = 1,67 моль H 2 O Всего молей = 0,916 моль C 3 H 7 OH + 1,67 моль H 2 O = 2,586 моль
Мольная доля = = 1.67 моль H 2 O 2,586 моль всего = 0,646 Молярный процент будет 64,6% .
- Какова массовая доля и массовый процент воды?
Общая масса = 54,94 г C 3 H 7 OH + 30 г H 2 O = 84.94 г
Массовая доля = = 30 г C 2 H 2 O 84,94 общих грамма = 0,353 Массовый процент будет 35.3% .
- Какая молярность воды?
Чтобы получить количество литров раствора, мы используем общую массу и плотность. Общая масса составляет 54,94 г плюс 30 г или 84,94 г.
( 84,94 г раствора ) ( 1 мл 0.  8494 г раствора
8494 г раствора ) = 100 мл раствора ( 30 г H 2 O ) ( ) = 1,67 моль H 2 O Молярность = моль H 2 O Л раствора = = 16.7 млн - Какова молярность воды?
Моляльность = моль H 2 O кг растворителя = 1.67 моль H 2 O 0,05494 кг C 3 H 7 OH = 30,4 м
- Ответ
- Ответ
- Ответ
- Ответ
- Какой будет точка плавления и температура кипения для раствора, содержащего 5 мл гексана, C 6 H 14 , (плотность = 0.658 г / мл) помещают в 100 мл бензола, C 6 H 6 (плотность = 0,8765 г / мл)? Нормальная температура кипения бензола составляет 80,1 ° C, а нормальная температура замерзания бензола составляет 5,5 ° C.
 Для бензола константа повышения температуры кипения, k b , составляет 2,53 ° C / м, а константа понижения точки замерзания, K f , составляет 5,12 ° C / м.
Для бензола константа повышения температуры кипения, k b , составляет 2,53 ° C / м, а константа понижения точки замерзания, K f , составляет 5,12 ° C / м.- Ответ
( 5 мл C 6 H 14 ) ( 0.658 г C 6 H 14 1 мл C 6 H 14 ) ( 1 моль C 6 H 14 86 г C 6 H 14 ) = 0.0383 моль C 6 H 14 ( 100 мл C 6 H 6 ) ( 0,8765 г C 6 H 6 1 мл C 6 H 6 ) ( ) = 0.08765 кг C 6 H 6
ΔT f = k f m = (5.Моляльность = 0,0383 моль C 6 H 14 0,08765 кг C 6 H 6 = 0,437 м  12 ° C / м) (0,437 м) = 2,24 ° C
Новый ф.п. = 5,5 ° C — 2,24 ° C = 3,26 ° C ΔT b = k b m = (2,53 ° C / м) (0,437 м) = 1,1 ° C
Новый б.п. = 80,1 ° C + 1,1 ° C = 81,2 ° C
12 ° C / м) (0,437 м) = 2,24 ° C
Новый ф.п. = 5,5 ° C — 2,24 ° C = 3,26 ° C ΔT b = k b m = (2,53 ° C / м) (0,437 м) = 1,1 ° C
Новый б.п. = 80,1 ° C + 1,1 ° C = 81,2 ° C
- Сколько литров этиленгликоля, C 2 H 6 O 2 , следует добавить к 3 л воды, чтобы приготовить раствор, который замерзнет при -20 ° C (-4 ° F)? Плотность C 2 H 6 O 2 составляет 1.11 г / мл и плотность воды 1 г / мл.
- Ответ
- ΔT = k f м ⇒ 20 ° C = (1,86 ° C / м) м ⇒
Моляльность = = 10,75 м = 10,75 моль C 2 H 6 O 2 кг воды ( 3 L H 2 O ) ( ) ( 10.75 моль C 2 H 6 O 2 1 кг H 2 O ) = 32,25 моль C 2 H 6 O 2 ( 32,25 моль C 2 H 6 O 2 ) ( 62 г C 2 H 6 O 2 1 моль C 2 H 6 O 2 ) ( 1 мл C 2 H 6 O 2 1.  11 г C 2 H 6 O 2
11 г C 2 H 6 O 2 ) = 1800 мл C 2 H 6 O 2 = 1,8 л
- ΔT = k f м ⇒ 20 ° C = (1,86 ° C / м) м ⇒
- Перечислите следующие водные растворы в порядке увеличения точки замерзания: 0,5 м Ca (NO 3 ) 2 , 0,8 м сахароза, 0,6 м LiF.
- Ответ
( 0.5 моль Ca (NO 3 ) 2 1 кг воды ) ( 3 моля частиц 1 моль Ca (NO 3 ) 2 ) = 1.5 мкм в частицах ( 0,8 моль сахарозы 1 кг воды ) ( 1 моль частиц 1 моль сахарозы ) = 0.8 мкм в частицах ( 0,6 моль LiF 1 кг воды ) ( 2 моля частиц 1 моль LiF ) = 1.2 мкм в частицах ΔT f = k f m предполагает, что изменение точки замерзания напрямую связано с моляльностью частиц в растворе. Чем больше моляльность, тем больше ΔT и ниже точка замерзания. Наивысшей точкой замерзания будет раствор с наименьшей моляльностью, которым является сахароза. Следующим будет раствор LiF, а раствор Ca (NO 3 ) 2 будет иметь самую низкую точку замерзания.
- Нандролон — это анаболический стероид (химическое вещество для наращивания мышечной массы), которое естественным образом встречается в организме человека, но только в крошечных количествах.Образец 20 г нандролона помещали в 500 мл CCl 4 (плотность = 1,59 г / мл), и было обнаружено, что точка замерзания раствора на 1,75 ° C ниже, чем нормальная точка замерзания. Каков молекулярный вес нандролона? k f для CCl 4 составляет 29,8 ° C / м.
- Ответ
Моляльность = = = 0.0587 м = 0,0587 моль нандролона кг CCl 4 (500 мл CCl 4 ) (1,59 г / мл) = 795 г CCl 4 = 0,795 кг CCl 4
( 0,795 кг CCl 4 ) ( 0.0587 моль нандролон 1 кг CCl 4 ) = 0,04667 моль нандролона Молекулярная масса = 20 г нандролона 0.04667 моль нандролон = 428,5 г / моль (C 28 H 44 O 3 )
- Парциальное давление кислорода, O 2 , при наивысшем зарегистрированном атмосферном давлении составляло 0,225 атм, а концентрация в воде при этих условиях составляла 6,5 x 10 -5 М. Какова была концентрация в воде при самом низком зарегистрированном атмосферном давлении. когда парциальное давление кислорода было 0.18 атм? Рыбам необходимо 1,56 x 10 -7 M O 2 , чтобы выжить. Достаточно ли у них высокая концентрация при самом низком зарегистрированном атмосферном давлении?
- Ответ
- Используя закон Генри: k = C г / P г = (6,5 x 10 -5 M) / (0,225 атм) = 0,00029 M / атм.
В новых условиях концентрация будет:
C г = (0,00029 М / атм) (0,18 атм) = 5 x 10 -5 M
Кислорода у рыбы будет много!
- Используя закон Генри: k = C г / P г = (6,5 x 10 -5 M) / (0,225 атм) = 0,00029 M / атм.
В новых условиях концентрация будет:
C г = (0,00029 М / атм) (0,18 атм) = 5 x 10 -5 M
- Давление пара над чистым растворителем составляет 120 торр.После добавления нелетучего растворенного вещества к растворителю давление над раствором составляет 80 торр. Какова мольная доля растворенного вещества в этом растворе?
- Ответ
В этом случае растворенное вещество является нелетучим, поэтому P ° растворенное вещество = 0.
P раствор = X растворитель P ° растворитель + X растворенное вещество P ° растворенное вещество = X растворитель P ° растворитель
X растворитель = P soln / P ° растворитель = (80 торр) / (120 торр) = 0.667
X растворитель + X растворенное вещество = 1 ⇒ X растворенное вещество = 1 — 0,667 = 0,333
Рассчитайте полное давление пара над раствором при 20 ° C, когда 100 моль C 6 H 12 объединены с 10 молями C 7 H 16 . Вот некоторые данные для этих веществ, которые могут быть использованы в этой задаче и в следующих двух задачах:
P ° (при 20 ° C) Плотность Молек.Вес. C 6 H 12 77,7 Торр 0,779 г / мл 84,16 г / моль C 7 H 16 90240 мл 100,21 г / моль - Ответ
- P до = X C 6 H 12 P ° C 6 H 12 + X C 7 H 16 P ° C 7 H = P C 6 H 12 + P C 7 H 16
P C 6 H 12 = ( 100 моль C 6 H 12 110 Всего родинок ) ( 77.7 Торр ) = 70,64 торр (C 6 H 12 )
P Итого = 74,28 ТоррP C 7 H 16 = ( 10 моль C 7 H 16 110 Всего родинок ) ( 40 Торр ) = 3.636 торр (C 7 H 16 )
- P до = X C 6 H 12 P ° C 6 H 12 + X C 7 H 16 P ° C 7 H = P C 6 H 12 + P C 7 H 16
- Какое давление пара над раствором, полученным путем объединения 500 мл C 6 H 12 и 100 мл C 7 H 16 ? См. Таблицу данных в предыдущей задаче.
- Ответ
Получите родинки каждого:
( 500 мл C 6 H 12 ) ( ) ( 1 моль C 6 H 12 84.16 г C 6 H 12 ) = 4,628 моль C 6 H 12 ( 100 мл C 7 H 16 ) ( ) ( 1 моль C 6 H 12 100.21 г C 7 H 16 ) = 0,6826 моль C 7 H 16 P C 6 H 12 = ( 4,628 моль C 6 H 12 5.311 Всего молей ) ( 77,7 Торр ) = 67,7 торр (C 6 H 12 )
P Итого = 72,84 ТоррP C 7 H 16 = ( 0,6826 моль C 7 H 16 5.311 Всего молей ) ( 40 Торр ) = 5,14 торр (C 7 H 16 )
- Каковы мольные доли C 6 H 12 и C 7 H 16 , если полное давление пара над раствором составляет 70 Торр? См. Таблицу данных в предпоследней задаче.
- Ответ
- P до = X C 6 H 12 P ° C 6 H 12 + X C 7 H 16 P ° C 7 H ; 1 = X C 6 H 12 + X C 7 H 16 70 торр = (1 — X C 7 H 16 ) (77,7 торр) + (X C 7 H 16 ) (40 торр) Решите, чтобы получить X C 7 H 16 = 0.2 и C 6 H 12 = 0,8
- Смесь сахара, C 6 H 12 O 6 и 500 мл воды имеет полное давление пара 9,0 торр при 10 ° C. Сколько сахара было добавлено в воду? При 10 ° C давление пара чистой воды составляет 9,21 торр, а плотность воды составляет 0,9997 г / мл.
- Ответ
- P до = X C 6 H 12 O 6 P ° C 6 H 12 O 6 + X H 2 O P ° H H 2 O ; P ° C 6 H 12 O 6 = 0 X H 2 O = P до / P ° H 2 O = (9 торр) / (9.21 торр) = 0,977 = (моль H 2 O) / (всего моль)
⇒ 0,977 = (27,77 моль H 2 O) / (x моль C 6 H 12 O 6 + 27.77 моль H 2 O) Решите относительно x, чтобы получить 0,654 моль C 6 H 12 O 6 (0,654 моль C 6 H 12 O 6 ) (180 г / моль) = 118 г C 6 H 12 O 6( 500 мл H 2 O ) ( ) ( ) = 27,77 моль H 2 O
- P до = X C 6 H 12 O 6 P ° C 6 H 12 O 6 + X H 2 O P ° H H 2 O ; P ° C 6 H 12 O 6 = 0 X H 2 O = P до / P ° H 2 O = (9 торр) / (9.21 торр) = 0,977 = (моль H 2 O) / (всего моль)
- Опишите межмолекулярные силы для каждого из решений (a), (b) и (c), которые будут вызывать поведение, показанное в каждом случае.
- Ответ
(a) Идеальное решение, все межмолекулярные взаимодействия одинаковы.
(b) Межмолекулярные силы соовент-растворитель и растворенное вещество-растворенное вещество больше, чем межмолекулярные силы растворитель-растворенное вещество. Это затрудняет растворение и увеличивает вероятность перехода в паровую фазу.
(c) Межмолекулярные силы растворитель-растворитель и растворенное вещество-растворенное вещество меньше, чем межмолекулярные силы растворитель-растворенное вещество. Растворенное вещество притягивается к растворителю, и над раствором остается меньше пара.
Определение массового процентного состава водного раствора
Определение и понимание состава раствора является фундаментальным в широком спектре химических методов.Раствор представляет собой однородную смесь, состоящую из вещества, растворенного в жидкости. Растворенное вещество называется растворенным веществом, а основная жидкость — растворителем. Растворы можно описать несколькими способами — во-первых, по типу растворителя, используемого для растворения растворенного вещества. В водных растворах в качестве растворителя используется вода. Органические растворители, такие как хлороформ, ацетонитрил или ацетон, используются для приготовления органических растворов в зависимости от свойств растворенного вещества.
Растворы также характеризуются количеством растворенного вещества, растворенного в определенном объеме растворителя, или концентрацией.Для получения дополнительной информации см. Видео этой коллекции «Растворы и концентрации».
Односторонний расчет концентрации раствора основан на массе каждого компонента раствора, называемой массовым процентом. Это видео познакомит вас с массовым процентом растворов и продемонстрирует, как определить это значение в лаборатории.
Количество растворенного вещества в растворителе можно выразить несколькими способами. Во-первых, массовый процент рассчитывается как масса растворенного вещества, деленная на общую массу раствора.Массовый процент записывается как процент по весу / весу, так как его иногда называют весовым процентом. Однако термин массовый процент обычно считается правильным.
Количество растворенного вещества в растворе также может быть выражено в массовых процентах по объему, обычно используемых в биологии, и рассчитывается как общая масса растворенного вещества, деленная на объем раствора. Эта единица не является истинным процентом, так как это не безразмерная величина. Аналогичным образом используется объемный процент, когда объем растворенного вещества делится на общий объем раствора.
Массовый процент отличается от объемного процента, так как только масса является добавочной величиной. Масса раствора — это сумма компонентов. Объем, с другой стороны, не всегда является аддитивным, поскольку молекулы растворенного вещества помещаются в открытые пространства между молекулами растворителя, что приводит к меньшему объему, чем ожидалось.
Несколько простых методов можно использовать для определения массового процента раствора в лаборатории. Во-первых, прямой метод требует регистрации общей массы раствора, а затем выпаривания растворителя.Оставшееся твердое вещество — это растворенное вещество, которое затем взвешивается и используется для расчета массового процента.
Плотность также может использоваться для определения массового процента неизвестной концентрации. Сначала готовится серия стандартных растворов с различными количествами растворенных веществ. Выберите стандарты с концентрацией от отсутствия растворенного вещества до максимальной растворимости растворенного вещества. Затем рассчитывается плотность для каждого стандарта и сравнивается с плотностью образца. Теперь, когда были изложены основы расчета массовых процентов, давайте посмотрим на расчет массовых процентов с использованием прямого метода и метода плотности в лаборатории.
Сначала взвесьте чистый и высушенный в печи стакан или чашу для кристаллизации и запишите массу.
Налейте небольшой объем раствора в чашку и точно взвесьте раствор и чашку. Вычтите вес чашки и запишите массу раствора.
Затем поставьте блюдо на плиту или в духовку, чтобы вода стекала. Медленное испарение является идеальным вариантом, так как кипение может привести к разбрызгиванию раствора и потере растворенного вещества. После испарения растворителя охладите оставшееся твердое вещество, которое является растворенным веществом.Точно определите массу. Рассчитайте массовый процент, разделив массу растворенного вещества после испарения на массу исходного раствора.
Сначала приготовьте пять стандартов с процентным содержанием состава в диапазоне от минимального до максимального ожидаемого неизвестного процентного состава. Не превышайте растворимость системы. Рассчитайте количество растворенного вещества и растворителя, необходимое для приготовления процентных композиций.
Взвесьте растворенное вещество и растворите его в определенной массе растворителя.
Затем измерьте массу точного объема каждого стандартного раствора. Затем рассчитайте плотность для каждого раствора. Сделайте то же самое с неизвестным решением. Смотрите видео этой коллекции о плотности для получения дополнительной информации.
Постройте график зависимости плотности стандартных растворов от массовых процентов. В этом примере был приготовлен набор стандартов хлорида натрия с составами в массовых процентах от 5 до 25% растворенного вещества в растворе. После нанесения данных на график примените линейную линию тренда и определите уравнение, где y — плотность, а x — массовый процентный состав.Используйте плотность неизвестного раствора, в данном случае 1,053 г / мл, чтобы определить его массовый процент. Решив для x, оказалось, что оно составляет 7,4%.
Теперь, когда вы ознакомились с основами определения массового процента водных растворов, давайте рассмотрим некоторые случаи, когда необходимо знать концентрацию раствора.
Буферные растворы обычно используются во многих лабораторных экспериментах, особенно в биологических приложениях. Буферные растворы содержат определенную концентрацию растворенных слабых кислот или оснований и их конъюгатов, что позволяет им поддерживать и противостоять изменениям pH.Часто буферы готовят с использованием смеси многих солей, в том числе с фосфатными группами, которые поддерживают постоянный pH в диапазоне 7,2–7,6.
Массовый процент также используется для разделения сложных смесей, как в этом примере градиента плотности. Для этого готовятся растворы с диапазоном массовых процентов, которые затем последовательно наслаивают от высокого массового процента до низкого массового процента. Это создает градиент плотности в трубке. Затем образец загружают на вершину градиента и центрифугируют.Затем компоненты смеси разделяются в зависимости от того, как далеко они проходят по трубке.
Понимание массового процента имеет решающее значение не только для применения в химии, но и для экологических исследований. Содержание влаги в почве важно понимать, чтобы определять условия окружающей среды, которые могут влиять на экосистемы. Содержание влаги в почве — это массовый процент, который описывает количество воды, удерживаемой в почве. Содержание влаги легко определить, взвесив влажную почву, высушив ее в печи и повторно взвесив.
Вы только что посмотрели введение JoVE в определение массового процента водного раствора. Теперь вы должны понимать важность массового процента, его использования в лаборатории и того, как определить его для водного раствора.
Спасибо за просмотр!
Молярность | Химия
ЦЕЛИ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Опишите основные свойства решений
- Рассчитайте концентрацию раствора, используя молярность
- Выполните расчеты разбавления, используя уравнение разбавления
В предыдущих разделах мы сосредоточились на составе веществ: образцы вещества, содержащие только один тип элемента или соединения.Однако смеси — образцы вещества, содержащие два или более вещества, соединенных физически, — встречаются в природе чаще, чем чистые вещества. Как и в случае с чистым веществом, относительный состав смеси играет важную роль в определении ее свойств. Относительное количество кислорода в атмосфере планеты определяет ее способность поддерживать аэробную жизнь. Относительные количества железа, углерода, никеля и других элементов в стали (смеси, известной как «сплав») определяют ее физическую прочность и устойчивость к коррозии.Относительное количество активного ингредиента в лекарстве определяет его эффективность в достижении желаемого фармакологического эффекта. Относительное количество сахара в напитке определяет его сладость (см. Рисунок 1). В этом разделе мы опишем один из наиболее распространенных способов количественной оценки относительного состава смесей.
Рис. 1. Сахар — один из многих компонентов сложной смеси, известной как кофе. Количество сахара в данном количестве кофе является важным фактором, определяющим сладость напитка.(кредит: Джейн Уитни)
Решения
Ранее мы определили растворы как гомогенные смеси, что означает, что состав смеси (и, следовательно, ее свойства) одинаковы по всему объему. Решения часто встречаются в природе, а также были реализованы во многих формах искусственных технологий. Мы рассмотрим более подробное рассмотрение свойств растворов в главе, посвященной растворам и коллоидам, но здесь мы познакомим вас с некоторыми из основных свойств растворов.
Относительное количество данного компонента раствора известно как его концентрация . Часто, хотя и не всегда, раствор содержит один компонент с концентрацией, значительно превышающей концентрацию всех других компонентов. Этот компонент называется растворителем и может рассматриваться как среда, в которой диспергированы другие компоненты, или как растворенный . Растворы, в которых растворителем является вода, конечно, очень распространены на нашей планете. Раствор, в котором вода является растворителем, называется водным раствором .
Растворенное вещество представляет собой компонент раствора, который обычно присутствует в гораздо более низкой концентрации, чем растворитель. Концентрации растворенных веществ часто описываются качественными терминами, такими как разбавленный (относительно низкой концентрации) и концентрированный (относительно высокой концентрации).
Концентрации могут быть количественно оценены с использованием большого количества единиц измерения, каждая из которых удобна для конкретных применений. Молярность ( M ) — полезная единица измерения концентрации для многих приложений в химии.Молярность определяется как количество молей растворенного вещества в 1 литре (1 л) раствора:
[латекс] M = \ frac {\ text {mol solute}} {\ text {L solution}} [/ latex]
Пример 1
Расчет молярных концентрацийОбразец безалкогольного напитка объемом 355 мл содержит 0,133 моль сахарозы (столовый сахар). Какая молярная концентрация сахарозы в напитке?
РешениеПоскольку указаны молярное количество растворенного вещества и объем раствора, молярность можно рассчитать, используя определение молярности.Согласно этому определению, объем раствора должен быть преобразован из мл в л:
.[латекс] M = \ frac {\ text {mol solute}} {\ text {L solution}} = \ frac {0.133 \ text {mol}} {355 \ text {mL} \ times \ frac {1 \ text {L}} {1000 \ text {mL}}} = 0,375M [/ латекс]
Проверьте свои знанияЧайная ложка столового сахара содержит около 0,01 моль сахарозы. Какова молярность сахарозы, если чайная ложка сахара была растворена в чашке чая объемом 200 мл?
Пример 2
Получение молей и объемов из молярных концентрацийСколько сахара (моль) содержится в небольшом глотке (~ 10 мл) безалкогольного напитка из Примера 1?
РешениеВ этом случае мы можем изменить определение молярности, чтобы выделить искомое количество в молях сахара.Затем мы подставляем значение молярности, полученное в примере 1, 0,375 M :
.[латекс] \ begin {array} {c} \\ M = \ frac {\ text {mol solute}} {\ text {L solution}} \\ \ text {mol solute} = M \ times \ text {L решение} \\ \\ \ text {моль растворенного вещества} = 0,375 \ frac {\ text {моль сахара}} {\ text {L}} \ times \ left (10 \ text {mL} \ times \ frac {1 \ text {L}} {1000 \ text {mL}} \ right) = 0,004 \ text {моль сахара} \ end {array} [/ latex]
Проверьте свои знанияКакой объем (мл) подслащенного чая, описанного в примере 1, содержит такое же количество сахара (моль), что и 10 мл безалкогольного напитка в этом примере?
Пример 3
Расчет молярных концентраций по массе растворенного веществаДистиллированный белый уксус (рис. 2) представляет собой раствор уксусной кислоты CH 3 CO 2 H в воде.Раствор 0,500 л уксуса содержит 25,2 г уксусной кислоты. Какова концентрация раствора уксусной кислоты в единицах молярности?
Рис. 2. Дистиллированный белый уксус — это раствор уксусной кислоты в воде.
РешениеКак и в предыдущих примерах, определение молярности является основным уравнением, используемым для расчета искомого количества. В этом случае указывается масса растворенного вещества вместо его молярного количества, поэтому мы должны использовать молярную массу растворенного вещества, чтобы получить количество растворенного вещества в молях:
[латекс] M = \ frac {\ text {mol solute}} {\ text {L solution}} = \ frac {25.2 g {\ text {CH}} _ {2} {\ text {CO}} _ {2} \ text {H} \ times \ frac {1 {\ text {mol CH}} _ {2} {\ text {CO}} _ {2} \ text {H}} {{\ text {60,052 г CH}} _ {2} {\ text {CO}} _ {2} \ text {H}}} {\ text { 0,500 л раствора}} = 0,839M [/ латекс]
[латекс] \ begin {array} {l} \\ M = \ frac {\ text {mol solute}} {\ text {L solution}} = 0.839M \\ M = \ frac {0.839 \ text {mol solute }} {1.00 \ text {L решение}} \ end {array} [/ latex]
Проверьте свои знанияРассчитайте молярность 6,52 г CoCl 2 (128,9 г / моль), растворенного в водном растворе общим объемом 75.0 мл.
Пример 4
Определение массы растворенного вещества в заданном объеме раствораСколько граммов NaCl содержится в 0,250 л раствора 5,30- M ?
Решение
Объем и молярность раствора указаны, поэтому количество (моль) растворенного вещества легко вычислить, как показано в Примере 2:
[латекс] \ begin {array} {c} \\ M = \ frac {\ text {mol solute}} {\ text {L solution}} \\ \ text {mol solute} = M \ times \ text {L раствор} \\ \ text {моль растворенного вещества} = 5.30 \ frac {\ text {mol NaCl}} {\ text {L}} \ times 0,250 \ text {L} = 1,325 \ text {mol NaCl} \ end {array} [/ latex]
Наконец, это молярное количество используется для определения массы NaCl:
[латекс] \ text {1,325 моль NaCl} \ times \ frac {58.44 \ text {г NaCl}} {\ text {моль NaCl}} = 77,4 \ text {г NaCl} [/ латекс]
Проверьте свои знанияСколько граммов CaCl 2 (110,98 г / моль) содержится в 250,0 мл раствора хлорида кальция 0,200- M ?
При пошаговом выполнении вычислений, как в примере 4, важно воздерживаться от округления любых промежуточных результатов вычислений, которые могут привести к ошибкам округления в конечном результате.В примере 4 молярное количество NaCl, вычисленное на первом этапе, 1,325 моль, должно быть правильно округлено до 1,32 моль, если оно должно быть указано; однако, хотя последняя цифра (5) не имеет значения, ее необходимо сохранить как защитную цифру в промежуточных вычислениях. Если бы мы не сохранили эту защитную цифру, окончательный расчет массы NaCl составил бы 77,1 г, то есть разница в 0,3 г.
Помимо сохранения защитной цифры для промежуточных вычислений, мы также можем избежать ошибок округления, выполняя вычисления за один шаг (см. Пример 5).Это исключает промежуточные этапы, поэтому округляется только конечный результат.
Пример 5
Определение объема раствора, содержащего заданную массу растворенного веществаВ примере 3 мы обнаружили, что типичная концентрация уксуса составляет 0,839 M . В каком объеме уксуса содержится 75,6 г уксусной кислоты?
Решение
Сначала используйте молярную массу, чтобы вычислить количество молей уксусной кислоты из заданной массы:
[латекс] \ text {g solute} \ times \ frac {\ text {mol solute}} {\ text {g solute}} = \ text {mol solute} [/ latex]
Затем используйте молярность раствора для расчета объема раствора, содержащего это молярное количество растворенного вещества:
[латекс] \ text {mol solute} \ times \ frac {\ text {L solution}} {\ text {mol solute}} = \ text {L solution} [/ latex]
Объединение этих двух шагов в один дает:
[латекс] \ text {g solute} \ times \ frac {\ text {mol solute}} {\ text {g solute}} \ times \ frac {\ text {L solution}} {\ text {mol solute}} = \ text {L раствор} [/ латекс]
[латекс] 75.6 \ text {g} {\ text {CH}} _ {3} {\ text {CO}} _ {2} \ text {H} \ left (\ frac {\ text {mol} {\ text {CH} } _ {3} {\ text {CO}} _ {2} \ text {H}} {60.05 \ text {g}} \ right) \ left (\ frac {\ text {L solution}} {0.839 \ text {mol} {\ text {CH}} _ {3} {\ text {CO}} _ {2} \ text {H}} \ right) = 1.50 \ text {L solution} [/ latex]
Проверьте свои знанияКакой объем раствора 1,50- M KBr содержит 66,0 г KBr?
Разведение растворов
Разбавление — это процесс уменьшения концентрации раствора за счет добавления растворителя.Например, мы можем сказать, что стакан холодного чая становится все более разбавленным по мере таяния льда. Вода из тающего льда увеличивает объем растворителя (воды) и общий объем раствора (холодный чай), тем самым снижая относительные концентрации растворенных веществ, которые придают напитку его вкус (рис. 3).
Рис. 3. Оба раствора содержат одинаковую массу нитрата меди. Раствор справа более разбавлен, потому что нитрат меди растворен в большем количестве растворителя.(кредит: Марк Отт)
Разбавление также является обычным способом приготовления растворов желаемой концентрации. Добавляя растворитель к отмеренной части более концентрированного маточного раствора , мы можем достичь определенной концентрации. Например, коммерческие пестициды обычно продаются в виде растворов, в которых активные ингредиенты гораздо более концентрированы, чем это необходимо для их применения. Прежде чем их можно будет использовать на сельскохозяйственных культурах, пестициды необходимо разбавить. Это также очень распространенная практика для приготовления ряда обычных лабораторных реагентов (рис. 4).
Рис. 4. Раствор KMnO4 готовят путем смешивания воды с 4,74 г KMnO4 в колбе. (кредит: модификация работы Марка Отта)
Простое математическое соотношение может использоваться для соотнесения объемов и концентраций раствора до и после процесса разбавления. Согласно определению молярности, молярное количество растворенного вещества в растворе равно произведению молярности раствора и его объема в литрах:
[латекс] n = ML [/ латекс]
Подобные выражения могут быть записаны для раствора до и после его разбавления:
[латекс] {n} _ {1} = {M} _ {1} {L} _ {1} [/ latex]
[латекс] {n} _ {2} = {M} _ {2} {L} _ {2} [/ latex]
, где нижние индексы «1» и «2» относятся к раствору до и после разбавления соответственно.Поскольку процесс разбавления не изменяет количество растворенного вещества в растворе, n 1 = n 2 . Таким образом, эти два уравнения могут быть приравнены друг к другу:
[латекс] {M} _ {1} {L} _ {1} = {M} _ {2} {L} _ {2} [/ латекс]
Это соотношение обычно называют уравнением разбавления. Хотя мы вывели это уравнение, используя молярность в качестве единицы концентрации и литров в качестве единицы объема, можно использовать другие единицы концентрации и объема, при условии, что эти единицы должным образом сокращаются в соответствии с методом метки фактора.Отражая эту универсальность, уравнение разбавления часто записывается в более общей форме:
[латекс] {C} _ {1} {V} _ {1} = {C} _ {2} {V} _ {2} [/ латекс]
, где C и V — концентрация и объем, соответственно.
Используйте моделирование PhET для концентрации, чтобы изучить отношения между количеством растворенного вещества, объемом раствора и концентрацией и подтвердить уравнение разбавления.
Пример 6
Определение концентрации разбавленного раствораЕсли 0.850 л 5,00- M раствора нитрата меди Cu (NO 3 ) 2 разбавляют до объема 1,80 л путем добавления воды. Какова молярность разбавленного раствора?
Решение
Нам даны объем и концентрация основного раствора, V 1 и C 1 , и объем полученного разбавленного раствора V 2 . Нам нужно найти концентрацию разбавленного раствора, C 2 .Таким образом, мы изменяем уравнение разбавления, чтобы выделить C 2 :
[латекс] \ begin {array} {c} {C} _ {1} {V} _ {1} = {C} _ {2} {V} _ {2} \\ \\ {C} _ { 2} = \ frac {{C} _ {1} {V} _ {1}} {{V} _ {2}} \ end {array} [/ latex]
Поскольку основной раствор разбавляется более чем в два раза (объем увеличивается с 0,85 л до 1,80 л), можно ожидать, что концентрация разбавленного раствора будет меньше половины 5 M . Мы сравним эту приблизительную оценку с расчетным результатом, чтобы проверить наличие грубых ошибок в вычислениях (например, таких как неправильная замена заданных величин).Подставляя указанные значения в члены в правой части этого уравнения, получаем:
[латекс] {C} _ {2} = \ frac {0.850 \ text {L} \ times 5.00 \ frac {\ text {mol}} {\ text {L}}} {1.80 L} = 2.36M [/ латекс]
Этот результат хорошо согласуется с нашей приблизительной оценкой (это чуть меньше половины концентрации запасов, 5 M ).
Проверьте свои знанияКакова концентрация раствора, полученная при разбавлении 25,0 мл раствора 2,04- M CH 3 OH до 500.0 мл?
Пример 7
Объем разбавленного раствораКакой объем 0,12 M HBr можно получить из 11 мл (0,011 л) 0,45 M HBr?
Решение
Нам даны объем и концентрация исходного раствора, V 1 и C 1 , и концентрация полученного разбавленного раствора C 2 . Нам нужно найти объем разбавленного раствора, V 2 .Таким образом, мы изменим уравнение разбавления, чтобы выделить V 2 :
[латекс] \ begin {array} {c} {C} _ {1} {V} _ {1} = {C} _ {2} {V} _ {2} \\ \\ {V} _ { 2} = \ frac {{C} _ {1} {V} _ {1}} {{C} _ {2}} \ end {array} [/ latex]
Поскольку концентрация разбавленного раствора (0,12 M ) составляет чуть более одной четвертой исходной концентрации (0,45 M ), мы ожидаем, что объем разбавленного раствора будет примерно в четыре раза больше исходной концентрации, или около 44 мл. . Подставляя данные значения и решая неизвестный объем, получаем:
[латекс] \ begin {array} {c} \\ {V} _ {2} = \ frac {\ left (0.45M \ right) \ left (0,011 \ text {L} \ right)} {\ left (0,12M \ right)} \\ {V} _ {2} = 0,041 \ text {L} \ end {array} [/ латекс]
Объем раствора 0,12- M составляет 0,041 л (41 мл). Результат разумный и хорошо согласуется с нашей приблизительной оценкой.
Проверьте свои знанияЛабораторный эксперимент требует 0,125 M HNO 3 . Какой объем 0,125 M HNO 3 можно приготовить из 0,250 л 1,88 M HNO 3 ?
Пример 8
Объем концентрированного раствора, необходимый для разведенияКакой объем 1.59 M KOH требуется для приготовления 5,00 л 0,100 M KOH?
Решение
Нам дана концентрация исходного раствора C 1 , а также объем и концентрация полученного разбавленного раствора V 2 и C 2 . Нам нужно найти объем основного раствора, V 1 . Таким образом, мы изменяем уравнение разбавления, чтобы выделить V 1 :
[латекс] \ begin {array} {c} {C} _ {1} {V} _ {1} = {C} _ {2} {V} _ {2} \\ \\ {V} _ { 1} = \ frac {{C} _ {2} {V} _ {2}} {{C} _ {1}} \ end {array} [/ latex]
Так как концентрация разбавленного раствора 0.100 M составляет примерно одну шестнадцатую объема исходного раствора (1,59 M ), мы ожидаем, что объем исходного раствора будет примерно в одну шестнадцатую объема разбавленного раствора, или около 0,3 литра. Подставляя данные значения и решая неизвестный объем, получаем:
[латекс] \ begin {array} {c} \\ {V} _ {1} = \ frac {\ left (0,100M \ right) \ left (5,00 \ text {L} \ right)} {1,59M} \\ {V} _ {1} = 0,314 \ text {L} \ end {array} [/ latex]
Таким образом, нам потребуется 0,314 л раствора 1,59- M для приготовления желаемого раствора.Этот результат согласуется с нашей приблизительной оценкой.
Проверьте свои знанияКакой объем раствора глюкозы 0,575- M , C 6 H 12 O 6 , можно приготовить из 50,00 мл раствора глюкозы 3,00- M ?
Ключевые концепции и резюме
Растворы представляют собой однородные смеси. Многие растворы содержат один компонент, называемый растворителем, в котором растворены другие компоненты, называемые растворенными веществами.Водный раствор — это раствор, в котором растворителем является вода. Концентрация раствора является мерой относительного количества растворенного вещества в данном количестве раствора. Концентрации могут быть измерены с использованием различных единиц, одна очень полезная единица — молярность, определяемая как количество молей растворенного вещества на литр раствора. Концентрация растворенного вещества в растворе может быть уменьшена путем добавления растворителя, этот процесс называется разбавлением. Уравнение разбавления представляет собой простую связь между концентрациями и объемами раствора до и после разбавления.
Ключевые уравнения
- [латекс] M = \ frac {\ text {mol solute}} {\ text {L solution}} [/ latex]
- C 1 V 1 = C 2 V 2
Упражнения по химии в конце главы
- Объясните, что меняется, а что остается прежним, когда 1,00 л раствора NaCl разбавляется до 1,80 л.
- Какая информация нам нужна для расчета молярности раствора серной кислоты?
- Что это значит, когда мы говорим, что образец объемом 200 мл и образец раствора соли объемом 400 мл имеют одинаковую молярность? В чем идентичность двух образцов? Чем отличаются эти два образца
- Определите молярность для каждого из следующих растворов:
- 0.{4} \ text {mg} [/ latex] HCl в 0,075 л раствора
- Определите молярность каждого из следующих растворов:
- 1,457 моль KCl в 1,500 л раствора
- 0,515 г H 2 SO 4 в 1,00 л раствора
- 20,54 г Al (NO 3 ) 3 в 1575 мл раствора
- 2,76 кг CuSO 4 • 5H 2 O в 1,45 л раствора
- 0,005653 моль Br 2 в 10,00 мл раствора
- 0.000889 г глицина, C 2 H 5 NO 2 , в 1,05 мл раствора
- Задумайтесь над вопросом: какова масса растворенного вещества в 0,500 л 0,30 M глюкозы, C 6 H 12 O 6 , используемых для внутривенной инъекции?
- Опишите шаги, необходимые для ответа на вопрос.
- Ответьте на вопрос.
- Задумайтесь над вопросом: какова масса растворенного вещества в 200,0 л 1.{-5} M {\ text {H}} _ {2} {\ text {SO}} _ {4} [/ latex], образец кислотного дождя
- 0,2500 л 0,1135 M K 2 CrO 4 , аналитический реагент, используемый в анализах железа
- 10,5 л 3,716 M (NH 4 ) 2 SO 4 , жидкое удобрение
- Опишите шаги, необходимые для ответа на вопрос.
- Ответьте на вопрос.
- Опишите шаги, необходимые для ответа на вопрос.
- Ответьте на вопрос.
- 0,195 г холестерина, C 27 H 46 O, в 0,100 л сыворотки, средняя концентрация холестерина в сыворотке крови человека
- 4.25 г NH 3 в 0,500 л раствора, концентрация NH 3 в бытовом аммиаке
- 1,49 кг изопропилового спирта, C 3 H 7 OH, в 2,50 л раствора, концентрация изопропилового спирта в медицинском спирте
- 0,029 г I 2 в 0,100 л раствора, растворимость I 2 в воде при 20 ° C
- 293 г HCl в 666 мл раствора, концентрированный раствор HCl
- 2.026 г FeCl 3 в 0,1250 л раствора, используемого как неизвестный в лабораториях общей химии
- 0,001 мг Cd 2+ в 0,100 л, ПДК кадмия в питьевой воде
- 0,0079 г C 7 H 5 SNO 3 в одной унции (29,6 мл), концентрация сахарина в диетическом безалкогольном напитке.
- 1.00 л 0,250- M раствора Fe (NO 3 ) 3 разбавляют до конечного объема 2,00 л
- 0,5000 л раствора 0,1222- M C 3 H 7 OH разбавляют до конечного объема 1,250 л
- 2,35 л 0,350- M раствора H 3 PO 4 разбавляют до конечного объема 4,00 л
- 22,50 мл 0,025- M раствора C 12 H 22 O 11 разбавляют до 100.0 мл
(b) Сначала преобразуйте массу в граммах в моль, а затем подставьте соответствующие термины в определение.
Молярная масса of H 3 PO 4 = 97,995 г / моль
[латекс] {\ text {mol (H}} _ {3} {\ text {PO}} _ {4} \ text {)} = 98.0 \ text {g} \ times \ frac {1 \ text {mol }} {97.995 \ text {g}} = 1.00 \ text {mol} [/ latex]
[латекс] M = \ frac {1,00 \ text {mol}} {1,00 \ text {L}} = 1,00M \ text {;} [/ latex]
(c) Молярная масса [Ca (OH) 2 ] = 79.{-1} = 0,06998M [/ латекс];
(d) Молярная масса (Na 2 SO 4 • 10H 2 O) = 322,20 г / моль
[латекс] 10 500 \ times \ frac {1 \ text {mol}} {322.20 \ text {g}} = 32.6 \ text {mol} [/ latex]
[латекс] \ frac {32.6 \ text {mol}} {18.60 \ text {L}} = 1.75M \ text {;} [/ latex]
(e) [латекс] M = \ frac {\ text {миллимоли растворенного вещества}} {\ text {объем раствора в миллилитрах}} [/ латекс]
[латекс] \ frac {{\ text {7,00 ммоль I}} _ {2}} {\ text {100 мл}} = 0,070M \ text {;} [/ latex] (f) Молярная масса (HCl) = 36.{-1} \ cancel {\ text {mol}} \ times \ text {180.158 g /} \ cancel {\ text {mol}} = \ text {27 g.} [/ Latex]
8. Молярность должна быть преобразована в моли растворенного вещества, которые затем преобразованы в граммы растворенного вещества:[латекс] M = \ frac {\ text {mol}} {\ text {litre}} \ text {or mol} = M \ times \ text {litre} [/ latex]
(a) [латекс] \ begin {array} {l} \\ {\ text {mol H}} _ {2} {\ text {SO}} _ {4} = 2,00 \ cancel {\ text {L} } \ times \ frac {18.5 \ text {mol}} {\ cancel {\ text {L}}} = 37.0 \ text {mol} {\ text {H}} _ {2} {\ text {SO}} _ {4} \\ 37.0 \ cancel {{\ text {mol H}} _ {2} {\ text {SO}} _ {4}} \ times \ frac {98.{-4} \ text {g NaCN} \ end {array} \ text {;} [/ latex]
(c) [латекс] \ begin {array} {l} \\ {\ text {mol H}} _ {2} \ text {CO} = 5.50 \ cancel {\ text {L}} \ times \ frac { 13.3 \ text {mol}} {\ cancel {\ text {L}}} = 73.2 \ text {mol} {\ text {H}} _ {2} \ text {CO} \\ 73.2 \ cancel {\ text { mol} {\ text {H}} _ {2} \ text {CO}} \ times \ frac {30.026 \ text {g}} {1 \ cancel {{\ text {mol H}} _ {2} \ text {CO}}} = 2198 \ text {g} {\ text {H}} _ {2} \ text {CO} = 2.20 \ text {kg} {\ text {H}} _ {2} \ text {CO } \ end {array} \ text {;} [/ latex]
(d) [латекс] \ begin {array} {l} \\ {\ text {mol FeSO}} _ {4} = 0. {- 1} {\ text {I}} _ {2}}} {0.{-1}}} {1.0 \ text {L}} = 0,025M [/ латекс]
16. [латекс] \ begin {array} {c} \ frac {{C} _ {1} {V} _ {1}} {{C} _ {2}} = {V} _ {2} \ \ \ frac {\ frac {0.3556 \ text {mol}} {\ text {L}} \ times 0.1718 \ text {L}} {\ frac {0.1222 \ text {mol}} {\ text {L}}} = {V} _ {2} \\ 0.5000 \ text {L} = {V} _ {2} \ end {array} [/ latex]
18. [латекс] {V} _ {1} = \ frac {{V} _ {2} \ times {M} _ {2}} {{M} _ {2}} = 25 \ text {mL} \ times \ frac {0,025M} {0,33M} = 1,9 \ text {mL} [/ latex]
20. (a) [латекс] {C} _ {2} = \ frac {{V} _ {1} \ times {C} _ {1}} {{V} _ {2}} = 1,00 \ cancel {\ text {L}} \ times \ frac {0.250 млн} {2,00 \ cancel {\ text {L}}} = 0,125 млн \ text {;} [/ latex]
(b) [латекс] {C} _ {2} = \ frac {{V} _ {1} \ times {C} _ {1}} {{V} _ {2}} = 0,5000 \ cancel {\ текст {L}} \ times \ frac {0,1222M} {1,250 \ cancel {\ text {L}}} = 0,04888M \ text {;} [/ latex]
(c) [латекс] {C} _ {2} = \ frac {{V} _ {1} \ times {C} _ {1}} {{V} _ {2}} = 2.35 \ cancel {\ текст {L}} \ times \ frac {0,350M} {4,00 \ cancel {\ text {L}}} = 0,206M \ text {;} [/ latex]
(d) [латекс] {C} _ {2} = \ frac {{V} _ {1} \ times {C} _ {1}} {{V} _ {2}} = 0,02250 \ cancel {\ текст {mL}} \ times \ frac {0.025M} {0.100 \ cancel {\ text {mL}}} = 0.{-1}} = 11,91 \ text {mol} [/ latex]
Эта HCl присутствует в 1,00 л, поэтому молярность составляет 11,9 M .
24. [латекс] 57 \ text {g} {\ text {K}} _ {2} {\ text {SO}} _ {4} \ times \ frac {1 \ text {mol}} {174.26 \ text {g}} \ times \ frac {1 \ text {L}} {0.20 \ text {mol}} = 1.6 \ text {L} [/ latex]
Глоссарий
водный раствор
раствор, для которого вода является растворителем
концентрированный
качественный термин для раствора, содержащего растворенное вещество в относительно высокой концентрации
концентрация
количественная мера относительных количеств растворенного вещества и растворителя, присутствующих в растворе
разбавленный
качественный термин для раствора, содержащего растворенное вещество в относительно низкой концентрации
разбавление
процесс добавления растворителя в раствор для снижения концентрации растворенных веществ
растворенный
описывает процесс, с помощью которого растворенные компоненты диспергируются в растворителе
молярность ( M )
единица концентрации, определяемая как количество молей растворенного вещества, растворенного в 1 литре раствора
растворенное вещество
компонент раствора присутствует в концентрации, меньшей, чем у растворителя
растворитель
компонент раствора присутствует в концентрации, которая выше по сравнению с другими компонентами


 ω3 (NaCl) = 32,5 %.
ω3 (NaCl) = 32,5 %. 6
6 1
1 п. 1873,2 K).
п. 1873,2 K). Решение на последней диаграмме рисунка \ (\ PageIndex {3} \) выше на самом деле не подчиняется закону Рауля — оно слишком сконцентрировано, но нарисовано так сконцентрировано, чтобы подчеркнуть суть.
Решение на последней диаграмме рисунка \ (\ PageIndex {3} \) выше на самом деле не подчиняется закону Рауля — оно слишком сконцентрировано, но нарисовано так сконцентрировано, чтобы подчеркнуть суть. .Какое парциальное давление этанола?
.Какое парциальное давление этанола?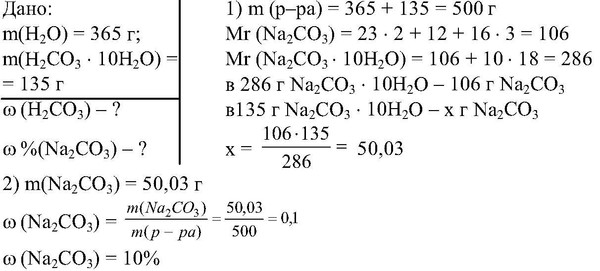 8 моль H 2 O
8 моль H 2 O 084
084  916 моль C 3 H 7 OH
916 моль C 3 H 7 OH 8494 г раствора
8494 г раствора 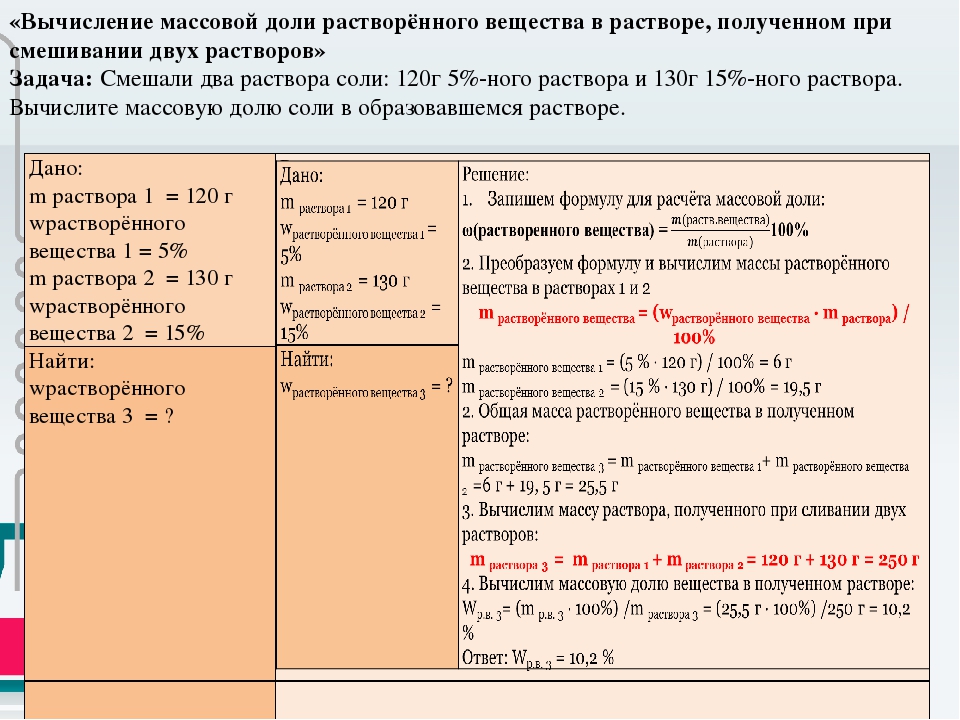 Для бензола константа повышения температуры кипения, k b , составляет 2,53 ° C / м, а константа понижения точки замерзания, K f , составляет 5,12 ° C / м.
Для бензола константа повышения температуры кипения, k b , составляет 2,53 ° C / м, а константа понижения точки замерзания, K f , составляет 5,12 ° C / м. 12 ° C / м) (0,437 м) = 2,24 ° C
Новый ф.п. = 5,5 ° C — 2,24 ° C = 3,26 ° C ΔT b = k b m = (2,53 ° C / м) (0,437 м) = 1,1 ° C
Новый б.п. = 80,1 ° C + 1,1 ° C = 81,2 ° C
12 ° C / м) (0,437 м) = 2,24 ° C
Новый ф.п. = 5,5 ° C — 2,24 ° C = 3,26 ° C ΔT b = k b m = (2,53 ° C / м) (0,437 м) = 1,1 ° C
Новый б.п. = 80,1 ° C + 1,1 ° C = 81,2 ° C  11 г C 2 H 6 O 2
11 г C 2 H 6 O 2
Leave A Comment