взаимодействие растворов / Справочник :: Бингоскул
Реакция уксусной кислоты и карбоната натрия: взаимодействие растворовдобавить в закладки удалить из закладок
Содержание:
Карбоновые кислоты – углеводороды, в которых содержится одна или несколько карбоксильных групп – СООН. Существует множество представителей этого класса органических соединений.
n
|
Формула кислоты | Название кислоты |
Название кислотного остатка R-COO— | |
По международной номенклатуре | Тривиальное | |||
0 | Н-СООН | Метановая | Муравьиная | Формиат |
1 | CH3 — СOOH | Этановая | Уксусная | Ацетат |
2 | CH3 — СH2 — СOOH | Пропановая | Пропионовая | Пропионат |
3 | CH3 — (СH2)2 — СOOH | Бутановая | Масляная | Бутират |
4 | CH3 — (СH2)3 — СOOH | Пентановая | Валериановая | Валеринат |
5 | CH3 — (СH2)4 — СOOH | Гексановая | Капроновая | Капронат |
9 | CH3 — (СH2)8 — СOOH | Декановая | Каприновая | Капринат |
15* | CH3 — (СH2)14 — СOOH | Гексадеконовая | Пальмитиновая | Пальмитат |
17* | CH3 — (СH2)16 — СOOH | Октадекановая | Стеариновая | Стеарат |
Особенности уксусной кислоты
Уксусная кислота CH3COOH – это одна из главных органических молекул. Люди используют 3-5%-ные растворы или 70-80%-ные растворы в приготовлении пищи. Также это вещество применяется при крашении, в кожевенном и лакокрасочном производствах.
Люди используют 3-5%-ные растворы или 70-80%-ные растворы в приготовлении пищи. Также это вещество применяется при крашении, в кожевенном и лакокрасочном производствах.
Физические свойства
Уксусная кислота – прозрачная жидкость с необычным запахом и кисловатым привкусом. Она растворяется в воде, а также смешивается с другими органическими соединениями. Уксусная кислота – распространенный растворитель, который часто используется в промышленности.
Способы получения
Уксусную кислоту синтезируют несколькими способами.
- Взаимодействием ацетальдегида с кислородом воздуха под действием катализатора (Mn(CH3COO)2) и при нагревании до 60˚С.
- Реакция метилового спирта, оксида углерода (II) и молекулярного водорода под действием катализатора.
- Взаимодействие бутана с окислителем при нагревании до 200˚С, повышении давления до 50 атм. и под действием катализатора кобальта СО.
- Окисление этилового спирта при участии ферментов (например, дрожжей).

Химические свойства
- Электролитическая диссоциация.
- CH3COOH ⇌ H+ + CH3COO—
- Реакции с активными металлами.
- 2CH3 COOH + Mg ⟶ (CH3COO)2Mg + H2↑
- Присоединение атома галогена к α-углеродному атому.
- СН3 — СOOH + Cl2 ⟶ CH2Cl — COOH +HCl
Эта реакция будет протекать до получения трихлоруксусного альдегида (Cl3-C-COOH).
- СН3 — СOOH + Cl2 ⟶ CH2Cl — COOH +HCl
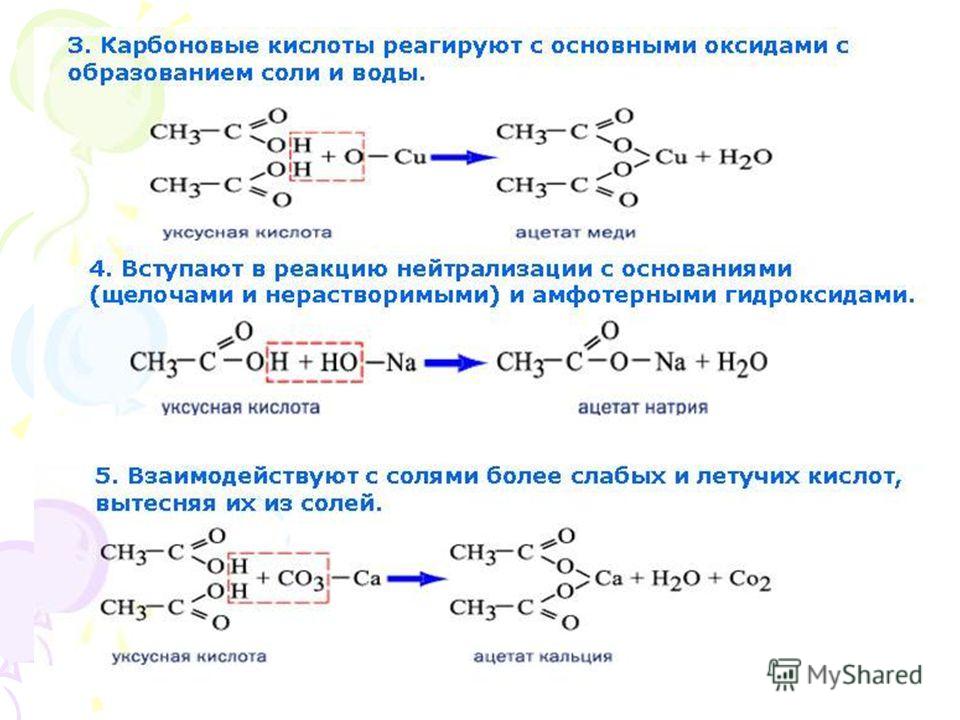
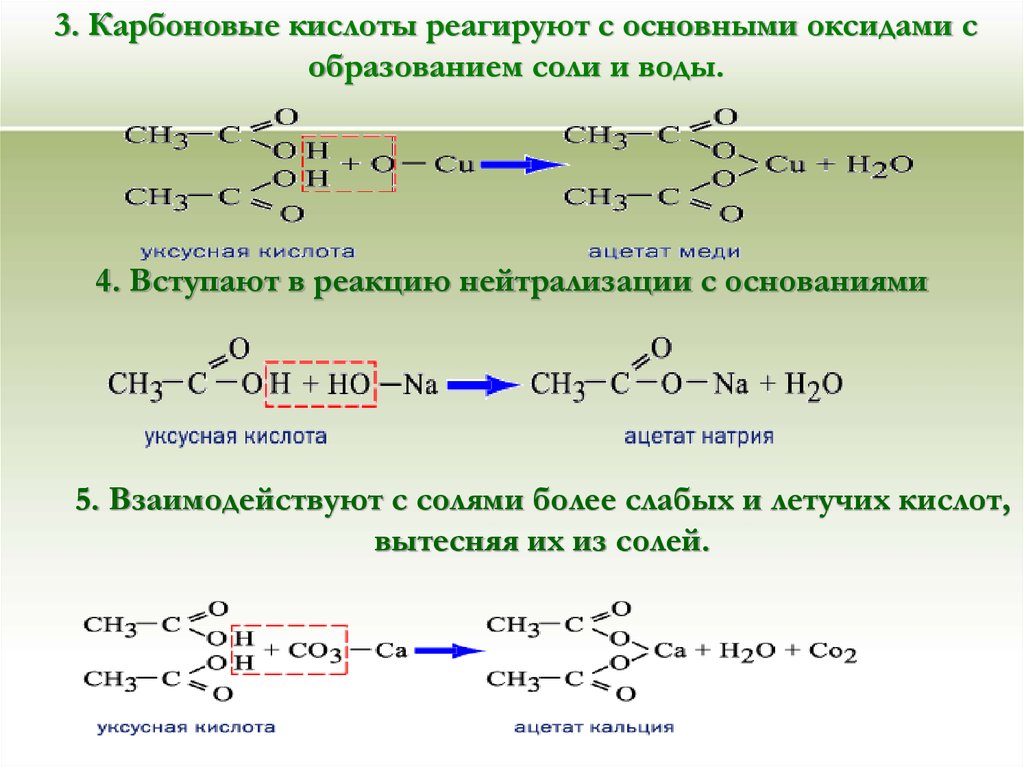
- Реакция с карбонатом натрия.
- Уксусная кислота реагирует с карбонатом натрия с активным выделением газа.
- 2CH3COOH+Na2CO3→2CH3COONa+H2O+CO2
То есть, прошла реакция обмена, но в силу того, что угольная кислота Н2СО3 неустойчива, она быстро распадается на углекислый газ CO2 и воду H2O.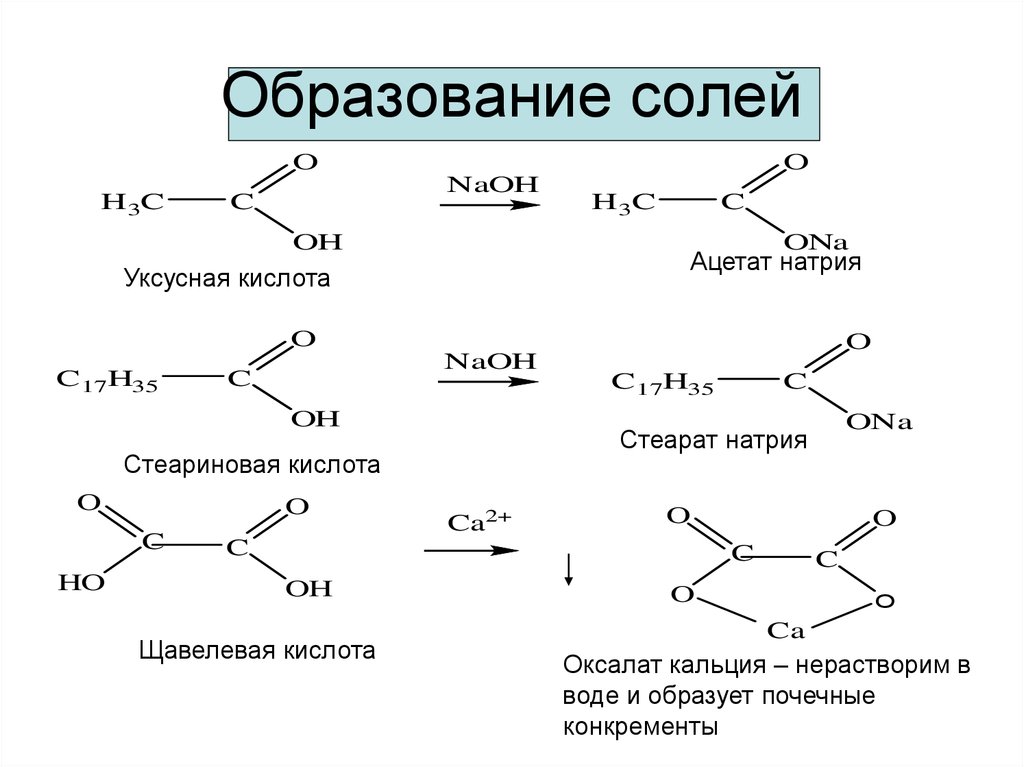
Применение уксусной кислоты
Пищевая добавка E260 изготавливается из уксусной кислоты. Ее применяют в пищевой промышленности, а в особенности при консервировании. Она используется при синтезе лекарств и парфюмерной продукции, а также в книгопечатании. Таким образом, уксусная кислота применяется практически во всех областях жизнедеятельности и без нее невозможно представить современную промышленность.
Поделитесь в социальных сетях:
26 ноября 2022, 13:25
Чем можно нейтрализовать уксусную кислоту в случае разлива или аварии — ООО ДХЗ
Химическая реакция нейтрализации представляет собой реакцию между щелочью и кислотой в результате которой образуется какая-то соль и вода. Примером таких процессов может быть реакция нейтрализации между уксусной кислотой и гидроксидом натрия или соляной кислотой и едким натрием.
Наблюдать реакцию нейтрализации кислоты щелочью можно только в том случае, если самого начала к раствору кислоты добавить индикатор, чтобы изменить окраску раствора. А как только к такому цветному раствору добавить щелочь, окраска сразу же исчезнет – будет выглядеть как фокус.
А как только к такому цветному раствору добавить щелочь, окраска сразу же исчезнет – будет выглядеть как фокус.
Как нейтрализовать уксусную кислоту гидроксидом натрия?
Для любой кислоты обязательно характерна реакция полной нейтрализации. В качестве доказательства этого можно провести эксперимент нейтрализации гидроксидом натрия уксусной кислоты. Для этого необходимо взять специальные химические колбы и наполнить их разбавленными растворами гидроксида натрия (NaОН) и уксусной кислоты (СН3 СООН). В ту колбу где будет раствор гидроксида натрия (NaОН) необходимо добавить несколько капель индикатора, а именно фенолфталеина, также можно добавить катализатор.
После этого в бюретку необходимо аккуратно налить раствор уксусной кислоты. Затем в раствор щелочи по одной капле добавляется кислота. Это продолжается до того момента, пока весь гидроксид натрия не перейдет в соль. Полный переход будет виден по окраске ранее добавленного индикатора – фенолфталеина. Как только вся щелочь полностью прореагирует с образовавшейся солью ацетата натрия – малиновый цвет раствора исчезнет и жидкость будет прозрачной.
Как только вся щелочь полностью прореагирует с образовавшейся солью ацетата натрия – малиновый цвет раствора исчезнет и жидкость будет прозрачной.
Современный способ нейтрализации уксусной кислоты.
На сегодняшний день в случае аварий и проливов на производствах используется способ нейтрализации уксусной кислоты на фасовочно-укупорочной автоматизированной машине. Осуществляется обработка поверхности, где была разлита уксусная кислота, безводным порошкообразным карбонатом натрия. Обработка кислоты ведется до образования густой пасты и паста не убирается. При последующих разливах уксусной кислоты на поддоне при появлении жидкой фазы поверхность места разлива обрабатывают карбонатом натрия до появления пасты, которая связывает жидкую фазу. В случае попадания кислоты на поверхность, расположенную вне поддона, нейтрализация проводится водой до получения раствора с концентрацией 25-30%.
Если остается открытый вопрос чем можно нейтрализовать уксусную кислоту, то это может быть либо карбонат натрия, либо гидроксид натрия.
Обработка поверхности карбонатом натрия в случае первого разлива выполняется при таком соотношении компонентов по общей массе: Na2CO3:Ch4COOH=1,6÷4,0:1. Такой способ нейтрализации обеспечивает значительное сокращение отходов всего технологического процесса, позволяет уменьшить выделение СО2 и позволяет снизить токсичность технологического процесса.
Также существуют способы нейтрализации кислоты и ее растворов водными растворами гидрокарбоната натрия с концентрацией 1-4%, или водными растворами гидроксида натрия с концентрацией 2,5-10%. Недостатком данных способов является очень большой расход раствора, и как следствие, большое количество сточной воды, которая содержит ацетат натрия. А такую воду обязательно нужно очистить перед сбросом. Кроме этого, недостатком является еще и выделение в атмосферу и рабочую зону диоксида углерода.
Максимально близким по технической сущности и полученному результату является метод нейтрализации уксусной кислоты на фасовочно-укупорочной машине.
Место разлива вещества на поверхностях выше поддона и на самом поддоне нейтрализуется с помощью раствора карбоната натрия. В растворе образуется большое количество ацетата натрия. Процесс нейтрализации контролируется при помощи устройства, определяющего уровень рН. Недостатком такого способа является также большое количество сточных вод с повышенной концентрацией ацетата натрия. Это приводит к тому, что для реализации выделения ацетата натрия нужна сложная технология, которая включает в себя кристаллизацию, выпаривание и фильтрование. Еще один недостаток – это большой расход карбоната натрий (порошкообразного), что связанно с избыточным его использованием. Кроме этого в ходе нейтрализации уксусной кислоты образуется очень большое количество углекислого газа. Негативной стороной способа является большая площадь нейтрализуемой смеси, а также несущественное повышение температуры, а это приводит к выделению паров уксусной кислоты.
Задача этого устройства – сокращение отходов всего технологического процесса, сокращение расхода нейтрализующего агента, сокращение уровня выделения СО2, а также уменьшение токсичности.
Эта задача достигается тем, что в методе нейтрализации водных горючих растворов кислоты на фасовочно-укупорочной автоматизированной линии, включающем дополнительную обработку поверхности, на которую была разлита кислота, порошкообразным карбонатом натрия до образования пасты и ее не убирают.
Автоматизированная фасовка и укупоривание выполняется на модифицированной фасовочно-укупорочной машине Б3-ОД-2-К/3-02/03/ по ТУ 3-1768. Данная машина предназначена для реализации фасовки 70-80%-ной уксусной кислоты в вакууме. Машина представляет собой автоматизированную систему ротационного типа с электроприводом, включающую специальный бункер полиэтиленовых пробок, карусели для укупоривания и фасовки. Максимальная мощность электропривода – 2,6 кВт. Основная часть уксусной кислоты выливается на поверхность поддона из нержавеющей стали, некоторая часть может попасть на поверхность вне поддона.
Поэтому если на своем предприятии вы не знаете, чем нейтрализовать уксусную кислоту, тогда данная система будет идеальным вариантом. На сегодняшний день это наиболее современный способ, который активно набирает популярность на различных предприятиях, занимающихся производством уксусной кислоты.
На сегодняшний день это наиболее современный способ, который активно набирает популярность на различных предприятиях, занимающихся производством уксусной кислоты.
Пузырьковых вулканов | Ресурс | RSC Education
В этом эксперименте учащиеся описывают, что наблюдается при смешивании этановой кислоты и гидрокарбоната натрия, используя такие ключевые термины, как реакция, шипение или вскипание и газ.
Учебный лист
На этом практическом занятии я буду:
- Экспериментировать, чтобы увидеть, что произойдет, если я смешаю этановую кислоту с гидрокарбонатом натрия.
- Описание наблюдаемого.
- Объясняя свои результаты, используя свои научные знания и понимание, используя такие ключевые слова, как реакция , шипение и газ .
Введение:
Вы древнеримский художник-ученый и только что услышали, как извержение вулкана Везувий покрыло большие территории, включая города Помпеи и Геркуланум, лавой и пеплом.
По общему мнению, извержение было ужасающим и очень захватывающим. Вы задаетесь вопросом, есть ли способ смоделировать собственное мини-извержение. Как и все хорошие ученые-художники, вы решаете продолжить расследование…
Оборудование:
Для группы из 2 учеников:
- 1 чайная ложка
- 1 форма для кексов
- 1стол
- 1 газета
- Гидрокарбонат натрия (бикарбонат соды или разрыхлитель) (50 г) Малоопасный
- Этановая кислота (белый уксус) (250 см
- 4 различных пищевых красителя (например, синий, красный, зеленый и желтый), они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы
Для дальнейших действий:
- Дополнительные карбонаты (например, карбонат калия ( Вреден при проглатывании, вызывает раздражение ), карбонат кальция ( Малоопасный )
- Бутыль с узким горлышком или 100 см 3 коническая колба или 25 см 3 мерный цилиндр
- Воздушный шар
- Шпатель
- Баланс
- Лодка для взвешивания
Метод:
- Накройте стол газетой на случай проливания (это очень вероятно).

- Наполовину наполните четыре формочки для кексов этановой кислотой.
- В одну из этих формочек для маффинов налейте 3-4 капли первого пищевого красителя. Повторите то же самое с остальными формочками для маффинов, каждый раз используя другой цвет.
- Используйте чайную ложку, чтобы добавить одну ложку гидрокарбоната натрия с горкой в каждый окрашенный раствор.
- Запишите, что происходит.
Идем дальше:
Попробуйте сравнить изменение массы при использовании разных карбонатов
- Поместите этановую кислоту в бутылку с узким горлышком.
- Поместите карбонат в воздушный шар и закрепите его на крышке банки, не переливая карбонат в бутылку.
- Найдите массу, прежде чем смешать два химиката.
- Теперь поднимите шарик, чтобы карбонат попал в бутылку, и вращайте, чтобы смешать химикаты.
- Смотри, что происходит, и описывай, что происходит с массой.
- Повторите с другими карбонатами и сравните изменения массы.

- Объясните свой результат
Что это говорит вам о химической реакции?
Теория:
Этановая кислота реагирует с гидрокарбонатом натрия с образованием углекислого газа и воды.
этановая кислота + гидрокарбонат натрия ↓ ацетат натрия + вода + диоксид углерода
CH 3 COOH + NaHCO 3 ↓ NaCH 3 COO + H 2 90 122 O + CO 2
Углекислый газ образовавшийся газ устремляется из раствора. Это видно как пузыри. Поскольку углекислый газ тяжелее воздуха, он не может легко уйти от реакции, поэтому кажется, что он стекает по краям вашей формы для кексов, немного напоминая лаву, вытекающую из вулкана.
Тот факт, что при реакции любого карбоната с кислотой не происходит потери массы, свидетельствует о сохранении массы. Это газообразная реакция, поэтому без баллона, прикрепленного к реакционному сосуду, газ выходит, и кажется, что масса уменьшается. Воздушный шар останавливается, захватывая газ, так что это реакция герметичного сосуда, и потери в массе нет.
Лист для учителя и техника
На этом практическом занятии студенты будут:
- Проведите эксперимент, чтобы увидеть, что происходит, когда этановая кислота реагирует с гидрокарбонатом натрия.
- Опишите наблюдаемое.
- Объясните свои результаты, используя свои научные знания и понимание, точно используя такие термины, как реакция , шипение и газ .
Введение:
Простой кухонный эксперимент, который интересно проводить, но который можно использовать для изучения реакций между кислотами и карбонатами. Его также можно использовать для представления того, что происходит, когда смесь для кекса готовится с использованием карбоната. Реакция карбоната с кислотой вызывает бурную реакцию, а цвет только добавляет драматизма и очаровывает детей младшего возраста.
Этановая кислота химически реагирует с гидрокарбонатом натрия с образованием углекислого газа и воды.
этановая кислота + гидрокарбонат натрия ↓ ацетат натрия + вода + диоксид углерода
CH 3 COOH + NaHCO 3 ↓ NaCH 3 COO + H 2 9012 2 O + CO 2
Углекислый газ образовавшийся газ устремляется в сторону от воды. Это видно как пузыри. Поскольку углекислый газ тяжелее воздуха, он не может уйти от реакции, поэтому кажется, что он стекает по краям формы для кексов, немного напоминая лаву, вытекающую из вулкана.
Диапазон учебных программ:
Это практическое занятие предназначено для учащихся старших классов начальной школы или учащихся младших классов средней школы, чтобы познакомить их с простыми химическими реакциями, и цель состоит в том, чтобы получить некоторое представление о том, как материалы используются для создания реакций, таких как некоторые из самые простые в приготовлении. Он связан с:
- Создание простых практических запросов, сравнительных и объективных тестов;
- Сообщение о результатах расследований и наблюдений, включая устные и письменные объяснения, демонстрацию или представление результатов и выводов;
- Использование прямых научных данных для ответа на вопросы или подтверждения своих выводов;
- Получите более систематическое представление о химии кислоты и карбонатов, исследуя, как гидрокарбонат натрия реагирует с кислотой, что может быть использовано для получения полезного свойства;
- Задавайте вопросы и развивайте направление исследований, основанное на наблюдениях за реальным миром, а также на предшествующих знаниях и опыте;
- Использовать соответствующие методы, оборудование и материалы во время лабораторных работ, обращая внимание на здоровье и безопасность;
- Делать и записывать наблюдения, используя ряд методов для различных исследований; оценить надежность методов и предложить возможные улучшения;
- Представление наблюдений с использованием соответствующих методов;
- Интерпретировать наблюдения и определять закономерности, используя эти наблюдения, чтобы делать выводы;
- Представление аргументированных объяснений, включая пояснение данных в отношении прогнозов и гипотез;
- Узнайте о концепции химической реакции, вскипания, кислотных и карбонатных реакций.

Предупреждения об опасности:
Гидрокарбонат натрия – высвобождает углекислый газ при слабом нагревании (или с кислотами). Гидрокарбонат натрия является одобренной пищевой добавкой, Е500, и используется в качестве пищевой соды. «Бикарбонат» или «бикарбонат соды» являются альтернативными названиями. Низкая опасность .
Этановая кислота – если менее 1,7 М. Она все же может причинить вред глазам или порезам. В том числе уксус. Уксус, купленный в магазине, обычно представляет собой раствор от 5% до 6% (от 0,8 до 0,9 моль/л) и составляет Low Hazard при этих значениях прочности.
Оборудование:
Для группы из 2 учеников:
- 1 чайная ложка
- 1 форма для кексов
- 1стол
- 1 газета
- Гидрокарбонат натрия (бикарбонат соды или разрыхлитель (Na HCO 3 )) (50 г)
- 1M Этановая кислота (или белый уксус CH 3 COOH) (250 см 3 )
- 4 разных пищевых красителя (например, синий, красный, зеленый и желтый – они должны быть искусственными, поскольку «натуральные» недостаточно концентрированы
- Пипетка
Для дальнейшего использования:
- 1 бутыль с узким горлышком (или 25 см 3 мерный цилиндр)
- 1 баллон
- Весы для верхней чаши
- Лодка для взвешивания или аналогичная
Технические примечания:
Ученики должны соблюдать осторожность при использовании красителей, так как искусственные красители могут окрасить кожу при контакте. Они не опасны, но могут выглядеть неприглядно.
Они не опасны, но могут выглядеть неприглядно.
Использовать одноразовые перчатки.
При выполнении задания «Движение вперед» учащиеся должны будут хорошо герметизировать воздушный шар и крышку бутылки, а это может означать, что воздушный шар будет трудно надеть, поэтому может потребоваться помощь взрослых.
Результаты:
При смешивании гидрокарбоната натрия (бикарбоната соды) и этановой/уксусной кислоты (уксуса) будет хорошо заметна реакция шипения. Пищевой краситель создает красочный дисплей, когда происходит реакция. Шипение стихает по мере израсходования реагентов. Реакцию можно повторить, добавив больше реагентов.
Учащиеся/дети могут понять, что шипение состоит из пузырьков CO 2 , подобных тем, которые наблюдаются в шипучих (газированных) напитках.
Этот эксперимент также можно провести с использованием одноразовых пластиковых стаканчиков, помещенных в миску или поднос. Конусы можно сделать из кругов, вырезанных из пластика или картона, с меньшим кругом, вырезанным в середине круга.
Использование различных карбонатов приведет к одинаковой реакции. Карбонат калия (вреден при проглатывании, вызывает раздражение) и карбонат кальция малоопасны. Одна чайная ложка или шпатель карбоната (примерно от 2,5 до 3,5 г, в зависимости от того, какой карбонат используется) помещают в баллон, который тщательно закрепляют над горлышком бутылки или мерного цилиндра, содержащего 15 см
Учащиеся могут заметить, что разные карбонаты имеют разный вес, но использование одинакового количества реагентов приводит к одной и той же реакции, и что общая масса реагентов будет равна общей массе продуктов.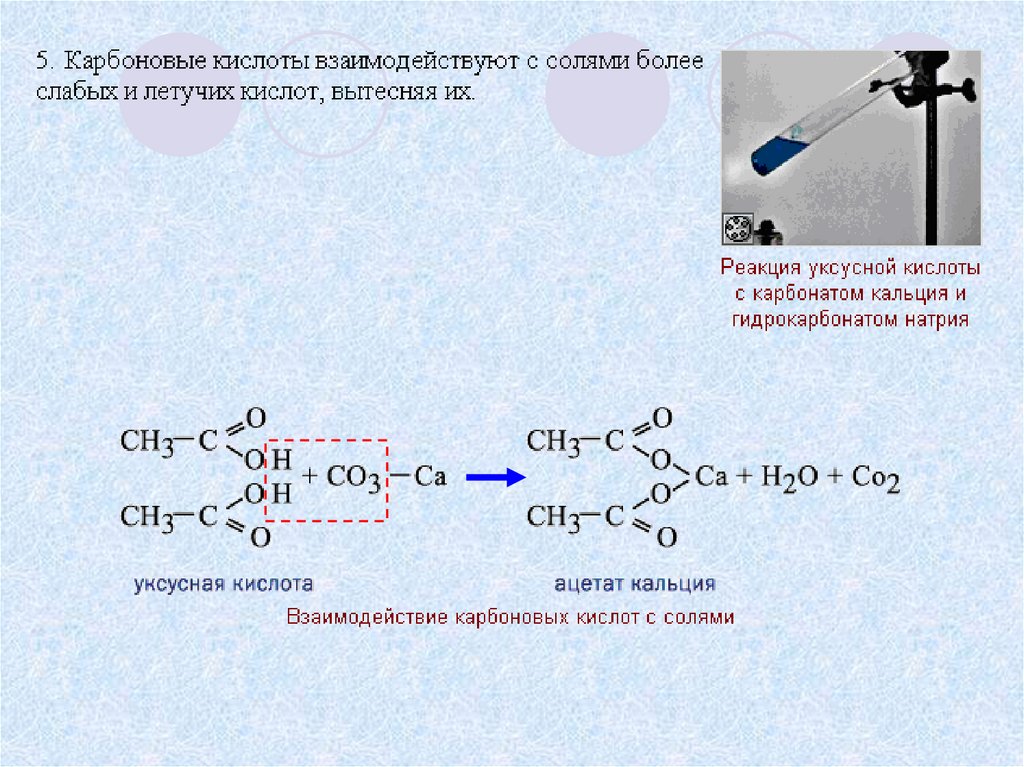 (Некоторые карбонаты могут быть более мелким порошком, чем другие, поэтому потребуется небольшое завихрение контейнера, чтобы смешать реагенты и начать реакцию). Это должно продемонстрировать сохранение массы, даже если это газообразная реакция, и если газ улетучится, масса, по-видимому, уменьшится — сильный источник заблуждений у некоторых более слабых студентов.
(Некоторые карбонаты могут быть более мелким порошком, чем другие, поэтому потребуется небольшое завихрение контейнера, чтобы смешать реагенты и начать реакцию). Это должно продемонстрировать сохранение массы, даже если это газообразная реакция, и если газ улетучится, масса, по-видимому, уменьшится — сильный источник заблуждений у некоторых более слабых студентов.
Идем дальше:
- Попробуйте использовать другие карбонаты, но измерьте массу химикатов до их смешивания и после смешивания химикатов.
- Поместите этановую кислоту в бутылку с узким горлышком.
- Поместите карбонат в воздушный шар и закрепите его на крышке банки, не переливая карбонат в бутылку.
- Найдите массу, прежде чем смешать два химиката.
- Теперь поднимите шарик, чтобы карбонат попал в бутылку, и вращайте, чтобы смешать химикаты.
- Смотри, что происходит, и описывай, что происходит с массой.
- Объясните свой результат
кислотно-основное — Скорость реакции Na2CO3 с уксусом по сравнению со скоростью реакции NaHCO3 с Ch4COOH
спросил
Изменено 7 лет, 3 месяца назад
Просмотрено 7к раз
$\begingroup$
Я работаю над проектом, требующим легкого производства газа, не вызывающего коррозию «обычных» бытовых материалов (например, двуокиси углерода).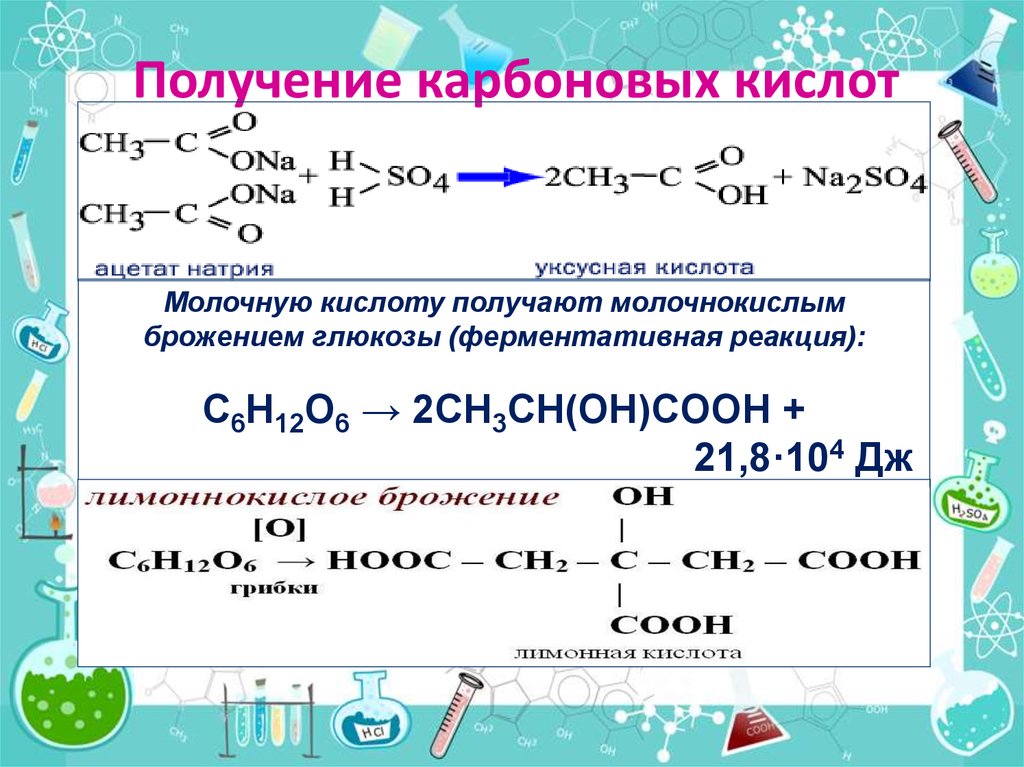 Я остановился на уксусе (уксусной кислоте) и пищевой или стиральной соде, так как они очень легко доступны большинству людей. Глядя на химическую формулу карбоната натрия и бикарбоната натрия, я могу предположить, что примерно одинаковое количество газа будет произведено в результате реакции обоих с уксусом.
Я остановился на уксусе (уксусной кислоте) и пищевой или стиральной соде, так как они очень легко доступны большинству людей. Глядя на химическую формулу карбоната натрия и бикарбоната натрия, я могу предположить, что примерно одинаковое количество газа будет произведено в результате реакции обоих с уксусом.
Однако есть ли вообще разница в скорости реакции? Меня не волнует конечный продукт, пока его можно смыть в канализацию.
- кислотно-щелочной
$\endgroup$
0
$\begingroup$
Карбонат натрия, $\ce{Na2CO3}$, не будет выделять газ при смешивании с эквимолярной частью уксусной кислоты (т.е. $1\ моль\ \ce{Na2CO3}:1\ моль\ \ce{Ch4COOH}$). Реакция протекала бы следующим образом: $$\ce{Na2CO3} + \ce{Ch4COOH} \ce{->} \ce{NaHCO3} + \ce{Ch4COONa}.$$ Следовательно, вам потребуется еще одна эквимолярная порция уксусной кислоты.



Leave A Comment