Кальций гидрокарбонат — Справочник химика 21
Карбонат кальция, гидрокарбонат кальция [c.284]К кислотному типу коррозии относится и углекислотная коррозия бетона. Такой вид разрушения зависит от концентрации растворенной углекислоты в воде, содержания в воде ионов кальция, гидрокарбонатов и характера бетона. Углекислотная коррозия про- [c.370]
Молярное соотношение карбоната кальция, гидрокарбоната кальция и нитрата кальция в смеси массой 100 г равно 1 2 3 (в порядке перечисления). Какой объем при 1200 °С и нормальном давлении займут газообразные продукты разложения этой смеси [c.220]
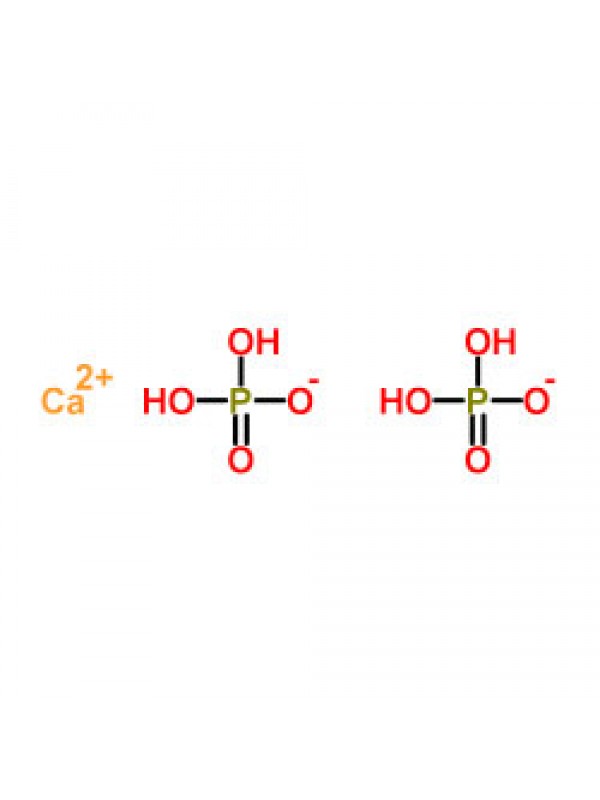
Составьте формулы следующих солей дигидрофосфат кальция, гидрокарбонат кальция, суль фат гидроксоалюминия, сульфит бария. [c.24]
Кислый углекислый кальций . гидрокарбонат кальция [c.75]
Угольная кислота, карбонат кальция, гидрокарбонат  284]
284]
Напишите формулы каждого из перечисленных ниже соединений и укажите степень окисления неметаллов — характеристических атомов азотистая кислота сульфид железа хлорат калия перйодат натрия фосфат кальция гидрокарбонат натрия. [c.232]
В качестве коллекторов используют гидроксиды железа, алюминия и некоторых других катионов сульфиды кадмия, ртути и др. карбонат кальция, гидрокарбонат железа и др. сульфаты бария, кальция и др. малорастворимые органические соединения а- и -нафтолы, фенолфталеин, дифениламин, о-оксихинолин, метиловый оранжевый и др. Коллектор должен обладать достаточной избирательностью действия по отношению к осаждаемому микрокомпоненту, достаточной плотностью, способствующей быстрому оседанию микрокомпонента, хорошей растворимостью в кислотах или других растворителях, не должен мешать последующему определению микрокомпонента или, в крайнем случае, легко от него отделяться, что позволяет получить соосаждаемые элементы практически в чистом виде.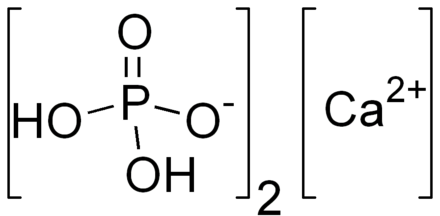
Жесткость воды определяете содержанием в ней растворимых солей магния и кальция гидрокарбонатов, сульфатов и хлоридов. Различают два вида жесткости карбонатную и некарбонатную. Карбонатная жесткость обусловлена присутствием в воде растворимых солей Са(НСОз)г и М (НСОз)2. При кипячении воды би-
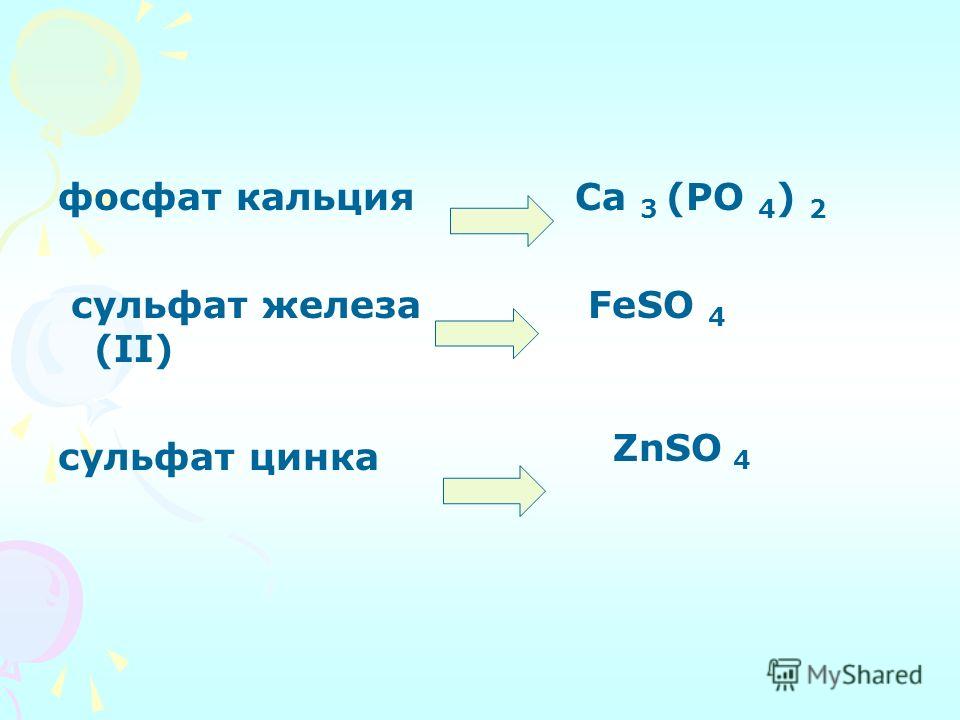
Сульфат алюминия Нитрат аммония Нитрит аммония Сульфат аммония Гидроксид бария Карбонат бария Хлорид бария Карбонат кальция Гидрокарбонат кальция Хлорид кальция Сульфат кальция Сульфат меди Хлорид железа (III) Сульфат железа (II) Сульфат железа (III) Карбонат свинца Сульфат свинца Карбонат магния Хлорид магния Сульфат магния Гидроксид марганца Карбонат марганца Нитрат калия Перманганат калия Фосфат калия Хлорид серебра Алюминат натрия Гидрокарбонат натрия Карбонат натрия То же
Несистемные антацидные средства (например, магния трисиликат, магния гидроокись, кальция гидрокарбонат, кальция фосфат, висмута карбонат, алюминия гидроокись).
 Препара-ты этой группы нерастворимы в воде, в незначительной степени всасываются из ЖКТ и не вызывают изменений КЩС. Эффекты несистемных антацидных средств развиваются медленнее, чем системных, однако они продолжаются дольше. Действие препаратов длится от 40 мин до 3-4 ч, поэтому назначают их не менее 6 раз в сутки через 1 ч после еды, т.е. на высоте секреции желудочного сока (при отсутствии особых показаний, например для снятия изжоги, болей). Для оптимального назначения антацидного препарата следует учитывать, что 1 г алюминия гидрохлорида снижает кислотность 250 мл 0,1 н. раствора НС до значений pH 4,0, 1 г Магния трисиликата — 155 мл 0,1 н. раствора НС до pH 5,0 6,0, I г окиси магния — 432 мл
Препара-ты этой группы нерастворимы в воде, в незначительной степени всасываются из ЖКТ и не вызывают изменений КЩС. Эффекты несистемных антацидных средств развиваются медленнее, чем системных, однако они продолжаются дольше. Действие препаратов длится от 40 мин до 3-4 ч, поэтому назначают их не менее 6 раз в сутки через 1 ч после еды, т.е. на высоте секреции желудочного сока (при отсутствии особых показаний, например для снятия изжоги, болей). Для оптимального назначения антацидного препарата следует учитывать, что 1 г алюминия гидрохлорида снижает кислотность 250 мл 0,1 н. раствора НС до значений pH 4,0, 1 г Магния трисиликата — 155 мл 0,1 н. раствора НС до pH 5,0 6,0, I г окиси магния — 432 мл Грубодисперсные вещества мешают процессу катионирования. Они, отлагаясь в порах катионита, уменьшают его обменную емкость. После катионирования вода становится более агрессивной, так как замена гидрокарбоиата кальция гидрокарбонато.м натрия освобождает равновесную углекислоту.
Опыт 11.10. Внести отдельно в п юбирки по од1Юму микрошпателю карбонатов натрия, калия, кальция, гидрокарбоната натрия и добавить в каждую пробирку ио 5—6 капель раствора соляной кислоты. Между какими иоиамн протекают реакции Написать ионные уравнения реакций. [c.107]
В районах, богатых известняками, грунтовые воды могут содержать большие количества ионов кальция и гидрокарбонат-иона НСОз». В отличие от нерастворимого карбоната кальция гидрокарбонат кальция Са(НСОз)2 — растворимое вещество. Такую воду (ее называют водой с временной жесткостью) можно умягчить простым кипячением, при котором происходит осаждение карбоната кальция и удаление избыточной двуокиси углерода
Из солей угольной кислоты большое значение имеют карбонат натрия (сода), карбонат калия (поташ), карбонат кальция, гидрокарбонат натрия (питьевая сода) и основной карбонат меди (СиОН)2СОз (малахит). [c.332]
Са(НСОз)2 Кислая Кислый углекислый кальций Гидрокарбонат кальция н-о с=о Сас=о Н—0/ [c. 68]
68]
Неорганическая химия (1987) — [ c.300 ]
Аналитическая химия (1965) — [ c.186 , c.291 ]
Общая химия 1982 (1982) — [ c.440 , c.616 ]
Общая химия 1986 (1986) — [ c.426 , c.596 , c.598 ]
Общая и неорганическая химия (1981) — [ c.319 ]
Неорганическая химия (1978) — [ c.277 ]
Неорганическая химия (1950) — [
c. 176
]
176
]
Общая химия Издание 18 (1976) — [ c.435 , c.606 , c.608 ]
Общая химия Издание 22 (1982) — [ c.440 , c.616 ]
Общая и неорганическая химия (1994) — [ c.336 ]
Практикум по общей химии Издание 5 (1964) — [ c.210 ]
Тест 61
1. Укажите формулу фосфида:
а) PCI5 б) K3PO4 в) P2O5 г) Ca3P2
2. Оксиду фосфора (III) отвечает кислота:
а) H3PO2 б)
HPO
3. Чтобы дигидрофосфат
калия перевести в гидрофосфат калия
нужно воспользоваться реактивом:
Чтобы дигидрофосфат
калия перевести в гидрофосфат калия
нужно воспользоваться реактивом:
а) водой б) ортофосфорной кислотой в) щёлочью г) серной кислотой
4. Отметьте формулы веществ, с которыми при определённых условиях реагирует как ортофосфорная, так и азотная кислоты:
а)
Cu б)
K2CO3 в)
Na2S г)
NH
5. С какими веществами может реагировать водный раствор дигидрофосфата аммония?
а) гидроксидом калия б) аммиаком в) хлоридом натрия г) гидроксидом бария
6. В каких рядах указаны формулы веществ, все из которых реагируют с ортофосфорной кислотой?
а) NH3, K2O, Ca(H2PO4)2 б) K2HPO4, CaO,NH4HCO3 в) Cu, Mg, KOH г) CaHPO4, Ca, KHS
7. Укажите схемы
реакций, в результате которых можно
получить ортофосфорную кислоту:
Укажите схемы
реакций, в результате которых можно
получить ортофосфорную кислоту:
а) Na3PO4 + H2O + CO2→ б) HPO3 + H2O t0 в) K2HPO4 + KOH t0 г) Ca3(PO4)2 + H2SO4(конц.) t0
8. Укажите формулы веществ, с которыми водный раствор K3PO4 реагирует с образованием осадка:
а) H3PO4 б) AgNO3 в) H2SO4(конц.) г) CaCI2
9. Ортофосфат калия в отличие от дигидроортофосфата калия реагирует с:
а) NaOH б) H3PO4 в) Ba(OH)2 г) NH3 (водный раствор)
10. Какая минимальная масса (кг) фосфорита с массовой долей Ca3(PO4)2, равной 90 %, нужна для получения 62 кг фосфора при выходе реакции 80 %?
а) 344,4 б) 382, 7 в) 430,6 г) 310,0
Тест 62
1. В реакции NH3 + H2PO4— → NH4+ + HPO42- дигидрофосфат-ион ведёт себя как:
В реакции NH3 + H2PO4— → NH4+ + HPO42- дигидрофосфат-ион ведёт себя как:
а) восстановитель б) окислитель в) донор протонов г) акцептор протонов
2. Укажите формулы дигидрофосфатов:
а) K2HPO4 б) NaH2PO4 в) MgH2P2O7 г) NH4H2PO4
3. Укажите формулу основной составной части фосфорита:
а) PH3 б) Ca3P2 в) CaHPO4 г) Ca3(PO4)2
4. Отметьте схемы реакций, которые могут быть использованы для получения солей ортофосфорной кислоты:
а) NH3 + H3PO4 → б) CaHPO4 + Ba(OH)2 → в) NH4NO3 + KH2PO4 → г) Ca(H2PO4)2 + H3PO4 →
5. Белый фосфор
более активен, чем азот, так как:
Белый фосфор
более активен, чем азот, так как:
а) заряд ядра атома фосфора меньше б) молекулы фосфора имеют большую массу
в) число протонов в ядре атома азота меньше, чем у фосфора
г) энергия связи между атомами в молекуле белого фосфора меньше, чем в молекуле азота
6. С какими веществами реагирует как ортофосфорная, так и азотная разбавленная кислота?
а) серебром б) оксидом кальция в) гидроксидом калия г) аммиаком
7. Составной частью каких удобрений является дигидрофосфат кальция?
а) фосфоритная мука б) аммофос в) простой суперфосфат г) двойной суперфосфат
8. С каким веществом не реагирует H3PO4, но реагирует НNО3 (разб.)?
а) карбонатом калия б) оксидом кальция в) медью г) карбонатом аммония
9.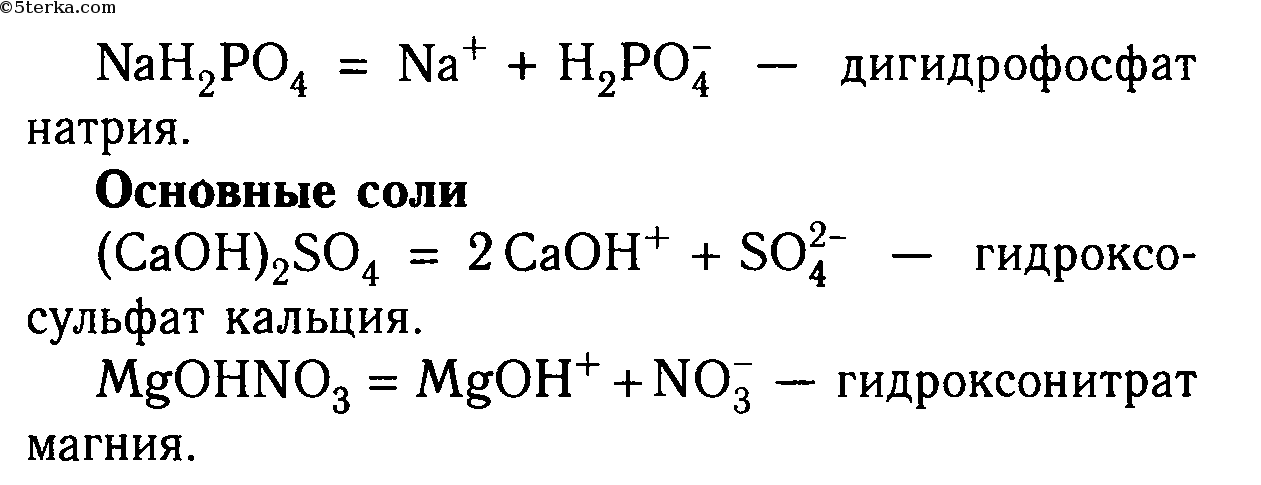 Укажите формулы
соединений с одинаковой степенью
окисления атомов фосфора:
Укажите формулы
соединений с одинаковой степенью
окисления атомов фосфора:
а) Ba(PO3)2 б) Ca3P2 в) Ca2P2O7 г) MgH2P2O7
10. Оксид фосфора (V) массой 35,5 г растворили в 75 г горячей воды. При этом получили раствор:
а) HPO3, w = 0,36 б) H3PO4, w = 0,44 в) H3PO4, w = 0,22 г) P2O5, w = 0,36
а) Фосфор ⟶ Оксид фосфора (V) ⟶ Ортофосфорная кислота
а)
| 4P + 5O2 = 2P2O5 | ||||
| P0 — 5ē ⟶ P+5 | 5 | 20 | 4 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 5 | окислитель (восстановление) | |
P2O5 + 3H2O = 2H3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
3H+ + PO43- + 3Na+ + 3OH— = 3Na+ + PO43- + 3H2O
H+ + OH— = H2O
2Na3PO4 + 3CaCl2 = 6NaCl + Ca3(PO4)2↓
6Na+ + 2PO43- + 3Ca2+ + 6Cl— = 6Na+ + 6Cl— + Ca3(PO4)2↓
3Ca2+ + 2PO43- = Ca3(PO4)2↓
Ca3(PO4)2 + 6HNO3(конц. ) = 3Ca(NO3)2 + 2H3PO4
) = 3Ca(NO3)2 + 2H3PO4
Ca3(PO4)2 + 6H+ + 6NO3— = 3Ca2+ + 6NO3— + 2H3PO4
Ca3(PO4)2 + 6H+ = 3Ca2+ + 2H3PO4
б)
| 4P + 5O2 = 2P2O5 | ||||
| P0 — 5ē ⟶ P+5 | 5 | 20 | 4 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 5 | окислитель (восстановление) | |
P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 6K+ + 6OH— = 6K+ + 2PO43- + 3H2O
P2O5 + 6OH— = 2PO43- + 3H2O
2K3PO4 + 3CaCl2 = 6KCl + Ca3(PO4)2↓
6K+ + 2PO43- + 3Ca2+ + 6Cl— = 6K+ + 6Cl— + Ca3(PO4)2↓
3Ca2+ + 2PO43- = Ca3(PO4)2↓
| 2Ca3(PO4)2 + 10C + 6SiO2 `overset(t)(=)` 6CaSiO3 + 10CO↑ + 4P | ||||
| C0 — 2ē ⟶ C+2 | 2 | 10 | 5 | восстановитель (окисление) |
| P+5 + 5ē ⟶ P0 | 5 | 2 | окислитель (восстановление) | |
| 3Mg + 2P = Mg3P2 | ||||
| Mg0 — 2ē ⟶ Mg+2 | 2 | 6 | 3 | восстановитель (окисление) |
| P0 + 3ē ⟶ P-3 | 3 | 2 | окислитель (восстановление) | |
в)
H3PO4 + KOH = KH2PO4 + H2O
H+ + H2PO4— + K+ + OH— = K+ + H2PO4— + H2O
H+ + H2PO4— + OH— = H2PO4— + H2O
KH2PO4 + KOH = K2HPO4 + H2O
K+ + H2PO4— + K+ + OH— = 2K+ + HPO42- + H2O
H2PO4— + OH— = HPO42- + H2O
K2HPO4 + KOH = K3PO4 + H2O
2K+ + HPO42- + K+ + OH— = 3K+ + PO43- + H2O
HPO42- + OH— = PO43- + H2O
2K3PO4 + H3PO4 = 3K2HPO4
6K+ + 2PO43- + H+ + H2PO4— = 6K+ + 3HPO42-
2PO43- + H+ + H2PO4— = 3HPO42-
K2HPO4 + H3PO4 = 2KH2PO4
2K+ + HPO42- + H+ + H2PO4— = 2K+ + 2H2PO4—
H+ + HPO42- = H2PO4—
KH2PO4 + HCl = KCl + H3PO4
K+ + H2PO4— + H+ + Cl— = K+ + Cl— + H3PO4
H+ + H2PO4— = H3PO4
г)
2H3PO4 `overset(t)(=)` H4P2O7 + H2O
H4P2O7 `overset(t,»вак. «)(=)` 2HPO3 + H2O
«)(=)` 2HPO3 + H2O
2HPO3 `overset(t)(=)` P2O5 + H2O
2P2O5 + 3HF `overset(t)(=)` POF3 + 3HPO3
HPO3 + H2O = H3PO4
д)
| 6Li + 2P = 2Li3P | ||||
| Li0 — 1ē ⟶ Li+ | 1 | 3 | 3 | восстановитель (окисление) |
| P0 + 3ē ⟶ P-3 | 3 | 1 | окислитель (восстановление) | |
Li3P + 3H2O = 3LiOH + PH3↑
PH3 + HI = PH4I
PH3 + H+ + I— = PH4+ + I—
PH3 + H+ = PH4+
PH4I + NaOH = NaI + PH3↑ + H2O
PH4+ + I— + Na+ + OH— = Na+ + I— + PH3↑ + H2O
PH4+ + OH— = PH3↑ + H2O
| 2PH3 + 4O2 = P2O5 + 3H2O | ||||
| P-3 — 8ē ⟶ P+5 | 8 | 8 | 1 | восстановитель (окисление) |
| O20 + 4ē ⟶ 2O-2 | 4 | 2 | окислитель (восстановление) | |
gomolog. ru1https://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/5-11.html
ru1https://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/5-11.html
Урок №37. Оксид фосфора (V). Фосфорная кислота и её соли. Фосфорные удобрения
Оксид фосфора (V) – фосфорный ангидрид
Физические свойства: Оксид фосфора (V) Р2О5 — белый гигроскопичный порошок (поглощает воду), следует хранить в плотно закрытых сосудах.
Получение: Получается при горении фосфора в избытке воздуха или кислорода
4P + 5O2 = 2P2O5
Применение: Оксид фосфора (V) очень энергично соединяется с водой, а также отнимает воду от других соединений. Применяется как осушитель газов и жидкостей.
Химические свойства: Оксид фосфора (V) – это кислотный оксид, взаимодействует, подобно другим кислотным оксидам с водой, основными оксидами и основаниями.
Фосфорный ангидрид особым образом взаимодействует с водой, взаимодействуя с водой при обычных условиях (без нагревания), образует в первую очередь метафосфорную кислоту НРО3:
P2O5 + H2O = HPO3
при нагревании образуется ортофосфорная кислота H3PO4:
P2O5 + 3H2O = 2H3PO4 (t˚C)
При нагревании H3PO4 можно получить пирофосфорную кислоту H4P2O7:
2H3PO4 = H2O + H4P2O7 (t˚C)
Ортофосфорная кислота
Наибольшее
практическое значение имеет ортофосфорная кислота Н3РO4.
Строение молекулы: В молекуле фосфорной кислоты атомы водорода соединены с атомами кислорода:
Физические свойства: Фосфорная кислота представляет собой бесцветное, гигроскопичное твердое вещество, хорошо растворимое в воде.
Получение:
1) Взаимодействие
оксида фосфора (V) с водой при нагревании:
P2O5 + 3H2O = 2H3PO4 (t˚C)
2) Взаимодействие
природной соли – ортофосфата кальция с
серной кислотой при нагревании:
Сa3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4 (t˚C)
3) При
взаимодействии фосфора с концентрированной азотной кислотой
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства:
Свойства, общие с другими кислотами | Специфические свойства |
1. Ортофосфорная кислота диссоциирует ступенчато: H3PO4 ↔ H+ + H2PO4—(дигидроортофосфат-ион) H2PO4— ↔ H+ + HPO42- (гидроортофосфат-ион) HPO42- ↔ H+ + PO43- (ортофосфат-ион) 2. Взаимодействует с металлами в ряду активности до (Н2): металл+ H3PO4=соль+Н2↑ 3. Взаимодействует с основными оксидами: оксид металла + H3PO4 = соль + Н2О 4. основание + H3PO4 = соль + Н2О если кислота в избытке, то образуется кислая соль: H3PO4(изб) + NaOH = NaH2PO4 + H2O или H3PO4(изб) + 2NaOH = Na2HPO4 + 2H2O 5. Реагирует с аммиаком (по донорно-акцепторному механизму), если в избытке кислота, образуются кислые соли: H3PO4 + NH3 = NH3H2PO4 H3PO4 + 2NH3 = (NH3)2HPO4 H3PO4 + 3NH3 = (NH3)3PO4 6. 2H3PO4+3Na2CO3 = 2Na3PO4 + 3H2O + 3CO2↑ | 1. При нагревании ортофосфорная кислота постепенно превращается в метафосфорную кислоту: 2H3PO4 (t˚C) →H2O + H4P2O7 H4P2O7 (t˚C)→H2O + 2HPO3 2. Качественная реакция на PO43- — фосфат ион. Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок: Н3РО4 + 3AgNO3 = Ag3PO4↓+ 3HNO3 3.
|
Применение:
В основном для производства минеральных удобрений.
А также, используется при пайке, для очищения от ржавчины металлических поверхностей. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество. Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Фосфорные удобрения
Фосфор – элемент важнейшего
органического соединения для любого организма аденозинтрифосфорной кислоты –
АТФ. Эта кислота служит аккумулятором энергии в живой клетке. Фосфор входит в
состав нуклеиновых кислот – ДНК и РНК, а без них невозможно хранение и
воспроизведение генетической информации, содержащейся в клетке. Фосфор
принимает активное участие в восстановлении и и распаде углеводов, оказывая
большое влияние на рост растения, его цветение и плодоношение.
Фосфор
принимает активное участие в восстановлении и и распаде углеводов, оказывая
большое влияние на рост растения, его цветение и плодоношение.
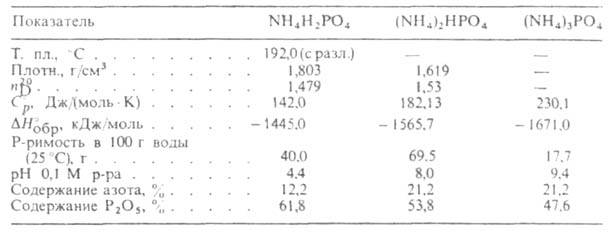
Растения усваивают фосфор из почвы главным образом в виде фосфат – иона (РО4-3). Как известно, фосфорная кислота образует три типа солей: орто-, гидро- и дигидрофосфаты. Для усвоения растением удобрение должно быть растворимо в воде, из средних фосфатов растворимы только соли щелочных металлов, гидрофосфаты растворимы лучше, зато дигидрофосфаты растворимы все без исключения.
Однако, и нерастворимая фосфоритная мука Са3(РО4)2 и труднорастворимый преципитат СаНРО4 прекрасно усваиваются некоторыми культурами (люпин, горох, горчица, гречиха…). Дело в том, что корневые волоски этих растений выделяют органические кислоты, растворяющие неподатливые в воде соли.
Одно из первых фосфорных удобрений
– это простой суперфосфат CaSO4. Ca(H2PO4)2. Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того,
большую часть этого удобрения составляет балласт – сульфат кальция. Однако,
пользоваться им будут еще долго, из-за легкости его получения:
Массовая доля оксида фосфора в нем не превышает 20% (это немного), кроме того,
большую часть этого удобрения составляет балласт – сульфат кальция. Однако,
пользоваться им будут еще долго, из-за легкости его получения:
Са3(РО4)2 + 2Н2SO4 = 2Ca SO4 + Ca(H2PO4)2
В другом фосфорном удобрении – двойном суперфосфате Са(Н2РО4)∙Н2О — в отличие от простого нет балласта – неусваиваемого растениями гипса. Производство этого удобрения связано с применением фосфорной кислоты вместо серной, сырьем может служить как фосфорит (ортофосфат кальция), так и известняк (карбонат кальция):
Са3(РО4)2 + 4Н3РО4+ 3Н2О = 3Са (Н2РО4)2∙Н2О
СаСО3 + 2Н3РО4 = Са(Н2РО4)2∙Н2О + СО2
На основе фосфорной кислоты также можно получить еще одно фосфорное удобрение – преципитат СаНРО4, содержащий 27–42 % фосфорного ангидрида:
2Н3РО4 + Са(ОН)2 = Са(Н2РО4)2 + 2Н2О
Са(Н2РО4)2+ Са(ОН)2 = 2СаНРО4 + 2Н2О
А если заменить в этих удобрениях довольно безразличный для растений кальций на ион аммония? Нейтрализацией фосфорной кислоты газообразным аммиаком получают высокоэффективные удобрения — аммофосы:
NH3 + H3PO4 = NH4H2PO4
или
2NH3 + H3PO4 = (NH4)2HPO4
ТРЕНАЖЁРЫ
 «Свойства фосфора и его соединений»
«Свойства фосфора и его соединений»Тренажёр №2. Тестовые задания по теме: «Азот и фосфор, их соединения»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций оксида фосфора (V) с1. Na2O
2. NaOH
3. H2O при нагревании
4. H2O без нагревания
Для 2 реакции запишите полное и краткое ионное уравнение.
№2. Составьте молекулярные и ионные уравнения реакций ортофосфорной кислоты с:
1. калием
2. оксидом калия
3. гидроксидом калия
4. сульфитом калия
№3. Осуществите превращения по схеме:
Сa3(PO4)2 -> P -> PH3 -> P2O5 -> H3PO4 -> Ca3(PO4)2
Назовите вещества
№4. Вычислите (в %), какое из фосфорных удобрений: двойной суперфосфат или преципитат богаче фосфором? Химические формулы удобрений найдите в схеме самостоятельно.
Одноосновный фосфат кальция | 10031-30-8
Одноосновный фосфат кальция Химические свойства, применение, производство
использует
Одноосновный фосфат кальция в основном используется в удобрениях. Он также используется в разрыхлителях; как минеральная добавка к пище; в качестве буфера для контроля pH; и как стабилизатор пластмасс.
Он также используется в разрыхлителях; как минеральная добавка к пище; в качестве буфера для контроля pH; и как стабилизатор пластмасс.Препарат
Одноосновный фосфат кальция может быть получен в лаборатории реакцией карбоната кальция с фосфорной кислотой:CaCO3 + 2h4PO4 → Ca (h3PO4) 2 + CO2 + h3O
Продукт класса удобрений получают путем измельчения фосфатной породы (трикальцийфосфат) в фосфорной или серной кислоте и выпаривания раствора.
Химические свойства
белые, большие, блестящие, трехцветные пластинки, кристалл (ы), порошок (ы) или гранулы; не гигроскопичен [MER06] [STR93]использует
Моногидрат монокальцийфосфата был первым кислым фосфатом, используемым в качестве закваски. Патент на его использование в разрыхлителях был выдан в 1956 году. Ранний MCP · h3 0 был получен путем озоления костей с образованием сырого продукта. Этот фосфат классифицируется как заквасочная кислота быстрого действия; примерно 60% теоретического CO 2 высвобождается в результате реакции MCP · h3 0 с содой на стадии смешивания теста или приготовления теста. После этого газ не выделяется, пока продукт не будет помещен в духовку и температура не достигнет примерно 140 ° F. Причина этого в том, что MCP · h3 0 диспропорционирует при контакте с водой с образованием некоторого количества дикальцийфосфата согласно следующему уравнению: Ca (h3PO4) 2.h3O + h3O = CaHPO4.2h3O + h4PO4.
После этого газ не выделяется, пока продукт не будет помещен в духовку и температура не достигнет примерно 140 ° F. Причина этого в том, что MCP · h3 0 диспропорционирует при контакте с водой с образованием некоторого количества дикальцийфосфата согласно следующему уравнению: Ca (h3PO4) 2.h3O + h3O = CaHPO4.2h3O + h4PO4. Из-за скорости реакции MCP · h30 сам по себе имеет ограниченное применение. Хотя его обычно используют при приготовлении фосфатной муки в количестве от 0,25 до 0,75% от веса готового продукта, а также при приготовлении печенья, в большинстве случаев его применяют в комбинации с другими фосфатными заквашивающими кислотами с более медленным действием.Ожидается, что на стадиях смешивания будет выделяться газ, чтобы способствовать образованию зародышей пузырьков, в то время как другие кислоты с более медленным действием выделяют газ во время стенда или выпечки.
использует
Одноосновный фосфат кальция — это подкислитель, разрыхлитель и пищевая добавка, которая существует в виде белых кристаллов или гранулированного порошка. Умеренно растворим в воде. Он используется как подкислитель в хлебе и сухих напитках; как источник кальция во фруктовых желе, консервах и злаках; и как компонент кондиционеров для теста.Он также имеет ограниченное применение в качестве химического разрыхлителя, поскольку он высвобождает около 67% диоксида углерода во время начального перемешивания, а это обычно происходит слишком быстро. Его также называют кислым фосфатом кальция, фосфатом монокальция, бифосфатом кальция и кислым фосфатом кальция.
Умеренно растворим в воде. Он используется как подкислитель в хлебе и сухих напитках; как источник кальция во фруктовых желе, консервах и злаках; и как компонент кондиционеров для теста.Он также имеет ограниченное применение в качестве химического разрыхлителя, поскольку он высвобождает около 67% диоксида углерода во время начального перемешивания, а это обычно происходит слишком быстро. Его также называют кислым фосфатом кальция, фосфатом монокальция, бифосфатом кальция и кислым фосфатом кальция.Сельское хозяйство
Апатит, обработанный серной кислотой, превращается в моно-дигидрофосфат кальция [Ca (H 2 PO 4 ) 2 ] который называется суперфосфатом.Дигидрофосфат кальция более растворим в воде. чем апатит.Сельское хозяйство
Почва состоит из частиц разного размера. Ил, а составляющая почвы, состоит из частиц размером от те из глины и песка. По данным международного гранулометрическая система, размер частиц ила составляет от 2 до 50 мкм. в диаметре. Далее он разделяется на мелкий ил (от 2 до 20 мкм).
и крупный ил (от 20 до 50 мкм). Процент ила
учитываются частицы в конкретной почве
при определении текстуры почвы.
в диаметре. Далее он разделяется на мелкий ил (от 2 до 20 мкм).
и крупный ил (от 20 до 50 мкм). Процент ила
учитываются частицы в конкретной почве
при определении текстуры почвы.Ил часто переносится в виде взвешенных частиц в процессе эксплуатации. вода и оседает на руслах рек, берегах рек или в озерах как аллювиальные отложения.
Почва, содержащая 40% или более глины и 40% или еще ила называют иловой глиной. Почва с содержанием глины от 27 до 40% и менее 20% песка известны как глинисто-алевритовый суглинок. Ил суглинок содержит 30% или более ила и от 12 до 27% глины. По аналогии, илистый суглинок состоит из 50-80% ила, менее 12% глина, а остальное — песок.
Продукты и сырье для получения одноосновного фосфата кальция
Сырье
Препараты
Осаждение фосфатов кальция из растворов электролитов
org/ScholarlyArticle»> 1.Avnimelech, Y .: Анализ обмена кальция 32 P и 45 Ca между гидроксиапатитом и его равновесным раствором, Israel J. Chem. 6 , 375–385 (1968)
CAS Google ученый
Бест, Дж. Б .: Некоторые теоретические соображения, касающиеся кристаллов, имеющие отношение к физическим свойствам кости. Биохим. биофиз. Acta (Amst.) 32 , 194–202 (1959)
Статья CAS Google ученый
Бетт, И.А.С., Кристнер, Л.Г., Холл, В.К .: Исследования водорода, удерживаемого твердыми телами. XII. Катализатор на основе гидроксиапатита. J. Amer. хим. Soc. 89 , 5535–5541 (1967).
Артикул CAS Google ученый
Brečević, Lj., Füredi-Milhofer, H .: Осаждение фосфатов кальция из растворов электролитов. II. Образование и трансформация осадков. Calcif. Тисс. Res. 10 , 82–90 (1972).
Артикул Google ученый
Даллемань, М. Дж., Бодсон, П., Фабри, К.: Обмениваемый кальций минеральной субстанции из étudié à l’aide de 45 Ca. Биохим. биофиз. Acta (Amst.) 18 , 394–406 (1955)
Артикул CAS Google ученый
Даллемань, М. Дж., Ришель, Л .: Костные соли. Аэромед. Revs. 1–60 (1960)
Деспотович, Р .: Коллоидная стабильность в водных и неводных средах. Диск. Faraday Soc. № 42, 175–209 (1966).
Диск. Faraday Soc. № 42, 175–209 (1966).
Артикул Google ученый
Despotović, R .: Kem. Инд. (Загреб) 16 , 13–19 (1967)
Google ученый
Eanes, E. D., Gillessen, J. H., Posner, A.S .: Промежуточные состояния при осаждении гидроксиапатита, Nature (Lond.) 208 , 365–367 (1965)
Артикул CAS Google ученый
Eanes, E. D., Gillessen, I. H., Posner, A. S .: Механизм превращения некристаллического фосфата кальция в кристаллический гидроксиапатит. Рост кристаллов 373–376 (1967)
Eanes, E. D., Posner, A. S .: Кинетика и механизм превращения некристаллического фосфата кальция в кристаллический гидроксиапатит. Пер. Акад.Наук, сер. II 28 , 233–241 (1965).
CAS Google ученый
Фрэнсис М. Д., Веб, Н. С. Образование гидроксиапатита из предшественника гидратированного моногидрофосфата кальция. Calcif. Тисс. Res. 6 , 335–342 (1971)
Артикул CAS Google ученый
Füredi-Milhofer, H., Bilinski, H., Breević, Ij., Despotović, R., Filipović-Vinceković, N., Oljica, E., Purgarić, B .: Образование осадков фосфата кальция. Метастабильные равновесия и кинетика. Proc. Международный коллоквиум по физической химии и кристаллографии апатитов, представляющих биологический интерес, Париж, 10–15 сентября 1973 г. (в печати)
(в печати)
Füredi-Milhofer, H., Brečević, Lj., Oljica, E., Purgarić, B ., Гасс, З., Перович, Г .: Влияние условий осаждения на образование и преобразование осадков фосфата кальция, стр. 109–120 в: А.Л. Смит, ред., Рост частиц в суспензии. Лондон-Нью-Йорк: Акад. Пресс 1973
Google ученый
Фюреди-Милхофер, Х., Пургарич, Б., Бречевич, Лдж., Павкович, Н .: Осаждение фосфатов кальция из растворов электролитов I. Исследование осадков в области физиологического pH. Calcif. Тисс. Res. 8 , 142–153 (1971)
Артикул Google ученый
Füredi-Milhofer, H., Purgarić, B., Breĉević, Lj., Pavković, N. , Oljica, E .: Зарождение фосфата кальция из растворов при физиологическом pH. Хорват. Chem. Acta 41 , 37–42 (1969)
, Oljica, E .: Зарождение фосфата кальция из растворов при физиологическом pH. Хорват. Chem. Acta 41 , 37–42 (1969)
Google ученый
Heughebart, J.C., Montel, G .: Sur la трансформация аморфных фосфатов в апатитные фосфаты, внутрикристаллическая реакция. Международный коллоквиум по физической химии и кристаллографии апатитов, представляющих биологический интерес.Париж. 10–15 сентября 1973 г. Сборник тезисов, с. 61
Холмс, Дж. М., Биби, Р. А .: Площадь поверхности путем газовой адсорбции аморфного фосфата кальция и кристаллического гидроксиапатита. Calcif. Тисс. Res. 7 , 163–174 (1971)
Артикул CAS Google ученый
Нейман, В. Ф., Нойман, М. У .: Химическая динамика костного минерала. Чикаго, Иллинойс: Издательство Чикагского университета 1958
Google ученый
Нойман, В. Ф., Вайкель, Дж. Х. Младший: перекристаллизация в костном минерале. Анна. Акад. Sci. 60 , 685–695 (1955)
PubMed Статья CAS Google ученый
Newesely, H .: Darstellung von «Oktacalcium Phosphat» для гомогенной кристаллизации. Mh. Chem. 91 , 1020–1023 (1960)
CAS Google ученый
Пак, К.Ю. К., Барттер, Ф. С. Ионное взаимодействие с костным минералом. I. Доказательства изоионного обмена кальция с гидроксиапатитом. Биохим. биофиз. Acta (Amst.) 141 , 401–409 (1967)
I. Доказательства изоионного обмена кальция с гидроксиапатитом. Биохим. биофиз. Acta (Amst.) 141 , 401–409 (1967)
CAS Google ученый
Пак, К. Ю., Скиннер, К. У.: ионное взаимодействие с костным минералом. IV. Различное сродство синтетических фосфатов кальция к Ca 2+ . Биохим. биофиз. Acta (Amst.) 165 , 274–282 (1969)
Google ученый
Pautard, F. G.E .: кристалличность фосфатов кальция у позвоночных и беспозвоночных. Международный коллоквиум по физической химии и кристаллографии апатитов, представляющих биологический интерес. Париж, 10–15 сентября 1973 г. Сборник тезисов, стр. 21–22; Pautard, F.G.E., частное сообщение
Smales, F.C .: Эффект Кельвина и рост кристаллов гидроксиапатита. Зубная эмаль II. (ред. Fearnhead, R. W. и Stack, M. V.). Бристоль: Джон Райт 1971
Google ученый
Собель, А. Э., Лоуренс, П. А .: Рост кристаллов в минерализующих тканях. Биохим. биофиз. Acta (Amst.) 41 , 1–8 (1960)
Статья CAS Google ученый
Strates, B. S., Neuman, W. F., Levinskas, G.J .: Растворимость костного минерала. II. Осаждение почти нейтральных растворов кальция и фосфатов. J. Phys. Chem. 61 , 279–285 (1957)
Артикул CAS Google ученый
Termine, J. D., Eanes, E. D .: Сравнительная химия аморфных и апатитовых препаратов фосфата кальция. Calcif. Тисс. Res. 10 , 171–197 (1972)
Артикул CAS Google ученый
Термин, Дж. Д., Пецкаускас, Р. А., Познер, А. С .: Образование фосфата кальция in vitro II. Влияние окружающей среды на аморфно-кристаллическое превращение. Arch. Biochem. Биофиз. 140 , 318–325 (1970)
PubMed Статья CAS Google ученый
Термин, Дж. Д., Познер, А. С .: Образование фосфата кальция in vitro. I. Факторы, влияющие на начальное разделение фаз. Arch. Biochem. Биофиз. 140 , 307–317 (1970)
PubMed Статья CAS Google ученый
Уолтон, А. Г., Бодин, В. Дж., Фюреди, Х., Шварц, А .: Зарождение фосфата кальция из раствора. Канад. J. Chem. 45 , 2695–2701 (1967)
Артикул CAS Google ученый
Вольф, Р. Х. Х .: Гетерогенный обмен осадков, VII. Расчет фракционного обмена при изменении состава системы в ходе экспериментов. Kolloid-Z., Z. Polymere 205 , 120–121 (1965)
Артикул CAS Google ученый
Цименс, К. Э .: Zur Kinetik heterogener Austauschreaktionen Arkiv Kemi, Mineral. Геол. А 20 , 18, 1–26 (1945)
Google ученый
% PDF-1.4 % 1 0 obj > endobj 5 0 obj /Заголовок /Предмет / Автор /Режиссер / Ключевые слова / CreationDate (D: 202101258-00’00 ‘) / ModDate (D: 201
150049 + 01’00 ‘)
>>
endobj
2 0 obj
>
endobj
3 0 obj
>
endobj
4 0 obj
>
транслировать
2019-01-14T14: 00: 22ZAperçu2019-01-14T15: 00: 49 + 01: 002019-01-14T15: 00: 49 + 01: 00Mac OS X 10. 12.6 Quartz PDFContextapplication / pdf
12.6 Quartz PDFContextapplication / pdf
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Регламент Комиссии (ЕС) № 231/2012 Показать полное название
Регламент Комиссии(ЕС) № 231/2012 от 9 марта 2012 г., устанавливающий спецификации для пищевых добавок, перечисленных в Приложениях II и III к Регламенту (ЕС) № 1333/2008 Европейский парламент и Совет (текст, имеющий отношение к ЕЭЗ)
Статус:
Это исходная версия (в том виде, в котором она была изначально принята).
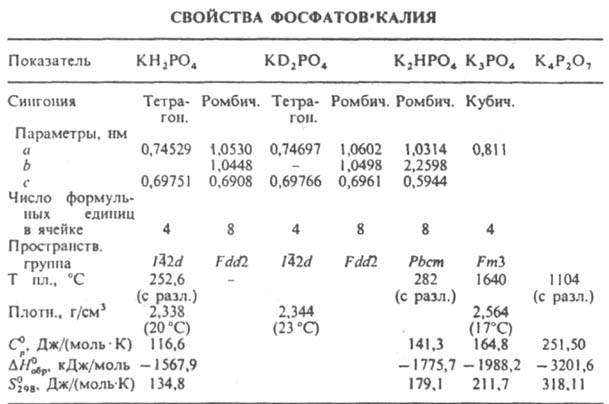
E 341 (i) ФОСФАТ МОНОКАЛЬЦИЯ| Синонимы | Одноосновный фосфат кальция; Ортофосфат монокальция |
| Определение | |
|---|---|
| Einecs | 231-837-1 |
| Химическое название | Кальция дигидрофосфатная формула |
| Химическая формула | |
| 4 ) 2 Моногидрат: Ca (H 2 PO 4 ) 2 · H 2 O | |
| Молекулярная масса | 234,05 (безводный) 252,08 (моногидрат) |
| Пробирка | Содержание не менее 95% в пересчете на сухую основу P 2 O 5 содержание от 55,5% до 61,1% на безводной основе |
| Описание | Гранулированный порошок или белые расплывчатые кристаллы или гранулы |
| Идентификация | |
| Тест на кальций | Пройден тест |
| Содержание CaO | От 23,0% до 27,5% (безводный) От 19,0% до 24,8% (моногидрат) |
| Чистота | |
| Потери при сушке | Безводный: не более 14% (105 ° C, 4 часа) Моногидрат: не более 17,5% (105 ° C, 4 часа) |
| Потери при возгорании | Безводный: не более 17,5% (после воспламенения при 800 ° C ± 25 ° C в течение 30 минут) Моногидрат: не более 25,0% (определяется сушкой при 105 ° C в течение одного часа, затем воспламенением при 800 ° C ± 25 ° C в течение 30 минут) |
| Фторид | Не более 30 мг / кг (в пересчете на фтор) |
| Мышьяк | Не более 1 мг / кг |
| Кадмий | Не более 1 мг / кг |
| Свинец | Не более 1 мг / кг |
| Ртуть | Не более 1 мг / кг |
| Алюминий | Не более 70 мг / кг (только при добавлении в пищу для младенцев и маленькие дети) Не более 200 мг / кг (для всех целей, кроме еды для младенцев и детей младшего возраста) |
Наверх
Именные соединения
2.
 3.Название ионных соединений
3.Название ионных соединенийЦель обучения
- Назвать ионные соединения.
Эмпирические и молекулярные формулы, обсуждаемые в предыдущем разделе, точны и очень информативны, но у них есть некоторые недостатки. Во-первых, они неудобны для рутинного устного общения. Например, сказать «C-A-три-P-O-четыре-два» для Ca 3 (PO 4 ) 2 намного сложнее, чем сказать «фосфат кальция».Кроме того, в разделе 2.4 «Наименование ковалентных соединений» вы увидите, что многие соединения имеют одинаковые эмпирические и молекулярные формулы, но разное расположение атомов, что приводит к очень разным химическим и физическим свойствам. В таких случаях соединениям необходимо иметь разные названия, которые позволяют различать возможные варианты расположения.
Многие соединения, особенно те, которые были известны относительно долгое время, имеют более одного названия: общее имя (иногда более одного) и систематическое имя , которое является именем, присвоенным в результате соблюдения определенных правил .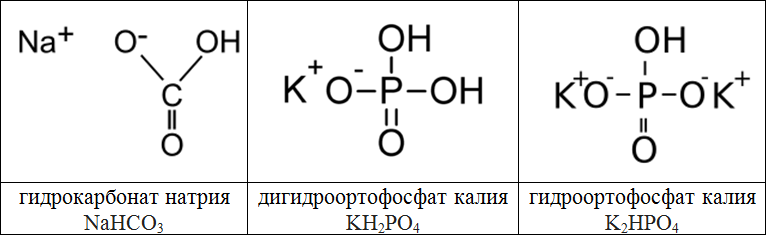 Как и названия большинства элементов, общие названия химических соединений обычно имеют историческое происхождение, хотя зачастую они не связаны с интересующими их соединениями. Например, систематическое название KNO 3 — нитрат калия, но его общее название — селитра.
Как и названия большинства элементов, общие названия химических соединений обычно имеют историческое происхождение, хотя зачастую они не связаны с интересующими их соединениями. Например, систематическое название KNO 3 — нитрат калия, но его общее название — селитра.
В этом тексте мы используем систематизированную номенклатуру для присвоения значимых имен миллионам известных веществ. К сожалению, некоторые химические вещества, которые широко используются в торговле и промышленности, все еще известны почти исключительно под их общими названиями; в таких случаях вы должны знать как общее, так и систематическое название.Цель этого и следующих двух разделов — научить вас писать формулу простого неорганического соединения по его названию — и наоборот — и познакомить вас с некоторыми из наиболее часто встречающихся общих названий.
Начнем с бинарных ионных соединений , которые содержат только два элемента. Процедура присвоения названия таким соединениям представлена на рисунке 2. 10 «Присвоение названия ионному соединению» и включает следующие шаги:
10 «Присвоение названия ионному соединению» и включает следующие шаги:
Рисунок 2.10 Именование ионного соединения
- Расположите ионы в их правильном порядке: катион, затем анион.
Назовите катион.
- Металлы, образующие только один катион. Как отмечалось в Разделе 2.1 «Химические соединения», эти металлы обычно находятся в группах 1-3, 12 и 13. Название катиона металла, образующего только один катион, совпадает с названием металла (с слово ion добавлено, если катион находится сам по себе). Например, Na + — ион натрия, Ca 2+ — ион кальция, а Al 3+ — ион алюминия.
Металлы, образующие более одного катиона. Как показано на Рисунке 2.11 «Металлы, образующие более одного катиона, и их положение в Периодической таблице», многие металлы могут образовывать более одного катиона.
 Такое поведение наблюдается для большинства переходных металлов, многих актинидов и наиболее тяжелых элементов групп 13–15. В таких случаях положительный заряд металла обозначается римской цифрой в скобках сразу после названия металла.Таким образом, Cu + — это медь (I) (читается как «медная»), Fe 2+ — железо (II), Fe 3+ — железо (III), Sn 2+ — олово (II ), а Sn 4+ олово (IV).
Такое поведение наблюдается для большинства переходных металлов, многих актинидов и наиболее тяжелых элементов групп 13–15. В таких случаях положительный заряд металла обозначается римской цифрой в скобках сразу после названия металла.Таким образом, Cu + — это медь (I) (читается как «медная»), Fe 2+ — железо (II), Fe 3+ — железо (III), Sn 2+ — олово (II ), а Sn 4+ олово (IV).Однако старая система номенклатуры таких катионов все еще широко используется. Название катиона с более высоким зарядом образовано от корня латинского названия элемента с добавленным суффиксом — ic , а имя катиона с более низким зарядом имеет тот же корень с суффиксом — ous .Имена Fe 3+ , Fe 2+ , Sn 4+ и Sn 2+ , таким образом, означают трехвалентное, двухвалентное, двухвалентное и двухвалентное олово соответственно. Несмотря на то, что в этом тексте используются систематические имена с римскими цифрами, вы должны уметь распознать эти общие имена, потому что они все еще часто используются.
 Например, на этикетке фтористого ополаскивателя вашего стоматолога химикаты называют фторид олова (II) и обычно обозначают фторид олова.
Например, на этикетке фтористого ополаскивателя вашего стоматолога химикаты называют фторид олова (II) и обычно обозначают фторид олова.Некоторые примеры металлов, образующих более одного катиона, приведены в таблице 2.5 «Общие катионы металлов, образующие более одного иона» вместе с названиями ионов. Отметим, что простой катион Hg + не встречается в химических соединениях. Вместо этого все соединения ртути (I) содержат димерный катион , Hg 2 2+ , в котором два атома Hg связаны вместе.
Таблица 2.5 Общие катионы металлов, образующие более одного иона
Катион Систематическое название Общее название Катион Систематическое название Общее название Cr 2+ хром (II) хром Cu 2+ медь (II) медь Cr 3+ хром (III) хром Cu + медь (I) медь Mn 2+ марганец (II) марганец * Hg 2+ ртуть (II) ртуть Mn 3+ марганец (III) марганец * Hg 2 2+ ртуть (I) ртутный † Fe 2+ железо (II) черный Sn 4+ олово (IV) станник Fe 3+ железо (III) железо Sn 2+ олово (II) оловянное Co 2+ кобальт (II) кобальт * Пб 4+ свинец (IV) отвес * Co 3+ кобальт (III) кобальтовый * Пб 2+ свинец (II) отвес * * Не широко используется. 
† Изолированный ион ртути (I) существует только в виде газообразного иона. - Многоатомные катионы. Имена общих многоатомных катионов, которые относительно важны в ионных соединениях (например, ион аммония), приведены в Таблице 2.4 «Общие многоатомные ионы и их названия».
Назовите анион.
- Одноатомные анионы. Одноатомные анионы именуются добавлением суффикса — ide к корню имени родительского элемента; таким образом, Cl — представляет собой хлорид, O 2- представляет собой оксид, P 3- представляет собой фосфид, N 3- представляет собой нитрид (также называемый азидом) и C 4- представляет собой карбид.
 Поскольку заряды на этих ионах можно предсказать, исходя из их положения в периодической таблице, указывать заряд в названии не обязательно , а не .Примеры одноатомных анионов приведены в Таблице 2.2 «Некоторые общие одноатомные ионы и их названия».
Поскольку заряды на этих ионах можно предсказать, исходя из их положения в периодической таблице, указывать заряд в названии не обязательно , а не .Примеры одноатомных анионов приведены в Таблице 2.2 «Некоторые общие одноатомные ионы и их названия». Многоатомные анионы. Многоатомные анионы обычно имеют общие имена, которые вы должны выучить; некоторые примеры приведены в Таблице 2.4 «Общие многоатомные ионы и их названия». Многоатомные анионы, которые содержат один атом металла или неметалла плюс один или несколько атомов кислорода, называются оксоанионами (или оксианионами) . В случаях, когда для элемента известны только два оксоаниона, название оксоаниона с большим количеством атомов кислорода оканчивается на — ate , а имя оксоаниона с меньшим количеством атомов кислорода заканчивается на —ite .Например, NO 3- — это нитрат, а NO 2- — нитрит.
Галогены и некоторые переходные металлы образуют более обширный ряд оксоанионов, состоящий из четырех членов.
 В названиях этих оксоанионов префикс на — используется для идентификации оксоаниона с наибольшим количеством кислорода (так, что ClO 4 — — это перхлорат, а ClO 3 — — хлорат), а префикс hypo — используется для идентификации аниона с наименьшим количеством кислорода (ClO 2 — — хлорит, а ClO — — гипохлорит).Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода изображена на рисунке 2.12 «Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода». Дифференцировать оксоанионы в таком ряду нетривиально. Например, гипохлорит-ион является активным ингредиентом отбеливателя для стирки и дезинфицирующего средства для бассейнов, но соединения, содержащие перхлорат-ион, могут взорваться при контакте с органическими веществами.
В названиях этих оксоанионов префикс на — используется для идентификации оксоаниона с наибольшим количеством кислорода (так, что ClO 4 — — это перхлорат, а ClO 3 — — хлорат), а префикс hypo — используется для идентификации аниона с наименьшим количеством кислорода (ClO 2 — — хлорит, а ClO — — гипохлорит).Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода изображена на рисунке 2.12 «Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода». Дифференцировать оксоанионы в таком ряду нетривиально. Например, гипохлорит-ион является активным ингредиентом отбеливателя для стирки и дезинфицирующего средства для бассейнов, но соединения, содержащие перхлорат-ион, могут взорваться при контакте с органическими веществами.
- Одноатомные анионы. Одноатомные анионы именуются добавлением суффикса — ide к корню имени родительского элемента; таким образом, Cl — представляет собой хлорид, O 2- представляет собой оксид, P 3- представляет собой фосфид, N 3- представляет собой нитрид (также называемый азидом) и C 4- представляет собой карбид.
Напишите название соединения как название катиона, а затем название аниона.

, а не необходимо указывать количество катионов или анионов, присутствующих на формульную единицу в названии ионного соединения, потому что эта информация подразумевается зарядами на ионах. Однако вы должны учитывать заряд ионов при написании формулы ионного соединения из его названия. Поскольку заряд иона хлорида равен -1, а заряд иона кальция равен +2, например, в соответствии с их положением в периодической таблице, простая арифметика говорит вам, что хлорид кальция должен содержать в два раза больше ионов хлорида, чем ионы кальция. для поддержания электрической нейтральности.Таким образом, формула CaCl 2 . Точно так же фосфат кальция должен быть Ca 3 (PO 4 ) 2 , потому что катион и анион имеют заряды +2 и -3 соответственно. Лучший способ научиться давать имена ионным соединениям — это проработать несколько примеров, ссылаясь на Рисунок 2.10 «Присвоение имен ионным соединениям», Таблицу 2.2 «Некоторые общие одноатомные ионы и их имена», Таблицу 2.
 4 «Общие многоатомные ионы и их имена. »и Таблицу 2.5« Обычные катионы металлов, образующие более одного иона », если необходимо.
4 «Общие многоатомные ионы и их имена. »и Таблицу 2.5« Обычные катионы металлов, образующие более одного иона », если необходимо.
Рис. 2.11 Металлы, образующие более одного катиона, и их расположение в Периодической таблице
За некоторыми исключениями, эти металлы обычно являются переходными металлами или актинидами.
Рисунок 2.12 Связь между названиями оксоанионов и количеством присутствующих атомов кислорода
Обратите внимание на шаблон
Катионы всегда называют перед анионами.
Большинство переходных металлов, многие актиниды и самые тяжелые элементы 13–15 групп могут образовывать более одного катиона.
Пример 6
Напишите систематическое название (и общее название, если применимо) для каждого ионного соединения.
- LiCl
- MgSO 4
- (NH 4 ) 3 PO 4
- Cu 2 O
Дано: эмпирическая формула
Спрашивали: имя
Стратегия:
A Если для катиона возможен только один заряд, дайте его имя, сверяясь с таблицей 2. 2 «Некоторые общие одноатомные ионы и их названия» или Таблица 2.4 «Общие многоатомные ионы и их названия», если необходимо. Если катион может иметь более одного заряда (Таблица 2.5 «Общие катионы металлов, образующих более одного иона»), укажите заряд римскими цифрами.
2 «Некоторые общие одноатомные ионы и их названия» или Таблица 2.4 «Общие многоатомные ионы и их названия», если необходимо. Если катион может иметь более одного заряда (Таблица 2.5 «Общие катионы металлов, образующих более одного иона»), укажите заряд римскими цифрами.
B Если анион не содержит кислорода, назовите его в соответствии с шагом 3а, используя Таблицу 2.2 «Некоторые общие одноатомные ионы и их названия» и Таблицу 2.4 «Общие многоатомные ионы и их имена», если необходимо.Для многоатомных анионов, содержащих кислород, используйте Таблицу 2.4 «Общие многоатомные ионы и их названия», а также соответствующий префикс и суффикс, перечисленные на этапе 3b.
C Напишите название соединения, начиная с катиона.
Решение:
- A B Литий находится в группе 1, поэтому мы знаем, что он образует только катион Li + , который является ионом лития.
 Точно так же хлор находится в группе 7, поэтому он образует анион Cl — , который является ионом хлорида. C Поскольку мы начинаем с названия катиона, это соединение называется хлорид лития, который используется в медицине как антидепрессант.
Точно так же хлор находится в группе 7, поэтому он образует анион Cl — , который является ионом хлорида. C Поскольку мы начинаем с названия катиона, это соединение называется хлорид лития, который используется в медицине как антидепрессант. - A B Катион — это ион магния, а анион, содержащий кислород, — сульфат. C Поскольку мы перечисляем катион в первую очередь, название этого соединения — сульфат магния. Гидратированная форма сульфата магния (MgSO 4 · 7H 2 O) продается в аптеках как английская соль, сильное, но эффективное слабительное.
- A B Катион — это ион аммония (из Таблицы 2.4 «Общие многоатомные ионы и их названия»), а анион — это фосфат. C Таким образом, соединение представляет собой фосфат аммония, который широко используется в качестве удобрения. Нет необходимости указывать, что формульная единица содержит три иона аммония, потому что три необходимы для уравновешивания отрицательного заряда фосфата.

- A B Катион — это переходный металл, который часто образует более одного катиона (Таблица 2.5 «Общие катионы металлов, образующие более одного иона»). Поэтому мы должны указать в названии положительный заряд катиона: медь (I) или, согласно более старой системе, медь. Анион оксидный. C Название этого соединения — оксид меди (I) или, в более старой системе, оксид меди. Оксид меди (I) используется в качестве красной глазури на керамике и в необрастающих красках для предотвращения роста организмов на днище лодок.
Cu 2 О. Дно лодки защищено красной необрастающей краской, содержащей оксид меди (I), Cu 2 O.
Упражнение
Напишите систематическое название (и общее название, если применимо) для каждого ионного соединения.
- CuCl 2
- мгCO 3
- FePO 4
Ответ:
- хлорид меди (II) (или хлорид меди)
- карбонат магния
- фосфат железа (III) (или фосфат железа)
Пример 7
Напишите формулы для каждого соединения.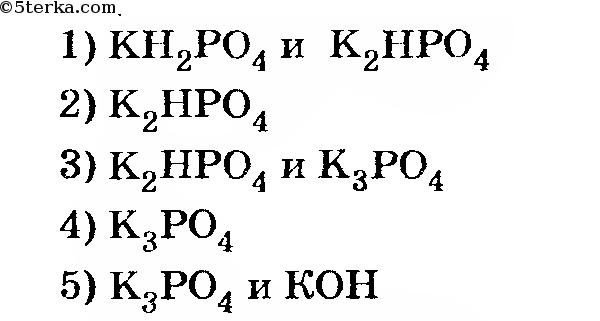
- дигидрофосфат кальция
- сульфат алюминия
- оксид хрома (III)
Дано: систематическое название
Спросил: формула
Стратегия:
A Определите катион и его заряд, используя расположение элемента в периодической таблице и Таблицу 2.2 «Некоторые общие одноатомные ионы и их названия», Таблица 2.3 «Физические свойства типичных ионных соединений и ковалентных молекулярных веществ», Таблица 2.4 «Общие многоатомные ионы и их названия» и Таблица 2.5 «Общие катионы металлов, образующих более одного иона». Если катион получен из металла, который может образовывать катионы с разными зарядами, используйте соответствующую римскую цифру или суффикс, чтобы указать его заряд.
B Определите анион, используя Таблицу 2. 2 «Некоторые общие одноатомные ионы и их названия» и Таблицу 2.4 «Общие многоатомные ионы и их названия».Начав с катиона, напишите формулу соединения, а затем определите количество катионов и анионов, необходимых для достижения электрической нейтральности.
2 «Некоторые общие одноатомные ионы и их названия» и Таблицу 2.4 «Общие многоатомные ионы и их названия».Начав с катиона, напишите формулу соединения, а затем определите количество катионов и анионов, необходимых для достижения электрической нейтральности.
Решение:
- A Кальций входит в группу 2, поэтому он образует только ион Ca 2+ . B Дигидрофосфат представляет собой ион H 2 PO 4 — (Таблица 2.4 «Общие многоатомные ионы и их названия»). Два иона H 2 PO 4 — необходимы для уравновешивания положительного заряда на Ca 2+ , чтобы дать Ca (H 2 PO 4 ) 2 .Гидрат дигидрофосфата кальция, Ca (H 2 PO 4 ) 2 · H 2 O, является активным ингредиентом разрыхлителя.

- A Алюминий, расположенный в верхней части группы 13 в периодической таблице, образует только один катион, Al 3+ (Рисунок 2.11 «Металлы, образующие более одного катиона, и их расположение в Периодической таблице»). B Сульфат — это SO 4 2- (Таблица 2.4 «Общие многоатомные ионы и их названия»).Чтобы сбалансировать электрические заряды, нам нужны два катиона Al 3+ и три аниона SO 4 2-, что дает Al 2 (SO 4 ) 3 . Сульфат алюминия используется для дубления кожи и очистки питьевой воды.
- A Поскольку хром является переходным металлом, он может образовывать катионы с различным зарядом. Римская цифра говорит нам, что положительный заряд в этом случае равен +3, поэтому катион Cr 3+ . B Оксид — O 2−.Таким образом, для получения электрически нейтрального соединения Cr 2 O 3 требуются два катиона (Cr 3+ ) и три аниона (O 2-).
 Это соединение — распространенный зеленый пигмент, который имеет множество применений, включая маскирующие покрытия.
Это соединение — распространенный зеленый пигмент, который имеет множество применений, включая маскирующие покрытия.
Cr 2 O 3 . Оксид хрома (III) (Cr 2 O 3 ) является обычным пигментом в темно-зеленых красках, таких как маскировочная краска.
Упражнение
Напишите формулы для каждого соединения.
- хлорид бария
- карбонат натрия
- гидроксид железа (III)
Ответ:
- BaCl 2
- Na 2 CO 3
- Fe (OH) 3
Сводка
Ионные соединения названы в соответствии с систематическими процедурами, хотя широко используются общие названия. Систематическая номенклатура позволяет записать структуру любого соединения по его названию и наоборот. Ионные соединения обозначаются следующим образом: сначала катион, а затем анион. Если металл может образовывать катионы с более чем одним зарядом, заряд обозначается римскими цифрами в скобках после названия металла. Оксоанионы представляют собой многоатомные анионы, которые содержат один атом металла или неметалла и один или несколько атомов кислорода.
Систематическая номенклатура позволяет записать структуру любого соединения по его названию и наоборот. Ионные соединения обозначаются следующим образом: сначала катион, а затем анион. Если металл может образовывать катионы с более чем одним зарядом, заряд обозначается римскими цифрами в скобках после названия металла. Оксоанионы представляют собой многоатомные анионы, которые содержат один атом металла или неметалла и один или несколько атомов кислорода.
Ключевые вынос
- Существует систематический метод определения ионных соединений.
Концептуальные проблемы
Назовите каждый катион.
- К +
- Al 3+
- NH 4 +
- мг 2+
- Ли +
Назовите каждый анион.

- Br —
- CO 3 2−
- S 2−
- НЕТ 3 —
- HCO 2 —
- Ф —
- ClO —
- С 2 О 4 2−
Назовите каждый анион.
- PO 4 3−
- Класс —
- СО 3 2−
- CH 3 CO 2 —
- HSO 4 —
- ClO 4 —
- НЕТ 2 —
- О 2−
Назовите каждый анион.

- СО 4 2−
- CN —
- Cr 2 O 7 2−
- N 3−
- ОН —
- I —
- О 2 2−
Назовите каждое соединение.
- мгBr 2
- NH 4 CN
- CaO
- KClO 3
- К 3 PO 4
- NH 4 НЕТ 2
- NaN 3
Назовите каждое соединение.

- NaNO 3
- Cu 3 (PO 4 ) 2
- NaOH
- Li 4 C
- CaF 2
- NH 4 Br
- мгCO 3
Назовите каждое соединение.
- руб.
- Mn 2 (SO 4 ) 3
- NaClO
- (NH 4 ) 2 СО 4
- NaBr
- КИО 3
- Na 2 CrO 4
Назовите каждое соединение.

- NH 4 ClO 4
- SnCl 4
- Fe (OH) 2
- Na 2 O
- MgCl 2
- К 2 СО 4
- РаСl 2
Назовите каждое соединение.
- KCN
- LiOH
- CaCl 2
- NiSO 4
- NH 4 ClO 2
- LiClO 4
- La (CN) 3
Ответ
- бромид рубидия
- сульфат марганца (III)
- гипохлорит натрия
- сульфат аммония
- натрия бромид
- йодат калия
- хромат натрия
Числовые задачи
Для каждого ионного соединения назовите катион и анион и укажите заряд каждого иона.

- BeO
- Pb (OH) 2
- BaS
- Na 2 Cr 2 O 7
- ZnSO 4
- KClO
- NaH 2 PO 4
Для каждого ионного соединения назовите катион и анион и укажите заряд каждого иона.
- Zn (НЕТ 3 ) 2
- CoS
- BeCO 3
- Na 2 SO 4
- К 2 С 2 О 4
- NaCN
- FeCl 2
Напишите формулы для каждого соединения.

- карбонат магния
- сульфат алюминия
- фосфат калия
- оксид свинца (IV)
- нитрид кремния
- гипохлорит натрия
- хлорид титана (IV)
- динатрий аммонийфосфат
Напишите формулы для каждого соединения.
- нитрат свинца (II)
- фосфат аммония
- сульфид серебра
- сульфат бария
- иодид цезия
- бикарбонат натрия
- дихромат калия
- гипохлорит натрия
Напишите формулы для каждого соединения.

- цианид цинка
- хромат серебра
- иодид свинца (II)
- бензол
- перхлорат меди (II)
Напишите формулы для каждого соединения.
- фторид кальция
- натрия нитрат
- оксид железа (III)
- ацетат меди (II)
- нитрит натрия
Напишите формулы для каждого соединения.
- натрия гидроксид
- цианид кальция
- фосфат магния
- натрия сульфат
- бромид никеля (II)
- хлорит кальция
- бромид титана (IV)
Напишите формулы для каждого соединения.

- хлорит натрия
- нитрит калия
- нитрид натрия (также называемый азидом натрия)
- фосфид кальция
- хлорид олова (II)
- кальция гидрофосфат
- дигидрат хлорида железа (II)
Напишите формулы для каждого соединения.
- карбонат калия
- сульфит хрома (III)
- фосфат кобальта (II)
- гипохлорит магния
- гексагидрат нитрата никеля (II)

 Водный раствор кислоты изменяет окраску индикаторов
на красный:
Водный раствор кислоты изменяет окраску индикаторов
на красный: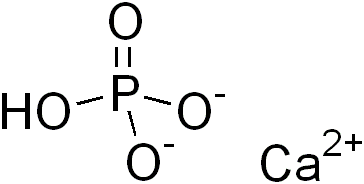 Взаимодействует с основаниями Ме(ОН)n:
Взаимодействует с основаниями Ме(ОН)n: Реагирует с солями слабых кислот:
Реагирует с солями слабых кислот: Играет
большую роль в жизнедеятельности животных и растений. Её остатки входят в
состав АТФ. При разложении АТФ выделяется большое количество энергии, что
очень важно для живых организмов.
Играет
большую роль в жизнедеятельности животных и растений. Её остатки входят в
состав АТФ. При разложении АТФ выделяется большое количество энергии, что
очень важно для живых организмов.
 Такое поведение наблюдается для большинства переходных металлов, многих актинидов и наиболее тяжелых элементов групп 13–15. В таких случаях положительный заряд металла обозначается римской цифрой в скобках сразу после названия металла.Таким образом, Cu + — это медь (I) (читается как «медная»), Fe 2+ — железо (II), Fe 3+ — железо (III), Sn 2+ — олово (II ), а Sn 4+ олово (IV).
Такое поведение наблюдается для большинства переходных металлов, многих актинидов и наиболее тяжелых элементов групп 13–15. В таких случаях положительный заряд металла обозначается римской цифрой в скобках сразу после названия металла.Таким образом, Cu + — это медь (I) (читается как «медная»), Fe 2+ — железо (II), Fe 3+ — железо (III), Sn 2+ — олово (II ), а Sn 4+ олово (IV). Например, на этикетке фтористого ополаскивателя вашего стоматолога химикаты называют фторид олова (II) и обычно обозначают фторид олова.
Например, на этикетке фтористого ополаскивателя вашего стоматолога химикаты называют фторид олова (II) и обычно обозначают фторид олова.
 Поскольку заряды на этих ионах можно предсказать, исходя из их положения в периодической таблице, указывать заряд в названии не обязательно , а не .Примеры одноатомных анионов приведены в Таблице 2.2 «Некоторые общие одноатомные ионы и их названия».
Поскольку заряды на этих ионах можно предсказать, исходя из их положения в периодической таблице, указывать заряд в названии не обязательно , а не .Примеры одноатомных анионов приведены в Таблице 2.2 «Некоторые общие одноатомные ионы и их названия». В названиях этих оксоанионов префикс на — используется для идентификации оксоаниона с наибольшим количеством кислорода (так, что ClO 4 — — это перхлорат, а ClO 3 — — хлорат), а префикс hypo — используется для идентификации аниона с наименьшим количеством кислорода (ClO 2 — — хлорит, а ClO — — гипохлорит).Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода изображена на рисунке 2.12 «Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода». Дифференцировать оксоанионы в таком ряду нетривиально. Например, гипохлорит-ион является активным ингредиентом отбеливателя для стирки и дезинфицирующего средства для бассейнов, но соединения, содержащие перхлорат-ион, могут взорваться при контакте с органическими веществами.
В названиях этих оксоанионов префикс на — используется для идентификации оксоаниона с наибольшим количеством кислорода (так, что ClO 4 — — это перхлорат, а ClO 3 — — хлорат), а префикс hypo — используется для идентификации аниона с наименьшим количеством кислорода (ClO 2 — — хлорит, а ClO — — гипохлорит).Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода изображена на рисунке 2.12 «Взаимосвязь между названиями оксоанионов и количеством присутствующих атомов кислорода». Дифференцировать оксоанионы в таком ряду нетривиально. Например, гипохлорит-ион является активным ингредиентом отбеливателя для стирки и дезинфицирующего средства для бассейнов, но соединения, содержащие перхлорат-ион, могут взорваться при контакте с органическими веществами.
 4 «Общие многоатомные ионы и их имена. »и Таблицу 2.5« Обычные катионы металлов, образующие более одного иона », если необходимо.
4 «Общие многоатомные ионы и их имена. »и Таблицу 2.5« Обычные катионы металлов, образующие более одного иона », если необходимо. Точно так же хлор находится в группе 7, поэтому он образует анион Cl — , который является ионом хлорида. C Поскольку мы начинаем с названия катиона, это соединение называется хлорид лития, который используется в медицине как антидепрессант.
Точно так же хлор находится в группе 7, поэтому он образует анион Cl — , который является ионом хлорида. C Поскольку мы начинаем с названия катиона, это соединение называется хлорид лития, который используется в медицине как антидепрессант.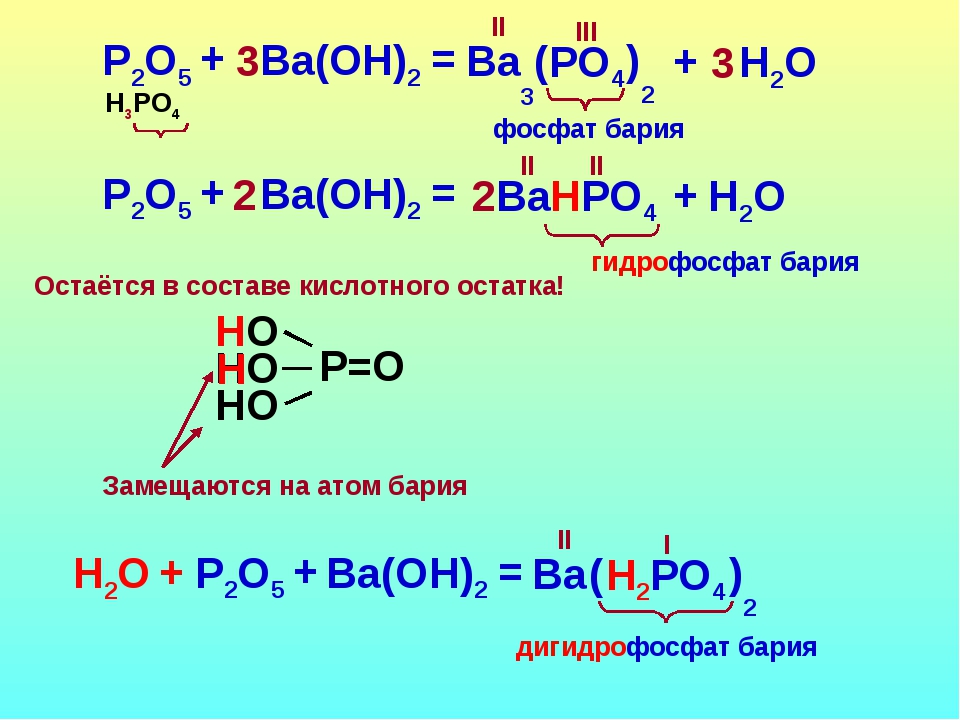
 Это соединение — распространенный зеленый пигмент, который имеет множество применений, включая маскирующие покрытия.
Это соединение — распространенный зеленый пигмент, который имеет множество применений, включая маскирующие покрытия.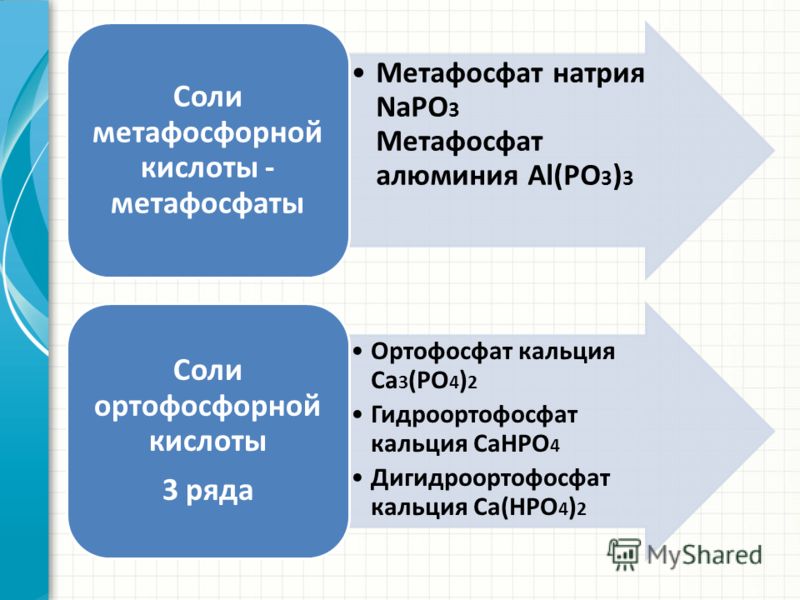







 2 ) , дигидрофосфат натрия s o lu ion (3.4) и раствор перхлората натрия (3.5), 450 + 450 + 100 (v + v + v) .
2 ) , дигидрофосфат натрия s o lu ion (3.4) и раствор перхлората натрия (3.5), 450 + 450 + 100 (v + v + v) .
 ..]
калибровки cu rv e : дигидрофосфат s o lu tion (мл)
..]
калибровки cu rv e : дигидрофосфат s o lu tion (мл) 8) и серии матрасов 20 мл (5.11), воды, содержащей 1 мл цидо-сульфрико, 1
8) и серии матрасов 20 мл (5.11), воды, содержащей 1 мл цидо-сульфрико, 1
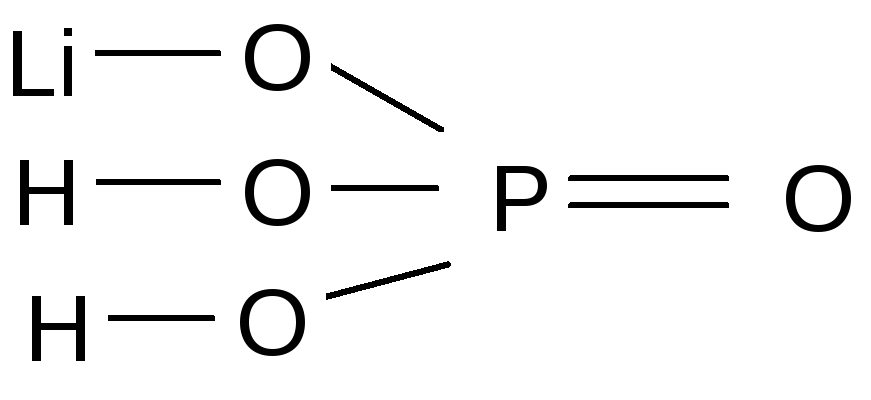 ..]
..]
 ..]
..] ..]
калия si u m дигидрофосфат K H
..]
калия si u m дигидрофосфат K H
 ..]
..] ..]
..] europa.eu
europa.eu com
com ..]
elulf at o de cal , e l fosfato a mnico , e l bic ar bonato […]
..]
elulf at o de cal , e l fosfato a mnico , e l bic ar bonato […] nmhs.net
nmhs.net eu
eu
Leave A Comment