Дигидроортофосфат кальция — это… Что такое Дигидроортофосфат кальция?
Все языкиАбхазскийАдыгейскийАзербайджанскийАймараАйнский языкАканАлбанскийАлтайскийАнглийскийАрабскийАрагонскийАрмянскийАрумынскийАстурийскийАфрикаансБагобоБаскскийБашкирскийБелорусскийБолгарскийБурятскийВаллийскийВарайскийВенгерскийВепсскийВерхнелужицкийВьетнамскийГаитянскийГреческийГрузинскийГуараниГэльскийДатскийДолганскийДревнерусский языкИвритИдишИнгушскийИндонезийскийИнупиакИрландскийИсландскийИспанскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКиргизскийКитайскийКлингонскийКомиКорейскийКриКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛюксембургскийМайяМакедонскийМалайскийМаньчжурскийМаориМарийскийМикенскийМокшанскийМонгольскийНауатльНемецкийНидерландскийНогайскийНорвежскийОрокскийОсетинскийОсманскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийРумынский, МолдавскийРусскийСанскритСеверносаамскийСербскийСефардскийСилезскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТатарскийТвиТибетскийТофаларскийТувинскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧеркесскийЧерокиЧеченскийЧешскийЧувашскийШайенскогоШведскийШорскийШумерскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЮпийскийЯкутскийЯпонский
Все языкиАбхазскийАварскийАдыгейскийАзербайджанскийАймараАйнский языкАлбанскийАлтайскийАнглийскийАрабскийАрмянскийАфрикаансБаскскийБашкирскийБелорусскийБолгарскийВенгерскийВепсскийВодскийВьетнамскийГаитянскийГалисийскийГреческийГрузинскийДатскийДревнерусский языкИвритИдишИжорскийИнгушскийИндонезийскийИрландскийИсландскийИспанскийИтальянскийЙорубаКазахскийКарачаевскийКаталанскийКвеньяКечуаКитайскийКлингонскийКорейскийКрымскотатарскийКумыкскийКурдскийКхмерскийЛатинскийЛатышскийЛингалаЛитовскийЛожбанМайяМакедонскийМалайскийМальтийскийМаориМарийскийМокшанскийМонгольскийНемецкийНидерландскийНорвежскийОсетинскийПалиПапьяментоПенджабскийПерсидскийПольскийПортугальскийПуштуРумынский, МолдавскийРусскийСербскийСловацкийСловенскийСуахилиТагальскийТаджикскийТайскийТамильскийТатарскийТурецкийТуркменскийУдмуртскийУзбекскийУйгурскийУкраинскийУрдуУрумскийФарерскийФинскийФранцузскийХиндиХорватскийЦерковнославянский (Старославянский)ЧаморроЧерокиЧеченскийЧешскийЧувашскийШведскийШорскийЭвенкийскийЭльзасскийЭрзянскийЭсперантоЭстонскийЯкутскийЯпонский
dic.academic.ru
Дигидроортофосфат кальция — Википедия
| Дигидроортофосфат кальция | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Дигидроортофосфат кальция |
| Традиционные названия | Однозамещённый ортофосфат кальция, Однозамещённый фосфорнокислый кальций |
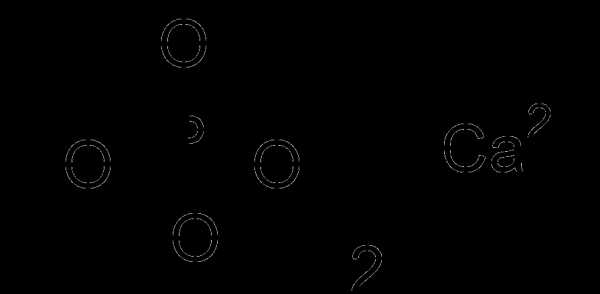
| Хим. формула | Ca(H2PO4)2 |
| Физические свойства | |
| Состояние | Бесцветные, блестящие моноклинные призмы |
| Молярная масса | 234,05 г/моль |
| Плотность | 2,55 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | |
| PubChem | 24454 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дигидроортофосфат кальция (однозамещённый фосфорнокислый кальций) — кислая соль кальция и ортофосфорной кислоты с формулой Ca(H2PO4)2. Образует кристаллогидрат.
Содержание
- 1 Получение
- 2 Физические свойства
- 3 Химические свойства
- 4 Применение
- 5 Литература
- Действием избытка ортофосфорной кислоты на оксид или карбонат кальция:
Физические свойства[править]
Безводный дигидроортофосфат кальция образует бесцветные, блестящие моноклинные призмы.
Из водных растворов выделяется кристаллогидрат Ca(H2PO4)2•H2O, бесцветные кристаллы с плотностью 2,22 г/см³.
Химические свойства[править]
- Кристаллогидрат и безводный дигидроортофосфат кальция термически неустойчивы:
- Из воздуха медленно поглощает аммиак:
- В насыщенных водных растворах разлагается:
- Реагирует с ортофосфатом кальция:
Основной компонент удобрения суперфосфат.
- Рипан Р., Четяну И.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
| Соединения кальция | |
|---|---|
Алюминаты кальция (mCaO·nAl2O3) • Алюмогидрид кальция (Ca[AlH4]2) • Амид кальция (Ca(NH2)2) • Арсенат кальция (Ca3(AsO4)2) • Ацетат кальция ((CH3COO)2 |
| Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
wp.wiki-wiki.ru
Василиса ЯВИКС — интеллектуальная поисковая система. Завтра уже здесь!
| Дигидроортофосфат кальция | |
|---|---|
| Общие | |
| Систематическое наименование | Дигидроортофосфат кальция |
| Традиционные названия | Однозамещённый ортофосфат кальция, Однозамещённый фосфорнокислый кальций |
| Хим. формула | Ca(H 2 PO 4 ) 2 |
| Физические свойства | |
| Состояние | Бесцветные, блестящие моноклинные призмы |
| Молярная масса | 234,05 г/ моль |
| Плотность | 2,55 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-23-8 |
| PubChem | 24454 |
| Рег. номер EINECS | 231-837-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E341(i) |
| ChEBI | 35433 |
| ChemSpider | 22862 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа) , если не указано иного. | |
Дигидроортофосфат кальция (однозамещённый фосфорнокислый кальций) — кислая соль кальция и ортофосфорной кислоты с формулой Ca(H 2 PO 4 ) 2 . Образует кристаллогидрат.
Получение
- ↑
Физические свойства
Безводный дигидроортофосфат кальция образует бесцветные, блестящие моноклинные призмы.
Из водных растворов выделяется кристаллогидрат Ca(H 2 PO 4 ) 2 •H 2 O, бесцветные кристаллы с плотностью 2,22 г/см³.
Химические свойства
- Кристаллогидрат и безводный дигидроортофосфат кальция термически неустойчивы:
- ⋅−−−−
- Из воздуха медленно поглощает аммиак :
- ⇄
- В насыщенных водных растворах разлагается:
- ⇄
- Реагирует с ортофосфатом кальция:
Применение
Основной компонент удобрений суперфосфат и двойной суперфосфат (первый содержит около 50% балласта — сульфата кальция , второй — почти чистый дигидроортофосфат кальция).
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М. : Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М. : Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5 .
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л. : Химия, 1971. — Т. 2. — 1168 с.
© 2014-2019 ЯВИКС — все права защищены.
yavix.ru
Дигидроортофосфат кальция — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Дигидроортофосфат кальция (однозамещённый фосфорнокислый кальций) — кислая соль кальция и ортофосфорной кислоты с формулой Ca(H2PO4)2. Образует кристаллогидрат.
Получение
- <math>\mathsf{CaO + 2\ H_3PO_4 \ \xrightarrow{\ }\ Ca(H_2PO_4)_2 + H_2O }</math>
- <math>\mathsf{CaCO_3 + 2\ H_3PO_4 \ \xrightarrow{\ }\ Ca(H_2PO_4)_2 + CO_2\uparrow + H_2O }</math>
Физические свойства
Безводный дигидроортофосфат кальция образует бесцветные, блестящие моноклинные призмы.
Из водных растворов выделяется кристаллогидрат Ca(H2PO4)2•H2O, бесцветные кристаллы с плотностью 2,22 г/см³.
Химические свойства
- Кристаллогидрат и безводный дигидроортофосфат кальция термически неустойчивы:
- <math>\mathsf{Ca(H_2PO_4)_2\cdot H_2O \ \xrightarrow[-H_2O]{100-110^oC}\ Ca(H_2PO_4)_2 \ \xrightarrow[-H_2O]{150-200^oC}\ Ca_2P_2O_7 + H_3PO_4 }</math>
- Из воздуха медленно поглощает аммиак:
- <math>\mathsf{ Ca(H_2PO_4)_2 + NH_3 \ \rightleftarrows\ (NH_4)_2Ca(HPO_4)_2 }</math>
- В насыщенных водных растворах разлагается:
- <math>\mathsf{ Ca(H_2PO_4)_2 \rightleftarrows\ CaHPO_4 + H_3PO_4 }</math>
- Реагирует с ортофосфатом кальция:
- <math>\mathsf{ Ca(H_2PO_4)_2 + Ca_3(PO_4)_2 \xrightarrow{\ }\ 4\ CaHPO_4 }</math>
Применение
Основной компонент удобрения суперфосфат.
Напишите отзыв о статье «Дигидроортофосфат кальция»
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Отрывок, характеризующий Дигидроортофосфат кальция
– Ах, я так счастлива, – отвечала она, улыбнулась сквозь слезы, нагнулась ближе к нему, подумала секунду, как будто спрашивая себя, можно ли это, и поцеловала его.Князь Андрей держал ее руки, смотрел ей в глаза, и не находил в своей душе прежней любви к ней. В душе его вдруг повернулось что то: не было прежней поэтической и таинственной прелести желания, а была жалость к ее женской и детской слабости, был страх перед ее преданностью и доверчивостью, тяжелое и вместе радостное сознание долга, навеки связавшего его с нею. Настоящее чувство, хотя и не было так светло и поэтично как прежнее, было серьезнее и сильнее.
– Сказала ли вам maman, что это не может быть раньше года? – сказал князь Андрей, продолжая глядеть в ее глаза. «Неужели это я, та девочка ребенок (все так говорили обо мне) думала Наташа, неужели я теперь с этой минуты жена , равная этого чужого, милого, умного человека, уважаемого даже отцом моим. Неужели это правда! неужели правда, что теперь уже нельзя шутить жизнию, теперь уж я большая, теперь уж лежит на мне ответственность за всякое мое дело и слово? Да, что он спросил у меня?»
– Нет, – отвечала она, но она не понимала того, что он спрашивал.
– Простите меня, – сказал князь Андрей, – но вы так молоды, а я уже так много испытал жизни. Мне страшно за вас. Вы не знаете себя.
Наташа с сосредоточенным вниманием слушала, стараясь понять смысл его слов и не понимала.
– Как ни тяжел мне будет этот год, отсрочивающий мое счастье, – продолжал князь Андрей, – в этот срок вы поверите себя. Я прошу вас через год сделать мое счастье; но вы свободны: помолвка наша останется тайной и, ежели вы убедились бы, что вы не любите меня, или полюбили бы… – сказал князь Андрей с неестественной улыбкой.
– Зачем вы это говорите? – перебила его Наташа. – Вы знаете, что с того самого дня, как вы в первый раз приехали в Отрадное, я полюбила вас, – сказала она, твердо уверенная, что она говорила правду.
– В год вы узнаете себя…
– Целый год! – вдруг сказала Наташа, теперь только поняв то, что свадьба отсрочена на год. – Да отчего ж год? Отчего ж год?… – Князь Андрей стал ей объяснять причины этой отсрочки. Наташа не слушала его.
– И нельзя иначе? – спросила она. Князь Андрей ничего не ответил, но в лице его выразилась невозможность изменить это решение.
– Это ужасно! Нет, это ужасно, ужасно! – вдруг заговорила Наташа и опять зарыдала. – Я умру, дожидаясь года: это нельзя, это ужасно. – Она взглянула в лицо своего жениха и увидала на нем выражение сострадания и недоумения.
– Нет, нет, я всё сделаю, – сказала она, вдруг остановив слезы, – я так счастлива! – Отец и мать вошли в комнату и благословили жениха и невесту.
С этого дня князь Андрей женихом стал ездить к Ростовым.
Обручения не было и никому не было объявлено о помолвке Болконского с Наташей; на этом настоял князь Андрей. Он говорил, что так как он причиной отсрочки, то он и должен нести всю тяжесть ее. Он говорил, что он навеки связал себя своим словом, но что он не хочет связывать Наташу и предоставляет ей полную свободу. Ежели она через полгода почувствует, что она не любит его, она будет в своем праве, ежели откажет ему. Само собою разумеется, что ни родители, ни Наташа не хотели слышать об этом; но князь Андрей настаивал на своем. Князь Андрей бывал каждый день у Ростовых, но не как жених обращался с Наташей: он говорил ей вы и целовал только ее руку. Между князем Андреем и Наташей после дня предложения установились совсем другие чем прежде, близкие, простые отношения. Они как будто до сих пор не знали друг друга. И он и она любили вспоминать о том, как они смотрели друг на друга, когда были еще ничем , теперь оба они чувствовали себя совсем другими существами: тогда притворными, теперь простыми и искренними. Сначала в семействе чувствовалась неловкость в обращении с князем Андреем; он казался человеком из чуждого мира, и Наташа долго приучала домашних к князю Андрею и с гордостью уверяла всех, что он только кажется таким особенным, а что он такой же, как и все, и что она его не боится и что никто не должен бояться его. После нескольких дней, в семействе к нему привыкли и не стесняясь вели при нем прежний образ жизни, в котором он принимал участие. Он про хозяйство умел говорить с графом и про наряды с графиней и Наташей, и про альбомы и канву с Соней. Иногда домашние Ростовы между собою и при князе Андрее удивлялись тому, как всё это случилось и как очевидны были предзнаменования этого: и приезд князя Андрея в Отрадное, и их приезд в Петербург, и сходство между Наташей и князем Андреем, которое заметила няня в первый приезд князя Андрея, и столкновение в 1805 м году между Андреем и Николаем, и еще много других предзнаменований того, что случилось, было замечено домашними.
wiki-org.ru
Дигидроортофосфат кальция Википедия
| Дигидроортофосфат кальция | |
|---|---|
| Общие | |
| Систематическое наименование | Дигидроортофосфат кальция |
| Традиционные названия | Однозамещённый ортофосфат кальция, Однозамещённый фосфорнокислый кальций |
| Хим. формула | Ca(H2PO4)2 |
| Физические свойства | |
| Состояние | Бесцветные, блестящие моноклинные призмы |
| Молярная масса | 234,05 г/моль |
| Плотность | 2,55 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-23-8 |
| PubChem | 24454 |
| Рег. номер EINECS | 231-837-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E341(i) |
| ChEBI | 35433 |
| ChemSpider | 22862 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дигидроортофосфат кальция (однозамещённый фосфорнокислый кальций) — кислая соль кальция и ортофосфорной кислоты с формулой Ca(H2PO4)2. Образует кристаллогидрат.
Получение
- CaO+2 h4PO4 → Ca(h3PO4)2+h3O{\displaystyle {\mathsf {CaO+2\ H_{3}PO_{4}\ {\xrightarrow {\ }}\ Ca(H_{2}PO_{4})_{2}+H_{2}O}}}
- CaCO3+2 h4PO4 → Ca(h3PO4)2+CO2↑+h3O{\displaystyle {\mathsf {CaCO_{3}+2\ H_{3}PO_{4}\ {\xrightarrow {\ }}\ Ca(H_{2}PO_{4})_{2}+CO_{2}\uparrow +H_{2}O}}}
Физические свойства
Безводный дигидроортофосфат кальция образует бесцветные, блестящие моноклинные призмы.
Из водных растворов выделяется кристаллогидрат Ca(H2PO4)2•H2O, бесцветные кристаллы с плотностью 2,22 г/см³.
Химические свойства
- Кристаллогидрат и безводный дигидроортофосфат кальция термически неустойчивы:
- Ca(h3PO4)2⋅h3O →−h3O100−110oC Ca(h3PO4)2 →−h3O150−200oC Ca2P2O7+h4PO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}\cdot H_{2}O\ {\xrightarrow[{-H_{2}O}]{100-110^{o}C}}\ Ca(H_{2}PO_{4})_{2}\ {\xrightarrow[{-H_{2}O}]{150-200^{o}C}}\ Ca_{2}P_{2}O_{7}+H_{3}PO_{4}}}}
- Из воздуха медленно поглощает аммиак:
- Ca(h3PO4)2+Nh4 ⇄ (Nh5)2Ca(HPO4)2{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}+NH_{3}\ \rightleftarrows \ (NH_{4})_{2}Ca(HPO_{4})_{2}}}}
- В насыщенных водных растворах разлагается:
- Ca(h3PO4)2⇄ CaHPO4+h4PO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}\rightleftarrows \ CaHPO_{4}+H_{3}PO_{4}}}}
- Реагирует с ортофосфатом кальция:
- Ca(h3PO4)2+Ca3(PO4)2→ 4 CaHPO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}+Ca_{3}(PO_{4})_{2}{\xrightarrow {\ }}\ 4\ CaHPO_{4}}}}
Применение
Основной компонент удобрений суперфосфат и двойной суперфосфат (первый содержит около 50% балласта — сульфата кальция, второй — почти чистый дигидроортофосфат кальция).
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
wikiredia.ru
| Дигидроортофосфат кальция | |
|---|---|
| Общие | |
| Систематическое наименование | Дигидроортофосфат кальция |
| Традиционные названия | Однозамещённый ортофосфат кальция, Однозамещённый фосфорнокислый кальций |
| Хим. формула | Ca(H2PO4)2 |
| Физические свойства | |
| Состояние | Бесцветные, блестящие моноклинные призмы |
| Молярная масса | 234,05 г/моль |
| Плотность | 2,55 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-23-8 |
| PubChem | 24454 |
| Рег. номер EINECS | 231-837-1 |
| SMILES | OP(=O)(O)[O-].OP(=O)(O)[O-].[Ca+2] |
| InChI | 1S/Ca.2h4O4P/c;2*1-5(2,3)4/h;2*(h4,1,2,3,4)/q+2;;/p-2YYRMJZQKEFZXMX-UHFFFAOYSA-L |
| екс Алиментариус | E341(i) |
| ChEBI | 35433 |
| ChemSpider | 22862 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
ru-wiki.ru
Дигидроортофосфат кальция — Википедия. Что такое Дигидроортофосфат кальция
Материал из Википедии — свободной энциклопедии| Дигидроортофосфат кальция | |
|---|---|
| Общие | |
| Систематическое наименование | Дигидроортофосфат кальция |
| Традиционные названия | Однозамещённый ортофосфат кальция, Однозамещённый фосфорнокислый кальций |
| Хим. формула | Ca(H2PO4)2 |
| Физические свойства | |
| Состояние | Бесцветные, блестящие моноклинные призмы |
| Молярная масса | 234,05 г/моль |
| Плотность | 2,55 г/см³ |
| Химические свойства | |
| Растворимость в воде | 1,5 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7758-23-8 |
| PubChem | 24454 |
| Рег. номер EINECS | 231-837-1 |
| SMILES | |
| InChI | |
| ChEBI | 35433 |
| ChemSpider | 22862 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Дигидроортофосфат кальция (однозамещённый фосфорнокислый кальций) — кислая соль кальция и ортофосфорной кислоты с формулой Ca(H2PO4)2. Образует кристаллогидрат.
Получение
- CaO+2 h4PO4 → Ca(h3PO4)2+h3O{\displaystyle {\mathsf {CaO+2\ H_{3}PO_{4}\ {\xrightarrow {\ }}\ Ca(H_{2}PO_{4})_{2}+H_{2}O}}}
- CaCO3+2 h4PO4 → Ca(h3PO4)2+CO2↑+h3O{\displaystyle {\mathsf {CaCO_{3}+2\ H_{3}PO_{4}\ {\xrightarrow {\ }}\ Ca(H_{2}PO_{4})_{2}+CO_{2}\uparrow +H_{2}O}}}
Физические свойства
Безводный дигидроортофосфат кальция образует бесцветные, блестящие моноклинные призмы.
Из водных растворов выделяется кристаллогидрат Ca(H2PO4)2•H2O, бесцветные кристаллы с плотностью 2,22 г/см³.
Химические свойства
- Кристаллогидрат и безводный дигидроортофосфат кальция термически неустойчивы:
- Ca(h3PO4)2⋅h3O →−h3O100−110oC Ca(h3PO4)2 →−h3O150−200oC Ca2P2O7+h4PO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}\cdot H_{2}O\ {\xrightarrow[{-H_{2}O}]{100-110^{o}C}}\ Ca(H_{2}PO_{4})_{2}\ {\xrightarrow[{-H_{2}O}]{150-200^{o}C}}\ Ca_{2}P_{2}O_{7}+H_{3}PO_{4}}}}
- Из воздуха медленно поглощает аммиак:
- Ca(h3PO4)2+Nh4 ⇄ (Nh5)2Ca(HPO4)2{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}+NH_{3}\ \rightleftarrows \ (NH_{4})_{2}Ca(HPO_{4})_{2}}}}
- В насыщенных водных растворах разлагается:
- Ca(h3PO4)2⇄ CaHPO4+h4PO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}\rightleftarrows \ CaHPO_{4}+H_{3}PO_{4}}}}
- Реагирует с ортофосфатом кальция:
- Ca(h3PO4)2+Ca3(PO4)2→ 4 CaHPO4{\displaystyle {\mathsf {Ca(H_{2}PO_{4})_{2}+Ca_{3}(PO_{4})_{2}{\xrightarrow {\ }}\ 4\ CaHPO_{4}}}}
Применение
Основной компонент удобрения суперфосфат.
Литература
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
wiki.sc

Leave A Comment