Азот
Цели:
- Воспитательные:
- воспитывать аккуратность в ведении записей в тетрадях;
- приучать к поддержанию чистоты и аккуратности рабочего места;
- воспитывать умение общения в коллективе.
- Образовательные:
- сформировать представление об азоте как простом веществе.
- изучить строение атома и молекулы азота.
- изучить свойства азота и способы его получения.
- рассмотреть круговорот азота в природе.
- Развития:
- уметь составлять строение атома и молекулы азота.
- уметь описывать физические свойства азота.
- уметь составлять уравнения химических реакций, отражающих химические свойства азота и способы его получение.
Оборудование и реактивы:проектор,
компьютер, Презентация,
рабочая тетрадь (Приложение 1),
дихромат аммония, серная кислота, стеклянная
палочка, асбестовая сетка, спиртовка.
Методы: словесно-наглядный.
Методика:традиционный урок, изучение нового.
ХОД УРОКА
– Здравствуйте, ребята!
У вас на столах находятся листы, которые сегодня
будут служить рабочей тетрадью. В них
представлены задания разного плана и характера.
И в течение урока вы будете вписывать туда
ответы.
(Презентация
– А нам, друзья, не должно быть всё равно. Ведь
мы живём в таком мире, в котором много тайн,
загадок, неизведанных фактов.
Сегодня мы переходим к изучению следующей
подгруппы элементов – это подгруппа азота. И
познакомимся с одним из удивительных веществ, с
таким знакомым и таким неизведанным, как азот.
Тема урока у вас уже представлена в рабочей
тетради (Приложение 1).
(Слайд 2)
Характеризовать азот будем по следующему плану:
- История открытия азота.

- Строение атома и молекулы азота.
- Свойства азота.
- Получения и применение азота.
- Круговорот азота в природе.
(Слайды 3,4)
I. История открытия азота
Откройте 2 лист.
Вам необходимо будет в течение моего рассказа
кратко вписать в пустые строки открытия учёных.
В 1756 г. англичанин Даниэль Резерфорд
установил, что воздух, оставшийся под колоколом,
где жила несколько дней мышь, освобожденный от
углекислого газа, не поддерживает горение и
дыхания. Этот газ он назвал «ядовитым воздухом».
В 1773 г.
В 1776 г. известный французский учёный Антуан Лавуазье, подробно исследуя «ядовитый» и «испорченный» воздухи, установил, что это одно и то же вещество, и предложил назвать его азотом.

(Слайд 5)
Азот в переводе с греческого означает
безжизненный (от лат. а – нет и зоэ –
жизнь).
Так ли это?
Узнаем, изучив более подробно азот и его
свойства.
Азот находится во 2 периоде, V группе, главной подгруппе.
(Слайд 6)
II. Строение атома и молекулы азота
1. Строение атома азота
Азот находится в V группе в главной подгруппе во
2 периоде.
? Сколько энергетических уровней в
атоме азота?
Пользуясь этой информацией изобразите строение
атома азота, вписав нужное количество протонов,
нейтронов и электронов.
Сверим ваши решения.
Далее нам необходимо заполнить таблицу.
Зарисуем строение внешнего электронного слоя.
? Сколько электронов на внешнем
энергетическом уровне?
? Каково максимальное количество
электронов на внешнем энергетическом уровне?
? Сколько электронов может
присоединить атом азота?
Вследствие этого он приобретёт степень
окисления – 3.
Атомы азота могут также отдавать свои внешние
электроны более электроотрицательным элементам.
? Каким, например?
Атомы азота приобретают при этом степень
окисления +3 и +5.
Летучее водородное соединение NH3 – аммиак.
Высший оксид – N3O5 – оксид азота (V).
Кислота – HNO3 – азотная кислота.
Рассмотрим свойства атома азота.
Впишите соответствующее количество электронов в схемы.
В первом случае азот – восстановитель, во втором – окислитель.
2. Строение молекулы азота
В свободном состоянии азот существует в виде
двухатомных молекул N2.
У атома азота на внешнем слое 5 электронов: 2
спаренных и 3 неспаренных.

В этих молекулах два атома азота связаны очень прочной тройной связью.
Даже при t ≈ 3300oC только одна из тысячи молекул азота распадается на атомы.
Молекула азота устойчива, инертна.
(Слайд 7)
Выполним задание 1.
(Слайд 8)
III. Свойства азота
Перевернули на 3 лист.
1. Физические свойства
Охарактеризуем физические свойства азота,
выполнив задание 2.
Вам необходимо прочитать §24, с. 143 второй абзац и
вписать ответы.
Азот – бесцветный газ без запаха и вкуса.
В воде растворяется хуже кислорода.
Азот в твёрдом состоянии имеет молекулярную
кристаллическую решётку, поэтому у него низкие
температуры плавления и кипения.
ρ = 0,81 г/см3 (N2 – жидкий)
tпл. = – 210oС
tкип. = – 195,8oС
(Слайд 9)
На этом слайде вы видите жидкий азот.
В молекуле азота атомы соединены прочной тройной связью.
? Как вы думаете, будет ли азот активен в химических реакциях?
Прочностью молекулы азота обусловлена его химическая инертность.
2. Химические свойства
И мы с вами перемещаемся в лабораторию химика. Это задание 3.
(Слайд 10)
При обычных условиях азот взаимодействует только с литием.
При этом образуется нитрид лития Li3N.
При нагревании азот образует нитриды с рядом
других металлов, например:
Азот в соединениях с металлами проявляет степень окисления = –3.
Попытайтесь составить уравнение химической
реакции взаимодействия азота с алюминием.
Проверим.
Уравнение химической реакции взаимодействие азота с кальцием допишите дома.
При высоких температурах, давлении и в
присутствии катализатора азот реагирует с
водородом, образуя летучее водородное
соединение – аммиак.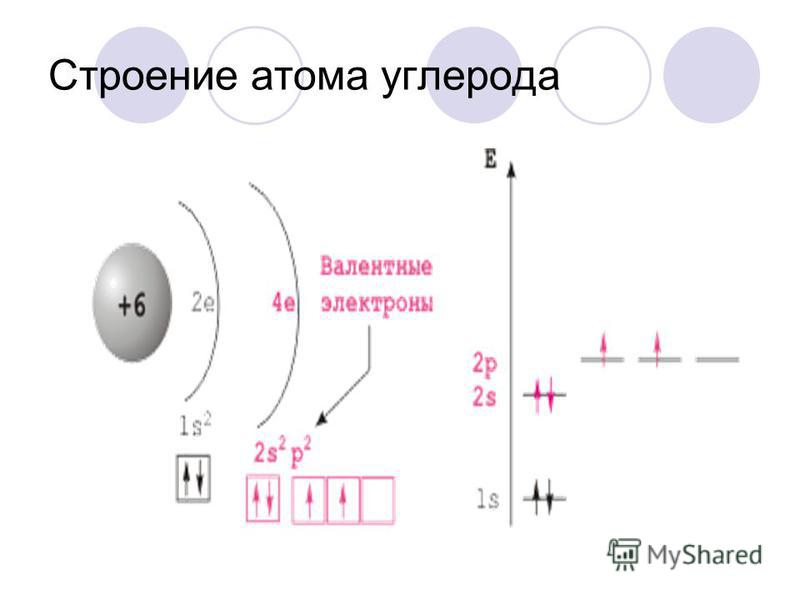
Закончите это уравнение реакции.
Что записали?
При температуре электрической дуги азот
реагирует с кислородом в результате образуется
оксид азота (II).
Что получилось в итоге?
(Слайд 11)
В природе подобный процесс наблюдается при
грозах.
Вы видите при каких трудных условиях протекают
эти реакции, а это связано с особенностями
строения молекулы азота, с наличием тройной
связи.
(Слайд 12)
Рассмотрим 2 последние реакции. Задание 4.
Реакция взаимодействия азота с кислородом.
Охарактеризуем её, выбрав соответствующую
характеристику из рамки посередине.
Во-первых, это реакция соединения, некаталитическая,
протекает с поглощением теплоты, то есть
? Охарактеризуйте реакцию
взаимодействия азота с водородом по тем же
критериям.
Проверим.
Мы рассмотрели строение и свойства азота.
А как его получают – рассмотрим.
Перевернули лист на следующую страницу.
IV. Получение и применение азота
1. Получение азота
(Слайд 13)
В промышленности азот получают перегонкой
жидкого воздуха.
В промышленности азот получают из воздуха,
используя различия в температурах кипения азота
и кислорода.
В лаборатории азот получают разложением
неустойчивых соединений азота.
Также его можно получить разложением дихромата
аммония.
(Демонстрация опыта).
А для чего он необходим, какова его роль.
2. Применение азота
(Слайд 14)
Глядя на рисунок в ваших листах, выполните
задание 5, составив связный рассказ о применении
азота.
Азот широко применяют в химической
промышленности для получения аммиака, мочевины и
других химикатов.
В электротехнике он используется как инертная
среда для заполнения электрических лампочек.
Жидкий азот применяют в охладительных системах.
(Слайд 15)
Но какова биологическая роль азота?
Нужен ли он человеку?
V. Круговорот азота в природе
Атмосфера на 78% состоит из азота, на 21% – из
кислорода. Оставшийся 1% занимают другие газы.
Атмосферный воздух является неисчерпаемым
резервуаром. Однако основная часть живых
организмов не может непосредственно
использовать этот азот. Он должен быть
предварительно связан в виде химических
соединений.
Для усвоения азота растениями необходимо, чтобы
он входил в состав ионов аммония NH4+
или нитрата NO3–.
Такие растения, как мышиный горошек, люпин,
люцерна, клевер способны усваивать атмосферный
азот.
Некоторое количество азота переводится в
связанное состояние во время грозы. Вы удивитесь,
но вспышки молний происходят гораздо чаще, чем вы
думаете, – порядка ста молний каждую секунду. Пока я проговорила это предложение, во всем мире
сверкнуло примерно 500 молний.
Пока я проговорила это предложение, во всем мире
сверкнуло примерно 500 молний.
Образовавшийся оксид азота выпадает с дождями на
поверхность почвы.
Кроме того, различные химические предприятия
собирают азот из воздуха.
В почве происходят процессы, в результате
которых образуются нитраты NO3–,
которые легко усваиваются корнями растений.
Давайте ответим на вопрос, поставленный в начале
урока.
Такой ли безжизненный азот?
Азот – безжизненный газ.
И что он значит для нас?
Какой для него закон?
Рассмотрим с разных сторон:
Азот – неживой, без сомненья
Не знает дыханья, горенья…
А, если, с другой стороны –
Иные аспекты видны:
Он входит в состав белков –
Для вечной жизни готов
И к нужной, полезной работе –
Участвует в круговороте…
Немного о нём мы знаем,
Но тайну приоткрываем.
И новые знания ждут,
Всех тех, кто дальше пойдут!
Открытий великих ряд
И вам любопытный взгляд,
И опытов тесный круг
Для царства одной из наук!
А химия как чаровница,
Как чудо, которое длится.
– Итак, подведём итоги урока. (Выставляю отметки).
Домашнее задание: §24 «Азот». Составить рассказ на тему: «Путешествие азота в природе».
Задание: Для перевозки овощей и фруктов на дальние расстояния используют рефрижераторы, в которых в качестве хладоагента используют жидкий азот. На каких свойствах это основано?
рисунок, несколько соединений и подробные пояснения —
Точечная структура Льюиса дает информацию об электронах внешней оболочки атома. В этой статье обсуждается точечная структура азота Льюиса, связанная с соединением с различными элементами.
Структура точки Льюиса записывается атомным символом атома и электронами самой внешней оболочки, присутствующими вокруг символа. Электроны, записанные точками, могут быть связывающими или несвязывающие электроны. Чтобы нарисовать точечную структуру азота Льюиса, мы должны подсчитать количество электронов внешней оболочки азота, то есть пять, записанных точками вокруг буквы «N».
Электроны, записанные точками, могут быть связывающими или несвязывающие электроны. Чтобы нарисовать точечную структуру азота Льюиса, мы должны подсчитать количество электронов внешней оболочки азота, то есть пять, записанных точками вокруг буквы «N».
Итак, азоту нужно три электрона, чтобы заполнить структуру октета. Это делает атом более стабильным.
Структура точки Льюиса газообразного азотаТочечная структура Льюиса Газообразный азот представляет собой расположение самых внешних электронов оболочки. Эти электроны участвуют в образовании связи между двумя атомами азота.
Чтобы нарисовать структуру точек Льюиса газообразного азота, мы должны посчитать электроны самой внешней оболочки азота, которых пять с электронной конфигурацией: [He] 2s2 2p3.
В соответствии с Правило октета каждый из атомов азота должен иметь 8 электронов на внешней оболочке. Это дает атомам азота стабильную конфигурацию. Они должны делиться электронами друг с другом и образовывать связь. Облигация представлена в виде одной линии.
Они должны делиться электронами друг с другом и образовывать связь. Облигация представлена в виде одной линии.
Два атома азота имеют шесть общих электронов (три пары электронов) и образуют тройную связь. Эти связи записываются в виде прямой линии. Четыре валентных электрона остаются после связывания в молекуле. Следовательно, каждый атом азота содержит несвязывающую пару, представленную точками.
Структура точки Льюиса с ионами азотаАзот является элементом «группы 15» в периодической таблице. Нейтральный атом азота имеет пять валентных электронов. Принимая три электрона, он становится нитрид-ионом.
Азот имеет пять валентных электронов в электронных оболочках 2s и 2p. У него на три электрона меньше по отношению к ближайшему Благородный газ. Таким образом, он принимает три электрона и образует нитрид-ион. Стать стабильным.
Чтобы представить структуру электронной точки, напишите символ атома азота. Все самые внешние электроны оболочки написаны вокруг символа атома. Все это показано внутри третьей скобки. Отрицательный заряд нитрид-иона должен быть записан справа за скобками.
Все это показано внутри третьей скобки. Отрицательный заряд нитрид-иона должен быть записан справа за скобками.
Азот является элементом «группы 15» (электронная конфигурация: 1s2 2s2 2p3), а кислород является элементом «группы 16» (электронная конфигурация: 1s2 2s2 2p4) в Периодической таблице.
Чтобы нарисовать структуру электронных точек, мы считаем электроны самой внешней оболочки молекулы. Электронная конфигурация валентной оболочки азота: [He] 2s2 2p3. Электронная конфигурация валентной оболочки кислорода: [He] 2s2 2p4.
Центральным атомом здесь является менее электроотрицательный азот. Чтобы получить стабильную структуру октета, он делит электроны с атомом кислорода. Для этого образуются одна двойная связь и одна одинарная связь. Но положение двойной связи меняется со временем. Это означает, что связывающие электроны делокализуются со временем для резонанса.
Точечная структура Льюиса NO2 очень значителен.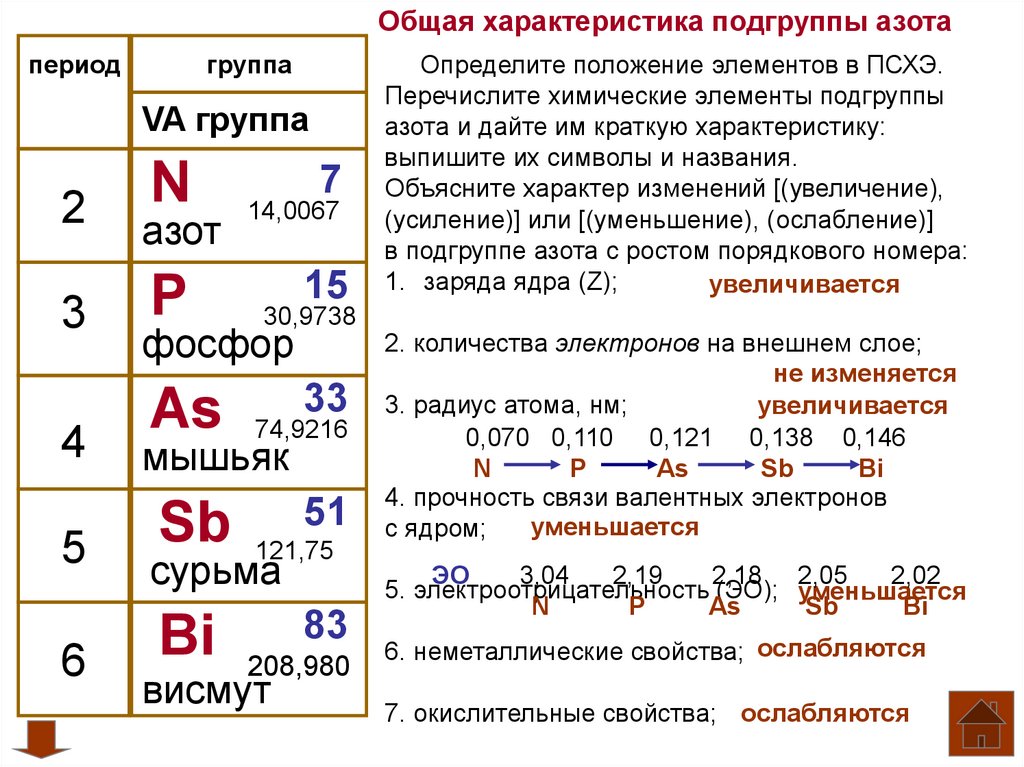 Это показывает, что азот имеет один единственный неспаренный электрон.
Это показывает, что азот имеет один единственный неспаренный электрон.
Монооксид азота является одним из элементов кислотных дождей. Это очень реактивная молекула. Это можно объяснить его структура точки Льюиса.
Общее количество электронов валентной оболочки монооксида азота равно одиннадцати. Азот имеет пять валентных электронов в электронных оболочках 2s и 2p, тогда как кислород имеет шесть электронов.
Азот и кислород имеют четыре общих валентных электрона, которые образуют двойная связь. Две пары несвязывающих электронов располагаются над кислородом. Азот имеет неподеленную пару и один неспаренный электрон.
Структура точки Льюиса трихлорида азотаХлор является элементом «группы 17» с электронной конфигурацией валентной оболочки: [Ne] 3s2 3p5.
В электронной точечной структуре треххлористого азота участвуют всего 26 валентных электронов. Среди этих шести электронов спарены для образования связи, что показано прямой линией.
Центральный атом азота имеет два несвязывающих электрона. Каждый атом хлора содержит три неподеленные пары. Эти несвязывающие электроны представлены точками.
Структура точек Льюиса с кальцием и азотомКальций является элементом «группы 2» в периодической таблице с 20 электронами на орбите. Его электронная конфигурация валентной оболочки: [Ar] 4s2.
Чтобы получить стабильную электронную структуру, такую как ближайший благородный газ, он переносит электроны внешней оболочки и образует положительный ион. Потребности атома азота три электрона, чтобы получить структуру октета.
Таким образом, три иона кальция соединяются с двумя ионами нитрида и образуют молекулу Ca3N2.
Структура точек Льюиса натрия и азотаНатрий является элементом «группы 1» в периодической таблице с электронной конфигурацией: 1s2 2s2 2p6 3s1. Таким образом, он имеет один валентный электрон оболочки.
Натрий пытается пожертвовать этот электрон оболочки 3s, чтобы получить стабильную структуру октета. Этот электрон переходит на орбиталь азота. Таким образом, три атома натрия координируются с одним атомом азота. Это приводит к Образование молекулы Na3N.
Этот электрон переходит на орбиталь азота. Таким образом, три атома натрия координируются с одним атомом азота. Это приводит к Образование молекулы Na3N.
Шесть электронов пары связи представлены прямыми линиями, а центральный атом азота содержит одну несвязывающую пару электронов, которая написана точками.
Структура точек Льюиса бария и азотаБарий является элементом «группы 2» с электронной конфигурацией валентной оболочки: [Xe] 6s2.
Чтобы получить стабильную электронную структуру, как у ближайшего благородного газа, барий превращает два валентных электрона в положительный ион. Эти электроны принимаются атомом азота и образуют нитрид-ион.
Одному атому азота нужно три электрона, чтобы заполнить структуру октета. Следовательно, три атома бария соединяются с двумя атомами азота.
Структура точек Льюиса из алюминия и азотаАлюминий является элементом «группы 13» с электронной конфигурацией самой внешней оболочки: [Ne] 3s2 3p1.
Согласно правилу октета, алюминий всегда пытается передать эти три валентных электрона. Эти электроны принимаются атомом азота. Таким образом, они оба способны образовывать стабильную электронную оболочку.
Связывающие электронные пары между алюминием и азотом представлены прямыми линиями. У алюминия нет неподеленной пары, тогда как у азота есть одна несвязывающая электронная пара.
Структура точек Льюиса с калием и азотомКалий является элементом «группы 1» в периодической таблице. Он имеет один самый внешний электрон оболочки в электронной оболочке 4s.
Калий жертвует этот валентный электрон, чтобы удовлетворить правилу октета и стать положительным ионом. Электрон принимается атомом азота и образует нитрид-ион.
Поскольку азоту нужно три электрона, чтобы заполнить его электронную оболочку, он в сочетании с тремя ионами калия дает K3N.
Три связи между калием и азотом представлены прямыми линиями.
Литий является элементом «группы 1» в периодической таблице с электронной конфигурацией: 1s2 2s1.
Чтобы удовлетворить правилу октета электронной конфигурации, литий передает валентный электрон, который принимается атомом азота.
Таким образом, три иона лития координируются с одним нитрид-ионом. Это приводит к образованию Li3N.
Структура точек Льюиса из бериллия и азотаБериллий — элемент «группы 2» с электронной конфигурацией: 1s2 2s2.
Согласно правилу октета каждый атом имеет электронную конфигурацию, подобную ближайшему благородному газу. Для достижения этой стабильности бериллий отдает два валентных электрона, которые забираются атомом азота с образованием иона нитрида.
Атом азота нуждается в трех электронах, чтобы заполнить структуру октета, поэтому два иона нитрида объединяются с тремя ионами бериллия и образуют молекулу Be3N2.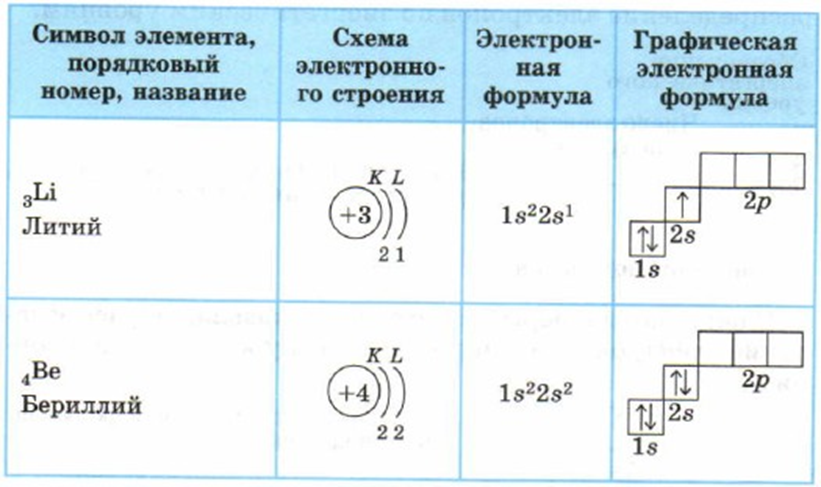
Магний является элементом «группы 2» с электронной конфигурацией самой внешней оболочки: [Ne] 3s2.
Чтобы нарисовать структуру электронных точек нитрида магния, мы подсчитываем общее количество электронов внешней оболочки. Магний имеет тенденцию отдавать два 3s-электрона. Эти электроны поглощаются атомом азота и образуют отрицательный ион.
Магний создает положительный ион с зарядом 2. Следовательно, шесть электронов могут быть переданы тремя атомами магния, которые принимаются двумя атомами азота, и образуется молекула Mg3N2.
Структура точек Льюиса стронция и азотаСтронций является элементом «группы 2» в периодической таблице. Электронная конфигурация его самой внешней оболочки — [Kr] 5s2.
В соответствии с правилом октетов каждый атом хочет, чтобы структура стабильных октетов заполнялась. Чтобы удовлетворить это, стронций отдает ему два самых внешних электрона оболочки, которые берет атом азота.
Поскольку атом азота имеет на три электрона меньше, чтобы получить стабильную электронную структуру. Два иона нитрида координируются с тремя ионами стронция и образуют молекулу Sr3N2.
Структура точек Льюиса бора и азотаБор относится к элементам 13-й группы. Электронная конфигурация его самой внешней оболочки: [He] 2s2 2p1.
Электроны валентной оболочки бора координируются с электронами валентной оболочки азота. Это приводит к образованию тройной связи, в которой участвует шесть электронов.
Азот содержит одну пару несвязывающих электронов (неподеленную пару), а в боре такой пары электронов нет.
Структура точек Льюиса азота и водородаВодород содержит только один электрон в своей электронной оболочке 1s. Азот имеет пять электронов на внешней оболочке, которые находятся в оболочках 2s и 2p.
Для получения стабильности, как у ближайшего благородного газа, азот разделяет три электрона с тремя атомами водорода. Следовательно, между азотом и тремя атомами водорода образуются три ковалентные связи.
Следовательно, между азотом и тремя атомами водорода образуются три ковалентные связи.
Два электрона валентной оболочки атома азота остаются в виде несвязывающей электронной пары, концентрирующейся над атомом азота..
структура точки Льюиса аммонийСтруктура точки Льюиса три-йодида азотаЙод является элементом «группы 17» с электронной конфигурацией валентной оболочки: [Kr] 4d10 5s2 5p5.
В этой молекуле три атома йода делят валентные электроны с одним атомом азота. Всего в координации участвует 26 электронов.
Здесь шесть электронов образуют три связи. Каждый атом йода содержит несвязывающие пары электронов, а атом азота также имеет два неспаренных электрона.
Структура точки Льюиса трифторида азотаФтор — это элемент 17-й группы с электронной конфигурацией: 1s2 2s2 2p5. Азот имеет пять электронов на внешней оболочке.
В молекуле трехфтористого азота азот является центральным атомом, поскольку он менее электроотрицателен, чем фтор. Три атома фтора координируются с одним атомом азота, всего в молекуле участвует 26 валентных электронов.
Три атома фтора координируются с одним атомом азота, всего в молекуле участвует 26 валентных электронов.
Среди электронов валентной оболочки шесть электронов образуют три ковалентные связи. Каждый атом фтора имеет три пары электронов, которые не образуют связи. Таким образом, три атома фтора имеют восемнадцать несвязывающих электронов, а атом азота также имеет одну неподеленную электронную пару.
Связи между двумя атомами изображаются прямыми линиями, а несвязывающие пары электронов записываются точками.
Подробнее о-Структура Льюиса Ch3CL2 Почему, как, когда и подробные факты
Chem4Kids.com: Азот: информация об орбитальном и связующем
Посмотрите на доску. В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он сообщает вам массу одного атома, сколько частей внутри и где он должен быть помещен в периодической таблице.
В следующем разделе мы рассмотрим электронные орбитали или электронные оболочки. Это может быть новой темой для некоторых из вас.
Это может быть новой темой для некоторых из вас.
Взгляните на картинку ниже. Каждый из этих цветных шаров является электроном. В атоме электроны вращаются вокруг центра, также называемого ядром. Электроны любят быть отдельными снаряды/орбитали . Оболочка номер один может содержать только 2 электрона, оболочка номер два может содержать 8, а для первых восемнадцати элементов оболочка номер три может содержать максимум восемь электронов. Когда вы узнаете об элементах с более чем восемнадцатью электронами, вы обнаружите, что третья оболочка может содержать больше восьми. Как только одна оболочка заполнена, следующий добавленный электрон должен перейти на следующую оболочку.
Итак… для элемента АЗОТ вы уже знаете, что атомный номер говорит вам о количестве электронов. Это означает, что в атоме азота 7 электронов. Глядя на картинку, вы можете видеть, что на первой оболочке два электрона, а на второй — пять.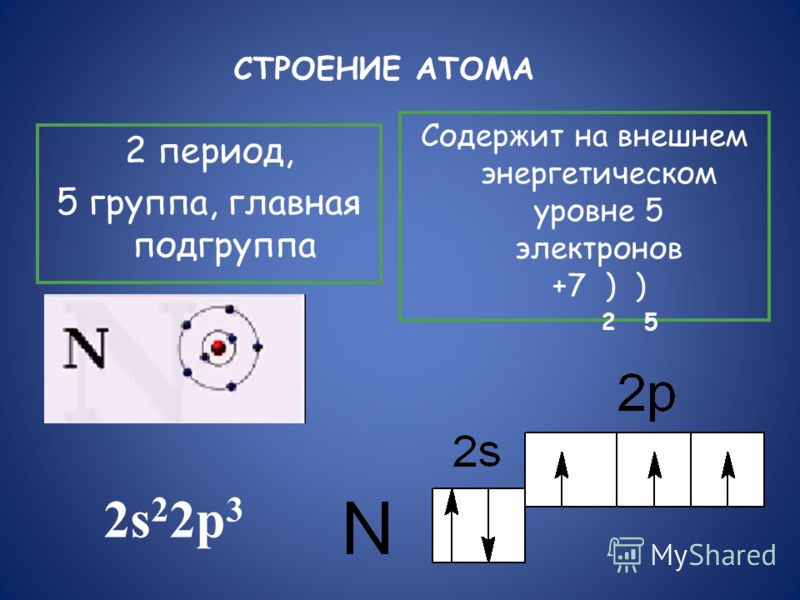
► Подробнее об истории и местах, где можно найти азот.
► Следующий элемент периодической таблицы.
- Скажи/Найди
- Орбитали/связи
- Предыдущий элемент
- Следующий элемент
- Список элементов
- Периодическая таблица
- Дополнительные темы
| Это молекула аммиака с формулой НХ 3 . Ученые используют название «аммиак», так же, как они называют H 2 O «вода». В этом соединении три атома водорода (H) делят свои электроны с атомом азота (N). Таким образом, азот имеет заполненную внешнюю оболочку, а водород имеет два электрона для заполнения своих оболочек. | ||
Азот может соединяться с тремя атомами хлора (Cl), образуя трихлорида азота 9. 0010 или NCl 3 . Азот делит свои электроны с атомами хлора, поэтому все атомы имеют заполненные оболочки. 0010 или NCl 3 . Азот делит свои электроны с атомами хлора, поэтому все атомы имеют заполненные оболочки.Взгляните на точки вокруг атомов. Все они теперь имеют восемь электронов и заполненную внешнюю оболочку! | ||
| Вот что-то новое! Здесь у нас есть три разных элемента: углерод, азот и хлор. В этом нет ничего особенного, но то, как они сочетаются! Посмотрите на углерод и азот, у них шесть общих электронов! Когда два атома имеют два общих электрона, это одинарная связь. Если их четыре, это двойная связь. Ну, эти двое делят шестерых, это тройная связь. Это чрезвычайно сильно и мощно. Потребуется много работы, чтобы разделить C и N ! Еще одно! Поскольку связь между углеродом и азотом настолько сильна, ученые называют их « цианоген » вместо углерод-азот. Ученые знают, что цианоген всегда CN . | ||
Химия азота (Z=7) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 565
Азот присутствует почти во всех белках и играет важную роль как в биохимических, так и в промышленных применениях. Азот образует прочные связи из-за своей способности образовывать тройную связь с самим собой и другими элементами. Таким образом, в соединениях азота содержится много энергии. Еще 100 лет назад мало что было известно об азоте. Теперь азот обычно используется для сохранения продуктов питания и в качестве удобрения.
Введение
Установлено, что азот имеет 3 или 5 валентных электронов и находится на вершине 15-й группы периодической таблицы. У него может быть 3 или 5 валентных электронов, потому что он может связываться на внешних 2p- и 2s-орбиталях. Молекулярный азот (\(N_2\)) не вступает в реакцию при стандартной температуре и давлении и представляет собой бесцветный газ без запаха.
У него может быть 3 или 5 валентных электронов, потому что он может связываться на внешних 2p- и 2s-орбиталях. Молекулярный азот (\(N_2\)) не вступает в реакцию при стандартной температуре и давлении и представляет собой бесцветный газ без запаха.
Азот — это неметаллический элемент, наиболее распространенный в атмосфере, газообразный азот (N 2 ) составляет 78,1% объема воздуха Земли. Он появляется только в 0,002% земной коры по массе. Соединения азота содержатся в пищевых продуктах, взрывчатых веществах, ядах и удобрениях. Азот входит в состав ДНК в виде азотистых оснований, а также в виде нейротрансмиттеров. Это один из крупнейших промышленных газов, который производится в промышленных масштабах в виде газа и жидкости.
| Название и условное обозначение | Азот, N |
| Категория | неметаллический |
| Атомный вес | 14. 0067 0067 |
| Группа | 15 |
| Электронная конфигурация | 1с 2 2с 2 2п 3 |
| Валентные электроны | 2, 5 |
| Фаза | Газ |
История
Азот, который составляет около 78% нашей атмосферы, представляет собой бесцветный газ без запаха и вкуса, химически неактивный газ при комнатной температуре. Он назван от греческого нитрон + гены образования соды. На протяжении многих лет в 1500-х и 1600-х годах ученые намекали, что помимо углекислого газа и кислорода в атмосфере есть еще один газ. Лишь в 1700-х годах ученые смогли доказать, что на самом деле существует еще один газ, набирающий массу в атмосфере Земли.
Открыт в 1772 году Дэниелом Резерфордом (и независимо другими, такими как Пристли и Кавендиш), который смог удалить кислород и углекислый газ из замкнутой трубки, наполненной воздухом. Он показал, что существует остаточный газ, который не поддерживает горение, как кислород или углекислый газ. В то время как его эксперимент доказал существование азота, в Лондоне также проводились другие эксперименты, в которых это вещество называлось «сгоревшим» или «дефлогистированным воздухом».
Он показал, что существует остаточный газ, который не поддерживает горение, как кислород или углекислый газ. В то время как его эксперимент доказал существование азота, в Лондоне также проводились другие эксперименты, в которых это вещество называлось «сгоревшим» или «дефлогистированным воздухом».
Азот является четвертым наиболее распространенным элементом в организме человека, и в известной Вселенной его больше, чем углерода или кремния. Большая часть коммерчески производимого газообразного азота извлекается из сжиженного воздуха. Из этого количества большая часть используется для производства аммиака (\(NH_3\)) по процессу Габера. Многое также превращается в азотную кислоту (\(HNO_3\)).
Изотопы
Азот имеет два встречающихся в природе изотопа, азот-14 и азот-15, , которые можно разделить химическим обменом или термической диффузией. У азота тоже есть изотопы с массой 12, 13, 16, 17, но они радиоактивны.
- Азот 14 является наиболее распространенной формой азота и составляет более 99% всего азота, обнаруженного на Земле.
 Это стабильное соединение, нерадиоактивное. Азот-14 имеет наиболее практическое применение и встречается в сельскохозяйственной практике, консервировании пищевых продуктов, биохимических веществах и биомедицинских исследованиях. Азот-14 в изобилии содержится в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником.
Это стабильное соединение, нерадиоактивное. Азот-14 имеет наиболее практическое применение и встречается в сельскохозяйственной практике, консервировании пищевых продуктов, биохимических веществах и биомедицинских исследованиях. Азот-14 в изобилии содержится в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником. - Азот-15 — еще одна стабильная форма азота. Он часто используется в медицинских исследованиях и консервации. Этот элемент нерадиоактивен и поэтому иногда может использоваться в сельскохозяйственной практике. Азот-15 также используется в исследованиях мозга, в частности, в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку в отличие от азота-14 (ядерный спин 1) он имеет ядерный спин 1/2, что имеет преимущества, когда дело доходит до наблюдения за исследованиями МРТ. и наблюдения ЯМР. Наконец, азот-15 можно использовать в качестве метки или в некоторых белках в биологии. Ученые в основном используют это соединение в исследовательских целях и еще не увидели его полного потенциала для использования в исследованиях мозга.

Соединения
Двумя наиболее распространенными соединениями азота являются нитрат калия (KNO 3 ) и нитрат натрия (NaNO 3 ). Эти два соединения образуются при разложении органических веществ, содержащих калий или натрий, и часто встречаются в удобрениях и побочных продуктах промышленных отходов. Большинство соединений азота имеют положительную свободную энергию Гиббса (т. е. реакции не протекают самопроизвольно).
Рисунок \(\PageIndex{2}\) : Точечная структура Льюиса молекулярного азота Молекула диазота (\(N_2\)) является «необычайно стабильным» соединением, особенно потому, что азот образует тройную связь сам с собой. Эту тройную связь трудно разорвать. Чтобы диазот соответствовал правилу октета, он должен иметь тройную связь. Азот имеет в общей сложности 5 валентных электронов, поэтому удвоив его, мы получим в общей сложности 10 валентных электронов с двумя атомами азота. Октет требует, чтобы атом имел 8 полных электронов, чтобы иметь полную валентную оболочку, поэтому он должен иметь тройную связь. -_{(водн.)} \label{2}\]
-_{(водн.)} \label{2}\]
При образовании азота с другими соединениями он главным образом образует ковалентные связи. Обычно их делают с другими металлами и они выглядят так: MN, M 3 N и M 4 N. Эти соединения обычно твердые, инертные и имеют высокие температуры плавления из-за способности азота образовывать тройные ковалентные связи.
Ионы аммония
Азот фиксируется путем реакции с газообразным водородом над катализатором. Этот процесс используется для производства аммиака. Как упоминалось ранее, этот процесс позволяет нам использовать азот в качестве удобрения, потому что он разрушает прочную тройную связь, удерживаемую N9.0049 2 . Знаменитый процесс Габера-Боша для синтеза аммиака выглядит следующим образом:
\[N_2 + 3H_2 \rightarrow 2NH_3 \label{3}\]
Аммиак является основанием и также используется в типичных кислотно-щелочных реакциях.
\[2NH_{3(водн.)} + H_2SO_4 \rightarrow (NH_4)_2SO_{4(водн. )} \label{4}\]
)} \label{4}\]
Ионы нитрида являются очень сильными основаниями, особенно в водных растворах.
Оксиды азота
Нитриды имеют различные степени окисления от +1 до +5 для оксидных соединений. Почти все образующиеся оксиды являются газами и существуют при 25 градусах Цельсия. Оксиды азота кислые и легко присоединяют протоны.
\[N_2O_5 + H_2O \rightarrow 2HNO_{3 (водный)} \label{5}\]
Оксиды играют большую роль в живых организмах. Они могут быть полезными, но опасными.
- Монооксид азота (N 2 O) — анестетик, используемый стоматологами в качестве веселящего газа.
- Двуокись азота (NO 2 ) вредна. Он связывается с молекулами гемоглобина, не позволяя молекуле выделять кислород по всему телу. Он выделяется из автомобилей и очень вреден.
- Нитрат (NO 3 — ) представляет собой многоатомный ион.
- Более нестабильные оксиды азота позволяют путешествовать в космос.
Гидриды
Гидриды азота включают аммиак (NH 3 ) и гидразин (N 2 H 4 ).
- В водном растворе аммиак образует описанный выше ион аммония, обладающий особыми амфипротными свойствами.
- Гидразин обычно используется в качестве ракетного топлива
Применение азота
- Азот обеспечивает защиту нашей атмосферы для производства химикатов и электронных отсеков.
- Азот используется в качестве удобрения в сельском хозяйстве для стимулирования роста.
- Газ под давлением для масла.
- Хладагент (например, для быстрой заморозки продуктов)
- Взрывчатые вещества.
- Обработка/защита металлов с помощью азота вместо кислорода
Ссылки
- Петруччи, Ральф Х., Уильям Харвуд и Ф. Херринг. Общая химия: принципы и современные приложения. 8 -й Изд. Нью-Джерси: Pearson Education Inc., 2001. .
- Садава, Дэвид и др. ЖИЗНЬ: биология. Издание восьмое. Ассоциированный Синауэр.
- Томас, Джейкоб. Азот и его применение в современном будущем .
 Издательство государственного университета Сан-Диего: 2007. .
Издательство государственного университета Сан-Диего: 2007. .
Задачи
- Завершите и сбалансируйте следующие уравнения
Н 2 + ___H 2 → ___NH _
H 2 N 2 O 2 → ?
2NH 3 + CO 2 → ?
__Mg + N 2 → Mg _ N _
N 2 H 5 + H 2 9005 0 О → ?
- Какие существуют изотопы азота?
- Перечислите степени окисления различных оксидов азота: N 2 O, NO, N 2 O 3 , N 2 O 4 , N 2 O 5
- Перечислите различные элементы, с которыми азот реагирует, делая его щелочным или кислотным. ic….
- Использование азота
Ответы
- Дополните и сбалансируйте следующие уравнения
N 2 + 3H 2 → 2NH 3 (процесс Габера)
H 2 N 2 O 9004 9 2 → HNO
2NH 3 + CO 2 → (NH 2 ) 2 CO + H 2 O
2Mg + 3N 2 9005 0 → Мг 3 Н 2
Н 2 H 5 + H 2 O → N 2 + H + + H 2 O
- Какие существуют изотопы азота?
Стабильные формы включают азот-14 и азот-15
- Перечислите степени окисления различных оксидов азота: +1, +2, +3, +4, +5 соответственно
- Перечислите различные элементы, с которыми азот будет реагировать, чтобы сделать его щелочным или кислотным: Ион нитрида является сильным основанием при реакции с водой, аммиак обычно является слабой кислотой
- Использование азота включает анестетик, хладагент, металлический протектор
Авторы
- Адам Ванделл (Калифорнийский университет в Дэвисе)
Chemistry of Nitrogen (Z=7) распространяется под лицензией CC BY-NC-SA 4.




 Это стабильное соединение, нерадиоактивное. Азот-14 имеет наиболее практическое применение и встречается в сельскохозяйственной практике, консервировании пищевых продуктов, биохимических веществах и биомедицинских исследованиях. Азот-14 в изобилии содержится в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником.
Это стабильное соединение, нерадиоактивное. Азот-14 имеет наиболее практическое применение и встречается в сельскохозяйственной практике, консервировании пищевых продуктов, биохимических веществах и биомедицинских исследованиях. Азот-14 в изобилии содержится в атмосфере и среди многих живых организмов. Он имеет 5 валентных электронов и не является хорошим проводником.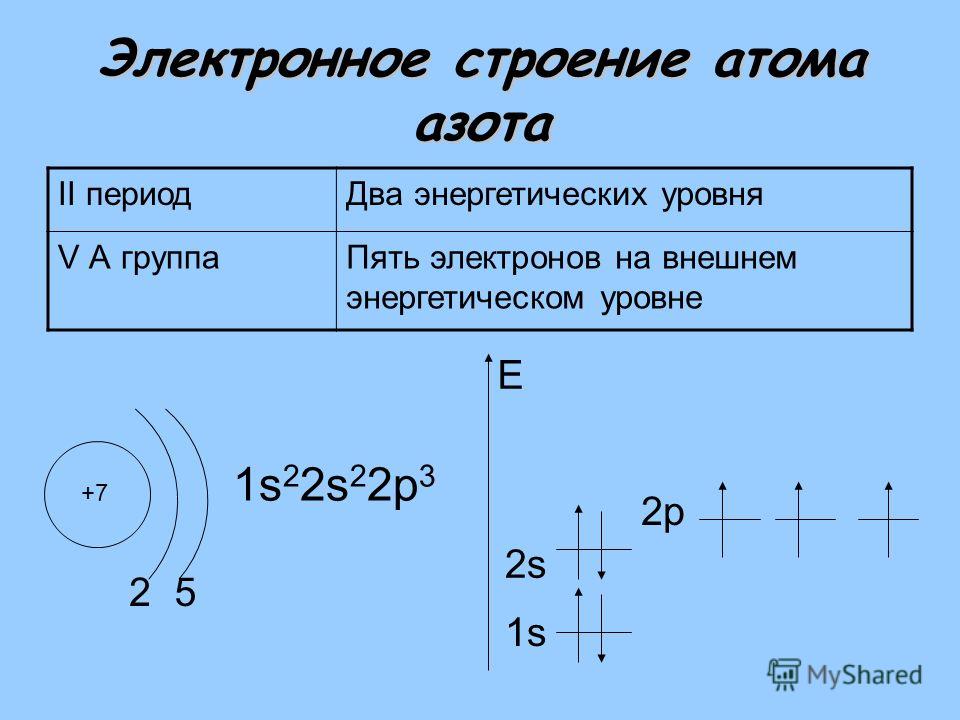
 Издательство государственного университета Сан-Диего: 2007.
Издательство государственного университета Сан-Диего: 2007.
Leave A Comment