Таблица менделеева — Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы — последняя группа, имеют законченную
электронную конфигурацию.
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 — K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
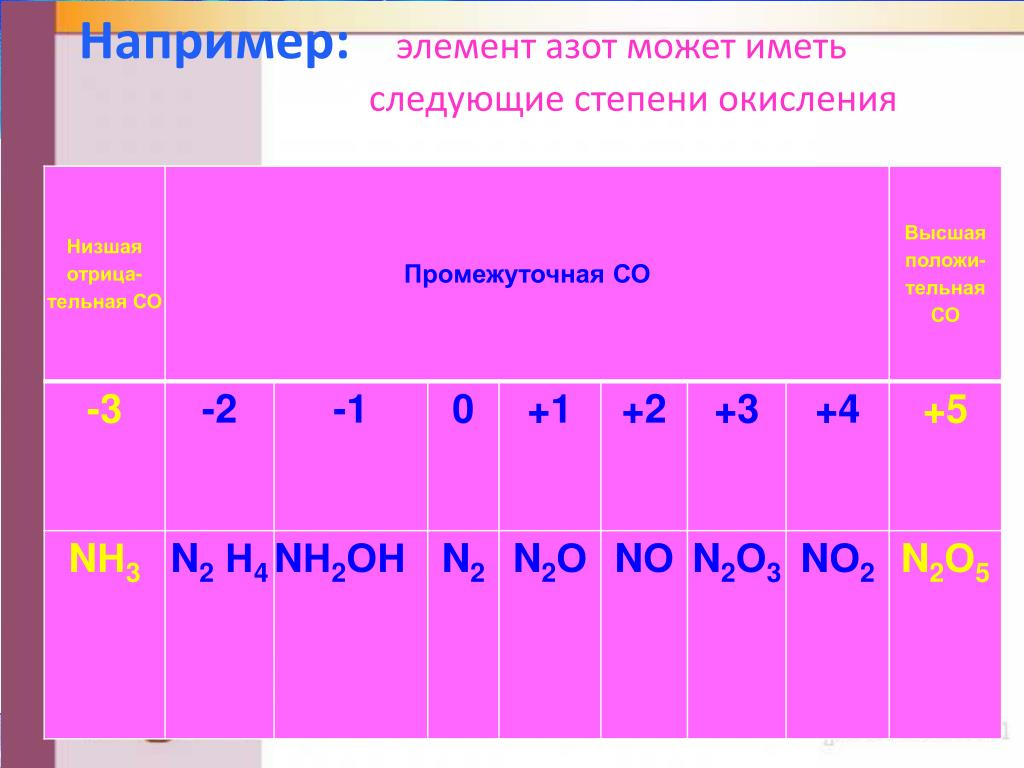
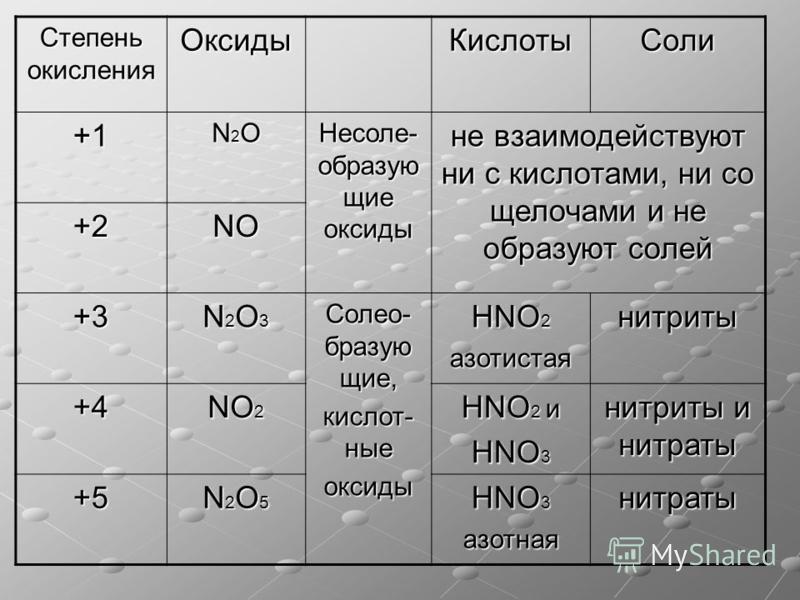
Степень окисления азота
Степень окисления азота.
Поделиться в:
Степень окисления азота:
Степень окисления (окислительное число) – это вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов. Однако она не является истинным зарядом атома в молекуле.
Однако она не является истинным зарядом атома в молекуле.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону (
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения.
Азот, свойства атома, химические и физические свойства
Значения степени окисления записывают арабскими цифрами сверху над символом элемента. При указании степени окисления первым ставится знак, а потом численное значение, а не наоборот.
Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения: -5, -4, -3, -2, -1, 0, +1, +2 , +3 , +4, +5, +6 , +7.
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как валентность равна IV.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей.
Степень окисления азота равна -3 , -2, -1, 0, +1, +2, +3 , +4, +5
| Степень окисления азота в соединениях | |
| -3 | Mg3N2, BN, NH3 |
| -2 | N2H2 |
| -1 | NH2OH |
| 0 | N2 |
| +1 | N2O |
| +2 | NO |
| +3 | NF3, N2O3, NOCl, NOBr, KNO2, NaNO2 |
| NO2 | |
| +5 | N2O5, N+5ON, NO2F |
Все свойства атома азота
Источник: https://ru.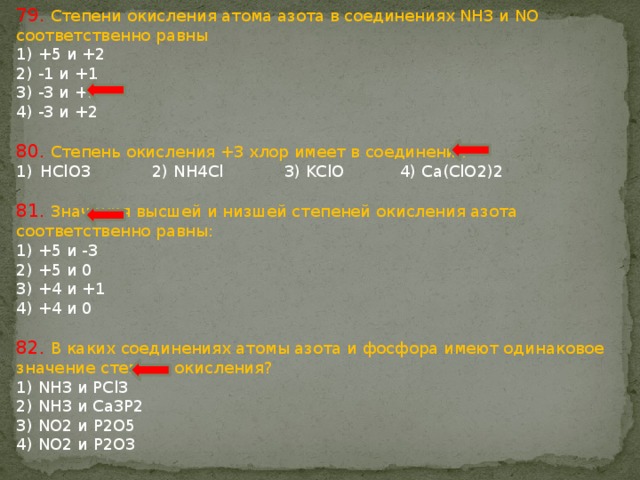 wikipedia.org
wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности 134
Степени окисления азота — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 765
- Уильям Ройш
- Университет штата Мичиган
При сравнении химии аминов со спиртами и эфирами мы обнаруживаем много классов родственных соединений, в которых азот принимает более высокие степени окисления, в отличие от ограниченных степеней окисления кислорода.
В этом контексте имейте в виду, что степень окисления элементарного кислорода (O 2 ) и азота (N 2 ) определяется как ноль.
Степень окисления | _ 3 | _ 2 | _ 1 | 0 | +1 | +3 |
|---|---|---|---|---|---|---|
| Формулы (имена) | Р 3 Н (амины) (аммоний) (имины) (нитрилы) | Р 2 Н–НР 2 (гидразины) (гидразоны) | РН=НР (азосоединение) (гидроксиламин) (оксид амина) | Н 2 (азот) (диазоний) | R–N=O (нитрозо) | Р-НО 2 (нитро) (нитритовый эфир) |
Оксиды аминов и Cope Исключение
Оксиды аминов получают путем окисления 3º-аминов или пиридинов перекисью водорода или надкислотами (например, ZOOH, где Z=H или ацил). {(–)} + ZOH\]
{(–)} + ZOH\]
Оксиды аминов являются относительно слабыми основаниями, pK a ок. 4,5 по сравнению с исходным амином. Координатно-ковалентная функция N–O полярна, при этом кислород является мощным акцептором водородной связи. Если один из алкильных заместителей состоит из длинной цепи, такой как C 12 H 25 , образующийся аминоксид является амфотерным поверхностно-активным веществом и находит применение в шампунях и других мягких чистящих средствах.
Реакция отщепления, дополняющая реакцию отщепления Хофмана, происходит при нагревании оксидов 3º-амина при температуре от 150 до 200 ºC. Эта реакция известна как Cope Elimination. Обычно его проводят путем добавления по каплям раствора оксида амина в нагретую трубку, наполненную мелкими стеклянными шариками. Поток газообразного азота, протекающий через колонну, переносит летучие алкеновые продукты в охлаждаемый приемник. Азотсодержащий продукт представляет собой гидроксиламин. В отличие от элиминации Хофмана, эта реакция происходит путем согласованной циклической реорганизации, как показано на следующей диаграмме. Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-связь.
Для такого механизма фрагменты бета-водорода и оксида амина обязательно имеют син-связь.
Удаление диастереомерных аминооксидов, таких как показано в примерах № 2 и 3 выше, обеспечивает доказательство син-отношения бета-водородных и аминоксидных групп. Эти примеры также демонстрируют сильную региоселективность в пользу более стабильной двойной связи.
Пиролитическое син-элиминирование
Оксиды аминов не являются единственными функциями, которые подвергаются мономолекулярному син-элиминированию при нагревании. Чтобы увидеть примеры других случаев, нажмите здесь
Нитроксидные радикалы
2º-амины, лишенные α-водорода, окисляются пероксидами (ZOOH) до нитроксильных радикалов удивительной стабильности. В примере, показанном в верхней части следующей диаграммы, следует отметить, что резонансная делокализация неспаренного электрона способствует образованию полярной связи N–O. Соединение R=H, известное под аббревиатурой TEMPO, представляет собой относительно стабильное твердое вещество красного цвета. Было получено много других нитроксидов, три из которых нарисованы в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксил разлагается на смеси, включающие аминооксиды и нитроны, как показано внизу слева. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Было получено много других нитроксидов, три из которых нарисованы в правом нижнем углу. Если один или несколько атомов водорода присутствуют на соседнем углероде, нитроксил разлагается на смеси, включающие аминооксиды и нитроны, как показано внизу слева. Нитроксиды окисляются галогенами до нестабильных катионов оксаммония.
Спин неспаренного электрона нитроксила можно изучить с помощью метода, называемого электронным парамагнитным резонансом (ЭПР или ЭПР). Эксперименты такого рода показали, что спектры ЭПР чувствительны к заместителям в радикале, а также к его непосредственному окружению. Это привело к стратегии спиновой маркировки для исследования конформационных структур макромолекул, таких как белки. Таким образом, сайт-направленная спиновая маркировка (SDSL) стала ценным методом для картирования элементов вторичной структуры на уровне основной складки в широком диапазоне белков, включая те, которые не поддаются структурной характеристике с использованием классических структурных методов. такие как ядерный магнитный резонанс и рентгеновская кристаллография.
такие как ядерный магнитный резонанс и рентгеновская кристаллография.
Фосфорные аналоги аминов
Фосфор в периодической таблице находится ниже азота. Чтобы увидеть примеры фосфорорганических соединений и их химии, нажмите здесь
Авторы
- Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
Эта страница под названием «Степени окисления азота» публикуется в соответствии с лицензией CC BY-NC-SA 4.0, автором, ремиксом и/или куратором этой страницы является Уильям Ройш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Уильям Ройш
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
11.16: Числа окисления и окислительно-восстановительные реакции
- Последнее обновление
- Сохранить как PDF
- Page ID
- 49538
- Ed Vitz, John W. Moore, Justin Shorb, Xavier Prat-Resina, Tim Wendorff, & Adam Hahn
- Chemical Education Digital Library (ChemEd DL)
Окислительно-восстановительные реакции могут включать перенос протонов и другие процессы разрыва и образования связей, а также переносы электронов, и поэтому с уравнениями, связанными с ними, гораздо труднее иметь дело, чем с уравнениями, описывающими кислотно-основные реакции. Чтобы иметь возможность распознавать окислительно-восстановительные реакции, нам нужен метод для тщательного учета всех электронов. Это делается путем присвоения степени окисления каждому атому до и после реакции.
Чтобы иметь возможность распознавать окислительно-восстановительные реакции, нам нужен метод для тщательного учета всех электронов. Это делается путем присвоения степени окисления каждому атому до и после реакции.
Например, в NO 3 – азоту присвоена степень окисления +5, а каждому кислороду – степень окисления –2. Это произвольное присвоение соответствует тому, что азот потерял свои первоначальные пять валентных электронов из-за электроотрицательных атомов кислорода. С другой стороны, в NO 2 азот имеет степень окисления + 4 и может считаться имеющим один валентный электрон для себя, то есть на один электрон больше, чем в NO 3 9.0050 – .
Это произвольно назначенное усиление на один электрон соответствует восстановлению атома азота при переходе от NO 3 – к NO 2 . Как правило, восстановлению соответствует понижение степени окисления некоторого атома. Окисление соответствует увеличению степени окисления некоторого атома. Применяя правила степени окисления к следующему уравнению, мы получаем
Применяя правила степени окисления к следующему уравнению, мы получаем
Хотя они полезны и необходимы для распознавания окислительно-восстановительных реакций, числа окисления являются в высшей степени искусственным средством. Атом азота в NO 3 – на самом деле не имеет заряда +5, который можно уменьшить до +4 в NO 9.0034 2 . Вместо этого у обоих видов существуют ковалентные связи и обмен электронными парами между азотом и кислородом, и азот, конечно, не полностью потерял свои валентные электроны в пользу кислорода. Даже несмотря на то, что это может (и должно) вызвать у вас подозрения в достоверности степеней окисления, они, несомненно, являются полезным инструментом для обнаружения процессов переноса электрона. До тех пор, пока они используются только для этой цели, а не означают, что атомы в ковалентных видах действительно имеют большие заряды, которые часто подразумевают степени окисления, их использование вполне правомерно.
Даже несмотря на то, что это может (и должно) вызвать у вас подозрения в достоверности степеней окисления, они, несомненно, являются полезным инструментом для обнаружения процессов переноса электрона. До тех пор, пока они используются только для этой цели, а не означают, что атомы в ковалентных видах действительно имеют большие заряды, которые часто подразумевают степени окисления, их использование вполне правомерно.
Ниже приведены общие правила для степеней окисления, взятые со следующей страницы Основного учебника по аналитической химии: Степени окисления
.Определение степеней окисления
Подсчет числа переданных электронов является неэффективным и трудоемким способом определения степеней окисления. Эти правила предлагают более простой метод:
- Степень окисления несвязанного элемента равна нулю. Это применимо независимо от структуры элемента: Xe, Cl 2 , S 8 , а также крупные структуры из углерода или кремния имеют нулевую степень окисления.

- Сумма степеней окисления всех атомов или ионов в нейтральном соединении равна нулю.
- Сумма степеней окисления всех атомов иона равна заряду иона.
- Более электроотрицательному элементу в веществе присваивается отрицательная степень окисления. Менее электроотрицательному элементу присваивается положительная степень окисления. Помните, что электроотрицательность максимальна в правом верхнем углу таблицы Менделеева и уменьшается в левом нижнем углу.
- Некоторые элементы почти всегда имеют одинаковые степени окисления в своих соединениях:
| Элемент | Обычная степень окисления | Исключения |
| Металлы группы 1 | Всегда +1 | |
| Металлы группы 2 | Всегда +2 | |
| Кислород | Обычно -2 | Пероксиды и F 2 O (см.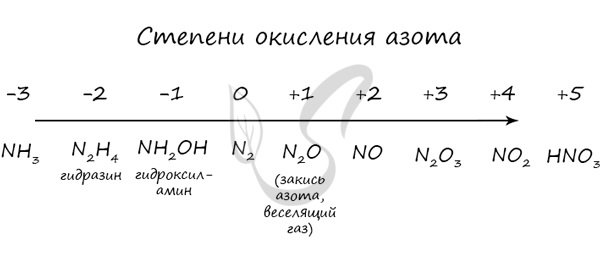 ниже) ниже) |
| Водород | Обычно +1 | Гидриды металлов (-1) (см. ниже) |
| Фтор | Всегда -1 | |
| Хлор | обычно -1 | Соединения с O или F (см. ниже) |
Исключения:
Водород в гидридах металлов : Гидриды металлов включают такие соединения, как гидрид натрия, NaH. Здесь водород существует в виде иона гидрида, H —. Степень окисления простого иона, подобного гидриду, равна заряду иона, в данном случае -1.
В качестве альтернативы сумма степеней окисления в нейтральном соединении равна нулю. Поскольку металлы группы 1 в своих соединениях всегда имеют степень окисления +1, отсюда следует, что водород должен иметь степень окисления -1 (+1 -1 = 0).
Кислород в пероксидах : Пероксиды включают пероксид водорода, H 2 O 2 . Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Это электрически нейтральное соединение, поэтому сумма степеней окисления водорода и кислорода должна быть равна нулю.
Поскольку каждый водород имеет степень окисления +1, каждый кислород должен иметь степень окисления -1, чтобы сбалансировать его.
Кислород в F 2 O : Отклонение здесь связано с тем фактом, что кислород менее электроотрицателен, чем фтор; фтор имеет приоритет со степенью окисления -1. Поскольку соединение является нейтральным, кислород имеет степень окисления +2. 9{–} + S}\)
Решение:
a) Соответствующие степени окисления:
Единственные атомы, которые изменяются, это Mn, от +7 до +2, восстановление, и S, от +4 до +6, окисление. Реакция представляет собой окислительно-восстановительный процесс. SO 2 окисляется MnO 4 – , поэтому MnO 4 – является окислителем. MnO 4 – был восстановлен с помощью SO 2 , поэтому SO 2 является восстановителем.
b) Числа окисления
показывают, что окислительно-восстановительного потенциала не произошло. Это кислотно-щелочная реакция, потому что переносится протон, но не электроны.
c)
H 2 S окислился, потеряв два электрона с образованием элементарного S. Поскольку H 2 S отдает электроны, он является восстановителем. HClO принимает эти электроны и восстанавливается до Cl – . Поскольку он принимает электроны, HClO является окислителем.
Эта страница под названием 11.16: числа окисления и окислительно-восстановительные реакции распространяется под лицензией CC BY-NC-SA 4.0, ее авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина. , Тим Вендорф и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.




Leave A Comment