единую транспортную систему клетки составляют
В клетке осуществляется синтез огромного количества видов веществ. Часть этих веществ потребляется клеткой на собственные нужды — синтез АТФ, построение органелл, накопление запасов, часть выводится из клетки — вещества оболочки (клетки растений, грибов, некоторых протист), гликокаликса (животные клетки), клеточные секреты (ферменты, гормоны, коллаген, кератин и т. д.). Синтез этих веществ, их перемещение из одной части клетки в другую и выведение за ее пределы происходят в системе замкнутых цитоплазматических мембран — эндоплазматической сети, или эндоплазматическом ретикулуме, и комплексе Гольджи, которые и образуют экспортную систему клетки.Эндоплазматический ретикулум (ЭР) представляет собой систему разветвленных каналов, вакуолей (цистерн), пузырьков, создающих подобие рыхлой сети в цитоплазме. Стенки каналов и полостей образованы элементарными мембранами. В клетке существуют два типа ЭР: гранулярный (шероховатый) и агранулярный (гладкий).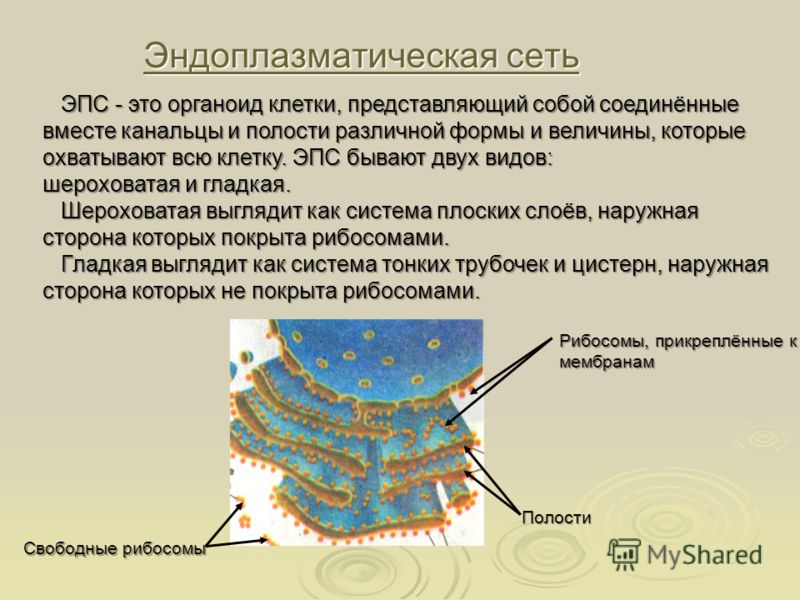

«Клетка и клеточные структуры» — Информио
Цитология — наука о развитии, строении и жизнедеятельности клеток.
Клетка — наименьшая единица живого, обладающая всеми признаками живого организма.
Клетка состоит из цитоплазмы, ядра и является основой строения, развития и жизнедеятельности всех животных и растительных организмов.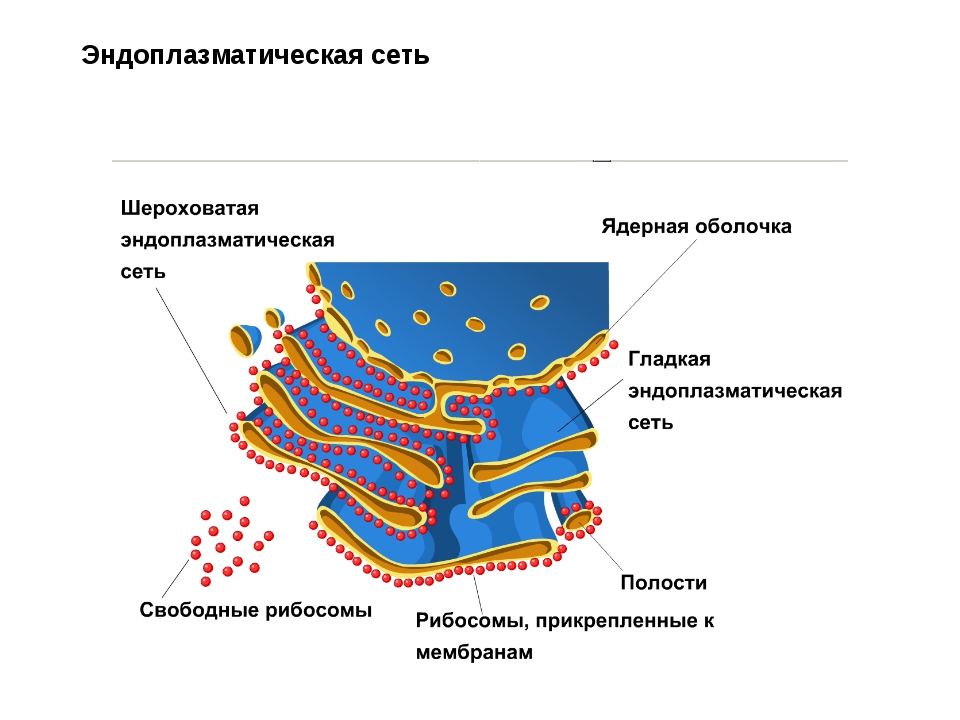
Впервые клетки наблюдаем при помощи увеличительных линз растительные клетки Роберт Гук в 1665г. Именно Гук назвал эти образования клетками.
1671г. Марчело Мальпиги, итальянский учёный и Неемия Грю подтвердили наблюдения Гука и показали, что разнообразные части растений состоят из «пузырьков» и «мешков». Грю ввел понятие ткань.
1680г. Антон ван Левенгук, голландский натуралист, основоположник научной микроскопии, открыл мир одноклеточных организмов и впервые увидел клетки животных (эритроциты).
1830г. Ян Пуркинье, чешский биолог, и его ученики разработали методы микроскопической технологии и описали клетки тканей животных. Введён термин протоплазма.
1831г. Роберт Броун, английский биолог, описал ядро растительной клетки.
1838г. Маттиас Шлейден, немецкий ботаник, сделал вывод том, что клетка является основной структурной единицей растительных организмов.
1839г. Теодор Шванн, физиолог и цитолог, опубликовал сочинение «Микроскопическое исследование о соответствии в стуктуре и росте животных и растений», тем самым сформулировал суть клеточной теории.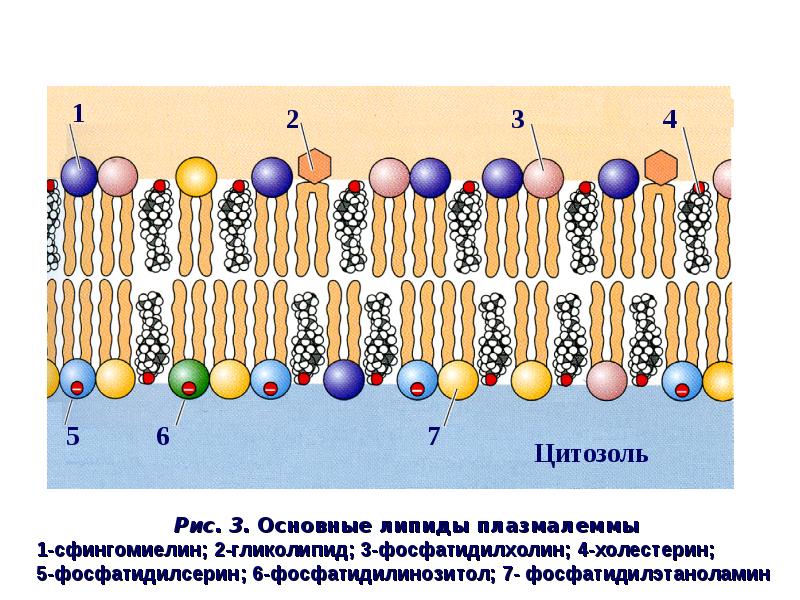
1858г. Рудольф Вирхов, немецкий врач и патологоанатом, показал, что причину патологических изменений в организме следует искать в клетке.
Как наука цитология стала развиваться после клеточной теории Шлейдена и Шванна.
Положения клеточной теории:
- Клетка — основная единица строения, функционирования и развития всех живых организмов, наименьшая единица живого, способная к самовоспроизведению, саморегуляции и самообновлению.
- Клетки всех одноклеточных и многоклеточных организмов сходны по своему строению, химическому составу и обмену веществ.
- Размножение клеток происходит путём деления.
- В многоклеточном организме клетки специализированы по выполняемым функциям и образуют ткани.
Эти законы доказывают единство происхождения всех живых организмов, единство всего органического мира.
Первое положение клеточной теории не противоречит тому, что в многоклеточных организмах встречаются и неклеточные структуры- симпласты, синцитии и межклеточное вещество, так как все они происходят из клеток.
Симпласты крупные структуры, образованные путём слияния многих клеток и состощие из цитоплазмы с множеством ядер. Примером симпласта может служить мышечные волокна скелетной мускулатуры. Синцитии характеризуются связями многих клеток с помощью тонких цитоплазматических перемычек. Межклеточное вещество является продуктом деятельности клеток (хорошо развито в соединительной ткани).
Несмотря на разнообразие форм клеток их функций, все клетки имеют общность в строении. В каждой клетке есть плазмолемма, цитоплазма и в большинстве ядра. В цитоплазме имеется гиалоплазма, в которой расположены две основные группы структур — органеллы и включения.
Органеллы представляют собой постоянно присутствующие обязательные структуры клеток, выполняющие важные функции. Органеллы бывают общего значения и специального. Органеллы общего значения – это те органеллы, которые присуще практически всем клеткам. Органеллы специального значения — присуще определённым клеткам. Так же по строению органеллы классифицируются на мембранные и не мембранные.
К мембранным органеллам относятся — митохондрии, ЭПС, аппарат комплекса Гольджи, лизосомы, пероксисомы. Не мембранные- рибосомы, микротрубочки, центриоли, микрофиламенты.
Включения — не обязательные компоненты клетки, возникающие и исчезающие в зависимости от состояния обмена веществ.
Биологические мембраны.
Основу биологической мембраны составляют молекулы липидов и белков. Липиды не растворимы в воде. В мембране присутствуют липиды трёх типов — фосфолипиды, холестерол, гликолипиды.
Большинство функций мембран — определяют белки. Типы белков и их количество сильно варьируется. В значительной части белки составляют половину её массы.
Углеводы мембраны представлены в виде олигосахаридных и полисахаридных цепей, присоединённых к мембранным белкам и липидам.
Все мембраны выполняют барьерную функцию, ограничивая свободную диффузию веществ между внешней средой и гиалоплазмой и содержимым мембранных органелл.
Плазмолемма.
Барьерно — транспортная и рецепторная система клетки.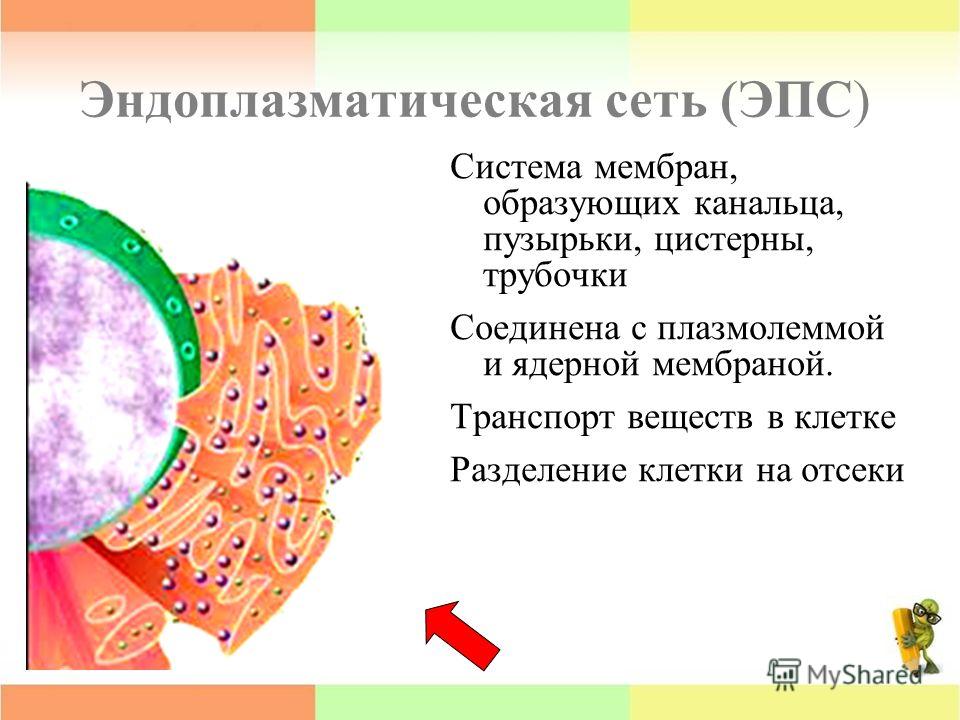 Она отделяет цитоплазму клетки от внешней среды и имеет толщину около 10нм. Рецепторная функция заключается в распознавании клеткой различных химических и физических факторов с помощью рецепторов.
Она отделяет цитоплазму клетки от внешней среды и имеет толщину около 10нм. Рецепторная функция заключается в распознавании клеткой различных химических и физических факторов с помощью рецепторов.
Цитоплазма.
Цитоплазма состоит из гиалоплазмы и расположенных в ней органелл и включений. Гиалоплазма является внутренней средой клетки. Представляет собой коллоидную систему, которая может менять своё физико — химическое состояние.
Эндоплазматическая сеть. (ЭПС)
Различают гранулярную и агранлярную. Гранулярная эндоплазматическая сеть- состоит из канальцев и цистерн, ограниченных мембранной на поверхности которой прикреплены рибосомы. Функция обеспечение синтеза белка на экспорт, образуют белки для нужд ЭПС, формируют лизосомы.
Агранулярная ЭПС сильно развита в клетках, секретирующих липиды или синтезирующих углеводы. Функция детоксикация вредных веществ и депонирование ионов кальция.
Комплекс Гольджи (пластинчатый комплекс).
Впервые выявлен в нервных клетках методом импрегнации серебром в 1898 г. К. Гольджи. С применением электронного микроскопа показано, что комплекс Гольджи состоит из секреторных гранул, транспортных визикул и цистерн. В комплексе Гольдже происходит образование лизосом. Участвует в транспорте веществ.
К. Гольджи. С применением электронного микроскопа показано, что комплекс Гольджи состоит из секреторных гранул, транспортных визикул и цистерн. В комплексе Гольдже происходит образование лизосом. Участвует в транспорте веществ.
Митохондрии.
Структуры округлой формы или палочковидной формы, описаны Бенда в 1897г. Электронная микроскопия показала, что митохондрии двух мембранные органеллы. Внутренняя мембрана образует выросты — кристы, погруженные в мелкозернистый матрикс, в котором расположены мелкие гранулы размером 15-20 нм- рибосомы и более крупные гранулы- места связывания двухвалентных катионов кальция, нити кольцевидных ДНК, ферменты и др. Основная функция синтез энергии — АТФ и клеточное дыхание. Митохондрии способны перемещаться внутри клетки, направляясь в те участки клетки, где требуется энергия АТФ.
Рибосомы.
Рибосомы — не мембранные органеллы синтеза белка образуются в ядрышке. Они имеют размеры 15-35 нм и состоят из двух субъединиц — малой и большой, каждая из которых построена из скрученного тяжа рибонуклеопротеида, где представлены поровну белки и рибосомная ДНК. Для образования рибосомы из двух субъединиц необходим магний. Для молодых клеток характерно наличие рибосом свободных, которые образуют белки для самой клетки. В дифференцированных клетках число свободных рибосом уменьшается, увеличивается число рибосом и полисом, связанных с эндоплазматической сетью и обеспечивающих синтез белков «на экспорт». Большое содержание рибосом в клетках обуславливает явление базофилии. Это свойство используется для контроля при проведении цитохимических реакций выявления РНК, например, методом Браше.
Для образования рибосомы из двух субъединиц необходим магний. Для молодых клеток характерно наличие рибосом свободных, которые образуют белки для самой клетки. В дифференцированных клетках число свободных рибосом уменьшается, увеличивается число рибосом и полисом, связанных с эндоплазматической сетью и обеспечивающих синтез белков «на экспорт». Большое содержание рибосом в клетках обуславливает явление базофилии. Это свойство используется для контроля при проведении цитохимических реакций выявления РНК, например, методом Браше.
Внутриклеточный синтез белка проходит ряд последовательных стадий и генетически контролируется ядром. Для обеспечения синтеза необходимо иметь следующие компоненты: аминокислоты, информационную РНК, транспортную РНК для всех аминокислот, ферменты для активирования аминокислот и АТФ.
Информационная РНК существует 4-8 часов, после чего разрушается ферментом РНКазой, содержащейся в одной из рибосом. За 1,5-2 минуты образуется 1 молекула белка. Число молекул белка определяется числом рибосом, через которую проходит и-РНК. Образующийся белок поступает в цистерны ГЭР и далее транспортируется в комплекс Гольджи.
Образующийся белок поступает в цистерны ГЭР и далее транспортируется в комплекс Гольджи.
Микротрубочки.
Микротрубочки представляют собой полые цилиндры с внешним диаметром 25 нм. Состоят из глобулярного белка тубулина, молекулы которого соединяются друг с другом в нитевидные комплексы, образуя цилиндрическую структуру. Микротрубочки, как и актиновые микрофиламенты, очень динамичны. Их сборка из молекул тубулина сходна со сборкой микрофиламентов: они легко обмениваются мономерами с цитоплазматическим тубулином. Как и микрофиламенты, микротрубочки обладают структурной полярностью (плюс- и минус-концы). Большинство микротрубочек ассоциированы со вспомогательными белками, которые участвуют в регуляции сборки микротрубочек и обеспечивают их взаимодействие с другими внутриклеточными структурами. В отличие от актиновых микрофиламентов, система микротрубочек в клетке централизована: они растут из определенного места, называемого центром организации микротрубочек. В интерфазной клетке этот центр располагается вблизи ядра и называется центросомой (или клеточным центром).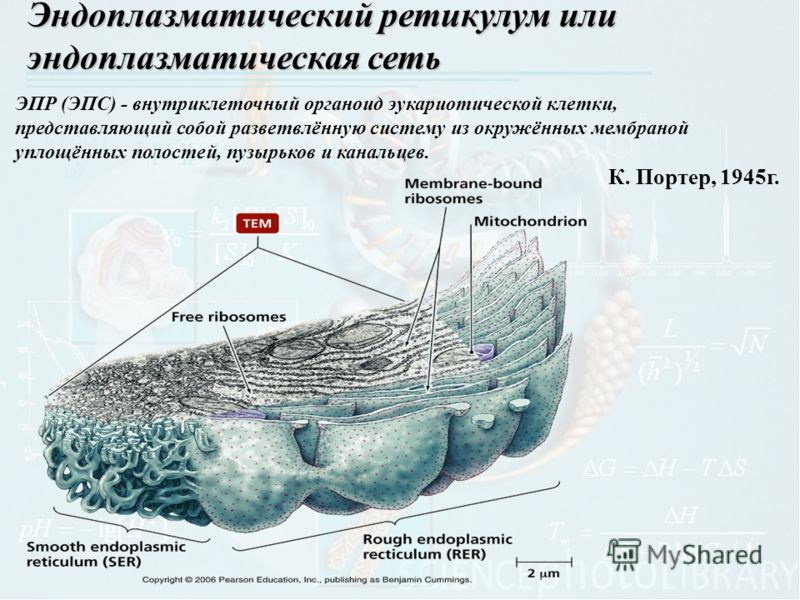 Центросома является носителем у-тубулиновых «затравок», инициирующих рост микротрубочек. Отсюда микротрубочки растут с постоянной скоростью вплоть до приближения их плюс-концов к краю клетки, где фазы роста сменяются фазами укорочения, и длина микротрубочек осциллирует (так называемый режим динамической нестабильности). Тем временем минус-конец микротрубочки может отделиться от центросомы, что приводит к быстрой деполимеризации — разборке микротрубочки. На освободившихся «затравках» может инициироваться рост новых микротрубочек. Вместе с тем в цитоплазме имеются микротрубочки, способные к спонтанной самосборке и разборке вне связи с какими-либо структурами.
Центросома является носителем у-тубулиновых «затравок», инициирующих рост микротрубочек. Отсюда микротрубочки растут с постоянной скоростью вплоть до приближения их плюс-концов к краю клетки, где фазы роста сменяются фазами укорочения, и длина микротрубочек осциллирует (так называемый режим динамической нестабильности). Тем временем минус-конец микротрубочки может отделиться от центросомы, что приводит к быстрой деполимеризации — разборке микротрубочки. На освободившихся «затравках» может инициироваться рост новых микротрубочек. Вместе с тем в цитоплазме имеются микротрубочки, способные к спонтанной самосборке и разборке вне связи с какими-либо структурами.
Некоторые растительные яды, например колхицин или колцемид, присоединяясь к мономерам тубулина, препятствуют его полимеризации и блокируют рост микротрубочек. Поскольку деполимеризация при этом продолжается, микротрубочки постепенно разрушаются, в том числе микротрубочки митотического веретена, что останавливает деление клетки на стадии митоза.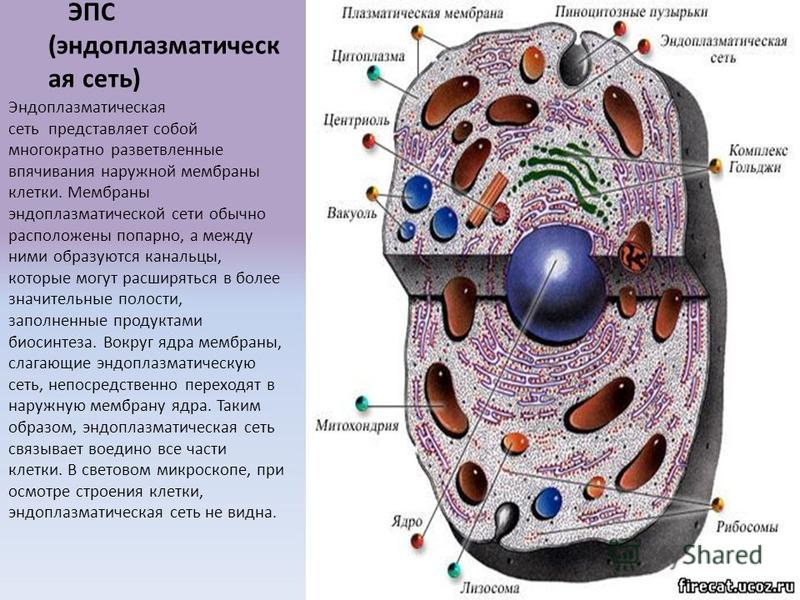 Аналогичным механизмом действия обладают противоопухолевые растительные алкалоиды винкристин и винбластин. Другой растительный агент — таксол — не подавляет, а, наоборот, активирует полимеризацию тубулина, препятствуя деполимеризации микротрубочек: последние становятся стабильными и не укорачиваются. Однако такая стабилизация тоже останавливает деление клетки на стадии митоза, что позволяет использовать таксол для противоопухолевой химиотерапии. Главной функцией микротрубочек является внутриклеточный транспорт. Благодаря специальным моторным белкам — динеинам и кинезинам — микротрубочки служат своеобразными «рельсами» для направленного перемещения в клетке различных органелл или каких-либо материалов. Молекула моторного белка одним своим концом прикрепляется к боковой стороне микротрубочки, а другой — к «грузу», подлежащему транспортировке. Подобно миозину, соединенному с актином, моторный белок (при наличии АТФ) развивает тянущее воздействие, вызывающее перемещение «груза» вдоль микротрубочки, или взаимное скольжение микротрубочек относительно друг друга.
Аналогичным механизмом действия обладают противоопухолевые растительные алкалоиды винкристин и винбластин. Другой растительный агент — таксол — не подавляет, а, наоборот, активирует полимеризацию тубулина, препятствуя деполимеризации микротрубочек: последние становятся стабильными и не укорачиваются. Однако такая стабилизация тоже останавливает деление клетки на стадии митоза, что позволяет использовать таксол для противоопухолевой химиотерапии. Главной функцией микротрубочек является внутриклеточный транспорт. Благодаря специальным моторным белкам — динеинам и кинезинам — микротрубочки служат своеобразными «рельсами» для направленного перемещения в клетке различных органелл или каких-либо материалов. Молекула моторного белка одним своим концом прикрепляется к боковой стороне микротрубочки, а другой — к «грузу», подлежащему транспортировке. Подобно миозину, соединенному с актином, моторный белок (при наличии АТФ) развивает тянущее воздействие, вызывающее перемещение «груза» вдоль микротрубочки, или взаимное скольжение микротрубочек относительно друг друга.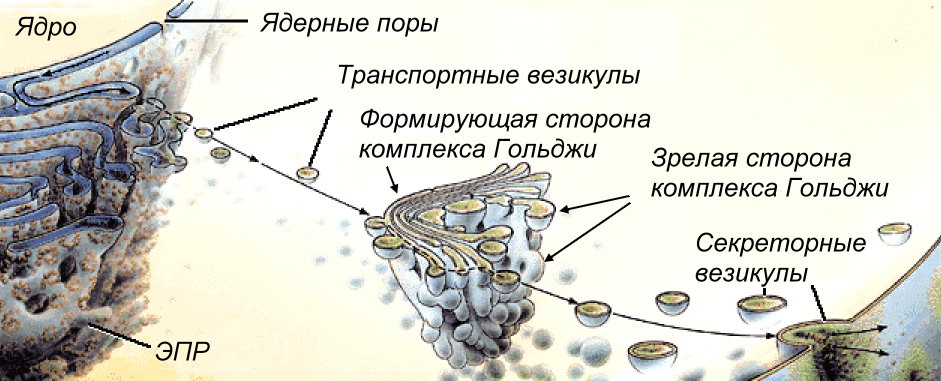 Направление движения определяется моторным белком: кинезины перемещают «груз» к плюс-концу, динеины — к минус-концу микротрубочки. Микротрубочки наряду с актиновыми микрофиламентами играют ключевую роль в приобретении клеткой асимметричной поляризованной формы, необходимой для ее направленного перемещения. Эта роль микротрубочек основана на их транспортной функции. Между актиновыми микрофиламентами и микротрубочками имеются поперечные механические связи, осуществляемые кросс-линкерными белками. Обе цитоскелетные системы кооперированно участвуют в процессах сборки и функционирования адгезионных структур, связывающих клетку с внеклеточным матриксом, определяя способность клеток к активному передвижению — локомоции.
Направление движения определяется моторным белком: кинезины перемещают «груз» к плюс-концу, динеины — к минус-концу микротрубочки. Микротрубочки наряду с актиновыми микрофиламентами играют ключевую роль в приобретении клеткой асимметричной поляризованной формы, необходимой для ее направленного перемещения. Эта роль микротрубочек основана на их транспортной функции. Между актиновыми микрофиламентами и микротрубочками имеются поперечные механические связи, осуществляемые кросс-линкерными белками. Обе цитоскелетные системы кооперированно участвуют в процессах сборки и функционирования адгезионных структур, связывающих клетку с внеклеточным матриксом, определяя способность клеток к активному передвижению — локомоции.
Центриоли.
Центриоли лежат в паре, каждая из которых состоит из 9 триплетов периферических микротрубочек. Пара центриолей (диплосома), расположенных перпендикулярно друг к другу, окружена зоной светлой цитоплазмы и радиально отходящими микротрубочками (центросфера).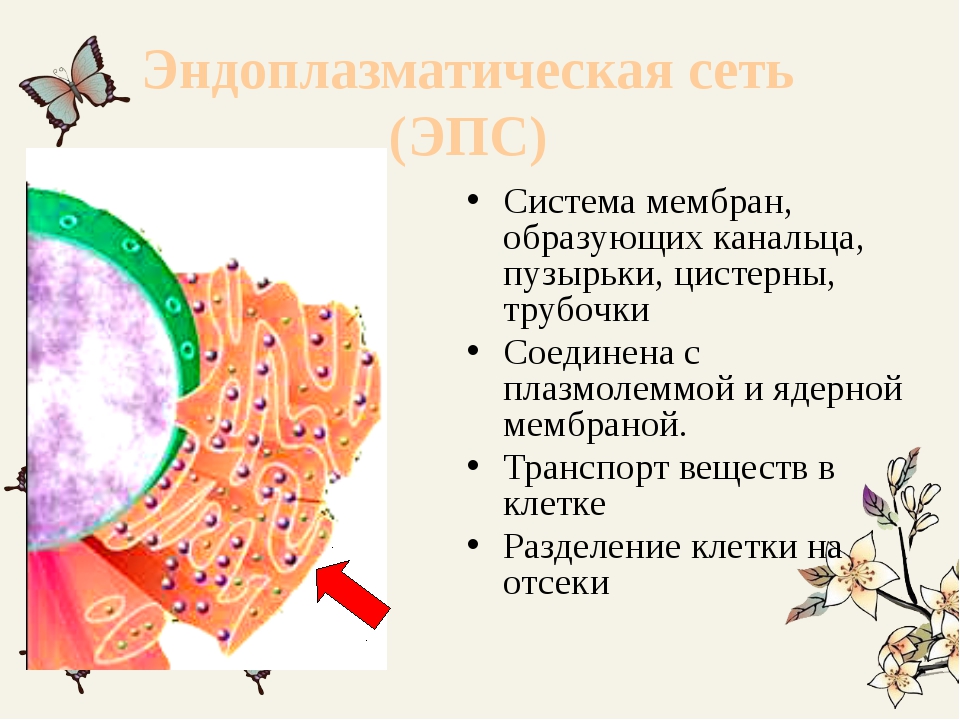 Все эти образования — диплосома и центросфера- образуют органеллу, которая называется клеточным центром.
Все эти образования — диплосома и центросфера- образуют органеллу, которая называется клеточным центром.
Ядро.
Основная функция ядра: 1) хранение и передача информации; 2) обеспечение синтеза белка- создание аппарата белкового синтеза.
Структура и функция ядра изменяется с течением цикла клетки — времени существования клетки от деления до деления или от деления до смерти. Клеточный цикл соматических клеток состоит из митоза и интерфазы (период между делениями). Интерфаза включает три основных периода: пресинтетический, синтетический, постсинтетический. Ядра интерфазных не делящихся клеток, несмортя на различие в размерах и форме, имеют общий план строения. Интерфазное ядро состоит из ядерной оболочки, хроматина, ядрышка и кариоплазмы.
Оригинал работы:
Конспект лекции на тему: «Клетка и клеточные структуры»
Строение клетки
Клетки, образующие ткани растений и животных, значительно различаются по форме, размерам и внутреннему строению.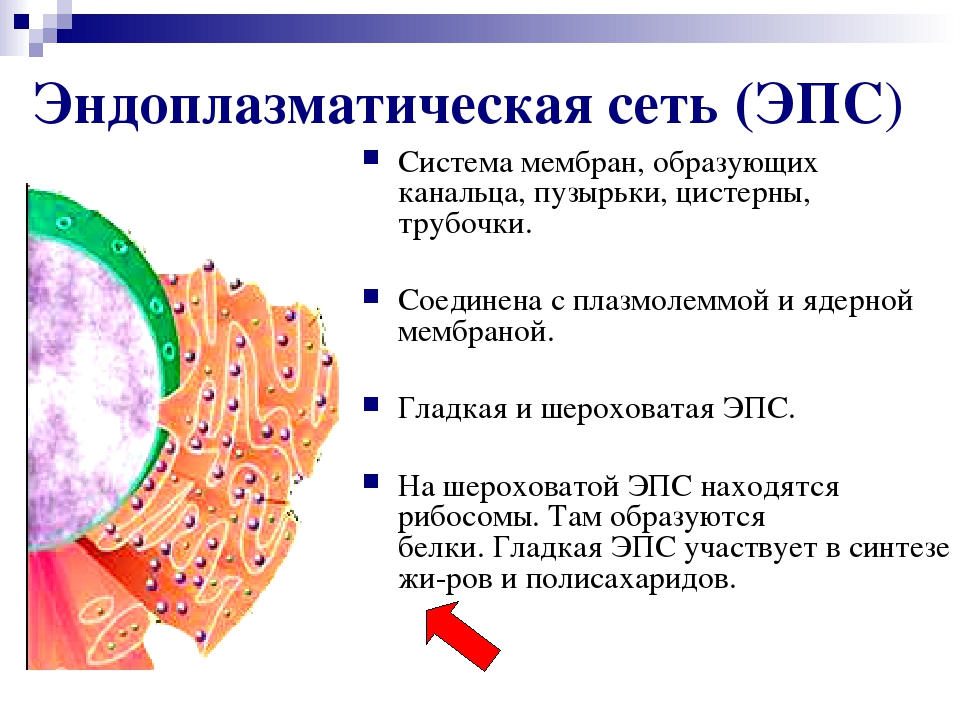 Однако все они обнаруживают сходство в главных чертах процессов жизнедеятельности, обмена веществ, в раздражимости, росте, развитии, способности к изменчивости.
Однако все они обнаруживают сходство в главных чертах процессов жизнедеятельности, обмена веществ, в раздражимости, росте, развитии, способности к изменчивости.
Биологические превращения, происходящие в клетке, неразрывно связаны с теми структурами живой клетки, которые отвечают за выполнение гой или иной функции. Такие структуры получили название органоидов.
Клетки всех типов содержат три основных, неразрывно связанных между собой компонента:
- структуры, образующие ее поверхность: наружная мембрана клетки, или клеточная оболочка, или цитоплазматическая мембрана;
- цитоплазма с целым комплексом специализированных структур — органоидов (эндоплазматическая сеть, рибосомы, митохондрии и пластиды, комплекс Гольджи и лизосомы, клеточный центр), присутствующих в клетке постоянно, и временных образований, называемых включениями;
- ядро — отделено от цитоплазмы пористой мембраной и содержит ядерный сок, хроматин и ядрышко.
Строение клетки
Поверхностный аппарат клетки (цитоплазматическая мембрана) растений и животных имеет некоторые особенности.
У одноклеточных организмов и лейкоцитов наружная мембрана обеспечивает проникновение в клетку ионов, воды, мелких молекул других веществ. Процесс проникновения в клетку твердых частиц называется фагоцитозом, а попадание капель жидких веществ — пиноцитозом.
Наружная плазматическая мембрана регулирует обмен веществ между клеткой и внешней средой.
В клетках эукариот есть органоиды, покрытые двойной мембраной, — митохондрии и пластиды. Они содержат собственные ДНК и синтезирующий белок аппарат, размножаются делением, то есть имеют определенную автономию в клетке. Кроме АТФ, в митохондриях происходит синтез небольшого количества белка. Пластиды свойственны клеткам растений и размножаются путем деления.
| Виды клеток | Строение и функции наружного и внутреннего слоев клеточной оболочки | ||
|---|---|---|---|
| наружный слой (хим. состав, функции) | внутренний слой — плазматическая мембрана | ||
| химический состав | функции | ||
| Клетки растений | Состоят из клетчатки.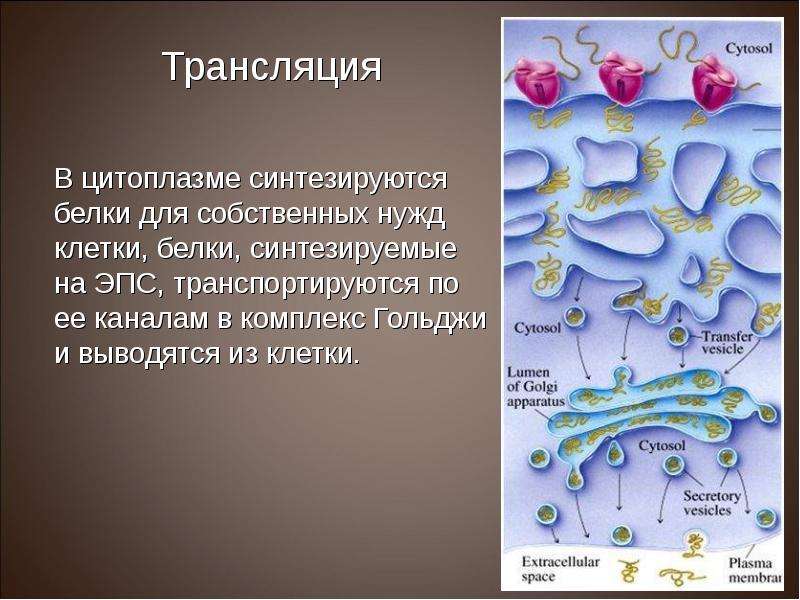 Этотслой служит каркасом клетки и выполняет защитную функцию Этотслой служит каркасом клетки и выполняет защитную функцию | Два слоя белка, между ними — слой липидов | Ограничивает внутреннюю среду клетки от внешней и поддерживает эти различия |
| Клетки животных | Наружный слой (гликокаликс) очень тонкий и эластичный. Состоит из полисахаридов и белков. Выполняет защитную функцию. | Тоже | Специальные ферменты плазматической мембраны регулируют проникновение многих иононов и молекул в клетку и выход их во внешнюю среду |
К одномембранным органоидам относятся эндоплазматическая сеть, комплекс Гольджи, лизосомы, различные типы вакуолей.
Современные средства исследования позволили биологам установить, что по строению клетки все живые существа следует делить на организмы «безъядерные» — прокариоты и «ядерные» — эукариоты.
У прокариот-бактерий и сине-зеленых водорослей, а также вирусов имеется всего одна хромосома, представленная молекулой ДНК (реже РНК), расположенной непосредственно в цитоплазме клетки.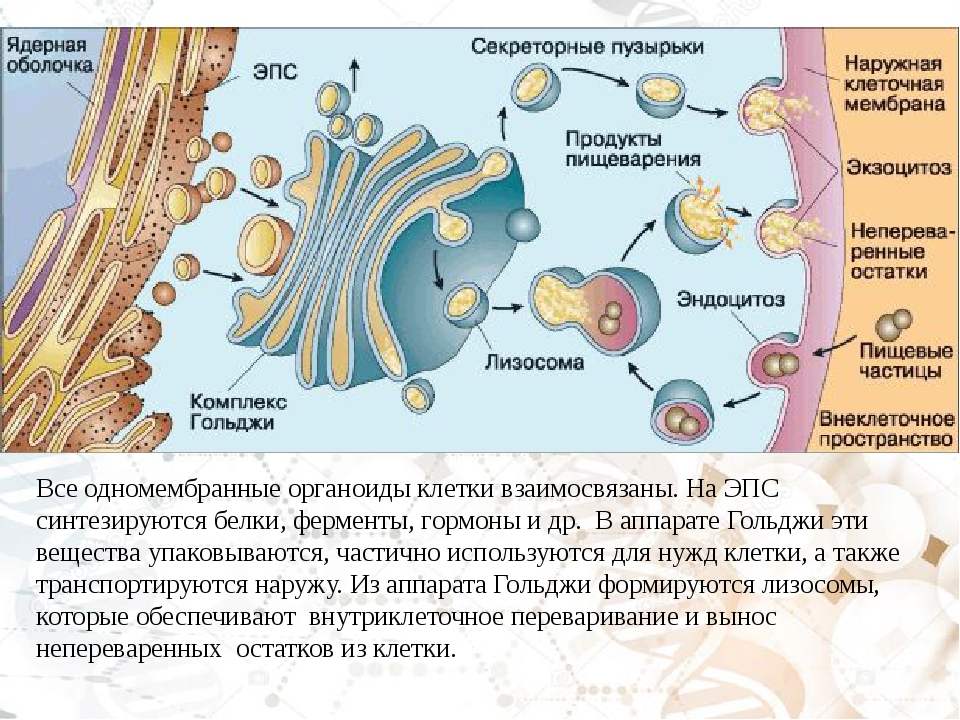
| Главные рганоиды | Строение | Функции |
|---|---|---|
| Цитоплазма | Внутренняя полужидкая среда мелкозернистой структуры. Содержит ядро и органоиды |
|
| ЭПС — эндоплазматическая сеть | Система мембран в цитоплазме» образующая каналы и более крупные полости, ЭПС бывает 2-х типов: гранулированная (шероховатая), на которой расположено множество рибосом, и гладкая |
|
| Рибосомы | Мелкие тельца диаметром 15—20 мм | Осуществляют синтез белковых молекул, их сборку из аминокислот |
| Митохондрии | Имеют сферическую, нитевидную, овальную и другие формы. Внутри митохондрий находятся складки (дл. от 0,2 до 0,7 мкм). Внешний покров митохондрий состоит из 2-х мембран: наружная — гладкая, и внутренняя — образует выросты-кресты, на которых расположены дыхательные ферменты Внутри митохондрий находятся складки (дл. от 0,2 до 0,7 мкм). Внешний покров митохондрий состоит из 2-х мембран: наружная — гладкая, и внутренняя — образует выросты-кресты, на которых расположены дыхательные ферменты |
|
| Пластиды — свойственны только клеткам раститений, бывают трех типов: | Двумембранные органеллы клетки | |
| хлоропласты | Имеют зеленый цвет, овальную форму, ограничены от цитоплазмы двумя трехслойными мембранами. Внутри хлоропласта располагаются грани, где сосредоточен весь хлорофилл | Используют световую энергию солнца и создают органические вещества из неорганических |
| хромопласты | Желтые, оранжевые, красные или бурые, образуются в результате накопления каротина | Придают различным частям растений красную и желтую окраску |
| лейкопласты | Бесцветные пластиды (содержатся в корнях, клубнях, луковицах) | В них откладываются запасные питательные вещества |
| Комплекс Гольджи | Может иметь разную форму и состоит из отграниченных мембранами полостей и отходящих от них трубочек с пузырьками на конце |
|
| Лизосомы | Округлые тельца диаметром около 1 мкм.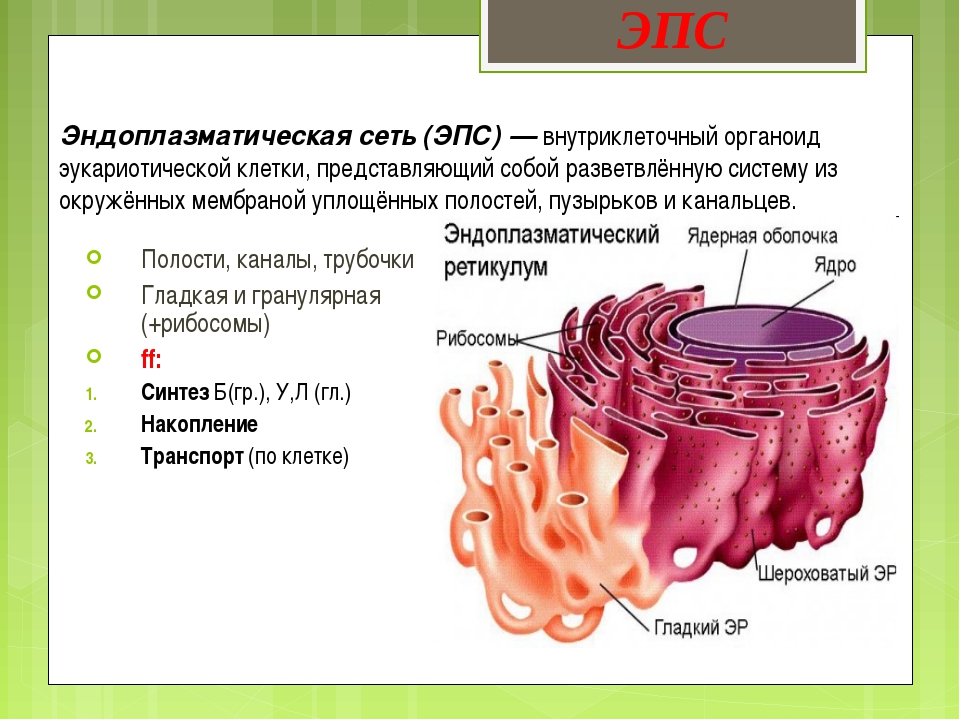 На поверхности имеют мембрану (кожицу), внутри которой находится комплекс ферментов На поверхности имеют мембрану (кожицу), внутри которой находится комплекс ферментов | Выполняют пищеварительную функцию — переваривают пищевые частицы и удаляют отмершие органоиды |
| Органоиды движения клеток |
|
|
| Клеточные включения | Это непостоянные компоненты клетки — углеводы, жиры и белки | Запасные питательные вещества, используемые в процессе жизнедеятельности клетки |
| Клеточный центр | Состоит из двух маленьких телец — центриолей и центросферы — уплотненного участка цитоплазмы | Играет важную роль при делении клеток |
Эукариоты обладают большим богатством органоидов, имеют ядра, содержащие хромосомы в виде нуклеопротеидов (комплекс ДНК с белком гистоном). К эукариотам относятся большинство современных растений и животных как одноклеточных, так и многоклеточных.
К эукариотам относятся большинство современных растений и животных как одноклеточных, так и многоклеточных.
Выделяют два уровня клеточной организации:
- прокариотический — их организмы очень просто устроены — это одноклеточные или колониальные формы, составляющие царство дробянок, синезеленых водорослей и вирусов
- эукариотический — одноклеточные колониальные и многоклеточные формы, от простейших — корненожки, жгутиковые, инфузории — до высших растений и животных, составляющие царство растений, царство грибов, царство животных
Особенности клеточного строения прокариотов н эукариотов
| Главные органоиды | Строение | Функции |
|---|---|---|
| Ядро растительной и животной клетки | Округлой или овальной формы | |
| Ядерная оболочка состоит из 2-х мембран с порами |
| |
| Ядерный сок (кариоплазма) — полужидкое вещество | Среда, в которой находятся ядрышки и хромосомы | |
| Ядрышки сферической или неправильной формы | В них синтезируется РНК, которая входит в состав рибосомы | |
| Хромосомы — плотные удлиненные или нитевидные образования, видимые только при делении клетки | Содержат ДНК, в которой заключена наследственная информация, передающаяся из поколения в поколение |
Все органоиды клетки, несмотря на особенности их строения и функций, находятся во взаимосвязи и «работают» на клетку, как на единую систему, в которой связующим звеном является цитоплазма.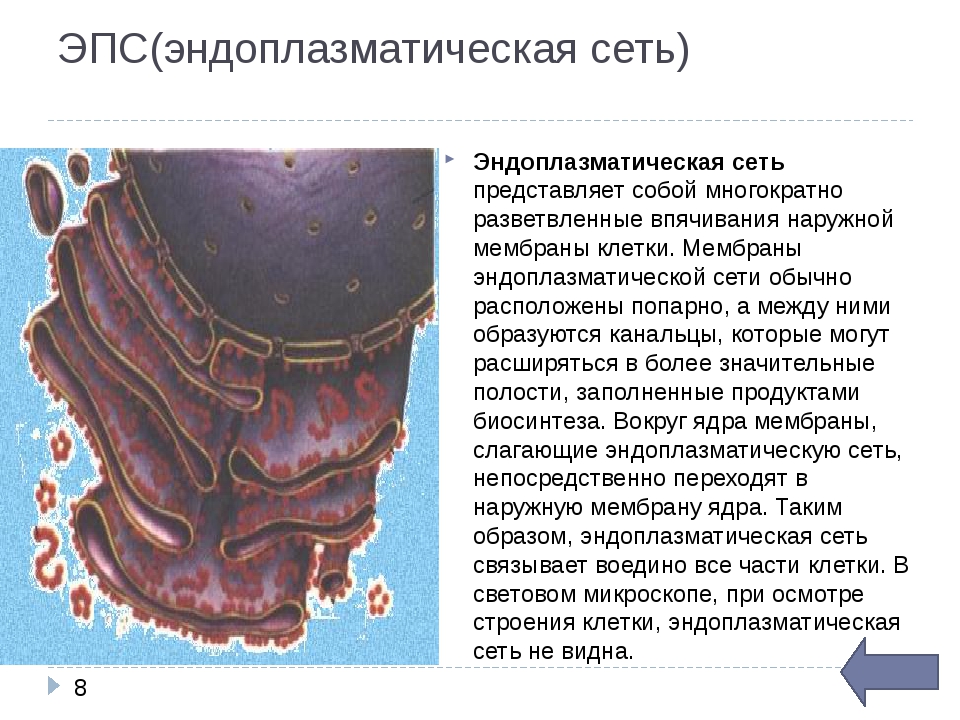
Особые биологические объекты, занимающие промежуточное положение между живой и неживой природой, представляют собой вирусы, открытые в 1892 г. Д. И. Ивановским, они составляют в настоящее время объект особой науки — вирусологии.
Вирусы размножаются только в клетках растений, животных и человека, вызывая различные заболевания. Вирусы имеют очень прослое строение и состоят из нуклеиновой кислоты (ДНК или РНК) и белковой оболочки. Вне клеток хозяина вирусная частица не проявляет никаких жизненных функций: не питается, не дышит, не растет, не размножается.
Вакуолярная система клетки » СтудИзба
Лекция № 5.
Количество часов: 2
Вакуолярная система клетки
1. Эндоплазматическая сеть, структура и функции
2. Комплекс Гольджи, структурная организация и значение
3. Лизосомы, классификация, строение и значение
4. Вакуолярная система клеток растений
Вакуолярная система клеток растений
К вакуолярной системе клетки относятся одномембранные органоиды клетки: эндоплазматическая сеть, комплекс Гольджи, лизосомы и различные вакуоли. Эти структуры имеют разное строение и выполняют различные взаимодополняющие функции. Поэтому, несмотря на морфологические и функциональные отличия этих элементов, вакуолярная система клетки представляет собой единое целое.
2. Эндоплазматическая сеть, структура и функции
Эндоплазматический ретикулум (от лат. ретикулум – сеть), эндоплазматическая сеть. Эндоплазматическая сеть была открыта К. Портером с сотрудниками в 1945 г. при изучении фибробластов цыплят. Дальнейшие исследования показали, что эта структура встречается практически во всех эукариотных клетках. Эндоплазматическая сеть представляет собой систему мелких канальцев, цистерн и пузырьков, пронизывающих всю цитоплазму и связанных с плазмалеммой и кариолеммой.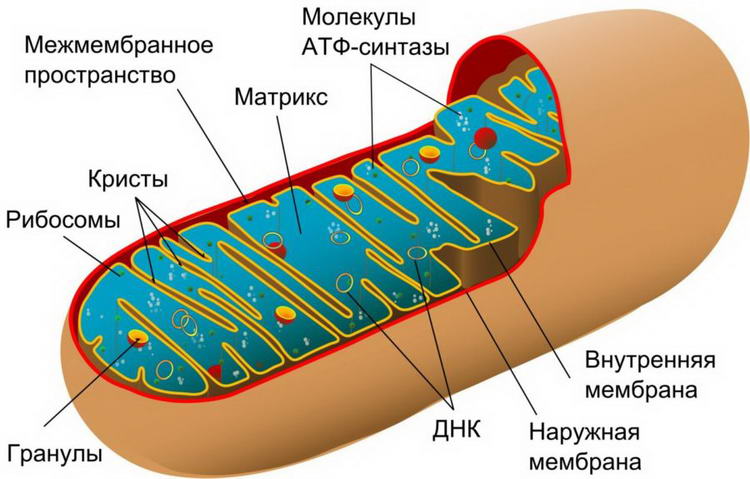 Эндоплазматическая сеть неоднородна по своему строению. Различают шероховатую (гранулярную) и гладкую (агранулярную) эндоплазматическую сеть.
Эндоплазматическая сеть неоднородна по своему строению. Различают шероховатую (гранулярную) и гладкую (агранулярную) эндоплазматическую сеть.
Гранулярная эндоплазматическая сеть (эргастоплазма). Гранулярная эндоплазматическая сеть представлена одиночными цистернами или их локальными скоплениями. Первый тип характерен для малоспециализированных клеток, а также для клеток с низкой метаболической активностью. Второй тип свойственен клеткам с высокой метаболической активностью (например, для клеток печени). Диаметр полостей цистерн варьирует от 20 нм до нескольких мкм и также зависит от метаболической активности клеток. Отличительной чертой эргастоплазмы является наличие на наружной поверхности мембран мелких (около 20 нм) гранул. Эти гранулы представляют собой рибосомы, собранные в виде плоских спиралей, розеток или гроздей. Такие структуры носят название полирибосомы (множество рибосом, объединенных одной информационной РНК).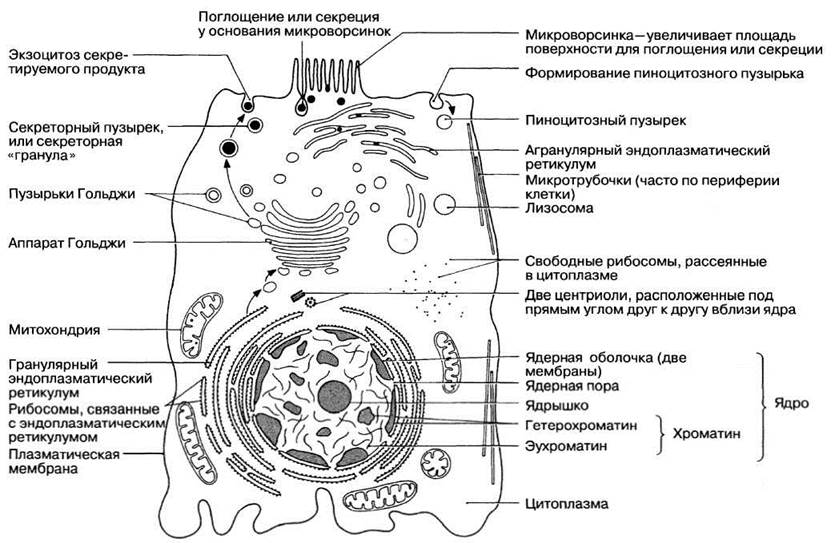 К мембранам эндоплазматической сети рибосомы прикрепляются своей большой субъединицей. Количество рибосом на эндоплазматической сети зависит от синтетической активности, степени дифференциации и физиологического состояния клеток. Например, при частичном удалении печени у грызунов значительно увеличивается деление клеток в оставшейся части. Это сопровождается редукцией эргастоплазмы и уменьшением числа рибосом. При патологии клеток также происходит уменьшение количества рибосом на мембранах эндоплазматической сети. Так при алкогольной хронической интоксикации количество рибосом, связанных с мембранами эндоплазматической сети, уменьшается на 25%.
К мембранам эндоплазматической сети рибосомы прикрепляются своей большой субъединицей. Количество рибосом на эндоплазматической сети зависит от синтетической активности, степени дифференциации и физиологического состояния клеток. Например, при частичном удалении печени у грызунов значительно увеличивается деление клеток в оставшейся части. Это сопровождается редукцией эргастоплазмы и уменьшением числа рибосом. При патологии клеток также происходит уменьшение количества рибосом на мембранах эндоплазматической сети. Так при алкогольной хронической интоксикации количество рибосом, связанных с мембранами эндоплазматической сети, уменьшается на 25%.
Функции гранулярной эндоплазматической сети заключаются в следующем:
1. Синтез белков. Причем рибосомы эргастоплазмы участвуют преимущественно в синтезе «экспортируемых» белков. Например, клетки слюнной железы синтезируют и выделяют пищеварительные ферменты; клетки молочной железы – казеин и др. Т. е. на мембранах эргастоплазмы синтезируются белки, необходимые для жизнедеятельности других клеток или для выполнения общеорганизменных функций (пищеварительные ферменты, белки плазмы крови, гормоны и др.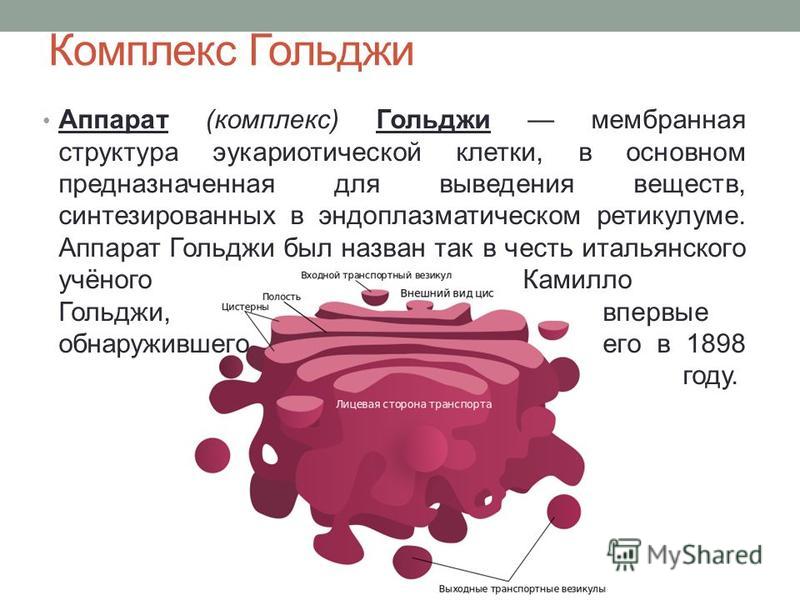 ). Следует отметить, что в большинстве случаев на рибосомах эргастоплазмы синтезируются белки, «ненужные» ей или даже вредные для клетки. Так, например, для роста и размножения клеток молочной железы совсем не нужен казеин молока, который они синтезируют. Клетки пищеварительных желез вырабатывают большое количество гидролитических ферментов, расщепляющих различные биологические макромолекулы. Свободный выход таких ферментов в цитоплазму вызовет самопереваривание клетки (автолиз).
). Следует отметить, что в большинстве случаев на рибосомах эргастоплазмы синтезируются белки, «ненужные» ей или даже вредные для клетки. Так, например, для роста и размножения клеток молочной железы совсем не нужен казеин молока, который они синтезируют. Клетки пищеварительных желез вырабатывают большое количество гидролитических ферментов, расщепляющих различные биологические макромолекулы. Свободный выход таких ферментов в цитоплазму вызовет самопереваривание клетки (автолиз).
2. Изоляция синтезированных белков от основных функционирующих белков клетки. Эта функциональная особенность гранулярного ЭР очень важна, так как она связана с целым рядом процессов, приводящих к выделению таких белков с помощью вакуолей аппарата Гольджи.
3. Транспорт синтезированных белков в другие участки клетки и комплекс Гольджи. Синтезированные белки перемещается по каналам и вакуолям от места синтеза в другие участки клетки. Белки, накапливающиеся в полостях ЭР, затем оказываются транспортированными в вакуоли аппарата Гольджи, откуда они переходят в другие вакуоли или выводятся из клетки.
4. Химическая модификация синтезированных белков. В ряде случаев в эргастоплазме может происходить химическая модификация белков, в частности связывание их с сахарами (глюкозилирование).
5. Синтез структурных компонентов клеточных мембран. Важнейшей функцией гранулярного ЭР является функция образования структурных компонентов клеточных мембран. Эта функция заключается в том, что элементы гранулярного ЭР синтезируют все мембранные белки, а также липидный компонент мембран. Кроме того, именно в гранулярной эндоплазматической сети происходит сборка липопротеидных мембран.
Гладкая эндоплазматическая сеть. Представлена мембранами, образующими мелкие вакуоли, трубочки и ветвящиеся канальцы. Диаметр вакуолей и канальцев гладкой эндоплазматической сети составляет обычно около 50-100 нм. В отличие от гранулярной эндоплазматической сети на мембранах гладкой эндоплазматической сети нет рибосом. Гладкая эндоплазматическая сеть возникает и развивается за счет эргастоплазмы. Деятельность гладкой эндоплазматической сети связана с метаболизмом липидов и некоторых внутриклеточных полисахаридов. Она сильно развита в клетках, секретирующих стероиды. В поперечно-полосатых мышечных волокнах гладкая эндоплазматическая сеть способна депонировать ионы кальция, необходимые для функции мышечной ткани. Очень важна роль гладкой эндоплазматической сети в дезактивации различных вредных для организма веществ за счет их окисления с помощью ряда специальных ферментов. Особенно сильно она проявляется в клетках печени. Так, при ряде отравлений в клетках печени появляются зоны, занятые лишь гладким эндоплазматическим ретикулумом.
Деятельность гладкой эндоплазматической сети связана с метаболизмом липидов и некоторых внутриклеточных полисахаридов. Она сильно развита в клетках, секретирующих стероиды. В поперечно-полосатых мышечных волокнах гладкая эндоплазматическая сеть способна депонировать ионы кальция, необходимые для функции мышечной ткани. Очень важна роль гладкой эндоплазматической сети в дезактивации различных вредных для организма веществ за счет их окисления с помощью ряда специальных ферментов. Особенно сильно она проявляется в клетках печени. Так, при ряде отравлений в клетках печени появляются зоны, занятые лишь гладким эндоплазматическим ретикулумом.
3. Комплекс Гольджи, структурная организация и значение
Комплекс Гольджи (аппарат Гольджи). В 1898 г. итальянский ученый К. Гольджи выявил в нервных клетках сетчатые образования. Позднее эти структуры были обнаружены практически во всех клетках эукариот и их стали называть комплексом Гольджи. Это обусловлено большим многообразием функций, которые выполняет этот органоид. Так практически любые клетки должны постоянно обновлять поверхностные мембраны, образовывать лизосомы. Во всех этих процессах важнейшая роль принадлежит комплексу Гольджи. Несмотря на разнообразие формы этого органоида, строение его сходно в клетках эукариот. Структурной единицей органоида является диктиосома. В диктиосоме плотно друг к другу расположены 5-10 плоских цистерн, между которыми располагаются тонкие прослойки цитоплазмы. Каждая цистерна имеет переменную толщину. В центре мембраны могут быть сближены (до 25 нм), а на периферии иметь расширения. Кроме плотно расположенных плоских цистерн, в зоне комплекса Гольджи наблюдается множество мелких пузырьков (везикул), которые встречаются главным образом в его периферических участках. В зоне диктиосомы различают проксимальный и дистальный участки. В секретирующих клетках проксимальная часть обычно обращена к ядру, дистальная — к поверхности клетки. В проксимальном участке к цистернам примыкает зона мелких гладких пузырьков и коротких мембранных цистерн.
Так практически любые клетки должны постоянно обновлять поверхностные мембраны, образовывать лизосомы. Во всех этих процессах важнейшая роль принадлежит комплексу Гольджи. Несмотря на разнообразие формы этого органоида, строение его сходно в клетках эукариот. Структурной единицей органоида является диктиосома. В диктиосоме плотно друг к другу расположены 5-10 плоских цистерн, между которыми располагаются тонкие прослойки цитоплазмы. Каждая цистерна имеет переменную толщину. В центре мембраны могут быть сближены (до 25 нм), а на периферии иметь расширения. Кроме плотно расположенных плоских цистерн, в зоне комплекса Гольджи наблюдается множество мелких пузырьков (везикул), которые встречаются главным образом в его периферических участках. В зоне диктиосомы различают проксимальный и дистальный участки. В секретирующих клетках проксимальная часть обычно обращена к ядру, дистальная — к поверхности клетки. В проксимальном участке к цистернам примыкает зона мелких гладких пузырьков и коротких мембранных цистерн. Дистальная часть характеризуется наличием крупных вакуолей, часто содержащих продукты клеточной секреции. Мембраны проксимальной и дистальной частей различаются по толщине: первые имеют толщину 6-7 нм, вторые — до 10 нм. Мембраны комплекса Гольджи образуются при участии гранулярной эндоплазматической сети.
Дистальная часть характеризуется наличием крупных вакуолей, часто содержащих продукты клеточной секреции. Мембраны проксимальной и дистальной частей различаются по толщине: первые имеют толщину 6-7 нм, вторые — до 10 нм. Мембраны комплекса Гольджи образуются при участии гранулярной эндоплазматической сети.
Во время деления клеток диктиосомы пассивно и случайно распределяются по дочерним клеткам. При росте клеток общее количество диктиосом увеличивается.
Комплекс Гольджи выполняет в клетке разнообразные функции:
1. Концентрация и уплотнение экзогенных и эндогенных веществ (упаковочный центр). Эта функция комплекса Гольджи заключается в том, что синтезированный на рибосомах эргастоплазмы белок отделяется и накапливается внутри цистерн эндоплазматической сети. По цистернам он транспортируется к зоне мембран пластинчатого комплекса. После концентрации и уплотнения от ампулярных расширений цистерн комплекса Гольджи отщепляются пузырьки, содержащие эти белки.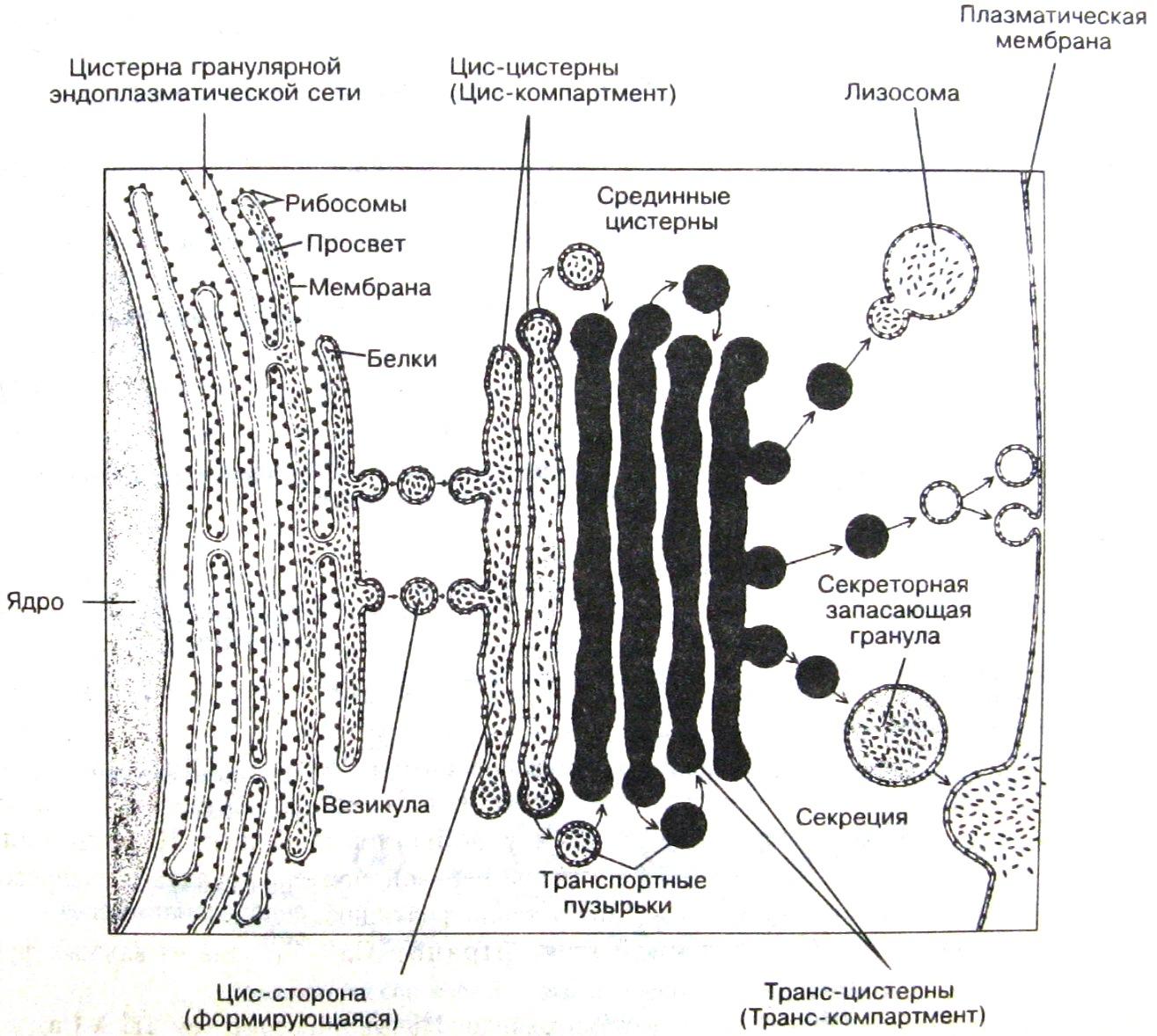 Такие везикулы также могут сливаться друг с другом и увеличиваться в размерах, образуя секреторные гранулы. После этого секреторные гранулы передвигаются к плазмолеммы, и, таким образом, содержимое гранул оказывается за пределами клетки. При этом процессе отдельные мелкие пузырьки с готовым продуктом отделяются от диктиосом. Затем они или разносятся по цитоплазме для внутреннего потребления клетки или сливаются в секреторные вакуоли. Эти вакуоли двигаются к поверхности клетки, где их мембрана сливается с плазматической и таким образом осуществляется выделение содержимого этих вакуолей за пределы клетки. Таким образом, аппарат Гольджи является промежуточным звеном между собственно синтезом секретируемого белка и выведением его из клетки.
Такие везикулы также могут сливаться друг с другом и увеличиваться в размерах, образуя секреторные гранулы. После этого секреторные гранулы передвигаются к плазмолеммы, и, таким образом, содержимое гранул оказывается за пределами клетки. При этом процессе отдельные мелкие пузырьки с готовым продуктом отделяются от диктиосом. Затем они или разносятся по цитоплазме для внутреннего потребления клетки или сливаются в секреторные вакуоли. Эти вакуоли двигаются к поверхности клетки, где их мембрана сливается с плазматической и таким образом осуществляется выделение содержимого этих вакуолей за пределы клетки. Таким образом, аппарат Гольджи является промежуточным звеном между собственно синтезом секретируемого белка и выведением его из клетки.
2. Образование и регенерация плазматической мембраны. Так в полости комплекса Гольджи поступают молекулы целлюлозы, которые перемещаются на поверхность клетки и включаются в клеточную оболочку. В аппарате Гольджи растительных клеток происходит синтез полисахаридов матрикса клеточной стенки (гемицеллюлозы, пектины).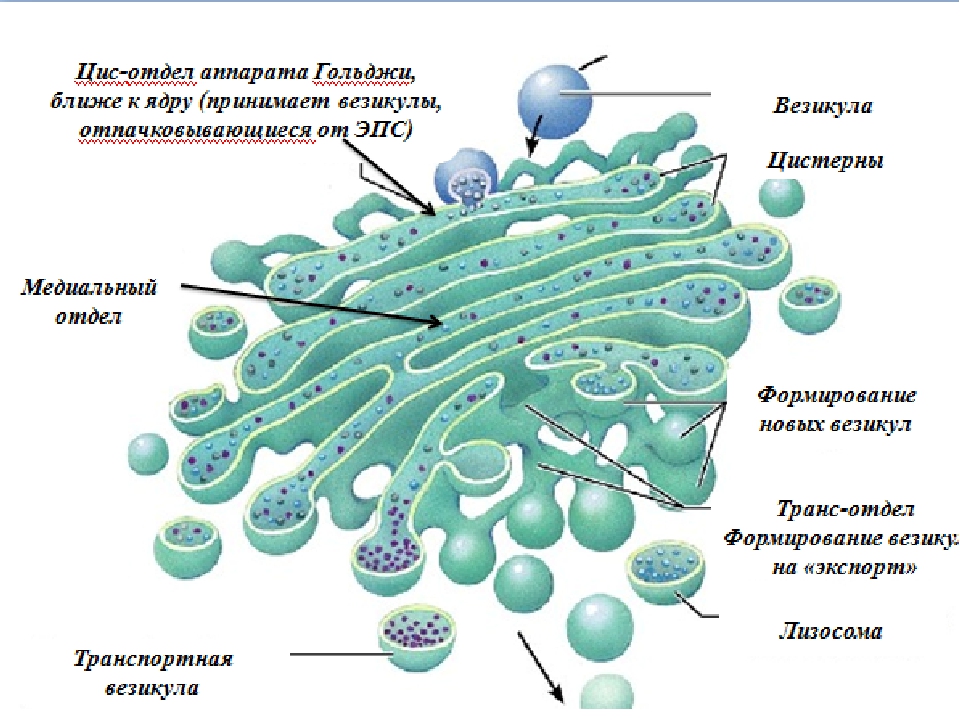
3. Модификация белков. В зоне комплекса Гольджи большинство белков подвергается модификации, заключающейся в образовании гликопротеидов и липопротеидов.
4. Образование первичных лизосом.
4. Лизосомы, классификация, строение и значение
Лизосомы (греч. “лизео” — растворяю, “сома” — тело). Лизосомы были открыты в 1955 г. французским ученым де Дювом при изучении клеток печени методом фракционного центрифугирования. В дальнейшем применение биохимических, цитохимических и электронно-микроскопических методов позволило детально изучить строение, функционирование и происхождение этих структур. Лизосомы представляют собой пузырьки диаметром от 0,2 до 1 мкм, содержащие различные ферменты. Всего в лизосомах обнаружено около 50 гидролитических ферментов (протеиназы, нуклеазы, глюкозидазы, фосфатазы, липазы и др.). Маркерным ферментом является кислая фосфатаза. Это самые мелкие мембранные органоиды, встречающиеся практически у всех эукариот. Однако частота встречаемости лизосом варьирует в зависимости от типа клеток. Так в тканях животных лизосомы чаще встречаются в клетках, поглощающих белковые и другие вещества. Это клетки кровеносной системы, клетки печени и почек.
Однако частота встречаемости лизосом варьирует в зависимости от типа клеток. Так в тканях животных лизосомы чаще встречаются в клетках, поглощающих белковые и другие вещества. Это клетки кровеносной системы, клетки печени и почек.
Образование лизосом происходит за счет деятельности эндоплазматической сети и комплекса Гольджи. Основная функция их заключается в участии в процессах внутриклеточного расщепления как экзогенных, так и эндогенных биологических макромолекул.
Среди лизосом можно выделить три основных типа: первичные лизосомы, вторичные лизосомы, остаточные тельца.
Первичные лизосомы. В первичных лизосомах содержатся неактивные ферменты. Эти ферменты синтезируются в гранулярной эндоплазматической сети. Затем они поступают в комплекс Гольджи, где упаковываются в мелкие мембранные пузырьки – первичные лизосомы.
Вторичные лизосомы. При соединении первичной лизосомы с фагоцитарными или пиноцитозными вакуолями образуются вторичные лизосомы. При этом содержимое первичной лизосомы сливается с содержимым эндоцитозной вакуоли. В дальнейшем под действием ферментов первичной лизосомы поглощенный материал постепенно расщепляется до мономеров. Мономеры транспортируются через мембрану лизосомы в цитоплазму, где они включаются в метаболизм клетки. Например, при введении в организм мыши чужеродного белка пероксидазы наблюдается накопление его в эндоцитозных вакуолях. С этими вакуолями соединяются первичные лизосомы, обладающие кислой фосфатазой. В образовавшейся новой вакуоли обнаруживается как пероксидазная, так и фосфатазная активность.
При этом содержимое первичной лизосомы сливается с содержимым эндоцитозной вакуоли. В дальнейшем под действием ферментов первичной лизосомы поглощенный материал постепенно расщепляется до мономеров. Мономеры транспортируются через мембрану лизосомы в цитоплазму, где они включаются в метаболизм клетки. Например, при введении в организм мыши чужеродного белка пероксидазы наблюдается накопление его в эндоцитозных вакуолях. С этими вакуолями соединяются первичные лизосомы, обладающие кислой фосфатазой. В образовавшейся новой вакуоли обнаруживается как пероксидазная, так и фосфатазная активность.
Разновидностью вторичных лизосом являются аутолизосомы (аутофагосомы), которые постоянно встречаются в клетках простейших, растений и животных. В отличие от обычных вторичных лизосом в аутолизосомах встречаются фрагменты или даже целые цитоплазматические структуры (митохондрии, пластиды, рибосомы и т. д.). Функциональное значение их заключается в уничтожении дефектных структур клетки.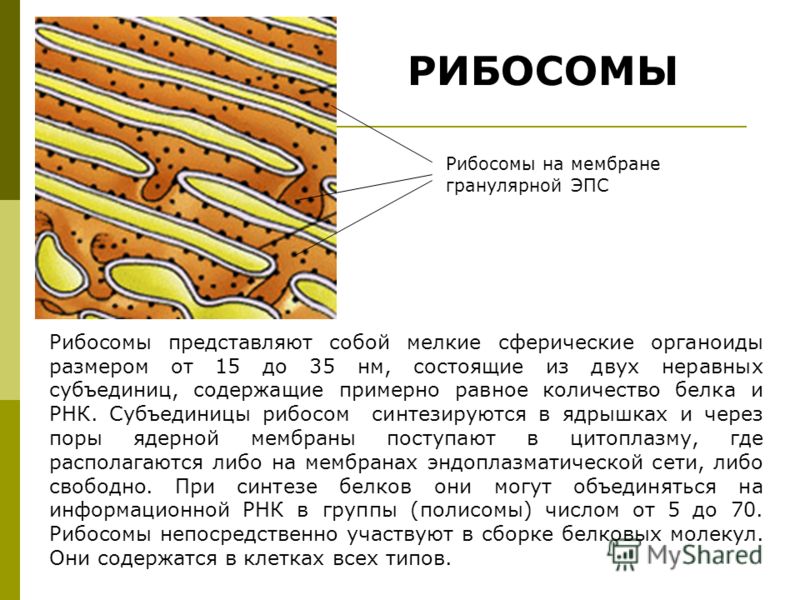 Число аутофагосом возрастает при метаболических стрессах и различных повреждениях клеток.
Число аутофагосом возрастает при метаболических стрессах и различных повреждениях клеток.
Остаточные тельца, или телолизосомы. В ряде случаев переваривание биогенных макромолекул внутри лизосом может идти не до конца. В этом случае в полостях лизосом накапливаются непереваренные продукты. Такие лизосомы называют остаточными тельцами. Судьба остаточных телец может быть различной: одни из них выбрасываются из клетки путем экзоцитоза, другие же остаются в клетках вплоть до их гибели (например, липофусциновые гранулы). Так у простейших остаточные тельца выделяются во внешнюю среду. У человека при старении организма в остаточных тельцах клеток мозга, печени, мышечных волокон накапливается «пигмент старения» — липофусцин. Остаточные тельца содержат меньше гидролитических ферментов, в них происходит уплотнение содержимого, его перестройка. Часто в остаточных тельцах наблюдается вторичная структуризация неперевариваемых липидов, которые образуют слоистые структуры.
Функции лизосом
1. Внутриклеточное пищеварение. Это основная функция лизосом. За эту функцию лизосомы часто называют «пищеварительными станциями» клетки.
Внутриклеточное пищеварение. Это основная функция лизосом. За эту функцию лизосомы часто называют «пищеварительными станциями» клетки.
2. Изменение клеточных продуктов. Например, благодаря лизосомам, в клетках щитовидной железы происходит преобразование тироглобулина в тироксин.
3. Переваривание дефектных клеточных органоидов. В некоторых случаях лизосомы также могут переварить отдельные органы. Например, исчезновение хвоста у головастика лягушек происходит под действием ферментов лизосом.
5. Вакуолярная система клеток растений
Вакуоли (от лат. vacuus – пустой) – полости в цитоплазме растительных клеток, ограниченные мембраной и заполненные жидкостью. Вакуоли содержатся в клетках как низших, так и высших растений. В последнем случае они достигают наибольшего развития. Вакуоли образуются в эндоплазматической сети и из пузырьков комплекса Гольджи. В молодых клетках вакуоли представлены системой мелких провакуолей. По мере роста и дифференцировки клетки провакуоли сливаются в одну или несколько крупных центральных вакуолей, занимающих основной объем клетки. В результате цитоплазма с ядром и органоидами оттесняется к периферии клетки. В зависимости от типа и возраста клеток вакуоли занимают от 5 до 95% объема клетки. Чаще всего это величина составляет свыше 50% объема клетки. От цитоплазмы центральные вакуоли отделены тонкой (около 10 нм) одинарной мембраной, которая называется тонопласт. Полость вакуоли заполнена клеточным соком. Клеточный сок представляет собой водный раствор, в котором находятся различные неорганические соли, сахара, органические кислоты и их соли, а также другие низкомолекулярные и высокомолекулярные соединения.
По мере роста и дифференцировки клетки провакуоли сливаются в одну или несколько крупных центральных вакуолей, занимающих основной объем клетки. В результате цитоплазма с ядром и органоидами оттесняется к периферии клетки. В зависимости от типа и возраста клеток вакуоли занимают от 5 до 95% объема клетки. Чаще всего это величина составляет свыше 50% объема клетки. От цитоплазмы центральные вакуоли отделены тонкой (около 10 нм) одинарной мембраной, которая называется тонопласт. Полость вакуоли заполнена клеточным соком. Клеточный сок представляет собой водный раствор, в котором находятся различные неорганические соли, сахара, органические кислоты и их соли, а также другие низкомолекулярные и высокомолекулярные соединения.
В растительной клетке вакуоли выполняют многообразные функции:
· Регуляция водно-солевого обмена.
· Поддержание тургорного давления в клетке. Тургор – это напряженное состояние клеточной оболочки, создаваемое гидростатическим давлением внутриклеточной жидкости.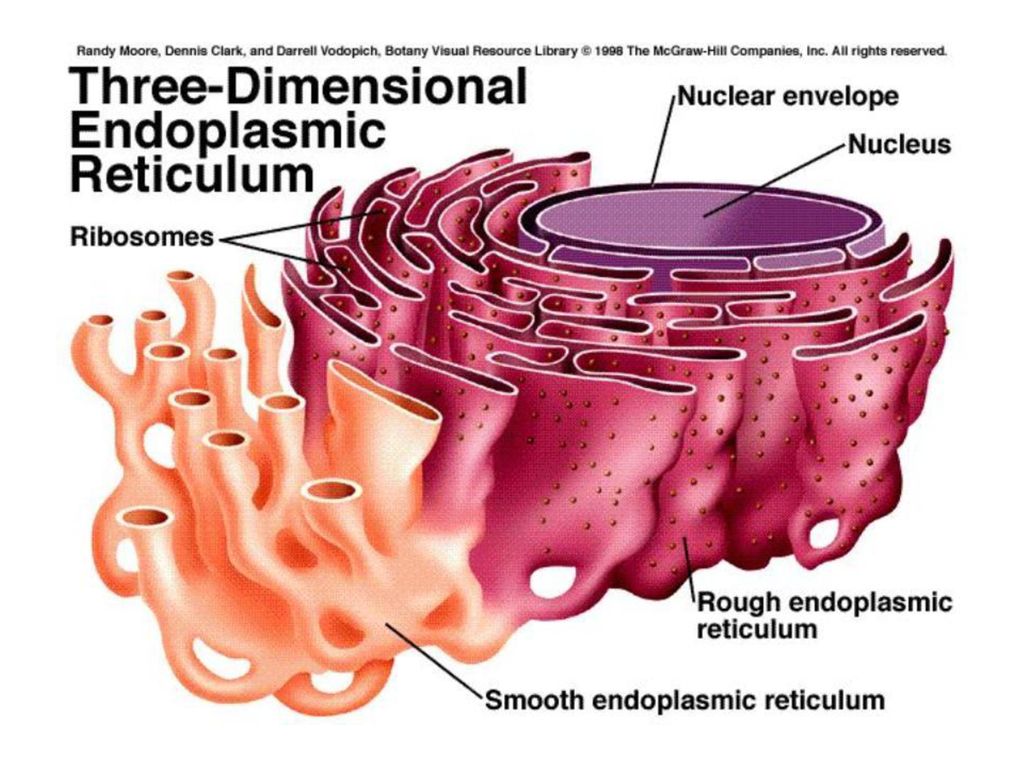 В сочетании с жесткой клеточной стенкой тургорное давление придает растительным клеткам большую прочность. Это позволяет достигать им больших размеров по сравнению с клетками животных. Все процессы увядания, автолиза и старения сопровождаются снижением тургорного давления.
В сочетании с жесткой клеточной стенкой тургорное давление придает растительным клеткам большую прочность. Это позволяет достигать им больших размеров по сравнению с клетками животных. Все процессы увядания, автолиза и старения сопровождаются снижением тургорного давления.
· Накопление различных веществ. Из органических веществ в вакуолях накапливаются углеводы и белки. Запасание белков особенно характерно для семян. Происходит оно в алейроновых вакуолях, которые после заполнения белками обезвоживаются и превращаются в твердые алейроновые зерна. При прорастании семян эти зерна обводняются и снова превращаются в вакуоли. Из неорганических веществ в вакуолярном соке накапливаются фосфаты калия, натрия, кальция, могут накапливаться соли органических кислот (оксалаты, цитраты и др.) Это придает вакуолярному соку кислую реакцию (рН от 2 до 5). В вакуолях могут накапливаться «красящие» вещества. Так антоцианы придают окраску лепесткам цветков, что способствует привлечению насекомых-опылителей. Возможно также накопление ядовитых веществ, которые предохраняют их от поедания травоядными животными. При повреждении клеток эти вещества высвобождаются из вакуолей и оказывают негативное действие на организм животного.
· Выведение экскреторных веществ. Вакуоли используются не только для накопления различных веществ, но и для экскреции их из клетки. Так выводятся из клетки все водорастворимые метаболиты. Нерастворимые в воде органические компоненты могут превращаться в растворимые глюкозиды, соединяясь с молекулами сахаров.
Введение в биологию (X) — caenogenesis — LiveJournal
Тема XЭУКАРИОТЫ
А сейчас поговорим об одной особой группе живых организмов, которая называется эукариотами. Вообще-то это название нам уже знакомо. Напомню, что эукариоты — один из трех доменов общепринятого древа жизни, наравне с бактериями и археями (вирусы пока не в счет). Причем на эволюционных деревьях, построенных по молекулярным данным, эукариоты однозначно ближе к археям, чем к бактериям. Архей и бактерий вместе называют прокариотами, но это не эволюционная ветвь, а просто сборный термин, образуемый методом исключения: мол, есть эукариоты, а есть все остальные.
Самые древние предполагаемые эукариоты, остатки которых удалось найти палеонтологам, имеют возраст 2,2 миллиарда лет (Retallack et al., 2013). А наиболее вероятный возраст самых древних следов жизни — 3,8 миллиарда лет. Это означает, что в течение больше чем полутора миллиардов лет биосфера Земли прекрасно обходилась без эукариот.
Если для начала кратко просуммировать основные отличия эукариотной клетки от прокариотной, получится примерно следующий список:
● Большой размер клеток: средний одноклеточный эукариот примерно раз в десять крупнее среднего прокариота.
● ДНК заключена в ядро, окруженное оболочкой из двух мембран.
● ДНК линейна, в отличие от кольцевой ДНК бактерий и архей.
● Клетка пронизана сложной системой внутренних мембранных полостей и пузырьков (эндоплазматическая сеть, аппарат Гольджи, вакуоли).
● Есть система внутриклеточных опорно-двигательных структур, называемая цитоскелетом.
● Распространены дополнительные органеллы, окруженные собственной мембраной — митохондрии (производят дыхание) и пластиды (производят фотосинтез).
Начнем с самого общего. В любой эукариотной клетке есть система взаимосвязанных мембранных полостей и каналов, которая называется эндоплазматической сетью (ЭПС). На шероховатой ЭПС сидят рибосомы, на гладкой нет. Основные функции ЭПС — синтез и транспорт белков и липидов.
Благодаря ЭПС и другим мембранным органеллам эукариотная клетка очень сильно компартментализована, то есть разделена на отсеки, переход веществ между которыми возможен только с участием специальных транспортных белков. Это гораздо более фундаментальная особенность, чем может показаться на первый взгляд. Прокариотную клетку можно рассматривать как единый мешок с раствором (пусть и вязким), а вот эукариотную — совершенно точно нельзя. Внутри прокариотной клетки ДНК, белки и другие молекулы могут перемещаться путем простой физической диффузии, как в любом растворе. В эукариотной клетке такое невозможно в принципе, там практически все молекулы добираются от места синтеза до «места работы» с помощью сложных транспортных систем, обеспечивающих направленные переходы из отсека в отсек. Все это означает, что у эукариотной клетки гораздо выше внутренняя упорядоченность, или, говоря научным языком — ниже энтропия. С физической точки зрения более фундаментальное отличие трудно придумать (Кунин, 2014).
Специализированное замкнутое разрастание ЭПС, заключающее в себе почти всю клеточную ДНК, называется ядром. Пространство между двумя мембранами ядра является непосредственным продолжением внутренней полости ЭПС. Во избежание путаницы скажем, что ДНК находится не в этой полости, а снаружи от нее, между причудливо сомкнутыми цистернами ЭПС, образующими нечто шарообразное. Часть содержимого клетки, находящаяся снаружи от ядра, называется цитоплазмой. Транспорт из ядра в цитоплазму и обратно происходит через ядерные поры — сложные белковые комплексы, пронизывающие обе ядерные мембраны и избирательно пропускающие молекулы. Белки, образующие ядерные поры, называются нуклеопоринами. Основное содержимое ядра — ДНК, ассоциированная с белками (хроматин). Важнейшие (хотя далеко не единственные) белки, взаимодействующие с ядерной ДНК эукариот — гистоны, на которые она буквально наматывается. В гистонах всегда много лизина и аргинина — положительно заряженных аминокислот, заряды которых облегчают взаимодействие с ДНК (ее молекула заряжена, как мы помним, отрицательно). Кроме того, гистоны часто подвергаются дополнительным химическим модификациям, которые бывают важны для регуляции экспрессии генов. Особая часть ядра — ядрышко, где формируются субъединицы рибосом; в целые рибосомы они собираются уже в цитоплазме, потому что целая рибосома не пройдет сквозь ядерную пору.
Клеточное ядро — важнейший признак эукариот. Собственно, «эукариоты» буквально и значит «обладающие настоящим ядром». На самом деле оговорка насчет «настоящего» тут не нужна, потому что у прокариот никакого ядра просто нет. И, с другой стороны, у всех современных эукариот ядро полностью сформировано, так что никаких переходных состояний мы тут не видим. Происхождение ядра — одна из самых больших эволюционных загадок.
Любая находящаяся внутри клетки полость, ограниченная мембраной, называется вакуолью. Строго говоря, вся эндоплазматическая сеть — не что иное, как сложная система ветвящихся, сливающихся, переходящих друг в друга вакуолей. Но в любой эукариотной клетке есть и множество мелких вакуолей, функции которых очень разнообразны. Они могут служить для переваривания захваченных клеткой пищевых объектов (пищеварительная вакуоль), для собирания и удаления лишней воды (сократительная вакуоль) или просто для транспорта разных веществ. Специализированная транспортная система эукариотной клетки — аппарат Гольджи — представляет собой стопку крупных плоских вакуолей, от краев которых могут отшнуровываться подвижные маленькие вакуоли. Разные молекулы «упаковываются» в эти вакуоли и отправляются в них по назначению.
Сложные формы клеток эукариот и все типы их внутриклеточной подвижности возможны благодаря цитоскелету, который делится на микротрубочки (состоят из белка тубулина), микрофиламенты (состоят из белка актина) и промежуточные филаменты (имеют разнообразный состав).
Микротрубочки представляют собой полые цилиндры, собранные из множества молекул тубулина, которые бывают нескольких типов, например α- и β-тубулин (они кодируются отдельными генами). Сборка и разборка микротрубочек питается энергией за счет расщепления ГТФ. Микротрубочки придают клеткам постоянную форму, а также с помощью специальных двигательных белков участвуют в клеточном делении, служат “рельсами” для перемещения вакуолей и образуют основу жгутиков и ресничек. Последние есть, например, у одноклеточных эукариот, попавших в школьный учебник зоологии — эвглены зеленой (жгутики) и инфузории-туфельки (реснички). Внутри каждого жгутика и каждой реснички проходит строго определенным образом устроенный пучок микротрубочек.
Микрофиламенты — это нити из актина, более тонкие, чем микротрубочки, но зато способные сокращаться с помощью белка миозина, расщепляющего АТФ. На самом деле эта формулировка неточна: отдельные микрофиламенты не сокращаются, а скользят по миозину относительно других микрофиламентов таким образом, что в результате вся клетка или ее часть меняет форму — например, становится короче. От микрофиламентов зависит большинство видов клеточной подвижности, в том числе амебоидное движение и мышечное сокращение.
Тестирование по биологии 9 класс по теме «ЭПС, рибосомы, Комплекс Гольджи, лизосомы
Тесты 9 класс по теме «Кариотип. ЭПС, рибосомы, комплекс Гольджи, лизосомы»
№1
Что такое кариотип? Диплоидный набор клетки. В каких клетках тела он встречается? Кков он у человека?
Строение, химическийсостав и функции рибосом.
Распределите особенности строения и значение междуорганоидами клетки:
1) ЭПС А) система мембранных мешочков и полостей с пузырьками
2) Комплекс Гольджи Б) одномембранные пузырьки с литирующими ферментами
3) Лизосомы В)мембранные каналы, образующие единую транспортную систему
Г) накопление белка,синтезуглеводов и липидов и транспортировка их
Д) сортировка и упаковка белков, углеводов, липидов мембранные мешочки
Е) расщепляют биополимеры до мономеров и растворяют ненужные структуры клеткии
№2
1.Что такое кариотип? Гаплоидный набор клетки. В каких клетках тела он встречается? Кков он у человека?
2.Строение и функции Комплекса Гольджи.
3.Распределите особенности строения и значение междуорганоидами клетки:
1) ЭПС А) состоят из 2 субъединиц,РНК и белка
2) Рибосомы Б) одномембранные пузырьки с литирующими ферментами
3) Лизосомы В)мембранные каналы, образующие единую транспортную систему
Г) накопление белка,синтезуглеводов и липидов и транспортировка их
Д) синтез белков
Е) расщепляют биополимеры до мономеров и растворяют ненужные структуры клеткии
№3
1.Что такое кариотип? Какие хромосомы называются гомологичными?
2.Строение и функции ЭПС
3.Распределите особенности строения и значение междуорганоидами клетки:
1)Комплекс Гольджи А) состоят из 2 субъединиц,РНК и белка
2) Рибосомы Б) одномембранные пузырьки с литирующими ферментами
3) Лизосомы В) система мембранных мешочков и полостей с пузырьками
Г) сортировка и упаковка белков, углеводов, липидов мембранные мешочки
Д) синтез белков
Е) расщепляют биополимеры до мономеров и растворяют ненужные структуры клеткии
№4
1.Что такое кариотип? Что такое аутосомы?
2.Строение и функции лизосом
3.Распределите особенности строения и значение между органоидами клетки:
1)Комплекс Гольджи А) состоят из 2 субъединиц,Р НК и белка
2) Рибосомы Б) мембранные каналы, образующие единую транспортную систему
3)ЭПС В) система мембранных мешочков и полостей с пузырьками
Г) сортировка и упаковка белков, углеводов, липидов мембранные мешочки
Д) синтез белков
Е) накопление белка, синтез углеводов и липидов и транспортировка их
№5
1.Что такое кариотип? Какие пары хромосом называют аутосомами? Сколько их у человека?
2.Строение, химический состав и функции рибосом.
3.Какие 2 критерия соответствуют Комплексу Гольджи?
А) система мембранных мешочков и полостей с пузырьками
Б) одномембранные пузырьки с литирующими ферментами
В)мембранные каналы, образующие единую транспортную систему
Г) накопление белка, синтез углеводов и липидов и транспортировка их
Д) сортировка и упаковка белков, углеводов, липидов мембранные мешочки
Е) расщепляют биополимеры до мономеров и растворяют ненужные структуры клеткии
№6
1.Что такое кариотип? Какие пары хромосом называют половыми? Сколько их у человека?
2.Строение, химическийсостав и функции ЭПС.
3.Какие 2 критерия соответствуют лизосмам?
А) система мембранных мешочков и полостей с пузырьками
Б) одномембранные пузырьки с литирующими ферментами
В)мембранные каналы, образующие единую транспортную систему
Г) накопление белка, синтез углеводов и липидов и транспортировка их
Д) сортировка и упаковка белков, углеводов, липидов мембранные мешочки
Е) расщепляют биополимеры до мономеров и растворяют ненужные структуры клетки
Эндоплазматическая сеть — Endoplasmic reticulum
Неправильная сеть мембран, прилегающих к внешней ядерной мембране в цитоплазме эукариот, которые образуют сеть трубчатых каналов, часто расширяющихся до цистерн.
Микрофотография грубой сети эндоплазматического ретикулума вокруг ядра (показана в правом нижнем углу рисунка). Темные кружочки в сети — митохондрии .Эндоплазматический ретикулум ( ЭР ) является, по существу, транспортной системой эукариотической клетки, и имеет много других важных функций , такие как сворачивания белка. Это тип органелл, состоящий из двух субъединиц — шероховатой эндоплазматической сети ( RER ) и гладкой эндоплазматической сети ( SER ). Эндоплазматический ретикулум встречается в большинстве эукариотических клеток и образует взаимосвязанную сеть уплощенных мембранных мешочков, известных как цистерны (в RER) и трубчатых структур в SER. Мембраны ER непрерывны с внешней ядерной мембраной . Эндоплазматический ретикулум не обнаруживается ни в эритроцитах , ни в сперматозоидах .
Эти два типа ER имеют много одинаковых белков и участвуют в определенных общих действиях, таких как синтез определенных липидов и холестерина . Различные типы клеток содержат разные соотношения двух типов ER в зависимости от активности клетки.
Наружная ( цитозольная ) поверхность грубого эндоплазматического ретикулума усеяна рибосомами, которые являются участками синтеза белка . Грубый эндоплазматический ретикулум особенно заметен в таких клетках, как гепатоциты . В гладком эндоплазматическом ретикулуме отсутствуют рибосомы и отсутствуют функции синтеза липидов, но не метаболизма , производства стероидных гормонов и детоксикации . Гладкая эндоплазматическая сеть особенно распространена в клетках печени и гонад млекопитающих .
История
ER наблюдался с помощью светового микроскопа Гарнье в 1897 году, который ввел термин эргастоплазма . С помощью электронной микроскопии кружевные мембраны эндоплазматического ретикулума были впервые замечены в 1945 году Кейт Р. Портер , Альберт Клод и Эрнест Ф. Фуллам. Позднее слово reticulum , что означает «сеть», было использовано Портером в 1953 году для описания этой мембранной ткани.
Структура
1 Ядро 2 ядерных пор 3 шероховатой эндоплазматической сети (RER) 4 Гладкий эндоплазматический ретикулум (СЕР) 5 рибосом на шероховатой ER 6 белков , которые транспортируются 7 Транспорт везикулы 8 Гольджи 9 Cis поверхности аппарата Гольджи 10 Транс поверхности аппарата Гольджи 11 Цистерны аппарата Гольджи 3D-рендеринг эндоплазматической сетиОбщая структура эндоплазматической сети представляет собой сеть мембран, называемых цистернами . Эти похожие на мешочки структуры удерживаются вместе цитоскелетом . Фосфолипид мембрана окружает полостное пространство (или полость), которая является непрерывной с перинуклеарным пространством , но отдельно от цитозола . Функции эндоплазматического ретикулума можно резюмировать как синтез и экспорт белков и мембранных липидов, но они варьируются в зависимости от ER и типа клеток и функций клеток. Количество как грубого, так и гладкого эндоплазматического ретикулума в клетке может медленно меняться от одного типа к другому, в зависимости от меняющейся метаболической активности клетки. Трансформация может включать в себя внедрение новых белков в мембрану, а также структурные изменения. Изменения содержания белка могут происходить без заметных структурных изменений.
Шероховатой эндоплазматической сети
Двухминутная анимация, показывающая, как белок, предназначенный для секреторного пути , синтезируется в грубую эндоплазматическую сеть, которая появляется вверху справа примерно в середине анимации.Поверхность грубого эндоплазматического ретикулума (часто сокращенно RER или грубого ER ; также называемого гранулярным эндоплазматическим ретикулумом ) усеяна рибосомами, производящими белок, что придает ему «грубый» вид (отсюда и его название). Сайт связывания рибосомы на шероховатом эндоплазматическом ретикулуме — это транслокон . Однако рибосомы не являются стабильной частью структуры этой органеллы, поскольку они постоянно связываются и высвобождаются из мембраны. Рибосома связывается с RER только после того, как в цитозоле образуется специфический комплекс белок-нуклеиновая кислота. Это специальные сложные формы , когда свободная рибосома начинает переводить на мРНК белка , предназначенный для секреторного пути . Первые 5–30 полимеризованных аминокислот кодируют сигнальный пептид , молекулярное сообщение, которое распознается и связывается частицей распознавания сигнала (SRP). Паузы перевода и рибосома комплекса связывается с RER транслоконом , где перевод продолжается с зарождающимися (новыми) белками , образуя в просвет RER и / или мембрану. Белок обрабатывается в просвете ER ферментом (сигнальной пептидазой ), который удаляет сигнальный пептид. На этом этапе рибосомы могут быть выпущены обратно в цитозоль; однако известно, что нетранслирующиеся рибосомы остаются связанными с транслоконами.
Мембрана грубого эндоплазматического ретикулума образует большие двухмембранные листы, которые расположены рядом с внешним слоем ядерной оболочки и продолжаются с ним . Листы с двойной мембраной уложены друг на друга и соединены несколькими правосторонними или левосторонними спиральными пандусами, «пандусами Терасаки», в результате чего образуется структура, напоминающая многоэтажную автостоянку . Хотя между эндоплазматическим ретикулумом и аппаратом Гольджи нет непрерывной мембраны , связанные с мембраной транспортные везикулы перемещают белки между этими двумя компартментами. Везикулы окружены белками оболочки, называемыми COPI и COPII. COPII нацеливает пузырьки на аппарат Гольджи, а COPI отмечает их возвращение в грубый эндоплазматический ретикулум. Шероховатая эндоплазматическая сеть работает согласованно с комплексом Гольджи , чтобы предназначаться новые белки в их соответствующих направления. Второй метод транспорта из эндоплазматического ретикулума включает области, называемые участками контакта с мембраной , где мембраны эндоплазматического ретикулума и других органелл плотно прилегают друг к другу, обеспечивая перенос липидов и других небольших молекул.
Грубая эндоплазматическая сеть играет ключевую роль в выполнении нескольких функций:
- Производство лизосомальных ферментов с добавлением маннозо-6-фосфатного маркера в цис- сеть Гольджи.
- Производство секретируемых белков, секретируемых либо конститутивно без метки, либо секретируемых регуляторным образом с участием клатрина и парных основных аминокислот в сигнальном пептиде .
- Интегральные мембранные белки, которые остаются в мембране, когда везикулы выходят и связываются с новыми мембранами. Белки Rab играют ключевую роль в нацеливании на мембрану; Белки SNAP и SNARE являются ключевыми в событии слияния.
- Начальное гликозилирование по мере сборки продолжается. Это N-сцепление (O-связывание происходит в Golgi).
- N-связанное гликозилирование: если белок правильно уложен, олигосахарилтрансфераза распознает последовательность AA N X S или N X T (с фосфорилированным остатком S / T) и добавляет основную цепь из 14 сахаров (2- N- ацетилглюкозамин, 9-разветвление). манноза и 3- глюкоза в конце) к азоту боковой цепи Asn.
Гладкая эндоплазматическая сеть
Электромикрофотография, показывающая гладкий ER (стрелка) в ткани мыши, при увеличении 110 510 ×.В большинстве клеток гладкая эндоплазматическая сеть (сокращенно SER ) недостаточна. Вместо этого есть области, где ER частично гладкий и частично шероховатый, эта область называется переходной ER. Переходная ER получила свое название, потому что она содержит сайты выхода ER. Это области, где транспортные везикулы, содержащие липиды и белки, вырабатываемые в ER, отделяются от ER и начинают двигаться к аппарату Гольджи . Специализированные клетки могут иметь много гладкой эндоплазматической сети, и в этих клетках гладкая ЭПР выполняет множество функций. Он синтезирует липиды , фосфолипиды и стероиды . Клетки, которые секретируют эти продукты, такие как клетки яичек , яичников и сальных желез, имеют большое количество гладкой эндоплазматической сети. Он также осуществляет метаболизм углеводов, детоксикацию продуктов естественного метаболизма, алкоголя и наркотиков, прикрепление рецепторов к белкам клеточной мембраны и метаболизм стероидов . В мышечных клетках он регулирует концентрацию ионов кальция . Гладкая эндоплазматическая сеть присутствует в различных типах клеток (как животных, так и растений) и в каждом из них выполняет разные функции. Гладкая эндоплазматическая сеть также содержит фермент глюкозо-6-фосфатазу , который превращает глюкозо-6-фосфат в глюкозу, что является этапом глюконеогенеза . Он связан с ядерной оболочкой и состоит из канальцев, расположенных вблизи периферии клетки. Эти трубки иногда разветвляются, образуя сетчатую сеть. В некоторых клетках есть расширенные области, такие как мешочки грубого эндоплазматического ретикулума. Сеть гладкой эндоплазматической сети позволяет увеличить площадь поверхности для действия или хранения ключевых ферментов и продуктов этих ферментов.
Саркоплазматический ретикулум
Волокно скелетных мышц с саркоплазматической сетью, окрашенной в синий цвет.Саркоплазматический ретикулум (SR), от греческого σάρξ sarx («плоть»), представляет собой гладкий ER, обнаруженный в миоцитах . Единственное структурное различие между этой органеллой и гладкой эндоплазматической сетью — это смесь белков, которые у них есть, оба связаны с их мембранами и дрейфуют в пределах их просветов. Это фундаментальное различие указывает на их функции: эндоплазматический ретикулум синтезирует молекулы, в то время как саркоплазматический ретикулум накапливает ионы кальция и перекачивает их в саркоплазму при стимуляции мышечных волокон. После выхода из саркоплазматического ретикулума ионы кальция взаимодействуют с сократительными белками, которые используют АТФ для сокращения мышечного волокна. Саркоплазматический ретикулум играет важную роль в взаимодействии возбуждения и сокращения .
Функции
Эндоплазматический ретикулум выполняет множество общих функций, включая сворачивание белковых молекул в мешочки, называемые цистернами, и транспорт синтезированных белков в везикулах к аппарату Гольджи . Правильная укладка вновь образованных белков возможна благодаря нескольким шаперонным белкам эндоплазматического ретикулума , включая протеин-дисульфидизомеразу (PDI), ERp29, член семейства Hsp70 BiP / Grp78 , калнексин , кальретикулин и семейство пептидилпропилизомераз. Только правильно свернутые белки транспортируются из грубого ER в аппарат Гольджи — развернутые белки вызывают ответ развернутого белка как стрессовую реакцию в ER. Нарушения окислительно-восстановительной регуляции, регуляции кальция, депривация глюкозы и вирусная инфекция или чрезмерная экспрессия белков могут привести к стрессовой реакции эндоплазматического ретикулума (стресс ER), состоянию, при котором сворачивание белков замедляется, что приводит к увеличению развернутых белков. . Этот стресс становится потенциальной причиной повреждения при гипоксии / ишемии, инсулинорезистентности и других расстройствах.
Белковый транспорт
Секреторные белки, в основном гликопротеины , перемещаются через мембрану эндоплазматического ретикулума. Белки, которые транспортируются эндоплазматическим ретикулумом по клетке, помечаются адресной меткой, называемой сигнальной последовательностью . N-конец (один конец) полипептидной цепи (т. Е. Белка) содержит несколько аминокислот, которые работают как адресные метки, которые удаляются, когда полипептид достигает места назначения. Растущие пептиды достигают ER через транслокон , мультипротеиновый комплекс, заключенный в мембрану. Белки, предназначенные для мест за пределами эндоплазматического ретикулума, упаковываются в транспортные пузырьки и перемещаются по цитоскелету к месту назначения. В человеческих фибробластах ER всегда совместно распределяется с микротрубочками, и деполимеризация последних вызывает его коагрегацию с митохондриями, которые также связаны с ER.
Эндоплазматический ретикулум также является частью пути сортировки белков. По сути, это транспортная система эукариотической клетки. Большинство его резидентных белков удерживается внутри него за счет удерживающего мотива . Этот мотив состоит из четырех аминокислот в конце белковой последовательности. Наиболее распространенными удерживающими последовательностями являются KDEL для белков, расположенных в просвете, и KKXX для трансмембранного белка. Однако вариации KDEL и KKXX действительно встречаются, и другие последовательности также могут вызывать удержание эндоплазматического ретикулума. Неизвестно, может ли такое изменение привести к локализации суб-ER. В клетках млекопитающих имеется три рецептора KDEL ( 1 , 2 и 3 ), и они имеют очень высокую степень идентичности последовательностей. Функциональные различия между этими рецепторами еще предстоит установить.
Биоэнергетическая регуляция поставки ER ATP с помощью механизма CaATiER
Са2 + -антагонизированный транспорт в эндоплазматический ретикулум (CaATiER) модельЭндоплазматический ретикулум не поддерживает механизм регенерации АТФ и, следовательно, требует импорта АТФ из митохондрий. Импортированный АТФ жизненно важен для ЭР для выполнения своих клеточных функций, таких как сворачивание и транспортировка белков.
Транспортер АТФ в ER, SLC35B1 / AXER, был недавно клонирован и охарактеризован, и митохондрии поставляют АТФ в ER посредством транспорта, антагонизированного Ca 2+, в механизм ER ( CaATiER ). Механизм CaATiER показывает чувствительность к цитозольному Ca 2+ в диапазоне от высоких нМ до низких мкМ, при этом Ca 2+ -чувствительный элемент еще предстоит идентифицировать и проверить.
Клиническое значение
Нарушения XBP1 приводят к усилению стрессовой реакции эндоплазматического ретикулума и, следовательно, вызывают более высокую восприимчивость к воспалительным процессам, которые могут даже способствовать развитию болезни Альцгеймера . В толстой кишке аномалии XBP1 связаны с воспалительными заболеваниями кишечника, включая болезнь Крона .
Развернутом ответ белок (УПО) представляет собой клеточный ответ стресс , связанные с эндоплазматической сети. UPR активируется в ответ на накопление развернутых или неправильно свернутых белков в просвете эндоплазматического ретикулума. UPR функционирует, чтобы восстановить нормальную функцию клетки, останавливая трансляцию белка , разрушая неправильно свернутые белки и активируя сигнальные пути, которые приводят к увеличению продукции молекулярных шаперонов, участвующих в укладке белков . Устойчивая сверхактивация UPR связана с прионными заболеваниями, а также с некоторыми другими нейродегенеративными заболеваниями, и ингибирование UPR может стать лечением этих заболеваний.
Рекомендации
внешняя ссылка
Эндоплазматическая сеть
5.7: Транспорт клеток — Биология LibreTexts
Простая диффузия
Распространение Хотя вы можете не знать, что такое диффузия, вы испытали этот процесс. Можете ли вы вспомнить, как вы вошли в парадную дверь своего дома и почувствовали приятный аромат, исходящий из кухни? Это была диффузия молекул из кухни к входной двери дома, которая позволяла обнаруживать запахи. Диффузия определяется как чистое перемещение молекул из области с большей концентрацией в область с меньшей концентрацией.
Рисунок \ (\ PageIndex {3} \). Простая диффузия, перемещение частиц из области с высокой концентрацией в область с низкой концентрацией. один из способов движения молекул в клетках. (Общественное достояние; LadyofHats Мариана Руис Вильярреал через Wikipedia.org;)Молекулы газа, жидкости или твердого тела находятся в постоянном движении благодаря своей кинетической энергии. Молекулы находятся в постоянном движении и сталкиваются друг с другом. Эти столкновения заставляют молекулы двигаться в случайных направлениях.Однако со временем больше молекул будет перемещаться в менее концентрированную область. Таким образом, чистое движение молекул всегда происходит от более плотно упакованных областей к менее плотно упакованным областям. Многие вещи могут распространяться. Запахи распространяются по воздуху, соль распространяется через воду, а питательные вещества распространяются из крови в ткани тела. Это распространение частиц за счет случайного движения из области с высокой концентрацией в область с более низкой концентрацией известно как диффузия. Это неравномерное распределение молекул называется градиентом концентрации.Когда молекулы становятся равномерно распределенными, наступает динамическое равновесие. Равновесие называется динамическим, потому что молекулы продолжают двигаться, но, несмотря на это изменение, нет чистого изменения концентрации с течением времени. И живые, и неживые системы испытывают процесс диффузии. В живых системах диффузия отвечает за перемещение большого количества веществ, таких как газы и небольшие незаряженные молекулы, в клетки и из них.
Осмос
Осмос — это особый тип диффузии; это прохождение воды из области с высокой концентрацией воды через полупроницаемую мембрану в область с низкой концентрацией воды.Вода перемещается в клетку или выходит из нее до тех пор, пока ее концентрация не станет одинаковой с обеих сторон плазматической мембраны.
Полупроницаемые мембраны представляют собой очень тонкие слои материала, которые позволяют некоторым вещам проходить сквозь них, но не позволяют другим вещам проходить сквозь них. Клеточные мембраны являются примером полупроницаемых мембран. Клеточные мембраны позволяют небольшим молекулам, таким как кислород, углекислый газ и кислород, проходить через них, но не позволяют более крупным молекулам, таким как глюкоза, сахароза, белки и крахмал, напрямую проникать в клетку.
Рисунок \ (\ PageIndex {4} \): Осмос через полупроницаемую мембрану клеток. (CC BY 4.0; OpenStax через Wikimedia.org).Классический пример, используемый для демонстрации осмоса и осмотического давления, — это погружение эритроцитов в растворы сахара различной концентрации. Есть три возможных отношения, с которыми могут столкнуться клетки, помещенные в сахарный раствор.
- Концентрация растворенного вещества в растворе может быть равной концентрации растворенного вещества в клетках.В этой ситуации ячейка находится в изотоническом растворе (iso = равно или такое же, как обычно). В этой среде эритроцит сохранит свою нормальную форму, поскольку количество воды, поступающей в клетку, равно количеству, покидающему клетку.
- Концентрация растворенного вещества в растворе может быть на больше, чем концентрация растворенного вещества в клетках. Эта ячейка описывается как находящаяся в гипертоническом растворе (гипер = больше нормы).В этой ситуации кажется, что эритроцит сжимается по мере того, как вода вытекает из клетки в окружающую среду.
- Концентрация растворенного вещества в растворе может быть меньше, чем концентрация растворенного вещества в клетках. Эта ячейка находится в гипотоническом растворе (гипо = меньше нормы). Красные кровяные тельца в этой среде станут заметно набухшими и потенциально разорвутся, когда вода попадет в клетку.
Facilitated Diffusion
Вода и многие другие вещества не могут просто диффундировать через мембрану. Гидрофильные молекулы, заряженные ионы и относительно большие молекулы, такие как глюкоза, нуждаются в помощи для диффузии. Помощь исходит от специальных белков в мембране, известных как транспортных белков . Диффузия с помощью транспортных белков называется облегченная диффузия . Существует несколько типов транспортных белков, включая канальные белки и белки-носители (Рисунок \ (\ PageIndex {6} \))
- Канальные белки образуют поры или крошечные отверстия в мембране.Это позволяет молекулам воды и небольшим ионам проходить через мембрану, не вступая в контакт с гидрофобными хвостами липидных молекул внутри мембраны.
- Белки-носители связываются с определенными ионами или молекулами и при этом меняют форму. Когда белки-носители меняют форму, они переносят ионы или молекулы через мембрану.
Формирование оболочки архей
Хотя археи имеют такую же клеточную организацию, как и другие прокариоты, липидный состав их мембран и их клеточной поверхности уникален. Здесь мы обсуждаем последние достижения в нашем понимании механизмов секреции белков архей, сборки макромолекулярных структур клеточной поверхности и высвобождения покрытых S-слоем везикул из архейной мембраны.
1. Оболочка архейной клетки
Способность многих архей переносить экстремальные условия во враждебной среде интригует исследователей с целью изучения молекулярных механизмов и специфических адаптаций. Очень рано стало понятно, что структура оболочки клеток архей существенно отличается от структуры бактерий [1]. За единственным исключением Ignicoccus , который демонстрирует внешнюю мембрану, охватывающую огромное периплазматическое пространство [2], известные археи обладают только единственной мембраной.Эта цитоплазматическая мембрана окружена S-слоем, двумерным кристаллом белка, который полностью покрывает клетки (см. Обзор Jarrell et al. В этом выпуске). В отличие от липидов сложных эфиров бактерий, липиды архей состоят из повторяющихся изопренильных групп, связанных с глицериновым остовом через эфирную связь [3, 4]. Эти липиды обычно образуют диэфирные двухслойные мембраны, подобные мембранам эукарий и бактерий. Гипертермоацидофилы содержат тетраэфирные липиды, которые состоят из изопреноидных ацильных цепей C 40 , которые полностью покрывают мембрану, образуя однослойную мембрану [5].Эти мембраны чрезвычайно непроницаемы для протонов и позволяют этим организмам выживать в условиях, когда внеклеточный pH на 4 единицы ниже, чем в цитоплазме [6]. Другой особенностью является то, что большинство внеклеточных белков архей гликозилировано посредством N- и O-гликозилирования. Наконец, археи не производят муреина, и только некоторые метаногенные виды, как известно, производят псевдомуреин [7].
Так как поверхность клеток архей настолько отличается от поверхности бактерий и эукарий, должны существовать уникальные механизмы, чтобы формировать и формировать ее.До недавнего времени большая часть наших знаний о секреции белка и сборке компонентов клеточной поверхности у архей была получена путем сравнительных геномных исследований. Однако в последние годы был достигнут огромный прогресс в нашем понимании сборки и функции структур клеточной поверхности, а также структурных и функциональных основ транслокации белков через мембрану архей. Здесь мы обсудим эти темы, уделяя особое внимание структурам клеточной поверхности.
2. Секреция белка
2.1. Транспорт развернутых белков через цитоплазматическую мембрану
Способность переносить белки через мембраны жизненно важна для жизнеспособности клеток. В целом системы, обнаруженные у архей, которые обеспечивают транспорт белков через цитоплазматическую мембрану, аналогичны таковым у бактерий. У архей большая часть белков секретируется через цитоплазматическую мембрану посредством общей секреции (Sec) или путем двойной аргининтранслоказы (Tat) (см. Рисунок 1). Путь Sec состоит из универсально консервативного комплекса транслокации, встроенного в мембрану, который называется SecYEG у бактерий и Sec61p в эндоплазматическом ретикулуме (ER) эукариот.Система Sec отвечает за транспорт развернутых белков, но также необходима для интеграции мембранных белков в цитоплазматическую мембрану [8]. У бактерий комплекс SecYEG либо связывается с рибосомой для котрансляционной вставки мембранного белка, либо с моторным белком SecA, чтобы катализировать посттрансляционную транслокацию белка. В ER Sec61p ассоциируется с рибосомой для транслокационной транслокации белков и встраивания мембранных белков, а Sec61p ассоциируется с комплексом Sec63p и просветным шапероном ER BiP для пост-трансляционной транслокации белков.Ядро белок-проводящего канала состоит из двух основных компонентов: SecY и SecE у бактерий и Sec61 и Sec61 у эукариот [9]. Оба белка обнаружены во всех архее, но третий, несущественный компонент, то есть SecG у бактерий или Sec61 у эукариот, был идентифицирован только после обширных биоинформатических анализов [10, 11]. В этом отношении гомолог SecG архей более близок к Sec61 эукариот, чем к бактериальному SecG. Поэтому транслокон архей часто называют комплексом SecYE [12].Однако точный состав минимальной протеинтранслоказы архей остается неясным. У архей отсутствует гомолог бактериального моторного белка SecA, белка, который хорошо сохраняется среди бактерий и тилакоидов хлоропластов [8]. Сходным образом археи также не содержат гомологов эукариального комплекса Sec63p, но они содержат шапероны DnaK (или Hsp70), гомологичные BiP. Эти шапероны выполняют общие функции в сворачивании белков, но по аналогии с ER, гомолог BiP, участвующий в транслокации белка, должен быть внеклеточным.Однако не было обнаружено никаких гомологов Hsp70 архей вне клетки, и, конечно, источник энергии АТФ будет отсутствовать. Следовательно, обычно предполагается, что транслокация белков ко-трансляционно связана с удлинением цепи на рибосоме [13]. Однако у эвриархеи Haloferax volcanii, было отмечено, что некоторые белки присутствуют в цитоплазме в виде полностью синтезированных предшественников сигнального пептида до того, как они секретируются. На основании этого открытия было высказано предположение, что посттрансляционная секреция белка также существует у архей [14].Интересно, что эуярхеи содержат гомолог бактериального белкового комплекса SecDF [15], тогда как у кренархей этот белок отсутствует. Точная роль SecDF неизвестна, но он вовлечен в зависимое от протонной движущей силы высвобождение транслоцированных белков с периплазматической стороны мембраны. SecDF не важен для транслокации как таковой, но он увеличивает скорость транслокации. Другие предполагаемые роли SecDF состоят в том, что он может действовать на каталитический цикл SecA-АТФазы, но поскольку SecA отсутствует у архей, такая роль кажется маловероятной.
Структурный анализ гетеротримера Methanocaldococcus jannashii SecYE [12] предоставил важные сведения о том, как этот канал может функционировать при транслокации белков. Основная субъединица SecY состоит из двух половин с внутренней псевдодвойственной симметрией. Эти две половины содержат трансмембранные сегменты (TMSs) 1–5 и 6–10, соответственно, и соединены шарнирной областью. В этой организации канал напоминает раковину моллюска, которая охватывает центральную пору в форме песочных часов с узким сужающим кольцом в середине мембраны.Это кольцо выстлано гидрофобными аминокислотными остатками и предлагается для предотвращения утечки ионов в «закрытом» состоянии. SecE V-образно обнимает раскладушку SecY со стороны петель. Третья субъединица, Sec61, периферически связана с комплексом SecYE. Пористое отверстие в центре закрыто заглушкой, также называемой TMS 2a, которая находится на периплазматической стороне сужающего кольца. Таким образом, он закрывает поры на внеклеточной поверхности мембраны. В раскладушке SecY две половины связываются друг с другом через TMS 2, TMS 7 и TMS 8.Разрыв между TMS2 и TMS7 / 8 называется боковыми воротами и располагается в передней части поры SecY. В открытом состоянии он может обеспечивать выход гидрофобных полипептидных сегментов на мембрану. Боковые ворота также играют важную роль в механизме открытия каналов во время транслокации белков [16]. Считается, что вставка сигнальной последовательности в область бокового затвора приводит к расширению центрального сужения и открытию канала. Это, в свою очередь, дестабилизирует домен-заглушку, который после выхода из внеклеточной воронки освободит центральный водный путь для полярных полипептидов, чтобы пересечь мембрану.Из-за высокой консервативности ядерных субъединиц транслокона предложенный механизм открытия каналов, вероятно, сохраняется во всех сферах жизни [8]. В этом отношении примечательно, что структурная работа с комплексом SecYE архей сыграла важную роль в определении объединяющего механизма транслокации белков, несмотря на тот факт, что точные детали этого процесса не были разрешены у архей, поскольку до сих пор не было найдено in vitro. Установлена система транслокации .
2.2. Транспорт свернутых белков через цитоплазматическую мембрану
Путь Tat опосредует транспорт белков в их свернутом состоянии. Это, в частности, но не только, касается кофакторсодержащих белков, которые сворачиваются и собираются в цитоплазме. Обычно бактериальный Tat-путь состоит из трех интегральных мембранных белков: TatA, TatB и TatC. У архей и у большинства грамположительных бактерий комплекс Tat состоит только из двух компонентов, TatA и TatC, тогда как третий компонент TatB отсутствует [11].В современных моделях TatBC участвует в начальном рекрутировании субстрата, в то время как TatA, вероятно, совместно с TatC, формирует поры, через которые свернутый белок транспортируется через мембрану [17]. У большинства бактерий и архей количество субстратов Tat относительно мало по сравнению с числом субстратов, которые перемещаются по пути Sec. Однако у галофильных архей путь Tat является преобладающим путем секреции белка [18]. Считается, что это требование для Tat-пути является адаптацией к среде с высоким содержанием соли, которая может мешать сворачиванию белка внутри клетки.Однако галофильная бактерия Salinibacter ruber в основном секретирует белки через Sec-путь [19], предполагая, что потребность в Tat не является адаптацией к высокому содержанию соли как таковой. Другой уникальной особенностью пути Tat у галоархей является то, что транслокация управляется движущей силой натрия, тогда как во многих других микроорганизмах движущая сила протонов используется в качестве движущей силы [20]. Следует отметить, что у бактерии Streptomyces coelicolor многие белки, которые обычно секретируются с помощью Sec-пути, вместо этого используют путь Tat [21].
Белки направляются в путь Sec или Tat с помощью N-концевого сигнального пептида, который после секреции удаляется сигнальной пептидазой. Основная трехкомпонентная организация сигнальных пептидов, используемых этими двумя путями, очень похожа. Сигнальные пептиды Sec и Tat имеют трехдоменную структуру: положительно заряженный N-концевой n-домен, центральный гидрофобный h-домен и полярный c-домен, который содержит сайт расщепления сигнальной пептидазы [22]. Помимо присутствия пары аргининов в мотиве SRRXFLK () в N-области сигнальных пептидов Tat [23], нет гомологии последовательностей в других областях.Сигнальные пептиды трех доменов жизни функционально взаимозаменяемы [24]. Примечательно, что около 60% сигнальных последовательностей Tat в Escherichia coli также способны направлять белки в механизм транслокации Sec [23]. В этом отношении развернутые белки отвергаются путем Tat [25], хотя некоторые другие исследования предполагают, что путь Tat может обрабатывать внутренне развернутые белки [26].
2.3. Транспорт через внешнюю оболочку
Самая внешняя граница архейной клетки обычно представляет собой слой кристаллического белка, то есть поверхностный (S-) слой.S-слой содержит отверстия, похожие на поры, которые позволяют свободно проходить питательным веществам и другим небольшим молекулам [1]. Однако мало что известно о том, как белки преодолевают этот барьер во время секреции. Секреция белка через внешнюю оболочку, внешнюю мембрану, была детально изучена на дидермальных бактериях. У этих организмов было обнаружено в общей сложности семь различных систем, и процессы секреции белка, связанные с этими системами, получили название секреции типа I-VII. Археи разделяют компоненты некоторых из этих систем, но поскольку секреция типов III, V, VI и VII, по-видимому, отсутствует в геномах архей, они не будут здесь обсуждаться далее.
Секреция типа I включает транспортер АТФ-связывающей кассеты (ABC), который через связанный с цитоплазматической мембраной гибридный (или адаптерный) белок (MFP) связывается с порами внешней мембраны [27]. Эти системы секретируют белки непосредственно из цитоплазмы наружу клетки. Транспортеры типа ABC относительно многочисленны у архей, но большинство из них участвуют в поглощении субстрата [11]. Неясно, существует ли секреция типа I у архей. Однако гомологи белков слияния мембран не были идентифицированы, а белки порина отсутствуют из-за отсутствия внешней мембраны.Протеомные исследования термофильных кренархей показывают, что значительная часть экзопротеомов касается белков, лишенных сигнальных последовательностей. Например, у термоацидофила Sulfolobus solfataricus сообщалось о секреции супероксиддисмутазы [28], но ген, кодирующий этот белок, не определяет сигнальную последовательность, и поэтому остается неизвестным, как этот белок высвобождается из клеток. Следовательно, остается установить, является ли присутствие сигнальных белков без последовательности во внешней среде результатом специфического процесса секреции белка или лизиса клеток [29–31].
Системы секреции дидермальных бактерий типа II состоят из 12–16 белков, которые собираются в аппарат секреции, охватывающий как цитоплазматическую, так и внешнюю мембрану. Гены, кодирующие систему секреции, часто объединяются в большой оперон. При секреции типа II субстратные белки сначала перемещаются в периплазму по пути Sec- или Tat [32, 33]. Эти белки складываются в свое естественное состояние в периплазме и могут даже собираться в многосубъединичные белковые комплексы.Затем эти свернутые белки перемещаются по ОМ через большую пору, называемую секретином. Нацеливание белков на секретин плохо изучено. Например, Pseudomonas aeruginosa секретирует различные белки, такие как липаза, эластаза и экзотоксин А, через свои системы секреции типа II, но эти субстраты не имеют общего мотива распознавания, и обычно считается, что секретин распознает структурные складки, а не аминокислотные последовательности [32]. Считается, что транспорт через секретин включает псевдопилус, короткий филамент, который собирается из субъединиц цитоплазматической мембраны.Было высказано предположение, что псевдопилус действует как своего рода поршень, чтобы проталкивать субстраты через секретин через внешнюю мембрану [32]. Хотя археи не обладают внешней мембраной, их системы сборки жгутиков и пилей содержат субъединицы, напоминающие белки в системах секреции типа II бактерий, и будут обсуждаться более подробно ниже.
Системы секреции типа IV участвуют в транспорте эффекторных белков и ДНК, но считаются в первую очередь экспортерами белков, которые секретируют ДНК посредством ее присоединения к секретируемому белку [34].Совсем недавно была выяснена структура канала секреции типа IV. Эта структура, состоящая из 4 различных субъединиц, охватывает все периплазматическое пространство и находится в цитоплазматической и внешней мембране [35]. Конъюгативные плазмиды, содержащие некоторые субъединицы систем секреции типа IV, идентифицированы только у кренархей [36–39]. В этих гомологах цитоплазматической АТФазы VirB4 были идентифицированы политопный мембранный белок VirB6 и связывающий белок VirD4, но они значительно отличаются от своих бактериальных аналогов.Никаких подробностей об их участии в конъюгативном переносе ДНК у архей неизвестно. В euryarchaeote Haloferax volcanii, сообщалось, что двунаправленный перенос хромосомной ДНК происходит во время конъюгации, и большие структуры (2 м в длину и 0,1 м в ширину), как предполагается, опосредуют перенос ДНК [40]. Однако система, опосредующая этот перевод, не была идентифицирована.
Еще одна хорошо изученная система у бактерий — это механизм сборки пилей типа IV, который участвует во множестве функций, таких как поверхностная адгезия, межклеточный контакт, аутоагрегация, подергивание подвижности и захват ДНК [41].Пилины типа IV содержат так называемые сигнальные пептиды класса III, которые перед реакцией сборки пилуса обрабатываются PilD, процессирующей пептидазой, которая также метилирует N-концевой фенилаланин зрелого пилина [42]. До 15 белков участвуют в правильной сборке пилинов в структуру пилуса, но движущая сила для его сборки обеспечивается цитоплазматической АТФазой PilB. Этому процессу противодействует действие АТФазы PilT, вызывающее разборку пилуса.Интересно, что аппарат биогенеза жгутика архей напоминает упрощенный механизм сборки типа IV, и были идентифицированы различные структуры поверхности архей, которые принадлежат к одному классу [43] (более подробно будут обсуждаться в разделе о структурах поверхности архей).
Все системы секреции типа II / IV и сборки пилей типа IV содержат цитозольную АТФазу, которая функционирует как двигатель, управляющий секрецией или сборкой. Из-за сходства эти АТФазы, вероятно, функционируют с помощью сходных механизмов и эволюционно связаны [44].Секреционные АТФазы собираются в гексамерное кольцо. Структура секреции АТФазы GspE2 A. fulgidus показывает, что N-концевой домен чередуется между положением стоя и положением лежа, и было высказано предположение, что этот процесс управляется АТФ и необходим для обеспечения поршневидного движения. это будет приводить в движение (или сборку) пилуса [45]. Относительный сдвиг N-концевого домена составляет 10 Å, что соответствует необходимому перемещению в 10,5 Å для сборки пилуса [45].Геномы большинства архей содержат гены, специфицирующие несколько АТФаз секреции типа II / IV [45]. Они часто располагаются в опероне вместе с генами, кодирующими пилин-подобные белки и мембранный белок. Следовательно, кажется, что системы сборки архей имеют меньшую сложность, чем их дидермальные бактериальные аналоги, по крайней мере, в них отсутствуют белковые компоненты внешней мембраны. В этом отношении они больше похожи на наблюдаемые у монодермических бактерий.
3. Сигнальные пептиды и секретомы
Выявлены три различных класса сигнальных пептидов, которые обрабатываются их собственной обозначенной сигнальной пептидазой [46].Сигнальные пептиды класса I расщепляются в C-домене сигнальными пептидазами типа I. Белки, содержащие сигнальные пептиды класса I, обычно высвобождаются в виде растворимых белков или, если они содержат С-концевую трансмембранную спираль, С-конец встроены в мембрану [47]. Сигнальные пептиды класса II обнаруживаются исключительно в липопротеинах. Для сигнальных пептидов класса II характерен консервативный цистеин, который присутствует в сайте расщепления. После отщепления сигнального пептида цистеин образует N-концевой остаток зрелого белка, где он служит сайтом прикрепления липидов для закрепления белка на мембране [48].У бактерий процессинг сигнального пептида класса II включает несколько стадий. Сначала к цистеину присоединяется диацилглицерильная группа. Эта реакция катализируется пролипопротеиддиацилглицерилтрансферазой. После этой модификации сигнальный пептид расщепляется сигнальной пептидазой типа II. Последний этап, то есть прикрепление липида, затем выполняется аполипопротеин-N-ацилтрансферазой. В частности, ни один из белков, участвующих в процессинге сигнальных пептидов класса II, не был идентифицирован у архей, несмотря на присутствие сигнальных пептидов функционального класса II [49].У архей сигнальные пептиды Sec и Tat могут быть обнаружены в сигнальных пептидах как класса I, так и класса II [46, 48]. Сигнальные последовательности класса III обрабатываются в N-домене специфической интегрированной в мембрану пептидазой, которая удаляет положительно заряженные аминокислоты, оставляя, таким образом, H-домен сигнального пептида прикрепленным к белку. Это событие обработки происходит на внутренней стороне цитозольной мембраны, и из-за удаления положительных зарядов блок транслокации удаляется, обеспечивая последующую транслокацию субъединицы пилина для последующей сборки.Последний включает H-домен, который функционирует как сборочный каркас, чтобы поддерживать образование пилуса или псевдопилуса снаружи клетки [41, 42]. У архей лучшим примером субстрата, несущего сигнальный пептид класса III, является флагеллин, субъединица жгутика архей, которая используется для подвижности. Сигнальные пептиды класса III процессируются специализированной пептидазой, то есть префлагеллин-пептидазой, которая использует тот же каталитический механизм, что и бактериальные препилинпептидазы [50, 51].Однако у архей сигнальные пептиды класса III не только относятся к флагеллинам, пилинам и / или псевдопилинам, но также обнаруживаются во множестве других внеклеточных белков, таких как субстрат-связывающие белки или протеазы [52].
Сигнальный пептид играет решающую роль в инициации процесса секреции. При ко-трансляционной секреции белка рибосома, синтезирующая белок, доставляется к транспортному механизму с помощью комплекса белок-РНК, называемого частицей распознавания сигнала (SRP). SRP связывается с сигнальным пептидом синтезируемого белка и с рибосомой.Комплекс рибосома-SRP взаимодействует с ассоциированным с мембраной рецептором SRP, и при входе сигнального пептида в транслокон Sec, рецепторы SRP и SRP высвобождаются [53]. У эукариот SRP содержит шесть белков вместе с молекулой РНК из 300 нуклеотидов, тогда как бактериальная версия намного проще, поскольку состоит из одного белка, Ffh, и молекулы РНК из 113 нуклеотидов. SRP архей похож на SRP эукариот, хотя и намного меньше. Он состоит из двух основных компонентов; белок SRP54 и молекула РНК длиной 300 нуклеотидов и несущественный вспомогательный белок SRP19 [54].Рецептор SRP архей больше похож на бактериальный рецептор SRP FtsY, чем на рецептор SRP эукариот, который состоит из двух субъединиц, SR и SR [55].
3.1. Секретом
Современные знания о секреции белков и развитие протеомики привели исследователей к определению секретома [56], который представляет собой набор белков, секретируемых клеткой. По сути, это белки, которые содержат сигнальный пептид и активно транспортируются через цитоплазматическую мембрану, но протеомные исследования также выявили наборы секретируемых белков, которые не содержат идентифицируемого сигнального пептида, но все же могут считаться секретируемыми.В принципе, любая программа, способная обнаруживать присутствие сигнальных пептидов, может быть использована для создания секретома in silico . Например, PSORTb предсказывает клеточную локализацию белка, а SignalP предсказывает вероятность того, что белок содержит сигнальный пептид [57, 58]. С помощью этих программ прогнозирования были составлены различные in silico секретомы архей [30, 46, 59–61]. Они варьируются от 1,2 до 19% от общего протеома в зависимости от конкретной программы, строгости критериев и анализируемых видов архей.Особый интерес представляют программы PRED-SIGNAL и Flafind [52, 62]. PRED-SIGNAL был разработан исключительно для предсказания сигнальных пептидов архей, а также позволяет различать сигнальные пептиды и аминоконцевые трансмембранные спирали. Анализ 48 геномов архей с помощью PRED-SIGNAL предсказывает, что 5% –14% протеома специфицируют белки, содержащие сигнальный пептид, в то время как никаких существенных различий между кренархеями и эвриархиями не обнаружено [62]. Программа Flafind распознает сигнальные пептиды класса III, которые, как полагают, у архей особенно важны для биогенеза придатков клеточной поверхности.Flafind указал на присутствие 308 белков, несущих сигнальный пептид класса III, среди 22 протеомов архей [52]. Большинство положительных результатов Flafind являются гипотетическими белками, которые связаны с системами сборки пилуса.
Критическим моментом является экспериментальная проверка секретомов in silico . В супернатанте психрофила Methanococcoides burtonii идентифицировано всего 7 белков, содержащих сигнальный пептид [47]. В более позднем исследовании это число было увеличено до 16 белков с помощью анализа всего протеома [63].В S. solfataricus попыток покрыть весь протеом привели к идентификации 32 белков, присутствующих исключительно в супернатанте [31]. Когда была проведена инвентаризация супернатантных протеомов и субпротеомов клеточной поверхности трех видов Sulfolobus , всего было сообщено о 64 белках [29]. У этих видов Sulfolobus белки клеточной поверхности доминировали в протеоме супернатанта, что позволяет предположить, что фактическая секреция является редким событием и что большинство секретируемых белков происходит из белков, высвобождаемых с клеточной поверхности.Это представление было дополнительно усилено наблюдением, что внеклеточная -амилаза в основном находится на поверхности клетки [29]. Сходные наблюдения были сделаны на кренархеоне Aeropyrum pernix , у которого было идентифицировано 107 белков как с поверхности клетки, так и из супернатанта [30]. Протеомные исследования показывают, что существуют значительные различия между предсказанными и экспериментальными секретомами. Например, белки, лишенные идентифицируемого сигнального пептида, не предсказываются методами in silico , но появляются в больших количествах внеклеточно.Важным источником белков без сигнальных пептидов являются белки, связанные с везикулами внеклеточных мембран, которые, по-видимому, являются результатом специфического феномена секреции (обсуждаемого ниже). Было высказано предположение, что цитозольные белки секретируются через еще неизвестные системы секреции [30], но этот феномен кажется общим в протеомных исследованиях как у бактерий, так и у архей и часто касается разных белков. В целом, эти цитозольные белки могут обладать высокой устойчивостью к протеолизу и, следовательно, иметь длительное время удерживания во внешней среде после лизиса клеток.Ни одно из протеомных исследований не привело к полному охвату секретома in silico . Последнее связано с различными ограничениями в анализе. Часто используется только одно условие роста, и поэтому экспрессируется только подмножество белков. Кроме того, способы не оптимизированы для выделения белков, связанных с внеклеточной поверхностью клетки, и наблюдаются только те, которые высвобождаются. Выделение гликозилированных белков клеточной поверхности с использованием лектиновых колонок [29, 64] позволяет значительно расширить набор идентифицированных внеклеточных белков.
4. Мембранные везикулы как новый носитель секреции
Довольно необычный и плохо изученный механизм секреции белков — это высвобождение белков, упакованных в небольшие мембранные везикулы, которые выходят с поверхности клетки. Известно, что многие дидермальные бактерии высвобождают пузырьки внешней мембраны со своей поверхности [65], но этот процесс, по-видимому, также происходит в архее, где мембранные пузырьки покрыты белками S-слоя. При скрининге вирусов среди эвриархей порядка Thermococcales было обнаружено, что большинство протестированных штаммов выделяли маленькие сферические везикулы [66].Эти везикулы не похожи на вирусы и часто имеют геномную ДНК, связанную с их поверхностью [66]. О высвобождении мембранных пузырьков сообщалось у многих различных архей, таких как термофильная эвриархея Aciduliprofundum boonei , выделенная из гидротермальных глубоководных жерл [67], и различных кренархеот, в частности Sulfolobus [68, 69]. У S. islandicus [70] и S. tokodaii [68] (Ellen et al, неопубликовано) мембранные везикулы, по-видимому, содержат антимикробный белок (белки), который ингибирует рост родственных видов Sulfolobus .Антимикробная активность включает белковый компонент, но его идентичность еще не выяснена. В целом, похоже, что в S. tokodaii, антимикробный белок (белки) специфически сортируется в мембранные везикулы, но неизвестно, связано ли образование мембранных везикул механически с секрецией факторов антимикробного белка. Также видов Ignicoccus являются активными продуцентами мембранных везикул. У этих организмов отсутствует клеточная стенка, и вместо этого они содержат внешнюю мембраноподобную структуру.Электронно-микроскопические исследования показывают, что мембранные везикулы высвобождаются из цитоплазматической мембраны и высвобождаются в обширное периплазматическое пространство [2]. Было высказано предположение, что эти везикулы сливаются с внешней мембраной и что они либо являются частью специфической системы секреции, либо участвуют в биогенезе внешней мембраны.
На сегодняшний день только для везикул, полученных из Sulfolobus , был проведен протеомный анализ. Белковый состав этих мембранных везикул заметно отличается от состава цитоплазматической мембраны [68], предполагая, что они могут возникать в результате специфического события высвобождения.Однако везикулы, по-видимому, не содержат специфического груза, который указывал бы на специфическую роль, за исключением присутствия архейных гомологов эукариотического эндосомного сортировочного комплекса, необходимого для белков transport-I (ESCRT) [68]. Это привело к гипотезе, что мембранные пузырьки возникают из цитоплазматической мембраны посредством события наружного почкования, сходного с внутренним почкованием пузырьков в эндосомном компартменте эукариот (см. Рис. 2). Везикулы Sulfolobus различаются по размеру от 50 до 200 нм и окружены S-слоем, что подтверждается протеомным анализом и дифракцией электронов [70].Присутствие оболочки S-слоя указывает на то, что мембранные везикулы проталкиваются через клеточную оболочку, что согласуется с предполагаемой гибкостью S-слоя. Белки ESCRT-III также участвуют в делении клеток [71], и другая возможность состоит в том, что мембранные везикулы являются остатками клеточного сужения и высвобождаются во время процессов клеточного деления. Интересно, что белки ESCRT-III не присутствуют в эвриархиях, хотя образование мембранных пузырьков также наблюдалось у этих архей.
Высвобождение мембранных везикул является общей чертой, наблюдаемой во всех трех сферах жизни. В этом отношении, несмотря на наличие клеточной стенки, высвобождение мембранных пузырьков также описано для монодермических бактерий и грибов [72, 73]. У дидермальных бактерий обычно наблюдается высвобождение пузырьков наружной мембраны, и некоторые косвенные генетические данные предполагают, что это важный процесс [74]. Белковый состав везикул (или пузырьков) внешней мембраны значительно отличается от состава внешней мембраны, что позволяет предположить, что белки специфически сортируются в пузырьки [75].Точная функция высвобождения мембранных пузырьков остается неясной, поскольку они вовлечены во множество процессов. Мембранные везикулы могут функционировать как система секреции белка, обеспечивая защищенную среду для груза. Например, в E. coli -гемолизин секретируется через систему секреции типа I. Однако большая часть β-гемолизина остается тесно связанной с везикулами внешней мембраны, которые также содержат TolC, порин внешней мембраны, связанный с системой секреции гемолизина I типа.Это предполагает связь между секрецией мембранно-активного токсина и образованием мембранных везикул [76]. Высвобождение мембранных везикул может быть стрессовым явлением, позволяющим избавиться от избыточного мембранного материала. Во многих случаях ДНК, по-видимому, связана с мембранными везикулами. Для Thermococcales было высказано предположение, что ассоциированная ДНК не упаковывается специфически в мембранные везикулы, а скорее ассоциируется с мембранными везикулами после их высвобождения в среду [66].ДНК может происходить из лизированных клеток, и из-за ассоциации с мембранами она может стать устойчивой к нуклеазной активности и, таким образом, проявлять большую устойчивость. Наконец, высвобождение мембранных везикул может предоставить средства для секреции нерастворимых гидрофобных веществ, которые распределяются в липидной мембране. Например, многие микроорганизмы производят молекулы, чувствительные к кворуму, с гидрофобными ацильными цепями различной длины. В Pseudomonas aeruginosa такие молекулы, чувствительные к кворуму, упакованы в пузырьки внешней мембраны [77].Высвобождение мембранных везикул может также служить для восстановления клеточного дисбаланса, вызванного агрегатами денатурированных белков, как предполагается для E. coli [78]. Будущие исследования должны выявить точную функцию секретируемых мембранных пузырьков у архей и дать ключ к разгадке механизма их биогенеза.
5. Монтаж поверхностных структур архей
5.1. Жгутики архей: структура и функции
Жгутики архей были изучены на генетическом, структурном и функциональном уровне для нескольких штаммов архей.Ранние наблюдения за этими пили-подобными филаментами с помощью электронной микроскопии привели к предположению, что они функционально аналогичны бактериальным жгутикам, выполняющим аналогичные задачи в плавании и формировании биопленок. Подвижность клеток с помощью жгутиков была продемонстрирована для архей Halobacterium salinarum , M. voltae , S. acidocaldarius и S. solfataricus [79–83] . У H. salinarum двунаправленное вращение жгутика создает движение в прямом или обратном направлении за счет мгновенного переключения вращения жгутика, которое похоже на вращение жгутика бактерий [82].Для других жгутиков архей подобное вращательное движение еще не наблюдалось. Жгутики также необходимы для прикрепления к поверхности и колонизации, как показано для Pyroccocus furiosus и S. solfataricus [84–86].
Субъединичный состав, структура и механизм сборки жгутика архей сильно отличается от такового жгутика бактерий [87, 88]. Жгутик архей имеет упаковку правой спиральной субъединицы с диаметром примерно 10–14 нм, что намного тоньше, чем жгутик бактерий [80, 89].Лишь в нескольких случаях были обнаружены более толстые филаменты в зависимости от собранных флагеллинов [90]. Жгутик архей не полый, а внутреннее пространство, скорее всего, образовано за счет взаимодействия спиральной спирали N-концевых гидрофобных доменов флагеллинов, аналогичных собранным пилусам IV типа [91]. Более того, недавние исследования предполагают, что энергия, необходимая для вращения жгутика H. salinarum , напрямую получается за счет гидролиза АТФ, а не за счет движущей силы протонов. Таким образом, механизм H.salinarum вращение жгутика принципиально отличается от вращения бактериальной системы [92]. Жгутик архей кодируется опероном fla , единственным локусом из 8-10 генов, присутствующих во многих Crenarchaeota и Euryarchaeota. Общий состав оперона fla имеет гомологию с бактериальной сборкой пилей типа IV, системами секреции типа II и типа IV [52, 80, 93–96]. Флагеллины являются субъединицами жгутика и содержат сигнальный пептид класса III, который необходим для их встраивания в мембрану и сборки в жгутике.Процессинг включает мембранную пептидазу FlaK (или PibD) [51, 97], и эти ферменты гомологичны бактериальному PilD, но не катализируют N-метилирование новообразованного N-конца субъединицы флагеллина. H-домен, вероятно, складывается в протяженную гидрофобную спираль, которая участвует во взаимодействиях спиральной спирали между субъединицами во внутреннем ядре жгутика. Исследования реконструкции жгутиков H. salinarum и S. shibatae предполагают, что H-домены составляют центральное гидрофобное ядро, аналогичное таковому у пилей типа IV, но прямых доказательств структурной роли H- домен [98, 99].
Жгутики архей различаются количеством структурных субъединиц — флагеллинов. Оперон fla M. voltae содержит 4 структурных гена флагеллина: flaA , flaB1 , flaB2, и flaB3 [100]. FlaB1 и FlaB2 являются основными компонентами жгутика, и удаление соответствующих им генов приводит к дефициту жгутика. FlaA распределяется по жгутику в качестве минорного компонента, а делеция flaA приводит к появлению флагеллированных, но менее подвижных мутантов [81].FlaB3 локализован проксимальнее поверхности клетки, образуя структуру изогнутой формы, похожую на структуру бактериального крючка. Делеция flaB3 привела к появлению флагеллированных и подвижных мутантов [101]. Сходство между этой предполагаемой структурой крючков архей и крючковым доменом бактериальных жгутиков может указывать на то, что подобное движение с крутящим моментом генерируется жгутиком M. voltae . Однако механизм подвижности M. voltae неизвестен, и роль архейного крючка во вращении жгутика не была продемонстрирована.В H. salinarum пять генов fla в двух локусах ( flaA1 , flaA2 и flaB1 , flaB2, flaB3 ) кодируют субъединицы жгутика [102–104]. Гены flaA1 и flaA2 кодируют основные компоненты жгутика. Жгутик H. salinarum действительно имеет механизм двунаправленного вращения, который перемещает клетки вперед и назад [82].
Возможно, центральный ядерный комплекс, кодируемый опероном fla , участвует только в сборке жгутика, во многом схоже с таковым у бактериальных пилинов IV типа, в то время как другая пока неизвестная система функционирует как вращающийся двигатель.Оперон Sulfolobales fla содержит только один структурный ген флагеллина — FlaB [80, 105]. У P. furiosus FlaB1 является основным компонентом жгутика, но оперон fla содержит вторую субъединицу флагеллина (FlaB2) с неизвестной функцией [84]. FlaI гомологичен сборке пилей бактерий типа IV и АТФаз секреции типа II, PilB и GspE, соответственно. Это дополнительно указывает на консервативный механизм сборки жгутика архей и бактериальных систем сборки пилей IV типа / секреции типа II [89, 94–96].АТФазная активность была продемонстрирована для белков FlaI S. solfataricus и S. acidocaldarius , экспрессированных и очищенных после сверхэкспрессии в E. coli [94, 106]. Пока что FlaI является единственным идентифицированным АТФазным компонентом корового комплекса жгутика и хотя его роль в флагелляции была продемонстрирована с делецией гена flaI , остается неясным, участвует ли FlaI также в возбуждении подвижности клетки. FlaJ — единственный известный интегральный мембранный компонент системы сборки жгутиков [79, 80, 101].Белки FlaJ содержат 9 трансмембранных сегментов и два больших цитоплазматических домена примерно 25 и 15 кДа соответственно. Считается, что эти полярные домены функционируют как сайт взаимодействия для FlaI, как показано для белков, заякоренных в мембране бактериальных систем секреции типа II. Структурный анализ взаимодействующих доменов EpsE и EpsN, сборки АТФазы и мембранного белка системы секреции токсина II типа бактерии Vibrio cholerae, показал, что за это взаимодействие ответственны гидрофобные взаимодействия и солевые мостики [107].Выравнивание FlaI / FlaJ архей с EpsE / EpsN указывает на то, что это взаимодействие может быть законсервировано в системах сборки пилей архей IV типа. Функция FlaJ в сборке жгутиков не исследована. Хотя жгутик S. solfataricus важен для подвижности на поверхностях [80], вращательное движение и крючковидная структура филамента жгутика еще предстоит продемонстрировать. В целом механизм подергивания подвижности с помощью жгутика архей изучен плохо.
Функция других компонентов оперона сборки жгутика архей неизвестна, однако в исследовании H. salinarum, недавно было продемонстрировано, что вспомогательные белки жгутиков FlaCE и FlaD взаимодействуют через два недавно идентифицированных белка с тремя различными белками из Сигнальный каскад Che (CheY, CheD и CheC2), обеспечивающий связь между жгутиком и сенсорным аппаратом [108]. Поскольку белки Che отсутствуют у кренархеот, FlaCED также отсутствуют в опероне жгутиков, что указывает на другой механизм того, как стимулы будут преобразовываться в изменение направления подвижности.
5.2. Новые структуры поверхности архей
Археи демонстрируют широкий спектр придатков на поверхности клеток с интересными структурами и биологическими функциями. Они кажутся высокоспециализированными из-за специфической адаптации микроорганизмов к их враждебной среде обитания. Сеть канюль Pyrodictium abyssi является примером такой структуры [109, 110].
P. abyssi был изолирован из гидротермальных морских сред, и его оптимальные температуры роста находятся в диапазоне от 80 до [111, 112].Сеть канюль кажется решающей для выживания клеток, поскольку она очень распространена в клеточных колониях. Канюльные трубки имеют внешний диаметр 25 нм и состоят по крайней мере из трех различных, но гомологичных субъединиц гликопротеина с идентичными N-концами, но с разными молекулярными массами (т.е. 20, 22 и 24 кДа). Эти белки обладают высокой устойчивостью к денатурирующим условиям, таким как воздействие температур до. Из трехмерной реконструкции связей между канюлями и клетками выясняется, что канюли входят в периплазматическое пространство, но не в цитоплазму, образуя межклеточное соединение периплазматических пространств между клетками [109].Эти связи образуются, когда клетки делятся, после чего клетки остаются связанными через растущие канюли [111]. Функция сети канюль до сих пор не ясна. Он может действовать, чтобы прикрепить клетки друг к другу или действовать как средство коммуникации, опосредовать обмен питательными веществами или даже транспорт генетического материала [87]. Также неизвестно, какая система (системы) задействована (ы) в сборке сети канюль.
Другой необычный придаток на поверхности клетки архей — «хамус» [87, 113].Эта структура представляет собой новый придаток нитчатых клеток неожиданно высокой сложности. Клетки архей, несущие эти структуры, обнаруживаются в макроскопически видимых структурах, подобных жемчужной нити, которые также опутывают бактериальные клетки, в основном Thiothrix (SM) или протеобактерии IMB1 (IM), которые растут в холодных () сульфидных источниках [114]. Клетки архей представляют собой коккоиды диаметром примерно 0,6 мкм м, с каждой клеткой прикреплено около 100 нитевидных пучков. Hami имеют длину от 1 до 3 мкм, м и диаметр от 7 до 8 нм и имеют спиральную структуру с тремя шипами (каждый диаметром 4 нм), исходящими от нити на периодических расстояниях 46 нм.Конец нити образован трехсторонним крючком, похожим на крючок с зазубринами. Хамус состоит в основном из белка массой 120 кДа. Однако последовательность этого белка неизвестна. Они стабильны в широком диапазоне температур (от 0 до) и pH (от 0,5 до 11,5) и обеспечивают прочную адгезию клеток к поверхностям с различным химическим составом. Предполагается, что ветвь действует при прикреплении к поверхности и инициировании биопленки, во многом подобно жгутикам и пилям при образовании бактериальной биопленки, но, кроме того, обеспечивает надежное закрепление.
Новый тип пилей был недавно выделен из Ignicoccus hospitalis , которые имеют ширину 14 нм и длину до 20 м и составляют до 5% клеточного белка. Они состоят в основном из белка Iho670, который имеет сигнальный пептид класса III [115]. Поскольку I. Hospitalis имеет внешнюю мембрану, можно было бы ожидать, что узел пилей будет располагаться на внешней мембране, а не на внутренней мембране, как у всех других известных архей.
S. solfataricus экспрессирует УФ-индуцированные пили на своей клеточной поверхности [116].Эта система кодируется опероном ups и присутствует во всех геномах S ulfolobales [94]. Этот оперон сильно индуцируется при воздействии ультрафиолетового света на S. solfataricus ; впоследствии клетки собирают пили на своей поверхности и образуют крупные клеточные агрегаты. Пили Ups намного короче волнообразных жгутиков S. solfataricus и относительно тонкие, их диаметр составляет 7 нм [80]. Они демонстрируют правостороннюю спиральную симметрию, подобную жгутику.Мутанты, у которых отсутствует ген upsE , кодирующий GspE-подобную АТФазу, испытывают дефицит в образовании пилей и агрегации клеток. UpsE имеет сильную гомологию с FlaI и другими сборочными АТФазами и, вероятно, активирует сборку пилей Ups. Ген upsF кодирует трансмембранный белок системы сборки и очень гомологичен FlaJ. Другой ген в опероне — upsX . UpsX не обнаруживает гомологии с каким-либо другим белком, и его функция неизвестна. Оперон ups содержит два гена, кодирующих пилины, UpsA и UpsB.Оба белка содержат сигнальный пептид класса III и процессируются общей сигнальной пептидазой класса III PibD. Сверхэкспрессия UpsA в S. solfataricus приводит к образованию необычных длинных пилей. Интересно, что пили Ups также необходимы для поверхностной адгезии S. solfataricus [86]. Система Ups и жгутик могут инициировать прикрепление S. solfataricus к различным поверхностям, и недавние исследования образования биопленки Sulfolobales показали, что система Ups важна для образования латеральной биопленки (Koerdt and Albers, неопубликовано).
Недавние исследования жгутиков и новых структур пилей продвинули инициативу по картированию пили-подобных кластеров биогенеза архей посредством биоинформатического анализа большого количества секвенированных геномов архей [52]. Программа FlaFind была разработана для поиска белков, содержащих сигнальные последовательности класса III, которые, следовательно, кодируют предполагаемые структурные поверхностные белки. Этот анализ in silico идентифицировал 388 предполагаемых белков, содержащих сигнальную последовательность класса III, в 22 геномах архей, из которых 102 белка были аннотированы с функцией: 44 субъединицы флагеллина и 33 как субстрат-связывающие белки.В этот список также входили внеклеточные протеазы и окислительно-восстановительные белки. Было обнаружено, что в общей сложности 120 из этих белков связаны с оперонами, аналогичными системам сборки пилиновых пилинов бактерий IV типа и сигнальным пептидазам пилина IV типа. Хиты FlaFind были проанализированы на предмет коротких и высококонсервативных мотивов. Также были идентифицированы восемь дополнительных SBP и 19 белков эвриархей, содержащих мотив QXSXEXXXL с неизвестной функцией. В домене DUF361 остаток Q находился на +1 от сайта расщепления. Некоторые из этих белков были идентифицированы в опероне вместе с новой сигнальной пептидазой типа IV, называемой EppA, из эвриархей Methanococcus maripaudis .Эксперименты показали, что EppA специфически обрабатывает белки, принадлежащие к группе DUF361. Расщепление тестировали путем совместной экспрессии белка, содержащего DUF361, с FlaK и EppA. Вероятно, что белки DUF361 функционально и структурно отличаются от хорошо известных белков флагеллина и пилина из-за потребности в гомологе, но все же другой сигнальной пептидазы типа IV для расщепления их сигнального пептида. Недавно структура пилуса M. maripaudis была определена с помощью криоэлектронной микроскопии и выявила новую структуру, собранную из упаковки из двух субъединиц [117].Филамент с однозаходной спиральной симметрией и кольцевая структура из 4 субъединиц были объединены в одной нити.
Другой интересной системой сборки пилуса архей IV типа является система сборки биндосом (Bas) в S. solfataricus , которая участвует в сборке сахаросвязывающих белков в биндосому, структура, которая, как ожидается, будет локализована близко к цитоплазматической. мембрана или интегрирована в S-слой [118]. Основным доказательством в поддержку наличия этой гипотетической структуры является то, что предлагаемые структурные компоненты, субстрат-связывающие белки (SBP), содержат последовательности сигнальных пептидов класса III, характерную черту, характерную для белков, которые, как хорошо известно, образуют олигомерные структуры в обоих археи и бактерии.Олигомеризацию сахар-связывающих белков изучали после выделения сахар-связывающих белков из мембраны S. solfataricus с помощью эксклюзионной хроматографии (Zolghadr et al., Неопубликовано). Предыдущие исследования продемонстрировали, что предшественники сахар-связывающих белков процессируются PibD, сигнальной пептидазой архейного типа IV [50, 97]. Предполагается, что олигомер связывающего сахар белка играет роль в облегчении поглощения сахара, функции, которая позволяет S. solfataricus расти на широком спектре субстратов.
Система Bas уникальна, и она была идентифицирована только в S. solfataricus . Оперон bas содержит пять генов, которые организованы в 2 меньших оперона: гены basEF , кодирующие основные компоненты системы сборки, которые являются гомологами FlaI / FlaJ системы сборки жгутика архей и UpsE / F из системы Ups Сульфолобус [94]. Второй набор генов включает basABC , который кодирует небольшие пили-подобные белки с сигнальными пептидами класса III.BasABC является уникальным и был идентифицирован только в S. solfataricus . Предыдущие исследования показали, что они экспрессируются конститутивно, но электронно-микроскопические исследования не выявили никаких структур пилей, собранных BasABC. Поглощение глюкозы сильно ингибировалось у мутанта с делецией basEF и, соответственно, сильно нарушался рост глюкозы. Однако делеция basABC лишь умеренно влияла на скорость роста и поглощение сахара. Эти результаты предполагают, что система Bas представляет собой новую систему сборки, участвующую в правильной локализации сахаросвязывающих белков в клеточной оболочке, которые имеют сигнальный пептид пилина.BasEF формирует ядро механизма сборки в мембране, в то время как BasABC помогает сборке связывающих белков с помощью еще не решенного механизма.
Бактерии выделяют гликозилированные белки и экзополимерные вещества (ЭПС) в среду для синтеза внеклеточных структур и биопленок. Образование EPS, не путать с гликозилированием белка, представляет собой сборку длинных полимеров сахара из различных моносахаридов, таких как глюкоза, манноза и фруктоза. EPS в большинстве случаев образуется в виде капсулы, окружающей клетку и тем самым увеличивая адгезию к поверхностям или укрепляя межклеточные контакты в клеточных агрегатах, что приводит к образованию биопленок [119–121].Другие функции EPS в биопленках заключаются, главным образом, в обеспечении стабильности структур биопленки и защиты от различных загрязняющих веществ в средах, таких как тяжелые металлы и токсичные органические соединения. Производство EPS обычно увеличивается, когда клетки подвергаются воздействию загрязняющих веществ. EPS и образование биопленок архей — новая область исследований. Используя флуоресцентно конъюгированные лектины, было продемонстрировано, что прикрепленные к поверхности клеток S. solfataricus продуцируют ЭПС, содержащие множество различных сахаров (глюкозу, маннозу, галактозу и N-ацетилглюкозамин) [86].Интересно, что внеклеточная сеть, продуцируемая PBL2025, штамм с делецией оказался отличным от штамма дикого типа S. solfataricus P2. В PBL2025 отсутствует набор из 50 генов, которые, согласно анализу BLAST-поиска, участвуют в метаболизме / катаболизме сахара и транспорте растворенных веществ через цитоплазматическую мембрану. Нарушение этих генов привело к избыточной продукции EPS, и анализ паттерна экспрессии этих генов в P2 показал, что они активируются во время поверхностного прикрепления клеток на слюде [86], что позволило идентифицировать первые гены, участвующие в модуляции секретируемых полисахариды.Большинство секретируемых архейных белков гликозилировано, и этот процесс подробно описан Эйхлером и Джарреллом в этом выпуске.
7. Выводы и перспективы
Электронно-микроскопические исследования культивируемых и некультивируемых архей выявили удивительное разнообразие придатков, связанных с клеточной поверхностью. В последние годы развитие генетических систем для ряда модельных архей позволяет проводить экспериментальные исследования сборки и функции этих структур по крайней мере у некоторых организмов.Эти исследования теперь быстро расширяют наше понимание того, как устроена поверхность клеток архей. Были идентифицированы различные структуры клеточной поверхности, такие как пили и жгутики, и их роль в межклеточных взаимодействиях и взаимодействиях с клеточной поверхностью начала быть раскрыта. Интересно, что секретируемые везикулы также были идентифицированы у разных видов архей, которые содержат специфический субнабор белков, включенных в эукариотически-подобные системы почкования пузырьков. Это иллюстрирует мозаичную природу архей, которые во многих случаях используют упрощенные эукариотические механизмы, подразумевающие аналогичное эволюционное происхождение.
Благодарности
Эта работа была поддержана Нидерландским центром протеомики (NPC) и грантом VIDI от Голландской научной организации (NWO) С. В. Альберсу, который также получил внутренние средства от Общества Макса Планка. А. Ф. Эллен и Б. Золгадр внесли равный вклад в эту работу.
Внеклеточное полимерное вещество — обзор
1.3 Иммунный ответ на экзопротеины в биопленке
Внеклеточные белки представляют собой еще один важный компонент ЭПС, который может конкурировать с экзополисахаридами с точки зрения общей массы биопленки. 31–34 Функционально экзопротеины жизненно важны для поддержания и модификации EPS, выполняя ферментативную деградацию структурных элементов для диспергирования и структурной перестройки. 35,36 Известно, что помимо поддержания и модификации матрикса, некоторые белки EPS, такие как ДНК-связывающие белки, являются ключевыми факторами физической стабильности архитектуры биопленки. Специальное нацеливание на эти белки антител было исследовано в качестве терапевтического средства для диспергирования биопленок. 37 Кроме того, было обнаружено, что многие другие белки специфичны для биопленок или, по крайней мере, имеют повышенную регуляцию роста биопленок и могут представлять собой дополнительные мишени для антител. 38–43 Также известно, что экзопротеины действуют во внеклеточном переваривании макромолекул для получения питательных веществ, поверхностной адгезии и адгезии EPS-каркаса, защиты от защитных клеток и молекул хозяина и межклеточной коммуникации 1,32,34 ; таким образом, воздействие на любой из этих механизмов клинически может препятствовать сохранению биопленки и вирулентности.
Многие группы пытались охарактеризовать протеом биопленки, и совершенно очевидно, что биопленки демонстрируют измененные транскриптомные и протеомные фенотипы. Например, Passmore et al. сравнили биопленку P. aeruginosa и планктонный «секретом» с помощью 2D-DiGE, выявив еще несколько белков, которые в большей степени экспрессируются клетками, происходящими из биопленки P. aeruginosa , чем планктонные клетки. 39 Точно так же Zijnge и соавторы использовали ЖХ-МС / МС для идентификации нескольких новых предполагаемых факторов вирулентности, продуцируемых Aggregatibacter actinomycetemcomitans в биопленке. 44 Хотя подобные исследования могут идентифицировать белки, специфичные для биопленок, мы еще не знаем, какую роль эти белки могут играть в модуляции иммунных ответов на биопленки.
В целом, существуют определенные характеристики бактериальных белков, которые действуют как PAMP или связанные с опасностями молекулярные структуры (DAMP, такие как n -формилметионин, пептид-инициатор трансляции прокариотических белков), которые по своей природе запускают врожденный иммунитет. отклик. 45 Формиловые пептидные рецепторы (FPR) представляют собой рецепторы, связанные с G-белком, присутствующие на поверхности фагоцитов хозяина, которые индуцируются при обнаружении и связывании прокариотических формилированных пептидов, воспалении и бактерицидной активности, такой как дегрануляция нейтрофилов и выработка супероксида. 46–49 Другие PRR, которые, как было показано, распознают микробные белки PAMP, включают TLR2 и TLR5. 50 Однако иммунный ответ на ЭПС-специфические экзопротеины недостаточно изучен, несмотря на растущее понимание их вклада в структуру и функцию биопленок. Здесь мы сообщаем о текущей литературе относительно ответа хозяина на внеклеточные белки в EPS, наиболее значительный из которых относится к вездесущему условно-патогенному микроорганизму, Staphylococcus aureus .
Было показано, что биопленки S. aureus содержат обширный экзопротеом из более чем 30 различных белков, функции которых варьируются от патогенеза (например, лейкоцидин и гемолизин) до иммуномодуляции (например, липопротеин, иммунодоминантные антигены, белок А, и IgG-связывающий белок), метаболизм углеводов (например, фосфоглицератмутаза, енолаза, глицеральдегид-3-фосфатдегидрогеназа, алкогольдегидрогеназа и фруктозобисфосфатальдолаза), метаболизм ДНК и стресс-реакция (например, фолдаза, ДНК-связывающий белок 2, нуклеаза и супероксиддисмутаза). 34,51–53 Brady et al. обнаружили, что более 20 специфичных для биопленок белков в биопленках остеомиелита S. aureus были иммуногенными. 51 Используя клинический штамм метициллин-резистентного S. aureus (MRSA) от пациента с остеомиелитом, исследователи индуцировали образование биопленки в большеберцовой кости кролика in vivo. Затем кроличьи сыворотки были собраны и использованы для исследования белков в биопленках in vitro (чтобы обойти проблему контаминации белков хозяина из образцов биопленок in vivo) с помощью вестерн-блоттинга и анализа MALDI-TOF, чтобы идентифицировать стафилококковые иммуногены в сравнении с существующими данными. генерируется из планктонных культур.
В другом исследовании, посвященном иммуногенности биопленок S. aureus , перитонеальные лейкоциты мышей стимулировали биопленкой или планктонными стафилококковыми культурами или их бесклеточными фильтратами, а затем производили цитокины (TNFα, IL-6, IL-10, MCP -1 и MIP-1α) определяли гемолитическую активность и продукцию стафилокиназы. 54 Было обнаружено, что аналогичные стафилококковые компоненты и метаболиты, обладающие иммуномодулирующими свойствами, присутствуют как в биопленочных, так и в планктонных фильтратах.Это говорит о том, что биопленки S. aureus обладают в некоторой степени «открытым» характером, и, несмотря на прикрытие бактериальной микроколонии ЭПС, многие факторы вирулентности S. aureus (например, PG, LTA, Hla) проникают в внешняя среда и, вероятно, играют роль в патогенезе.
Эти данные указывают на неотъемлемую антигенную природу многих белков биопленок, предполагая, что участвуют другие компоненты, помимо врожденной иммунной системы, учитывая гуморальный ответ. Следует отметить, что, несмотря на значительный иммунный ответ, биопленки все еще могут сохраняться, что еще раз подчеркивает физическую и химическую защиту, предоставляемую патогенам, живущим внутри биопленки.Однако некоторые исследователи пытались использовать антигенность бактериальных экзопротеинов в клинических целях. Например, Gil et al. недавно было обнаружено, что прививка мышей экстрактом экзопротеома из биопленки S. aureus значительно ингибировала последующее образование биопленок. 53 Это может свидетельствовать о том, что незрелые биопленки S. aureus менее способны компенсировать иммуногенность белков EPS, и что значительная экспрессия экзопротеома с большей вероятностью будет наблюдаться в устоявшихся биопленках.Эту гипотезу поддержали Брэди и др., Которые обнаружили, что некоторые иммуногенные белки вызывают ответ антител только после длительного периода инфицирования, составляющего более 28 или даже 42 дней.
Например, Saniu et al. смогли идентифицировать специфические Streptococcus mutans клеточные белки биопленки, которые распознаются иммуноглобулином А (IgA) в слюне людей, у которых был кариес зубов, по сравнению с теми, у кого этого не было. 55 Интересно, что подавляющее большинство белков, вызывавших реактивность IgA, были внутриклеточными белками, участвующими во внутриклеточных процессах, таких как биосинтез аминокислот, гликолиз и деление клеток, что дает дополнительные доказательства того, что, несмотря на то, что клетки биопленки погребены в EPS, их межклеточные белки являются все еще доступен для иммунной системы.
Ясно, что секрет культур планктонных клеток сильно отличается от секрета биопленок; однако мы очень мало знаем о том, как изменяется секретом биопленки в моно- и полимикробных биопленках, или если секретом, наблюдаемый in vitro, даже похож на наблюдаемый in vivo.Состав населения, безусловно, имеет значение. Например, в то время как разнообразие белков P. aeruginosa , секретируемых в полимикробных условиях, было ниже, чем в условиях монокультуры, некоторые секретируемые белки (такие как фактор вирулентности ToxA и гемофор HasAp) были однозначно экспрессированы в полимикробных биопленках. 56 Неудивительно, что клетки-хозяева по-разному реагируют на биопленки в зависимости от их видового состава. В недавнем исследовании многослойные культуры десневого эпителия человека подвергались воздействию биопленок, созданных до 10 различных видов бактерий в полости рта in vitro.Затем исследователи охарактеризовали эпителиальный секретом с помощью тандемной жидкостной хроматографии и масс-спектрометрии. 57 Группа определила в общей сложности 192 секретируемых белка-хозяина и отметила, что регуляция большего количества белков снижалась, чем повышалась после воздействия биопленок. Важно отметить, что на секретом клетки-хозяина сильно влиял видовой состав биопленки.
Идентификация, структура и характеристика экзополисахарида, продуцируемого Histophilus somni во время образования биопленки | BMC Microbiology
Inzana TJ, Corbeil LB: Haemophilus. Патогенез бактериальных инфекций у животных. Отредактировано: Gyles CLJFP, Songer JG, Thoen CO. 2004, Oxford: Blackwell Publishing Ltd, 243-257. 3
Google ученый
Siddaramppa S, Inzana TJ: Haemophilus somnus Факторы вирулентности и устойчивость к иммунитету хозяина. Anim Health Res Rev.2004, 5: 79-93. 10.1079 / AHR200466.
PubMed CAS Статья Google ученый
Corbeil LB, Gogolewski RP, Stephens LR, Inzana TJ: Haemophilus somnus : анализ антигена и иммунные ответы. Haemophilus, Actinobacillus и Pasteurella. Под редакцией: Доначи В., Лейнсон Ф.А., Ходжсон Дж. С.. 1995, Нью-Йорк: Plenum Press, 63-73.
Google ученый
Behling-Kelly E, Vonderheid H, Kim KS, Corbeil LB, Czuprynski CJ: Роли клеточной активации и сульфатированных гликанов в прикреплении Haemophilus somnus к эндотелиальным клеткам микрососудов головного мозга крупного рогатого скота.Заражение иммунной. 2006, 74: 5311-5318. 10.1128 / IAI.00614-06.
PubMed CAS PubMed Central Статья Google ученый
Gogolewski RP, Leathers CW, Liggitt HD, Corbeil LB: Experimental Haemophilus somnus пневмония у телят и иммунопероксидазная локализация бактерий. Vet Pathol. 1987, 24: 250-256.
PubMed CAS Google ученый
Mandrell RE, Griffiss JM, Macher BA: липоолигосахариды (LOS) Neisseria gonorrhoeae и Neisseria meningitidis имеют компоненты, которые иммунологически подобны предшественникам антигенов группы крови человека. J Exp Med. 1988, 168: 107-126. 10.1084 / jem.168.1.107.
PubMed CAS Статья Google ученый
Mandrell RE, McLaughlin R, Kwaik YA, Lesse A, Yamasaki R, Gibson B, Spinola SM, Apicella MA: липоолигосахариды (LOS) некоторых видов Haemophilus имитируют гликосфинголипиды человека, а некоторые LOS являются сиалилированными.Заражение иммунной. 1992, 60: 1322-1328.
PubMed CAS PubMed Central Google ученый
Cox AD, Howard MD, Brisson J-R, Van Der Zwan M, Thibault P, Perry MB, Inzana TJ: Структурный анализ липоолигосахарида с переменной фазой из штамма Haemophilus somnus 738. Eur J Biochem. 1998, 253: 507-516. 10.1046 / j.1432-1327.1998.2530507.x.
PubMed CAS Статья Google ученый
McQuiston JH, McQuiston JR, Cox AD, Wu Y, Boyle SM, Inzana TJ: Характеристика области ДНК, содержащей 5′-CAAT-3 ‘последовательности ДНК, участвующие в биосинтезе липоолигосахаридов в Haemophilus somnus . Microb Pathog. 2000, 28: 301-312. 10.1006 / mpat.1999.0351.
PubMed CAS Статья Google ученый
Wu Y, McQuiston JH, Cox A, Pack TD, Inzana TJ: Молекулярное клонирование и мутагенез локуса ДНК, участвующего в биосинтезе липоолигосахаридов в Haemophilus somnus .Заражение иммунной. 2000, 68: 310-319. 10.1128 / IAI.68.1.310-319.2000.
PubMed CAS PubMed Central Статья Google ученый
Howard MD, Cox AD, Weiser JN, Schurig GG, Inzana TJ: Антигенное разнообразие липоолигосахарида Haemophilus somnus : доступность фосфорилхолинового эпитопа с переменной фазой. J Clin Microbiol. 2000, 38: 4412-4419.
PubMed CAS PubMed Central Google ученый
Inzana TJ, Glindemann G, Cox AD, Wakarchuk W, Howard MD: Включение N -ацетилнейраминовой кислоты в липоолигосахарид Haemophilus somnus (LOS): повышение устойчивости к сыворотке и снижение связывания антител LOS. Заражение иммунной. 2002, 70: 4870-4879. 10.1128 / IAI.70.9.4870-4879.2002.
PubMed CAS PubMed Central Статья Google ученый
Виддерс П.Р., Смит Дж. У., Ярналл М., Макгуайр Т.С., Корбейл Л.Б.: Связывание неиммунного иммуноглобулина Haemophilus somnus .J Med Microbiol. 1988, 26: 307-311. 10.1099 / 00222615-26-4-307.
PubMed CAS Статья Google ученый
Ярналл М., Гоголевски Р.П., Корбейл Л.Б.: Характеристика двух рецепторов Haemophilus somnus Fc. J Gen Microbiol. 1988, 134: 1993–1999.
PubMed CAS Google ученый
Corbeil LB, Blau K, Prieur DJ, Ward ACS: Сывороточная чувствительность к Haemophilus somnus из клинических случаев крупного рогатого скота и носителей.J Clin Microbiol. 1985, 22: 192-198.
PubMed CAS PubMed Central Google ученый
Gomis SM: Внутриклеточная выживаемость Haemophilus somnus в моноцитах бычьей крови и альвеолярных макрофагах. Microb Pathog. 1998, 25: 227-235. 10.1006 / mpat.1998.0228.
PubMed CAS Статья Google ученый
Ховард М.Д., Бун Дж. Х., Бюхнер-Максвелл В., Шуриг Г. Г., Инзана Т. Дж.: Ингибирование продукции супероксидных анионов бычьих макрофагов и полиморфно-ядерных лейкоцитов с помощью Haemophilus somnus .Microb Pathog. 2004, 37: 263-271.
PubMed CAS Статья Google ученый
Lederer JA, Brown JF, Czuprynski CJ: « Haemophilus somnus », факультативный внутриклеточный патоген мононуклеарных фагоцитов крупного рогатого скота. Заражение иммунной. 1987, 55: 381-387.
PubMed CAS PubMed Central Google ученый
Gomis SM, Godson DL, Beskorwayne T, Wobeser GA, Potter AA: Модуляция фагоцитарной функции мононуклеарных фагоцитов крупного рогатого скота с помощью Haemophilus somnus .Microb Pathog. 1997, 22: 13-21. 10.1006 / mpat.1996.0086.
PubMed CAS Статья Google ученый
Corbeil LB: Histophilus somni Взаимоотношения паразит-хозяин. Anim Health Res Rev.2007, 8: 151-160. 10.1017 / S1466252307001417.
PubMed Статья Google ученый
Zekarias B, Mattoo S, Worby C, Lehmann J, Rosenbusch RF, Corbeil LB: Histophilus somni IbpA DR2 / Fic в вирулентности и иммунопротекции на естественном альвеолярном эпителиальном барьере хозяина.Заражение иммунной. 2010, 78: 1850-1858. 10.1128 / IAI.01277-09.
PubMed CAS PubMed Central Статья Google ученый
Sylte MJ, Corbeil LB, Inzana TJ, Czuprynski CJ: Haemophilus somnus индуцирует апоптоз в эндотелиальных клетках крупного рогатого скота in vitro. Заражение иммунной. 2001, 69: 3: 1650-1660.
PubMed Статья Google ученый
Силте М.Дж., Инзана Т.Дж., Чупрински К.Дж .: Реактивные промежуточные соединения кислорода и азота способствуют апоптозу эндотелиальных клеток крупного рогатого скота, опосредованному липоолигосахаридами Haemophilus somnus .Vet Immunol Immunopathol. 2004, 97: 207-217. 10.1016 / j.vetimm.2003.09.005.
PubMed CAS Статья Google ученый
Sylte MJ, Kuckleburg CJ, Atapattu D, Leite FP, McClenahan D, Inzana T.J., Czuprynski CJ: Передача сигналов через рецептор интерлейкина-1 типа 1 уменьшает Haemophilus somnus липоолигосахарид-опосредованных эндосахаридных клеток. Microb Pathog. 2005, 39: 121-130. 10.1016 / j.micpath.2005.07.001.
PubMed CAS Статья Google ученый
Challacombe JF, Duncan AJ, Brettin TS, Bruce D, Chertkov O, Detter JC, Han CS, Misra M, Richardson P, Tapia R, Thayer N, Xie G, Inzana TJ: полная последовательность генома Haemophilus somnus ( Histophilus somni ) штамм 129Pt и сравнение с Haemophilus ducreyi 35000 HP и Haemophilus influenzae Rd. J Bacteriol.2007, 189: 1890-1898. 10.1128 / JB.01422-06.
PubMed CAS PubMed Central Статья Google ученый
Corboz L: Эпидемиология инфекции « Haemophilus somnus » у крупного рогатого скота: колониальные варианты штаммов, выделенных из различных источников. Haemophilus, Pasteurella, Actinobacillus. Под редакцией: Килиан М.В.Ф., Биберштейн Э.Л. 1981, Лондон: Academic Press, 133–142.
Google ученый
Стивенс Л.Р., Литтл ПБ: Ультраструктура Haemophilus somnus , возбудителя инфекционного тромбоэмболического менингоэнцефалита крупного рогатого скота. Amer J Vet Res. 1981, 42: 1638-1640.
PubMed CAS Google ученый
Миллер Р.Дж., Реншоу Х.В., Эванс HW: Комплекс Haemophilus somnus : антигенность и специфичность фракций Haemophilus somnus . Am J Vet Res. 1975, 36: 1123-1128.
PubMed CAS Google ученый
Sandal I, Hong W, Swords WE, Inzana TJ: Характеристика и сравнение развития биопленок патогенными и комменсальными изолятами Histophilus somni . J Bacteriol. 2007, 189: 8179-8185. 10.1128 / JB.00479-07.
PubMed CAS PubMed Central Статья Google ученый
Лазарь В., Чифирюк М.К .: Архитектура и физиология микробных биопленок. Roum Arch Microbiol Immunol. 2010, 69: 95-107.
PubMed CAS Google ученый
Inzana TJ, Corbeil LB: Разработка определенной среды для Haemophilus somnus от крупного рогатого скота. Am J Vet Res. 1987, 48: 366-369.
PubMed CAS Google ученый
Inzana TJ: Очистка и частичная характеристика капсульного полимера Haemophilus pleuropneumoniae серотипа 5.Заражение иммунной. 1987, 55: 1573-1579.
PubMed CAS PubMed Central Google ученый
Inzana TJ, Iritani B, Gogolewski RP, Kania SA, Corbeil LB: Очистка и характеристика липоолигосахаридов из четырех штаммов « Haemophilus somnus ». Заражение иммунной. 1988, 56: 2830-2837.
PubMed CAS PubMed Central Google ученый
Dubois M, Hamilton A, Rebers PA, Smith F: Колориметрический метод определения сахаров и родственных веществ. Anal Chem. 1956, 28: 350-356. 10.1021 / ac60111a017.
CAS Статья Google ученый
Пелконен С., Хайринен Дж., Финне Дж. Электропорез в полиакриламидном геле капсульных полисахаридов Escherichia coli K1 и других бактерий. J Bacteriol. 1988, 170: 2646-2653.
PubMed CAS PubMed Central Google ученый
Min H, Cowman MK: Комбинированное окрашивание гликозаминогликанов в полиакриламидных гелях альциановым синим и серебром: применение для электрофоретического анализа распределения молекулярной массы. Анальная биохимия. 1986, 155: 275-285. 10.1016 / 0003-2697 (86) -9.
PubMed CAS Статья Google ученый
Inzana TJ, Mathison B: серотипическая специфичность и иммуногенность капсульного полимера Haemophilus pleuropneumoniae серотипа 5.Заражение иммунной. 1987, 55: 1580-1587.
PubMed CAS PubMed Central Google ученый
Inzana TJ: Упрощенная процедура подготовки сенсибилизированных латексных частиц для обнаружения капсульных полисахаридов: применение для типирования и диагностики Actinobacillus pleuropneumoniae . J Clin Microbiol. 1995, 33: 2297-2303.
PubMed CAS PubMed Central Google ученый
Ward CK, Inzana TJ: Устойчивость Actinobacillus pleuropneumoniae к бактерицидному антителу и комплементу опосредуется капсульным полисахаридом и блокирующим антителом, специфичным для липополисахарида. J Immunol. 1994, 153: 2110-2121.
PubMed CAS Google ученый
Sandal I, Hong W, Swords WE, Inzana TJ: Характеристика и сравнение развития биопленок патогенными и комменсальными изолятами Histophilus somni .J Bacteriol. 2007, 189: 8179-8185. 10.1128 / JB.00479-07.
PubMed CAS PubMed Central Статья Google ученый
Грейнер Л.Л., Эдвардс Дж.Л., Шао Дж., Рабинак С., Энтц Д., Апичелла М.А.: Формирование биопленок с помощью Neisseria gonorrhoeae . Заражение иммунной. 2005, 73: 1964-1970. 10.1128 / IAI.73.4.1964-1970.2005.
PubMed CAS PubMed Central Статья Google ученый
Leontein K, Lindberg B, Lonngren J, Carlo DJ: Структурные исследования капсульного полисахарида из Streptococcus pneumoniae типа 12A. Carbohydr Res. 1983, 114: 257-266. 10.1016 / 0008-6215 (83) 88192-0.
PubMed CAS Статья Google ученый
Lee YC, Ballou CE: Полные структуры гликофосфолипидов микобактерий. Биохим. 1965, 4: 1395-1404. 10.1021 / bi00883a026.
CAS Статья Google ученый
Ранс М., Соренсен О. В., Боденхаузен Г., Вагнер Г., Эрнст Р. Р., Вутрих К.: Улучшенное спектральное разрешение в уютных спектрах ЯМР 1 H белков за счет двойной квантовой фильтрации. Biochem Biophys Res Commun. 1983, 117: 479-485. 10.1016 / 0006-291X (83)
PubMed CAS Статья Google ученый
Chomczynski P: Реагент для одноэтапного одновременного выделения РНК, ДНК и белков из образцов клеток и тканей.Биотехники. 1993, 15: 532-537.
PubMed CAS Google ученый
Inzana TJ: Электрофоретическая гетерогенность и межштаммовые вариации липополисахарида Haemophilus influenzae . J Infect Dis. 1983, 148: 492-499. 10.1093 / infdis / 148.3.492.
PubMed CAS Статья Google ученый
Леб М.Р., Захари А.Л., Смит Д.Х.: Выделение и частичная характеристика наружных и внутренних мембран инкапсулированных Haemophilus influenzae типа b.J Bacteriol. 1981, 145: 596-604.
PubMed CAS PubMed Central Google ученый
Молинаро А., Пископо В., Ланцетта Р., Паррилли М.: Структурное определение сложного экзополисахарида из вирулентного штамма Cryphonectria parasitica . Carbohydr Res. 2002, 337: 1707-1713. 10.1016 / S0008-6215 (02) 00283-5.
PubMed CAS Статья Google ученый
Sandal I, Shao JQ, Annadata S, Apicella MA, Boye M, Jensen TK, Saunders GK, Inzana TJ: Histophilus somni образование биопленки в сердечно-легочной ткани коровьего хозяина после респираторного заражения. Микробы заражают. 2009, 11: 254-263. 10.1016 / j.micinf.2008.11.011.
PubMed CAS Статья Google ученый
Райдер С., Берд М., Возняк Д. Д.: Роль полисахаридов в развитии биопленки Pseudomonas aeruginosa .Curr Opin Microbiol. 2007, 10: 644-648. 10.1016 / j.mib.2007.09.010.
PubMed CAS PubMed Central Статья Google ученый
Дэвис Д.Г., Чакрабарти А.М., Гиси Г.Г. Производство экзополисахаридов в биопленках: субстратная активация экспрессии альгинатного гена с помощью Pseudomonas aeruginosa . Appl Environ Microbiol. 1993, 59: 1181-1186.
PubMed CAS PubMed Central Google ученый
Falsetta ML, McEwan AG, Jennings MP, Apicella MA: Анаэробный метаболизм происходит в субстрате гонококковых биопленок и может частично поддерживаться оксидом азота. Заражение иммунной. 2010, 78: 2320-2328. 10.1128 / IAI.01312-09.
PubMed CAS PubMed Central Статья Google ученый
Кларк В.Л., Кэмпбелл Л.А., Палермо Д.А., Эванс TM, Климпель К.В.: Индукция и репрессия белков внешней мембраны анаэробным ростом Neisseria gonorrhoeae .Заражение иммунной. 1987, 55: 1359-1364.
PubMed CAS PubMed Central Google ученый
Виноградов Е., Петерсен Б., Бок К.: Структурный анализ интактного полисахарида маннана из дрожжей Saccharomyces cerevisiae с использованием спектроскопии ЯМР 1 H и 13 C при 750 МГц. Carbohydr Res. 1998, 307: 177-183.
PubMed CAS Статья Google ученый
Howard MD, WL, Wakarchuk W., St. Michael F, Cox A, Horne W.T., Hontecilas R, Bassaganya-Riera J, Lorenz E, Inzana TJ: Генетика и молекулярная специфичность сиалирования липоолигосахарида Histophilus somni (LOS) и влияние сиалирования LOS на передачу сигналов Toll-подобного рецептора-4. Vet Microbiol. 2011,
Google ученый
Ram S, Sharma AK, Simpson SD, Gulati S, McQuillen DP, Pangburn MK, Rice PA: Новый сайт связывания сиаловой кислоты на факторе H опосредует резистентность в сыворотке сиалированной Neisseria gonorrhoeae .J Exp Med. 1998, 187: 743-752. 10.1084 / jem.187.5.743.
PubMed CAS PubMed Central Статья Google ученый
Фигейра М.А., Рам С., Голдштейн Р., Худ Д.В., Моксон Э.Р., Пелтон С.И.: Роль комплемента в защите среднего уха, выявленная путем восстановления вирулентности нетипируемых мутантов Haemophilus influenzae siaB. Заражение иммунной. 2007, 75: 325-333. 10.1128 / IAI.01054-06.
PubMed CAS PubMed Central Статья Google ученый
Swords WE, Moore ML, Godzicki L, Bukofzer G, Mitten MJ, VonCannon J: Сиалирование липоолигосахаридов способствует образованию биопленок нетипируемыми Haemophilus influenzae . Заражение иммунной. 2004, 72: 106-113. 10.1128 / IAI.72.1.106-113.2004.
PubMed CAS PubMed Central Статья Google ученый
Greiner LL, Watanabe H, Phillips NJ, Shao J, Morgan A, Zaleski A, Gibson BW, Apicella MA: нетипируемый Haemophilus influenzae штамм 2019 образует биопленку, содержащую N -ацетилнейраминовую кислоту, которая может имитировать сиалированные О-связанные гликаны.Заражение иммунной. 2004, 72: 4249-4260. 10.1128 / IAI.72.7.4249-4260.2004.
PubMed CAS PubMed Central Статья Google ученый
Jurcisek J, Greiner L, Watanabe H, Zaleski A, Apicella MA, Bakaletz LO: Роль сиаловой кислоты и биосинтеза сложных углеводов в формировании биопленки нетипируемыми Haemophilus influenzae в среднем ухе шиншиллы. Заражение иммунной. 2005, 73: 3210-3218. 10.1128 / IAI.73.6.3210-3218.2005.
PubMed CAS PubMed Central Статья Google ученый
Hood DW, Makepeace K, Deadman ME, Rest RF, Thibault P, Martin A, Richards JC, Moxon ER: Сиаловая кислота в липополисахариде Haemophilus influenzae : распределение штаммов, влияние на устойчивость сыворотки и структурную характеристика. Mol Microbiol. 1999, 33: 679-692. 10.1046 / j.1365-2958.1999.01509.x.
PubMed CAS Статья Google ученый
Джексон К.Д., Старки М., Кремер С., Парсек М.Р., Возняк Д.Д.: Идентификация psl , локуса, кодирующего потенциальный экзополисахарид, который необходим для образования биопленки Pseudomonas aeruginosa PAO1. J Bacteriol. 2004, 186: 4466-4475. 10.1128 / JB.186.14.4466-4475.2004.
PubMed CAS PubMed Central Статья Google ученый
Берд М.С., Садовская И., Виноградов Е., Лу Х., Спринкл А.Б., Ричардсон С.Х., Ма Л., Ральстон Б., Парсек М.Р., Андерсон Е.М., Лам Дж.С., Возняк Д.Д.: Генетический и биохимический анализ псевдомонад aeruginosa Экзополисахарид Psl обнаруживает перекрывающиеся роли ферментов синтеза полисахаридов в продукции Psl и LPS.Mol Microbiol. 2009, 73: 622-638. 10.1111 / j.1365-2958.2009.06795.x.
PubMed CAS PubMed Central Статья Google ученый
Иида А., Хараяма С., Иино Т., Хазельбауэр Г.Л.: Молекулярное клонирование и характеристика генов, необходимых для транспорта и использования рибозы в Escherichia coli K-12. J Bacteriol. 1984, 158: 674-682.
PubMed CAS PubMed Central Google ученый
Mollerach M, Lopez R, Garcia E: Характеристика гена galU из Streptococcus pneumoniae , кодирующего уридиндифосфоглюкозопирофосфорилазу: ген, необходимый для биосинтеза капсульного полисахарида. J Exp Med. 1998, 188: 2047-2056. 10.1084 / jem.188.11.2047.
PubMed CAS PubMed Central Статья Google ученый
Вонг С.М., Акерли Б.Дж.: Экологическая и генетическая регуляция фосфорилхолинового эпитопа липоолигосахарида Haemophilus influenzae .Mol Microbiol. 2005, 55: 724-738.
PubMed CAS Статья Google ученый
Гены | Бесплатный полнотекстовый | Синтез ризобиальных экзополисахаридов и их значение для симбиоза с бобовыми растениями
1. Введение
Ризобии — это грамотрицательные почвенные бактерии, принадлежащие к α- и β-протеобактериям, которые могут взаимодействовать с бобовыми растениями-хозяевами. В условиях ограничения азота они вызывают образование клубеньков на корнях растений-хозяев, вторгаются в клубеньки и колонизируют их, а внутри них восстанавливают диазот до аммиака, который используется растениями.В сложных условиях окружающей среды, таких как почва, в которой ресурсы ограничены, а условия жизни изменчивы, часто преобладают виды бактерий с большими и сложными геномами. Геномы ризобий в основном состоят из хромосомы и нескольких плазмид. Гены, связанные с симбиотическим взаимодействием с растениями, обычно расположены в одной из плазмид (так называемая симбиотическая плазмида, pSym) или в хромосоме в виде симбиотических островов [1,2]. Помимо pSym, другие части ризобиального генома, особенно несимбиотические плазмиды, могут влиять на симбиотические характеристики бактерий, кодируя дополнительные факторы, такие как белки и полисахариды клеточной поверхности, которые влияют на конкурентоспособность и азотфиксацию [3,4,5,6, 7,8].Симбиоз ризобий и бобов специфичен и зависит от обмена сигнальными молекулами, такими как флавоноиды, секретируемые растениями, которые рекрутируют совместимые ризобии [9]. Посредством взаимодействия с регуляторным белком NodD флавоноиды индуцируют экспрессию генов нодуляции ризобий (nod), кодирующих ферменты, необходимые для синтеза специфических липохитоолигосахаридов, называемых факторами Nod (NF) [4,10,11,12]. NF является ключевым сигнальным фактором, распознаваемым рецептором фактора Nod (NFR), который инициирует первые реакции растений, такие как завивание корневых волосков, когда ризобии оказываются в ловушке [13,14,15,16].Бактерии, захваченные микроколониями, проникают в корни и колонизируют их через трубчатые структуры, называемые инфекционными нитями, которые представляют собой прогрессирующие врастания мембран растительных клеток, содержащих матрикс, состоящий из материала стенок растительных клеток; однако маловероятно, что EPS является необходимым структурным компонентом матрицы инфекционной нити [17]. Внутри корневых волосков бактерии размножаются и вызывают деления в клетках коры корня, что приводит к образованию зачатков клубеньков [17,18,19]. В зачатке клубенька ризобии высвобождаются путем эндоцитоза из инфекционных нитей и образуют компартменты, называемые симбиосомами, где бактерии окружены мембранами, полученными из растений-хозяев [12,20].В симбиосомах бактерии дифференцируются в бактероиды, то есть азотфиксирующие формы ризобий, которые восстанавливают диазот до аммиака, передаваемого растению-хозяину. В свою очередь, бактерии получают углерод и источники энергии от фотосинтеза растений и находят нишу для роста и размножения в клубеньках бобовых [21,22,23,24,25]. Каждый шаг симбиоза ризобий-растение жестко контролируется сложной сетью сигнальных каскадов в растении [26]. Недавно было продемонстрировано, что эпидермальные и корковые реакции на ризобиальную инфекцию координируются с помощью передачи сигналов фитогормона цитокининов и ауксинов растений [18,27].Бобовые, принадлежащие к семейству Fabaceae, образуют клубеньки двух основных типов: индетерминантные и детерминантные [28,29]. Неопределенные клубеньки, образованные бобовыми культурами, принадлежащими к кладе галегоидов подсемейства Papilionoideae (например, Medicago, Trifolium, Vicia, Pisum и Astragalus), так называемая клада с перевернутым повторением (IRLC), имеют устойчивые меристемы, которые остаются активными в течение развитие узелка целиком. Внутри этих клубеньков новые поколения растительных клеток, инфицированных ризобиями, образуют градиент развития из морфологически различных зон: апикальной меристемы клубенька, зоны инвазии, в которую нити инфекции высвобождают ризобии, зоны азотфиксации, а также стареющие и сапрофитные зоны.Внутри узелков этого типа бактероиды окончательно дифференцируются, потому что они необратимо трансформируются в полиплоидию и не могут вернуться в жизнеспособную форму [19,29,30,31,32]. В обоих типах клубеньков бактероиды обнаруживают изменения в экспрессии генов и метаболической активности, тогда как большие изменения в содержании ДНК происходят только во время дифференцировки бактероидов в неопределенных клубеньках [31]. Несмотря на бактериоидную дегенерацию, небольшая часть ризобиальных клеток в сапрофитной зоне клубеньков остается в жизнеспособной вегетативной форме, массово размножается в инфекционных потоках и может быть извлечена из клубеньков после старения клубеньков, что увеличивает популяцию бактерий в почве. [33,34,35,36,37].Терминальная дифференцировка бактероидов контролируется хозяином и зависит от присутствия клубенько-специфических богатых цистеином (NCR) пептидов, которые подобны дефенсинам, описанным у видов галегоидов [34]. Существует предположение, что пептиды NCR вмешиваются во многие аспекты метаболизма бактероидов и могут оптимизировать процесс азотфиксации [32,38]. В определенных клубеньках, образованных фазоидными бобовыми (например, Phaseolus, Lotus и Glycine), функции меристемы только в начале развития клубеньков, т.е.е., образование зачатков клубеньков. Бактероиды, фиксирующие азот, жизнеспособны и могут превращаться в свободноживущие формы. Рост узелков возможен во многом из-за разрастания клеток; следовательно, узелки имеют сферическую форму и однородны по развитию [29,34,38,39,40].2. Ризобиальные экзополисахариды играют разнообразную роль в симбиотическом взаимодействии с бобовыми растениями
Развитие эффективного симбиоза зависит не только от генов, непосредственно необходимых для симбиоза и расположенных в основном на плазмидах pSym, но и от генов, ответственных за производство различных типов полисахариды клеточной поверхности [3,4].Поверхность ризобиальных клеток содержит множество полисахаридов, таких как локализованный на внешней мембране липополисахарид (LPS), полисахарид капсулы (CPS), гелеобразующий полисахарид (GPS), экзополисахариды (EPS), полисахарид K-антигена (KPS), циклический β- (1,2) глюканы и высокомолекулярный нейтральный полисахарид (NP или глюкоманнан) [6,41,42]. ЛПС закреплен на внешней мембране и состоит из липида А, основного олигосахарида и полисахарида О-антигена. Липополисахарид важен на более поздних стадиях симбиоза [43].Нейтральные CPS образуют своего рода полисахаридную матрицу, прочно связанную с поверхностью клетки. Его нерастворимая гелеобразная форма синтезируется в стационарной фазе роста Rhizobium leguminosarum и Rhizobium trifolii [44]. В свою очередь, циклические нейтральные β- (1,2) глюканы расположены в периплазматическом пространстве и играют важную роль при гипоосмотической адаптации и заражении растений [45]. Ризобиальный KPS структурно напоминает K-антигены Escherichia coli [46], в то время как глюкоманнан, который локализуется исключительно на одном из полюсов бактериальной клетки, важен для высокоаффинного связывания лектинов гороха и вики и конкурентной клубеньки ризобии [42,47].Экзополисахариды, продуцируемые ризобиями, представляют собой химически различные видоспецифичные гетерополимеры, состоящие из линейных или разветвленных повторяющихся звеньев, содержащих моносахариды, такие как d-глюкоза, d-галактоза, d-манноза, l-рамноза, d-глюкуроновая кислота и d- галактуроновая кислота, обычно замещенная неуглеводными группами (например, ацетильная, пирувильная, сукцинильная и 3-гидроксибутаноильная группы) [48,49,50,51] (Рисунок 1). Гетерогенность экзополисахаридных структур, а также разнообразие гликозидных связей и степень полимеризации повторяющейся единицы отражаются в сложном пути биосинтеза EPS [41].Экзополисахарид — это внеклеточный полимер, который слабо связан с бактериальной поверхностью и, таким образом, обильно выделяется в окружающую среду. Преобладание ЭПС в различных бактериях, а также многочисленные и разнообразные функции, приписываемые этому гетерополимеру (включая защиту от стрессов, образование биопленок и прикрепление к абиотическим поверхностям и корням растений-хозяев, а также получение питательных веществ), что дает микробам адаптивные экологические преимущества. , являются причиной того, что этому секретируемому полисахариду уделяется особое внимание [3,6].Хотя существует множество исследований роли ЭПС в симбиозах, механизмы, в которых ЭПС определяют полезные взаимодействия между хозяином и симбионтом у бобовых, остаются в основном неизвестными. Однако было описано несколько недавних открытий, касающихся симбиотической функции EPS. Было показано, что у ризобий, индуцирующих детерминированные узелки, EPS играет сигнальную роль на поздних стадиях как инициации инфекции, так и высвобождения бактерий в симбиозе с Lotus japonicus [54]. Мутанты Mesorhizobium loti, пораженные на средних или поздних стадиях биосинтеза ЭПС, индуцировали неинфицированные зачатки клубеньков, а иногда и несколько инфицированных клубеньков.Эти мутанты были разрушены на стадии развития инфекционной нити (ИТ). С другой стороны, у Sinorhizobium fredii Hh203, эффективно клубеньков различных бобовых, в том числе растений, образующих детерминантные и неопределенные клубеньки, отсутствие EPS увеличивает его конкурентоспособность по отношению к клубенькам сои, предполагая, что в этом взаимодействии EPS является незаменимым, но снижает способность Hh203 инфицировать это растение [55]. В симбиозе галегоидных бобовых, несколько классов поверхностных полисахаридов, по-видимому, необходимы для инициирования и распространения инфекционных потоков и развития клубеньков [10,43,56].Роль ЭПС в инфекционном процессе наиболее интенсивно изучалась у симбиозов Sinorhizobium meliloti и Rhizobium leguminosarum. Мутанты, не продуцирующие ЭПС, способны вызывать скручивание корневых волос, но не вызывают образование инфекционных нитей и узелков, фиксирующих азот [6,10,57,58,59]. S. meliloti продуцирует симбиотически активный сукциногликан (EPS I) и галактоглюкан (EPS II). Галактоглюкан представляет собой полимер повторяющейся единицы дисахарида, состоящей из ацетилированной глюкозы и остатка пирувилированной галактозы [60], и он был постулирован как симбиотически важный экзополисахарид S.meliloti [61]. Сукциногликан состоит из повторяющихся звеньев октасахарида, состоящих из одной галактозы и семи остатков глюкозы и модифицированных сукцинильными, ацетильными и пирувильными заместителями. EPS R. leguminosarum состоит из октамеров, состоящих из одной галактозы, двух глюкуроновой кислоты и пяти остатков глюкозы, декорированных O-ацетильными и пирувильными заместителями (рис. 1). Эти EPS производятся в двух полимерных формах: с низкой молекулярной массой (LMW), состоящей из мономеров, димеров и тримеров основной субъединицы, и с высокой молекулярной массой (HMW) с массой 10 6 –10 7 Да [6 , 43,62,63,64].Уже давно постулируется, что фракция LMW EPS в S. meliloti и R. leguminosarum важна для эффективной инфекции клубеньков [65,66,67]. Однако недавние данные однозначно показывают, что мутанты S. meliloti, которые не продуцируют LMW-сукциногликан, устанавливают продуктивный симбиоз с Medicago truncatula, хотя и с меньшей эффективностью, чем штамм дикого типа [68]. Ранее было доказано, что мутант exoH S. meliloti продуцирует неукцинилированный EPS I в форме HMW EPS, который не расщепляется специфическими гликаназами и вызывает снижение количества неэффективных клубеньков на люцерне, в которых прекращается инфекционное течение [69, 70,71].Mendis et al. [68] продемонстрировали, что двойной мутант, дефицитный по гликаназам ExoH и ExoK, не продуцировал LMW EPS, но был способен установить продуктивный симбиоз с M. truncatula. Это указывает на то, что фракция LMW EPS не играет существенной роли в симбиозе; однако для эффективного клубеньков необходимо сукцинилирование EPS. Более того, было доказано, что LMW-гексозосодержащий сахаросодержащий материал, продуцируемый двойными мутантами ExoH / ExoK, скорее всего, был циклическим β-глюканом. Эти результаты подтвердили, что сукцинилированный HMW EPS I необходим для продуктивного симбиоза S.meliloti с модельным растением Medicago truncatula [68]. Высокомолекулярная фракция EPS может служить защитой от высыхания бактерий [72]. Также было показано, что отрицательно заряженные сукцинильные и пирувильные остатки в EPS I играют важную роль. Потеря сукцинильных групп в EPS I привела к увеличению вязкости и жесткости полимерной цепи [73]. Отсутствие отрицательного заряда снижает способность сукциногликана реагировать с положительно заряженными ионами в матрице инфекционного нити [74].Более того, ацилирование сукциногликана может изменять его способность подавлять активные формы кислорода (АФК) внутри инфекционных нитей и, таким образом, влиять на их образование [75]. Повышенное количество кислого сукциногликана, продуцируемого S. meliloti, сверхэкспрессирующим ген exoY, кодирующий примирующую галактозилтрансферазу, усиливает симбиотическую активность. продуктивность инокулированного M. truncatula. Было высказано предположение, что уровень экзополисахарида, продуцируемого ризобиями, может быть одним из факторов, участвующих в оптимизации взаимодействия с растениями-хозяевами [76].У R. leguminosarum фракция HMW EPS может быть полезной на стадии инфекции. Было замечено, что мутанты R. leguminosarum, которые продуцируют больше экзополисахаридов с более высокой степенью полимеризации, чем штамм дикого типа, способствуют производству большего количества зеленой массы инфицированных растений клевера [63,77]. Роли, которые LMW и HMW EPS играют в симбиотическом взаимодействии, коррелируют с функциями, которые LMW и HMW полисахариды играют у других бактерий; например, О-антиген S (короткая цепь) Shigella flexneri определяет вирулентность штамма [78], а О-антиген VL (очень длинная цепь) делает бактерии устойчивыми к системе врожденного иммунитета комплемента [79].Недавно Кавахарада и др. [80] пролили свет на узнавание ЭПС бобовыми растениями, и был идентифицирован рецепторный белок растений, взаимодействующий с ЭПС ризобий. Mesorhizobium loti продуцирует кислый ЭПС, состоящий из О-ацетилированных октамеров рибозы, глюкозы и галактозы, и вступает в симбиоз с L. japonicus, образуя клубеньки детерминированного типа [54,81,82,83]. Мутант M. loti в гене exoU продуцировал усеченный EPS (пентагликан), образовывал колонии с грубой морфологией и индуцировал небольшое количество неэффективных мелких клубеньков на растениях-хозяевах [54].Таким образом, мутант ExoU не был затронут в индукции ранних симбиотических реакций хозяина, таких как завивка корневых волос, но не образовывал нормальных инфекционных нитей. Это позволило сделать вывод, что усеченный EPS ускользает от распознавания мутированной формой рецепторного белка хозяина, что приводит к нормальной нодуляции [80]. Было обнаружено, что мутантный штамм растения-супрессора в гене Epr3, обозначенный как экзополисахаридный рецептор 3, образует инфицированные клубеньки с мутантом exoU. Экзополисахаридный рецептор 3 (EPR3), идентифицированный у L.japonicus оказался трансмембранным рецептором-подобным белком со значительным сходством с белком NFR1 (рецептор 1 фактора Nod), ответственным за распознавание ризобиального NF, но с уникальной доменной организацией. И EPR3, и NFR1 имеют три внеклеточных домена LysM, связанных с хитин-связывающими белками. Внутриклеточный киназный домен, присутствующий в обоих белках, трансдуцирует сигнал от рецептора к внутриклеточным сигнальным каскадам. Кавахарада и др. [80] продемонстрировали, что как EPS дикого типа, так и функциональный рецептор EPR3 необходимы для устойчивой инициации потока инфекции.В анализе in vitro было доказано, что очищенные мономеры EPS могут распознаваться очищенным эктодоменом EPR3 путем прямого связывания, что указывает на то, что распознавание осуществляется на стадии инфекции и колонизации эпидермальных клеток. Экспрессия гена Epr3 в корневых волосках и эпидермальных клетках чувствительной зоны запускается факторами Nod, передающими сигналы через NRF1 и NRF5 (киназы сериновых / треониновых рецепторов), которые отвечают за первый симбиотический сигнал, передаваемый растительным клеткам, приводящий к нескольким ответам, включая транскрипцию. Epr3 и восприятие структурно специфичных ЭПС у инфицирующих бактерий.Существует сильное предположение, что EPR3 различает структуры EPS и отрицательно реагирует на несовместимые EPS и положительно на совместимые EPS [80]. В дальнейшем исследовании Kawaharada et al. [84] установили, что действие белка рецептора EPR3 не ограничивается корневыми волосками, но способствует развитию внутриклеточной инфекции и коррелирует с инвазией инфекционных нитей коркового вещества корня и зачатков клубеньков, способствуя эффективному инфицированию растений. Было высказано предположение, что распознавание совместимого EPS с помощью EPR3 повторяется во время прогрессирования инфекции и способствует механизму внутриклеточной корковой инфекции.Наличие EPS и восприятия EPS посредством EPR3 важно для прогрессирования клубеньковой инфекции и влияет на развитие клубенька. Мутация генов синтеза Epr3 или EPS снижает или устраняет инфицирование узелков инфекционными потоками и снижает количество инфицированных клеток [84]. Эти последние результаты значительно продвинули наше понимание механизма заражения ризобиями, при котором структурно совместимые EPS могут распознаваться специфическими рецепторами растений-хозяев.3. Wzx / Wzy-зависимый синтез экзополисахарида в Rhizobium leguminosarum bv.trifolii
Текущее состояние знаний о биосинтезе ЭПС было получено в результате всесторонних исследований сукциногликана, продуцируемого S. meliloti, и, в меньшей степени, из исследования синтеза ЭПС на модели R. leguminosarum, и этот вопрос недавно был подробно рассмотрен [41, 85]. Вкратце, было обнаружено, что гены, управляющие биосинтезом экзополисахаридов, многочисленны и помещены в большие кластеры (часто синтеничные в геномах различных видов ризобий), расположенные либо в хромосоме, либо в мегаплазмидах [86,87,88,89].В мегаплазмиде pSymB S. meliloti был обнаружен большой (> 30 т.п.н.) кластер из 28 генов exo / exs. Гены кодируют ферменты, необходимые для синтеза предшественников нуклеотидных сахаров, белков, участвующих в сборке и модификации единиц, а также тех, которые необходимы для полимеризации повторяющихся единиц и транспорта EPS вне клетки [90,91,92,93,94,95] . Примечательно, что несколько других генов, необходимых для биосинтеза EPS I и регуляции этого процесса, были обнаружены рассредоточенными по хромосоме S.meliloti [96,97]. Как правило, полисахариды могут быть полностью синтезированы в цитоплазме перед транспортировкой за пределы клетки или с помощью механизма, при котором повторяющиеся субъединицы сначала синтезируются в цитоплазме, а затем транспортируются в периплазму для полимеризации, а затем секреции [ 98,99]. Экзополисахариды синтезируются по второй схеме, называемой Wzx / Wzy-зависимой, с участием двух ключевых белков: Wzx (флиппаза) и Wzy (полимераза). Эти белки отсутствуют в системах биосинтеза полисахаридов, основанных на активности АТФ-связывающих кассетных (ABC) -транспортеров [100] или синтазы (например.g., альгинат, продуцируемый Pseudomonas) [101]. Полисахариды, такие как декстран, продуцируются секретируемым или ассоциированным с клеткой внеклеточным ферментом [99]. В случае пути, зависимого от переносчика ABC, полисахарид (в основном капсульный) синтезируется в цитоплазме и впоследствии транспортируется через периплазму посредством ABC. -семейный белок. Если в области генов биосинтеза полисахаридов кодируется только одна гликозилтрансфераза, продуцируемый полисахарид является гомополимером, а если имеется больше генов, кодирующих гликозилтрансферазы, образуется гетерополимер [101].Полисахариды, такие как курдлан, целлюлоза или альгинат, синтезируются и транспортируются из цитоплазмы с помощью мембранной синтазы, которая представляет собой процессивную гликозилтрансферазу, способную образовывать полимер и способствовать прохождению полимера через мембрану. Полимер транспортируется за пределы клетки с участием периплазматического белка, действующего как каркас и предотвращающего деградацию полисахарида, и β-цилиндрического белка, расположенного во внешней мембране. Белки этой системы не связаны с компонентами Wzx / Wzy-зависимой и ABC-транспортной систем [101].В Wzx / Wzy-зависимом пути субъединицы олигосахаридных повторов сначала синтезируются вместе с так называемым липидным якорем ундекапренилфосфатом (undPP) из-за активности специфических гликозилтрансфераз. Биосинтетические предшественники, то есть активированные производные нуклеотидных сахаров (NDP-сахара), синтезируются в цитоплазме поверх und-PP. Полные олигосахаридные повторяющиеся единицы переносятся из цитоплазмы в периплазматические створки внутренней мембраны за счет активности флиппазы Wzx [102].Еще будучи закрепленными на внутренней мембране, они соединяются в периплазме с помощью полимеразы Wzy. В процессе сборки последнего полисахарида участвует белок, лишенный полимеризационной активности, но незаменимый в процессе и участвующий в регуляции длины цепи, так называемая полисахаридная сополимераза (PCP) [98]. Затем возникающая полисахаридная цепь экспортируется за пределы клетки.3.1. Основные субъединицы EPS синтезируются гликозилтрансферазами
Генетический контроль продукции EPS у R.leguminosarum была частично охарактеризована на молекулярном уровне, и были проанализированы функции нескольких генов, участвующих в этом процессе, генов pss (синтез полисахаридов). У R. leguminosarum основной набор генов биосинтеза EPS (> 20 генов) сгруппирован в хромосомной области, названной Pss-I [87,88,89] (Рисунок 2). Область Pss-I содержит гены, кодирующие гликозилтрансферазы, ответственные за синтез субъединиц EPS (за исключением pssA, кодирующего белок, участвующий в первой стадии синтеза EPS, ответственный за добавление глюкозо-1-фосфата к полипренилфосфатному носителю) [103,104] и гены чьи продукты образуют систему сборки и экспорта EPS, i.например, предполагаемая флиппаза [105], полисахаридная полимераза [63], белок сополимеразы [64] и белок канала внешней мембраны [106] (рис. 2). Локус Pss-I является высококонсервативным и синтенным. между R. leguminosarum bvs. trifolii (Rlt) и viciae (Rlv) и близкородственные Rhizobium etli (Rhe). Сохранение консервативного порядка генов обычно не является случайным признаком, потому что соответствующее соседство генов дает клетке адаптивное преимущество [107]. Таким образом, кластеризация основного набора генов EPS кажется не случайной и, вероятно, отражает их скоординированную экспрессию и точную, сложную регуляцию, осуществляемую как на транскрипционном, так и на посттранскрипционном уровнях, на что дополнительно влияют многочисленные факторы окружающей среды (включая свет), а также рост и стрессовые условия [41,108,109,110].Многочисленные гены, участвующие в биосинтезе поверхностных полисахаридов, также были обнаружены рассредоточенными в геномах R. leguminosarum, например, ортолог exoB, участвующий в биосинтезе различных гетерополисахаридов (EPS, CPS, LPS, GPS, глюкоманнан) [42,111], был обнаружен в хромосома, регуляторные гены psi и psr [112], расположенные в симбиотической плазмиде (pSym), в то время как гены rosR, exoR [113,114] и pssB [115] расположены в другом месте хромосомы. Информации о гликозилтрансферазах относительно мало, т.е.е., представители белков, участвующих в биосинтезе экзополисахарида у ризобий. В целом, гликозилтрансферазы представляют собой разнообразное семейство белков, что находит отражение в растущем содержании базы данных CAZy (Carbohydrate Active Enzymes) [116]. Связь между аминокислотной последовательностью предполагаемой гликозилтрансферазы и ее специфичностью не очевидна, что затрудняет прогнозирование ее функции только на биоинформатической основе [99,117]. Функции ферментов, активных на различных стадиях синтеза субъединиц сукциногликана, и фенотипические эффекты мутаций были охарактеризованы на модели S.meliloti [94,95,118]. Однако информации о взаимодействиях между гликозилтрансферазами и предполагаемых взаимоотношениях между гипотетическим комплексом гликозилтрансфераз и белками, активными на более поздних стадиях синтеза, нет. Функции нескольких гликозилтрансфераз, кодируемых внутри и вне области Pss-I у R. leguminosarum bv. trifolii ранее изучались в нашей группе. Среди них наиболее изучена праймирующая глюкозилизопренилфосфат (IP) -трансфераза PssA, инициализирующая синтез октасахаридов путем переноса глюкозы в липид-связанный undPP [103,119].Глюкуронозил-β-1,4-глюкозилтрансфераза PssDE переносит глюкуроновую кислоту на глюкозу [104,120], а другой остаток глюкуроновой кислоты переносится глюкуронозил-β-1,4-глюкуронозилтрансферазой PssC [121]. Мутации в генах, кодирующих гликозилтрансферазы, могут приводить к полному ингибированию синтеза EPS (pssA, pssE, pssD) [104,119,120] или к снижению уровня синтеза, как в случае мутанта pssC [122]. Последний результат интересен, так как указывает на то, что мутация не блокирует полимеризацию субъединиц, предполагая, что конкретная клеточная функция берет на себя другой белок.Ферменты, участвующие в более поздних стадиях синтеза субъединиц, подробно не исследованы. Известно, что pssS кодирует гипотетический белок, похожий на гликозилтрансферазы с GT-B-складкой (класс инвертирующих гликозилтрансфераз с характерной топологией, состоящей из двух β / α / β доменов Россмана, которые обращены друг к другу и гибко связаны), наиболее вероятно участвует в четвертом этапе сборки единицы, т. е. присоединении последнего остатка глюкозы к основной цепи [123]. Биоинформатический анализ показал, что не охарактеризованные гипотетические гены гликозилтрансфераз, участвующие в биосинтезе EPS, могут присутствовать среди белков, кодируемых в области Pss-I.Стоит отметить, что во всех случаях данные, касающиеся гликозилтрансфераз у ризобий, ограничиваются подтверждением участия в биосинтезе EPS или функции, определенной на основе сходства аминокислотных последовательностей. Механизмы действия, субстратная специфичность, доменная структура или взаимодействия между гликозилтрансферазами и взаимодействия с другими белками еще предстоит расшифровать.3.2. Субъединицы EPS переносятся через внутреннюю мембрану под действием Wzx-флиппазы
Wzx-флиппаза принадлежит к семейству белков PST (переносчик полисахаридов) в суперсемействе экспортеров множественных лекарств / олигосахаридил-липидов / полисахаридов (MOP) [124].Он представляет собой класс белков, механизм действия которых был недавно выяснен. Несмотря на преобладание генов, кодирующих Wzx, в доменах Bacteria и Archaea, уровень сходства аминокислотных последовательностей между белками очень низок. Недавно было показано, что транслоказы Wzx обычно адаптируются к своей нативной повторяющейся единице, что обеспечивает объяснение большого разнообразия генов wzx, которое сопровождается большим разнообразием перемещаемых структур [125]. В то же время белки PST характеризуются специфической топологией с 10–14 предсказанными TMS (трансмембранными сегментами) [124].Единственными данными, касающимися структуры белков Wzx, являются модели топологии мембран для четырех белков Wzx различных видов бактерий. Общей темой во всех этих моделях является наличие 12 TMS, хотя методология, использованная в экспериментах, была другой [105,126,127,128]. Islam et al. [127] идентифицировали интересные (и ранее опускаемые) особенности, такие как присутствие заряженных остатков в TMSs, т.е. феномен, который не наблюдался в других топологических исследованиях флиппазов [127].Специфическая функция Wzx заключается в переносе гидрофильного полисахарида, закрепленного на гидрофобном носителе, через внутреннюю мембрану. Недавно были предоставлены подтверждающие доказательства того, что перенос происходит в соответствии с механизмом H + -зависимого антипорта, при котором запускаются конформационные изменения и перестройки между трансмембранными сегментами Wzx, так что олигосахарид, все еще закрепленный в мембране, связывается в просвете белка и высвобождается на другой стороне мембраны [102,127,129,130].Компоненты Wzx / Wzy-зависимой системы сборки, т.е. гены, кодирующие полимеразу, сополимеразу и транслоказу, обычно объединяются в кластеры. То же верно и для области Pss-I у R. leguminosarum bv. trifolii; Исключением является ген, кодирующий флиппазу, расположенный в другом месте, однако, в непосредственной близости от генов, кодирующих гликозилтрансферазу. Флиппаза Wzx у R. leguminosarum bv. trifolii кодируется геном pssL. Предполагаемый белок был сначала аннотирован как альтернативная полисахаридная полимераза из-за сходства топологии этих белков у Rhizobium [105].Однако обновленный анализ in silico позволил более точно обозначить PssL как предполагаемую флиппазу, наиболее вероятно действующую в переносе субъединиц EPS из цитоплазматического в периплазматический листок внутренней мембраны. Модель топологии мембраны PssL была первой предложенной для этого семейства белков [105]. Несмотря на то, что полученная in silico модель с 12 TMS была полностью подтверждена с помощью подхода слияния PhoA / LacZ, некоторые важные особенности белка Wzx (например, присутствие положительно заряженных аминокислотных остатков в трансмембранных сегментах), по-видимому, не были учтены из-за реализованная методология, т.е.е., исследуя предвзятую модель, сделанную in silico [127]. Функция pssL в транслокации субъединиц EPS не была подтверждена, поскольку получение нулевого мутанта в модели R. leguminosarum bv. trifolii TA1 (RtTA1) было невозможно [105].3.3. Белок Wzy отвечает за полимеризацию субъединиц EPS
Wzy представляет собой полисахаридную полимеразу, белок с активностью гликозилтрансферазных связывающих субъединиц для образования полисахарида [131]. Подобно флиппазам, белки Wzy характеризуются низким уровнем сходства аминокислотных последовательностей и одновременно отличительной топологией с 10–14 TMS и 1-2 периплазматическими доменами (PL; меньше на N-конце и больше на C-конце). ) [63,127,132].Как и в случае с белками Wzx, трудности в получении структурных данных сделали картирование топологии важным для раскрытия важных функциональных особенностей этих белков. Последняя топологическая модель, описанная Islam et al. [127], для белка Wzy в Pseudomonas aeruginosa PAO1 была моделью, основанной на объективной локализации С-концевой репортерной метки [127]. Специфические аминокислотные мотивы были идентифицированы внутри больших периплазматических петель PL3 и PL5, присутствующих в Wzy. Эти мотивы RX 10 G содержат ключевые остатки аргинина, важные для функции Wzy.Несмотря на высокую степень сохранения последовательности, контекст последовательности способствует совершенно разным зарядовым характеристикам обеих петель, то есть совершенно разным значениям изоэлектрической точки (pI) [133]. Из-за различного суммарного заряда эти домены представляют собой сайты связывания для двух версий одного и того же олигосахарида, то есть основной субъединицы в форме, связанной с липидным носителем, а затем как часть растущего полисахарида. Wzy-зависимая полимеризация связанных повторяющихся звеньев undPP происходит в периплазме.PL3 будет функционировать как захватывающее плечо для входящих отрицательно заряженных субъединиц. Большая периплазматическая петля PL5 с ее более отрицательно заряженной средой должна обеспечивать сайт для связывания и высвобождения растущей цепи. Этот предполагаемый механизм был назван «поймать и высвободить» [133]. Важность остатков аргинина была также подтверждена для активности полимеризации Wzy у Shigella flexneri. Белок имеет мотив RX 15 G как в PL3, так и в PL5. Однако, в то время как в Wzy у P. aeruginosa остатки Arg PAO1 обнаруживаются в основном внутри специфических мотивов RX 10 G, у S.flexneri Wzy также есть несколько остатков Arg, расположенных между этими двумя мотивами. Также было обнаружено, что периплазматические домены S. flexneri Wzy обладают зарядовыми характеристиками, отличными от таковых у Wzy в P. aeruginosa PAO1. Последнее может быть связано с различиями в чистом заряде олигосахаридов, переносимых определенными белками [134]. Биоинформатический поиск позволил идентифицировать такие консервативные остатки Arg, а также гомологию последовательностей PL3-PL5 у филогенетически разнообразных бактерий [135].Белки Wzy демонстрируют огромные вариации последовательности (аналогично белкам Wzx). Недавно было доказано, что эти полимеразы могут даже различать внутренние связи в идентичных в остальном олигосахаридных единицах [136]. У R. leguminosarum bv. trifolii, pssT, кодирующая EPS-полимеразу, была идентифицирована раньше, чем ген, кодирующий pssL-флиппазу. Его роль в синтезе ЭПС была подтверждена мутагенезом. Мутант с геном pssT, разрушенным вблизи 3′-конца, продуцировал больше EPS, чем штамм дикого типа, а экзополисахарид содержал больше цепей с более высокой молекулярной массой (фракция HMW) [63].Выявлены взаимодействия между полисахаридной полимеразой и сополимеразой (описанной ниже) у R. leguminosarum bv. trifolii и другие бактерии проливают свет на этот фенотип. На мутант в pssT влияет контроль длины экзополисахарида из-за нарушений белок-белковых взаимодействий внутри «центра полимеризации EPS» [77]. PssT содержит 12 TMS. Сначала мы предположили, что белок имеет только одну большую периплазматическую петлю (PL5). Однако недавнее исследование последовательности белка в поисках мотивов RX 10 G, необходимых для функции полимеразы [133], а также тщательное изучение ранее необъяснимых экспериментальных данных показали, что топология PssT, скорее всего, напоминает топологию Wzy в П.aeruginosa PAO1 [127] с двумя большими доменами и мотивами PL, содержащими остатки аргинина, важные для гликозилтрансферазной активности белка полимеразы [77].3.4. Сополимеразы полисахаридов определяют длину экзополисахаридных цепей
Полимеризация субъединиц EPS (или повторяющихся блоков O-антигена) в системе Wzx / Wzy в значительной степени зависит от других белков, лишенных гликозилтрансферазной активности, но незаменимых в процессе полимеризации. Эти белки специфически влияют на длину полимера, образующегося в данном штамме, и первоначально были классифицированы как детерминанты длины цепи (Cld / Rol) [137], а затем как вспомогательные мембранные периплазматические (MPA) [138] и полисахаридные сополимеразы (PCP). [139].Недавно группа белков PCP была классифицирована как бактериальные тирозинкиназы (BYK) [140, 141]. Белки, принадлежащие к этому семейству, характеризуются низкой консервативностью среди различных бактерий, но вместе с тем имеют характерную топологию с одной большой периплазматической петлей, фланкированной двумя трансмембранными сегментами [138, 139]. Механизмы, определяющие штамм-специфические длины цепей полисахаридов, все еще недостаточно изучены. Несколько моделей было предложено с тех пор, как впервые был обнаружен феномен определения длины цепи.Tocilj et al. [142] предложили модель, зависящую от стехиометрии белкового комплекса, содержащего PCP. Другие результаты предполагают, что длина цепи, определяющая функцию PCP, зависит от определенных аминокислотных остатков [143]. В случае PCP, участвующего в определении длины цепей О-антигена у P. aeruginosa, сообщалось, что уровень белка коррелировал не с длиной, а с количеством полисахаридных цепей. Длина цепей О-антигена зависела от конкретного аминокислотного остатка в домене спиральной спирали (спиральные спирали специфически присутствуют в периплазматических доменах PCP) [144, 145] и свидетельствует о том, что длина цепи О-антигена связана с стабильность гомодимеризации сополимеразы с положительной корреляцией между стабильностью димера и образованием более длинных цепей.Было показано, что одиночные аминокислотные мутации в белке PCP, контролирующие длину цепи O-антигена у S. flexneri, вызывают тонкие и локализованные структурные изменения, которые резко влияют на распределение длин цепи LPS [146], и консервативные остатки глицина во втором фрагменте. трансмембранный сегмент играет роль во взаимодействиях белок-белок и вносит вклад в характерную модальность O-антигена [147]. Полисахаридные сополимеразы белков, участвующих в синтезе O-антигена, незначительно отличаются от белков, участвующих в синтезе экзополисахаридов.Последние обладают дополнительным протяженным цитоплазматическим доменом и характеризуются аутофосфорилирующей киназной активностью. Было показано, что эта тирозинкиназная активность влияет на олигомеризацию белка, продукцию экзополисахарида и регуляцию длины полимерной цепи [148]. Наиболее всеобъемлющий механизм функции PCP предложен Исламом и Ламом [98] и называется «цепной». -фидбэк-линейка ‘; он объединяет генетические и структурные данные о различных PCP, участвующих в определении длины экзополисахаридов и O-антигенов в различных бактериях.Согласно этой модели, белки полимеразы и PCP взаимодействуют друг с другом и с растущим полисахаридом и удерживают его в заданном положении, что способствует добавлению дополнительных субъединиц. Удлинение полимера приводит к его сворачиванию в более упорядоченные структуры, что вызывает ослабление взаимодействий между Wzy и PCP и прекращение «удлинения» полисахарида [98]. Белок PssP ранее был идентифицирован как обладающий характеристиками полисахарида. -полимеразы и незаменим в синтезе EPS в RtTA1 [64].Это большой олигомерный белок, расположенный во внутренней мембране [77]. Это важно для биосинтеза, так как делеционный мутант не продуцирует EPS. Как и другие белки PCP, PssP участвует в определении длины цепей, образующихся из-за активности полисахаридной полимеразы PssT. Укорочение белка на С-конце изменяет соотношение HMW: LMW EPS, продуцируемого мутантом, за счет фракции LMW. Это свидетельствует о том, что белок не только необходим для синтеза EPS, но и необходим для образования HMW-формы EPS [64].Транспорт экзополисахаридов за пределы клетки происходит через канал, образованный в грамотрицательной внешней мембране олигомерами белков Wza. Wza представляет собой липопротеин, расположенный на внешней мембране, который образует октамерный α-спиральный канал, охватывающий мембрану, но основная масса белка существует в виде большой периплазматической структуры [149,150,151,152]. Стратегия перекрестного сшивания in vivo помогла уловить полисахаридную цепь внутри просвета канала Wza, тем самым предоставив первое доказательство того, что Wza фактически является каналом для экспорта полимеризованной экзополисахаридной цепи [153].Было показано, что белки Wza и PCP взаимодействуют друг с другом, образуя канал трансконтажа или платформу, открывающуюся в цитоплазму и в окружающую среду, окружающую клетку, через которую полисахарид выходит за пределы клетки [154]. Были показаны сополимеразы полисахаридов. чтобы сформировать туннель транс-оболочки для растущей полисахаридной цепи, взаимодействуя с транслоказой внешней мембраны [155]. Роль транслоказы наружной мембраны у R. leguminosarum bv. trifolii обслуживается PssN.Было показано, что PssN является липопротеином внешней мембраны, способным образовывать гомоолигомерные структуры, содержащие не менее четырех протомеров [106]. Его вторичная структура и топология, характерная для Wza-подобных белков, вместе с недавно обнаруженными взаимодействиями с белком PssP, дали твердую поддержку гипотезе о том, что белок служит транслоказой внешней мембраны для экзополисахарида (хотя это было невозможно нарушить ген) [77]. Механизмы биосинтеза и транслокации полисахаридов за пределы клетки должны быть скоординированы во времени и пространстве.Это возможно только благодаря взаимодействию белков, участвующих в процессах. Существование такого мультибелкового комплекса было предложено с момента первоначальной концепции Wzx / Wzy-зависимого пути синтеза [156]. Исследования подтверждают существование таких мультибелковых взаимодействий в Wzx / Wzy-зависимом пути, но во всех случаях они представляют собой фрагментарные данные для различных модельных бактерий. Некоторые данные касаются образования гомоолигомерных структур (с различным количеством вовлеченных протомеров) с помощью белков PCP [77,142,157,158,159,160], Wzy [77,132] и Wza [106,152].Как и ожидалось изначально, количество данных, свидетельствующих о существовании гетерологичных взаимодействий, растет. Марольда и др. [161] предоставили генетические доказательства взаимодействий между Wzx-Wzy и PCP, в то время как другие данные касались взаимодействия между Wzy и PCP [77, 134, 135, 162, 163] и PCP и Wza [77, 155]. Недавно Нат и Морона [164] подтвердили давно постулируемое физическое взаимодействие между полимеразой и сополимеразой (в данном случае Wzz). Им удалось совместно очистить Wzy и Wzz от мембран S.flexneri. Никакие взаимодействия между гликозилтрансферазами, действующими в Wzx / Wzy-зависимом пути, не были экспериментально продемонстрированы и все еще существуют в качестве постулата. Исследования архитектуры и механизма действия транспортной системы EPS у R. leguminosarum bv. trifolii предоставляют некоторые доказательства существования существенной и сложной сети взаимодействий между различными компонентами, которые активны на разных стадиях процесса сборки EPS [77,106,163] (Figure 3). Олигомерный комплекс сополимеразы PssP, расположенный во внутренней мембране, взаимодействует с олигомером, образованным липопротеином PssN внешней мембраны и олигомерной полимеразой PssT [77].Предполагается, что сополимераза PssP взаимодействует также с PssL флиппазой, на что указывают результаты двухгибридного анализа [77]. В свете доступных данных, PssP может образовывать мост между PssL флиппазой и PssT полимеразой и служить каркасом для молекул полимеразы, согласно модели, предложенной Tocilj et al. [142]. Последнее отразилось на результатах картирования доменов взаимодействия в белках PssT и PssP. В случае белка PssP было показано, что делеции его различных доменов вызывают неспособность образовывать гомоолигомеры, но не полностью отменяют способность белка взаимодействовать с PssT [77].В соответствии с этим, мутанты с более короткими вариантами PssP продуцировали EPS, в котором преобладали фракции LMW [64]. В случае белка PssT удаление его С-концевой части сделало белок более склонным к гомоолигомеризации, но отсутствие того же домена сделало его взаимодействия с PssP необнаруживаемыми [77]. Удаление С-концевой части PssT у мутанта привело к продукции EPS с большинством цепей HMW [64] (Рисунок 3).3,5. Другие области генома, которые способствуют синтезу (экзо) полисахаридов
Pss-I — не единственный кластер генов, участвующих в синтезе полисахаридов у R.leguminosarum; четыре других региона (обозначенные Pss-II – Pss-V) с генами-кандидатами были идентифицированы как в хромосоме, так и в плазмиде [88] (Рисунок 2). Кластер Pss-II, расположенный примерно в 200 т.п.н. от области Pss-I, был почти идентичен с точки зрения последовательности и порядка генов соответствующей части хромосомы Rlv с лишь незначительными изменениями по сравнению с Rhe. Было высказано предположение, что Pss-II может участвовать в биосинтезе LPS, EPS или CPS, поскольку он группирует гены, организация и сходство последовательностей которых указывают на гипотетические функции гликозилтрансфераз, полимеразы Wzy-типа, флиппазы Wzx-типа, транслоказы Wza-типа и PCP. сополимераза, т.е.е., ключевые компоненты Wzx / Wzy-зависимой системы [88, 163] (Рисунок 2). Pss-III представляет собой область биосинтеза полисахарида, переносимого плазмидой RtTA1, с неизвестной функцией. Высокогомологичный сегмент был обнаружен в Rlv, но не в геноме Rhe. Pss-IV и Pss-V являются другими участками биосинтеза хромосомных полисахаридов, предположительно функционально связанными с биосинтезом LPS. Обе эти области были синтеничны сегментам, обнаруженным в Rlv и Rhe (Рисунок 2). Более того, многие другие предполагаемые гены биосинтеза ЛПС и небольшие кластеры (acpXL, lpc, lpxQ, lpsB, kdtA) были обнаружены в R.leguminosarum и Rhe [87, 165, 166, 167]. Очевидное обилие генов биосинтеза полисахаридов может быть демонстрацией метаболической избыточности, типичной для геномов ризобий [87,89,168,169], или универсальности поверхности клеток ризобий, состоящей из множества полисахаридов, которым приписывается множество адаптивных биологических функций. Многочисленные локусы Pss могут кодировать альтернативные пути синтеза поверхностных полисахаридов. Например, у R. leguminosarum кислый CPS имеет сходную или даже идентичную структуру с кислым EPS [51], отличаясь только неуглеводными остатками [50].Таким образом, гены Pss-I, Pss-II и Pss-III могут вносить вклад в биосинтез CPS у R. leguminosarum. С другой стороны, предполагаемое функциональное перекрытие генов биосинтеза полисахаридов, расположенных в разных регионах, можно предположить, и это предположение, по-видимому, дополнительно подтверждается плейотропными эффектами, вызываемыми мутациями в генах pss [170]. Недавние функциональные исследования, проведенные Marczak et al. [163] предоставили важные данные, касающиеся вопроса о потенциальной функциональной взаимосвязи / взаимозаменяемости продуктов генов, кодируемых в отдельных кластерах Pss.Сополимераза PssP2, кодируемая внутри Pss-II, обладает большинством характерных черт этого семейства, например специфической топологией. Инструменты, позволяющие обнаруживать удаленные гомологи, позволяют однозначно аннотировать pssP2 как белок PCP; однако менее чувствительный традиционный поиск на основе последовательностей также указал на сходство с семейством Wzz / Wzc [163]. Фенотип мутанта pssP2, кодирующего белок, лишенный 153 аминокислот из его С-концевого цитоплазматического домена, показал, что белок не только действовал как сополимераза, но и его функция была комплементарной белку PssP.Мутант продуцировал больше ЭПС, чем штамм дикого типа, и с преобладанием фракций HMW с цепями с молекулярными массами выше, чем у штамма дикого типа [163]. Одна из гипотез относительно регуляции степени полимеризации полисахаридов предполагает, что гликозилтрансферазы должны взаимодействовать с флиппаза и сополимераза, и это шаг, на котором может действовать регулирование длины цепи [171]. Ключевым элементом такого комплекса может быть прайминговая гликозилтрансфераза PssA [119].Взаимодействие с сополимеразой может контролировать поток субъединиц от предполагаемого гликозилтрансферазного комплекса к сайту полимеризации. Было показано, что PssP2 взаимодействует с гликозилтрансферазой PssC и белками PssP / PssT, формирующими «центр полимеризации» субъединиц EPS [163] (рис. 3). Следовательно, когда PssP может служить мостом между флиппазой и полимеразой и участвовать в синтезе фракции HMW EPS, PssP2 может быть связующим звеном между гликозилтрансферазами и полимеразой и участвовать в полимеризации фракции LMW EPS.PssP2 и PssP, таким образом, могут выполнять взаимодополняющие / противоположные роли в определении степени полимеризации EPS [163]. Участие двух сходных белков в полимеризации EPS будет напоминать участие двух белков Wzz в бимодальном распределении O-антигена у S. flexneri, где два белка конкурируют за контроль степени полимеризации [172]. Более того, у S. meliloti для продукции форм сукциногликана HMW и LMW требуется более одного паралога PCP [173]. Функции других генов в области Pss-II не изучены; однако их глубокий анализ кажется разумным, чтобы прояснить функциональную важность большого количества гомологов, участвующих в синтезе одного и того же полисахарида.У R. leguminosarum и Rhe большинство генов биосинтеза полисахаридов являются хромосомными без различимой плазмиды pExo, такой как описанная ранее для S. meliloti, несущего кластеры exo / exs [86]. Тем не менее, плазмиды не кажутся полностью незаменимыми в отношении биосинтеза поверхностных структур. Некоторые локусы синтеза полисахаридов были картированы вне хромосом в Rlt, Rlv и Rhe [88,89,174]. Производные RtTA1, излеченные от pRleTA1b или pRleTA1d и особенно удаленные в pRleTA1a (в которых ранее не были картированы гены, связанные с биосинтезом полисахаридов), продуцируют несколько более высокие количества EPS по сравнению с диким типом, что свидетельствует о существовании сложной регуляторной сети синтеза EPS, состоящей из генов, расположенных на разных плазмидах и особенно на pSym [175].Ранее было показано, что внехромосомные репликоны придают бактериям значительную метаболическую гибкость, что важно для их адаптации в почве и конкурентоспособности клубеньков [7,8,176], а также может быть вызвано модуляцией состава поверхности ризобий. Было показано, что качество и количество поверхностных полисахаридов, особенно экзополисахаридов (EPS) и липополисахаридов (LPS), продуцируемых ризобиями, могут влиять как на их аутоагрегацию, так и на образование биопленок [177,178,179].Взаимодействие ризобиальных клеток с поверхностью, приводящее к образованию биопленки, играет решающую роль в инфицировании корневых волос во время симбиоза [180].4. Выводы
Распространенность и неоднородность бактериальных поверхностных полисахаридов, а также их разнообразные функции давно привлекают внимание ученых. Это особенно заметно в исследованиях симбиоза Rhizobium-plant, где бактериальные поверхностные структуры, особенно экзополисахариды (EPS), составляют ключевой детерминант успешного взаимодействия между симбиотическими партнерами.Комплексное исследование продукции сукциногликана (EPS I) у S. meliloti предоставило важные данные о роли биосинтеза EPS в модели ризобий. Однако дальнейшие исследования расширили наши знания о сложном пути экспорта и функции EPS.
Во-первых, механизмы, в которых EPSs определяют полезные взаимодействия в бобовых, долгое время оставались неизвестными, с постулируемой сигнальной ролью EPS, которая не была распознана на молекулярном уровне. Недавние открытия пролили свет на распознавание ЭПС бобовыми растениями, и был идентифицирован рецепторный белок растений EPR3, взаимодействующий с ЭПС ризобий.Киназный домен, присутствующий в EPR3, трансдуцирует сигнал от рецептора к внутриклеточным сигнальным каскадам. Паттерн экспрессии EPR3 предполагает, что восприятие EPS рецепторным белком важно для прогрессирования инфекции и развития клубеньков.
Во-вторых, ранее был сделан вывод, что повторяющиеся субъединицы EPS синтезируются в цитоплазме, транспортируются в периплазму, полимеризуются, а затем секретируются за пределы клетки. Wzx / Wzy-зависимый путь, управляющий синтезом EPS, был признан у R.leguminosarum модель. Он включает действие двух ключевых белков: флиппазы Wzx-типа PssL и полимеразы Wzy-типа PssT. Флиппаза PssL, скорее всего, переносит субъединицы EPS из цитоплазмы в периплазматический листок внутренней мембраны. PssT-зависимая полимеризация олигосахаридных единиц, связанных с undPP, происходит в периплазме с вовлечением двух периплазматических доменов, содержащих мотивы с остатками аргинина, важными для гликозилтрансферазной активности полимеразы. PssP, большой олигомерный белок внутренней мембраны, был идентифицирован как сополимераза полисахаридов, участвующая в определении длины цепей EPS.PssN, гомоолигомерный липопротеин внешней мембраны, представляет собой транслоказу внешней мембраны, позволяющую экспортировать растущие полисахаридные цепи за пределы клетки. Было предоставлено доказательство того, что белки, составляющие Wzx / Wzy-зависимую систему сборки EPS у R. leguminosarum bv. trifolii создают сложную сеть, в которой образуются гомоолигомерные структуры и гетерокомплексы.
Наконец, функциональные исследования предполагаемых локусов pss, кодируемых за пределами основного кластера генов Pss-I, участвующих в продукции EPS, показали, что обилие генов биосинтеза полисахаридов может быть не только случайным признаком, но и просто демонстрацией типичной метаболической избыточности. для геномов ризобий.Было показано, что белок PssP2, кодируемый в области Pss-II у R. leguminosarum, взаимодействует с белками, кодируемыми в области Pss-I. Было высказано предположение, что аналогичные сополимеразы PssP и PssP2 могут играть комплементарные / противоположные роли в определении степени полимеризации EPS. Было также продемонстрировано, что производные R. leguminosarum, излеченные от плазмид, в которых ранее не были картированы гены pss, продуцировали несколько более высокие количества EPS по сравнению со штаммом дикого типа. Это свидетельствует о существовании сложной сети взаимодействий между белками синтеза полисахаридов, кодируемыми в разных компартментах геномов ризобий.Эти последние открытия также, по-видимому, определяют направление будущих исследований биосинтеза EPS в ризобиальной модели. Открытым вопросом является функция многочисленных генов-гомологов, участвующих в синтезе одного и того же полисахарида, и взаимодействия их продуктов с уже распознанными белками Pss.
Пенополистирол (пенополистирол): использование, структура и свойства
E xpanded P oly S тирол (EPS) — белый пенопласт, изготовленный из твердых шариков полистирола.Он в основном используется для упаковки, изоляции и т. Д. Это жесткий пенопласт с закрытыми ячейками, изготовленный из:
- Стирол, образующий ячеистую структуру
- Пентан, используемый в качестве вспенивателя
И стирол, и пентан являются углеводородными соединениями и получаются из побочных продуктов нефти и природного газа.
EPS очень легкий, с очень низкой теплопроводностью, влагопоглощением и отличными амортизирующими свойствами.Одним из серьезных ограничений пенополистирола является его довольно низкая максимальная рабочая температура ~ 80 ° C. Его физические свойства не изменяются в диапазоне рабочих температур (т.е. до 75 ° C / 167 ° F) при длительном температурном воздействии.
Его химическая стойкость практически эквивалентна материалу, на котором он основан — полистиролу .
EPS на 98% состоит из воздуха и на 100% пригоден для вторичной переработки
Некоторые из ключевых производителей EPS включают: BASF, NOVA Chemicals, SABIC, DowDupont, Synthos Group и т. Д.
»Просмотреть все коммерческие марки и поставщиков EPS в базе данных Omnexus Plastics
Эта база данных по пластику доступна всем бесплатно. Вы можете отфильтровать свои варианты по свойствам (механические, электрические…), приложениям, режиму преобразования и многим другим параметрам.
Продолжайте читать или нажмите, чтобы перейти в конкретный раздел страницы:
Как производится EPS?
Превращение вспененного полистирола в пенополистирол осуществляется в три этапа: предварительное расширение, созревание / стабилизация и формование.
Полистирол производится из стирола, полученного при переработке сырой нефти.Для производства пенополистирола гранулы полистирола пропитываются пенообразователем пентаном . Гранулят полистирола предварительно вспенивается при температуре выше 90 ° C.
Эта температура вызывает испарение вспенивающего агента и, следовательно, раздутие термопластичного основного материала в 20-50 раз от его первоначального размера.
После этого шарики выдерживают 6-12 часов, позволяя им достичь равновесия. Затем шарики транспортируются в форму для изготовления форм, подходящих для каждого применения.
Производство листов / форм из пенополистирола
На заключительном этапе стабилизированные шарики формуются либо в виде больших блоков (процесс формования блоков), либо разрабатываются в нестандартных формах (процесс формования).
Материал может быть модифицирован добавлением добавок, таких как антипирен , для дальнейшего улучшения огнестойкости EPS.
Свойства и основные преимущества пенополистирола
EPS — легкий материал с хорошими изоляционными характеристиками, обладающий такими преимуществами, как:
- Тепловые свойства (изоляция) — EPS имеет очень низкую теплопроводность из-за своей закрытой ячеистой структуры, состоящей на 98% из воздуха.Этот воздух, задержанный внутри ячеек, является очень плохим проводником тепла и, следовательно, обеспечивает пену отличными теплоизоляционными свойствами. Теплопроводность пенополистирола плотностью 20 кг / м 3 составляет 0,035 — 0,037 Вт / (м · К) при 10 ° C.
ASTM C578 Стандартные технические условия для теплоизоляции из жесткого ячеистого полистирола рассматривают физические свойства и рабочие характеристики пенополистирола в том, что касается теплоизоляции в строительстве.
- Механическая прочность — Гибкое производство делает EPS универсальным по прочности, которую можно регулировать в соответствии с конкретным применением. EPS с высокой прочностью на сжатие используется для тяжелых нагрузок, тогда как для образования пустот может использоваться EPS с более низкой прочностью на сжатие.
Как правило, прочностные характеристики повышаются с плотностью , однако амортизационные характеристики упаковки из пенополистирола зависят от геометрии формованной детали и, в меньшей степени, от размера валика и условий обработки, а также от плотности.
- Стабильность размеров — EPS обеспечивает исключительную стабильность размеров , оставаясь практически неизменным в широком диапазоне факторов окружающей среды. Можно ожидать, что максимальное изменение размеров пенополистирола составит менее 2%, что соответствует требованиям метода испытаний ASTM D2126.
| Плотность (pcf) | Напряжение при сжатии 10% (фунт / кв. Дюйм) | Прочность на изгиб (фунт / кв. Дюйм) | Предел прочности на разрыв (фунт / кв. Дюйм) | Прочность на сдвиг (фунт / кв. Дюйм) |
| 1.0 | 13 | 29 | 31 | 31 |
| 1,5 | 24 | 43 | 51 | 53 |
| 2,0 | 30 | 58 | 62 | 70 |
| 2,5 | 42 | 75 | 74 | 92 |
| 3,0 | 64 | 88 | 88 | 118 |
| 3.3 | 67 | 105 | 98 | 140 |
| 4,0 | 80 | 125 | 108 | 175 |
Типичные свойства формовочной упаковки из пенополистирола (температура испытания 70 ° F)
(Источник: EPS Industry Alliance)
- Электрические свойства — Электрическая прочность EPS составляет приблизительно 2 кВ / мм.Его диэлектрическая проницаемость , измеренная в диапазоне частот 100-400 МГц и при полной плотности от 20-40 кг / м 3 , находится между 1,02-1,04. Формованный пенополистирол можно обрабатывать антистатиками в соответствии со спецификациями электронной промышленности и военной упаковки.
- Водопоглощение — EPS не гигроскопичен. Даже при погружении в воду он впитывает лишь небольшое количество воды. Поскольку стенки ячеек водонепроницаемы, вода может проникать в пену только через крошечные каналы между сплавленными шариками.
- Химическая стойкость — Вода и водные растворы солей и щелочей не влияют на пенополистирол. Однако EPS легко подвергается воздействию органических растворителей.
- Устойчивость к атмосферным воздействиям и старению — EPS устойчив к старению. Однако воздействие прямых солнечных лучей (ультрафиолетовое излучение) приводит к пожелтению поверхности, которое сопровождается легким охрупчиванием верхнего слоя. Пожелтение не имеет значения для механической прочности изоляции из-за небольшой глубины проникновения.
- Огнестойкость — EPS легко воспламеняется. Модификация антипиренами значительно снижает воспламеняемость пены и распространение пламени.
Экструдированный полистирол против вспененного полистирола
XPS часто путают с EPS. EPS (вспененный) и XPS (экструдированный) — это жесткая изоляция с закрытыми порами, изготовленная из одних и тех же основных полистирольных смол. Однако разница заключается в их производственном процессе.
| Пенополистирол (EPS) | Экструдированный полистирол (XPS) |
|
|
Также прочтите: Экструзия пенопласта — основы и введение
Источник: Owens Corning
Применение вспененного полистирола
Пенополистирол (EPS) используется для производства ряда применений, таких как:
Строительство и строительство
EPS широко используется в строительстве благодаря своим изоляционным свойствам, химической инертности, устойчивости к бактериям и вредителям и т. Д.Его структура с закрытыми ячейками обеспечивает лишь небольшое водопоглощение. Он прочен, прочен и может использоваться в качестве систем теплоизоляции для фасадов, стен, крыш и полов в зданиях, в качестве плавучего материала при строительстве причалов и понтонов, а также в качестве легкого заполнителя в дорожном и железнодорожном строительстве.Изоляция из пенополистирола имеет множество экологических преимуществ, в том числе:
- Пониженное потребление энергии
- Вторичное содержание
- Локализованное распространение и
- Улучшение качества воздуха в помещении
»Найдите подходящую марку пенополистирола для строительства и строительства
Пищевая упаковка
EPS можно экструдировать с использованием обычного оборудования для формирования непрерывного листа.Этот лист может позже быть сформирован (например, с использованием вакуумного формования, формования под давлением) для производства таких изделий, как лотки для фруктов и т. Д.EPS не имеет никакой питательной ценности и, следовательно, не поддерживает рост грибков, бактерий или любых других микроорганизмов. Поэтому он широко используется для упаковки пищевых продуктов, таких как морепродукты, фрукты и овощи. Теплоизолирующие свойства EPS помогают сохранять продукты свежими и предотвращают образование конденсата по всей цепочке сбыта.
Это широко используемый материал для производства контейнеров для общественного питания, таких как чашки для напитков, подносы для еды и контейнеры-раскладушки.
В упаковке из пенополистирола фрукты и овощи сохраняют содержание витамина С дольше, чем упаковка для пищевых продуктов из других материалов.
Промышленная упаковка
Упаковка из пенополистирола часто используется для промышленной упаковки. Он обеспечивает промышленные продукты идеальным материалом для полной защиты и безопасности от рисков при транспортировке и погрузочно-разгрузочных работах благодаря свойству амортизации .Этому жесткому легкому пеноматериалу можно придать любую форму для защиты и изоляции чувствительных продуктов, таких как хрупкое медицинское оборудование, электронные компоненты, бытовые электрические товары, игрушки, а также продукты садоводства во время транспортировки и хранения.EPS также используется для изготовления одноразовых охладителей пены и упаковки арахиса для транспортировки.
В упаковочных приложениях необходимо учитывать плотность упаковки при выборе
правильного уровня амортизации, необходимого для работы
»Выберите подходящий сорт для упаковки
Другие области применения формованного EPS
EPS можно придать любую форму, примеры:- Спортивные шлемы
- Детские автокресла
- Стулья
- Места в спорткарах
- Несущие конструктивно изолированные панели и т. Д.
EPS — Безопасность, устойчивость и возможность вторичной переработки
Изоляция EPS состоит из органических элементов — углерода, водорода и кислорода — и не содержит хлорфторуглеродов (CFC) или гидрохлорфторуглеродов (HCFC). EPS пригоден для вторичной переработки на многих этапах жизненного цикла.
Пенополистирол на 100% пригоден для вторичной переработки и имеет идентификационный код пластмассовой смолы 6.
Однако сбор пенополистирола может быть серьезной проблемой, поскольку продукт очень легкий.Переработчики полистирола создали систему сбора, в которой пенополистирол доставляется на небольшие расстояния на предприятие, где материал подвергается дальнейшей переработке:
- Гранулирование — пенополистирол добавляется в гранулятор, который измельчает материал на более мелкие кусочки.
- Смешивание — материал помещается в блендер для тщательного перемешивания с аналогичными гранулами.
- Экструзия — материал подается в экструдер, где расплавляется. Может быть добавлен цвет, а затем из экструдированного материала формируется новый продукт с добавленной стоимостью.
Материалы EPS можно переработать и превратить в новую упаковку или товары длительного пользования
В нескольких странах действуют официальные программы переработки пенополистирола
во всем мире
Преимущества устойчивого развития , связанные с EPS:
- Производство EPS не связано с использованием разрушающих озоновый слой ХФУ и ГХФУ
- При производстве не образуются твердые остаточные отходы
- Он способствует экономии энергии, поскольку является эффективным теплоизоляционным материалом, который помогает снизить выбросы CO 2
- EPS подлежит вторичной переработке на многих этапах жизненного цикла
- EPS инертен и нетоксичен.Не выщелачивает никакие вещества в грунтовые воды
Посмотрите интересное видео о переработке вспененного полистирола!
Источник: Moore Recycling Associates
Коммерчески доступный пенополистирол (EPS) марок
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.
Leave A Comment