Помогите мне с ответом на Вопрос 1 § 27 Химия 9 класс Габриелян – Рамблер/класс
Помогите мне с ответом на Вопрос 1 § 27 Химия 9 класс Габриелян – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Какое из веществ проявляет только восстановительные,
только окислительные или и окислительные, и восстано-
серная кислота? Почему? Подтвердите свой ответ урав-
нениями соответствующих реакций.

ответы
а) Сероводород проявляет только восстановительные свойства, т.к.
сера в данном соединении имеет степень окисления -2 (наименьшая из
возможных).
б) оксид серы (IV) может проявлять свойства как окислителя, так и
восстановителя, т.к. степень окисления серы в данном соединении +4
является промежуточной.
в) сера также может проявлять окислительные и восстановительные
способности, т.е. степень окисления серы O является промежуточной.
S + Н2 = H2S↑, S + O
г) серная кислота проявляет окислительные свойства, т.к. степень
окисления серы +6 является максимально возможной.
2H2SO4(конц)+Cu = CuSO4+SO2↑+2Н2O.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Приготовление раствора сахара и расчёт его массовой доли в растворе.
Попробуйте провести следующий опыт. Приготовление раствора
сахара и расчёт его массовой доли в растворе.
Отмерьте мерным (Подробнее…)
ГДЗШкола8 классХимияГабриелян О.С.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые).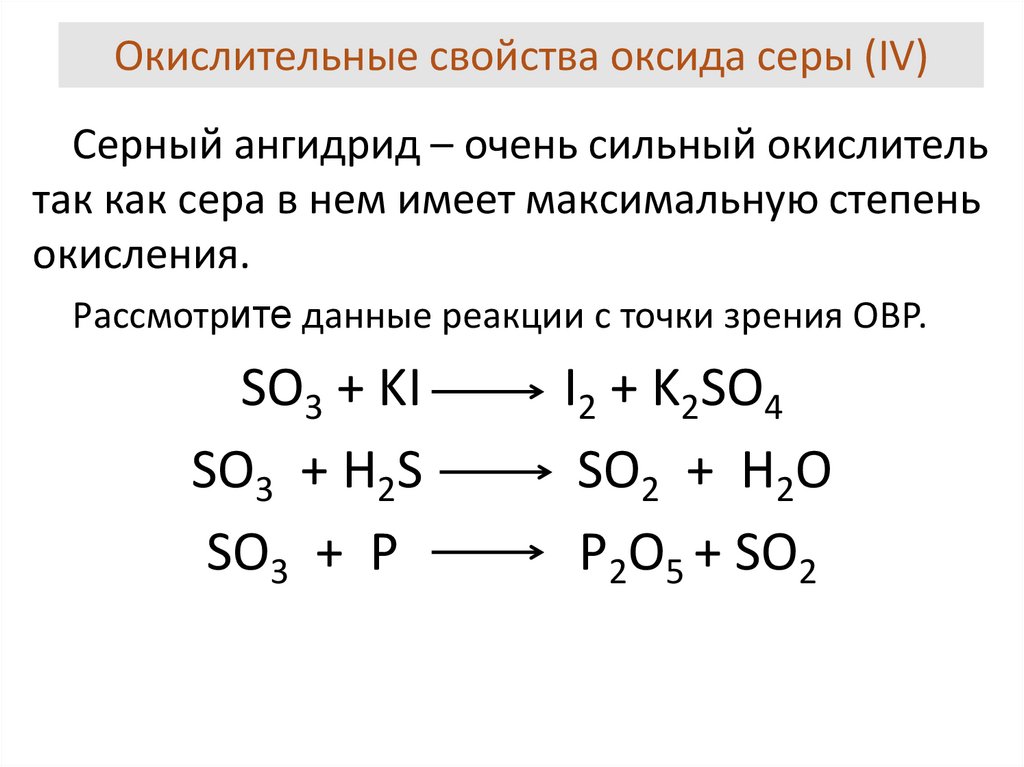 (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Окислительно-восстановительные реакции (ОВР) — что это такое? Примеры и реакции
Поможем понять и полюбить химию
Начать учиться
143.3K
Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Узнай, какие профессии будущего тебе подойдут
Пройди тест — и мы покажем, кем ты можешь стать, а ещё пришлём подробный гайд, как реализовать себя уже сейчас
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S+6 в серной кислоте (H2SO4), N+5 в азотной кислоте (HNO3) или солях-нитратах, Cr+6 в хроматах (CrO42−) и дихроматах (Cr2O72−) соответственно, а также Mn
В зависимости от среды проведения реакции Mn+7 и Cr+6 ведут себя по-разному. Рассмотрим на схемах:
И марганец, и хром в кислой среде (H+) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH−) марганец превращается в манганат (MnO42−), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H+) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н+ при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Запоминаем!
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных.
Fe + H2SO4 (разб) = FeSO4 + H2
6СuCl + K2Cr2O7 + 14HCl (разб) = 6CuCl2 + 2CrCl3 + 2KCl + 7H2O.
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
межмолекулярные ОВР;
внутримолекулярные ОВР;
реакции диспропорционирования;
реакции контрпропорционирования.

Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I−1).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl+5 — окислитель, а O−2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N+3 переходит в N+5, являясь восстановителем, и N+3 переходит в N+2, являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости.
 Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.

Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Ксения Боброва
К предыдущей статье
167. 6K
6K
Молярная масса
К следующей статье
Ионная связь
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Лантан | химический элемент | Британика
лантан
Посмотреть все СМИ
- Ключевые люди:
- Карл Густав Мосандер
- Похожие темы:
- химический элемент редкоземельный элемент
Просмотреть все связанные материалы →
лантан (La) , химический элемент, редкоземельный металл группы 3 периодической таблицы, который является прототипом ряда элементов лантанидов.
Лантан — пластичный и ковкий серебристо-белый металл, достаточно мягкий, чтобы его можно было резать ножом. Это второй по реакционной способности редкоземельный металл после европия. Лантан окисляется на воздухе при комнатной температуре с образованием La 2 O 3 . Медленно реагирует с водой и быстро растворяется в разбавленных кислотах, кроме плавиковой кислоты (HF) из-за образования на поверхности металла защитного фторидного слоя (LaF 3 ). Металл является парамагнитным от 6 К (-267 ° C или -449° F) до точки плавления при 1191 К (918 ° C, или 1684 ° F) с почти независимой от температуры магнитной восприимчивостью от 4 до 300 К (от -269 до 27 ° C, или от -452 до 80 ° F). Лантан становится сверхпроводящим при атмосферном давлении ниже 6,0 К (-267,2 ° C, или -448,9 ° F) в гранецентрированной кубической β-фазе или 5,1 К (-268,1 ° C, или -450,5 ° F) в двойной замкнутой упакованная гексагональная α-фаза.
Это второй по реакционной способности редкоземельный металл после европия. Лантан окисляется на воздухе при комнатной температуре с образованием La 2 O 3 . Медленно реагирует с водой и быстро растворяется в разбавленных кислотах, кроме плавиковой кислоты (HF) из-за образования на поверхности металла защитного фторидного слоя (LaF 3 ). Металл является парамагнитным от 6 К (-267 ° C или -449° F) до точки плавления при 1191 К (918 ° C, или 1684 ° F) с почти независимой от температуры магнитной восприимчивостью от 4 до 300 К (от -269 до 27 ° C, или от -452 до 80 ° F). Лантан становится сверхпроводящим при атмосферном давлении ниже 6,0 К (-267,2 ° C, или -448,9 ° F) в гранецентрированной кубической β-фазе или 5,1 К (-268,1 ° C, или -450,5 ° F) в двойной замкнутой упакованная гексагональная α-фаза.
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Этот элемент был открыт в виде оксида (лантана) в 1839 году Карлом Густавом Мосандером, который отличил его от оксида церия (церия). Его название происходит от греческого лантанеин , что означает «быть скрытым», что указывает на то, что его трудно изолировать. Лантан встречается в редкоземельных минералах монаците и бастназите. Его так же много, как кобальта, в верхней части континентальной коры Земли.
Его название происходит от греческого лантанеин , что означает «быть скрытым», что указывает на то, что его трудно изолировать. Лантан встречается в редкоземельных минералах монаците и бастназите. Его так же много, как кобальта, в верхней части континентальной коры Земли.
В природе встречаются два изотопа: стабильный лантан-139 (99,9119%) и очень долгоживущий радиоактивный лантан-138 (0,0888%). Всего было охарактеризовано 38 радиоактивных изотопов лантана (исключая ядерные изомеры) с массой от 117 до 155 и периодом полураспада от 23,5 миллисекунд (лантан-117) до 1,02 × 10 9 .0041 11 года (лантан-138). Изотоп лантан-140 был обнаружен в виде продукта деления в снегу после испытательных ядерных взрывов.
Лантан концентрируется в промышленных масштабах путем кристаллизации нитрата лантана аммония. Ионообменные методы и методы экстракции растворителем используются, когда требуется высокая чистота. Металл получают электролизом расплавленных безводных галогенидов или металлотермическим восстановлением его галогенидов щелочными или щелочноземельными металлами (например, восстановление фторида кальцием).
Лантан существует в трех аллотропных (структурных) формах. α-фаза представляет собой гексагональную двойную плотную упаковку с a = 3,7740 Å и c = 12,171 Å при комнатной температуре. β-фаза является гранецентрированной кубической с a = 5,303 Å при 325 ° C (617 ° F). γ-фаза является объемно-центрированной кубической с a = 4,26 Å при 887 ° C (1629 ° F).
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Высокоочищенный оксид лантана используется в производстве низкодисперсионных стекол с высоким преломлением для компонентов линз. Лантан часто используется в качестве сплавов для хранения водорода на основе LaNi 5 и никель-металлогидридных аккумуляторных батарей в гибридных автомобилях. Лантан добавляют в сплавы черных металлов (для удаления кислорода, серы и других примесей) и в сплавы цветных металлов, такие как суперсплавы, сплавы магния и сплавы алюминия. Соединения лантана используются в качестве основы для люминофоров в флуоресцентном освещении и детекторах рентгеновского излучения, а также в катализаторах крекинга нефти, что является одним из его основных применений. Миш-металл (обычно 50 процентов церия, 25 процентов лантана, 18 процентов неодима, 5 процентов празеодима и 2 процента других редкоземельных элементов) в основном используется для изготовления более легких кремней и легирующих добавок. В сочетании с железом и кремнием лантан образует кубические интерметаллиды с общей химической формулой La(Fe 1− x Si x ) 13 проявляющие гигантский магнитокалорический эффект. Когда эти соединения гидрируются примерно до 1,2–1,5 атомов водорода на формульную единицу, они имеют температуры магнитного упорядочения, близкие к комнатной температуре, и поэтому их можно использовать в качестве магнитных охлаждающих материалов для применений, близких к комнатной температуре.
Соединения лантана используются в качестве основы для люминофоров в флуоресцентном освещении и детекторах рентгеновского излучения, а также в катализаторах крекинга нефти, что является одним из его основных применений. Миш-металл (обычно 50 процентов церия, 25 процентов лантана, 18 процентов неодима, 5 процентов празеодима и 2 процента других редкоземельных элементов) в основном используется для изготовления более легких кремней и легирующих добавок. В сочетании с железом и кремнием лантан образует кубические интерметаллиды с общей химической формулой La(Fe 1− x Si x ) 13 проявляющие гигантский магнитокалорический эффект. Когда эти соединения гидрируются примерно до 1,2–1,5 атомов водорода на формульную единицу, они имеют температуры магнитного упорядочения, близкие к комнатной температуре, и поэтому их можно использовать в качестве магнитных охлаждающих материалов для применений, близких к комнатной температуре.
В соединениях лантан проявляет только одну степень окисления +3. Ионный радиус — самый большой из редкоземельных элементов R 9.0041 3+ и, как следствие, белый оксид La 2 O 3 является наиболее щелочным оксидом редкоземельных элементов.
Ионный радиус — самый большой из редкоземельных элементов R 9.0041 3+ и, как следствие, белый оксид La 2 O 3 является наиболее щелочным оксидом редкоземельных элементов.
| атомный номер | 57 | |
|---|---|---|
| атомный вес | 138,90552092091091091091 | 918 °C (1684 °F) |
| температура кипения | 3464 ° C (6 267 °F) | |
| удельный вес | 6,146 (24 °C или 75 °F) | |
| степень окисления | +3 | |
| электронная конфигурация | [Xe]5 d 1 6 2 248 91 |
Эта статья была недавно пересмотрена и обновлена Эриком Грегерсеном.
Степень окисления элементов группы 17
Введение в элементы группы 17
Дата последнего обновления: 24 апреля 2023 г.
•
Всего просмотров: 311,4k
•
Просмотров сегодня: 7.11k
Элементы группы 17 имеют степень окисления -1, когда они соединяются с элементами слева от их положения и ниже элементов таблицы Менделеева. Элементы группы 17 периодической таблицы известны как галогены. Галогены являются реактивными неметаллами и включают фтор, хлор, бром и йод. Степень окисления кислорода обычно равна -2, за исключением соединений с фтором, кислород имеет положительную степень окисления. Все элементы 17-й группы образуют соединения в нечетных степенях окисления (-1, +1, +3, +5, +7), но вниз по группе значимость высших степеней окисления обычно снижается. Элементам группы 17 требуется только один дополнительный электрон, чтобы сформировать полный октет. Эта характеристика делает их более реакционноспособными, чем другие группы неметаллов.
Что такое галогены?
Элементы группы 17 периодической таблицы известны как галогены, по-гречески: гало означает соль, а гены означают производство, поэтому в совокупности галогены означают производство соли. Это очень реакционноспособные неметаллы. Элементами являются фтор, хлор, бром, йод и астат. Галогены реагируют с металлами, образуя соединения, называемые солью. Галогенные элементы имеют семь валентных электронов, поэтому в периодической таблице они расположены слева от инертных газов. Галогены имеют семь электронов на внешней оболочке (ns2np5), и один электрон не соответствует конфигурации ближайшего инертного газа.
Это очень реакционноспособные неметаллы. Элементами являются фтор, хлор, бром, йод и астат. Галогены реагируют с металлами, образуя соединения, называемые солью. Галогенные элементы имеют семь валентных электронов, поэтому в периодической таблице они расположены слева от инертных газов. Галогены имеют семь электронов на внешней оболочке (ns2np5), и один электрон не соответствует конфигурации ближайшего инертного газа.
Степень окисления
1. Все элементы семейства галогенов проявляют степень окисления -1.
2. Такие элементы, как хлор, бром и йод, также проявляют состояния +1, +3, +5 и +7.
3. При хлоре, броме и йоде, галогенах в сочетании с малыми и сильно электроотрицательными атомами фтора и кислорода реализуется высшая степень окисления.
4. Оксокислоты и оксиды брома и хлора имеют состояния +6 и +4. Атомы фтора не могут расширить свой октет, потому что у фтора нет валентных оболочечных d-орбиталей.
5. Фтор является наиболее электроотрицательным элементом и проявляет только степень окисления -1.
Физические свойства
Физическое состояние: Фтор и хлор являются газами, с другой стороны, бром представляет собой жидкость, а йод – твердое вещество.
Цвет: Элементы группы 17 имеют различные цвета. Например, йод имеет темно-фиолетовый цвет, а фтор — бледно-желтый цвет.
Растворимость: Хлор и фтор растворимы в воде, с другой стороны, йод и бром менее растворимы в воде.
Химические свойства галогенов
1. Обладая высокой реакционной способностью, галогены реагируют с металлами и неметаллами с образованием галогенидов. По мере продвижения вниз групповая реакционная способность галогенов уменьшается. Галогены обладают сильными окислительными свойствами среди галогенных элементов, F 2 является самым сильным окисляющим галогеном, он легко окисляет другие ионы галогенидов, присутствующие в твердой фазе или в растворе. Как правило, галоген окисляет ионы галогенидов с более высоким атомным номером. Например: 9{+} (водн.) + O_{2} (г) \rightarrow 2I_{2} (т) + 2H_{2} O (I)\]
Галогены обладают сильными окислительными свойствами среди галогенных элементов, F 2 является самым сильным окисляющим галогеном, он легко окисляет другие ионы галогенидов, присутствующие в твердой фазе или в растворе. Как правило, галоген окисляет ионы галогенидов с более высоким атомным номером. Например: 9{+} (водн.) + O_{2} (г) \rightarrow 2I_{2} (т) + 2H_{2} O (I)\]
Общая характеристика элементов 17 группы
1. Характеристики семейства галогенов
Символ и название | 0 Номер | Электронная схема | Температура плавления | Температура кипения | |
Ф Фтор | 9 | 2,7 3 | |||
Cl Хлор | 17 | 2, 8, 7 | -101oC, 172K | -34oC, 235K | |
Br 9090 3 Br | 35 | 2, 8, 18, 7 | -7оС, 256К | 59оС, 332К | |
I 08 Йод | 32, 8, 18, 18, 7 | 114oC, 387K | 185oC, 458K | ||
Ат Астатин | 85 | , 18, 32, 18, 7302oC, 575K | 337oC, 610К |
2.
 Электронная конфигурация
Электронная конфигурацияЧлены семейства галогенов имеют семь валентных электронов, в то время как галогены имеют семь электронов на внешней орбите. Из ближайших конфигураций благородных газов галогены имеют один электрон короче. Конфигурация семейства галогенов представлена как ns 2 np 5 .
Атомный номер | Имя | Электронная конфигурация | |
9 | ФТОР | 0 | 2, 317 | ХЛОР | 2, 8, 7 |
35 | БРОМ | 2, 8, 18, 7 ОДИНА | 2, 8, 18, 18, 7 |
85 | АСТАТИН | 7 90 3 2 18 18 0091 |
3.
 Электроотрицательность галогена Семейство
Электроотрицательность галогена СемействоФтор: 4,0
Хлор: 3,0
Бром: 2,8
Йод: 2,8
Йод: 2,0 185
Астат: 2,2
Объясните относительную реактивность
Считается, что среди галогенов фтор обладает наибольшей реакционной способностью. Это в основном из-за низкой энергии диссоциации, которой он обладает по сравнению с другими элементами в семье. А с большинством других элементов фтор может создавать прочные и стабильные связи.
Встречая элементы семейства галогенов. И хлор, и фтор — это газы, наблюдаемые при комнатной температуре. В то время как бром представляет собой красновато-коричневую жидкость с температурой около 20 градусов по Цельсию. При такой температуре йод может образовывать кристаллы темно-фиолетового цвета.
В то время как бром представляет собой красновато-коричневую жидкость с температурой около 20 градусов по Цельсию. При такой температуре йод может образовывать кристаллы темно-фиолетового цвета.
Вы знаете, что такое сродство к электрону? Из свободного атома или иона энергия выделяется в виде иона. И эта скорость называется сродством к электрону. Почти все элементы семейства галогенов имеют одинаковое сродство к электрону. И они лишь немного отличаются по своим значениям. В периодической таблице галогены имеют более высокое сродство к электрону. Похожая концепция и есть электроотрицательность. Это свойство элементов притягивать электроны. И это самое высокое для фтора. Другими словами, мы можем сказать о стремлении элемента стать устойчивым, завершив октет.
Интересные факты
Элементы 17-й группы называются «галогенами», потому что они дают соли при взаимодействии с металлами.



 Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.

Leave A Comment