Характеристика химической связи. Типы кристаллических решёток
Сабақтың оқу — әдестемелік жоспары
Учебно-методический план занятий
Топ Группа |
|
|
|
|
|
Күні Дата |
|
|
|
|
|
Тақырыбы:
Тема: Характеристика
химической связи. Типы кристаллических решёток.
Типы кристаллических решёток.
Сабақтың тақырыбы:
Вид урока: комбинированный
Сабақ мақсаты:
Цели урока
Білімділік
Обучающая: Обобщить, углубить и расширить знания учащихся о химической связи, ее характеристиках, типах кристаллических решеток, агрегатных состояниях веществ.
Дамытушылык
Развивающая: Развивать умения составлять план-конспект, умение работать в должном темпе.
Тәрбиелік
Воспитательная: Формировать мотивы учения.
Пәнаралық байланыс
Межпредметные связи: геометрия
Көрнекті құралдар, жабдықтар, үлестірме кағаздар
Наглядные пособия, оборудование, раздаточный материал: модели решёток, плакаты, образцы пластмасс, пластилин, шоколадка, жевательная резинка, воск, кварц, поваренная соль, образцы металлов.
Сабақтың барысы/ Ход урока
І. Ұйымдастыру кезеңі
Организационная часть
ІІ. Өткен тақырыпты қайталау:
Опрос и проверка пройденного материала
1)Какие виды частиц вы знаете? Имеют ли заряды ионы, атомы и молекулы?
2)Какие виды химических связей вы знаете?
3)Какие вам известны агрегатные состояния веществ?
ІІІ. Жана тақырыпты
зерделеу
Жана тақырыпты
зерделеу
Изучение нового материала
Тақырыбы
Тема: Характеристика химической связи
1) Длина – межъядерное расстояние
2) Энергия – энергия, выделяющаяся при образовании или поглощающаяся при разрыве химической связи.
3) Насыщаемость – определяется способностью атомов образовывать ограниченное число связей:
Например, водород всегда одновалентен;
азот может быть трехвалентен в молекуле аммиака Nh4 и четырёхвалентен в ионе аммония Nh5+ (валентные возможности расширяются за счёт участия неподелённой электронной пары атома азота в образовании ковалентной связи по донорно-акцепторному механизму).
4) Направленность – обуславливает форму молекулы в пространстве.
Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов при образовании σ – связей.
Кристаллической решёткой называют совокупность точек пространства, в которых располагаются
частицы, образующие кристалл.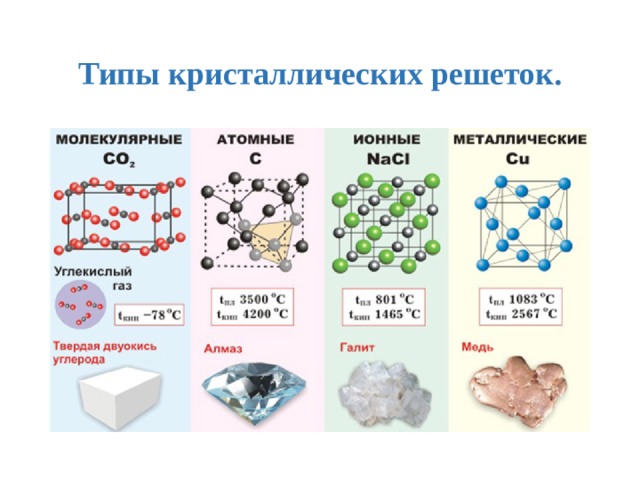 Точки, в которых размещаются частицы кристалла,
называют узлами решётки».
Точки, в которых размещаются частицы кристалла,
называют узлами решётки».
В зависимости от того, какие виды частиц находятся в узлах этой решётки, различают 4 типа решёток. Если в узлах кристаллической решётки находятся ионы, то такая решётка называется ионной.
— Как будут называться крист. решётки, в узлах которых находятся атомы, молекулы?
Но есть крист. решётки, в узлах которых находятся и атомы, и ионы. Такие решётки называются металлическими.
Заполнить таблицу: «Кристаллические решётки»
Рассмотрим 1-й тип кристаллической решётки, которая называется ионной.
— Какие частицы располагаются в узлах этой решётки?
— Какая химическая связь в этих веществах?
Посмотрите на ионную кр.решётку (показывается
модель такой решётки). В её узлах находятся положительно и отрицательно
заряженные ионы. Например, кристалл хлорида натрия построен из положительных
ионов натрия и отрицательных хлорид-ионов, образующих решётку в форме куба. К
веществам с ионной крист.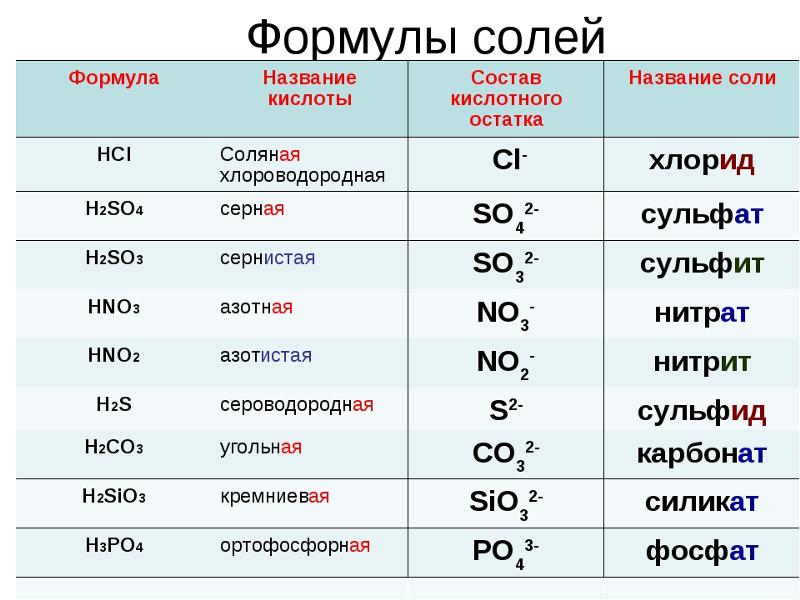
Рассмотрим 2-й тип крист.решётки, которая называется молекулярной
— Какие частицы располагаются в узлах этой решётки?
Далее учащиеся по учебнику рассматривают модель молекулярной кристаллической решётки.
Химическая связь в молекулах, которые
находятся в узлах решётки, может быть и ковалентная полярная, и ковалентная
неполярная. Несмотря на то, что атомы внутри молекулы связаны очень прочными
ковалентными связями, между самими молекулами действуют слабые силы
межмолекулярного притяжения. Поэтому вещества с молекулярной кристаллической
решёткой имеют малую твердость, низкие температуры плавления и летучие. Когда
газообразные или жидкие вещества при особых условиях превращаются в твёрдые,
тогда у них появляется молекулярная крист. решётка. Примерами таких веществ
может быть твёрдая вода — лёд, твёрдый углекислый газ — сухой лёд.
— Какими свойствами молекулярной кристаллической решётки обусловлено применение нафталина? (летучестью).
Рассмотрим 3-й тип кристаллической решётки, которая называется металлической. В узлах такой решётки находятся атомы и ионы, между которыми свободно перемещаются электроны, связывая их в единое целое.
Далее учащиеся по учебнику рассматривают модель металлической кристаллической решётки.
Такое внутреннее строение металлов и определяет их характерные физические свойства.
— Какие физические свойства металлов вы знаете? (ковкость, пластичность, электро- и теплопроводность, металлический блеск).
Последний тип кристаллической решётки называется атомной..
Физические свойства веществ с атомной крист.
реш. те же, что и у веществ с ионной крист. реш., но часто в превосходной
степени — очень твёрдые, очень прочные. Алмаз, у которого атомная крист. реш. —
самое твёрдое вещество из всех природных веществ.
IV. Нығайту
Закрепление
— На какие группы делятся твёрдые вещества?
— В чём их отличие?
— Какие типы кристаллических решёток вы узнали?
— Какие частицы находятся в узлах различных типов кристаллических решёток?
V. Үй тапсырмасы
Домашнее задание: пар.8,9
VІ. Өзіндік жұмыс
Самостоятельная работа
Тестовые задания для закрепления:
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr, Na2O, KI
3) SO2, P4, CaF2
4) h3S, Br2, K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) Nh4 и HCI
4.
1) HCl, NaCl, Cl2
2) O2, h3O, CO2
3) h3O, Nh4, Ch5
4) NaBr, HBr, CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) С12, NO2, НС1
2) HBr, NO, Br2
3) h3S, h3O, Se
4) HI, h3O, Ph4
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью являетс
1) С12 2) NaBr 3) h3S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС12 2) MgS 3) h3S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) Nh4 2) Сu 3) h3S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
Ковалентная полярная связь характерна для
1) KC1 2) НВr 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1) ковалентную полярную
2) ковалентную неполярну
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВr
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для
вещества
Водородная связь не характерна для
вещества
1) Н2О 2) СН4 3) Nh4 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3) брома 4) йода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) йода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2) СО, CuO, Ch4Cl
3) BaS, C6H6, h3
4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО, С3Н6, S8
2) Fe , NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ,
указанных в ряду:
Ковалентные связи имеет каждое из веществ,
указанных в ряду:
1) C3H6, NO2, NaF
2) КС1, Ch4Cl, C6h2206
3) P2O5, NaHSO4, Ba
4) C2H5Nh3, P4, Ch4OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1) СF4
2) CCl4
3) CBr4
4) CI4
29. Среди веществ Nh5Cl, CsCl, NaNO3, Ph4, HNO3 — число соединений с ионной связью равно
1)1 2)2 3)3 4)4
30. Среди веществ (Nh5)2SO4, Na2SO4, CaI2, I2, CO2 — число соединений с ковалентной связью равно
1)1 2)2 3)3 4)4
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
Типы химических связей
Автор Марина Андреева На чтение 7 мин Просмотров 16.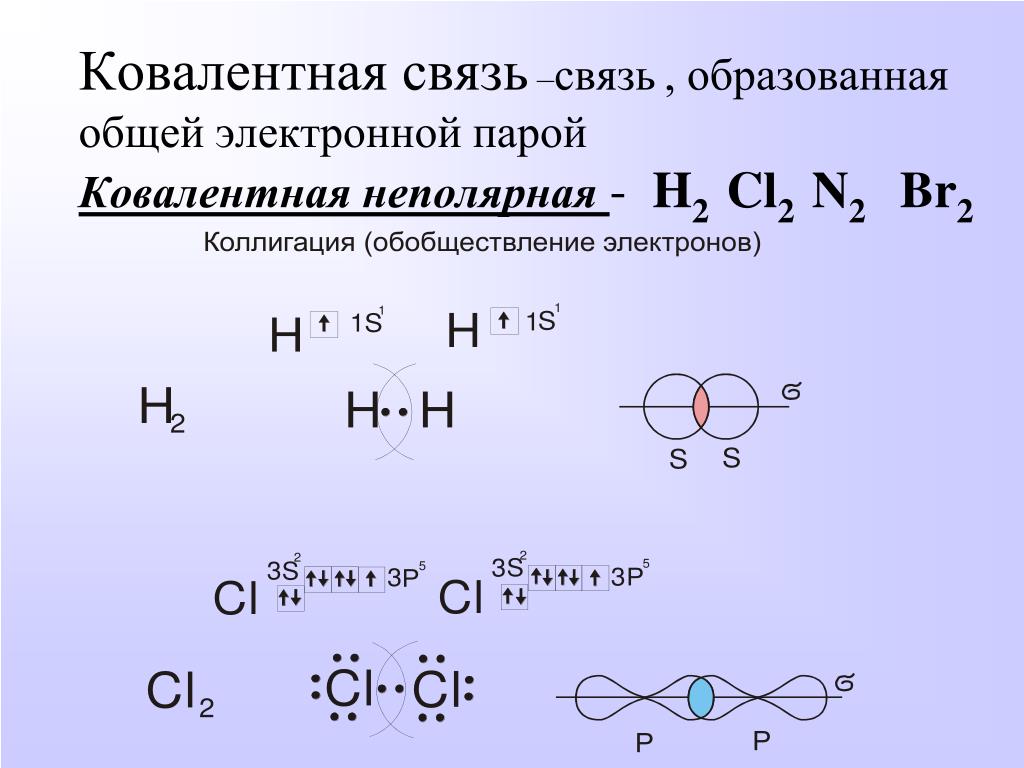 5к. Опубликовано
5к. Опубликовано
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами. Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
Содержание
- Типы химических связей
- Ковалентная связь
- Ковалентная неполярная связь
- Ковалентная полярная связь
- Ионная связь
- Металлическая связь
- Водородная связь
- Примеры решения задач по химии в ЕГЭ на типы химических связей
Типы химических связей
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная связь
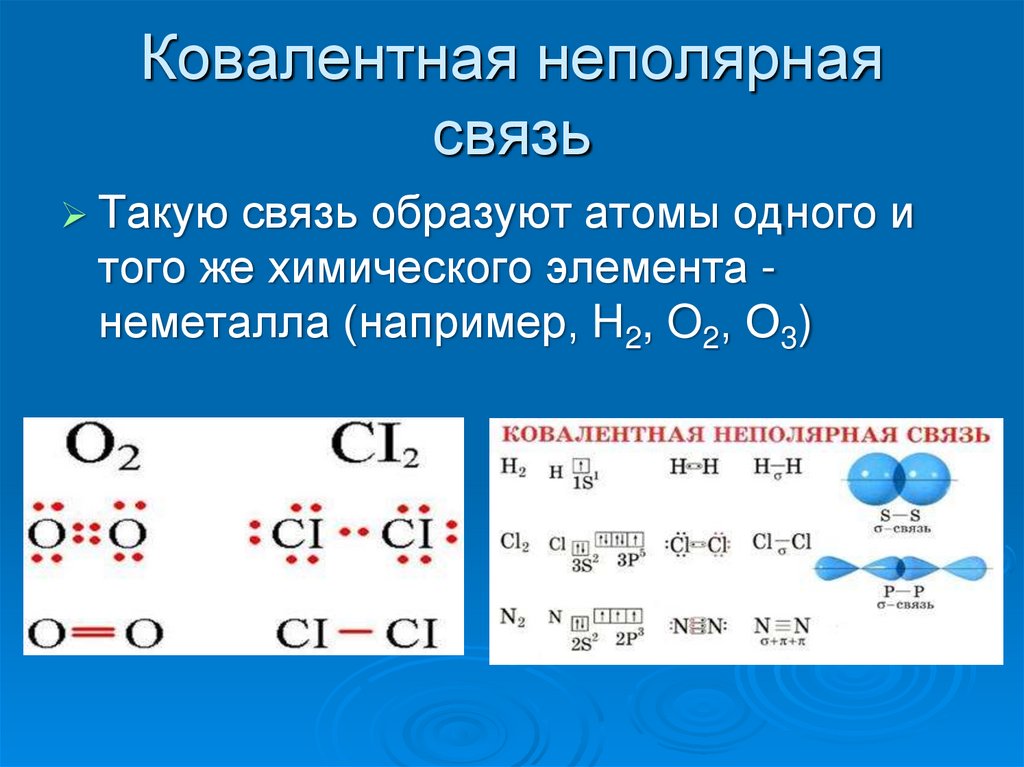
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.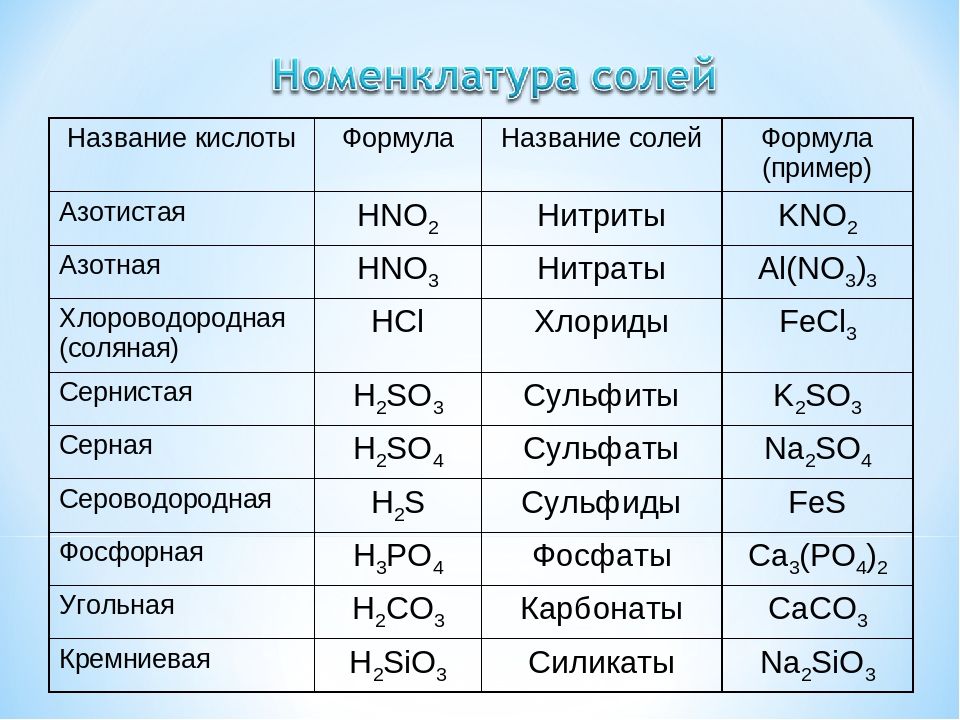
Рассмотри образование ковалентной неполярной связи, на примере водорода:
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из элементов отдает свои электроны и он заряжается положительно. Элемент, который принимает электроны заряжается отрицательно.
Металлическая связь
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).
| Тип связи | Примеры |
| Ковалентная неполярная | Cl2, O2, Br2, I2, N2 и др. |
| Ковалентная полярная | HCl, H2S, HBr, H2O, SO2, SO3 и др. |
| Ионная | NaCl, KCl, CaBr2, Na2O и др. |
| Металлическая | Na, Ca, Zn, Al и др. |
| Водородная | Между молекулами:
|
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задача 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
- Ca(ClO2)2
- HClO3
- NH4Cl
- HClO4
- Cl2O7
Решение: Ионная химическая связь характерна для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли —это вариант 1 и 3.
Задача 2. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
- Cl2
- С2S
- NaBr
- K2S
- Al2O3
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная связь характерна для простых веществ-неметаллов и соединений типа неметалл-неметалл. Это простое вещество хлор и сульфид углерода. Таким образом ответ будет 1 и 2.
Задача 3. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
- NH4OH
- He
- HCl
- P2O5
- PbO
Решение: Ковалентная полярная связь образуется между двумя разными неметаллами. Ответ 34.
Задача 4. Из предложенного перечня выберите два соединения, в которых присутствует водородная химическая связь.
- H2O
- C2H6
- CH3OCH3
- С2H5OH
- H2
Решение: Водородная химическая связь возникает между молекулами воды и одноатомных спиртов. Ответ 14.
Задача 5. Из предложенного перечня выберите два соединения, в которых ковалентная связь образована по донорно-акцепторному механизму.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: Донорно-акцепторный механизм образования связи характерен для иона аммония и угарного газа в связи с наличием неподеленной электронной пары на азоте и углероде соответственно. Ответ: 25.
Ответ: 25.
Задача 6. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
- CO2
- K2O
- F2
- H2O
- O2
Запишите в поле ответа номера выбранных соединений.
Решение: ковалентная неполярная связь образуется между одинаковыми атомами. Это фтор и кислород.
Ответ 35.
Задача 7. Из предложенного перечня выберите два вещества, с каждым из которых сера образует ионные связи.
- Фтор
- Натрий
- Кислород
- Кальций
- Углерод
Запишите в поле ответа номера выбранных соединений.
Решение: Ионные связи образуются между металлом и неметаллом. Сера-неметалл, значит, нужно выбрать металлы. Это натрий и кальций.
Ответ: 24.
Задача 8. Из предложенного перечня выберите два вещества, в молекулах которых имеются как полярные, так и неполярные ковалентные связи.
- CCl4
- C6H6
- HNO3
- N2O4
- CO2
Решение: В молекуле под номером 1 есть 4 связи C-Cl, все они полярные, но в задании нужно найти молекулу как с полярными, так и с неполярными связями.
В молекуле бензола (под номером 2) содержится 2 вида связей: C-C неполярная и C-H полярная.
В молекуле HNO3 хоть и 3 кислорода, но между собой они не связаны, поэтому наблюдается 2 вида только полярных связей H-N, N-O.
В молекуле N2O4 2 типа связей: N-N неполярная и N-O полярная.
В молекуле углекислого газа оба кислорода связаны только с углеродом, образуя только полярные связи.
Ответ 24.
Задача 9. Из предложенного перечня выберите два вещества, в которых присутствует металлическая связь.
- Na2O
- Cu(OH)2
- Fe
- B
- Zn
Решение: металлическая связь характерная для металлов и сплавов.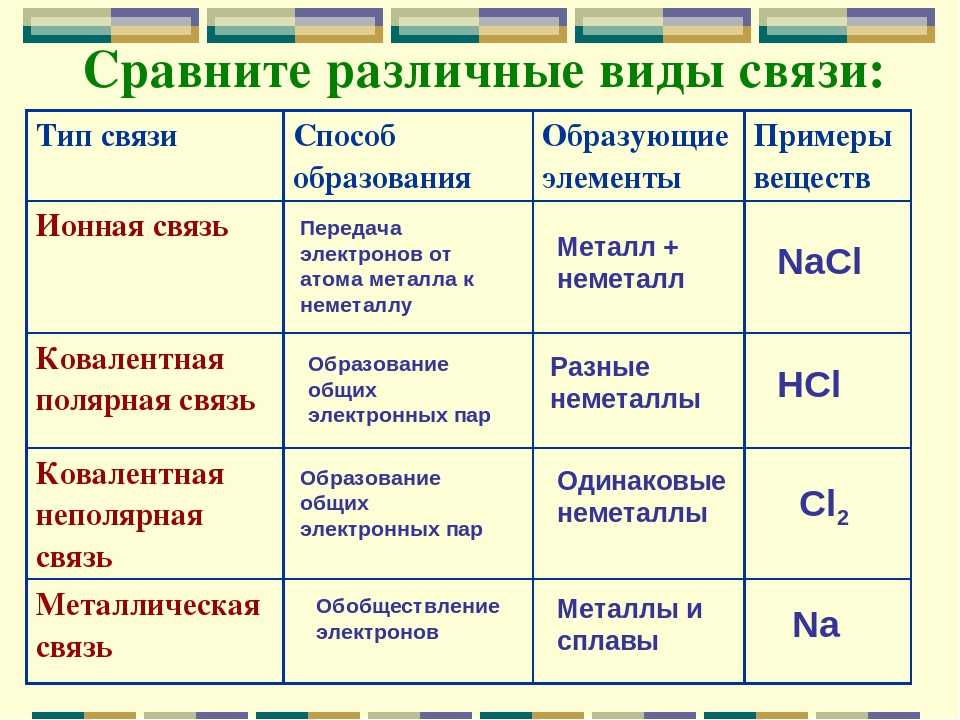 Металлы здесь — железо и цинк. Ответ 35.
Металлы здесь — железо и цинк. Ответ 35.
Задача 10. Из предложенного перечня выберите два вещества, с которыми соединения хлора имеют ковалентную полярную связь.
- Водород
- Калий
- Магний
- Натрий
- Фосфор
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому ковалентную полярную связь имеет соединение хлора с водородом и фосфором. С остальными — связь ионная.
Ответ: 15.
Задача 11. Из предложенного перечня выберите два соединения, в которых имеются только ионные связи.
- KI
- BaCl2
- KClO3
- BaSO4
- (NH4)2S
Решение: Ковалентная не полярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ионные связи присутствуют в KI и BaCl2.
Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ионные связи присутствуют в KI и BaCl2.
Ответ: 12.
Задача 12. Из предложенного перечня выберите два соединения, между молекулами которых образуются водородные связи.
- Фтороводород
- Бутанол
- Хлорметан
- Диметиловый эфир
- Этилен
Решение: Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы.
Среди предложенных веществ водородная связь образуется между молекулами фторводорода и бутанола.
Ответ: 12.
Задача 13. Из предложенного перечня выберите два соединения, образованные как ковалентной, так и ионной связью.
- CaSO4
- C2H5OH
- NH4NO3
- NaCl
- C6H6
Решение: В этиловом спирте связи ковалентные, в хлориде натрия — ионные, в бензоле — ковалентные. В нитрате аммония и сульфате кальция связи в ионе аммония и нитратном и сульфатном анионах ковалентные, а между ионом аммония и нитратным анионом, а также ионом кальция и сульфат анионом — ионная.
Ответ: 13
Задача 14. Из предложенного перечня выберите два соединения, где кислород образует ковалентную полярную связь.
- NO2
- O2
- CO
- CaO
- Al2O3
Решение: Ковалентная полярная связь осуществляется между разными неметаллами.
Ответ: 13
Задача 15. Из предложенного перечня выберите два типа химических связей, которые реализуются в сульфате калия.
- ковалентная неполярная
- ковалентная полярная
- ионная
- металлическая
- водородная
Решение: Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. В сульфате калия между ионами калия и сульфат-ионами связь ионная, а между кислородом и серой в сульфат-ионе — ковалентная полярная.
Ответ: 23.
Двуокись азота является ковалентным соединением. Сколько атомов кислорода содержится в молекулах диоксида азота?
Дата последнего обновления: 19 апреля 2023 г. 03
Подсказка: В ковалентных соединениях атомы связаны ковалентной связью. Молекулярная формула диоксида азота: $N{O_2}$. Центральный атом азота связан с одним кислородом с одной стороны и с другим кислородом с другой стороны.
Полный пошаговый ответ:
Ковалентные соединения — это такие химические соединения, в которых атомы, присутствующие в химическом соединении, связаны ковалентными связями. 4}$, валентный электрон в кислороде равен 6. Общее количество валентных электронов, присутствующих в молекулах диоксида азота, равно 17 (присутствуют два атома кислорода).
4}$, валентный электрон в кислороде равен 6. Общее количество валентных электронов, присутствующих в молекулах диоксида азота, равно 17 (присутствуют два атома кислорода).
В связывании принимают участие 6 электронов, 5 пар электронов присутствуют на атоме кислорода и один электрон присутствует на атоме азота.
Структура диоксида азота показана ниже.
Всего два атома кислорода присутствуют в диоксиде азота.
Примечание:
В диоксиде азота двойная связь образуется из одной сигма-связи и одной пи-связи, а одинарная связь образуется из одной сигма-связи.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класс химия JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А 11 класс химии JEE_Main
Фосфин получают из следующей руды Кальций 12 класса химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba, Sr, Ca и Mg могут быть отнесены к 12 классу химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класс химии JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 класс 12 химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций 12 химического класса JEE_Main
Актуальные сомнения
NO2 (двуокись азота) Точечная структура Льюиса
Двуокись азота (NO 2 ) представляет собой ковалентное соединение, состоящее из центрального атома азота, одинарной связи с атомом кислорода и двойной связи с другим атомом кислорода атом. При комнатной температуре двуокись азота представляет собой красновато-коричневый газ с плотностью 1,8 г/дм 3 . Он слегка токсичен для человека из-за его склонности реагировать в организме человека и производить химически активные формы азота и кислорода, которые могут повредить внутренние структуры.
При комнатной температуре двуокись азота представляет собой красновато-коричневый газ с плотностью 1,8 г/дм 3 . Он слегка токсичен для человека из-за его склонности реагировать в организме человека и производить химически активные формы азота и кислорода, которые могут повредить внутренние структуры.
«Небольшой пузырь воздуха остался неабсорбированным… если есть какая-то часть флогистированного воздуха [азота] нашей атмосферы, которая отличается от остальной части и не может быть восстановлена до азотистой кислоты, мы можем с уверенностью заключить, что это не более чем 1/120 часть целого». — Генри Кавендиш
Диоксид азота не имеет единой структуры Льюиса из-за его относительно странной электронной конфигурации. Расположение двойной связи со временем меняется, а это означает, что в любой момент любой из атомов кислорода может иметь двойную связь с атомом азота. Таким образом, диоксид азота представлен резонансной структурой Льюиса:
Для диоксида азота требуется резонансная структура Льюиса, поскольку его электронная конфигурация постоянно колеблется между двумя формами. «Истинной» электронной конфигурацией диоксида азота считается некоторая средняя из двух приведенных выше резонансных структур. Структура Льюиса диоксида азота также интересна тем, что на центральном атоме азота есть один неспаренный валентный электрон. Соединения с неспаренными электронами иногда называют «свободными радикалами». Этот неспаренный электрон объясняет реактивное поведение диоксида азота, так как он имеет сильное желание заполнить это открытое электронное пятно.
«Истинной» электронной конфигурацией диоксида азота считается некоторая средняя из двух приведенных выше резонансных структур. Структура Льюиса диоксида азота также интересна тем, что на центральном атоме азота есть один неспаренный валентный электрон. Соединения с неспаренными электронами иногда называют «свободными радикалами». Этот неспаренный электрон объясняет реактивное поведение диоксида азота, так как он имеет сильное желание заполнить это открытое электронное пятно.
Давайте сделаем шаг назад и рассмотрим правила рисования структуры Льюиса. Мы пойдем шаг за шагом, чтобы увидеть, как мы можем построить структуру Льюиса для большинства соединений главной группы, включая диоксид азота.
Структуры Льюиса: основы
В двух словах, структура Льюиса — это графическое представление атомной структуры и электронной конфигурации атома или соединения. Отдельные атомы представлены своим уникальным химическим символом, электроны представлены одиночными точками, а общие пары электронов представлены одинарным тире (-) для одиночной пары, двойной чертой (=) для двойной пары и тройной. полоса (≡) для тройной пары.
полоса (≡) для тройной пары.
«Каждое химическое вещество, будь то природное или искусственное, подпадает под одну из двух основных категорий в зависимости от пространственных характеристик его формы. Различие между теми веществами, которые имеют плоскость симметрии, и теми, у которых ее нет. Первые относятся к минеральному, вторые — к живому миру». — Луи Пастер
Назначение структуры Льюиса — увидеть, как электроны расположены в атоме или соединении. Структуры Льюиса основаны на правиле октетов — эмпирическом наблюдении, что атомы склонны образовывать связи до тех пор, пока у них не будет полной валентной оболочки из 8 электронов. Единственным исключением из правила октета является водород, который будет образовывать связи только до тех пор, пока у него не будет 2 валентных электрона.
Валентные электроны представлены парами точек, где каждая точка представляет один электрон. Атомы образуют ковалентные связи, делясь своими валентными электронами с другими атомами. Например, один атом хлора имеет 7 валентных электронов; 3 пары и один свободный электрон. Два атома хлора будут иметь общий неспаренный электрон, так что каждый атом будет иметь полный октет электронов, образуя молекулу хлора (Cl 2 ). В общем, так работают ковалентные связи. Атомы будут делиться валентными электронами до тех пор, пока у каждого атома не будет полного октета. Если все валентные электроны спарены, но атом еще не имеет полного октета, электронные пары будут перемещаться, образуя двойные и тройные связи. Общее количество электронов в структуре Льюиса равно сумме числа валентных электронов отдельных атомов.
Например, один атом хлора имеет 7 валентных электронов; 3 пары и один свободный электрон. Два атома хлора будут иметь общий неспаренный электрон, так что каждый атом будет иметь полный октет электронов, образуя молекулу хлора (Cl 2 ). В общем, так работают ковалентные связи. Атомы будут делиться валентными электронами до тех пор, пока у каждого атома не будет полного октета. Если все валентные электроны спарены, но атом еще не имеет полного октета, электронные пары будут перемещаться, образуя двойные и тройные связи. Общее количество электронов в структуре Льюиса равно сумме числа валентных электронов отдельных атомов.
Структуры Льюиса рассказывают вам о расположении атомов и распределении электронов в атоме или соединении. Хотя сами по себе структуры Льюиса не дают явной информации о трехмерной геометрии молекулы, правила записи структур Льюиса можно комбинировать с правилами, управляющими молекулярной геометрией, чтобы предсказать форму, которую будет иметь соединение.
Правила изготовления структур Льюиса
Давайте рассмотрим правила изготовления структур Льюиса на примере диоксида азота.
Шаг 1. Определить общее количество валентных электронов.
Первый шаг — выяснить, сколько электронов должно быть на вашей диаграмме. Общее количество электронов в структуре Льюиса должно быть равно сумме валентных электронов каждого отдельного атома. Количество валентных электронов элемента можно определить, посмотрев на номер их группы в периодической таблице. Как правило, элементы групп 1 и 2 имеют 1 и 2 валентных электрона соответственно. Элементы групп 13-18 имеют 3, 4, 5, 6, 7 и 8 валентных электронов соответственно. Элементы группы 3-12 — это переходные металлы, которые могут иметь различное количество валентных электронов 9.0003
В нашем случае диоксид азота состоит из 1 атома азота и двух атомов кислорода. Азот является элементом 15-й группы и поэтому имеет 5 валентных электронов, а кислород 16-й группы имеет 6 валентных электронов. Есть два атома кислорода, поэтому общее количество валентных электронов на нашей диаграмме составляет:
Есть два атома кислорода, поэтому общее количество валентных электронов на нашей диаграмме составляет:
5(1) + 6(2) = 17 электронов
Всего на нашей диаграмме должно быть 17 электронов.
Шаг 2: Нарисуйте атомную структуру соединения
Теперь, когда у нас есть количество валентных электронов, мы можем начать построение диаграммы. Если соединение двухатомное (два атома), структура проста; атомы могут располагаться рядом. В случае соединений с тремя или более атомами обычно имеется центральный атом, который имеет несколько общих связей с концевыми атомами. В общем, для трехатомных или более крупных соединений центральный атом является наименее электроотрицательным элементом.
В нашем случае у нас есть трехатомное соединение, поэтому в нашей структуре, скорее всего, будет центральный атом, связанный с несколькими концевыми атомами. Азот менее электроотрицателен, чем кислород (3,04<3,44), поэтому азот у нас в центре.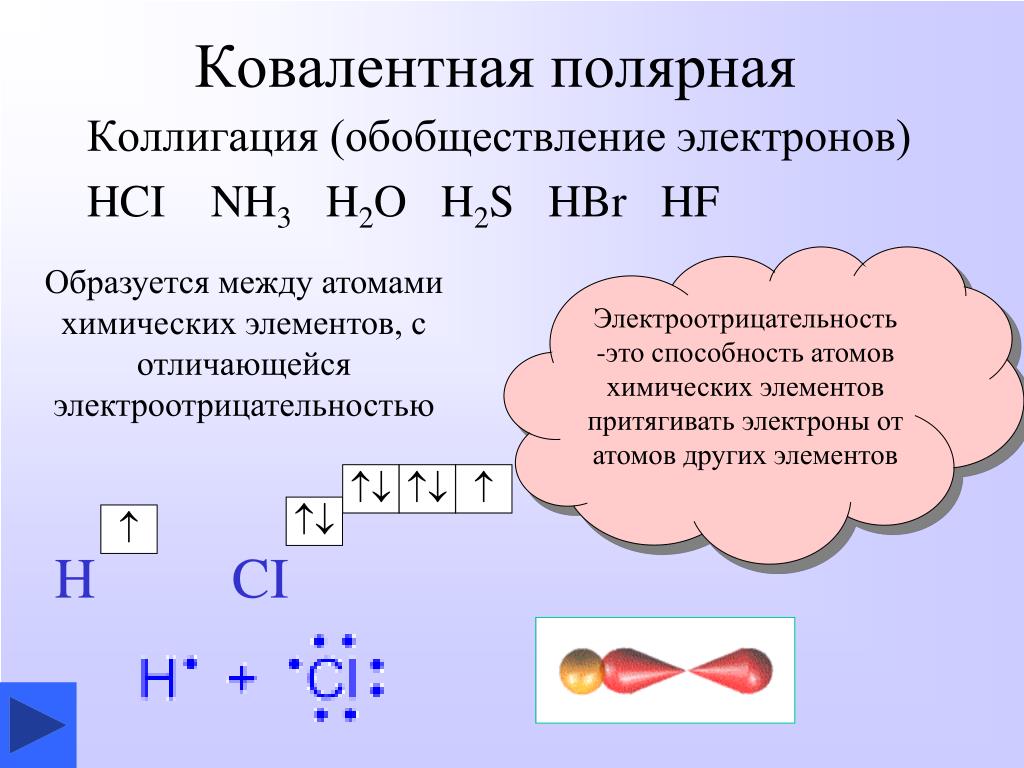 Размещение символов дает нам:
Размещение символов дает нам:
Авторы и права: Автор
Шаг 3: Разместите пары электронов так, чтобы у каждого атома была хотя бы одна одинарная связь
Далее мы можем начать размещать электроны в нашей модели. Сначала мы проходим и размещаем одинарную связь между каждым атомом. На каждую отдельную связь приходится 2 электрона, поэтому мы вычитаем эти электроны из общего количества, чтобы получить, сколько электронов нам осталось разместить.
В нашем случае мы размещаем две одинарные связи, по одной между каждым атомом, что выглядит так:
Поскольку мы разместили 2 пары, мы разместили всего 4 электрона. Теперь у нас есть 17-4 = 13 дополнительных электронов для размещения.
«Современная химия с ее далеко идущими обобщениями и гипотезами — прекрасный пример того, как далеко может зайти человеческий разум в исследовании неизвестного за пределами чувств». — Гораций Г. Деминг
Шаг 4: Разместите электронные пары, начиная с концевых атомов, пока у каждой не будет полный октет.
Далее размещаем оставшиеся электроны. Начиная с концевых атомов, закрасьте точки, пока у каждого атома не будет в общей сложности 8 валентных электронов. Если у вас есть оставшиеся атомы, поместите их на центральный атом парами или в виде одиноких электронов.
Начиная с концевых атомов кислорода, мы размещаем по 6 электронов вокруг каждого так, чтобы у них был полный октет. Любые оставшиеся электроны мы размещаем на атоме азота. Добавление 6 электронов к каждому атому кислорода дает всего 12, поэтому мы помещаем оставшийся единственный электрон на атом азота:
После размещения этих 13 электронов осталось 13-13 = 0 электронов . Но мы еще не закончили, потому что наш центральный атом все еще не имеет полного октета, азот в настоящее время имеет только 5 электронов; 2 пары и один неспаренный электрон.
Шаг 5: Перемещайте пары электронов, чтобы образовать двойные и тройные связи, пока у каждого атома не появится октет или он не будет настолько близок к октету, насколько это возможно.
Если все электроны размещены, а некоторые атомы все еще не имеют полного октета, тогда соединения будут образовывать двойные и тройные связи, чтобы каждый атом максимально приблизился к 8 электронам. Просто переместите пары электронов от концевых атомов, чтобы образовать двойные и тройные связи.
В нашем случае все наши электроны размещены, но азот имеет только 5 валентных электронов. Перемещение пары несвязанных электронов от одного из атомов кислорода создает двойную связь с азотом, давая ему 7 электронов. Перемещение любой дополнительной пары электронов дало бы азоту более 8 электронов, поэтому мы зашли так далеко, как могли, и наша структура Льюиса должна выглядеть так:
Резонансные структуры
необходимо выбрать пару электронов для образования двойной связи. Мы выбрали левый атом кислорода, но нельзя ли было выбрать правильный атом кислорода, чтобы получить что-то подобное?:
Да, это также действительная структура Льюиса для двуокиси азота.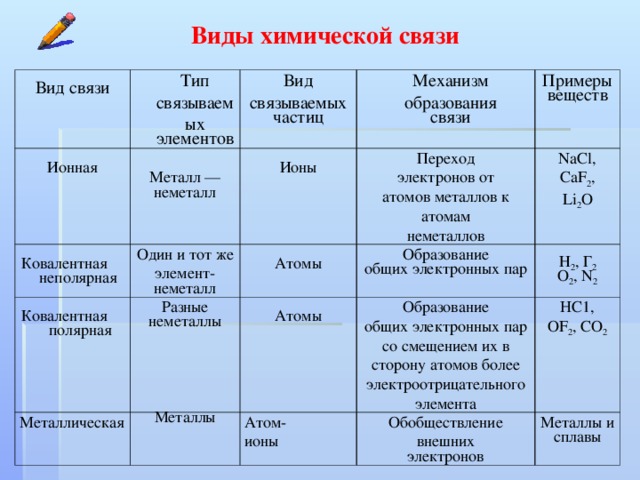 Однако эта структура явно отличается от предыдущей; двойная связь находится справа, а не слева. Если обе структуры Льюиса законны, то какая из них является «настоящей» структурой Льюиса диоксида азота? Ответ: оба.
Однако эта структура явно отличается от предыдущей; двойная связь находится справа, а не слева. Если обе структуры Льюиса законны, то какая из них является «настоящей» структурой Льюиса диоксида азота? Ответ: оба.
В тех случаях, когда для соединения существует более одной допустимой структуры Льюиса, вся структура Льюиса представляется как среднее значение нескольких структур. Эти структуры известны как резонансных структур , и они используются для соединений, электронная конфигурация которых не может быть полностью представлена одной уникальной диаграммой Льюиса. Резонансная структура двух наших диаграмм для двуокиси азота выглядит так:
«Реальная» структура двуокиси азота интерпретируется как некоторая комбинация двух диаграмм. Резонансные структуры возможны, потому что для некоторых соединений электронные пары делокализованы и колеблются между одной конфигурацией и другой. Резонансные структуры необходимы, потому что атомные конфигурации некоторых молекул не могут быть точно зафиксированы с помощью одной структуры Льюиса.

Leave A Comment