Свойства фторида натрия и область использования химического вещества
Фторид натрия представляет собой вещество бинарного типа, полученное в ходе неорганического соединения. Молекула химического реактива состоит из двух элементов, натрия и фтора, что видно в формуле фторида натрия (NaF). В основном получение натрия фторида происходит в промышленных условиях, но иногда вещество можно встретить и в природе, в виде редкого минерала виллиомита или в составе некоторых магматических пород.
Свойства фторида натрия
Физические свойства фторида натрия характеризуют реагент, как белое вещество, которое иногда может сопровождаться легким серым оттенком. Фтористый натрий не имеет характерного ярко выраженного запаха. Плохо растворяется в воде, но отлично поглощает жидкости из воздуха. Растворимость фторида натрия в этаноле нулевая, полное растворение возможно в безводной плавиковой кислоте. Это химическое вещество токсично, но не наделено горючестью или взрывоопасными характеристиками. Путем электролиза разлагается на составляющие – на натрий и фтор.
Путем электролиза разлагается на составляющие – на натрий и фтор.
Химические свойства фторида натрия характеризуют его как активное вещество. Легко взаимодействует с фтороводородной кислотой, и с сильными кислотами. Например, с серной. Вступает в реакции с гидроокисью лития, фторсиликатами и фторалюминатами.
Класс опасности
Фтористый натрий является токсичным и ядовитым веществом. Присвоен фториду натрия класс опасности 2. Особенно токсичен при попадании в дыхательные пути и в органы пищеварения. Отравление веществом приводит к нарушениям работы сердечно-сосудистой системы, скачкам артериального давления, раздражению желудочного тракта, включая появление язв.
При отравлении фтористым натрием проявляются такие симптомы:
- тошнота, диарея и рвота;
- слюно- и слезотечение;
- падение уровня артериального давления;
- повышение температуры тела;
- нарушения зрения.

Вред фтористый натрий приносит и при попадании на кожу, что способствует появлению сильных химических ожогов.
Меры безопасности при хранении и транспортировке
Принесет фторид натрия вред или пользу зависит от того, насколько соблюдаются меры безопасности при работе с токсичным веществом. На производстве, где используется фтористый натрий, регулярно проводят анализ состава воздуха для оценки содержания ПДК. Сотрудники, кто взаимодействует с токсичным химикатом, должны надевать средства индивидуальной защиты. Рабочее место оснащается системой принудительной вентиляции.
Транспортировка фтористого натрия происходит любым видом транспорта. Складировании и хранение токсичного вещества возможно только в сухих, хорошо проветриваемых помещениях.
Области применения фторида натрия
Применение фтористого натрия не ограничивается какой-либо определенной сферой промышленности. Использование химического вещества распространяется на:
- Производство лекарственных препаратов и зубной пасты.

- Получение алюминия в металлургии, где вещество используется для очистки металлов и создания антикоррозийного покрытия для деталей.
- Обработку древесины, где фтористый натрий используется, как антисептик и консервант для дерева.
- Сельское хозяйство, где вещество используется для борьбы с вредными насекомыми.
- Водоподготовку для обогащения воды фтором.
- Область производства стеклянных и керамических изделий, эмали, огнеупоров, флюсов.
- Лабораторные исследования, при которых вещество применяется в качестве реактива.
- Фармакологическую отрасль, в которой вещество применяется для тестирования лекарственных препаратов.
- Биохимическую отрасль, в которой фтористый натрий используется для консервации тканевых образцов.
- Сферу очищения газов от фторидов урана.
Также применение фторида натрия распространяется на химическую промышленность, где реактив используется для различных реакций, включая синтез фторорганических соединений, реактивов, фреонов и прочего.
Вы сможете купить натрия фторид по выгодной цене в нашей компании, отправьте заявку на почту [email protected], мы вам пришлем счет.
Фторид натрия Ионная связь Кристаллическая структура, Ионная связь, фиолетовый, сфера, химия png
Фторид натрия Ионная связь Кристаллическая структура, Ионная связь, фиолетовый, сфера, химия pngтеги
- фиолетовый,
- сфера,
- химия,
- пурпурный,
- фрукты,
- структура,
- фторид,
- натрий,
- хлорид натрия,
- фторид натрия,
- оксид лития,
- ионный кристалл,
- ионное соединение,
- ион,
- кристаллическая структура,
- кристалл,
- круг,
- химическая формула,
- химическое соединение,
- png,
- прозрачный,
- бесплатная загрузка
Об этом PNG
- Размер изображения
- Размер файла
- 179.
 22KB
22KB - MIME тип
- Image/png
изменить размер PNG
ширина(px)
высота(px)
Лицензия
Некоммерческое использование, DMCA Contact Us
- Хлорид натрия Ионное соединение Химическое соединение Ионное соединение, другие, Разное, фиолетовый, другие png 1000x948px 262.72KB
- Хлорид натрия Ионное соединение Химия, кристалл, Разное, пурпурный, другие png 1100x1056px 358.85KB
- Кубическая кристаллическая система Кристаллическая структура Решетка Хлорид натрия, куб, угол, симметрия, химия png 1040x1000px 165.71KB org/ImageObject»> Хлорид серебра Ионное соединение Химическое соединение, 3d, Сфера, химия, твердое тело png 1100x978px 302.83KB
- Фторид натрия Хлорид калия Хлорид натрия Фторид калия, 3d, Разное, фиолетовый, другие png 1074x1100px 481.94KB
- Фторид лития фтор-ионный, другие, разное, фиолетовый, другие png 1100x1069px 475.28KB
- Кристаллическая структура Химия Решетка, Хлорид железа, синий, другие, симметрия png 989x1000px 379.9KB
- Химическое соединение Химический синтез Химия Органическое соединение Молекула, химическая формула, угол, белый, текст png 1917x1466px 134.17KB
- Эпсом Магний сульфат Соль, соль, химическое соединение, минерал, солевой раствор png 600x600px 287.41KB
- Ионная связь Фторид серебра (I) Химия Химическая связь Фторид никеля (II), др., Разное, другие, сфера png 1100x984px 604.83KB
- Хлорид натрия Энергия решетки Ионные соединения Ионные связи, частицы, Разное, фиолетовый, другие png 1100x1093px 416.29KB
- Атомная теория Периодическая таблица Атомы в молекулах Химия, наука, разное, химический элемент, презентация png 1500x1600px 592.81KB
- иллюстрация атома, модель Бора Натрия Атом Химия модель Резерфорда, медная оболочка, разное, химический элемент, другие png 550x553px 181.6KB
- Металлическая связь Химическая связь Электрон Атом, металлические материалы, текст, электрон, химия png 680x421px 56.21KB
- Металлическая связь Химическая связь Химический элемент Атом, кристалл, фиолетовый, химический элемент, сфера png
1100x1038px
505.
 55KB
55KB - Химическая формула Молекула Химическая структура Химия Химические вещества, другие, угол, текст, прямоугольник png 709x616px 8.01KB
- черно-белая иллюстрация, Молекула Химия Молекулярная геометрия Химическая структура, молекула, синий, текст, цвет png 2482x1761px 300.48KB
- Кристаллическая структура Ионное соединение Твердый хлорид натрия, Трехмерный, разное, другие, симметрия png 500x500px 62.2KB
- Ионное соединение Хлорид натрия Электропроводность Вода, вода, стекло, химия, материал png 2100x1573px 315.03KB
- Кофеин Кофеин Молекулы Химическая структура Молекулярная геометрия, Кофе, угол, белый, текст png
1200x987px
40.
 58KB
58KB - Носкапин Молекула Химическое соединение Химическая формула Химия, Структура, угол, белый, текст png 1060x958px 23.77KB
- Кристаллическая структура Кальций фторид Химия, др., синий, другие, цвет png 1092x1053px 792.85KB
- Хлорид натрия ионная связь ионное соединение, додецилбензолсульфонат натрия, фиолетовый, другие, химия png 768x728px 501.5KB
- Сольватационная оболочка, молекула иона натрия, молекулы клеток, сфера, химия, катион png 720x780px 159.54KB
- Мочевая кислота Кристаллическая структура Аллантоин Химическое соединение, Аллантоин, угол, белый, текст png
1200x855px
29.
 67KB
67KB - Кофеин Кофеин Молекула Химия Химическое вещество, Кофе, угол, белый, текст png 748x615px 25.92KB
- Ионик Кристалл Хлорид натрия Соль Натрийхлорид-Структур Ионное соединение, соль, электрон, фрукты, металл png 1320x1225px 141.18KB
- Нитрат серебра структура Льюиса Символ, серебро, угол, мебель, текст png 1200x661px 17.3KB
- Химическая формула Молекулярная формула Молекула Химия Вода, раковина, химический элемент, мебель, текст png 1280x867px 22.72KB
- Эндорфины бета-эндорфин химический пептид химическое вещество, ренин, угол, белый, текст png
1280x1011px
47.
 7KB
7KB - Кристаллическая структура вюрцита Оксид цинка Сульфид цинка, ячейка, Разное, другие, ячейка png 990x1100px 223.4KB
- Золото (I) сульфид Золото (III) хлорид Золото (III) сульфид, клетка, золото, химия, ячейка png 2070x2150px 817.64KB
- Ацетон Химическое соединение Структурная формула Химическая формула Метильная группа, другие, угол, текст, другие png 1920x1141px 40.17KB
- чаша соли, морская соль специи приправа гималайская соль, деревянная чаша соли, еда, деревянная доска, деревянная текстура png 1025x681px 572.2KB
- Бензол Химия Химическая структура Структурная формула, каучуки, угол, белый, текст png
880x1040px
38.
 73KB
73KB - Университет Западного Орегона Химия Растворимость хлорида натрия, Растворение, текст, химия, украшения для тела png 1767x878px 1.1MB
- Молекула Химическое соединение Химическая формула Аминокислота Леводопа, дофамин, угол, белый, текст png 1280x546px 25.57KB
- Структура Льюиса Хлор Атом Химия Хлорид, другие, химический элемент, текст, другие png 768x768px 23.82KB
- Гидроксид натрия Хлорид натрия Промышленность, др., Разное, другие, химические png 1000x783px 395.36KB
- Твердая кристаллическая структура Минерал, соль, разное, фиолетовый, другие png
1000x948px
627.
 55KB
55KB - Кристаллическая структура диоксид олова рутил диоксид титана, ячейка, Разное, другие, химия png 1200x806px 212.34KB
- Мелатонин Химическое строение Химическое вещество Химия Химическое соединение, другие, угол, белый, текст png 1232x1024px 30.73KB
- Бура Борат Химический состав Химическое соединение, другие, угол, белый, текст png 696x520px 16.51KB
- Молекула Кофеин Химия Химическая структура Химическая связь, молекула, Разное, синий, химический Элемент png 1024x875px 271.14KB
- Химическая формула Молекула Вода Химия Химическое соединение, вода, угол, текст, логотип png
1280x549px
12.
 36KB
36KB - Ион Хлорид натрия Межмолекулярная сила Химия, Автомат решетчатого газа, фиолетовый, другие, симметрия png 828x621px 127.38KB
- Кристаллическая система решетки Браве Алмаз кубический Кристаллическая структура, решетка, фиолетовый, алмаз, химия png 600x654px 196.29KB
Ионная связь – Введение в химию
ЛюменОбучение
Ионная связь и перенос электронов
Ионная связь возникает в результате переноса электрона от атома металла к атому неметалла.
ЦЕЛИ ОБУЧЕНИЯ
Определение основных характеристик ионных связей
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Ионные связи образуются между катионами и анионами.
- Катион образуется, когда ион металла теряет валентный электрон, а анион образуется, когда неметалл приобретает валентный электрон.
 Благодаря этому обмену они оба достигают более стабильной электронной конфигурации.
Благодаря этому обмену они оба достигают более стабильной электронной конфигурации. - Ионные твердые вещества образуют кристаллические решетки или повторяющиеся структуры атомов с высокими температурами плавления и обычно растворимы в воде.
Ключевые термины
- электролит : ионное соединение, которое растворяется в воде, делая полученный раствор способным проводить электричество.
- : Тенденция атома притягивать к себе электроны.
- : Положительно заряженный ион.
- : Отрицательно заряженный ион.
Ионные связи
Ионная связь — это тип химической связи, при которой валентные электроны отдаются одним атомом и приобретаются другим. Этот обмен приводит к более стабильной электронной конфигурации благородного газа для обоих вовлеченных атомов. Ионная связь основана на электростатических силах притяжения между двумя ионами с противоположным зарядом.
Катионы и анионы
Ионные связи включают катион и анион. Связь образуется, когда атом, обычно металл, теряет электрон или электроны и становится положительным ионом или катионом. Другой атом, обычно неметалл, способен приобрести электрон(ы), чтобы стать отрицательным ионом или анионом.
Связь образуется, когда атом, обычно металл, теряет электрон или электроны и становится положительным ионом или катионом. Другой атом, обычно неметалл, способен приобрести электрон(ы), чтобы стать отрицательным ионом или анионом.
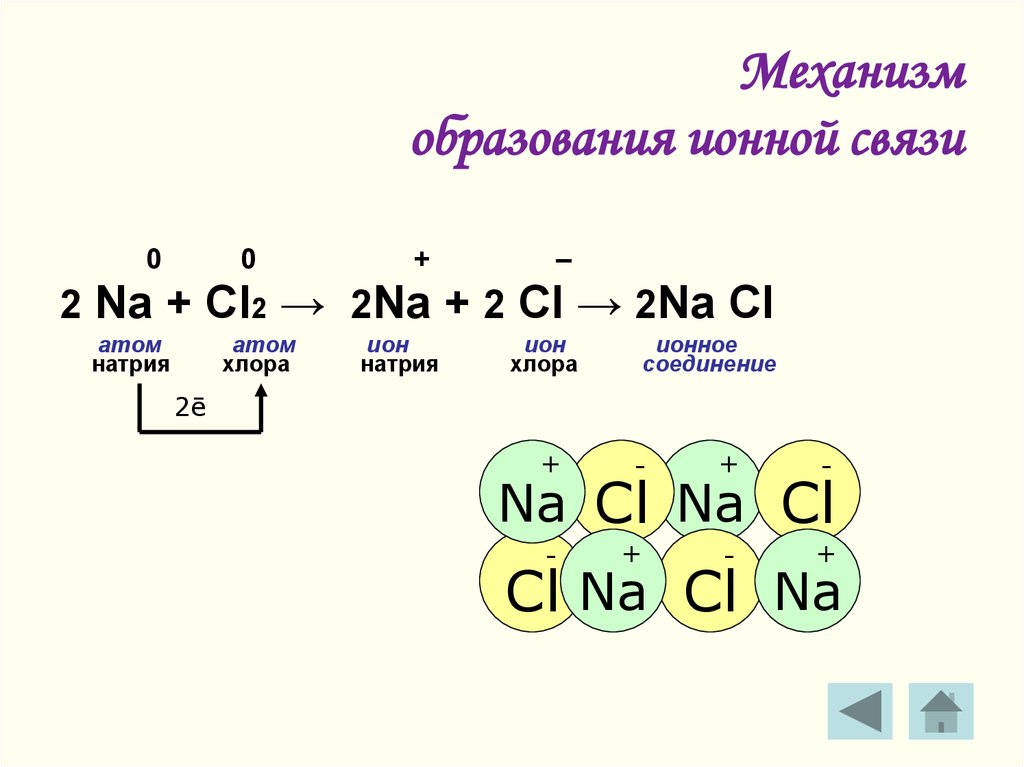
Одним из примеров ионной связи является образование фторида натрия, NaF, из атома натрия и атома фтора. В этой реакции атом натрия отдает свой единственный валентный электрон атому фтора, у которого как раз достаточно места, чтобы его принять. Образовавшиеся ионы имеют противоположный заряд и притягиваются друг к другу благодаря электростатическим силам.
Образование NaF: электрон переносится от Na к F. Образовавшиеся ионы Na+ и F– электрически притягиваются друг к другу. В макроскопическом масштабе ионные соединения образуют решетки, при нормальных условиях представляют собой твердые кристаллы и имеют высокие температуры плавления. Большинство этих твердых веществ растворимы в [латексе]\text{H}_2\text{O}[/latex] и при растворении проводят электричество. Благодаря способности проводить электричество в растворе эти вещества получили название 9.0052 электролиты . Поваренная соль, [латекс]\текст{NaCl}[/латекс], является хорошим примером соединения этого типа.
Благодаря способности проводить электричество в растворе эти вещества получили название 9.0052 электролиты . Поваренная соль, [латекс]\текст{NaCl}[/латекс], является хорошим примером соединения этого типа.
Ионные связи отличаются от ковалентных. Оба типа приводят к стабильным электронным состояниям, связанным с благородными газами. Однако в ковалентных связях электроны распределяются между двумя атомами. Все ионные связи имеют тот или иной ковалентный характер, но чем больше разница в электроотрицательности между двумя атомами, тем больше ионный характер взаимодействия.
Ionic Bonding – YouTube: В этом видео Пол Андерсен объясняет, как образуются ионные твердые вещества, когда катионы и анионы притягиваются.
Энергия решетки
Энергия решетки является мерой прочности связи в ионном соединении.
ЦЕЛИ ОБУЧЕНИЯ
Описать энергию решетки и факторы, влияющие на нее
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Энергия решетки определяется как энергия, необходимая для разделения моля ионного твердого вещества на газообразные ионы.
- Энергия решетки не может быть измерена эмпирически, но ее можно рассчитать с помощью электростатики или оценить с помощью цикла Борна-Габера.
- Двумя основными факторами, влияющими на величину энергии решетки, являются заряд и радиус связанных ионов.
Ключевые термины
- экзотермическая реакция : Процесс, при котором тепло выделяется в окружающую среду.
- энергия решетки : Количество энергии, высвобождаемой при образовании кристаллического ионного твердого тела из газообразных ионов. 9-(g) \rightarrow \text{NaCl}(s) \ \ \ \ \ \ \ \Delta H = -787,3 \text{ кДж/моль}[/latex]
Отрицательный знак энергии указывает на экзотермическую реакцию.

В качестве альтернативы энергия решетки может рассматриваться как энергия, необходимая для разделения моля ионного твердого вещества на газообразную форму его ионов (то есть реакция, обратная показанной выше).
Кристаллическая решетка NaCl: ионы натрия (Na+) и ионы хлорида (Cl–), изображенные фиолетовым и зеленым соответственно, чередуются в кристаллической решетке твердого NaCl.В качестве альтернативы энергия решетки может рассматриваться как энергия, необходимая для разделения моля ионного твердого вещества на газообразную форму его ионов (то есть реакция, обратная показанной выше).
Энергия решетки не может быть определена экспериментально из-за сложности выделения газообразных ионов. Энергетическое значение можно оценить с помощью цикла Борна-Габера или рассчитать теоретически с помощью электростатического исследования кристаллической структуры.
Факторы, влияющие на энергию решетки 92}{4 \pi \epsilon _0 r_0} (1 — \frac{1}{n})[/latex]
В этом уравнении N A — постоянная Авогадро; М — постоянная Маделунга, зависящая от геометрии кристалла; z + – зарядовый номер катиона; z – – зарядовое число аниона; e — элементарный заряд электрона; n — показатель Борна, характеристика сжимаемости твердого тела; [латекс]\эпсилон _о[/латекс] — диэлектрическая проницаемость свободного пространства; r 0 — расстояние до ближайшего иона.

Эта модель подчеркивает два основных фактора, влияющих на энергию решетки ионного твердого тела: заряд ионов и радиус или размер ионов. Эффект этих факторов:
- по мере увеличения заряда ионов энергия решетки увеличивается
- по мере увеличения размера ионов энергия решетки уменьшается
Энергии решетки также важны для предсказания растворимости ионных твердых веществ в [латексе]\text{H}_2\text{O}[/latex]. Ионные соединения с меньшей энергией решетки имеют тенденцию быть более растворимыми в [латексе]\text{H}_2\text{O}[/latex].
Энергии решетки – Учебное пособие по химии. В этом учебном пособии рассматривается энергия решетки и способы сравнения относительных энергий решетки различных ионных соединений.
Формулы ионных соединений
Ионные формулы должны удовлетворять конфигурациям инертных газов для составляющих ионов, а соединение продукта должно быть электрически нейтральным.

ЦЕЛИ ОБУЧЕНИЯ
Применить знания об ионной связи для предсказания формулы ионных соединений
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Заряд катионов и анионов в ионном соединении можно определить по потере или приобретению валентных электронов, необходимых для достижения стабильных электронных конфигураций инертных газов.
- Количество катионов и анионов, объединенных в ионное соединение, представляет собой простейшее соотношение целых чисел, которое можно объединить для достижения электронейтральности.
- Катион предшествует аниону как в письменной форме, так и в формуле.
Ключевые термины
- : Любой из элементов группы 18 периодической таблицы, который является одноатомным и, за очень небольшими исключениями, инертным или нереакционноспособным.
- электрически нейтральный : Суммарный нулевой заряд, который возникает, когда атом или молекула/соединение не имеют избытка или дефицита электронов.

- эмпирическая формула : Простейшее целочисленное соотношение между элементами в формуле соединения.
- : Ион, состоящий из нескольких атомов.
Ионные соединения
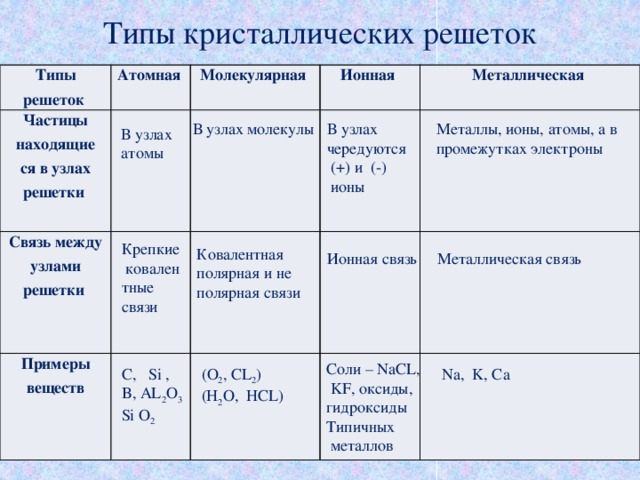
Ионная связь образуется за счет переноса одного или нескольких валентных электронов, обычно от металла к неметаллу, в результате чего образуются катион и анион, связанные вместе электростатической силой притяжения. В макроскопическом масштабе ионные соединения, такие как хлорид натрия ([латекс]\текст{NaCl}[/латекс]), образуют кристаллическую решетку и являются твердыми телами при нормальных температурах и давлениях.
Кристаллическая решетка: Кристаллическая решетка хлорида натрияЗаряд катионов и анионов определяется количеством электронов, необходимых для достижения стабильных электронных конфигураций инертных газов. Затем ионный состав определяется требованием, чтобы полученное соединение было в целом электрически нейтральным.
Например, чтобы объединить магний ([латекс]\текст{Mg}[/латекс]) и бром ([латекс]\текст{Br}[/латекс]) для получения ионного соединения, мы сначала отметим электронные конфигурации этих атомов (уровень валентности выделен курсивом):
мг: 1s 2 2s 2 2p 6 3s2
Br: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10
9004p5
Чтобы получить конфигурацию благородного газа, атому магния необходимо потерять два валентных электрона, в то время как атому брома, имеющему 7 валентных электронов, требуется один дополнительный электрон для заполнения его внешней оболочки. Следовательно, чтобы полученное соединение было нейтральным, два аниона брома должны соединиться с одним катионом магния с образованием бромида магния ([латекс]\текст{MgBr}_2[/латекс]). Кроме того, хотя любое отношение 2 атомов брома к 1 атому магния будет удовлетворять двум указанным выше требованиям, формула для ионных соединений обычно представляется в виде эмпирической формулы или простейшего отношения целых чисел атомов с положительными целыми числами.
Следовательно, чтобы полученное соединение было нейтральным, два аниона брома должны соединиться с одним катионом магния с образованием бромида магния ([латекс]\текст{MgBr}_2[/латекс]). Кроме того, хотя любое отношение 2 атомов брома к 1 атому магния будет удовлетворять двум указанным выше требованиям, формула для ионных соединений обычно представляется в виде эмпирической формулы или простейшего отношения целых чисел атомов с положительными целыми числами.
Обратите внимание, что катион всегда предшествует аниону как в письменной форме, так и в формулах. В письменной форме, хотя название катиона обычно совпадает с названием элемента, суффикс одноатомных анионов изменен на – 9.-[/латекс] объединяются в [латекс]\текст{KClO}_2[/латекс]
Резюме видео
Химия 5.
 3 Написание формул: ионные соединения — YouTube: урок по написанию формул для бинарных ионных соединений, а также ионных соединений, содержащих многоатомные ионы. Показан перекрестный метод.
3 Написание формул: ионные соединения — YouTube: урок по написанию формул для бинарных ионных соединений, а также ионных соединений, содержащих многоатомные ионы. Показан перекрестный метод.Ионная и ковалентная связь Характер
Ионные связи могут иметь ковалентный характер.
ЦЕЛИ ОБУЧЕНИЯ
Обсудить идею о том, что в природе связи обладают характеристиками как ионных, так и ковалентных связей
ОСНОВНЫЕ ВЫВОДЫ
Ключевые моменты
- Ионная связь представлена как полный перенос валентных электронов, как правило, от металла к неметаллу.
- В действительности электронная плотность остается общей между составляющими атомами, что означает, что все связи имеют некоторый ковалентный характер.
- Ионный или ковалентный характер связи определяется относительной электроотрицательностью вовлеченных атомов.
Ключевые термины
- : Ковалентная связь, имеющая частичный ионный характер в результате разницы в электроотрицательности между двумя связывающими атомами.

- : Мера тенденции атома притягивать к себе электроны.
- ковалентный характер : Частичное совместное использование электронов между атомами, имеющими ионную связь.
Ионная и ковалентная связь
Химические соединения часто классифицируют по связям между составляющими их атомами. Существует несколько видов сил притяжения, включая ковалентные, ионные и металлические связи. Модели ионной связи обычно представляются как полная потеря или приобретение одного или нескольких валентных электронов от металла к неметаллу, в результате чего катионы и анионы удерживаются вместе за счет электростатических сил притяжения.
Ионная связь: образование ионной связи между литием и фтором с образованием LiF. В действительности связь между этими атомами более сложна, чем показано в этой модели. Связь, образующаяся между любыми двумя атомами, не является чисто ионной связью. Все связывающие взаимодействия имеют некоторый ковалентный характер, поскольку электронная плотность остается общей между атомами. Степень ионного по сравнению с ковалентным характером связи определяется разницей в электроотрицательности между составляющими атомами. Чем больше разница, тем более ионный характер связи. В общепринятом представлении связи обозначаются как ионные, когда ионный аспект больше, чем ковалентный аспект связи. Связи, находящиеся между двумя крайностями, имеющие как ионный, так и ковалентный характер, классифицируются как полярные ковалентные связи. Такие облигации считаются состоящими из частично заряжены положительными и отрицательными полюсами.
Степень ионного по сравнению с ковалентным характером связи определяется разницей в электроотрицательности между составляющими атомами. Чем больше разница, тем более ионный характер связи. В общепринятом представлении связи обозначаются как ионные, когда ионный аспект больше, чем ковалентный аспект связи. Связи, находящиеся между двумя крайностями, имеющие как ионный, так и ковалентный характер, классифицируются как полярные ковалентные связи. Такие облигации считаются состоящими из частично заряжены положительными и отрицательными полюсами.
Хотя ионный и ковалентный характер представляют точки вдоль континуума, эти обозначения часто полезны для понимания и сравнения макроскопических свойств ионных и ковалентных соединений. Например, ионные соединения обычно имеют более высокие температуры кипения и плавления, а также обычно лучше растворяются в воде, чем ковалентные соединения.
ЛИЦЕНЗИИ И АВТОРСТВО
CC ЛИЦЕНЗИОННОЕ СОДЕРЖИМОЕ, ПРЕДОСТАВЛЕННОЕ РАНЕЕ
- Курирование и пересмотр. Предоставлено : Безграничный.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНОЕ АВТОРСТВО
- Ионная связь. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
- анион. Предоставлено : Викисловарь. Расположен по адресу : http://en.
 wiktionary.org/wiki/anion. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/anion. Лицензия : CC BY-SA: Attribution-ShareAlike - катион. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/cation. Лицензия : CC BY-SA: Attribution-ShareAlike
- НаФ. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike
- Ионная связь – YouTube. Расположен по адресу : http://www.youtube.com/watch?v=hiyTfhjeF_U. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Энергия решетки. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Lattice_energy. Лицензия : CC BY-SA: Attribution-ShareAlike
- Цикл Борна-Габера.
 Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Born-Haber_Cycle. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Born-Haber_Cycle. Лицензия : CC BY-SA: Attribution-ShareAlike - экзотермический. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/exothermic. Лицензия : CC BY-SA: Attribution-ShareAlike
- НаФ. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike
- Ионная связь – YouTube. Расположен по адресу : http://www.youtube.com/watch?v=hiyTfhjeF_U. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Википедия. Предоставлено : Википедия.
 Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike - Энергии решетки – Учебник по химии. Расположен по адресу : http://www.youtube.com/watch?v=EwnU8RalZOw. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- благородный газ. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/noble_gas. Лицензия : CC BY-SA: Attribution-ShareAlike
- Ионное соединение. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Ionic_compound. Лицензия : CC BY-SA: Attribution-ShareAlike
- Номенклатура ИЮПАК. Предоставлено : Википедия. Расположен по адресу : http://en.
 wikipedia.org/wiki/IUPAC_nomenclature. Лицензия : CC BY-SA: Attribution-ShareAlike
wikipedia.org/wiki/IUPAC_nomenclature. Лицензия : CC BY-SA: Attribution-ShareAlike - НаФ. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike
- Ионная связь – YouTube. Расположен по адресу : http://www.youtube.com/watch?v=hiyTfhjeF_U. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Википедия. Предоставлено : Википедия. Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
- Энергии решетки – Учебник по химии. Расположен по адресу : http://www.youtube.com/watch?v=EwnU8RalZOw. Лицензия : Общественное достояние: нет данных Авторские права .
 Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube - Химия 5.3 Написание формул: ионные соединения — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=bvFylpHrJJY. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Википедия. Предоставлено : Википедия. Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
- Ионная связь. Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Ionic_bond. Лицензия : CC BY-SA: Attribution-ShareAlike
- ковалент. Предоставлено : Викисловарь. Расположен по адресу : http://en.wiktionary.org/wiki/covalent. Лицензия : CC BY-SA: Attribution-ShareAlike
- НаФ.
 Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike - Ионная связь – YouTube. Расположен по адресу : http://www.youtube.com/watch?v=hiyTfhjeF_U. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Википедия. Предоставлено : Википедия. Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
- Энергии решетки – Учебник по химии. Расположен по адресу : http://www.youtube.com/watch?v=EwnU8RalZOw. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
- Химия 5.
 3 Написание формул: ионные соединения — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=bvFylpHrJJY. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
3 Написание формул: ионные соединения — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=bvFylpHrJJY. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube - Википедия. Предоставлено : Википедия. Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
- Википедия. Предоставлено : Википедия. Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
- Углерод-фтор-полярность-2D-черный. Предоставлено : Wikimedia Commons. Расположен по адресу : https://commons.wikimedia.org/wiki/File:Carbon-fluorine-bond-polarity-2D-black.png. Лицензия : Общедоступное достояние: неизвестно Авторские права
Эта глава является адаптацией главы «Ионная связь» из книги Boundless Chemistry компании LumenLearning и распространяется под лицензией CC BY-SA 4. 0.
0.
Почему, Как, Структура Льюиса, Подробные пояснения —
Автор Адити Рой
В этой статье «является ли NaF ионным или ковалентным» кратко обсуждаются ионные или ковалентные свойства NaF с подробными пояснениями.
Фторид натрия представляет собой неорганическое соединение с более сильным ионным характером. Он проявляет весь ионный характер, как и любые ионные соединения. Эта соль растворима в воде и имеет белый цвет. Он имеет различное применение, например, фторирование питьевой воды и пестицидов, средство от крыс, а также используется для предотвращения кариеса в зубах.
В этой статье даны ответы на некоторые вопросы о фториде натрия и его химическом поведении.
Определение ковалентного и ионного соединенияКовалентные и ионные соединения являются двумя наиболее важными видами химии. Все молекулы или химические вещества в основном подразделяются на эти два соединения.
Совместное использование электронов является ключевым словом ковалентного соединения, поскольку разница в электроотрицательности между двумя атомами невелика. Но в ионном соединении происходит полное совместное использование электронов из-за большей разницы электроотрицательностей между двумя состоящими атомами.
Но в ионном соединении происходит полное совместное использование электронов из-за большей разницы электроотрицательностей между двумя состоящими атомами.
Изображение предоставлено: Wikimedia Commons Совместное использование электронного облака в ковалентном соединении.
Изображение предоставлено: Википедия
Чтобы узнать больше, пожалуйста, проверьте: 10 примеров ионной связи: объяснение и подробные факты
Как NaF является ионным? NaF состоит из двух атомов, один из которых представляет собой натрий (Na), электроположительный металл, а другой представляет собой соединение галогена фтора (F), электроотрицательный элемент. Электроотрицательность натрия 0,9.3 (по шкале Полинга), а для фтора это значение равно 3,98 (по шкале Полинга). Существует огромная разница в электроотрицательности натрия и фтора (=3,05).
Большая разница в электроотрицательности приводит NaF к ионному соединению. Атомный номер натрия равен 11 (1s 2 2s 2 2p 6 3s 1 ), а фтора равен 9 (1s 2 2s 2 907 16 5 2p 90). Натрий может легко отдать свой 3s-электрон фтору, быть моноположительным ионом металла натрия и получить ближайшую электронную конфигурацию благородного газа. Точно так же фтор может принять электроны, отданные натрием, чтобы создать электронную конфигурацию, подобную ближайшему благородному газу.
Фторид натрия как ионное соединениеТаким образом, валентные электроны натрия полностью передаются фтору, что является основной характеристикой любого ионного соединения.
% ионного характера (% I.C) любого ковалентного и ионного соединения можно определить по следующей формуле: – χ B ) 2
В этой формуле χ A и χ B — электроотрицательность атома А и В соответственно.
Используя эту формулу, процент ионного характера фторида натрия составляет –
- % I.C = 16 (3,98-0,93) + 3,5 (3,98-0,93) 2
- % I.C = 81,35
- ионного характера указывает на то, что NaF является ионным соединением.
Чтобы узнать больше, следуйте инструкциям: 5 Примеры полярной ковалентной связи: подробная информация и факты
Почему NaF не является ковалентным соединением?Чтобы быть ковалентным соединением, разность электроотрицательностей между двумя молекулами должна быть одинаковой или иметь меньшую разность. Таким образом, электронное облако делится между двумя атомами. Электронное облако больше смещено в сторону того атома, у которого электроотрицательность чуть больше, чем у другого атома.
В NaF натрий полностью передает свои электроны атому фтора, поскольку фтор является наиболее электроотрицательным элементом, а натрий — одним из наиболее электроположительных элементов в таблице Менделеева.

Из приведенных выше данных ясно, что NaF является ионным соединением. Кроме того, NaF обладает большей энергией решетки.
Чтобы узнать больше, пожалуйста, прочитайте: 4 примера одинарной ковалентной связи: подробные сведения и факты и молекула». Структура Льюиса, также известная как структура электронных точек, является очень важным термином для предсказания связанных электронов, а также несвязывающих электронов.
Чтобы определить структуру Льюиса любого соединения, необходимо выполнить следующие шаги:
- Вокруг соответствующих атомов показаны валентные электроны. Несвязанные электроны не показаны.
- Атомы должны быть соединены одинарными связями. Если общее количество электронов в любой структуре Льюиса равно «n», а количество одинарных связей равно «N», то остается разместить (n-2N) электронов. Они указывают количество несвязанных электронов.
На следующем изображении показана точечная структура молекулы воды. Кислород имеет всего 8 электронов с 6 валентными электронами.
 Между этими шестью электронами два электрона образуют две сигма-связи с двумя атомами водорода, а остальные четыре электрона показаны на этом рисунке вокруг атома кислорода.
Между этими шестью электронами два электрона образуют две сигма-связи с двумя атомами водорода, а остальные четыре электрона показаны на этом рисунке вокруг атома кислорода.Натрий имеет свой валентный электрон 1, а фтор имеет свой валентный электрон 5. Натрий отдает свой один валентный электрон фтору, и в результате фтор имеет 6 валентных электронов. Итак, у фтора теперь всего 10 и валентных электронов 6. Эти шесть электронов показаны вокруг атома фтора.
Чтобы узнать больше, ознакомьтесь с: Является ли пептидная связь ковалентной: почему, сравнительный анализ и факты
Часто задаваемые вопросы (FAQ) Что происходит, когда фторид натрия реагирует с водой?Ответ: При взаимодействии фторида натрия с водой образуются гидроксид натрия (NaOH) и фтороводород (HF). NaF + H 2 O → NaOH + HF
Растворим ли фторид натрия в воде?Ответ: Фторид натрия — полярное неорганическое соединение, а вода — полярный растворитель.




 22KB
22KB 55KB
55KB 58KB
58KB 67KB
67KB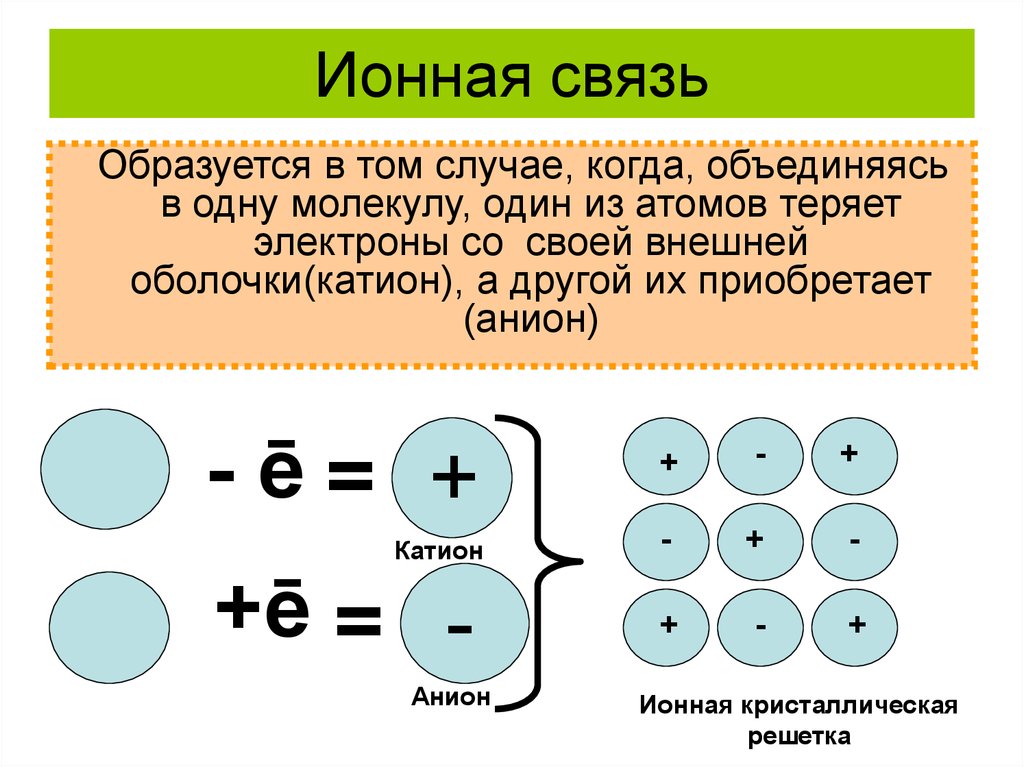 7KB
7KB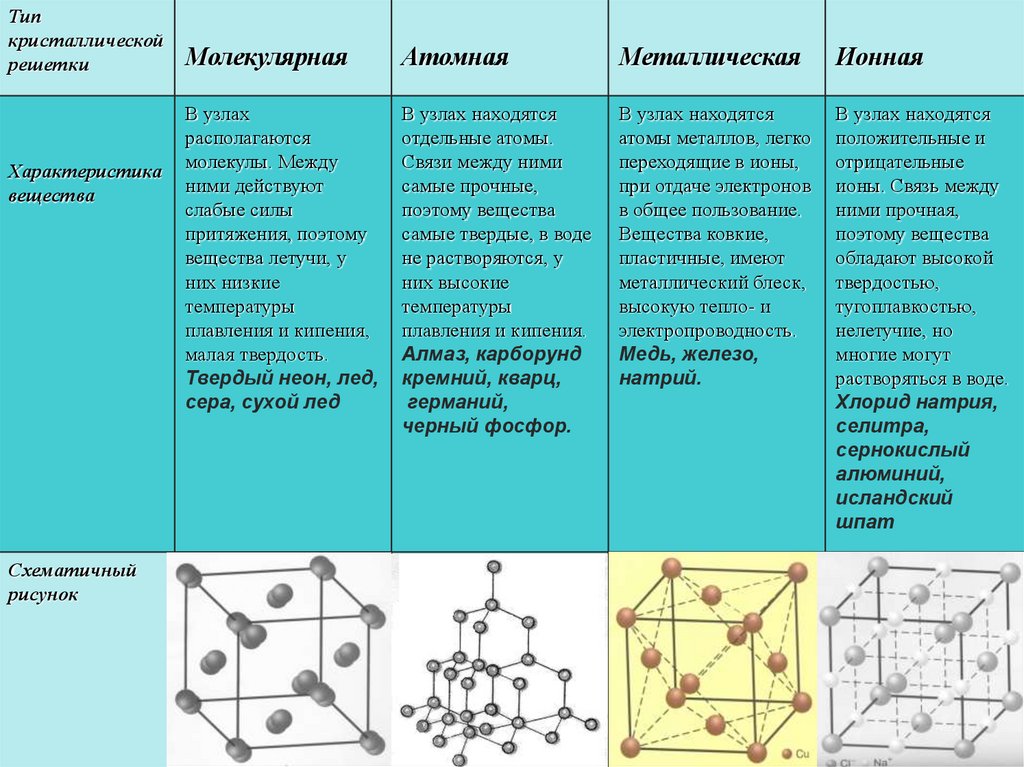 73KB
73KB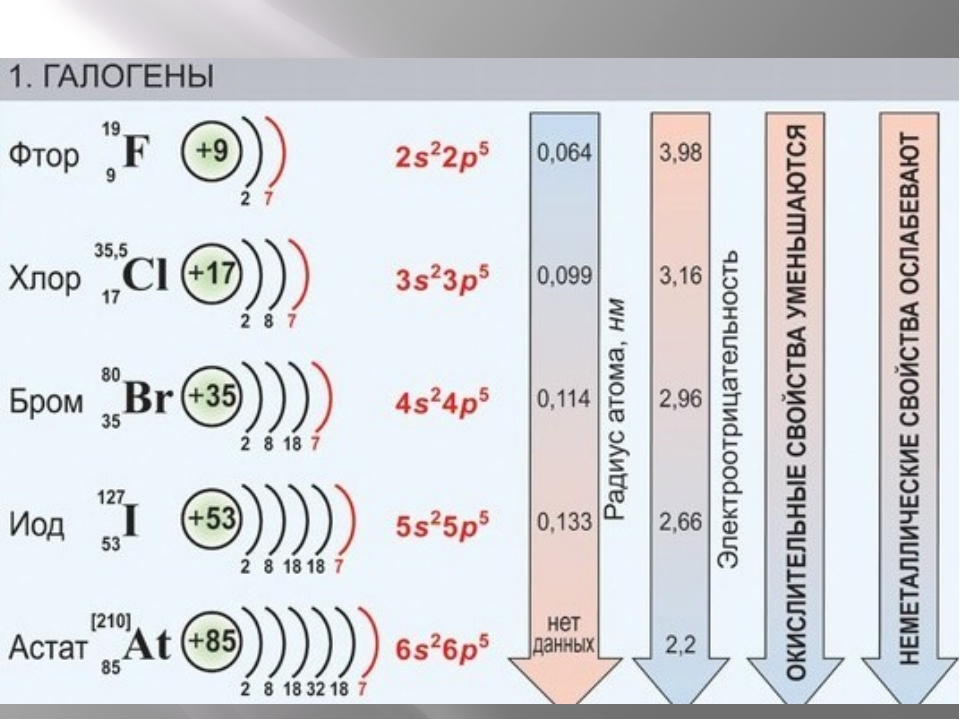 55KB
55KB 36KB
36KB Благодаря этому обмену они оба достигают более стабильной электронной конфигурации.
Благодаря этому обмену они оба достигают более стабильной электронной конфигурации.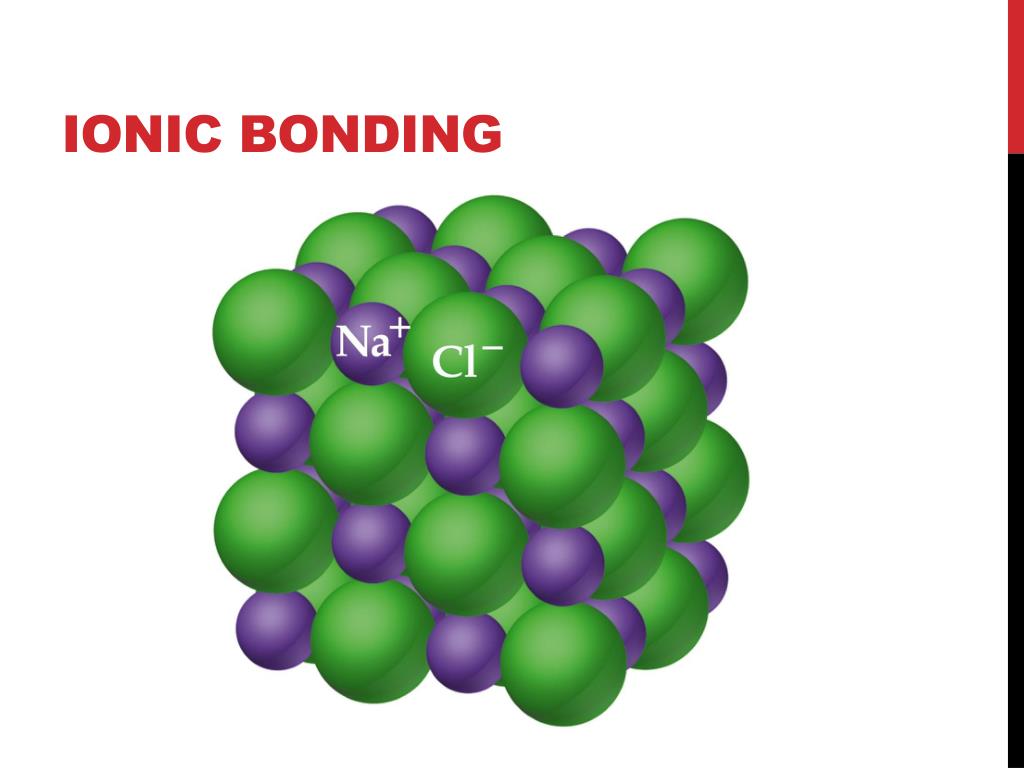


 wiktionary.org/wiki/anion. Лицензия : CC BY-SA: Attribution-ShareAlike
wiktionary.org/wiki/anion. Лицензия : CC BY-SA: Attribution-ShareAlike  Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Born-Haber_Cycle. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/Born-Haber_Cycle. Лицензия : CC BY-SA: Attribution-ShareAlike  Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike
Расположен по адресу : http://www.wikipedia.org. Лицензия : CC BY-SA: Attribution-ShareAlike  wikipedia.org/wiki/IUPAC_nomenclature. Лицензия : CC BY-SA: Attribution-ShareAlike
wikipedia.org/wiki/IUPAC_nomenclature. Лицензия : CC BY-SA: Attribution-ShareAlike  Условия лицензии : Стандартная лицензия YouTube
Условия лицензии : Стандартная лицензия YouTube Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike
Предоставлено : Википедия. Расположен по адресу : http://en.wikipedia.org/wiki/File:NaF.gif. Лицензия : CC BY-SA: Attribution-ShareAlike  3 Написание формул: ионные соединения — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=bvFylpHrJJY. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
3 Написание формул: ионные соединения — YouTube. Расположен по адресу : http://www.youtube.com/watch?v=bvFylpHrJJY. Лицензия : Общественное достояние: нет данных Авторские права . Условия лицензии : Стандартная лицензия YouTube
 Между этими шестью электронами два электрона образуют две сигма-связи с двумя атомами водорода, а остальные четыре электрона показаны на этом рисунке вокруг атома кислорода.
Между этими шестью электронами два электрона образуют две сигма-связи с двумя атомами водорода, а остальные четыре электрона показаны на этом рисунке вокруг атома кислорода.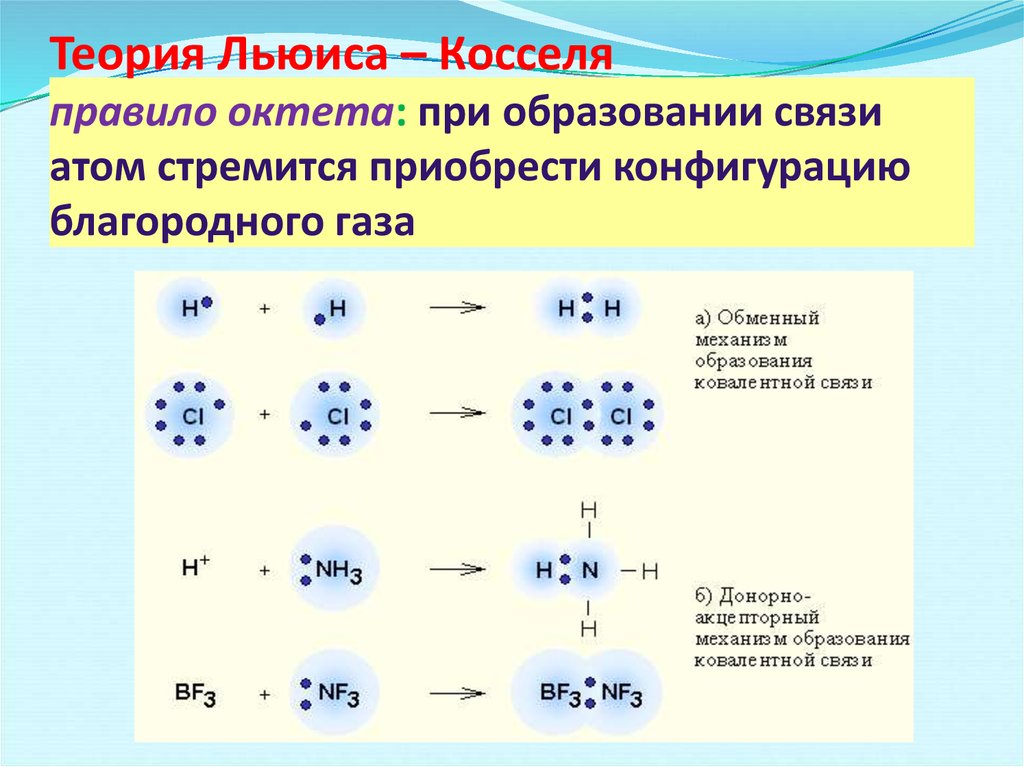
Leave A Comment