что, как сбалансировать и часто задаваемые вопросы —
By Томлешкумар Дешмукх
H2SO4 (Серная кислота) является сильной кислотой и Fe2S3(Железный сульфид) — нестойкий искусственный материал. Сообщите нам некоторые факты о H2SO4 + Fe2S3
Серная кислота также известна как купоросное масло. Это бесцветная вязкая жидкость без запаха. Сульфид железа, состоящий из элементов серы и железа, также известен как сульфид железа (III). Это твердый черный порошок.
В этой статье мы обсудим реакцию между серной кислотой и сульфидом железа, уравновешивание уравнения, титрование и ионное уравнение реакции.
Что является произведением H2SO4 и Fe2S3Сульфат железа и сероводород образуются, когда серная кислота реагирует с сульфидом железа.
3H2SO4 + Fe2S3 = Fe2(ТАК4)3 + 3H2S
Какой тип реакции Н2SO4 + Fe2S3H2SO4 + Fe2S3 это реакция смещения.
Реакция уравновешивается с помощью следующих шагов
H2SO4 + Fe2S3 = Fe2(ТАК4)3 + H2S
- Подсчитывается количество атомов, присутствующих с обеих сторон, которое должно быть одинаковым.
| Сторона реагента | Сторона продукта |
|---|---|
| 2-атом водорода | 2-атом водорода |
| 4-атом кислорода | 12-атом кислорода |
| 4-атом серы | 4-атом серы |
| 2-Атом железа | 2-Атом железа |
- Количество атомов кислорода обеих сторон реакции уравновешивают добавлением коэффициента 3 к молекуле серной кислоты на стороне реагента.

- 3H2SO4 + Fe2S3 = Fe2(ТАК4)3 + H2S
- Количество атомов водорода обеих сторон реакции уравновешивается добавлением коэффициента 3 к молекуле сероводорода на стороне продукта..
- 3H2SO4 + Fe2S3 = Fe2(ТАК4)3 + 3H2S
- Таким образом, сбалансированная химическая реакция
- 3H2SO4 + Fe2S3 = Fe2(ТАК4)3 + 3H2S
H2SO4 + Fe2S3 не подвергать титрованию, так как нет точки эквивалентности.
H2SO4 + Fe2S3 чистое ионное уравнениеЧистое ионное уравнение
3H2+(водн.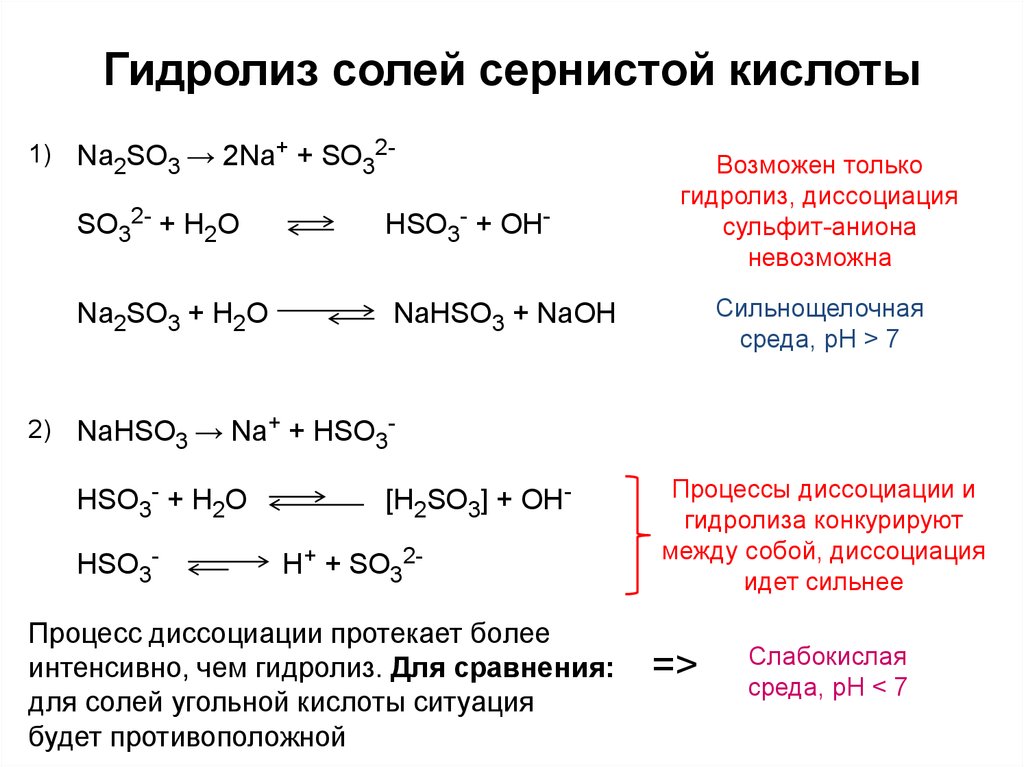 ) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
Чистое ионное уравнение выводится с использованием шагов, упомянутых ниже.
- Сбалансированное уравнение с фазами для H2SO4 + Fe2S3
- 3H2SO4 (водн.) + Fe2S3 (с) = Fe2(ТАК4)3 (водн.) + 3H2С (г)
- Тогда уравнение, записанное в расщеплении соединений
- 3H2+(водн.) + 3SO42- (водн.) + Fe2S3 (с) = 2Fe3+ (водн.) + 3SO42- (водн.) + 3H2С (г)
- Чистое ионное уравнение выглядит следующим образом, удаляя ионы-наблюдатели (ионы, которые одинаковы на стороне реагента и продукта)
- 3H2+(водн.
 ) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
- Сопряженное основание H2SO4 ТАК42-
- Сопряженное основание Fe2S3 S32-
- Водородная связь, диполь-дипольное взаимодействие и дисперсия Ван-дер-Ваальса являются межмолекулярными силами в H2SO4
- Сульфид железа ковалентно связан друг с другом
Энтальпия реакции H2SO4 + Fe2S3 is -103.33 кДж/моль.
| Соединение | Моли | Энтальпия образования, ΔH0f (кДж/моль) |
|---|---|---|
| H2SO4 | 3 | -814 |
| Fe2S3 | 1 | -101. 67 67 |
| Fe2(ТАК4)3 | 1 | -2585.2 |
| H2S | 3 | -20.6 |
- Стандартная энтальпия реакции рассчитывается по следующей формуле:
- & delta; H0ф (реакция) = Σ∆H0ф (продукт) – Σ∆Н0f (реагенты)
- Таким образом, изменение энтальпии = -103.33. кДж/моль
H2SO4 + Fe2S3 реакция не приведет к образованию буферного раствора, потому что серная кислота является сильной кислотой и в буферном растворе может присутствовать только слабая кислота или основание.
Is H2SO4 + Fe2S3 полная реакцияH2SO4 + Fe2S3 является полной реакцией, так как образуются такие продукты, как сульфат железа и сероводород.
H2SO4 + Fe2S3 есть экзотермическая реакция потому что он выделяет тепло в окружающую среду во время реакции.
Is H2SO4 + Fe2S3 окислительно-восстановительная реакцияH2SO4 + Fe2S3 не окислительно-восстановительная реакция потому что нет изменения степени окисления атомов реагента и продукта, участвующих в реакции.
Н2SO4 + Fe2S3 реакция осажденияH2SO4 + Fe2S3 реакция не является реакцией осаждения, так как во время реакции не образуются осадки.
Н2SO4 + Fe2S3 обратимая или необратимая реакцияH2SO4 + Fe2S3 является необратимой реакцией, потому что образующиеся продукты не реагируют с возвратом реагентов в тех же условиях.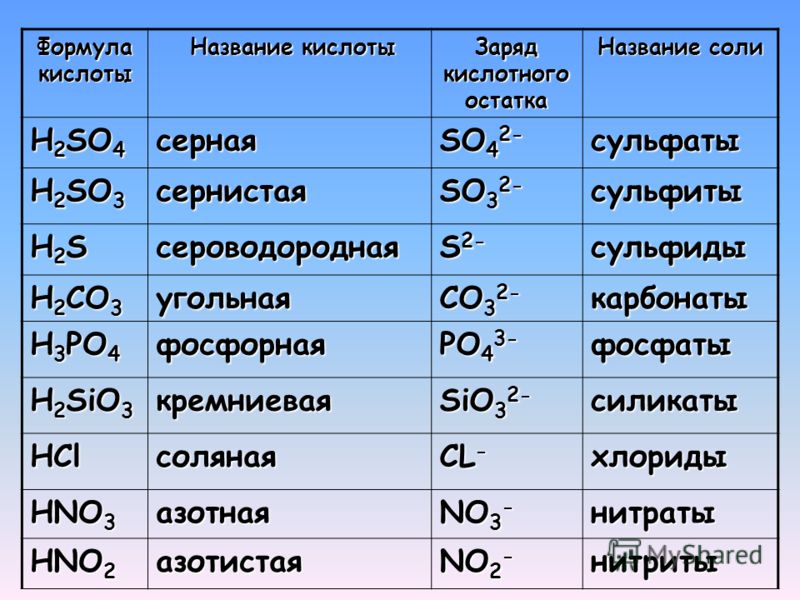
H2SO4 + Fe2S3 представляет собой реакцию двойного замещения, в которой сульфат-ион вытесняется из H2SO4 молекула и ион серы из Fe2S3 молекулы с образованием сульфата железа и сероводорода.
3H2++ 3СО42- + Fe23++ S32- = Fe2 (ТАК4)3 + 3H2S
ЗаключениеСерная кислота реагирует с сульфидом железа и дает сульфат железа и сероводород. Это реакция двойного замещения, и во время реакции не происходит ни окисления, ни восстановления.
Задачи 30, 31 ЕГЭ по химии-2020
Задачи 30 и 31 из реального ЕГЭ по химии-2020, все задачи на окислительно-восстановительные реакции из реального экзамена ЕГЭ по химии, задания 30 и 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.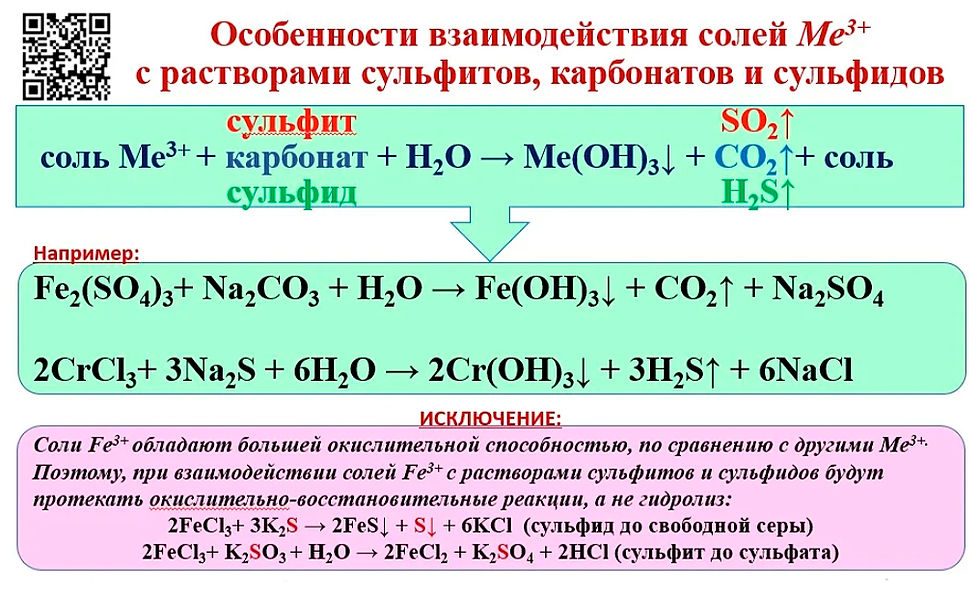
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. Примечания: 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
3. Серная кислота, гидрокарбонат бария, сульфат калия, оксид меди(I), оксид марганца(IV), гидроксид калия.
4. Ацетат бария, гидросульфат натрия, оксид железа(II), пероксид водорода, гидроксид хрома(III), серная кислота.
5. Гидроксид бария, сульфит калия, аммиак, нитрат серебра, перманганат калия, дигидрофосфат калия.
6. Хромат калия, оксид серы(IV), нитрит калия, хлор, ацетат серебра, хлорид кальция.
7.
8. Хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра, хлорид аммония.
9. Перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия.
Перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия.
10. Азотная кислота, гидроксид железа(II), хлорат калия, ацетат серебра, оксид хрома(III), сероводород.
11. Гидроксид стронция, сульфид меди(II), фосфин, азотная кислота, перманганат калия, дигидрофосфат натрия.
12. Азотная кислота, оксид меди(I), сероводород, ацетат аммония, оксид железа(III), оксид хрома(VI).
13. Ацетат бария, нитрит магния, сульфат железа(II), хромат калия, гидроксид меди(II), серная кислота.
14. Пероксид водорода, гидроксид железа(II), перманганат калия, дигидрофосфат магния, серная кислота, гидроксид калия.
15. Перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, йодид калия.
16. Перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария.
Перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария.
17. Перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция.
18. Ацетат аммония, гидроксид натрия, перманганат натрия, соляная кислота, нитрит натрия, оксид марганца(IV).
19.
20. Перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром.
21. Сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария.
22. Серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония.
23. Сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция.
24. Силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония.
25. Нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II).
26. Перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод.
27. Сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния.
28. Оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия.
29.
30. Гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин.
31. Азотная кислота, оксид меди(I), оксид марганца(IV), хлорид железа(III), сера, фторид аммония.
Азотная кислота, оксид меди(I), оксид марганца(IV), хлорид железа(III), сера, фторид аммония.
32. Перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода.
Понравилось это:
Нравится Загрузка…
Выщелачивание сульфида железа (II) серной кислотой
Зеликман А., Вольдман Г., Беляевская Л., Теория гидрометаллургических процессов , Москва: Металлургия, 1983.
Google Scholar
Масленецкий И., Доливо-Добровольский В., Доброхотов Г., Соболь С., Чугаев Л., Беликов В., Автоклавные процессы в цветной металлургии , Москва: Металлургия, 1969
Google Scholar
Dixon, D.G., Mayne, D.D., and Baxter, K.G., Galvanox TM — новая технология атмосферного выщелачивания медного концентрата с гальваническим воздействием, Can.

Артикул Google Scholar
Чопур, М., Озметин, К., Озметин, Э. и Кочакерим, М.М., Исследование оптимизации процесса выщелачивания обожженного концентрата сульфида цинка растворами серной кислоты, Химическая технология и переработка , 2004, том. 43, стр. 1007–1014.
Артикул Google Scholar
Gu, Y., Zhang, T.A., Liu, Y., et al., Кислотное выщелачивание концентрата сульфида цинка под давлением, Trans. Цветные металлы. соц. Китай
Артикул Google Scholar
Русен А., Сункар А.С., Топкая Я. Извлечение цинка и свинца из остатков выщелачивания Чинкур гидрометаллургическим методом, Гидрометаллургия , 2008, вып. 93, стр. 45–50.
Артикул Google Scholar
«>Сантос, С.М.К., Исмаэль, М.Р.К., Коррейя, М.Дж.Н., Рейс, М.Т.А., Дип, А., и Карвалью, Дж.М.Р., Гидрометаллургическая обработка цинкового концентрата методом прямого атмосферного выщелачивания, Proc. Европейский конгресс химической инженерии (ECCE-6), Копенгаген, 2007 г., стр. 1–11.
Google Scholar
Xu, H., Wei, C., et al., Выщелачивание сложной сульфидной силикатсодержащей цинковой руды в растворе серной кислоты под давлением кислорода,
Артикул Google Scholar
«>Rath, P.C., Paramguru, R.K., and Jena, P.K., Кинетика растворения сульфида цинка в водном растворе хлорида железа, Гидрометаллургия , 1981, вып. 6, стр. 219–225.
Артикул Google Scholar
Бобек, Г.Э. и Su, H., Кинетика растворения сфалерита в растворе хлорида железа, Metall. Транс. , 1985, Б 16Б, стр. 413–424.
Артикул Google Scholar
Суни, Дж., Хенейн, Х., Уоррен, Г.В., и Редди, Д., Моделирование кинетики выщелачивания распределения размера концентрата сфалерита в растворе хлорида железа, Гидрометаллургия , 1989, вып.
 22, стр. 25–38.
22, стр. 25–38.Артикул Google Scholar
Джин З.М. и Уоррен, Г.В., Исследование электрохимической природы выщелачивания сфалерита хлоридом железа, Int. Дж. Майнер. Процесс. , 1993, том. 37, стр. 232–238.
Google Scholar
Баба, А.А., Адекола, Ф.А., Месуби, М.А., и Бэйл, Р.Б., Характеристика и выщелачивание минерала сфалерита в некоторых кислых минералах, J. Chem. соц. Нигерия , 2003, том. 28, стр. 40–44.
Google Scholar
Аль-Хараше, М. и Кингман, С., Влияние микроволн на выщелачивание сфалерита в хлориде железа, Chem. англ. Процесс. , 2007, том. 46, стр. 883–888.
Артикул Google Scholar
Казанбаев Л., Козлов П., Кубасов В., Гидрометаллургия цинка, процессы выщелачивания , Москва: Руда и металлы, 2007.

Google Scholar
Мацумото К., Танигучи С. и Кикучи А., J. Japan Inst. Металлы , 1991, вып. 55, стр. 853–859.
Google Scholar
Лохманн Дж. и Педлик М., Кинетика растворения сфалерита в растворе сульфата железа, Hydrometallurgy , 1995, vol. 37, стр. 89–96.
Артикул Google Scholar
Хакл Р.П., Драйзингер Д., Питер Э. и Кинг Дж.А. Пассивация халькопирита во время окислительного выщелачивания в сульфатной среде, Hydrometallurgy , 1995, vol. 39, стр. 25–48.
Артикул Google Scholar
Маркус Х., Фуглеберг С., Валтакари Д., Салми Т., Мурзин Д.Ю. и Лахтинен М., Кинетическое моделирование твердожидкостной реакции: восстановление трехвалентного железа до двухвалентного железа с сульфидом цинка, Химическая инженерия , 2004, т.
 1, с. 59, стр. 919–930.
1, с. 59, стр. 919–930.Артикул Google Scholar
Айдоган С., Арас А., Учар Г., Эрдемоглу М., Кинетика растворения галенита в растворах уксусной кислоты с перекисью водорода, Гидрометаллургия , 2007, вып. 89, стр. 189–195.
Артикул Google Scholar
Сафарзде М.С., Морадхани Д., Ильхи М.О., Гольшан Н.Х. Определение оптимальных условий выщелачивания Cd-Ni остатков из электролитического цинкового завода с использованием статистического планирования экспериментов, J. Технология разделения и очистки , 2008, vol. 58, стр. 367–376.
Артикул Google Scholar
Абрамов А.А. и Авдохин В.М., . Окисление сульфидных минералов в процессе обогащения , Gordon and Breach Science Publishers, Нидерланды, 1997.
Google Scholar
«>Xu, H., Wei, C., Li, C., et al., Сернокислотное выщелачивание цинкосиликатной руды под давлением, Hydrometallurgy , 2010, vol. 105, стр. 186–190.
Артикул Google Scholar
Акчил, А.А., Предварительные исследования кислотного выщелачивания колчеданной медной руды на медном руднике Куре, Турция, Minerals Engineering , 2002, том. 15, стр. 695–699.
Артикул Google Scholar
Антониевич М.М. и Богданович Г.Д. Исследование процесса выщелачивания халькопиритовой руды в кислых растворах // Гидрометаллургия . № . 73, стр.
 245–256.
245–256.Артикул Google Scholar
Антониевич М.М., Янкович З.Д., Димитриевич М.Д., Кинетика растворения халькопирита перекисью водорода в серной кислоте, Гидрометаллургия , 2004, вып. 71, стр. 329–334.
Артикул Google Scholar
Li, C., Wei, C., et al., Окислительное выщелачивание сфалеритового концентрата с высоким содержанием индия и железа в среде серной кислоты, Hydrometallurgy , 2010, vol. 102, стр. 91–94.
Артикул Google Scholar
Бхат, К.Л. и Натараджан К.А., 9 лет0005 Труды Индийского института металлов , 1987, том. 40, стр. 361–371.
Google Scholar
Claassen, J.O., et al., Осаждение железа из растворов, богатых цинком: определение процесса цинкования, Hydrometallurgy , 2002, vol.
 67, стр. 87–108.
67, стр. 87–108.Артикул Google Scholar
Элгерсма, Ф. и др., Кислотное растворение феррита цинка, Гидрометаллургия , 1992, вып. 29, стр. 173–192.
Артикул Google Scholar
Олубамби, П.А., Бороде, Дж.О., и Ндлову, С., Сернокислотное выщелачивание цинка и меди из нигерийской комплексной сульфидной руды в присутствии перекиси водорода, Журнал Южноафриканского института горного дела и металлургии
Google Scholar
Дениз Туран, М., Сонер Алтундоган, Х., и Фикрет Ткмен, Извлечение цинка и свинца из остатков цинкового завода, Гидрометаллургия , 2004, том. 75, стр. 169–176.
Артикул Google Scholar
Моради С. и Монхемиус А.Дж., Смешанные сульфидно-оксидные свинцовые и цинковые руды: проблемы и решения, Минеральное дело , 2011, т. 1, с. 24, стр. 1062–1076.
Артикул Google Scholar
Скачать ссылки
Когда разбавленная серная кислота вступает в реакцию с сульфидом железа, выделяется газ
Если вы видите это сообщение, это означает, что JavaScript отключен в вашем браузере , пожалуйста, включите JS , чтобы это приложение заработало.Получение изображения
Пожалуйста, подождите…
Предыдущий вопросСледующий вопрос
Вопрос:
Ответ:
Связанный ответ
Когда разбавленная серная кислота реагирует с помощью сульфида железа, газовый эволюционирован
. Больше связанных вопросов и ответов
Больше связанных вопросов и ответов
3,0K нравятся
3,0K. Просмотры
1,5K 3.0K Акции
3,0K Like
3,0K Просмотры
1,5K Акции
3,0K Like
3,0K Просмотры
1,5K Акции
3,0K любят
3,0K Views
.5K.0007
3,0K Like
3,0K Просмотры
1,5K Акции
3,0K Like
3,0K Views
1,5K Ар.
3,0K Просмотры
1,5K Акции
3,0K Like
3,0K просмотр
1,5K Акции
3.0K нравятся
3.


 ) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
) + Fe2S3 (с) = 2Fe3+ (водн.) + 3H2С (г)
 22, стр. 25–38.
22, стр. 25–38.
 1, с. 59, стр. 919–930.
1, с. 59, стр. 919–930. 245–256.
245–256. 67, стр. 87–108.
67, стр. 87–108.
Leave A Comment