Тренировочные тесты ЕГЭ по химии Вещества молекулярного и немолекулярного строения. Типы кристаллических решёток. Зависимость свойств веществ от их состава и строения.
1. Молекулярное строение имеет 1) С12 2) СаО 3) ZnCl2 4) NaBr
2. Кристаллическая решетка хлорида кальция 1) металлическая 2) молекулярная 3) ионная 4) атомная
3. Кристаллическая решетка твердого оксида углерода (IV) 1) ионная 2) молекулярная 3) металлическая 4) атомная
4. Молекулярную кристаллическую решетку имеет 1) CaF2 2) СО2 3) SiO2 4) A1F3
5. Немолекулярное строение имеет 1) Н2О 2) H2SO4
6. 1) алмаз 2) азот 3) кремний 4) поваренная соль
7. Немолекулярное строение имеет 1) азот 2) графит 3) аммиак 4) кислород
8. Наибольшую температуру плавления имеет 1) водород 2) кислород 3) оксид углерода (IV) 4) оксид кремния (IV)
9. Ионное строение имеет 1) оксид бора 2) оксид углерода (IV) 3) оксид серы (VI) 4) оксид магния
10. Вещества с металлической кристаллической решеткой 1) хрупкие, легкоплавкие 2) проводят электрический ток, пластичные 3) обладают низкой тепло- и электропроводностью 4) обладают хорошими оптическими свойствами
11. Немолекулярное строение имеет каждое из двух веществ: 1) СО2иСl2 2) Fe и NaCl 3) СО и Mg 4) Na2CO3 и I2 (тв)
12. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную
13. 1) кремний 2) оксид углерода (IV) 3) оксид кремния 4) нитрат аммония
14. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду: 1) хлорид калия, азот, метан 2) иод, диоксид углерода, гелий 3) алюминий, бром, алмаз 4) водород, сульфат магния, оксид железа (Ш)
15. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду: 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V)
16. Молекулярное строение имеет 1) СO2 2) КВг 3) MgSО4 4) SiO2
17. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия
18. 1) малахит 2) бронза 3) кремнезем 4) графит
19. Кристаллическая решетка брома 1) молекулярная 2) металлическая 3) ионная 4) атомная
20. Верны ли следующие суждения о зависимости свойств веществ от особенностей их кристаллической решетки? А. Расплавы веществ с ионной кристаллической решеткой проводят электрический ток. Б. Алмаз и кварц имеют атомную кристаллическую решетку. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
21. Немолекулярное строение имеет
22. 1) СН4 и I2 2) SO, и Н2О 3) Сl2 и NH3 4) LiF и KCl
23. Молекулярное строение имеет каждое из двух веществ: 1) NН4С1 и CH3NH3 2) Na 3) C2H5OH и СН4 4} H2S и CH3COONa
24. Молекулярную кристаллическую решетку имеет 1) фторид кальция 2) бромид алюминия 3) сероводород 4) хлорид меди (П)
25. Молекулярное строение имеет 1) С2Н5ОН 2) А1 3) Fe2(SO4)3 4) КСЮ3
26. Вещества только немолекулярного строения приведены в ряду 1) S8, O2(г), лед 2) Fe, NaCl (тв), алмаз 3) СО2 (г), N2 (г), А1 4) графит, Na2CO3 (тв), I2
27.
28. Кристаллическая решетка хлорида кальция
29.
30. Молекулярную кристаллическую решетку имеет
31.
Ответы: 1-1, 2-3, 3-2, 4-2, 5-3, 6-2, 7-2, 8-4, 9-4, 10-2, 11-2, 12-4, 13-2, 14-2, 15-3, 16-1, 17-4, 18-2, 19-1, 20-3, 21-3, 22-4, 23-3, 24-3, 25-1, 26-2, 27-4, 28-1, 29-2, 30-2, 31-3
|
Решутест. Продвинутый тренажёр тестов
Решутест. Продвинутый тренажёр тестов- Главная
- ЕГЭ
- Химия
- Строение веществ
- Типы кристаллических решеток
Решил заданий
Не решил заданий
Осталось заданий
История решения
8817 — не приступал 6481 — не приступал 7726 — не приступал 7600 — не приступал 3044 — не приступал 2317 — не приступал 3104 — не приступал 4133 — не приступал 3692 — не приступал 9382 — не приступал 5187 — не приступал 7809 — не приступал 8970 — не приступал 4291 — не приступал 6858 — не приступал 9115 — не приступал 7777 — не приступал 7835 — не приступал 9506 — не приступал 7115 — не приступалФормат ответа: цифра или несколько цифр, слово или несколько слов..jpg) Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть Скрыть
№1Молекулярное строение имеет
- сероводород
- сульфат железа (III)
- оксид углерода (IV)
- оксид железа (III)
- графит
Молекулярное строение имеет
- сульфат калия
- водород
- гидроксид натрия
- бром
- ртуть
Молекулярную кристаллическую решетку имеет
- AlF3
- CO2
- HCl
- SiO2
- CaF2
Из предложенного перечня выберите два вещества, которые имеют молекулярное строение.
- CH3CHO
- FeCl3
- C(алмаз)
- C6H6
- С(графит)
Молекулярную кристаллическую решетку имеет соединение
- KCl
- BaO
- СH4
- Li2O
- HBr
Молекулярную кристаллическую решетку имеют
- хлорид бария
- оксид бария
- хлор
- оксид углерода (IV)
- кремний
Атомную кристаллическую решетку имеют
- графит
- кремний
- хлор
- йод
- хлорид калия
Молекулярное строение имеют
- хлороводород
- гидроксид калия
- нитрат бария
- бромоводород
- цинк
Молекулярное строение имеют
- фосфат натрия
- оксид натрия
- фруктоза
- натрий
- метанол
Из предложенного перечня выберите два вещества, для которых характерна молекулярная кристаллическая решетка.
- этанол
- графит
- хлорид натрия
- озон
- диоксид кремния
Из предложенного перечня выберите два вещества, для которых характерна летучесть, легкоплавкость.
- озон
- калия
- ацетат натрия
- перхлорат кальция
- белый фосфор
Молекулярное строение имеет
- O2
- NaBr
- CaO
- ZnCl2
- Cl2
Из предложенного перечня выберите два вещества, для которых характерна молекулярная кристаллическая решетка
- бром
- кремний
- ацетат калия
- оксид магния
- этанол
Молекулярная кристаллическая решетка характерна для
1. водород
2. сульфат магния
3. оксид железа (III)
4. иод
5. алюминий
алюминий
Ионную кристаллическую решетку имеют
- кальций
- оксид кальция
- карбонат кальция
- оксид фосфора (V)
- натрий
Молекулярную кристаллическую решетку имеет
- нитрат аммония
- оксид углерода (IV)
- оксид кремния
- оксид углерода (II)
- кремний
К веществам с атомной кристаллической решеткой относятся
- свинец
- азотная кислота
- оксид магния
- бор
- алмаз
Веществу с ионным типом связи отвечает формула
- CaS
- HCl
- RbF
- SiF4
- SO3
Из предложенного перечня выберите два вещества, для которых характерна молекулярная кристаллическая решетка
- анилин
- бертолетова соль
- каустическая сода
- кальций
- азот
Молекулярное строение имеют
- CH3OCH3
- CCl4
- CH3COONH4
- C2H5ONa
- NH4Cl
Так твой прогресс будет сохраняться.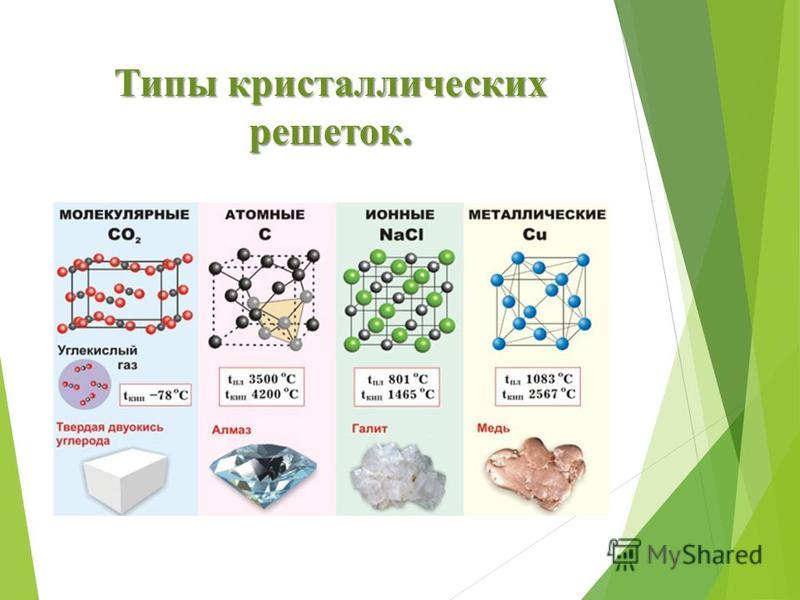
Регистрация
Мы отправили код на:
ИзменитьПолучить код повторно через 00:00
Я прочитал(-а) Политику конфиденциальности и согласен(-на) с правилами использования моих персональных данных
Ништяк!
Решено верно
Браво!
Решено верно
Крутяк!
Решено верно
Зачёт!
Решено верно
Чётко!
Решено верно
Бомбезно!
Решено верно
Огонь!
Решено верно
Юхууу!
Решено верно
Отпад!
Решено верно
Шикарно!
Решено верно
Блестяще!
Решено верно
Волшебно!
Решено верно
Сульфат натрия — CreationWiki, энциклопедия науки о сотворении
| Сульфат натрия | ||
|---|---|---|
| Общие | ||
| Систематическое название | Сульфат натрия | |
| Другие наименования | Тенардит (минерал) Mirabilte (декагидрат) Sal mirabilis (декагидрат) Глазуберова соль (декагидрат) | |
| Молекулярная формула | На 2 ТАК 4 | |
| УЛЫБКИ | [Na+]. [Na+].[O-]S([O-])(=O)=O [Na+].[O-]S([O-])(=O)=O | |
| Молярная масса | [[Молярная масса::142,04 г/моль (безводный) 322,20 г/моль (декагидрат)]] | |
| Внешний вид | белое кристаллическое твердое вещество, гигроскопичное | |
| Номер CAS | номер КАС::7727-73-3 | |
| Недвижимость | ||
| Плотность | [[Плотность::2,664 г/см 3 (безводный) 1,464 г/см 3 (декагидрат) ]] | |
| Растворимость в воде | 47,6 г/л (0°C) этанол | |
| Температура плавления | [[Точка плавления::884°C (безводный) 32,4°C (декагидрат)]] | |
| Температура кипения | Точка кипения::1429°C (безводный) | |
| Структура | ||
| Кристаллическая структура | орторомбическая или шестиугольная (безводная) моноклинный (декагидрат) | |
| Опасности | ||
| Паспорт безопасности | Паспорт безопасности материала | |
| Основные опасности | Раздражитель | |
| NFPA 704 | 2 | |
| Температура вспышки | негорючий | |
| Родственные соединения | ||
| Прочие анионы | Селенат натрия Теллурат натрия | |
| Прочие катионы | Сульфат лития Сульфат калия Сульфат рубидия Сульфат цезия | |
| Родственные соединения | Бисульфат натрия Сульфит натрия Персульфат натрия | |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) Отказ от ответственности и ссылки | ||
Сульфат натрия представляет собой натриевую соль формулы Na 2 SO 4 .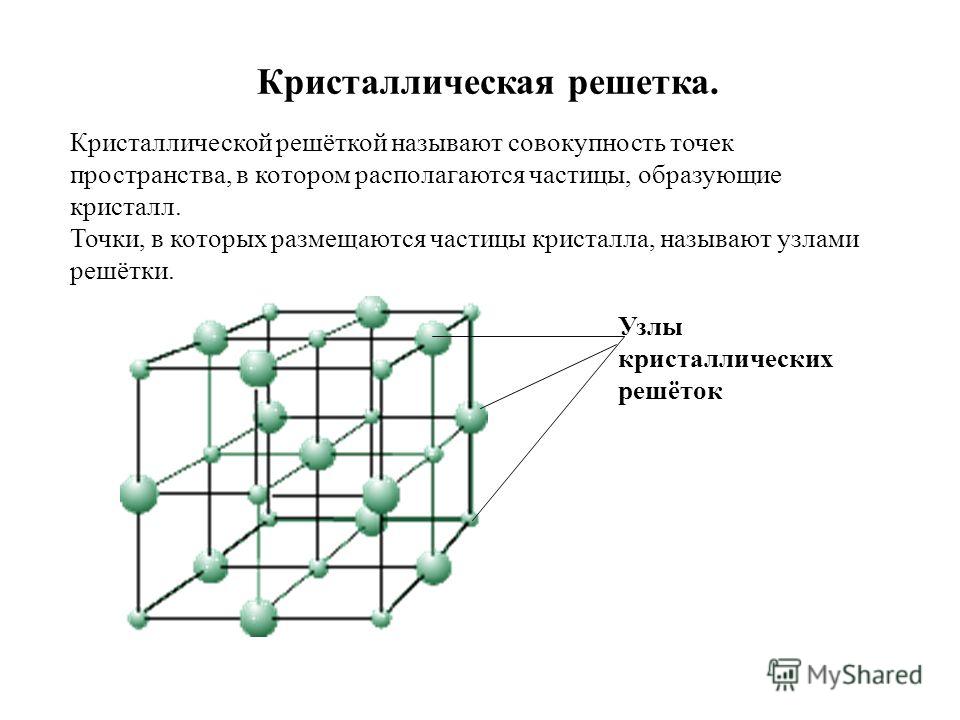 Она известна как глауберова соль, названная в честь немецкого химика Иоганна Рудольфа Глаубера (1604-1670), открывшего ее в 1625 году. Когда он ее открыл, он назвал ее чудотворной солью. Он появляется в виде безводной, декагидратной и гептагидратной форм. Сульфат натрия в безводном виде представляет собой белое кристаллическое твердое вещество. Когда он выглядит как декагидрат, он имеет формулу Na 2 SO 4 · 10H 2 O. При охлаждении он выглядит как гептагидрат. Обычно он остается стабильным. Сульфат натрия может быть получен естественным или химическим путем. Когда он производится естественным путем, его обычно можно найти в Большом Соленом озере. Когда он производится химическим путем, он обычно вступает в реакцию с другими химическими веществами. Сульфат натрия обычно используется для изготовления моющих средств, текстиля, аккумуляторов тепла и т.д. [1]
Она известна как глауберова соль, названная в честь немецкого химика Иоганна Рудольфа Глаубера (1604-1670), открывшего ее в 1625 году. Когда он ее открыл, он назвал ее чудотворной солью. Он появляется в виде безводной, декагидратной и гептагидратной форм. Сульфат натрия в безводном виде представляет собой белое кристаллическое твердое вещество. Когда он выглядит как декагидрат, он имеет формулу Na 2 SO 4 · 10H 2 O. При охлаждении он выглядит как гептагидрат. Обычно он остается стабильным. Сульфат натрия может быть получен естественным или химическим путем. Когда он производится естественным путем, его обычно можно найти в Большом Соленом озере. Когда он производится химическим путем, он обычно вступает в реакцию с другими химическими веществами. Сульфат натрия обычно используется для изготовления моющих средств, текстиля, аккумуляторов тепла и т.д. [1]
Содержание
- 1 Свойства
- 2 события
- 3 История
- 4 варианта использования
- 5 Различные названия сульфата натрия
- 6 Безопасность
- 7 Видео
- 8 Каталожные номера
Свойства
Образец сульфата натрия
Сульфат натрия имеет плотность 2,664 г/см3 (безводный) и 1,464 г/см3 (декагидрат). Его температуры плавления составляют 884°C (безводный) и 32,4°C (декагидрат). Температура кипения сульфата натрия 1429.°С (безводный). Он негорюч и выглядит как белое кристаллическое твердое вещество. Сульфат натрия обычно остается стабильным. Даже если его нагреть, он не разлагается. При нормальных температурах сульфат натрия не реагирует с восстановителями и окислителями. Сульфат натрия может превратиться в сульфид натрия при повышении температуры. При растворении в воде сульфат натрия представляет собой нейтральную соль с pH 7. Причина в том, что сульфат натрия образуется из сильного основания (гидроксида натрия) и сильной кислоты (серной кислоты).
Его температуры плавления составляют 884°C (безводный) и 32,4°C (декагидрат). Температура кипения сульфата натрия 1429.°С (безводный). Он негорюч и выглядит как белое кристаллическое твердое вещество. Сульфат натрия обычно остается стабильным. Даже если его нагреть, он не разлагается. При нормальных температурах сульфат натрия не реагирует с восстановителями и окислителями. Сульфат натрия может превратиться в сульфид натрия при повышении температуры. При растворении в воде сульфат натрия представляет собой нейтральную соль с pH 7. Причина в том, что сульфат натрия образуется из сильного основания (гидроксида натрия) и сильной кислоты (серной кислоты).
Сульфат натрия может реагировать с серной кислотой в водном растворе:
Na 2 SO 4 (водн.) + H 2 SO 4 (водн.) —> 2 NaHSO 4 (водн.)
Na 2 SO 4 считается типичным ионным сульфатом, поскольку он содержит ионы Na+ и ионы SO 4 2-.
Осадки могут быть получены водными растворами с комбинацией солей бария или свинца:
Na 2 SO 4 (водн.) + BaCl 2 (водн.) —> 2 NaCl(водн.) + BaSO 4 (тв.)
В отличие от других соединений сульфат натрия обладает особыми характеристиками растворимости в воде. Если в сульфат натрия добавить хлорид, растворимость будет ниже. Люди могут объяснить необычные свойства сульфата натрия гидратацией. Причина в том, что 32,4 ° C соответствует температуре, при которой глауберова соль превращается в безводную твердую фазу и сульфатную жидкую фазу. [2] При повышении температуры резко возрастает и растворимость сульфата натрия. Однако растворимость начнет медленно снижаться после достижения определенной температуры, которая составляет около 33°C. Декагидратные кристаллы дают безводную соль, разлагаясь при температуре около 33°C. Влага из воздуха быстро поглощается безводной солью, образуя декагидратные кристаллы высолов. [3]
[3]
Из-за сходных свойств сульфат натрия часто заменяют другими соединениями. Сульфат натрия можно заменить гидроксидом натрия (едким натром) и эмульгированной серой для производства бумаги. Его также можно заменить сульфатом кальция и кальцинированной содой для производства стекла. [4]
Возникновение
Большая часть сульфата натрия находится в Большом Соленом озере
Сульфат натрия можно получить естественным и химическим путем. Около 400 миллионов тонн сульфата натрия (12%) находится в Соединенных Штатах Америки. Китай производит больше всего сульфата натрия. Ожидается, что к 2013 году одна производственная компания будет производить более 4,8 млн метрических тонн. Несмотря на то, что большая часть сульфата натрия производится в Китае, он также производится во многих других странах. Некоторое количество сульфата натрия образуется как побочный продукт. Сульфат натрия, полученный химическим и естественным путем, способен обмениваться с другим. [4]
[4]
Натуральное производство
В Соединенных Штатах две компании обычно извлекают природный сульфат натрия из растений в Техасе и Калифорнии. Люди могут извлекать сульфат натрия из соленых вод озера Сирлс в Калифорнии. Сумма оценивается примерно в 450 миллионов метрических тонн. 12% сульфата натрия находится в Большом Соленом озере штата Юта. Это количество может перевести сульфат натрия в 400 миллионов тонн. Вашингтон, Невада и Вайоминг также являются штатами, в которых есть природный сульфат натрия. Не только в Соединенных Штатах, но и в других странах есть природный сульфат натрия. Эти страны: Мексика, Канада, Испания, Турция, Китай, Италия, Египет, Южная Африка и Румыния. Вот почему Соединенные Штаты импортируют сульфат натрия из других стран. [5]
Химически произведенный
В то время как половина сульфата натрия в мире содержится в естественной среде, другая половина обычно производится химическим путем. Есть несколько процессов, которые могут производить сульфат натрия.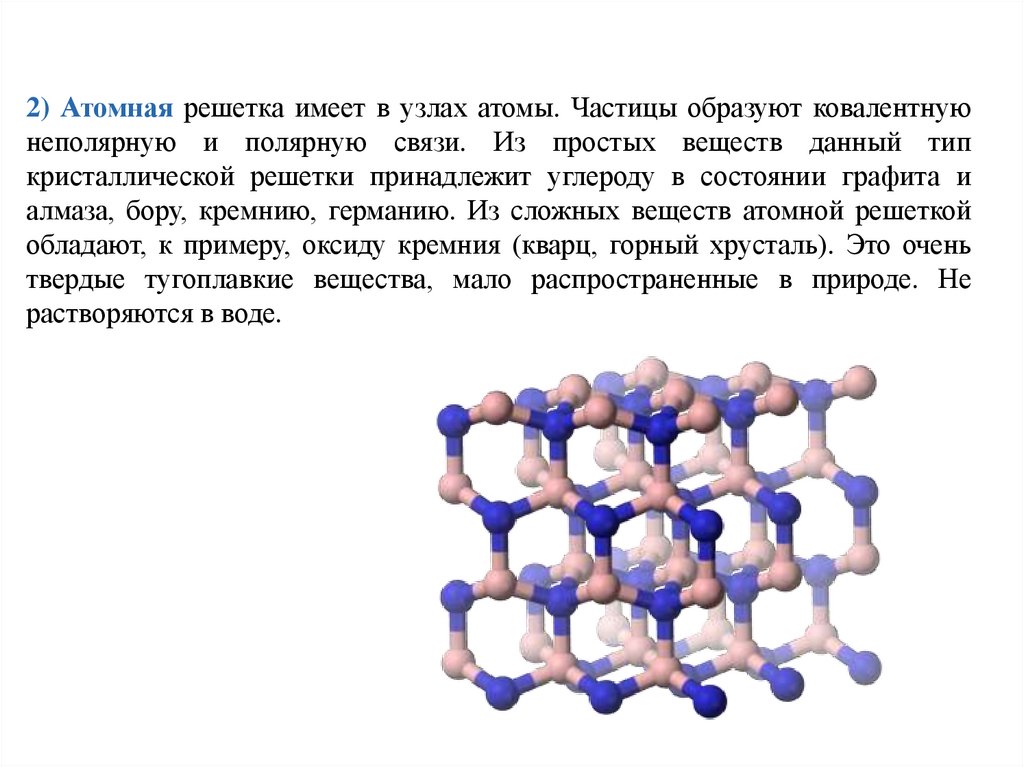 Обычно он является побочным продуктом других процессов. [2] Одним из важнейших химических производств сульфата натрия является производство соляной кислоты. В процессе Мангейма сульфат натрия создается либо из серной кислоты, либо из хлорида натрия. Кроме того, он может быть получен методом Харгривза с диоксидом серы. Сульфат натрия, полученный в результате этих процессов, называется 9.0295 солонка .
Обычно он является побочным продуктом других процессов. [2] Одним из важнейших химических производств сульфата натрия является производство соляной кислоты. В процессе Мангейма сульфат натрия создается либо из серной кислоты, либо из хлорида натрия. Кроме того, он может быть получен методом Харгривза с диоксидом серы. Сульфат натрия, полученный в результате этих процессов, называется 9.0295 солонка .
- Маннхейм Процесс:
2 NaCl + H 2 SO 4 → 2 HCL + NA 2 SO 4
- . O 2 + 2 H 2 O → 4 HCl + 2 Na 2 SO 4
Процесс нейтрализации избытка серной кислоты гидроксидом натрия является следующим основным процессом сульфата натрия. Этот процесс обычно применяется и удобен для лабораторной подготовки.
2 NaOH(водн.) + H 2 SO 4 (водн.) → Na 2 SO 4 (водн.) + 2 H 2 O(л)
При добавлении серной кислоты к раствору хромата натрия образуется дихромат натрия.
 Сульфат натрия также образуется из дихромата натрия. Затем снова сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1]
Сульфат натрия также образуется из дихромата натрия. Затем снова сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1] История
Изображение Глаубера
Сульфат натрия также называют глауберовой солью. Аптекарь и немецкий химик по имени Иоганн Рудольф Глаубер (1604-1670) обнаружил сульфат натрия в 1625 году в австрийской родниковой воде. Когда он впервые обнаружил ее, он назвал ее sal mirabilis, что означает «волшебная соль». Он назвал его потому, что он обладает целебными свойствами. Кристаллы этой соли использовались в качестве слабительного. В 18 веке люди начали использовать сульфат натрия для промышленного производства карбоната натрия. [6]
Применение
Сульфат натрия используется в моющих средствах
Примерно в 1995 году люди в Соединенных Штатах Америки продавали сульфат натрия примерно по 70 долларов за тонну.
 Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него изготавливают моющие средства, мыло, стаканы, теплоаккумуляторы и др.
Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него изготавливают моющие средства, мыло, стаканы, теплоаккумуляторы и др.Моющее средство и мыло
Так как сульфат натрия настолько дешев, люди начали использовать его для производства моющих средств и мыла. Вероятно, люди используют сульфат натрия в основном в качестве наполнителя в порошкообразных стиральных порошках для домашнего белья. В Европе общее потребление Na 2 SO 4 составил около 1,6 млн тонн. 80% было использовано в качестве моющих средств. [2] Причина, по которой люди использовали сульфат натрия в моющих средствах для домашнего белья, заключается в белизне сульфата натрия. Однако примерно в конце 1980-х люди начали использовать жидкие моющие средства и суперконцентраты. Этот факт очень важен, поскольку жидкие моющие средства не требуют сульфата натрия.
 [6]
[6] Стекло
Сульфат натрия используется не только в моющих средствах и мыле, но и в стекольной промышленности. Стекольная промышленность США использует около 30 000 тонн. Сульфат натрия используется для удаления мелких пузырьков воздуха из расплавленного стекла. Это называется «осветлитель». Он также предотвращает образование накипи и делает стекло флюсовым. В стекольной промышленности также говорят, что стекло создается путем смешивания в основном сульфата натрия, смеси песка и карбоната натрия. [6]
Аккумулятор тепла
Люди использовали глауберову соль, декагидрат, как слабительное. Люди также начали использовать его для хранения тепла в системах пассивного солнечного отопления. Это действительно полезно для людей, так как дает выгоду от высокой теплоты кристаллизации (78,2 кДж/моль). Также это дает преимущество необычных свойств растворимости.
Прочие
В Японии натрий широко используется для производства текстиля.
 Это помогает уменьшить отрицательные заряды пятерок и способствует равномерному проникновению красителей. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали. Другими областями применения сульфата натрия могут быть глазурь на окнах, освежители ковров, добавка к корму для крупного рогатого скота и производство крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного осушителя органического вещества. [2]
Это помогает уменьшить отрицательные заряды пятерок и способствует равномерному проникновению красителей. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали. Другими областями применения сульфата натрия могут быть глазурь на окнах, освежители ковров, добавка к корму для крупного рогатого скота и производство крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного осушителя органического вещества. [2] Различные названия сульфата натрия
- Мирабилит (декагидрат)
- Моносульфат натрия
- Серная кислота, Натриевая соль
- Сульфат динатрия
- Серная кислота, динатриевая соль
- Натрийсульфат
- Тенардит (минерал)
- Глауберова соль (декагидрат)
- Sal mirabilis (декагидрат)
- Трона
- Солёный пирог
- Бинатрия сульфат [4]
Безопасность
Поскольку сульфат натрия является соединением, люди должны знать факты о безопасности сульфата натрия.
 Людям приходится помещать сульфат натрия в закрытый контейнер. Они также должны отделить его от несовместимых веществ. Примерами являются сильные кислоты, магний и алюминий. Ожидается, что сульфат натрия не представляет опасности для здоровья, когда люди прикасаются к своей коже. Он может иметь легкую токсичность из-за приема внутрь. Это может вызвать понос, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмотической активности. Люди не должны бросать это себе в глаза. Если люди коснутся его кожей, они должны смыть его водой с мылом. Если он попадет им в глаза, они должны смыть его проточной водой. Людям следует принимать лекарства, если они видят раздражение. Наконец, если люди случайно съедят его, им следует выпить много стаканов воды. [3]
Людям приходится помещать сульфат натрия в закрытый контейнер. Они также должны отделить его от несовместимых веществ. Примерами являются сильные кислоты, магний и алюминий. Ожидается, что сульфат натрия не представляет опасности для здоровья, когда люди прикасаются к своей коже. Он может иметь легкую токсичность из-за приема внутрь. Это может вызвать понос, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмотической активности. Люди не должны бросать это себе в глаза. Если люди коснутся его кожей, они должны смыть его водой с мылом. Если он попадет им в глаза, они должны смыть его проточной водой. Людям следует принимать лекарства, если они видят раздражение. Наконец, если люди случайно съедят его, им следует выпить много стаканов воды. [3] Видео
Ссылки
- ↑ 1.0 1.1 Сульфат натрия Википедия.

- ↑ 2,0 2,1 2,2 2,3 Сульфат натрия Ганс Лонингер, Википедия.
- ↑ 3,0 3,1 Натрия сульфат декагидрат этакуд
- ↑ 4,0 4,1 4,2 Зона минералов сульфата натрия
- ↑ Институт информации о минералах сульфата натрия, Eoearth, 20 января 2008 г.
- ↑ 6,0 6,1 6,2 Сульфат натрия Tititudorancea
- ↑ [1] Cristallerie, Youtube, 18 марта 2008 г.
CreationWiki, энциклопедия науки о сотворении
Этанол Общие Систематическое название Этанол Другие наименования Этиловый спирт, зерновой спирт Молекулярная формула С 2 Н 6 О УЛЫБКИ ССО Молярная масса Молярная масса::46,06844 г/моль Внешний вид Прозрачная жидкость без запаха Номер CAS номер КАС::64-17-5 Недвижимость Плотность и фаза Плотность::.  8 г/м³, жидкость
8 г/м³, жидкостьРастворимость в воде Незначительный Температура плавления Температура плавления::-114°C Температура кипения Точка кипения::78°C Кислотность (p K a ) 16 Основность (p K b ) -1,9 Вязкость 0,0012 Па·с при 20°C Структура Молекулярная форма Четырехгранный и изогнутый Дипольный момент 1.69Д Опасности Паспорт безопасности [1] Основные опасности Легковоспламеняющийся NFPA 704 3
2
1
Температура вспышки 14°С Заявление R/S Р: Р11
С:С2,С7,С16Номер РТЭКС КК6300000 Родственные соединения Родственные соединения этанол
этилен
ацетонЕсли не указано иное, данные приведены для материалов
в их стандартном состоянии (при 25 °C, 100 кПа)
Отказ от ответственности и ссылкиЭтанол представляет собой органический спирт, который в основном используется в качестве топлива или в алкогольных напитках.
 Он также широко известен как этиловый спирт или зерновой спирт. Этанол легко воспламеняется, имеет прозрачный вид и не имеет запаха. Он имеет молекулярную формулу C 2 H 6 O и представляет собой растворенное вещество, которое хорошо сочетается с другими элементами, а также с другими соединениями. Этанол образуется из 95-процентного спирта и 5-процентной воды. Эти соединения естественным образом получают из сахаров и дрожжей и могут производить многие другие виды этанола путем перегонки. Этанол может быть вредным в некоторых случаях, но в наши дни это отличное растворяющее вещество, в котором нуждаются люди. [1]
Он также широко известен как этиловый спирт или зерновой спирт. Этанол легко воспламеняется, имеет прозрачный вид и не имеет запаха. Он имеет молекулярную формулу C 2 H 6 O и представляет собой растворенное вещество, которое хорошо сочетается с другими элементами, а также с другими соединениями. Этанол образуется из 95-процентного спирта и 5-процентной воды. Эти соединения естественным образом получают из сахаров и дрожжей и могут производить многие другие виды этанола путем перегонки. Этанол может быть вредным в некоторых случаях, но в наши дни это отличное растворяющее вещество, в котором нуждаются люди. [1] Содержание
- 1 Свойства
- 2 Синтез
- 3 варианта использования
- 3.1 Топливо
- 3.2 Алкогольные напитки и другие виды использования
- 3.3 Химическое производство
- 4 История этанола
- 5 Видео
- 6 Каталожные номера
Свойства
Этанол, часто называемый этиловым спиртом, используется в качестве первичного спирта и состоит в основном из воды и спирта.
 Этанол состоит из 5 процентов воды и 95-процентный спирт. Когда этанол не содержит воды и содержит 100% спирта, его называют абсолютным этанолом. [1] Этанол имеет низкую температуру кипения 78 градусов Цельсия и температуру плавления -114 градусов Цельсия. Это летучая бесцветная жидкость с жгучим вкусом и спиртовым приятным запахом. Этанол имеет плотность 0,789 г/мл, что легче воды. [2] Химические свойства этанола определяются элементом этена, известным как C2h5. Этанол становится бледно-голубым, когда они сгорают, и они образуют воду и углекислый газ. [1] Этанол не может быть полностью получен простой перегонкой. Хотя в процессе соединения бензола с этанолом может образовываться абсолютный этанол, этот процесс может быть ядовитым из-за остатков бензола. [3]
Этанол состоит из 5 процентов воды и 95-процентный спирт. Когда этанол не содержит воды и содержит 100% спирта, его называют абсолютным этанолом. [1] Этанол имеет низкую температуру кипения 78 градусов Цельсия и температуру плавления -114 градусов Цельсия. Это летучая бесцветная жидкость с жгучим вкусом и спиртовым приятным запахом. Этанол имеет плотность 0,789 г/мл, что легче воды. [2] Химические свойства этанола определяются элементом этена, известным как C2h5. Этанол становится бледно-голубым, когда они сгорают, и они образуют воду и углекислый газ. [1] Этанол не может быть полностью получен простой перегонкой. Хотя в процессе соединения бензола с этанолом может образовываться абсолютный этанол, этот процесс может быть ядовитым из-за остатков бензола. [3] Синтез
Мельничная обработка сахарного тростника Производство этанола
Этанол представляет собой природное соединение, получаемое в результате ферментации сахаров дрожжами.
 [4] В США Этанол производится в основном из кукурузы. Производится мокрым или сухим способом. Измельчение перерабатывает урожай и ферментирует его в этанол с мукой или расщепляет белок и крахмал в кукурузе для получения этанола. Эти явления основаны на сахаре и крахмале. Хотя это обычно не производится, этанол также имеет целлюлозное сырье, которое не должно использоваться ни в какой культуре, а вместо этого используется древесина для производства этанола. Есть два способа получения этанола из целлюлозы: термохимический и биохимический. Оба этих способа требуют дерева или травы для производства этанола. Производство целлюлозы является более сложным, чем производство на основе крахмала и сахара. [5]
[4] В США Этанол производится в основном из кукурузы. Производится мокрым или сухим способом. Измельчение перерабатывает урожай и ферментирует его в этанол с мукой или расщепляет белок и крахмал в кукурузе для получения этанола. Эти явления основаны на сахаре и крахмале. Хотя это обычно не производится, этанол также имеет целлюлозное сырье, которое не должно использоваться ни в какой культуре, а вместо этого используется древесина для производства этанола. Есть два способа получения этанола из целлюлозы: термохимический и биохимический. Оба этих способа требуют дерева или травы для производства этанола. Производство целлюлозы является более сложным, чем производство на основе крахмала и сахара. [5] Применение
Этанол Топливо
Топливо
Этанол может быть полезен для многих целей. Большинство соединений этанола используются в качестве топлива или алкогольных напитков. Этаноловое топливо может быть еще одним источником моторного топлива и бензина.
 Можно с другими видами топлива служить бензином. Есть автомобили, которые полностью работают на этаноле или смеси этанола. [6] Некоторые автомобили с гибким топливом могут полностью работать на смеси бензина и гидратированного этанола, если в бензине содержится не менее 20 % этанола. Этанол полезен тем, что его можно смешивать с водой и другими растворителями. Есть также много типов этанола, таких как безводный этанол, который является 95% этанола и 5% воды, которые можно смешивать с водой и помогать окружающей среде, уменьшая загрязнение воздуха. Не только в США они используют этанол в качестве топлива, но и в Бразилии этанол смешивают с бензином, поскольку они способны работать на соединениях, смешанных с этанолом и водой, а также на гидратированном этаноле. В Бразилии этанол в основном производится из сахарных культур, а в Соединенных Штатах этанол в основном производится из кукурузы. [7]
Можно с другими видами топлива служить бензином. Есть автомобили, которые полностью работают на этаноле или смеси этанола. [6] Некоторые автомобили с гибким топливом могут полностью работать на смеси бензина и гидратированного этанола, если в бензине содержится не менее 20 % этанола. Этанол полезен тем, что его можно смешивать с водой и другими растворителями. Есть также много типов этанола, таких как безводный этанол, который является 95% этанола и 5% воды, которые можно смешивать с водой и помогать окружающей среде, уменьшая загрязнение воздуха. Не только в США они используют этанол в качестве топлива, но и в Бразилии этанол смешивают с бензином, поскольку они способны работать на соединениях, смешанных с этанолом и водой, а также на гидратированном этаноле. В Бразилии этанол в основном производится из сахарных культур, а в Соединенных Штатах этанол в основном производится из кукурузы. [7] Алкогольные напитки и другие виды применения
Другим основным применением этанола является потребление людьми алкогольных напитков.
 Этаноловый спирт часто называют этиловым или зерновым спиртом. Этаноловый спирт также используется в парфюмерии, одеколоне, лаке для волос или в медицинских целях. [8] Этанол также широко используется в фармацевтике. Например, леденцы от кашля и растворы йода. Этанол снова является очень полезным соединением, потому что он является растворителем и может смешиваться с другими различными элементами. Поэтому многие фармацевты могут использовать этанол для изготовления таблеток, пилюль, витаминов и антибиотиков. Этаноловый спирт также используется во многих бытовых чистящих средствах, бутылка с дезинфицирующим спреем содержит более половины этанола для очистки объектов. Также этанол может использоваться в таких веществах, как краски и лаки, а иногда даже в пищевых продуктах, которые мы потребляем, таких как ароматизаторы, экстракты и глазури. [9]
Этаноловый спирт часто называют этиловым или зерновым спиртом. Этаноловый спирт также используется в парфюмерии, одеколоне, лаке для волос или в медицинских целях. [8] Этанол также широко используется в фармацевтике. Например, леденцы от кашля и растворы йода. Этанол снова является очень полезным соединением, потому что он является растворителем и может смешиваться с другими различными элементами. Поэтому многие фармацевты могут использовать этанол для изготовления таблеток, пилюль, витаминов и антибиотиков. Этаноловый спирт также используется во многих бытовых чистящих средствах, бутылка с дезинфицирующим спреем содержит более половины этанола для очистки объектов. Также этанол может использоваться в таких веществах, как краски и лаки, а иногда даже в пищевых продуктах, которые мы потребляем, таких как ароматизаторы, экстракты и глазури. [9] Химическое производство
Этанол можно превратить в два химических соединения при его окислении. С дихроматом натрия, дихроматом калия и перманганатом калия этанол может образовывать ацетальдегид (или этаналь).
 Если этаналь будет обнаружен в дальнейшем, его также можно будет найти в виде этановой кислоты, которую также обычно называют уксусной кислотой. [1]
Если этаналь будет обнаружен в дальнейшем, его также можно будет найти в виде этановой кислоты, которую также обычно называют уксусной кислотой. [1] Этанол как соединение может быть очень полезным химическим веществом. [4] Этанол можно превратить в сложные эфиры, а хлорид — в химическое соединение. Он способен реагировать при очень высоких температурах и легко образовывать кислород и водород. [1] При соединении этанола с серной кислотой образуется этилен. Эта концепция известна как дегидратация этанола и может быть осуществлена только при нагревании до 170 градусов Цельсия. Также при смешивании с серной кислотой при 140 градусах Цельсия образуется диэтил. Этанол реагирует с натрием и образует этоксид натрия за счет замещения атома натрия. Этанол может образовываться и реагировать со многими различными соединениями и элементами, включая пентахлорид фосфора, с образованием хлористого водорода, фосфорилхлорида и этилхлорида. [4]
История этанола
Автомобиль Генри Форда, который использовал чистый этанол для своих автомобилей.

Этанол используется во многих областях для различных целей. История этанола уходит корнями дальше, чем мы знаем в наши дни. Этанол, который сейчас используется в качестве топлива, был получен на раннем этапе ферментации сахара. Люди обнаружили, что этанол также можно получить путем перегонки и ферментации. [10] С помощью этих шагов они могли получить больший объем спирта, а также найти метод сублимационной перегонки. В 1976 Иоганн Тобиас Ловитц открыл чистый этанол методом дистилляции. Он обнаружил, что этанол состоит из водорода, кислорода и углерода. Позже, в 19 веке, Николя-Теодор де Соссюр нашел химическую формулу этанола. [11] В 1850 г. в США производилось почти 90 млн галлонов этанола ежегодно. Они использовались в основном для производства топлива и алкогольных напитков. Затем, в 1862 году, налог сделал этанол более дорогим, и людям стало трудно его покупать. [10] В 1896 Этанол впервые был использован в автомобилях. Генри Форд использовал чистый этанол для запуска своих автомобилей, а затем использовал смесь этанола для своих автомобилей.
 Когда в 1919 году был введен сухой закон, был проведен процесс денатурации, и этанол был очень вредным, потому что он был ядовитым, и люди не могли его пить. Но сухой закон закончился в 1933 году, и производство этанола снова увеличилось, чтобы удовлетворить потребности многих людей во время Второй мировой войны. После Второй мировой войны фермеры начали выращивать урожай для получения этанола. В настоящее время заводы по производству этанола по-прежнему производятся для использования в качестве топлива и многих других продуктов и в основном производятся на Среднем Западе, получая около 5 миллиардов галлонов. [11]
Когда в 1919 году был введен сухой закон, был проведен процесс денатурации, и этанол был очень вредным, потому что он был ядовитым, и люди не могли его пить. Но сухой закон закончился в 1933 году, и производство этанола снова увеличилось, чтобы удовлетворить потребности многих людей во время Второй мировой войны. После Второй мировой войны фермеры начали выращивать урожай для получения этанола. В настоящее время заводы по производству этанола по-прежнему производятся для использования в качестве топлива и многих других продуктов и в основном производятся на Среднем Западе, получая около 5 миллиардов галлонов. [11] Видео
Список литературы
- ↑ 1,0 1,1 1,2 1,3 10074 10074.417. Веб. По состоянию на 21 февраля 2012 г. Автор неизвестен.
- ↑ Физические свойства wordpress . Веб.


 Молекулярное строение имеет
Молекулярное строение имеет Молекулярную кристаллическую решетку имеет
Молекулярную кристаллическую решетку имеет Металлическую кристаллическую решетку имеет
Металлическую кристаллическую решетку имеет Ионы являются структурной единицей для каждого из двух веществ:
Ионы являются структурной единицей для каждого из двух веществ: Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для
Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для
 Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами
Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами Сульфат натрия также образуется из дихромата натрия. Затем снова сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1]
Сульфат натрия также образуется из дихромата натрия. Затем снова сульфат натрия можно снова получить путем производства хелатирующих агентов, карбоната лития, аскорбиновой кислоты, резорцина, фенола, азотной кислоты и кремнеземных пигментов. [1] 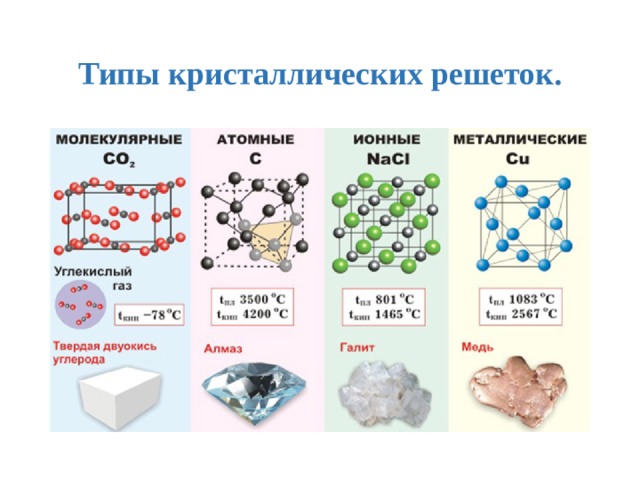 Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него изготавливают моющие средства, мыло, стаканы, теплоаккумуляторы и др.
Его даже продали за 90 долларов за хорошее качество. Это означает, что сульфат натрия был очень дешевым материалом. Сегодня сульфат натрия стал широко используемым материалом. Из него изготавливают моющие средства, мыло, стаканы, теплоаккумуляторы и др. [6]
[6]  Это помогает уменьшить отрицательные заряды пятерок и способствует равномерному проникновению красителей. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали. Другими областями применения сульфата натрия могут быть глазурь на окнах, освежители ковров, добавка к корму для крупного рогатого скота и производство крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного осушителя органического вещества. [2]
Это помогает уменьшить отрицательные заряды пятерок и способствует равномерному проникновению красителей. Сульфат натрия не похож на хлорид натрия тем, что не повреждает сосуды из нержавеющей стали. Другими областями применения сульфата натрия могут быть глазурь на окнах, освежители ковров, добавка к корму для крупного рогатого скота и производство крахмала. Наконец, безводный сульфат натрия в лаборатории используется в качестве инертного осушителя органического вещества. [2] 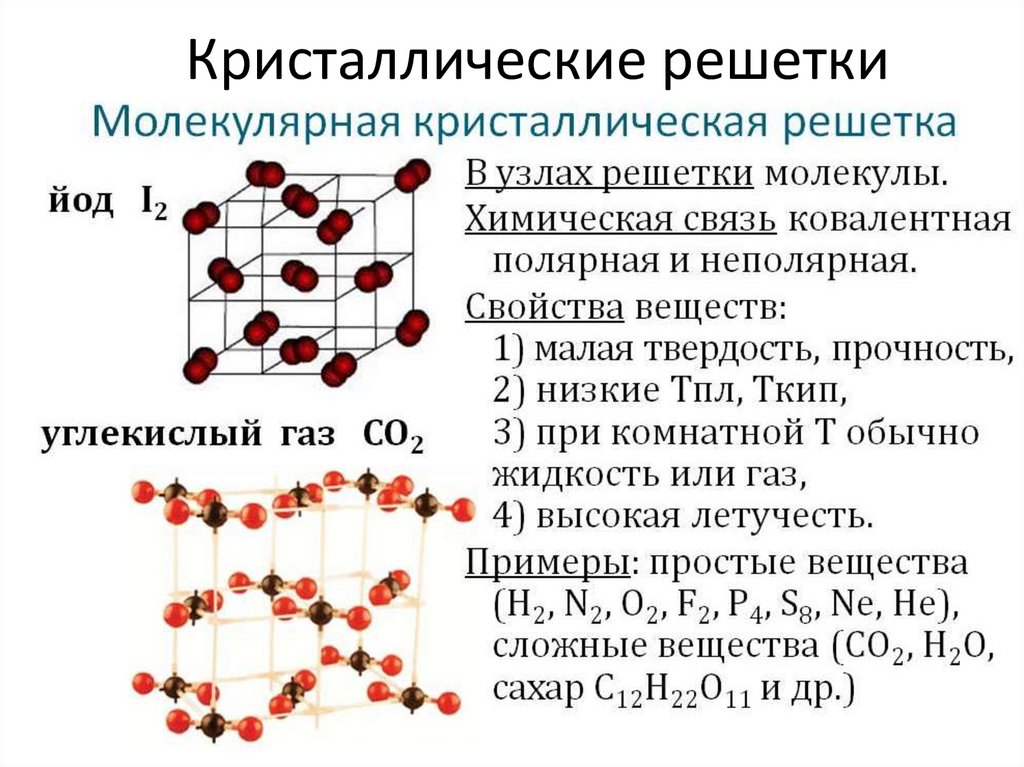 Людям приходится помещать сульфат натрия в закрытый контейнер. Они также должны отделить его от несовместимых веществ. Примерами являются сильные кислоты, магний и алюминий. Ожидается, что сульфат натрия не представляет опасности для здоровья, когда люди прикасаются к своей коже. Он может иметь легкую токсичность из-за приема внутрь. Это может вызвать понос, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмотической активности. Люди не должны бросать это себе в глаза. Если люди коснутся его кожей, они должны смыть его водой с мылом. Если он попадет им в глаза, они должны смыть его проточной водой. Людям следует принимать лекарства, если они видят раздражение. Наконец, если люди случайно съедят его, им следует выпить много стаканов воды. [3]
Людям приходится помещать сульфат натрия в закрытый контейнер. Они также должны отделить его от несовместимых веществ. Примерами являются сильные кислоты, магний и алюминий. Ожидается, что сульфат натрия не представляет опасности для здоровья, когда люди прикасаются к своей коже. Он может иметь легкую токсичность из-за приема внутрь. Это может вызвать понос, падение артериального давления, потерю жидкости при попадании в воду. Причина в его осмотической активности. Люди не должны бросать это себе в глаза. Если люди коснутся его кожей, они должны смыть его водой с мылом. Если он попадет им в глаза, они должны смыть его проточной водой. Людям следует принимать лекарства, если они видят раздражение. Наконец, если люди случайно съедят его, им следует выпить много стаканов воды. [3] 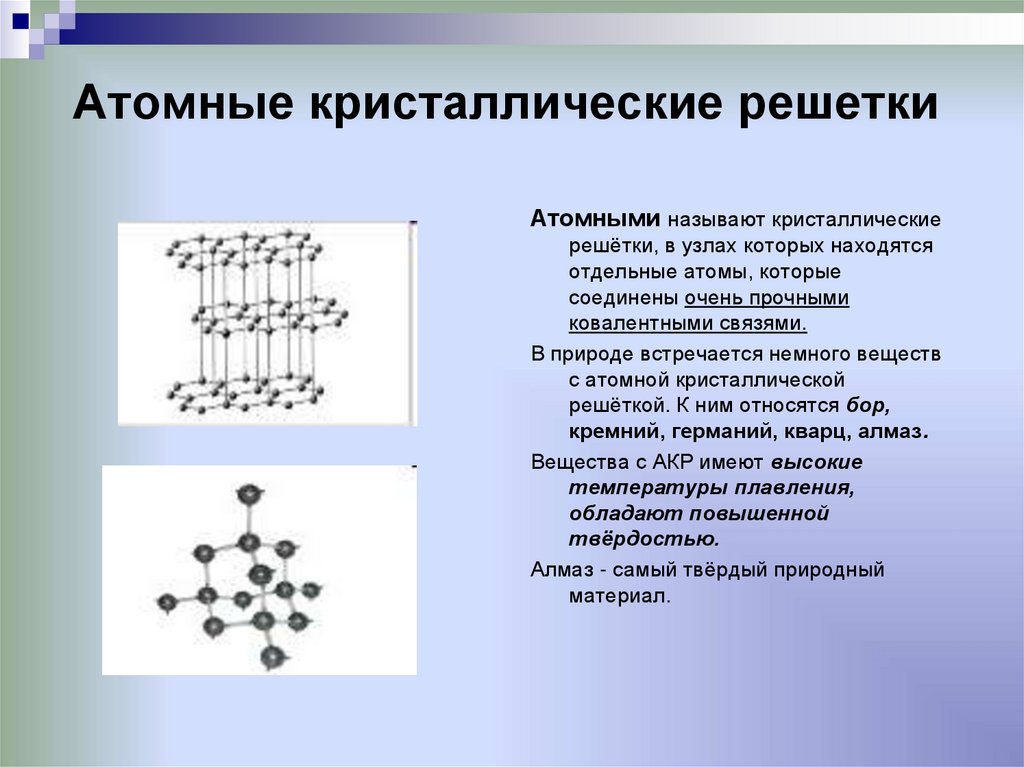
 8 г/м³, жидкость
8 г/м³, жидкость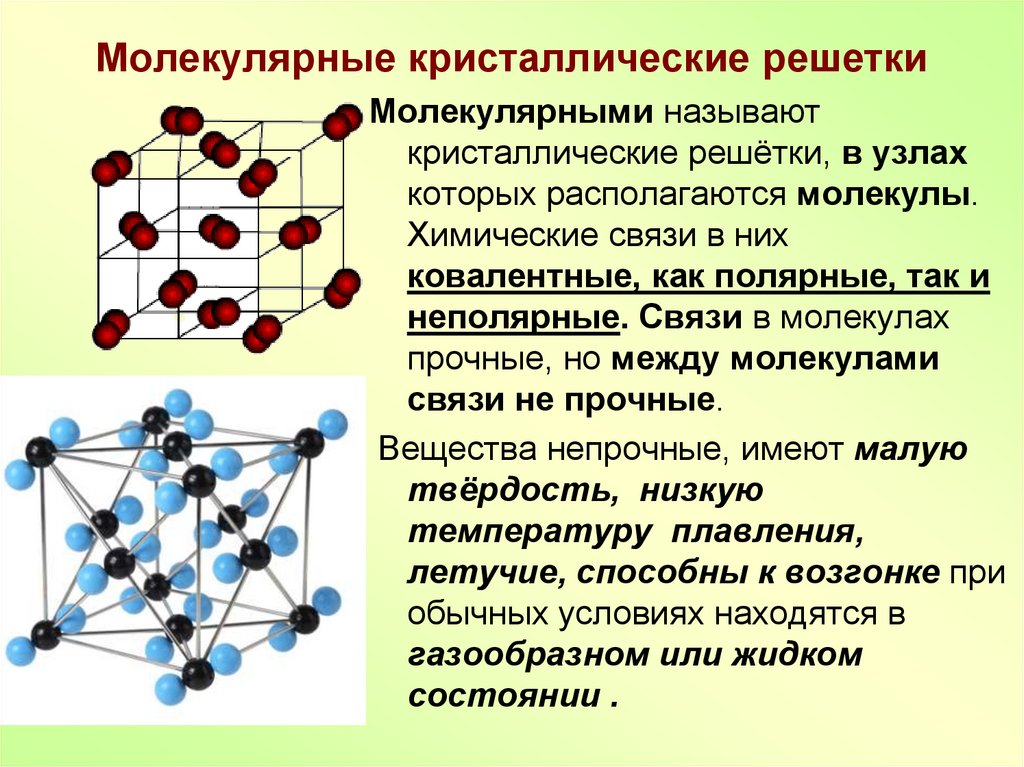 Он также широко известен как этиловый спирт или зерновой спирт. Этанол легко воспламеняется, имеет прозрачный вид и не имеет запаха. Он имеет молекулярную формулу C 2 H 6 O и представляет собой растворенное вещество, которое хорошо сочетается с другими элементами, а также с другими соединениями. Этанол образуется из 95-процентного спирта и 5-процентной воды. Эти соединения естественным образом получают из сахаров и дрожжей и могут производить многие другие виды этанола путем перегонки. Этанол может быть вредным в некоторых случаях, но в наши дни это отличное растворяющее вещество, в котором нуждаются люди. [1]
Он также широко известен как этиловый спирт или зерновой спирт. Этанол легко воспламеняется, имеет прозрачный вид и не имеет запаха. Он имеет молекулярную формулу C 2 H 6 O и представляет собой растворенное вещество, которое хорошо сочетается с другими элементами, а также с другими соединениями. Этанол образуется из 95-процентного спирта и 5-процентной воды. Эти соединения естественным образом получают из сахаров и дрожжей и могут производить многие другие виды этанола путем перегонки. Этанол может быть вредным в некоторых случаях, но в наши дни это отличное растворяющее вещество, в котором нуждаются люди. [1] 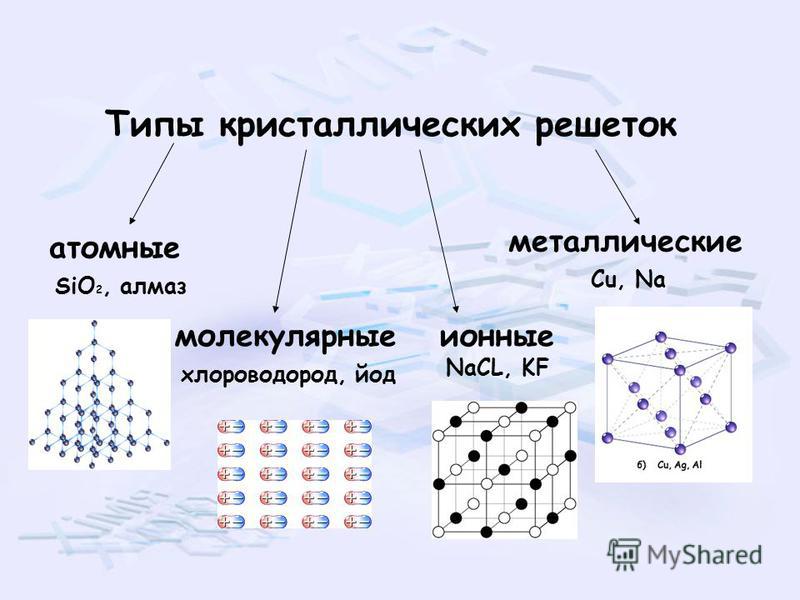 Этанол состоит из 5 процентов воды и 95-процентный спирт. Когда этанол не содержит воды и содержит 100% спирта, его называют абсолютным этанолом. [1] Этанол имеет низкую температуру кипения 78 градусов Цельсия и температуру плавления -114 градусов Цельсия. Это летучая бесцветная жидкость с жгучим вкусом и спиртовым приятным запахом. Этанол имеет плотность 0,789 г/мл, что легче воды. [2] Химические свойства этанола определяются элементом этена, известным как C2h5. Этанол становится бледно-голубым, когда они сгорают, и они образуют воду и углекислый газ. [1] Этанол не может быть полностью получен простой перегонкой. Хотя в процессе соединения бензола с этанолом может образовываться абсолютный этанол, этот процесс может быть ядовитым из-за остатков бензола. [3]
Этанол состоит из 5 процентов воды и 95-процентный спирт. Когда этанол не содержит воды и содержит 100% спирта, его называют абсолютным этанолом. [1] Этанол имеет низкую температуру кипения 78 градусов Цельсия и температуру плавления -114 градусов Цельсия. Это летучая бесцветная жидкость с жгучим вкусом и спиртовым приятным запахом. Этанол имеет плотность 0,789 г/мл, что легче воды. [2] Химические свойства этанола определяются элементом этена, известным как C2h5. Этанол становится бледно-голубым, когда они сгорают, и они образуют воду и углекислый газ. [1] Этанол не может быть полностью получен простой перегонкой. Хотя в процессе соединения бензола с этанолом может образовываться абсолютный этанол, этот процесс может быть ядовитым из-за остатков бензола. [3] 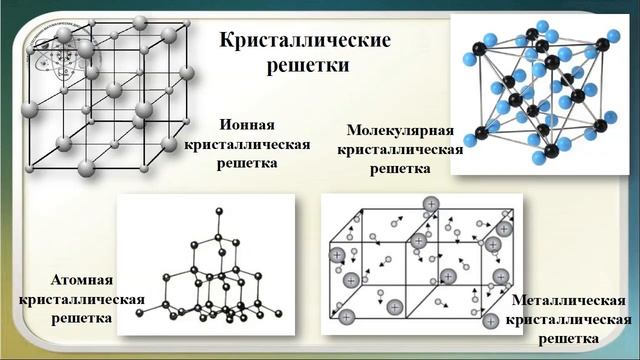 [4] В США Этанол производится в основном из кукурузы. Производится мокрым или сухим способом. Измельчение перерабатывает урожай и ферментирует его в этанол с мукой или расщепляет белок и крахмал в кукурузе для получения этанола. Эти явления основаны на сахаре и крахмале. Хотя это обычно не производится, этанол также имеет целлюлозное сырье, которое не должно использоваться ни в какой культуре, а вместо этого используется древесина для производства этанола. Есть два способа получения этанола из целлюлозы: термохимический и биохимический. Оба этих способа требуют дерева или травы для производства этанола. Производство целлюлозы является более сложным, чем производство на основе крахмала и сахара. [5]
[4] В США Этанол производится в основном из кукурузы. Производится мокрым или сухим способом. Измельчение перерабатывает урожай и ферментирует его в этанол с мукой или расщепляет белок и крахмал в кукурузе для получения этанола. Эти явления основаны на сахаре и крахмале. Хотя это обычно не производится, этанол также имеет целлюлозное сырье, которое не должно использоваться ни в какой культуре, а вместо этого используется древесина для производства этанола. Есть два способа получения этанола из целлюлозы: термохимический и биохимический. Оба этих способа требуют дерева или травы для производства этанола. Производство целлюлозы является более сложным, чем производство на основе крахмала и сахара. [5] 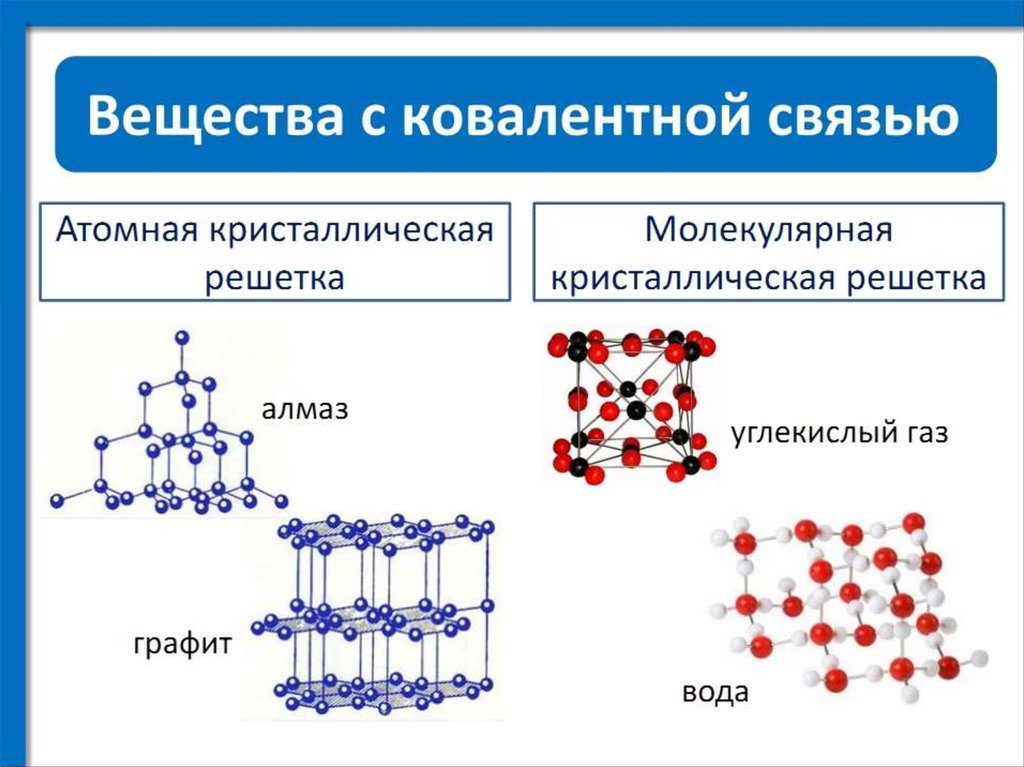 Можно с другими видами топлива служить бензином. Есть автомобили, которые полностью работают на этаноле или смеси этанола. [6] Некоторые автомобили с гибким топливом могут полностью работать на смеси бензина и гидратированного этанола, если в бензине содержится не менее 20 % этанола. Этанол полезен тем, что его можно смешивать с водой и другими растворителями. Есть также много типов этанола, таких как безводный этанол, который является 95% этанола и 5% воды, которые можно смешивать с водой и помогать окружающей среде, уменьшая загрязнение воздуха. Не только в США они используют этанол в качестве топлива, но и в Бразилии этанол смешивают с бензином, поскольку они способны работать на соединениях, смешанных с этанолом и водой, а также на гидратированном этаноле. В Бразилии этанол в основном производится из сахарных культур, а в Соединенных Штатах этанол в основном производится из кукурузы. [7]
Можно с другими видами топлива служить бензином. Есть автомобили, которые полностью работают на этаноле или смеси этанола. [6] Некоторые автомобили с гибким топливом могут полностью работать на смеси бензина и гидратированного этанола, если в бензине содержится не менее 20 % этанола. Этанол полезен тем, что его можно смешивать с водой и другими растворителями. Есть также много типов этанола, таких как безводный этанол, который является 95% этанола и 5% воды, которые можно смешивать с водой и помогать окружающей среде, уменьшая загрязнение воздуха. Не только в США они используют этанол в качестве топлива, но и в Бразилии этанол смешивают с бензином, поскольку они способны работать на соединениях, смешанных с этанолом и водой, а также на гидратированном этаноле. В Бразилии этанол в основном производится из сахарных культур, а в Соединенных Штатах этанол в основном производится из кукурузы. [7]  Этаноловый спирт часто называют этиловым или зерновым спиртом. Этаноловый спирт также используется в парфюмерии, одеколоне, лаке для волос или в медицинских целях. [8] Этанол также широко используется в фармацевтике. Например, леденцы от кашля и растворы йода. Этанол снова является очень полезным соединением, потому что он является растворителем и может смешиваться с другими различными элементами. Поэтому многие фармацевты могут использовать этанол для изготовления таблеток, пилюль, витаминов и антибиотиков. Этаноловый спирт также используется во многих бытовых чистящих средствах, бутылка с дезинфицирующим спреем содержит более половины этанола для очистки объектов. Также этанол может использоваться в таких веществах, как краски и лаки, а иногда даже в пищевых продуктах, которые мы потребляем, таких как ароматизаторы, экстракты и глазури. [9]
Этаноловый спирт часто называют этиловым или зерновым спиртом. Этаноловый спирт также используется в парфюмерии, одеколоне, лаке для волос или в медицинских целях. [8] Этанол также широко используется в фармацевтике. Например, леденцы от кашля и растворы йода. Этанол снова является очень полезным соединением, потому что он является растворителем и может смешиваться с другими различными элементами. Поэтому многие фармацевты могут использовать этанол для изготовления таблеток, пилюль, витаминов и антибиотиков. Этаноловый спирт также используется во многих бытовых чистящих средствах, бутылка с дезинфицирующим спреем содержит более половины этанола для очистки объектов. Также этанол может использоваться в таких веществах, как краски и лаки, а иногда даже в пищевых продуктах, которые мы потребляем, таких как ароматизаторы, экстракты и глазури. [9]  Если этаналь будет обнаружен в дальнейшем, его также можно будет найти в виде этановой кислоты, которую также обычно называют уксусной кислотой. [1]
Если этаналь будет обнаружен в дальнейшем, его также можно будет найти в виде этановой кислоты, которую также обычно называют уксусной кислотой. [1] 
 Когда в 1919 году был введен сухой закон, был проведен процесс денатурации, и этанол был очень вредным, потому что он был ядовитым, и люди не могли его пить. Но сухой закон закончился в 1933 году, и производство этанола снова увеличилось, чтобы удовлетворить потребности многих людей во время Второй мировой войны. После Второй мировой войны фермеры начали выращивать урожай для получения этанола. В настоящее время заводы по производству этанола по-прежнему производятся для использования в качестве топлива и многих других продуктов и в основном производятся на Среднем Западе, получая около 5 миллиардов галлонов. [11]
Когда в 1919 году был введен сухой закон, был проведен процесс денатурации, и этанол был очень вредным, потому что он был ядовитым, и люди не могли его пить. Но сухой закон закончился в 1933 году, и производство этанола снова увеличилось, чтобы удовлетворить потребности многих людей во время Второй мировой войны. После Второй мировой войны фермеры начали выращивать урожай для получения этанола. В настоящее время заводы по производству этанола по-прежнему производятся для использования в качестве топлива и многих других продуктов и в основном производятся на Среднем Западе, получая около 5 миллиардов галлонов. [11] 
Leave A Comment