Практическая работа 2. Задача 4. Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Практическая работа 2. Задача 4. Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Как это происходит?
Проделайте опыты по осуществлению следующих превращений:
а) цинк → сульфат цинка → гидроксид цинка
в) цинк → хлорид цинка → гидроксид цинка
ответы
Реакции опытов:
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н.
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Медь сернокислая 5-водная Ч — База химической продукции Югреактив
Главная»В помощь технологу»Химическая продукция»Реактивная продукция»Медь сернокислая 5-водная Ч
Медь сернокислая (II) 5-водная
Синонимы: Медь (II) сульфат пятиводная, Медь сернокислая (II) пентагидрат, медный купорос, сульфат меди
Мы предлагаем Медь сернокислую, медь сульфат 5-водную по выгодным ценам с доставкой по всей России.
Спецификация | |
|---|---|
Молекулярный вес | 249,68 |
Плотность | 2,29 г/см3 (20°C) |
Температура плавления | 110С |
Медь сернокислая, «ч» | % |
Основное вещ-во, не менее | 98,5 % |
Нерастворимых в воде веществ, не более | 0,008 % |
Содержание CL, не ,более | 0,005 % |
Содержание N общ. | 0,008 % |
Содержание Fe, не более | 0,02 % |
Содержание SO4, не более | 0,2 % |
Медь сернокислая, «чда» | % |
Основное вещ-во, не менее | 99,0 % |
Содержание меди (Cu), не менее | 25,0 % |
Нерастворимых в воде веществ, не более | 0,005 % |
Содержание хлоридов (CL), не более | 0,001 % |
Содержание N общ., не более | 0,001 % |
Содержание Fe, не более | 0,005 % |
Содержание Pb, не более | 0,005 % |
Содержание Sb, не более | 0,006 % |
Содержание Ni, не более | 0,0005 % |
Содержание Zn, не более | 0,002 % |
Медь сернокислая (II) 5-водная или ее также называют медный купорос, сульфат меди — это синий кристаллический порошок, растворимый в воде, разбавленном спирте и концентрированной соляной кислоте, выветривающиеся на воздухе, легко образует основные сульфаты, двойные соли (шёниты), аммиакаты.
Медь сернокислая (II) 5-водная встречается в природе в виде минералов халькокианита CuSO4, халькантита CuSO4.5h3O, бонаттита CuSO4.3Н2О, бутита CuSO4.7Н2О, брошантита CuSO4.3Сu(ОН)2 и др.
Получение
Медь сернокислую, медный купорос получают в промышленности
• растворением меди и медных отходов в разбавленной серной кислоте при продувании воздуха;
• растворением CuO в серной кислоте;
• сульфатизирующим обжигом сульфидов меди;
• как побочный продукт электролитического рафинирования меди и др.
Применение сульфата меди
Медь сернокислая или Медь (II) сульфат пятиводная широко используют
• как протраву при крашении текстильных материалов,
• для протравливания семян,
• в гальванотехнике,
• Медный купорос марок «Ч» и «ЧДА» успешно используется в сельском хозяйстве как средство защиты плодово-ягодных, фруктовых, овощных растений и городских зеленых насаждений, то есть как фунгицид; для приготовления добавок вносимых в почву и кормовых добавок для домашних и сельскохозяйственных животных, премиксов, для приготовления бордоской жидкости и бургундской смеси.
 Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.
Возможно применение медного купороса при обработке зерновых культур в процессе хранения и протравке семян перед посевом для уничтожения спор плесневых грибов и др.23.1: Прямые окислительно-восстановительные реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 53967
Золото и серебро широко используются для изготовления ювелирных изделий. Одна из причин, по которой эти металлы используются для этой цели, заключается в том, что они очень нереакционноспособны. Они не вступают в реакцию при контакте с большинством других металлов, поэтому с большей вероятностью сохранят целостность в сложных условиях. Никто не хочет, чтобы его любимое украшение развалилось!
Прямые окислительно-восстановительные реакции
Когда полоску металлического цинка помещают в синий раствор сульфата меди (II) (рисунок ниже), сразу же начинается реакция, когда полоска цинка начинает темнеть.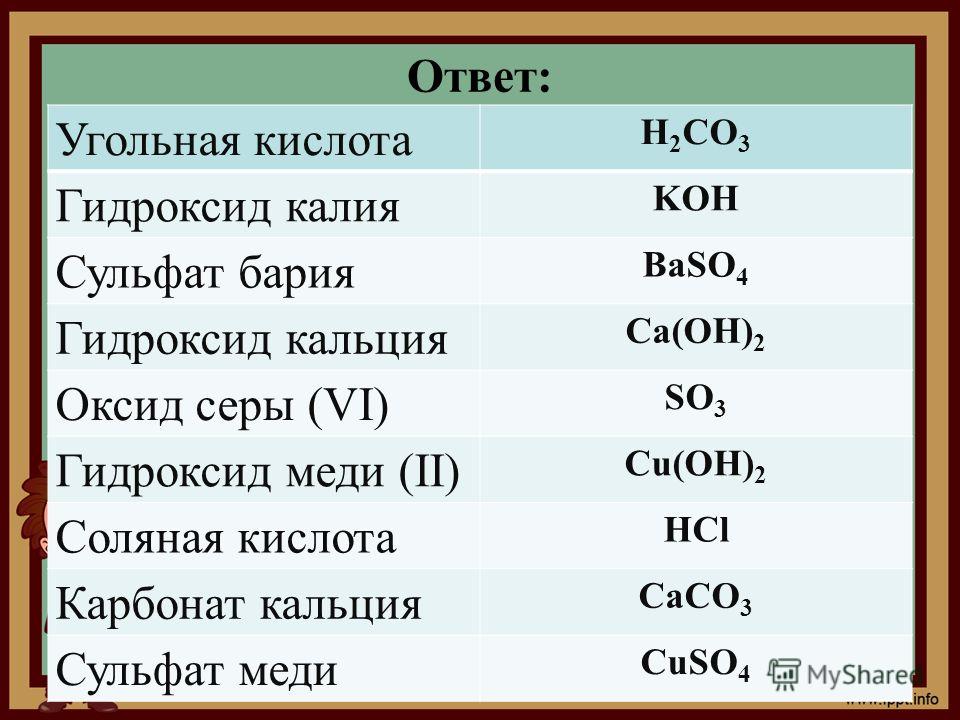 Если оставить в растворе на более длительный период времени, цинк будет постепенно распадаться из-за окисления до ионов цинка. В то же время ионы меди (II) из раствора восстанавливаются до металлической меди (см. второй рисунок ниже), что приводит к обесцвечиванию синего раствора сульфата меди (II). 9{2+}} \left( aq \right) + \ce{Cu} \left( s \right) \end{array}\nonumber \]
Если оставить в растворе на более длительный период времени, цинк будет постепенно распадаться из-за окисления до ионов цинка. В то же время ионы меди (II) из раствора восстанавливаются до металлической меди (см. второй рисунок ниже), что приводит к обесцвечиванию синего раствора сульфата меди (II). 9{2+}} \left( aq \right) + \ce{Cu} \left( s \right) \end{array}\nonumber \]
Почему эта реакция протекает самопроизвольно? Ряд активности представляет собой список элементов в порядке убывания реактивности. Элемент, стоящий выше в ряду активности, способен вытеснить элемент, стоящий ниже в ряду, в реакции однократного замещения. В этой серии также перечислены элементы в порядке легкости окисления. Элементы наверху окисляются легче всего, а элементы внизу — труднее всего. В таблице ниже показаны ряды активности вместе с полуреакцией окисления каждого элемента. 9-}\)
Обратите внимание, что цинк указан выше меди в ряду активности. это означает, что цинк легче окисляется, чем медь. Вот почему ионы меди (II) могут действовать как окислитель при контакте с металлическим цинком. Ионы любого металла с содержанием ниже цинка, например свинца или серебра, окислят цинк в аналогичной реакции. Эти типы реакций называются прямыми окислительно-восстановительными реакциями , потому что электроны перетекают непосредственно от атомов одного металла к катионам другого металла. Однако никакой реакции не произойдет, если полоску металлической меди поместить в раствор ионов цинка, потому что ионы цинка не способны окислять медь. Другими словами, такая реакция неспонтанна.
Вот почему ионы меди (II) могут действовать как окислитель при контакте с металлическим цинком. Ионы любого металла с содержанием ниже цинка, например свинца или серебра, окислят цинк в аналогичной реакции. Эти типы реакций называются прямыми окислительно-восстановительными реакциями , потому что электроны перетекают непосредственно от атомов одного металла к катионам другого металла. Однако никакой реакции не произойдет, если полоску металлической меди поместить в раствор ионов цинка, потому что ионы цинка не способны окислять медь. Другими словами, такая реакция неспонтанна.
Резюме
- Приведен ряд активности металлов.
- Описаны параметры самопроизвольных реакций между металлами.
Эта страница под названием 23.1: Прямые окислительно-восстановительные реакции распространяется под лицензией CK-12 и была создана, изменена и/или курирована Фондом CK-12 с использованием исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Фонд CK-12
- Лицензия
- СК-12
- Программа OER или Publisher
- СК-12
- Показать страницу TOC
- № на стр.
- Теги
- источник@https://flexbooks.
 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
- источник@https://flexbooks.
Реакция одиночного замещения: ион цинка и меди(II) REDOX
При погружении металлического цинка в раствор 0,1 М водного раствора сульфата меди(II) металлические пластины меди выходят на цинк. Раствор изначально имеет синий цвет. В течение двух минут на цинке появляется темный слой металлической меди, а по прошествии 45 минут на цинковой полоске появляется толстый слой порошка металлической меди, и синий цвет раствора значительно светлеет.
Zn(s) + Cu 2 + (водный) -> Zn 2 + (водн.) + Cu(s)
Атомы цинка окисляются до Zn 2 + (водн.): Zn(s) -> Zn 2 + (водн.) + 2e- (потеря электронов)
Ионы меди(II) восстанавливаются до Cu(s): Cu 2 + (водн.) + 2e—> Cu(s) (прирост электронов)
или не медь будет реагировать с ZnSO 4 (водн.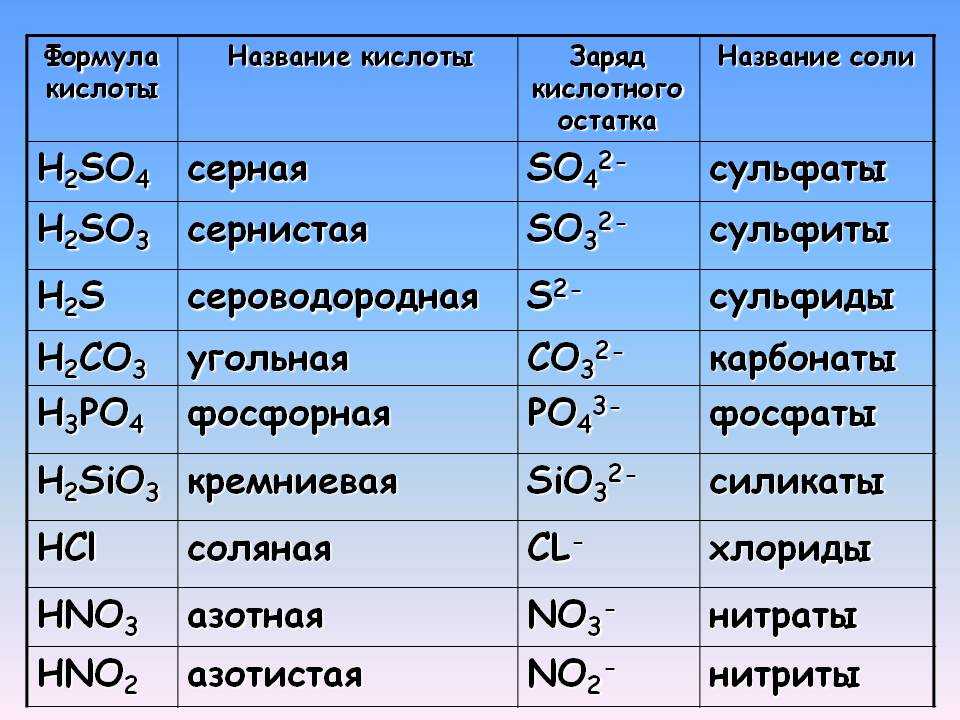 ).
).Cu(s) + Zn 2 + (водн.) -> Нет реакции
Цинк является более активным металлом по сравнению с медью. Ионы Zn 2+ (водн.) не служат восстановителем.
Примечания к учебному плану
Это отличная демонстрация, которую можно представить в начале раздела по электрохимии, поскольку позже за ним может последовать демонстрация цинково-медного элемента. Эту демонстрацию также можно использовать при обсуждении реакций одинарного замещения, окислительно-восстановительных реакций или электроотрицательности.
Активное обучение
Пожалуйста, не читайте лекции своим студентам. Используйте ряд хорошо продуманных вопросов, визуализаций и учебник в стиле POGIL, чтобы научить учащихся понимать, при каких условиях будут происходить реакции одиночного смещения.
Эффективность демонстрации повышается, когда 1) учащиеся проходят последовательность инструкций, 2) учащиеся просматривают компьютерную анимацию, показывающую, что происходит на атомном уровне: окисление цинка и восстановление Cu 2 + ионов, и 3) учащиеся работают с рабочим листом, сопровождающим демонстрацию и компьютерное моделирование. Набор слайдов Power Point, пытающихся привнести активное обучение в презентацию этой демонстрации, размещен в меню справа.
Набор слайдов Power Point, пытающихся привнести активное обучение в презентацию этой демонстрации, размещен в меню справа.
Серия действий по металлам Компьютерное моделирование
Выберите различные металлы для тестирования в водных растворах M 2 + . Составьте ряд активности приема пищи на основе наблюдений за тем, реагирует ли металл с водным раствором M 2 + . Возможность просмотра компьютерной анимации на уровне частиц взаимодействия иона M 2 + с металлическим электродом. На основании наблюдений напишите окислительно-восстановительные полуреакции.
http://pages.uoregon.edu/tgreenbo/redox2.html
http://intro.chem.okstate.edu/1515F01/Laboratory/ActivityofMetals/home.html
© 2010 Greenbowe Chemistry Education Instructional Resources.
Это компьютерная симуляция на основе СТАРОЙ ФЛЭШ, разработанная Томом Гринбоу и его исследовательской группой по химическому образованию.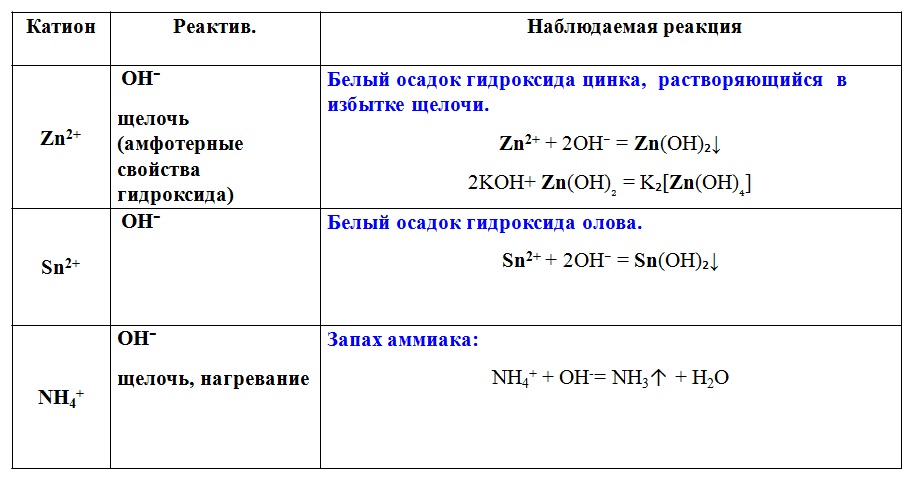


 ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
ck12.org/cbook/ck-12-chemistry-flexbook-2.0/
Leave A Comment