Ответы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
CaC2->C2h3->C6H6->C6H6-NO2->C6H6-Nh3
Диагональ куба равно 6 см найдите ребро куба
электронный баланс Nh4+O2=NO+h3O
В каком году была сформулирована теория — предшественница кислородной теории горения.
sio2-si-sio2-na2sio3-h3sio3-sio2
Пользуйтесь нашим приложением
Решить задачу. термохимическое уравнение реакции оксида меди (ii) с соляной кислотой cuo +2hcl = cucl2 + h3o + 63,6 кдж. сколько теплоты выделиться при растворении 200 г оксида меди в соляной кислоте? — Школьные Знания.net
Все предметы
Математика
Литература
Алгебра
Русский язык
Геометрия
Английский язык
Физика
Биология
Другие предметы
История
Обществознание
Окружающий мир
География
Українська мова
Информатика
Українська література
Қазақ тiлi
Экономика
Музыка
Беларуская мова
Французский язык
Немецкий язык
Психология
Оʻzbek tili
Кыргыз тили
Астрономия
Физкультура и спорт
Термохимическое уравнение реакции оксида меди (II) с соляной кислотой
CuO +2HCl = CuCl2 + h3O + 63,6 кДж. Сколько теплоты выделиться при растворении 200 г оксида меди в соляной кислоте?
Сколько теплоты выделиться при растворении 200 г оксида меди в соляной кислоте?
Ответ дан
mrvladimir2
Ответ: 159 кДж
Объяснение:
200 г х кДж
CuO +2HCl = CuCl2 + h3O + 63,6 кДж
80 г
200:80 = х:63,6
х=Q = 200 г*63,6 кДж/80 г = 159 кДж
Ответ: 159 кДж
CuO + 2HCl → CuCl2 + h3O
- Mã giảm giá Shopee!
Trang trước
Trang sau
Phản ứng CuO + HCl сено CuO ra CuCl ợc can bằng chính xac và chi tiết nhất. Bên cạnh đó là một số bai tập có liên quan về CuO có lời giải, mời các bạn dón xem:
CuO + 2HCl → CuCl 4 +3 20013 2 O
Куанг Цао
Чийу Кьен Пхон Унг
— Нхьет Доп Пхонг.
Cách thực hiện phản ứng
— Cho 1 it bột CuO vào trong ng nghiệm sau đó nhỏ vài giọt dung clohich axit dịhich axit.
Hiện tượng nhận biết phản ứng
— CuO tan dần và dung dịch chuyển sang màu xanh.
Bạn có biết
— Các oxit kim loại (FeO, Fe 2 O 3 , Al 2 O 3 … ) tác dụng với axit HCl sinh ra muối clorua và nước
Ví dụ minh họaVí dụ 1:
A. 0,5M B. 1M
В. 1,5М Г. 2М
Đáp án B
Hướng dẫn giải:
CuO + 2HCl → CuCl 2 + Н 2 О
а 2а а
Fe 2 O 3 + 6HCl → 2FeCl 3 + 3H 2 O
а/2 3а а
m hỗn hợp = 80. a + 160. a/2 = 3,2 г ⇒ a = 0,02 моль ⇒ n HCl = 0,1 моль
a + 160. a/2 = 3,2 г ⇒ a = 0,02 моль ⇒ n HCl = 0,1 моль
⇒ С М = 1М
Quảng cáo
Ví dụ 2: Cho 8 г CuO tác dụng vừa đủ với 50 мл навоза HCl. Nồng độ mol của dung dịch HCl là
A. 1M B. 2M
В. 3М Г. 4М
Đáp án D
Hướng dẫn giải:
n CuO = 0,1 моль
CuO + 2HCl → CuCl 2 + H 2 O
0,1 → 0,2 моль
⇒ С М (HCl) = 4М.
Ví dụ 3: Cho 16 г CuO tác dụng vừa đủ với dung dịch HCl. Khối lượng muối thu được là:
A. 13,5 г B. 27 г
C. 40,5 г D. 6,75 г
Чап ан Б
Hướng dẫn giải:
n CuO = 0,2 моль
CuO (0,2) + 2HCl → CuCl2 (0,2 моль) + H 2 O
м CuCl 2 = 0,2. 135 = 27 г
Нган ханг трук нгхием миен фи он тхи THPT Куок Гия туи номер
 000 câu trắc nghiệm Hóa có đáp án chi tiet
000 câu trắc nghiệm Hóa có đáp án chi tiet CHỈ TỪ 250K 1 BỘ TÀI LIEU GIÁO ÁN, ĐỀ THI, KHÓA HỌC BẤT KÌ, VIETJACK HỖ TRỢ DỊCH COVID
Bộ giáo ang án, th, th, thi khóa học dành cho cac thầy cô và học sinh lớp 12 , đẩy đủ cac bộ sách cánh diều, kết nối tri thức, chân trời sáng tạo tại https://tailieugiaovien.com.vn/ . Hỗ trợ zalo VietJack Official
Giáo án, bài giảng powerpoint Ван, Тоан, Ли, Хоа….
4,5 (243)
799 000 центов
199 000 донгов
1000 Đề thi bản word THPT quốc gia cá trường 2023 Toán, Lí, Hóa….
4,5 (243)
799 000đ
199 000 донгов
Đề thi thử DGNL (bản word) các trường 2023
4,5 (243)
799 000đ
199 000 донгов
xem tất cả
Trang trước Trang sau
phuong-trinh-hoa-hoc-cua-dong-cu.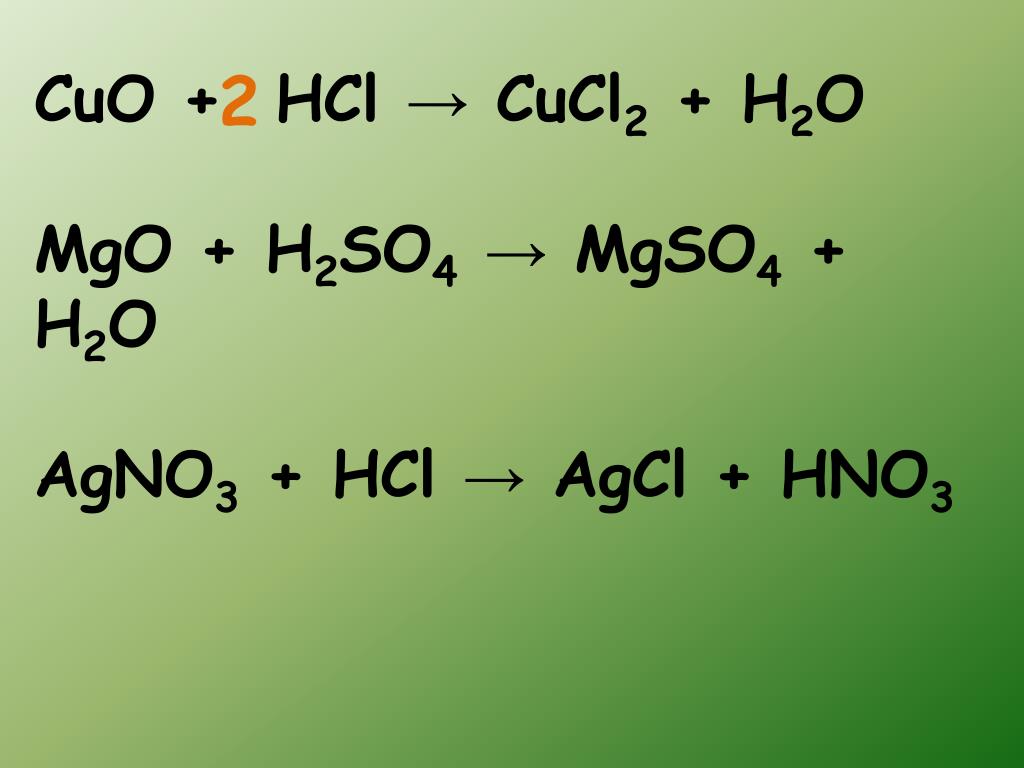 jsp
jsp
Oxidation-Reduction
Где мир собирается для
гальваники, анодирования и отделки Вопросы и ответы с 1989 года
——
2004
Я участвую в научном проекте о том, как кислота повлияет на грязные монеты и очистит ногти. Я действительно хочу знать, что происходит в эксперименте и использовании данных. Я знаю, что этот эксперимент как-то связан с окислением-восстановлением, но я действительно этого не понимаю.
Спасибо.
Линда Л.
Студентка — Оттава, Онтарио, Канада
2003
Все в порядке, ваш учитель естественных наук, вероятно, тоже этого не понимает, и я тоже — со степенями окисления и окислительно-восстановительными реакциями меди сложно.
Основная идея заключается в том, что медь может существовать в нескольких степенях окисления. Это может быть металлическая медь в нулевой степени окисления, это может быть соединение или соль меди, такая как Cu2O, в степени окисления плюс 1, или это может быть соединение меди или соль, такая как CuO, в степени окисления плюс 2. Когда он переходит из более низкой степени окисления в более высокую в процессе окисления. Когда он переходит из более высокой степени окисления в более низкую, он восстанавливается. Чтобы он восстановился, какой-то другой элемент в реакции должен окислиться. Чтобы он окислился, какой-то другой элемент в реакции должен быть восстановлен. Если вы попытаетесь сбалансировать уравнение, в котором медь находится в другой степени окисления с одной стороны, вы увидите, что какой-то другой элемент в уравнении также должен изменить степень окисления, чтобы компенсировать это.
Когда он переходит из более низкой степени окисления в более высокую в процессе окисления. Когда он переходит из более высокой степени окисления в более низкую, он восстанавливается. Чтобы он восстановился, какой-то другой элемент в реакции должен окислиться. Чтобы он окислился, какой-то другой элемент в реакции должен быть восстановлен. Если вы попытаетесь сбалансировать уравнение, в котором медь находится в другой степени окисления с одной стороны, вы увидите, что какой-то другой элемент в уравнении также должен изменить степень окисления, чтобы компенсировать это.
Теперь вернемся к тому, что происходит, когда вы «чистите» пенни кислотой.
Минеральные кислоты (неокисляющие кислоты), такие как соляная кислота, обладают способностью поглощать оксид меди, CuO, коричневый налет на монетах, и растворять его в виде растворимая соль.
2HCl + CuO => CuCl2 +h3O
Но степень окисления меди из потускнения до и после реакции равна Cu++, поэтому окисление-восстановление не происходит. Если вместо соляной кислоты вы используете удобные для учащихся кислоты, такие как уксус и соль, реакция будет аналогичной, хотя еще одна проблема заключается в том, чтобы объяснить, почему уксус или соль сами по себе не удаляют сильное потускнение, а их комбинация удаляет. Я не пытался сбалансировать это уравнение.
Если вместо соляной кислоты вы используете удобные для учащихся кислоты, такие как уксус и соль, реакция будет аналогичной, хотя еще одна проблема заключается в том, чтобы объяснить, почему уксус или соль сами по себе не удаляют сильное потускнение, а их комбинация удаляет. Я не пытался сбалансировать это уравнение.
Затем посмотрите на тряпку, которой вы ее чистили, и обратите внимание на зеленые соли меди, похожие на медь-медь, которые должны состоять из чего-то похожего на CuCl2, предсказанный реакцией.
Но другая проблема заключается в том, что «чистый» пенни выходит скорее лососевого, а не медного цвета. Это, по-видимому, указывает на присутствие, по крайней мере, небольшого количества Cu2O, а не просто на обнажение основного металла Cu. Если это так, то была ли часть меди в потускнении CuO восстановлена до Cu2O или часть металлической меди была окислена? Если предположение верно, но я не уверен, какой еще элемент был восстановлен или окислен, чтобы сделать это возможным. Подловил! Является ли объяснение тем, что часть металлической меди была окислена, а часть потускнела уменьшена, и это поддерживало баланс? Если да, то не странно ли, что одна и та же реакция вызывает как восстановление, так и окисление меди?
Подловил! Является ли объяснение тем, что часть металлической меди была окислена, а часть потускнела уменьшена, и это поддерживало баланс? Если да, то не странно ли, что одна и та же реакция вызывает как восстановление, так и окисление меди?
Не понимаю, почему ты не понимаешь, Линда 🙂
Тед Муни, ЧП
Стремление жить Алоха
Finishing.com — Пайн-Бич, Нью-Джерси
Finishing.com стал возможным благодаря …
этот текст заменен на bannerText
(Здесь нет «мертвых тем»! Ваш вопрос , A или Комментарий восстановит ветку на Горячую линию)
Вопрос, ответ или комментарий в ЭТОЙ теме -или- Начать НОВУЮ тему
Отказ от ответственности. С помощью этих страниц невозможно полностью диагностировать проблему отделки или опасность операции. Вся представленная информация предназначена для общего ознакомления и не является профессиональным мнением или политикой работодателя автора.

 02.16
02.16
Leave A Comment