Толуол — формула, свойства и применение химического вещества
Физиологические качества
Толуол (метилбензол) считается мутной эмульсией с резким запахом, показывает слабое наркотическое влияние, нерастворим в воде, превосходно открывается в базовых растворителях, воздействует на полимеры. Температура полного кипения — 110.60 гр. Содержит сладковатый аромат, напоминающий запах красок, лаков. Горючее вещество коптит сажей. Метилбензол менее токсичен, чем бензол.
Улетучивания толуола запросто создают взрывоопасную консистенцию, которая воспламеняется, довольно искры от электроэнергии, чтобы стартовало горение. У толуола есть химическая формула: C7H8. Её вполне вероятно образовать любым способом: C6H5 — Ch4. При этом количество атомов остаётся прежним.
Структурная основа
Состав базового продукта, состоящего лишь только из атомов углерода и водорода, демонстрирует формулу толуола. Между ним и бензолом есть однотипность, которая состоит в кольце из 6 углеродных атомов при гибридизации. В гомологах отличие от составляющих одного и того же соответствующего ряда есть.
Любая из составляющих формирует 3 сигма-связи с примыкающими частичками (2 атома углерода и 1 водорода). Отвесно кольцу есть только 1 система из негибридных P-орбиталей (единственная из 6 углеродных атомов). В итоге вещество получает свои свойства от пройденного цикла.
Уплотнённость между углеродными атомами, компонентами ядра, распределена пропорционально. Наружный вид отражается в бензольной формуле. Ключевая формула в этом случае отражает главные структурированные особенности молекулы. Метильная категория обладает возможностью быть в любом из 6 атомов ядра, они эквивалентны друг другу.
Получение этилбензола
Существует несколько типов технологических моделей, используемых для производства. Установки для создания бензола, за некоторыми исключениями, служат одновременно для получения толуола и ксилола (который либо разделяется в виде чистого продукта, либо алюминия на бензол). Выбор метода производства является стратегическим решением, которое зависит от доступного сырья, стоимости и спроса на рынке.
Установки для создания бензола, за некоторыми исключениями, служат одновременно для получения толуола и ксилола (который либо разделяется в виде чистого продукта, либо алюминия на бензол). Выбор метода производства является стратегическим решением, которое зависит от доступного сырья, стоимости и спроса на рынке.
Сырье, используемое для производства ароматических соединений, пиролитического газа и риформиата, является побочным продуктом процесса производства олефинов и бензина, это также смесь фракций, которые можно разделить способом, который индивидуально выбран под конкретный состав сырья.
Наиболее распространенным методом отделения бензола от других компонентов, образующих азеотропную смесь, является сложный метод физического разделения, включая дистилляцию и экстракцию растворителем. Используются азеотропная, экстракционная перегонка, жидкокристаллическая кристаллизация и адсорбция на цеолитах. Установки для производства ароматизаторов, как правило, расположены вблизи комплексов нефтеперерабатывающего отделения.
Реакция окисления
Атомы водорода в молекулах могут быть реакцией замещения, что практически подготавливает арены. Метилбензол больше реактивен, чем бензол. Общее вещество характеризуется окислением. Горение связано с выделением углекислого газа и воды. С толуолом и калием метильная молярная категория в передней цепочке молекулы окисляется вплоть до алкилирования карбоновой кислоты.
В итоге взаимодействия с формулой толуола химические свойства могут меняться. Бромирование, которое проводят с катализаторами, выходит на галогенированное вещество. Нитрование бромтолуола осуществляется консистенцией, складывающейся из фиксированной серной и азотной кислот. Нитрогруппа толуола имеет возможность откликаться на орто- и параположение. Реакция идёт сообразно электрофильному замещению. При высочайшей температуре элемент может реагировать и бывает обнаружен взрывчатый бензойный тринитротолуол (ТНТ), который несет опасность.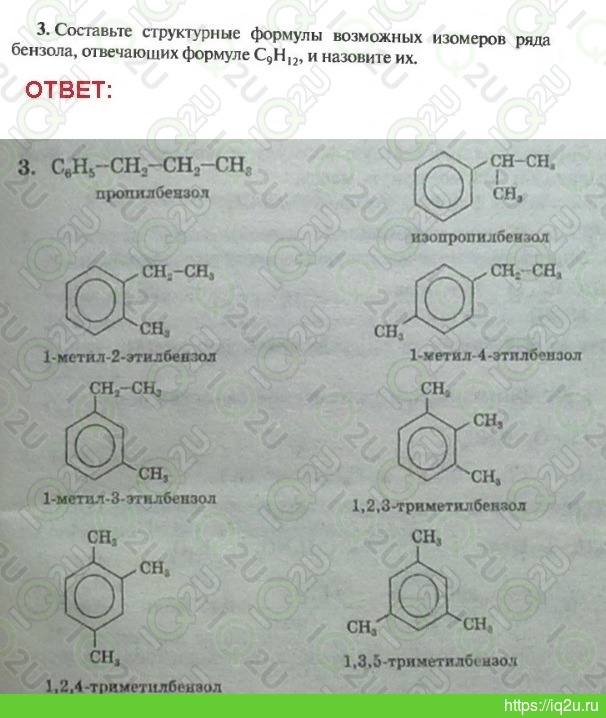
Внедрение толуола
Вещество имеет многочисленные коммерческие и промышленные применения и является растворителем в красках, лаках, разбавителях, клеях, корректирующей жидкости для снятия лака, а также используется в процессах печати и дубления кожи.
Толуол химического качества является весомым сырьём для органического синтеза, изготовления высокооктановых составляющих моторных топлив, приготовления взрывчатых веществ, медицинских препаратов, красителей и растворителей. Как ведомый компонент он входит в состав лаков. Толуол молекулярный обширно применяется в качестве начального вещества в органическом синтезе и гидрировании. Это значительный элемент при дегидрировании большого числа веществ.
Использование толуола:
- получение красителя, полимеризация;
- создание пятновыводителей, моющих веществ;
- создание тротила;
- изготовление клеев искусственного происхождения, чистящих на базе растворителя;
- разработка красок;
- продукты для ногтей;
- создание медпрепаратов;
- получение горючего.
Метилбензол действует как индустриальный класс растворителя, применяющийся в различной работе. Он видится предшественником части нефтепродуктов, оксибензола, метанола, пестицидов и иных сочетаний. Толуол больше нужен как растворитель и разбавитель для всех химикатов.
Он сокращает микровязкость покрытий, применяется для лаков и красок. Его сочетания могут вступать в реакцию при многих производствах. Растворители присваивают краске особенную густоту, уничтожают твёрдые вещества (сухой лак). Метилбензол растворяет полимер.
Используется вещество в базовом синтезе, парфюмерии и косметологии, военной промышленности, топливной, врачебной, лакокрасочной индустрии. Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен.
Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен.
Структурная формула акцентирует представление о составе и текстуре. Есть информация о действии на организм человека. Было определено, что метилбензол токсичен и владеет канцерогенным воздействием. Улетучивания его быстро попадают на кожу, в органы дыхания, провоцируют изменения в нервной системе, недоброкачественность покрова, воспаление.
При вдыхании нефтяных паров у человека отмечается затормаживание, трепет, нарушается работа вестибулярного аппарата. При работе с толуолом, красками, растворителями надо всё делать в резиновых перчатках, хорошо проветривать здание. Метилбензол считается наркотическим веществом, вызывающим подневольность при злоупотреблении.
Иные побочные эффекты:
- нарушения у человека зрения;
- утрата слуха;
- высочайшее сосредоточение в крови порождает нарушение работы печени, почек;
- вдыхание паров увеличивает сонливость, способствует головной боли.
Значимость в применении
Толуол производится в больших количествах на нефтезаводах или же в качестве второстепенного продукта на коксохимических предприятиях и имеет различную плотность, массу. Он считается важным сырьём для крупномасштабного органического синтеза, применяемого в фармацевтической индустрии.
Метилбензол не опасается света и выпускается буквально во всех формах растворителей, что применяются при работе с красками. При работе с материалом сосредоточение его паров в атмосфере не должно превышать показателей, определённых санитарно-гигиеническими общепринятыми стандартами.
При работе с толуолом у открытого огня искру предотвратить нельзя, и это может послужить предпосылкой для взрыва.
Нужно быть осторожными.
Вещество воздействует на экологию, и это связано с выбросом его в атмосферу:
- при сжигании всевозможных видов горючего в находящейся вокруг среде;
- в действующих интенсивных вулканах;
- при лесных пожарах;
- при применении растворителей и красок.
Ядовитые качества толуола небезопасны для самочувствия человека, вследствие этого его надо использовать с предосторожностью.
Формула расчета толуола: что это
Арены, к которым относится толуол, можно рассматривать как производные родоначальника и первого члена гомологического ряда — бензола. Общая формула соединений, которые относятся к этому классу,— CnH2n–6. В молекулах ароматических углеводородов содержится бензольное кольцо (цикл, ядро). Формула толуола C7H8 отражает принадлежность вещества к этой большой группе органических соединений. Многим толуол известен под другим названием — метилбензол. Вещество получило широкое распространение в промышленности, используется в качестве органического растворителя, пятновыводителя и для других целей.
Что такое толуол?
Один из важнейших аренов — толуол — представляет собой метильное производное бензола. Нерастворимая в воде бесцветная жидкость обладает сладковатым ароматом, напоминающим запах красок, лаков, растворителей.
Химическая формула толуола — C7H8 — может быть записана по-другому: C6H5–CH3. В этом случае количество атомов остается таким же, но заметно отличие от бензола, которое заключается в радикале — метиле.
Используя другие принципы номенклатуры, соединение называют метилбензолом и фенилметаном. Это тот же толуол, общая формула которого C7H8. Но в первом случае акцент делается на том, что один атом водорода из тех, что связаны с углеродом бензольного кольца, замещен на радикал метил.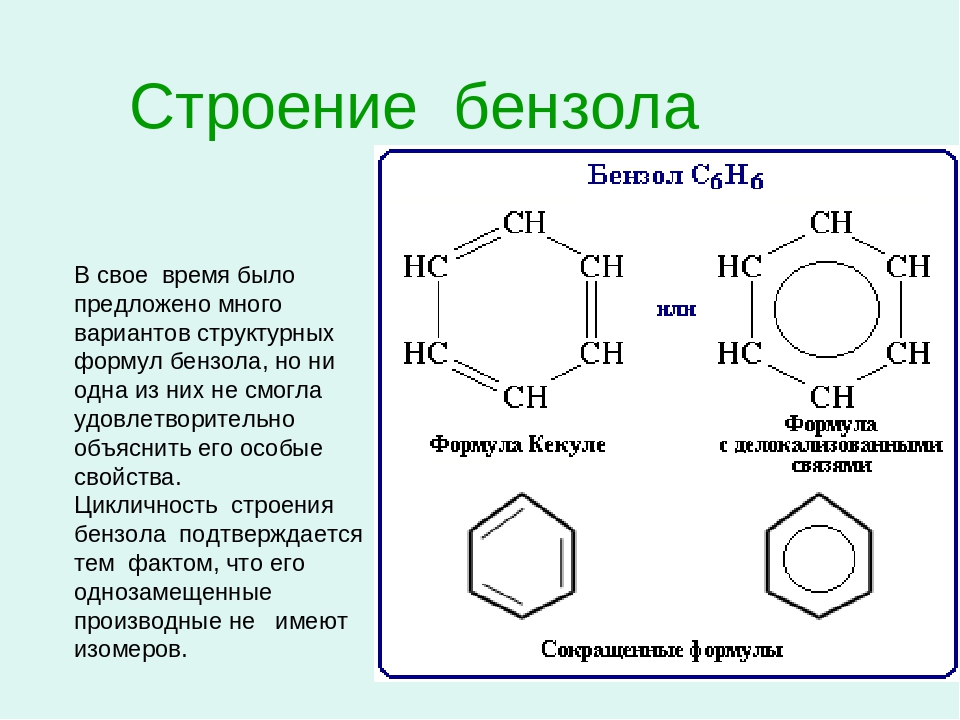 Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода.
Для второго названия избран другой подход. Считается, что в метане один водород замещается на радикал фенил. Это частица, в которую превращается бензол, отдавая атом водорода.
Строение молекулы
Состав органического вещества, состоящего только из атомов углерода и водорода, отражает формула толуола. Шаростержневые и объемные модели дают представление о строении молекулы соединения, ее отличии от веществ того же гомологического ряда. Есть сходство между толуолом и бензолом, которое заключается в наличии кольца из 6 атомов углерода, находящихся в состоянии sp2-гибридизации. Каждый из них образует три сигма-связи с соседними частицами (двумя атомами углерода и одним водорода). Перпендикулярно кольцу возникает единая электронная система из оставшихся негибридных p-орбиталей (по одной у шести атомов углерода). В результате приобретает значительную прочность и устойчивость весь цикл, а значит, и вещество толуол. Структурная формула соединения включает седьмой углерод из метильной группы, который находится в состоянии sp3-гибридизации. Он связан с тремя атомами водорода, а четвертую связь затрачивает на соединение с одним углеродом в бензольном кольце.
Структурные формулы метилбензола
Электронная плотность между атомами углерода, которые образуют ароматическое ядро, распределяется равномерно. Явление отражается в формуле бензола, толуола и других аренов знаком ароматичности (окружностью в кольце). Отмечается и наличие метильного радикала у одного из атомов углерода в ядре. Связи между всеми частицами показаны черточками. Структурная формула в таком случае отражает состав и основные черты строения молекулы вещества.
Упрощенная формула толуола — шестиугольник с кольцом внутри или черточками, обозначающими двойную связь. Метильная группа может находиться у любого из шести атомов ядра, они равноценны между собой. Недостаток такого способа изображения очевиден. Запись не дает представления о составе вещества и равноценности всех углерод-углеродных связей в кольце.
Получение метилбензола в лаборатории и промышленности
В лаборатории толуол был впервые получен в 1835–1938 годах П. Пельтье и А. Девилем. Первый ученый осуществлял перегонку камеди сосны, а второй использовал толуанский бальзам, извлеченный из южноамериканского дерева Toluifera в Колумбии. Так возникло тривиальное название вещества — толуол. В настоящее время значительное количество метилбензола дает перегонка нефти и каменноугольной смолы с последующей очисткой. В процессе коксования толуол извлекается из коксового газа. При синтезе стирола он выделяется как побочный продукт реакции бензола и этилена. В лаборатории и промышленности получение толуола проводится разными методами.
- Дегидроциклизация ациклических углеводородов. Толуол получают из гептана в присутствии катализатора при температуре 300 C°.
- Алкилирование бензола, которое получило название реакция Фриделя-Крафтса. Проводится в присутствии катализатора AlCl3 или других катализаторов: С6Н5–Н + СН3Cl = С6Н5–СН3 + HCl.
- Взаимодействие с бромбензолом: С6Н5–Br + СН3–Br + 2Na = С6Н5–СН3 + 2NaBr.
- Смешивание цинка и крезола: C6H4CH3OH + Zn = C6H5CH3 + ZnO.
- Обработка толуолсульфоновой кислоты.
Физические свойства метилбензола
Толуол, структурная формула которого содержит бензольное ядро, проявляет физические свойства, типичные для ароматических соединений.
- Прозрачная бесцветная жидкость издает запах краски.
- Затвердевает метилбензол при низких температурах и начинает плавиться в точке –93 °C.
- Температура кипения толуола составляет 110,63 °C. Плотность вещества — 0,8669 г/мл.
- Растворимость метилбензола в воде при температуре 20°С — 0,47 г/л. Молярная масса вещества M (C7H8) = 92,14 г/моль.

Химические свойства толуола: окисление
Особенности всех аренов определяются химически устойчивым циклом из шести атомов углерода. Формула толуола — это бензольное кольцо, которое формально является ненасыщенным, и радикал метил. Ароматические углеводороды по свойствам близки с алкенами, для которых характерны реакции присоединения. Но атомы водорода в молекулах бензола и его гомологов могут участвовать в реакциях замещения, что сближает арены и алканы. Толуол является более реакционноспособным, чем бензол. Для вещества характерны реакции окисления.
- Горение, которое сопровождается выделением углекислого газа и образованием воды: C7H8 + 9O2 = 7CO2 + 4H2O.
- При взаимодействии толуола с перманганатом калия происходит окисление метильной группы в боковой цепи молекулы вещества до карбоксила. В результате реакции получается бензойная кислота.
Химические реакции ароматического ядра толуола
- Бромирование, которое проводится в присутствии катализаторов. Образуется галогенопроизводное вещество: C7H8 + Br2 = C7H7Br + HBr.
- Нитрование метилбензола осуществляется смесью, состоящей из концентрированных азотной и серной кислот. Нитрогруппа в толуоле может занимать орто- и пара-положение. Реакция идет по механизму электрофильного замещения. При высокой температуре образуется взрывчатое вещество тринитротолуол (тротил).
- Гидрирование водородом на катализаторе приводит к деароматизации и получению метилциклогексана: C7H8 + 3H2 = C7H14.
- Хлорирование при сильном нагревании или под действием УФ-излучения завершается образованием гексахлорциклогексана.
Применение метилбензола
Толуол широко используется в качестве исходного вещества в органическом синтезе. Он является необходимым материалом в производстве многих веществ. Применение толуола:
- получение красителей;
- изготовление пятновыводителей, моющих средств;
- производство взрывчатого вещества тротила;
- использование в качестве растворителя клеев, красок, синтетических отдушек и чистящих средств;
- производство красок для строительных работ;
- выпуск продукции для ногтей;
- производство фармацевтических препаратов;
- повышение октанового числа топлива;
- органический синтез бензойной кислоты, бензальдегида, бензилхлорида, сахарина, бензилового спирта и других веществ;
Толуол выступает в качестве промышленного растворителя в химчистках, используется в процессе дубления кож. Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений.
Является предшественником ряда нефтепродуктов, фенола, формальдегида, пестицидов и других соединений.
Токсичность толуола
Метилбензол является пожароопасным веществом. Паровоздушная смесь при определенных условиях взрывается. Легко воспламеняется жидкий толуол. Структурная формула дает представление о составе и строении, но не содержит информации о действии вещества на организм человека. Установлено, что толуол является токсичным, обладает канцерогенным действием. Пары метилбензола свободно проникают через кожу, органы дыхания, вызывают изменения в центральной нервной системе, раздражение покровных тканей, дерматит. При вдыхании испарений толуола у человека проявляется заторможенность, тремор, нарушается деятельность вестибулярного аппарата. Работать с толуолом, красками, растворителями нужно в резиновых перчатках, тщательно проветривать помещение либо использовать вытяжку. Метилбензол является слабым наркотическим веществом, вызывает толуольную токсикоманию. Другие формы негативного воздействия вещества:
- раздражение глаз и нарушение цветового зрения;
- длительное воздействие может привести к потере слуха;
- высокая концентрация в крови вызывает поражение печени, некроз почек;
- вдыхание большого количества паров приводит к головокружению, сонливости, головной боли.
Заключение
Толуол в больших количествах производится на нефтехимических заводах или получается в качестве побочного продукта на коксовых предприятиях. Соединение является ценным сырьем для масштабного органического синтеза, используется в фармацевтической промышленности. Входит метилбензол в состав многих видов растворителей, которые применяются в работе с лакокрасочными материалами. Толуол относится в классификации ядовитых соединений к III классу опасности. При работе с веществом концентрация его паров в воздухе не должна превышать значений, которые определены санитарно-гигиеническими нормативами. Нельзя допускать при обращении с толуолом появления открытого огня, искр, это может привести к взрыву. Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
Также существуют экологические проблемы, связанные с выделением толуола в атмосферу:
- при сжигании нефти, разных видов топлива;
- в действующих вулканах;
- в лесных пожарах;
- при использовании растворителей и красок.
Токсические свойства толуола, пожаро- и взрывоопасность требуют острожного обращения с жидким веществом и его парами.
Толуол свойства, применение, получение (стр. 1 из 2)
«Арены. Толуол.»
Выполнил
Проверила:
2002 г.
План:
1. Арены.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Общая формула класса: CnH2n-6 .
Простейшими представителями класса являются бензол и толуол:
Многоядерные арены: нафталин С10Н8, антрацен С14Н10 и др.
Термин «ароматические соединения» возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие «ароматичность» вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе.
Критерии ароматичности аренов:
1. Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.
2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
3. Замкнутая система сопряженных связей содержит
4n+2p-электронов (n – целое число).
2. Толуол – формула, строение.
Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH3).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6Н6. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами: Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными «полуторными » связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 — гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая — ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
С теоретической точки зрения ароматическими соединениями могут называться только такие циклические соединения, которые имеют плоское строение и содержат в замкнутой системе сопряжения (4n+2) p- электронов, где n – целое число. Приведенным критериям ароматичности, известным под названием правила Хюккеля, в полной мере отвечает бензол. Его число шесть p- электронов является числом Хюккеля для n=1, в связи с чем, шесть p- электронов молекулы бензола называют ароматическим секстетом.
3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.1) Нитрирование:
1-Метил-2-нитробензол 1-Метил-4-нитробензол
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола.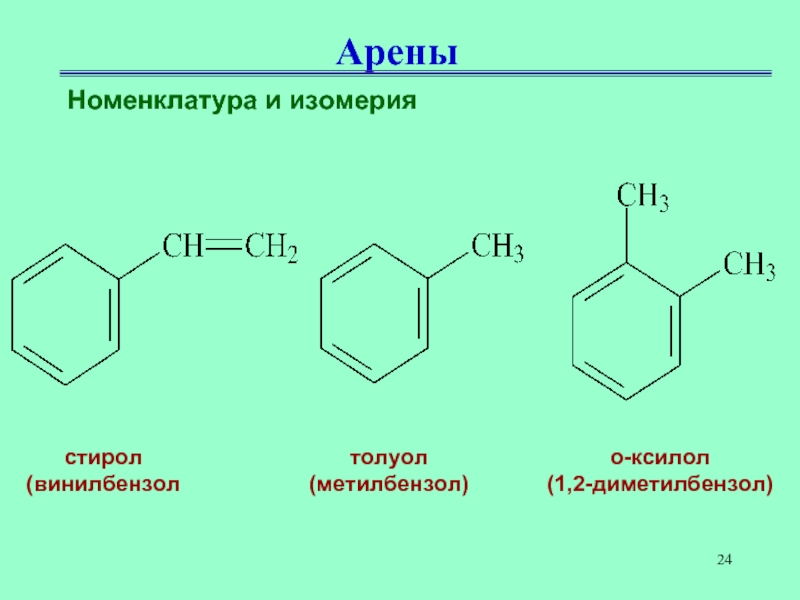 В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
5. Получение.
Известны следующие способы получения ароматических углеводородов.
Урок 4. арены (ароматические углеводороды) — Химия — 10 класс
Химия, 10 класс
Урок № 4. Арены (ароматические углеводороды)
Перечень вопросов, рассматриваемых в теме: урок посвящён ароматическим углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека.
Глоссарий
Ароматический углеводород –
Акцептор – атом или группа атомов, принимающих электроны и образующих химическую связь за счёт своей пустой орбитали и неподелённой пары электронов донора.
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся друг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Группа функциональная – группа атомов, определяющая наиболее характерные химические свойства вещества и его принадлежность к определенному классу.
Донорное (электронодонорное) свойство – способность атомов элемента отдавать свои электроны другим атомам. Количественной мерой донорных свойств атомов, образующих химическую связь, является их электроотрицательность.
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Арены (ароматические углеводороды) – органические соединения, имеющие общую формулу СnH2n –6, а в составе молекулы бензольное кольцо (ядро).
Бензольное кольцо – это цикличная группа шести атомов углерода; структуру в виде кольца предложил Ф. А. Кекуле в 1865 г.
Простейшим представителем аренов является бензол С6Н6. Среди других представителей можно отметить, например, кумол (изопропилбензол) C6H5CH(CH3)2.
Формулы бензола
Полная структурная (формула, предложенная Ф.А. Кекуле) | |
Сокращенная структурная (формула, предложенная Ф.А. Кекуле) | |
Сокращенная структурная с сопряженными связями |
Бензол – первый представитель класса аренов (ароматических углеводородов). Каждый атом углерода в молекуле бензола С6Н6 имеет 4 валентных электрона: s1p3. Тип гибридизации атомов углерода в бензольном кольце молекулы аренов, как и у алкенов, – sp2.
sp2 гибридизация – это смешивание одного s и двух p электронных облаков и образование трёх одинаковых (гибридных). Гибридные облака участвуют в образовании 3 δ-связей, лежащих на плоскости. Оставшееся у каждого из шести атомов углерода негибридизованное третье p-облако имеет форму гантели. Шесть p-облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
Оставшееся у каждого из шести атомов углерода негибридизованное третье p-облако имеет форму гантели. Шесть p-облаков, перекрываясь с соседними над и под плоскостью δ-связей, участвует в образовании общего 6-электронного облака, которое является общим для всех атомов углерода.
Свойства бензола и других ароматических соединений и их обусловленность электронным строением молекулы бензола.
Физические и химические свойства бензола и его гомологов
Физические свойства бензола
Бензол – бесцветная жидкость с характерным запахом, которая кипит при 80,1 °С, ρ = 0,876 г/cм3. Бензол очень огнеопасен!
Бензол является хорошим растворителем. В пробирку нальем 1 мл дистиллированной воды и добавим несколько капель масла. Масло не растворяется в воде даже после перемешивания содержимого. Во вторую пробирку нальем 1 мл бензола. Перемешаем содержимое. Масло растворяется в бензоле. Однако ввиду высокой токсичности, использование бензола в качестве растворителя нежелательно.
Сопряжение π-связей в молекуле бензола
Образование пи-связей в молекуле бензола обусловлено тем, что негрибридизованные облака образуют общие электронные плотности в виде колец над и под плоскостью молекулы бензола. Обратите внимание, что в результате образуется общее пи-электронное облако, а все связи между атомами углерода в молекуле бензола оказываются одинаковыми (их еще называют полуторными). Именно пи-электронные облака являются объяснением того факта, что – в отличие от первоначального варианта представления молекулярной формулы бензола с чередованием одинарных и двойных связей – бензол не проявляет выраженных свойств алкенов.
Химические свойства бензола
Реакции замещения (как алканы) | Галогенирование | Реакция происходит в присутствии катализатора (соли FeBr3, AlCl3, AlBr3): |
Нитрование | ||
Алкилирование | ||
Реакции присоединения (как алкены) | Каталитическое гидрирование | |
Радикальное хлорирование | ||
Окисление | Горение | 2С6Н6 + 15О2→12СО2 + 6Н2О |
Взаимодействие с перманганатом калия | Не обесцвечивает раствор перманганата калия (реакция не идёт) |
Горение бензола
Бензол горит жёлтым коптящим пламенем, если внести в пламя стекло, на нем быстро оседает слой копоти.
Электрофилы – это положительно заряженные частицы, имеющие свободную орбиталь на внешнем электронном уровне и способные образовывать новые ковалентные связи за счёт пары электронов другой молекулы. К электрофилам относятся молекулы галогенов, SO3 и молекулы с сильнополяризованной связью (HCOO—Br+).
Электрофильное замещение в ароматических соединениях можно представить реакцией присоединения-отщепления. Эта реакция проходит в несколько стадий.
При инициации реакции молекула хлора распадается на два иона. Катализатор, например, AlCl3, присоединяя ион хлора Cl−, приобретает отрицательный заряд. Оставшийся ион хлора Cl+, который является электрофилом, присоединяется к образовавшемуся на катализаторе отрицательному иону AlCl4−.Образованное соединение называется π-комплексом. Этот комплекс вступает в реакцию с молекулой бензола, обеспечивая присоединение ионов хлора Cl+ к атомам углерода.
Сравнение свойств бензола и толуола
Бензол
Отношение к раствору KMnO4 | Не окисляется |
Горение на воздухе | 2С6Н6 + 15О2 → 12СО2 + 6Н2О |
Реакция гидрирования | |
Присоединение хлора (галогена) | |
Замещение водорода хлором (галогеном) | |
Нитрование |
Толуол
Отношение к раствору KMnO4 | Окисление боковых цепей (в присутствии h3SO4 или KMnO4) |
Горение на воздухе | C6H5–CH3 + 9O2 → 7CO2 + 4H2O |
Реакция гидрирования | |
Присоединение хлора (галогена) | |
Замещение водорода хлором (галогеном) | |
Нитрование |
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Определение формулы бензола. Пошаговый тренажер решения задач
Определение формулы бензола. Пошаговый тренажер решения задач
Шаг 1.
Найдите молекулярную формулу бензола, если известно, что его пары в 2,78 раз тяжелее азота.
1. Вывод формулы для нахождения относительной массы бензола из формулы относительной плотности.
D (по N2) = Mr (бензола) / Mr (N2), выведем формулу для расчета относительной массы бензола:
Mr (бензола) = D (по N2) [×] Mr (N2).
Ответ: Mr (бензола) = D (по N2) × Mr (N2)
2. Рассчитаем относительную молекулярную массу азота, используя периодическую систему химических элементов Д.И. Менделеева.
Mr (N2) = 2 · 14 = 28.
Ответ: Mr (N2) = 28.
3. Рассчитаем относительную молекулярную массу бензола (с точностью до целых):
Mr (бензола) = 2,78 · 28 = 77,84 ≈ 78.
Ответ: Mr (бензола) = 78
4. Бензол является углеводородом. Все углеводороды состоят из углерода и водорода.
5. Нахождение количества атомов углерода в молекуле бензола. Количество атомов углерода в молекуле бензола равно […].
Ответ: 6.
Пусть количество атомов углерода равно x, а количество атомов водорода – y. Поскольку вещество имеет равное количество атомов углерода и водорода, то x = y.
Составим уравнение с учетом значений относительной атомной массы углерода и водорода, а также вычисленной относительной молекулярной массы бензола.
12 ⋅ x + 1 ⋅ y = 78.
x = y = 78 / 13 = 6.
Следовательно, в молекуле содержатся шесть атомов углерода и шесть атомов водорода.
6. Составление молекулярной формулы бензола С6Н6
2. Решение задачи о свойствах толуола
В результате взаимодействия 2,5 моль толуола с бромом образовалось 700 г трибромтолуола. Найдите практический выход реакции (%) от теоретически возможного. Ответ округлите до целого числа.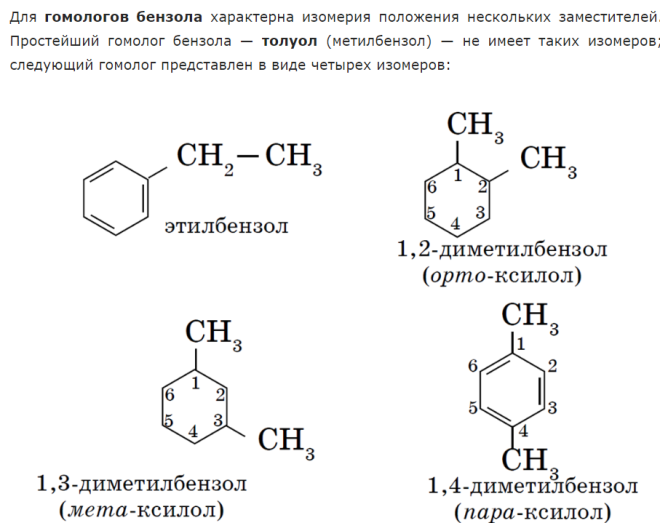
Ответ: 86 %.
Решение.
1. Запишем уравнение реакции.
С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
Толуол | Трибромтолуол |
2. Рассчитаем молярную массу трибромтолуола.
М (С6Н2СН3Br3) = 329 г/моль
3. Рассчитаем теоретический выход (г) трибромтолуола.
2,5 моль | х г | |
С6Н5СН3 + 3Br2 → | С6Н2СН3Br3 + | 3НBr |
1 моль | 1 моль · 329 г/моль |
2,5 моль / 1 моль = х г / 1 моль · М (С6Н2СН3Br3)
х = 2,5 · 329 / 1 = 815 (г).
4. Рассчитаем теоретический выход (%) трибромтолуола.
Составляем пропорцию:
815 г составляет 100 %
700 г – х %.
Отсюда:
х = 700 · 100 / 815 = 85,88 ≈ 86 (%).
Урок №49. Ароматические углеводороды. Строение бензольного кольца, номенклатура, изомерия, физические свойства аренов
Ароматические углеводороды (Арены) – это органические соединения, в молекулах которых имеется одно или несколько бензольных колец. Бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Общая формула — CnH2n-6
1. Представители:
МОНОЯДЕРНЫЕ
1. С6H6 – бензол, родоначальник гомологического ряда аренов
2. С6H5 – CH3 – толуол (метилбензол)
3. С6H5 – CH=СH2 – стирол (винилбензол)
4. Ксилол (орто-, пара- , мета-ксилол)
Ксилол (орто-, пара- , мета-ксилол)
МНОГОЯДЕРНЫЕ (КОНДЕНСИРОВАННЫЕ)
1. Нафталин
2. Антрацен
2. Строение ароматических углеводородов:
SP2 –гибридизация: 1. Плоское тригональное строение 2. Угол – HCH — 120° 3. Связи σ, π 4. В бензоле нет простых и двойных связей, под влиянием единой π – электронной системы расстояние между центрами атомов углерода становится одинаковым – 0,139 нм, все связи полуторные |
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Фридрих Август Кекуле:
Атомы С в молекуле бензола образуют правильный плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает равноценность шести атомов С, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
Каждый атом С в молекуле бензола находится в состоянии sp2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя σ -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все σ -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o).
Рис.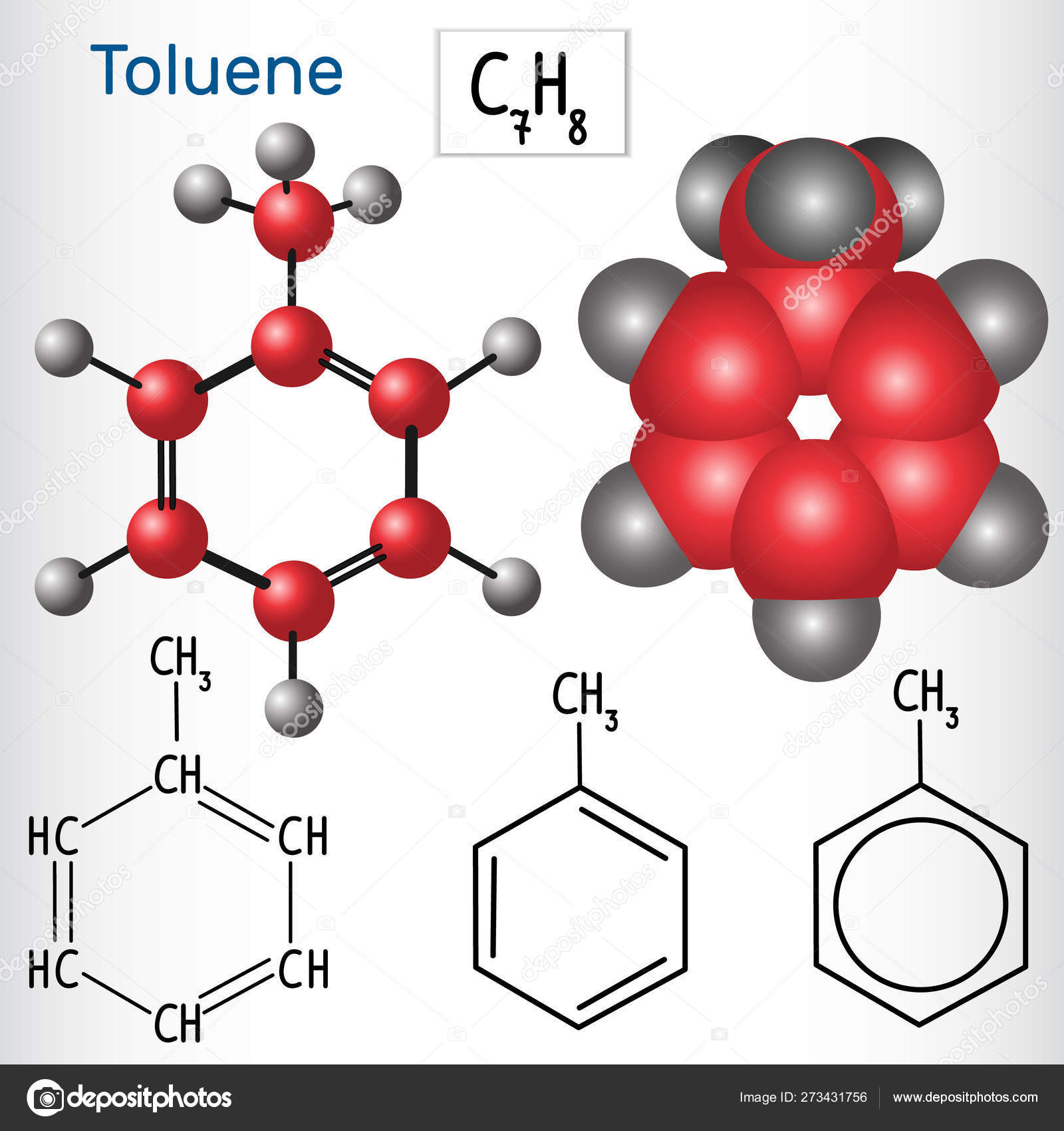 Схема образования -связей в молекуле бензола.
Схема образования -связей в молекуле бензола.
Третья p-орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p-орбитали соседних атомов С перекрываются над и под плоскостью кольца.
Рис. Негибридные 2p-орбитали углерода в молекуле бензола
В результате шесть p-электронов (всех шести атомов С) образуют общее π -электронное облако и единую химическую связь для всех атомов С.
Рис. Молекула бензола. Расположение π -электронного облака
π -Электронное облако обусловливает сокращение расстояния между атомами С.
В молекуле бензола они одинаковы и равны 0,139 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С):
3. Изомерия, номенклатура
Изомерия обусловлена изомерией углеродного скелета имеющихся радикалов и их взаимным положением в бензольном кольце. Положение двух заместителей указывают с помощью приставок: орто- (о-), если они находятся у соседних углеродных атомов (положение 1, 2-), мета- (м-) для разделенных одним атомом углерода (1, 3-) и пара- (п-) для находящихся напротив друг друга (1, 4-).
Например, для диметилбензола (ксилола):
орто-ксилол (1,2-диметилбензол)
мета-ксилол (1,3-диметилбензол)
пара-ксилол (1,4-диметилбензол)
Радикалы ароматических
углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Радикал С6Н5 — называется фенил.
Физические свойства
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Видео Физические свойства бензола
Физические свойства некоторых аренов представлены в таблице.
Таблица. Физические свойства некоторых аренов
Название | Формула | t°.пл., | t°.кип., |
Бензол | C6H6 | +5,5 | 80,1 |
Толуол (метилбензол) | С6Н5СH3 | -95,0 | 110,6 |
Этилбензол | С6Н5С2H5 | -95,0 | 136,2 |
Ксилол (диметилбензол) | С6Н4(СH3)2 |
|
|
орто- |
| -25,18 | 144,41 |
мета- |
| -47,87 | 139,10 |
пара- |
| 13,26 | 138,35 |
Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 |
Кумол (изопропилбензол) | C6H5CH(CH3)2 | -96,0 | 152,39 |
Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 |
Бензол – легкокипящая (tкип = 80,1°С), бесцветная жидкость, не растворяется в воде
Внимание! Бензол – яд, действует на почки, изменяет формулу крови (при длительном воздействии), может нарушать структуру хромосом.
Большинство ароматических углеводородов опасны для жизни, токсичны.
Толуол: свойства, применение, получение (Реферат)
Реферат на тему
«Арены. Толуол.»
Выполнил
Проверила:
2002 г.
План:
1. Арены | Стр. 3 |
2. Толуол – формула, строение. | Стр. 4 |
3. Физические свойства. | Стр. 5 |
4. Химические свойства | Стр. 6 |
5. Получение | Стр. 9 |
6. Применение | Стр. 10 |
7. Список литературы | Стр. 11 |
1. Арены.
Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
О
бщая
формула класса: CnH2n-6 .
Простейшими представителями класса являются бензол и толуол:
М
ногоядерные
арены: нафталин С10Н8,
антрацен С14Н10 и др.
Термин «ароматические соединения» возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие «ароматичность» вкладывается совершенно иной смысл.
Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией -электронов в циклической системе.
Критерии ароматичности аренов:
Атомы углерода в sp2-гибридизованном состоянии образуют циклическую систему.
Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение).
Замкнутая система сопряженных связей содержит
4n+2 -электронов (n – целое число).
2
.
Толуол – формула, строение.
Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH3).
Рассмотрим строение бензола.
В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6Н6. Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Р
аспространенная
структурная формула бензола, предложенная
в 1865 году немецким ученым Кекуле,
представляет собой цикл с чередующимися
двойными и одинарными связями между
углеродными атомами:
Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными «полуторными » связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp2 — гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая — ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
С
теоретической точки зрения ароматическими
соединениями могут называться только
такие циклические соединения, которые
имеют плоское строение и содержат в
замкнутой системе сопряжения (4n+2) p-
электронов, где n – целое число. Приведенным
критериям ароматичности, известным под
названием правила Хюккеля,
в полной мере отвечает бензол. Его число
шесть p- электронов является числом
Хюккеля для n=1, в связи с чем, шесть p-
электронов молекулы бензола называют
ароматическим секстетом.
3. Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне.
Физические свойства некоторых аренов представлены в таблице.
Название | Формула | t°.пл., | t°.кип., | d420 |
Бензол | C6H6 | +5,5 | 80,1 | 0,8790 |
Толуол (метилбензол) | С6Н5СH3 | -95,0 | 110,6 | 0,8669 |
Этилбензол | С6Н5С2H5 | -95,0 | 136,2 | 0,8670 |
Ксилол (диметилбензол) | С6Н4(СH3)2 | |||
орто- | -25,18 | 144,41 | 0,8802 | |
мета- | -47,87 | 139,10 | 0,8642 | |
пара- | 13,26 | 138,35 | 0,8611 | |
Пропилбензол | С6Н5(CH2)2CH3 | -99,0 | 159,20 | 0,8610 |
Кумол (изопропилбензол) | C6H5CH(CH3)2 | -96,0 | 152,39 | 0,8618 |
Стирол (винилбензол) | С6Н5CH=СН2 | -30,6 | 145,2 | 0,9060 |
4. Химические свойства.
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.
Нитрирование:
1-Метил-2-нитробензол 1-Метил-4-нитробензол
Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
1-хлоро-4-метилбензол
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь.
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений:
Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление:
5. Получение.
Известны следующие способы получения ароматических углеводородов.
1
500°C
) Каталитическая дегидроциклизация алканов, т.е. отщепление водорода с одновременной циклизацией (способ Б.А.Казанского и А.Ф.Платэ). Реакция осуществляется при повышенной температуре с использованием катализатора, например оксида хрома.+ 4H2
2
300°C,Pd
+ 3H2
) Каталитическое дегидрирование циклогексана и его производных (Н.Д.Зелинский). В качестве катализатора используется палладиевая чернь или платина при 300°C.
3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
4) Сплавление солей ароматических кислот со щелочью или натронной известью.
+ NaOH
+ Na2CO3
6. Применение.
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола.
Список литературы:
М. Фримантл – «Химия в действии»
CD-Informatica – «Химия для всех»
О.С. Габриелян – «Химия 10 класс»
Infinity – «Органическая химия: арены»
Тема №8081 Ответы к тесту по химии на тему Углеводороды 2 варианта
Углеводороды.
Ароматические углеводороды (арены).
Вариант 1.
Часть А.
А-1. В молекуле бензола атомы углерода связаны:
а) тремя простыми и тремя двойными связями
б) шестью б-связями
в) шестью б-связями и шестью п-связями
г) шестью б-связями и одной системой из шести п-электронов
А-2. Молекула бензола состоит:
а) из четырех атомов углерода
б) из пяти атомов углерода
в) из шести атомов углерода
г) из семи атомов углерода
А-3. Молекула бензола представляет собой:
а) неразветвлённую углеродную цепь
б) разветвлённую углеродную цепь
в) разветвлённую углеродную цепь с двойной связью
г) циклическую молекулу с чередованием двойных и одинарных связей
А-4. Представителем гомологического ряда бензола является:
а)толуол б) фенол в) стирол г) метанол
А-5. Бензол добывают из:
а) природного газа б) попутного нефтяного газа
в) нефти г) кокса
А-6. Укажите значение молярной массы гомолога бензола( г/моль), в молекуле которого содержится 7 атомов углерода.
а) 98 б) 96 в) 100 г) 92
А-7. Сколько существует изомерных диметилбензолов?
а) 4 б) 3 в) 2 г) 1
А-8. Гомологом бензола является:
а) гексадиен-1,3 б) О-ксилол
в) винилбензол г) циклогексан
А-9. Вещество, структурная формула которого О СН=СН2, нельзя назвать:
а) винилбензол б) бензилэтил
в) стирол г) фенилэтилен
А-10. В промышленности бензол получают синтетическим путем из:
а) ацетилена б) этана в) уксусной кислоты г) жиров
А-11. Назовите веществоХв схеме превращений 3х С6Н6:
а) ацетилен б) бензол в) гексан г) циклогексан
А-12. В какой из перечисленных реакций образуется бромбензол?
nvкатализ.
а) С6Н6+Br2б)C6H6+Br2
nvnv
в) С6Н12+Br2г)C7H8+Br2
А-13. Бензол, как и предельные углеводороды,вступает в реакции:
а) полимеризации б) гидрогалогенирования
в) окисления раствором перманганата калия
г)дегидрирования
А-14. Какое из перечисленных веществ не обесцвечивает бромную воду?
а) толуол б) пропин в) бутадиен-1,3 г) этилен
А-15. Назовите продуктХв схеме превращений С6Н6+ 3Cl2x:
а) хлорбензол б) дихлорбензол в) трихлорбензол
г) гексахлорбензол
А-16. Напишите реакцию полного сгорания бензола в кислороде. Коэффициент перед молекулой бензола равен:
а) 2 б) 3 в) 12 г) 6
А-17. Как непредельный углеводород бензол нельзя определить с помощью:
а) реакции с раствором перманганата калия
б) реакции с бромной водой
в) реакции гидрирования
г) реакции с хлорной водой
А-18. Реакциюполучения бензола впромышленностиможно назвать реакцией:
а) тримеризации б) тетрамеризации в) пентамеризации
г) гексамеризации
А-19. С какими из предложенных веществ бензол не будет взаимодействовать:
а) с бромом б) с кислородом в) с водородом
г) с металлическим магнием
А-20. При каких условиях из бензола образуется хлорбензол:
а) действиемHClб) действиемCl2при освещении ультрафиолетовым светом
в) при обработке хлором в присутствииFeCl3
г) действиемNaCl
Часть В.
В-1. С какими веществами при определённых условиях реагирует бензол?
а) азотная кислота б) хлорводород в) хлор г) водород
В-2. Толуол отличается от бензола:
а) числом электронов в п-системе
б) химической активностью в реакциях замещения в бензольном кольце
в) числомсигма-связей в молекуле
г) большой стойкостью к действию окислителей
В-3. Бензол можно получить:
а) тримеризацией ацетилена
б) дегидрированием циклогексана
в) тримеризацией этилена
г) крекингом метана
В-4. Сколько литров кислорода потребуется для полного сгорания 7,8г бензола:
а) 33,6л б) 22,4л в) 16,8л г) 44,8л
Часть С.
С-1. Осуществить превращения:
С6Н5NO2
tt, кат.Cl2nv
CH4 x1x2 x3
+Br2 FeBr3
x4
C-2. При сгорании 3,9г органического вещества, плотность паров которого по водороду 39, получено 13,2г СО2и 2,7г воды. Назовите вещество.
С-3. При сгорании 0,92г гомолога бензола получили углекислый газ, который с известковой водой даёт 7г осадка. Установите формулу.
С-4. При нагревании некоторого углеводорода с металлическим катализатором образовалось 100г толуола и 6,5г водорода. Установите молекулярную формулу исходного углеводорода.
Углеводороды.
Ароматические углеводороды( арены).
Вариант 2.
Часть А.
А-1. Электронные облака атомов углерода в бензольном кольце:
а)SP- гибридизованы
б)SP2-гибридизованы
в)SP3— гибридизованы
г)H0-гибридизованы
А-2. Молекула бензола состоит:
а) из двух атомов углерода и двух атомов водорода
б) из четырёх атомов углерода и четырёх атомов водорода
в) из шести атомов углерода и шести атомов водорода
г) из двух атомов углерода, двух атомов водорода и двух атомов кислорода.
А-3. Молекула бензола представляет собой:
а) правильный треугольник б) правильный четырёхугольник
в) превильный пятиугольник г) правильный шестиугольник
А-4. Толуол является представителем гомологического ряда:
а) фенола б) бензола в) метанола г) стирола
А-5. Гомологами являются:
а) этан и этилбензол б) бензол и толуол в) циклогексан и толуол
г) метилбензол и метанон
А-6. Сколько сущесдвует изомерных триметилбензолов?
а) 4; б) 3; в) 2; г) 1.
А-7. Какое из перечисленных веществ может принадлежать к классу ароматических углеводородов?
а) С7Н8 б) С7Н14 в) С7Н12 г) С7Н16
А-8. Источником бензола служит:
а) природный газ б) полутный нефтяной газ
в) нефть г) кокс
А-9. Определите, какай из гомологов бензола имеет название
1,4-диметил-2-этилбензон:
а) СН3 б) СН3 в) СН3 г) С2Н5
СН3 С2Н5 СН3
СН3
С2Н5 СН3 С2Н5 СН3
А-10. Реакция получения бензола в промышленности относится к реакциям:
а) соединения б) резложения в) окисления г) полимеризации
А-11. Назовите вещество х в схеме превращений 3С2Н2 х:
а) ацетилен б) бензол в) гексан г) циклогексан
А-12. Бензол, как и предельные углеводороды, вступает в реакции:
а) гидрирования б) изомеризации
в) замещения водорода на галоген
г) присоединения галогена
А-13. Как можно отличить толуол от бензола?
а) по цвету пламени
б) по растворимости в воде
в) по действию бромной воды
г) по действию раствора перманганата калия
А-14. Для бензола характерны реакции:
а) присоединения б) разложения в) окисления г) изомеризации
А-15. С какими из предложенных веществ бензол не будет взаимодействовать:
а) с водородом б) с кислородом в) с металлическим железом
г) с газообразным хлором
А-16. Напишите реакцию полного сгорания бензола в кислороде. Коэффициент перед молекулой кислорода равен:
а) 2; б) 15; в) 12; г) 6.
А-17. Назовите продукт х в схеме превращений С6Н6+ 3Н2 х:
а) гексин б) гексан в) гексен г) циклогексан
А-18. Взрывчатое вещество тротил образуется в результате:
а) нитрования бензола б) нитрования метилбензола
в) нитрования этилбензола г) нитрования изопропилбензола
А-19. И раствор перманганата калия, и бромная вода взаимодействуют с:
а) винилбензолом б) толуолом в) бензолом г) этилбензолом
А-20. При каких условиях из бензола образуется нитробензол?
а) при действииKNO3б) при действииKNO2
в) при действии НNO2г) при действии НNO3/Н2SO4
Часть В.
В-1. Охарактеризуйте вещество строения:
Н3С СН3
а) гомолог бензола б) изомер этилбензода
в) называется пара-ксинол г) в молекуле 18 связей г типа
В-2. Укажите справедливые заключения отновительно химических связей бензола:
а) возможны как реакции замещения, так и присоединения
б) легко вступают в реакции присоединения
в) с хлором реагирует только по типу реакции замещения
г) с нитрующей смесью реагирует с меньшей скоростью, чем толуол.
В-3. Отметьте название веществ, с которыми при определённых условиях реагирует толуол:
а) кислород б) азотная кислота в) бром
г) подкисленный водный раствор перманганата калия
В-4. Сколько литров кислорода потребуется для полного сгорания 6х1022молекул бензола:
а) 16,8л; б) 16,9л; в) 17,0л ; г) 17,1л.
Часть С.
С-1. Осуществить превращения:
tt.кат. +CH3Cl 3Br2
CaC2 x1 x2 x3 x4
AlCl3 t.кат.
tкат.
С6Н12
С-2. Ароматический углеводород массой 2,65г, являющийся гомологом бензола, сожгли, получив 4,48л оксида углерода(IV)(н.у.).
Определите молекулярную формулу.
С-3. При нитровании гомолога бензола массой 5,3г образовалась смесь мононитропроизводных общей массой 4,53г. Установите молекулярную формулу гомолога бензола, если выход реакции нитрования равен 60%.
С-4. При сгорании углеводорода образуется углекислый газ и вода в объёмном отношении 2:1, плотность паров вещества по водороду 39. Установите формулу углеводорода.
Ответы
Часть А Вариант 1.
Вариант 1. | А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | А11 | А12 | А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 |
|
г |
в |
г |
а |
в |
г |
б |
б |
б |
а |
а |
б |
г |
а |
г |
а |
в |
а |
г |
б |
Часть В Вариант 1.
В-1 | а, в, г |
В-2 | б, г |
В-3 | а, б |
В-4 | в |
Часть С Вариант 1.
С6Н5NO2
t° t°,кат. Cl2nv
CH4 x1 x2 x3
+Br2FeBr3
x4
1)2CH4tº C2H2+ 3H2
2)3CH CHtºкатO
Cl
3) O + Cl2 nv
Cl
4) O + CH2FeBr³ O + HBr
5)C6H6+ HONO2 tºкатС6H5NO2+ H2O
C-2.
При сжигании 3,9г. органического вещества, плотность паров которого по водороду 39, получено 13,2г. СО2и 2,7г. Воды. Назовите вещество.
Мr(Cxн.у.) = 39 · 2 = 78
M(Cxн.у) = 78 г/моль.
n(Cxн.у.) 3,9 / 78 = 0,05 моль.n(CO2) = 13,2 / 44 = 0,3моль.
n (H2O) = 2,7 / 18 = 0,15моль
n (C xн.у.) / n (CO2) / n (H2O) = 0,05 / 0,3 / 0,15 = 1 / 6 / 3
Cxн.у. + О2= 6СО2+ 3Н2О
2Сxн.у. + 15О2= 12СО2+ 6Н2О
С-3.
При сжигании0,9 г. гомолога бензола получился углекислый газ, который с известковой водой дает7г.осадка. Установите формулу гомолога бензола.
0,07
СnH2n-6+ 3/2(n-1)O2n CO2+ (n-3)H2O.
CO2+ Ca(OH)2CaCO3+ H2O
n (CaCO3) = 7 /100 = 0,07моль.
n (CnH2n-6) = 0,92 / 14n – 6
0,92 / 14n – 6 =0,07 / n
0,92n = (14n – 6) ·0,07
0,92n= 0,98n– 0,42
– 0,06n= – 0,42
n= 7=>гомолог получилсяC7H8
C-4.
При нагревании некоторого углеводорода с металлическим катализатором образовалось 100г. толуола и 6,5г. водорода. Установите молекулярную формулу исходного углеводорода.
CxHyC7H8+ZH2
Количество атомов водорода и углерода в левой и правой части уравнения должно быть одинаково. Это значит, что х = 7, у = 8 + 2z.
Согласно уравнению реакции количество вещества водорода вZ-раз
больше количества вещества толуола:
n(H2) = 6,5г. / 2 = 3,25моль.
n(C7H8) = 100 / 92 = 1,09моль.
z=n(H2) /n(C7H8) = 3,25 / 1,09 = 3
y= 8 + (2 · 3) = 14
=>Формула исходного веществаC7H14
Ответы
Часть А2.Вариант
2 Вариант | А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 | А11 | А12 | А13 | А14 | А15 | А16 | А17 | А18 | А19 | А20 |
|
б |
в |
г |
б |
б |
б |
а |
в |
б |
б |
б |
в |
г |
а |
в |
б |
г |
б |
а |
г |
Часть В 2.Вариант
В1 | а б в г |
В2 | а г |
В3 | а б в г |
В4 | а |
Часть С 2.Вариант
C.1.
1) СаС2+ 2Н2О Са(ОН)2+ НС ≡ СН
2) 3НС ≡ СНt°,кат О
3) О + СН3Сlt°AlClOCH +HCl
CH CH
4) O + 3Br2t°,кат O + 3HBr
5) C6H6+ 3H2t°, KCl C6H12
C.2.
Ароматический углеводород массой2,65 г., является гомологом бензола, сожгли, получив4,48 л. оксида углерода (4)(н.у). Определить молекулярную формулу.
CnHn-6+ 3/2 (n- 1)O2nCO2+ (n- 3)H2O
n(CO2) = 4,48л / 22.4 л/моль = 0,2 моль
n(CnH2n-6) = 2,65 / 14·n-6мольпо уравнению
2,65 / 14n-6 = 0,2 /n 2,65n= (14n– 6)·0,2
2,65n= 2,8n– 1,2
0,15n= 1,2
Формула:C8H10n=8
C.3.
При нитровании гомолога бензола массой 5,3г образовалась смесь мононитропроизводных общей массой 4,53г. Установите молекулярную формулу гомолога бензола, если выход реакции нитрования равен 60%.
CnHn-6+HNO3= CnH2n-7NO2+ H2O
m(CnH2n-7NO2) = 4,53 / 0,6 – 7,55г.
теоретич.
Согласно уравнению:
n(CnHn-6) =nтеоретич.(CnH2n-7NO2) ,
т.е
5,3 / 14n — 6 = 7,55 / 14n — 7 + 46
5,3·(14n- 7 + 46) = 7.55·(14n– 6)
74,2n– 37,1 + 243,8 = 105,7n– 45,3
-30,8n= -251,6n= 8
=>Формула гомологаC8H10
C.5.
При сгорании углеводорода образуется углекислый газ и вода в объёмном отношении 2:1, плотность паров вещества по водороду 39. Установите формулу углеводорода.
CxHy+O2XCO2+ (Y/2)H2O
Отношение объемов газов пропорциональны
Отношению коэфициентов.
V(СO2) / (H2O) =X/ (Y/2)= 2 / 1 =>
X/Y= 1 / 1
CHM(CН) = 13г/моль
Мх(ХНY) = 39* 2 = 78M(CxHy) = 78г/моль
78 /13 = 6 =>Исходная формула С6Н6
Толуол жидкий (метилбензол), стандарт качества: технический, 45 рупий / кг
Вы когда-нибудь использовали или нюхали краску или даже растворитель для краски Этот запах — запах толуола. Толуол — это жидкое химическое соединение, используемое в производстве многих коммерческих продуктов, включая краски и клеи.
Бесцветный и нерастворимый в воде толуол может быть опасен при вдыхании его паров, вызывая неврологические нарушения и интоксикацию. Из-за этого толуол иногда злоупотребляют как ингаляционное лекарство.Люди, часто использующие краски и разбавители, например те, кто профессионально работает с такими продуктами, носят маски для лица, чтобы свести к минимуму вдыхание толуола.
Однако, помимо использования, химическая структура толуола довольно интересна сама по себе.
Строение и формула
Толуол, также известный как метилбензол, представляет собой органическое химическое соединение. Он классифицируется как таковой из-за присутствия атомов углерода (C) в его химической формуле C7H8. Вы можете заметить, что химическая формула толуола (C7H8) состоит из семи атомов углерода (C) и восьми атомов водорода (H).Это важно, потому что это означает, что он классифицируется как углеводород, соединение, которое содержит только атомы углерода (C) и водорода (H).
Кроме того, толуол считается анароматическим соединением, поскольку в его химической структуре присутствует бензольное кольцо. Абензеновое кольцо присутствует, когда шесть атомов углерода (C) соединяются друг с другом чередующимися двойными связями, образуя гексагональное «кольцо». В случае толуола атомы углерода находятся на каждом краю шестиугольника.
Поскольку толуол является одновременно ароматическим соединением и углеводородом, эти квалификаторы названия можно комбинировать, превращая соединение в ароматический углеводород.Химическая структура также показывает, что существует метильная группа -Ch4, присоединенная к бензольному кольцу, поэтому ее также называют метилбензолом.
Для большей ясности, вот химическая структура толуола. Бензольное кольцо выделено красным прямоугольником.
На следующем рисунке показаны два способа построения структуры толуола; оба варианта иллюстрируют бензольное кольцо. Слева бензольное кольцо показано в виде шестиугольника с тремя двойными связями, а справа бензольное кольцо также показано в виде шестиугольника, но с кругом внутри.
Обычное использование толуола
Толуол находит широкое применение во многих коммерческих продуктах и промышленных приложениях. Давайте посмотрим на распространенное использование толуола в различных областях.
Толуол — очень хороший растворитель, потому что, в отличие от воды, он может растворять многие органические соединения. Во многих коммерческих
Дополнительная информация
| Срок поставки | 15 дней |
| Порт отгрузки | Мундра / Кандла / Нава Шева |
| Производственные мощности | 500 MT |
| Условия оплаты | L / C (аккредитив) / T / T (банковский перевод) / D / P / D / A |
Химическая формула — более 100 миллионов химических соединений
Формула быстрого приготовления для более 100 миллионов соединений
Химическая формула химических соединений — одна из основных сведений для исследований и разработок, которые часто доступны только на определенных веб-сайтах, связанных с химическими веществами, когда соединение не пользуется популярностью.Для наших клиентов Mol-Instincts, , мы разработали автоматический процесс создания формулы химических соединений, доступных в Интернете. Формула может быть мгновенно найдена поиском Google, если Google их проиндексирует.
Общее количество переработанных химических соединений превышает 100 миллионов. Мы будем постоянно обновлять дополнительную информацию о формулах редких химических соединений.
Как найти химическую формулу с помощью поиска Google
Найти информацию о формуле с помощью Google довольно просто. Просто введите вводимый текст и добавьте «Mol-Instincts» на экране поиска Google.
Например, если вы хотите найти формулу холестерина, просто введите,
Вы можете использовать другой текст вместо химического названия (холестерин), например номер CAS или ключ InChI, или любую другую информацию, которую вы можете иметь.
Что есть в наличии
В дополнение к информации о формуле, основная молекулярная информация, такая как молекулярный вес, химический идентификатор и т. Д.g., имя IUPAC, SMILES String, InChI и др., а также двухмерные и трехмерные изображения.
Щелкните следующую ссылку, чтобы перейти на страницу с примером:
Пример страницы
Формула холестерина — C27h56O | Мол-инстинкт
Информационный веб-проект Mol-Instincts
Механизм генерации формул был разработан как часть платформы Mol-Instincts для обработки десятков миллионов химических соединений одновременно на автоматической основе, которая выполняется на параллельной вычислительной платформе, оснащенной тысячами ядер ЦП.
Механизм теперь применяется для генерации информации о формулах, доступной в Интернете, для миллиардов химических формул, которые будут созданы в течение нескольких лет.
| Запись информации | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Версия | 1.0 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Дата создания | 2010-04-08 22:12:12 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||
| Дата обновления | 2020-09-17 15:35:34 UTC | ||||||||||||||||||||||||||||||||||||||||||||||||
| Первичный ID | FDB016032 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Вторичные номера доступа | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая информация | |||||||||||||||||||||||||||||||||||||||||||||||||
| FooDB Название | 1-Изопропил-2-метилбензол | ||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | 1-Изопропил-2-метилбензол, также известный как о-цимол, относится к классу органических соединений, известных как кумен.Это ароматические соединения, содержащие проп-2-илбензольный фрагмент. о-Цимол — это органическое соединение, классифицируемое как ароматический углеводород. Его структура состоит из бензольного кольца, орто-замещенного метильной группой и изопропильной группой. Это легковоспламеняющаяся бесцветная жидкость, практически не растворимая в воде, но растворимая в органических растворителях. о-Цимен был обнаружен, но не определен в цитрусовых. о- Помимо о-цимола, есть два других геометрических изомера, называемых м-цимолом, в котором алкильные группы мета-замещены, и п-цимолом, в котором они пара-замещены.п-Цимен является наиболее распространенным и единственным природным изомером. Три изомера образуют группу цименов. Цимены можно получить путем алкилирования толуола пропиленом (https://doi.org/10.1002/14356007.a13_227). | ||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 527-84-4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Структура | |||||||||||||||||||||||||||||||||||||||||||||||||
| Синонимы |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Прогнозируемые свойства | |||||||||||||||||||||||||||||||||||||||||||||||||
| Химическая формула | C10h24 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Название IUPAC | 1-метил-2- (пропан-2 — ил) бензол | ||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификатор InChI | InChI = 1S / C10h24 / c1-8 (2) 10-7-5-4-6-9 (10) 3 / h5-8H, 1-3h4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ключ InChI | WWRCMNKATXZARA-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||
| Изомерные SMILES | CC (C) C1 = CC = CC = C1C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Средний молекулярный вес | 134.2182 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Моноизотопный молекулярный вес | 134.109550448 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Классификация | |||||||||||||||||||||||||||||||||||||||||||||||||
| Описание | Относится к классу органических соединений, известных как кумен. Это ароматические соединения, содержащие проп-2-илбензольный фрагмент. | ||||||||||||||||||||||||||||||||||||||||||||||||
| Королевство | Органические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||
| Суперкласс | Бензоиды | ||||||||||||||||||||||||||||||||||||||||||||||||
| Класс | Бензол и замещенные производные | ||||||||||||||||||||||||||||||||||||||||||||||||
| Подкласс | Кумены | ||||||||||||||||||||||||||||||||||||||||||||||||
| Непосредственные родители | Альтернативные родители | ||||||||||||||||||||||||||||||||||||||||||||||||
| Заместители |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Молекулярный каркас | Ароматические гомомоноциклические соединения | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние дескрипторы | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Онтология | |||||||||||||||||||||||||||||||||||||||||||||||||
| Расположение 9113 9000 9000 Расположение 9000 Биологическое местоположение: | |||||||||||||||||||||||||||||||||||||||||||||||||
| Роль | Биологическая роль: | ||||||||||||||||||||||||||||||||||||||||||||||||
| Физико-химические свойства — экспериментальные | |||||||||||||||||||||||||||||||||||||||||||||||||
| Физико-химические свойства — экспериментальные |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||
| Spectra | |||||||||||||||||||||||||||||||||||||||||||||||||
| EI-MS / GC-MS |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| MS / MS |
| ||||||||||||||||||||||||||||||||||||||||||||||||
| ЯМР | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| E xternal Links | |||||||||||||||||||||||||||||||||||||||||||||||||
| ChemSpider ID | 10253 | ||||||||||||||||||||||||||||||||||||||||||||||||
| ChEMBL ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| KEGG Compound ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pubchem ID | 107034 Pubchem ID соединения | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Phenol-Explorer ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| DrugBank ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| HMDB ID | CR | ||||||||||||||||||||||||||||||||||||||||||||||||
| DFC (Словарь пищевых соединений) ID | KMC92-W: KMC92-W | ||||||||||||||||||||||||||||||||||||||||||||||||
| EAFUS ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dr.Duke ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| BIGG ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| KNApSAcK ID | C00010974 | ||||||||||||||||||||||||||||||||||||||||||||||||
| HET ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Food Biomarker | |||||||||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||
| Flavornet ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| GoodScent ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| SuperScent ID | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Wikipedia ID | Недоступно4 | Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||
| Дубликат IDS | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Старое IDS DFC | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Associated Foods | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Биологические эффекты и взаимодействия | |||||||||||||||||||||||||||||||||||||||||||||||||
| Воздействие на здоровье / биоактивность | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Пути | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Метаболизм | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Биосинтез | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Органолептические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ароматизаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Недоступно | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылки | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка на синтез | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Общая ссылка | Недоступно | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ссылка на содержимое | 9004 2 | ||||||||||||||||||||||||||||||||||||||||||||||||
ВВЕДЕНИЕ АРЕНЫ (АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ) На этой странице рассматриваются структуры и физические свойства простейших аренов (бензола и метилбензола), а также очень краткое введение в их реакционную способность.Многое из этого подробно описано в других разделах сайта — например, в разделах, посвященных соединению и механизмам. Вы найдете ссылки на все эти страницы. Что такое арены? Арены — ароматические углеводороды. Термин «ароматический» первоначально относился к их приятным запахам, но теперь подразумевает особый вид делокализованной связи (см. Ниже). Арены, которые вы, вероятно, встретите на этом уровне, основаны на бензольных кольцах. Самым простым из них является сам бензол, C 6 H 6 .Следующий простейший — метилбензол (старое название: толуол), в котором один из атомов водорода, присоединенный к кольцу, заменен метильной группой — C 6 H 5 CH 3 . Строение бензола Структура бензола подробно описана на двух страницах в разделе «Органические соединения» этого сайта. Чтобы понять химию бензола и метилбензола, важно понимать их досконально. Если вы не читали эти страницы в последнее время, вам следует потратить на них некоторое время, прежде чем продолжить работу по этой странице. | |
Примечание: Вы найдете две страницы, посвященные связыванию в бензоле. Один имеет дело со структурой Келуле, а другой — с современной делокализованной структурой. Вы должны прочитать обе этих страниц, начиная со страницы о структуре Келуле. Вы найдете ссылку на вторую страницу внизу первой. Это, вероятно, займет у вас некоторое время, потому что вам, вероятно, придется перейти по другим ссылкам, чтобы полностью понять вторую страницу.Не пытайтесь сократить это. Используйте кнопку BACK (или, что более вероятно, файл HISTORY или меню GO) в вашем браузере, чтобы вернуться на эту страницу позже. | |
Что вам нужно знать о бензоле:
На этой диаграмме показана одна из молекулярных орбиталей, содержащая два делокализованных электрона, которые могут быть найдены где угодно в пределах двух «пончиков». Остальные молекулярные орбитали почти не отрисовываются. Строение метилбензола (толуола) Метилбензол просто имеет метильную группу, присоединенную к бензольному кольцу, заменяя один из атомов водорода. Присоединенные группы часто рисуются в верхней части кольца, но иногда вы можете найти их нарисованными в других местах с повернутым кольцом. | |
Примечание: Если вам нужно подсчитать атомы водорода на диаграмме такого рода, не забывайте, что нет атома водорода ни в одном углу шестиугольника, где есть что-то еще. Молекулярная формула метилбензола, например, C 7 H 8 .Убедитесь, что вы получили ответ на этой диаграмме! | |
Физические свойства Точки кипения В бензоле единственное притяжение между соседними молекулами — это дисперсионные силы Ван-дер-Ваальса. На молекуле нет постоянного диполя. Бензол кипит при 80 ° C, что намного выше, чем у других углеводородов с таким же молекулярным размером (например, пентана и гексана).Предположительно это связано с легкостью, с которой могут быть созданы временные диполи с участием делокализованных электронов. | |
Примечание: Если вас не устраивают дисперсионные силы Ван-дер-Ваальса, вам следует перейти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Метилбензол кипит при 111 ° C. Это более крупная молекула, поэтому дисперсионные силы Ван-дер-Ваальса будут больше. Метилбензол также имеет небольшой постоянный диполь, поэтому будут диполь-дипольные притяжения, а также силы рассеяния. Диполь возникает из-за склонности группы CH 3 «отталкивать» электроны от себя. Это также влияет на реакционную способность метилбензола (см. Ниже). Температуры плавления Можно было ожидать, что температура плавления метилбензола будет выше, чем у бензола, но это не так — она намного ниже! Бензол плавится при 5.5 ° С; метилбензол при -95 ° C. Молекулы должны эффективно упаковываться в твердом теле, если они хотят наилучшим образом использовать свои межмолекулярные силы. Бензол представляет собой аккуратную симметричную молекулу, которая очень эффективно упаковывается. Выступающая в метилбензоле метильная группа имеет тенденцию нарушать герметичность упаковки. Если молекулы не так плотно упакованы, межмолекулярные силы не работают, и поэтому температура плавления падает. Растворимость в воде Арены не растворимы в воде. Бензол довольно большой по сравнению с молекулой воды. Чтобы бензол растворился, необходимо разорвать множество существующих водородных связей между молекулами воды. Вы также должны разрушить довольно сильные дисперсионные силы Ван-дер-Ваальса между молекулами бензола. Оба они требуют энергии. Единственными новыми силами между бензолом и водой будут дисперсионные силы Ван-дер-Ваальса. Они не так сильны, как водородные связи (или исходные дисперсионные силы в бензоле), поэтому вы не получите много энергии, когда они образуются. Бензолу просто не выгодно растворяться в воде. Конечно, для более крупных молекул арена было бы еще хуже. Реакционная способность Бензол Выше уже указывалось, что бензол устойчив к реакциям присоединения. Чтобы добавить в кольцо что-то новое, вам потребуется использовать часть делокализованных электронов для образования связей с тем, что вы добавляете. Это приводит к серьезной потере стабильности, поскольку нарушается делокализация. Вместо этого бензол в основном претерпевает реакции замещения — замену одного или нескольких атомов водорода чем-то новым. Это оставляет делокализованные электроны такими, какими они были. | |
Примечание: Делокализация фактически прерывается во время реакции замещения, но в конце реформируется. Если вас интересуют механизмы реакций замещения бензола, вы можете перейти по этой ссылке. Если вы захотите вернуться на эту страницу позже, вероятно, лучше всего будет использовать файл HISTORY или меню GO в вашем браузере. | |
метилбензол Вы должны учитывать реакционную способность чего-то вроде метилбензола в двух разных частях: Например, если вы исследуете другие страницы этого раздела, вы обнаружите, что алкильные группы, присоединенные к бензольному кольцу, окисляются щелочным раствором манганата калия (VII). Этого не происходит в отсутствие бензольного кольца. Тенденция группы CH 3 «отталкивать» электроны от себя также влияет на кольцо, заставляя метилбензол реагировать быстрее, чем сам бензол.Вы также найдете это на других страницах этого раздела.
© Джим Кларк 2004 (изменено в феврале 2016 г.) | |
1,2-дийод-3-ме… CAS #: 1608-48-6 |
| Литература: Перри, Роберт Дж .; Тернер, С. Ричард Журнал органической химии, 1991, т. 56, №23 с. 6573–6579 |
1,2-дийод-3-ме… CAS #: 1608-48-6 |
| Литература: Уиллер; Liddle American Chemical Journal, 1909, т. 42, стр. 457 |
1,2-дийод-3-ме… CAS #: 1608-48-6 |
| Литература: Уиллер; Liddle American Chemical Journal, 1909, т. 42, стр. 457 |
1,2-дийод-3-ме… CAS #: 1608-48-6 |
| Литература: Уиллер; Liddle American Chemical Journal, 1909, т. 42, стр. 457 |
ТОЛУОЛ | CAMEO Chemicals | NOAA
Химический лист данных
Химические идентификаторы
В Поля химического идентификатора включать общие идентификационные номера, NFPA алмаз U.S. Знаки опасности Министерства транспорта и общие описание химического вещества. Информация в CAMEO Chemicals поступает из множества источники данных.| Номер CAS | Номер ООН / NA | Знак опасности DOT | USCG CHRIS Код |
|---|---|---|---|
| |||
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Толуол | |||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | 2 | Может вызвать временную нетрудоспособность или остаточную травму. | |
| Воспламеняемость | 3 | Может воспламеняться практически при любых температурах окружающей среды. | |
| Нестабильность | 0 | Обычно стабильно даже в условиях пожара. | |
| Специальный |
(NFPA, 2010)
Общее описание
Прозрачная бесцветная жидкость с характерным ароматным запахом.Температура вспышки 40 ° F. Менее плотный, чем вода (7,2 фунта / галлон), и не растворим в воде. Значит плавает по воде. Пары тяжелее воздуха. Может быть токсичным при вдыхании, проглатывании или контакте с кожей. Используется в авиационном и автомобильном топливе в качестве растворителя и для производства других химикатов.
Опасности
Оповещения о реактивности
Реакции воздуха и воды
Легковоспламеняющиеся. Нерастворим в воде.
Пожарная опасность
Поведение при пожаре: Пар тяжелее воздуха, может распространиться на значительное расстояние до источника возгорания и вспыхнуть.(USCG, 1999)
Опасность для здоровья
Пары раздражают глаза и верхние дыхательные пути; вызывают головокружение, головную боль, наркоз, остановку дыхания. Жидкость раздражает глаза и вызывает высыхание кожи. При аспирации вызывает кашель, рвоту, недомогание и быстро развивающийся отек легких. При проглатывании вызывает рвоту, схватки, диарею, угнетенное дыхание. (USCG, 1999)
Профиль реактивности
ТОЛУОЛ активно реагирует с аллилхлоридом или другими алкилгалогенидами даже при -70 ° C в присутствии дихлорида этилалюминия или сесквихлорида этилалюминия.Сообщалось о взрывах [NFPA 491M 1991]. Несовместим с сильными окислителями. При добавлении в резервуар с дихлоридом серы в резервуаре повышается давление и происходит разрыв реакции, которая, как считается, катализируется железом или хлоридом железа (III) [Chem. Англ. Новости, 1988, 66 (32), 2].
Принадлежит к следующей реактивной группе (группам)
Потенциально несовместимые абсорбенты
Информация отсутствует.
Ответные рекомендации
В Поля рекомендаций ответа включать расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, противопожарное реагирование, защитная одежда и первая помощь.В информация в CAMEO Chemicals поступает из различных источники данных.Изоляция и эвакуация
Выдержка из руководства ERG 130 [Легковоспламеняющиеся жидкости (несмешивающиеся с водой / ядовитые)]:В качестве немедленной меры предосторожности изолировать место разлива или утечки на расстоянии не менее 50 метров (150 футов) во всех направлениях.
БОЛЬШОЙ РАЗЛИВ: Рассмотрите возможность начальной эвакуации с подветренной стороны на расстояние не менее 300 метров (1000 футов).
ПОЖАР: Если цистерна, железнодорожный вагон или автоцистерна вовлечены в пожар, ИЗОЛИРУЙТЕ 800 метров (1/2 мили) во всех направлениях; также рассмотрите возможность начальной эвакуации на 800 метров (1/2 мили) во всех направлениях.(ERG, 2016)
Пожарная
Выдержка из руководства ERG 130 [Легковоспламеняющиеся жидкости (несмешивающиеся с водой / ядовитые)]:ВНИМАНИЕ: Все эти продукты имеют очень низкую температуру воспламенения: использование водяного спрея при тушении пожара может быть неэффективным.
МАЛЫЙ ПОЖАР: Сухие химикаты, CO2, водяная струя или обычная пена.
БОЛЬШОЙ ПОЖАР: водяная струя, туман или обычная пена. Не используйте прямые потоки. Уберите контейнеры из зоны пожара, если это можно сделать без риска.
ПОЖАР В ЦИСТЕРНАХ ИЛИ АВТОМОБИЛЬНЫХ / ПРИЦЕПНЫХ НАГРУЗКАХ: тушите пожар с максимального расстояния или используйте необслуживаемые держатели шлангов или контрольные насадки.После того, как огонь не погаснет, охладите емкости затопленным количеством воды. Немедленно удалите воду в случае появления шума из вентиляционных устройств безопасности или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. При сильном пожаре используйте безлюдные держатели для шлангов или контрольные насадки; если это невозможно, отойдите с территории и дайте огню загореться. (ERG, 2016)
Non-Fire Response
Выдержка из Руководства ERG 130 [Легковоспламеняющиеся жидкости (Несмешивающиеся с водой / Ядовитые)]:УСТРАНИТЬ все источники возгорания (запрещается курить, факелы, искры или пламя в непосредственной близости).Все оборудование, используемое при работе с продуктом, должно быть заземлено. Не прикасайтесь к пролитому материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Не допускайте попадания в водные пути, канализацию, подвалы или закрытые пространства. Пена для подавления паров может использоваться для уменьшения испарений. Собрать или накрыть сухой землей, песком или другим негорючим материалом и переложить в контейнеры. Для сбора впитанного материала используйте чистые неискрящие инструменты.
БОЛЬШОЙ РАЗЛИВ: плотина перед разливом жидкости для последующей утилизации.Распыление воды может уменьшить испарение, но не может предотвратить возгорание в закрытых помещениях. (ERG, 2016)
Защитная одежда
Кожа: Носите соответствующую личную защитную одежду для предотвращения контакта с кожей.Глаза: Используйте соответствующие средства защиты глаз, чтобы избежать контакта с глазами.
Промыть кожу: Рабочий должен немедленно промыть кожу, если она загрязнится.
Удалить: намокшую рабочую одежду следует немедленно снять из-за ее опасности воспламенения (например, для жидкостей с температурой вспышки <100 ° F)
Изменение: не дается никаких рекомендаций, указывающих на необходимость для рабочего менять одежду после работы. сдвиг.(NIOSH, 2016)
Ткани для костюмов DuPont Tychem®
Легенда ткани Tychem®
| QS = Tychem 2000 SFR |
| QC = Tychem 2000 |
| SL = Тихем 4000 |
| C3 = Тихем 5000 |
| TF = Тихем 6000 |
| TP = Тихем 6000 FR |
| BR = Тихем 9000 |
| RC = Tychem RESPONDER® CSM |
| TK = Тихем 10000 |
| RF = Тихем 10000 FR |
Детали тестирования
Данные о проницаемости ткани были получены для DuPont независимыми испытательные лаборатории с использованием ASTM F739, EN369, EN 374-3, EN ISO 6529 (методы A и B) или методы испытаний ASTM D6978.Нормализованное время прорыва (время, при котором скорость проникновения равна 0,1 мкг / см2 / мин) сообщается в минутах. Все жидкие химикаты были протестированы при температуре примерно от 20 ° C до 27 ° C, если не указано иное. Другая температура может существенно повлиять на время прорыва; скорость проникновения обычно увеличивается с температура. Все химические вещества имеют были протестированы при концентрации более 95%, если не указано иное заявил.Если не указано иное, проницаемость измерялась для отдельных химикатов. Характеристики проницаемости смесей могут значительно отличаться. от проницаемости отдельных химических веществ. Боевые отравляющие вещества (люизит, зарин, зоман, сера Горчица, табун и нервно-паралитический агент VX) были протестированы при 22 ° C и 50% относительная влажность в соответствии с военным стандартом MIL-STD-282.
| Химическая промышленность | Номер CAS | Государство | QS | QC | SL | C3 | TF | ТП | BR | RC | ТК | РФ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Толуол (> 95%) | 108-88-3 | Жидкость | имм. | имм. | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 | > 480 |
Специальные предупреждения от DuPont
- Зубчатые и переплетенные швы повреждены какой-либо опасной жидкостью химические вещества, такие как сильные кислоты, и их не следует носить при эти химические вещества присутствуют.
- ВНИМАНИЕ: эта информация основана на технических данных, которые
DuPont считает себя надежным. Подлежит пересмотру как
приобретаются дополнительные знания и опыт. DuPont не делает
гарантия результатов и не берет на себя никаких обязательств или ответственности …
… в связи с этой информацией. Ответственность за определить уровень токсичности и надлежащие средства индивидуальной защиты необходимое оборудование.Информация, изложенная здесь, отражает лабораторные эксплуатационные качества тканей, а не комплектных предметов одежды, в контролируемых условиях. Он предназначен для информационного использования лицами, имеющими технические навыки для оценка с учетом конкретных условий конечного использования по собственному усмотрению и риск. Любой, кто намеревается использовать эту информацию, должен сначала проверить что выбранная одежда подходит для предполагаемого использования. Во многих случаях, швы и закрытия имеют более короткое время прорыва и более высокую проницаемость ставки, чем ткань.Пожалуйста, свяжитесь с DuPont для получения конкретных данных. Если ткань рвется, истирается или прокалывается, или если швы или затворы выходят из строя, или если прикрепленные перчатки, козырьки и т. д. повреждены, конечный пользователь должен прекратить использование одежды, чтобы избежать потенциального воздействия химикатов. Поскольку условия использования находятся вне нашего контроля, мы не даем никаких гарантий, явных или подразумеваемых, включая, помимо прочего, отсутствие гарантий товарной пригодности или пригодности для конкретного использования и не несем ответственности в связи с любым использованием эта информация.Эта информация не предназначена для использования в качестве лицензии на работу. под или рекомендацией нарушить какой-либо патент или техническую информацию компании DuPont или других лиц, охватывающих любой материал или его использование.
(DuPont, 2018)
Первая помощь
ГЛАЗА: Сначала проверьте пострадавшего на предмет контактных линз и снимите их, если они есть. Промойте глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно позвонив в больницу или токсикологический центр.Не наносите мази, масла или лекарства в глаза пострадавшему без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывки глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.КОЖА: НЕМЕДЛЕННО затопите пораженную кожу водой, сняв и изолировав всю загрязненную одежду. Осторожно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы перевезти пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделайте глубокий вдох на свежем воздухе. При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы перевезти пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, попадающим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (АДА); если недоступен, используйте уровень защиты, превышающий или равный тому, который рекомендован в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: НЕ ВЫЗЫВАЙТЕ РВОТУ. Если пострадавший находится в сознании и не испытывает конвульсий, дайте 1 или 2 стакана воды для разбавления химического вещества и НЕМЕДЛЕННО позвоните в больницу или токсикологический центр. Будьте готовы перевезти пострадавшего в больницу по совету врача. Если пострадавший находится в конвульсиях или потерял сознание, не давайте ничего через рот, убедитесь, что дыхательные пути пострадавшего открыты, и положите пострадавшего на бок так, чтобы голова была ниже тела. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу.(NTP, 1992)
Физические свойства
Точка возгорания: 40 ° F (NTP, 1992)
Нижний предел взрываемости (НПВ): 1,27% (NTP, 1992)
Верхний предел взрываемости (ВПВ): 7,1% (NTP, 1992)
Температура самовоспламенения: 896 ° F (USCG, 1999)
Температура плавления: -139 ° F (NTP, 1992)
Давление газа: 10 мм рт. при 43,5 ° F ; 20 мм рт. Ст. При 65,1 ° F; 40 мм рт. Ст. При 89,2 ° F (NTP, 1992)
Плотность пара (относительно воздуха): 3.14 (NTP, 1992)
Удельный вес: 0,867 при 68 ° F (USCG, 1999)
Точка кипения: 231,1 ° F при 760 мм рт. (NTP, 1992)
Молекулярный вес: 92,14 (NTP, 1992)
Растворимость воды: менее 1 мг / мл при 64 ° F (NTP, 1992)
Потенциал ионизации: 8,82 эВ (NIOSH, 2016)
IDLH: 500 частей на миллион (NIOSH, 2016)
AEGL (рекомендуемые уровни острого воздействия)
ERPG (Руководство по планированию действий в чрезвычайных ситуациях)
| Химическая промышленность | ЭРПГ-1 | ЭРПГ-2 | ЭРПГ-3 |
|---|---|---|---|
| Толуол (108-88-3) | 50 страниц в минуту | 300 частей на миллион | 1000 частей на миллион |
(АМСЗ, 2016)
PAC (Критерии защитного действия)
| Химическая промышленность | PAC-1 | PAC-2 | PAC-3 | |
|---|---|---|---|---|
| Толуол (108-88-3) | 67 частей на миллион | 560 частей на миллион | 3700 частей на миллион | НПВ = 14000 частей на миллион |
(DOE, 2016)
Нормативная информация
В Поля нормативной информации включать информацию из U.S. Сводный список раздела III Агентства по охране окружающей среды. Списки, химический объект Министерства внутренней безопасности США Стандарты борьбы с терроризмом, и Администрации США по охране труда Стандартный список управления производственной безопасностью особо опасных химических веществ (подробнее об этих источники данных).Сводный список списков Агентства по охране окружающей среды
| Нормативное название | Номер CAS / 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | EPCRA 313 TRI | RCRA Код | CAA 112 (r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Толуол | 108-88-3 | 1000 фунтов | 313 | U220 |
(Список списков EPA, 2015)
Стандарты по борьбе с терроризмом для химических объектов DHS (CFATS)
Нет нормативной информации.Список стандартов управления безопасностью процессов (PSM) OSHA
Нет нормативной информации.Альтернативные химические названия
В этом разделе представлен список альтернативных названий этого химического вещества, включая торговые наименования и синонимы.
- АНТИСАЛ 1А
- БЕНЗОЛ, МЕТИЛ-
- CP 25
- CP 25 (РАСТВОРИТЕЛЬ)
- МЕТАЦИД
- МЕТАН, ФЕНИЛ-
- МЕТИЛБЕНЗОЛ
- МЕТИЛБЕНЗОЛ
- МЕТИЛБЕНЗОЛ
- 1-МЕТИЛБЕНЗОЛ
- МЕТИЛБЕНЗОЛ
- NCI-C07272
- ФЕНИЛМЕТАН
- ФЕНИЛМЕТАН
- ТОЛУ-СОЛ
- ТОЛУОЛ
- ТОЛУОЛ
1-Бром-3-фтор-5-метилбензол | CAS 202865-83-6 | SCBT
1-Бром-3-фтор-5-метилбензол | CAS 202865-83-6 | SCBT — Santa Cruz Biotechnology 1-бром-3-фтор-5-метилбензол CAS: 202865-83-6MF: C7H6BrF
MW: 189.02
- Дом
- Химические вещества
- Прочие химические вещества
- Дополнительные биохимические вещества
- 1-Бром-3-фтор-5-метилбензол
Заявка: CAS: 202865-83-6, MF: C 7 H 6 BrF, MW: 189.02
Количество CAS: 202865-83-6
Молекулярный вес: 189,02
Молекулярная формула: К 7 В 6 BrF
Только для исследовательского использования. Не предназначено для диагностического или терапевтического использования.
* См. Сертификат анализа для получения данных по партии (включая содержание воды).Нажмите на изображение или кнопку увеличения, чтобы увеличить
Закрыть
Только для исследовательского использования.Не предназначено для диагностического или терапевтического использования.
Улыбки :
CC1 = CC (= CC (= C1) Br) F
Adobe Acrobat Reader требуется для надежного просмотра,
печати и комментирования PDF-документов.
Santa Cruz Biotechnology, Inc.является мировым лидером в разработке продуктов для рынка биомедицинских исследований. Позвоните нам по бесплатному телефону 1-800-457-3801 .
Copyright © 2007-2021 Santa Cruz Biotechnology, Inc. Все права защищены. «Santa Cruz Biotechnology» и логотип Santa Cruz Biotechnology, Inc., «Здоровье животных Санта-Крус», «San Juan Ranch», «Дополнение чемпионов», логотип San Juan Ranch, «Ultracruz», «Chemcruz», » Immunocruz «,» Exactacruz «и» EZ Touch «являются зарегистрированными товарными знаками Santa Cruz Biotechnology, Inc.
Все товарные знаки являются собственностью соответствующих владельцев.
Получена ваша подписка на рассылку новостей и объявлений по электронной почте. Регистрируясь, вы подтверждаете, что прочитали и согласны с условиями нашей политики конфиденциальности. Вы имеете право отказаться от подписки в любое время, щелкнув ссылку «отказаться от подписки» в любом полученном вами электронном письме с новостями и объявлениями.
Чтобы разместить заказ с использованием юаней или отправить товар в континентальный Китай, посетите сайт www.

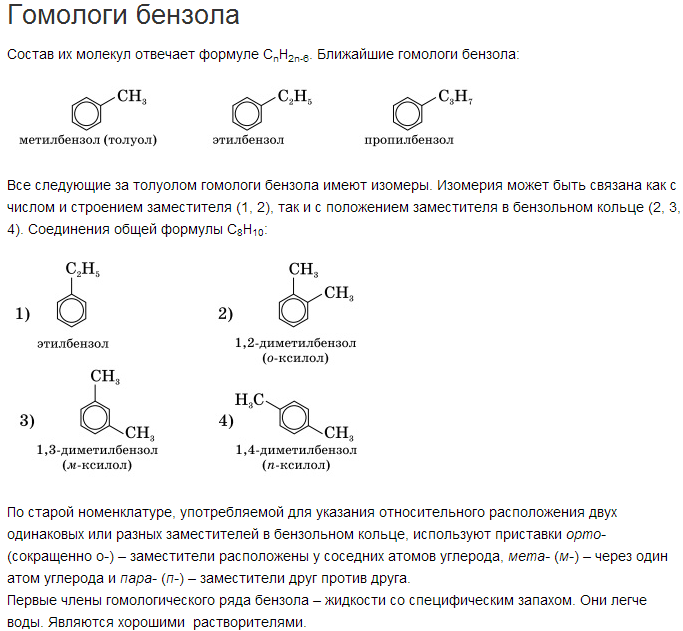 Нужно быть осторожными.
Нужно быть осторожными.
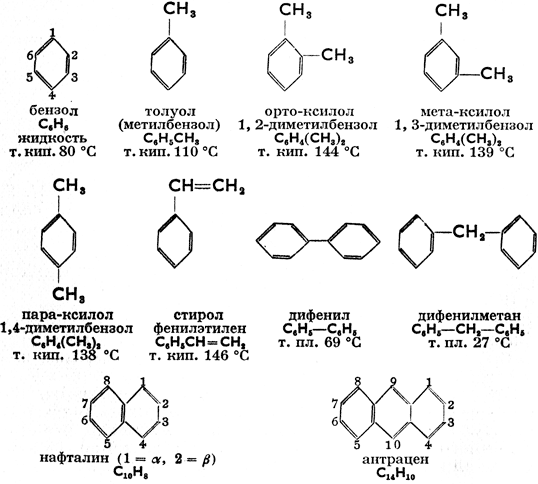
Leave A Comment