Азот, соединения азота
Азот, соединения азота
Азот – элемент V A группы главной подгруппы, значит, на внешнем энергетическом уровне у него 5 электронов. До завершения внешнего уровня ему не хватает 3 электрона, которые он может присоединить, в этом случае степень окисления его будет равна -3. Кроме этого, атом азота может и отдавать электроны и приобретать положительные степени окисления. Таким образом, для атома азота в соединениях возможны степени окисления от -3 до +5.
Рассмотрим соединения азота.
Например,
в аммиаке – NH3
– степень окисления азота -3; в оксиде азота (I) – N2O
– степень окисления азота +1; в оксиде азота (II) – NO
– степень окисления азота +2; в азотистой кислоте – HNO2
– степень окисления азота +3; в оксиде азота (IV) – NO2
– степень окисления азота +4; в азотной кислоте – HNO
Таким образом, если степень окисления азота -3, то он проявляет восстановительные свойства, если степень окисления +5, то азот проявляет окислительные свойства, а если у азота в соединении промежуточные степени окисления: +1, +2, +3, +4, то он может проявлять и окислительные, и восстановительные свойства.
Азот входит в состав воздуха, где его объёмная доля составляет 78%, он входит в состав земной коры и живых организмов. В космосе азот занимает по распространённости четвёртое место, вслед за водородом, гелием и кислородом.
Азот входит и в состав чилийской селитры – NaNO3 – это неорганическое вещество образовалось из остатков птичьего помёта в условиях сухого и жаркого климата. Широко распространена и калийная селитра – KNO3, встречающаяся в Индии.
Азот
входит в состав всех белков, а белок просто необходим
для жизни. Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Человек получает белок из растительной и животной пищи, а животные получают
белок, в основном, из растений. А сами растения являются источником пополнения
азота. Поэтому в природе постоянно происходит круговорот азота.
Так как азот входит в состав органических соединений, то он недоступен для растений. Но, в результате жизнедеятельности определённой группы бактэрий, органические соединения превращаются в неорганические – минеральные – это соли аммония и нитраты. И уже эти неорганические вещества усваиваются растениями. Затем растениями, которые усвоили азот, питаются животные и из растений получают необходимый белок.
Большую роль в фиксации азота играют клубеньковые бактерии, которые живут в клубеньках бобовых растений (клевера, гороха, люпина). Они усваивают атмосферный азот и превращают его в соединения, которые доступные растениям.
Кроме
этого, соединения азота в почве пополняются за счёт грозовых ливней.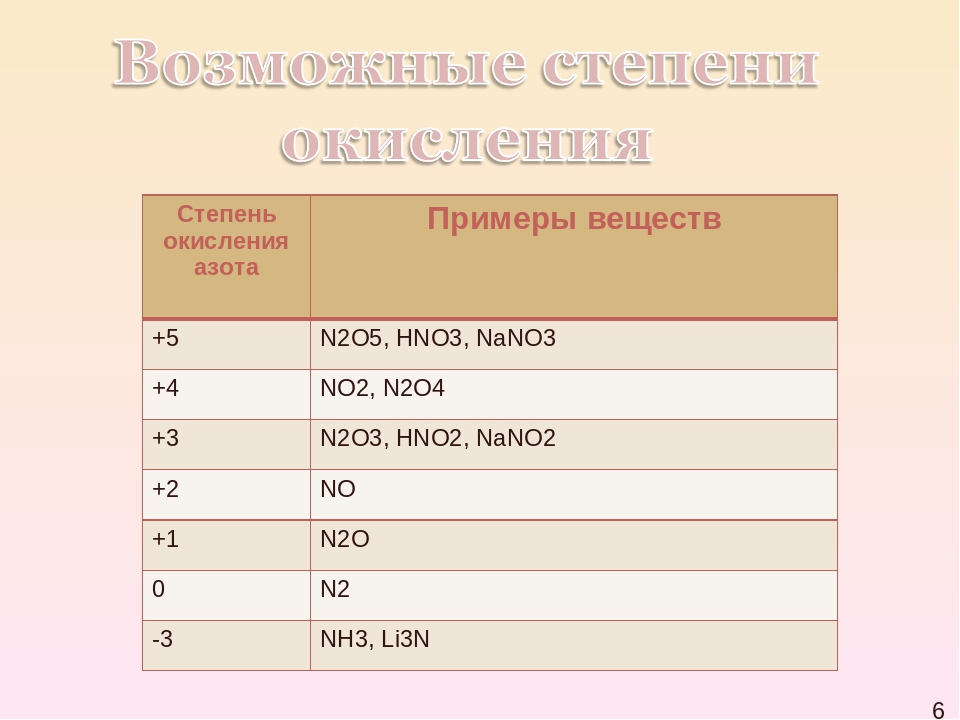 Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Сначала из азота и кислорода образуется оксид азота (II), который под действием
кислорода воздуха превращается в оксид азота (IV). Этот оксид реагирует с водой
в присутствии кислорода воздуха и получается азотная кислота. Кислота
затем вступает во взаимодействие с соединениями натрия, кальция и калия,
которые находятся в почве, и образует соли – селитры, которые нужны для питания
растений.
Простое вещество азот состоит из двухатомных молекул – N2. В молекуле азота атомы связаны между собой тройной ковалентной неполярной связью. Эта связь очень прочная, поэтому азот является малоактивным веществом.
Азот
является бесцветным газом, не имеет запаха и вкуса, немного легче воздуха.
Не сжижается при обычной температуре, плохо растворим в воде, его температура
плавления -210 0C,
а температура кипения -196 0C.
В лаборатории азот получают разложением нитрита аммония при слабом нагревании.
Азот относительно инертен в химических реакциях. Он не реагирует ни с кислотами, ни с водой, ни со щелочами.
При обычных условиях азот реагирует только с литием. При этом образуется нитрид лития.
Литий повышает свою степень окисления с 0 до +1, а азот понижает с 0 до -3. Каждый атом алюминия отдает по 6 электронов молекуле азота, при этом литий является восстановителем, а азот окислителем.
С другими металлами азот реагирует только при высоких температурах.
Например, в реакции с магнием образуется нитрид магния. Магний изменяет свою степень окисления с 0 до +2, а азот понижает с 0 до -3. Каждый атом магния отдаёт по 3 электрона молекуле азота. Магний в реакции является восстановителем, а азот – окислителем.
При
высоких температуре, давлении и в присутствии катализатора
азот реагирует с водородом, образуя при этом аммиак. В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
В этой реакции азот
понижает свою степень окисления с 0 до -3, а водород повышает с 0я до +1. Азот
является окислителем, а водород восстановителем.
Как видите, это реакция соединения, так как из двух простых веществ образуется одно сложное, реакция экзотермическая, так как протекает с выделением теплоты, обратимая, то есть идёт как в прямом, так и в обратном направлении, каталитическая, потому что в реакции присутствует катализатор – железо. Реакция является окислительно-восстановительной, потому что происходит изменение степеней окисления, реакция гомогенная, так как вступающие в химическую реакцию вещества и продукты реакции в одном агрегатном состоянии – газообразном.
При высокой температуре азот соединяется с кислородом
В
этой реакции азот повышает свою степень окисления с 0 до +2, а кислород
понижает с 0 до -2. Азот является восстановителем, а кислород – окислителем.
Азот является восстановителем, а кислород – окислителем.
Так как эта реакция идёт с изменением степеней окисления, то она является окислительно-восстановительной, это реакция соединения, потому что из двух простых веществ образуется одно сложное. Реакция обратимая, идёт в прямом и обратном направлении, эндотермическая, так как теплота поглощается, реакция некаталитическая, потому что не требует участия катализатора, является
Следует отметить, что в реакциях с металлами и водородом азот проявляет окислительные свойства, а в реакциях с кислородом – восстановительные.
Основная
область применения азота – производство аммиака и азотной кислоты. Азот
применяют также для создания инертной среды при сушке взрывчатых веществ, при
хранении ценных произведений живописи и рукописей. Азотом раньше
наполняли электрические лампы. Жидкий азот используют в охладительных системах.
Жидкий азот используют в охладительных системах.
В медицине чистый азот применяют в качестве инертной среды при лечении туберкулёза лёгких, а жидкий азот – при лечении заболеваний позвоночника и суставов.
В 1772 году английский учёный Резерфорд и шведский исследователь Шееле в экспериментах по сжиганию веществ обнаружили газ, не поддерживающий дыхание и горение. Позднее, в 1787 году, Лавуазье установил наличие в воздухе газа, не поддерживающего дыхания и горения. Он дал название этому газу «азот», означающее «безжизненный» (от латинского а – нет и зоэ – жизнь). В 1790 году Шапталь дал азоту другое название – нитрогениум – означающее «рождающий селитру».
Решим
задачу. Определим массу соединения, которое образуется при нагревании
металлического магния массой 7,2 г в азоте объёмом 10 л при
нормальных условиях.
В условии задачи нам дана масса магния и объём азота. Найти необходимо массу образовавшегося соединения, то есть массу нитрида магния. Найдём количество вещества магния, для этого необходимо массу магния разделить на его молярную массу. То есть 7,2 г разделим на 24 г/моль, получим 0,3 моль, теперь найдём количество вещества азота, для этого нужно объём азота разделить на молярный объём. Для этого разделим 10 л на 22,4 л/моль, получается 0,446 моль. По уравнению реакции видно, что соотношение моль магния и азота составляет 3 : 1. Следовательно, количество вещества азота должно быть в три раза меньше количества вещества магния, то есть 0,1 моль. В результате вычислений мы получили количество вещества азота, равное 0,446 моль. Поэтому азот находится в избытке, и количество вещества нитрида магния находим по магнию.
Получается,
что количество вещества нитрида магния будет 0,1 моль, то есть 0,3 умножим на 1
и разделим на 3 и получится 0,1 моль. Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Найдём молярную массу нитрида магния. Для
этого относительную атомную массу магния (24) умножим на 3 и прибавим
относительную атомную массу азота (14), умноженную на 2, получается 100 г/моль.
Найдём массу этого вещества. Для этого следует количество вещества умножить на
молярную массу, поэтому 0,1 моль умножаем на 100 г/моль и получим 10 г.
Таким образом масса нитрида магния будет равна десять г.
Укажите возможные степени окисления азота. Приведите примеры соединений с различными
срочно , помогите пожалуйста!!! химия 7 класс, практическая работа номер 3
Помогите срочно нужно каждий вопрос пролежать с этими речовинамы
Выбери ряд химических формул, обозначающих вещества, все из которых могут взаимодействовать со щелочами: NiCO3,HNO3,FeBr3 CO2,h4PO4,Ni(NO3)2 ZnO, … HI,Li2O Ba(OH)2,Al(OH)3,Cr(NO3)3
2)Перечислите объекты поражения кислотными дождями и приведите следы действия кислотных дождей на окружающую среду вашего города.
Умоляю, помогите с химией!!! Очень прошу!!! Задание 1 Основания образуются, когда с водой реагируют вещества: P2O5 Ag2O Rb Li2O Задание 2 Выбе … ри вещество, при взаимодействии которого с водой выделяется водород: Rb2O CO2 Ba Ag2O Задание 3 Выбери верные утверждения: продукт реакции металла с водой окрашивает лакмус в красный цвет реакция воды с металлом относится к реакциям соединения многие оксиды неметаллов реагируют с водой с образованием кислот вода реагирует с оксидами активных металлов Задание 4 При определённых условиях вода реагирует со всеми веществами ряда: SO2,Br2O7,Au Ba,BaO,BeO Fe,SiO2,Na2O Al,NO2,CO2 Задание 5 При определённых условиях вода реагирует со всеми веществами ряда: SO2,Br2O7,Au Ba,BaO,BeO Fe,SiO2,Na2O Al,NO2,CO2 Задание 6 Вычисли массу кислорода, который содержится в 20 г кристаллогидрата CaCl2⋅2h3O. (Вычисления проводи с точностью до тысячных, а ответ округли до целых). Ответ: масса кислорода равна г. Я вас очень прошу!!!! Мне очень срочно! Только правильно!!!
найти все массовые доли.
помогите пожалуйста, даю 25 баллов
Укажіть відповідність між кількістю речовин кислоти і ма- сою (r) калій гідроксиду, необхідного для повної нейтралізації кислоти: Кількість Maca (2) р … ечовини кислоти xanii siðpoxcudy 1) 0,1 моль сульфідної кислоти А) 11,2 2) 0,1 моль нітратної кислоти Б) 44,8 3) 0,2 моль карбонатної кислоти В) 33,6 4) 0,3 моль сульфітної кислоти г) 22,4 Д) 5,6
СРОЧНО !!! Б) KCIO3→ O2→Li2O В) h3O→ O2→P2O5 Г) h3O2→ O2→ZnO Д) Ch5 → h3O→AI2O3
ЗАПИСАТИ ХІМІЧНІ РІВНЯННЯ Cr(1-7)допоможить пж
Задания 4. Валентности и степени окисления элементов.
Задание №1
EBA347
Степень окисления +2 во всех соединениях проявляет
1) олово
2) фосфор
3) железо
4) цинк
РешениеОтвет: 4
Пояснение:
Из всех предложенных вариантов степень окисления +2 в сложных соединениях проявляет только цинк, являясь элементом побочной подгруппы второй группы, где максимальная степень окисления равна номеру группы.
Олово – элемент главной подгруппы IV группы, металл, проявляет степени окисления 0 (в простом веществе), +2, +4 (номер группы).
Фосфор – элемент главной подгруппы главной группы, являясь неметаллом, проявляет степени окисления от -3 (номер группы – 8) до +5 (номер группы).
Железо – металл, элемент расположен в побочной подгруппе главной группы. Для железа характерны степени окисления: 0, +2, +3, +6.
Задание №2
F45DFA
Соединение состава KЭО4 образует каждый из двух элементов:
1) фосфор и хлор
2) фтор и марганец
3) хлор и марганец
4) кремний и бром
РешениеОтвет: 3
Пояснение:
Соль состава KЭО4 содержит кислотный остаток ЭО4—, где кислород обладает степенью окисления -2, следовательно, степень окисления элемента Э в этом кислотном остатке равна +7. Из предложенных вариантов подходят хлор и марганец – элементы главной и побочной подгруппы VII группы соответственно.
Фтор – также элемент главной подгруппы VII группы, однако, являясь самым электроотрицательным элементом, не проявляет положительных степеней окисления (0 и -1).
Бор, кремний и фосфор – элементы главных подгрупп 3, 4 и 5 групп соответственно, поэтому в солях проявляют соответствующие максимальные степени окисления +3, +4, +5.
Задание №3
BA7EFF
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Zn и Cr
- 2. Si и B
- 3. Fe и Mn
- 4. P и As
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и As. Это элементы расположены в главной подгруппе V группы.
Zn и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях цинк проявляет высшую степень окисления +2, хром — +6.
Fe и Mn – элементы побочных подгруппы VIII и VII групп соответственно. Высшая степень окисления у железа составляет +6, у марганца — +7.
Высшая степень окисления у железа составляет +6, у марганца — +7.
Задание №4
DC98F9
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Hg и Cr
- 2. Si и Al
- 3. F и Mn
- 4. P и N
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и N. Эти элементы расположены в главной подгруппе V группы.
Hg и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
Si и Al − элементы главных подгруппы IV и III групп соответственно. Следовательно, для кремния максимальная степень окисления в сложных соединениях равна +4 (номер группы, где расположен кремний), для алюминия − +3 (номер группы, где расположен алюминия).
F и Mn – элементы главной и побочной подгрупп VII групп соответственно. Однако фтор, являясь самым электроотрицательным элементом Периодической системы химических элементов, не проявляет положительных степеней окисления: в сложных соединения его степень окисления равна −1 (номер группы−8). Высшая степень окисления марганца составляет +7.
Высшая степень окисления марганца составляет +7.
Задание №5
C0E0FE
Степень окисления +3 азот проявляет в каждом из двух веществ:
- 1. HNO2 и NH3
- 2. NH4Cl и N2О3
- 3. NaNO2 и NF3
- 4. HNO3 и N2
Ответ: 3
Пояснение:
В азотистой кислоте HNO2 степень окисления кислорода в кислотном остатке равна -2, у водорода — +1, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота составляет +3. В аммиаке NH3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
Хлорид аммония NH4Cl является аммонийной солью, поэтому степень окисления азота такая же, как в аммиаке, т. е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
В нитрите натрия NaNO2 (соли азотистой кислоты) степень окисления азота такая же, как в азота в азотистой кислоте, т.к. составляет +3. Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
В азотной кислоте азот обладает высшей степенью окисления, равной номеру группы (+5). Азот как простое соединение (поскольку состоит из атомов одного химического элемента) обладает степенью окисления 0.
Задание №6
EDD5FF
Высшему оксиду элемента VI группы соответствует формула
- 1. Э4O6
- 2. ЭO4
- 3. ЭO2
- 4. ЭО3
Ответ: 4
Пояснение:
Высшим оксидом элемента является оксид элемента с его максимальной степени окисления. В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
Первый вариант является неверным, т.к. элемент обладает степенью окисления 0-(-2)⋅6/4 = +3.
Во втором варианте элемент обладает степенью окисления 0-(-2) ⋅ 4 = +8.
В третьем варианте степень окисления элемента Э: 0-(-2) ⋅ 2 = +4.
В четвертом варианте степень окисления элемента Э: 0-(-2) ⋅ 3 = +6, т.е. это искомый ответ.
Задание №7
EFF6F9
Степень окисления хрома в дихромате аммония (NH4)2Cr2O7 равна
РешениеОтвет: 1
Пояснение:
В бихромате аммония (NH4)2Cr2O7 в катионе аммония NH4+ азот как более электроотрицательный элемент обладает низшей степенью окисления -3, водород заряжен положительно +1. Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Для того чтобы молекула оставалась электронейтральной, у кислотного остатка Cr2O72− заряд должен быть -2. Кислород в кислотных остатках кислот и солей всегда обладает зарядом -2, поэтому 7 атомов кислорода, входящих в состав молекулы бихромата аммония, заряжены -14. Атомов хрома Cr в молекулы 2, следовательно, если заряд хрома обозначить за x, то имеем:
2x + 7 ⋅ (-2) = -2, где x = +6. Заряд хрома в молекуле бихромата аммония равен +6.
Задание №8
3FC0F3
Степень окисления +5 возможна для каждого из двух элементов:
1) кислорода и фосфора
2) углерода и брома
3) хлора и фосфора
4) серы и кремния
РешениеОтвет: 3
Пояснение:
В первом предложенном варианте ответов только фосфор как элемент главной подгруппы V группы может проявлять степень окисления +5, которая является для него максимальной. Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF2 – +1. Степень окисления +5 для него не характерна.
Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF2 – +1. Степень окисления +5 для него не характерна.
Углерод и бром – элементы главных подгрупп IV и VII групп соответственно. Для углерода характерна максимальная степень окисления +4 (равна номеру группы), а бром проявляет степени окисления -1, 0 (в простом соединении Br2), +1, +3, +5 и +7.
Хлор и фосфор – элементы главных подгрупп VII и V групп соответственно. Фосфор проявляется максимальную степень окисления +5 (равную номеру группы), для хлора аналогично брому характерны степени окисления -1, 0 (в простом соединении Cl2), +1, +3, +5, +7.
Сера и кремний – элементы главных подгрупп VI и IV групп соответственно. Сера проявляет широкий спектр степеней окисления от -2 (номер группы − 8) до +6 (номер группы). Для кремния максимальная степень окисления равна +4 (номер группы).
Задание №9
44E50C
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. NaNO3
- 2. NaNO2
- 3. NH4Cl
- 4. NO
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
В нитрате натрия NaNO3 натрий имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 3, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен иметь степень окисления: 0 − (+1) − (−2)·3 = +5.
В нитрите натрия NaNO2 атом натрий также имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления: 0 − (+1) − (−2)·2 = +3.
NH4Cl − хлорид аммония. В хлоридах атомы хлора имеют степень окисления −1, атомы водорода, которого в молекуле 4, заряжен положительно, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота: 0 − (−1) − 4 ·(+1) = −3. В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +2.
Задание №10
0EB205
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. Fe(NO3)3
- 2. NaNO2
- 3. (NH4)2SO4
- 4. NO2
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т. е. +5.
е. +5.
Одна структурная единица нитрата железа Fe(NO3)3 состоит из одного иона Fe3+ и трех нитрат-ионов. В нитрат-ионах атомы азота независимо от типа противоиона имеют степень окисления +5.
В нитрите натрия NaNO2 натрий имеет степень окисления +1 (элемент главной подгруппы I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления 0 − (+1) − (−2)⋅2 = +3.
(NH4)2SO4 – сульфат аммония. В солях серной кислоты анион SO42− имеет заряд 2−, следовательно, каждый катион аммония заряжен 1+. На водороде заряд +1, поэтому на азоте −3 (азот более электроотрицателен, поэтому оттягивает на себя общую электронную пару связи N−H). В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO2 кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +4.
Задание №11
28910EВ соединениях состава Fe(NO3)3 и CF4 степень окисления азота и углерода равна соответственно
1) +3 и –2
2) +3 и +4
3) –3 и –4
4) +5 и +4
РешениеОтвет: 4
Пояснение:
Одна структурная единица нитрата железа (III) Fe(NO3)3 состоит из одного иона железа Fe3+ и трех нитрат-ионов NO3−. В нитрат-ионах азот всегда имеет степень окисления +5.
Во фториде углерода CF4 фтор является более электроотрицательным элементом и оттягивает на себя общую электронную пару связи C-F, проявляя степень окисления -1. Следовательно, углерод C имеет степень окисления +4.
Задание №12
A32B0BСтепень окисления +7 хлор проявляет в каждом из двух соединений:
- 1.
 Ca(OCl)2 и Cl2O7
Ca(OCl)2 и Cl2O7 - 2. KClO3 и ClO2
- 3. BaCl2 и HClO4
- 4. Mg(ClO4)2 и Cl2O7
Ответ: 4
Пояснение:
В первом варианте атомы хлора обладают степенями окисления +1 и +7 соответственно. Одна структурная единица гипохлорита кальция Ca(OCl)2 состоит из одного иона кальция Ca2+ (Ca — элемент главной подгруппы II группы) и двух гипохлорит-ионов OCl−, каждый из которых имеет заряд 1−. В сложных соединениях, кроме OF2 и различных перекисей, кислород всегда имеет степень окисления −2, поэтому, очевидно, что хлор имеет заряд +1. В оксиде хлора Cl2O7, как и во всех оксидах, кислород обладает степенью окисления −2, следовательно, на хлор в этом соединении имеет степень окисления +7.
В хлорате калия KClO3 атом калия имеет степень окисления +1, а кислород — −2. Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
В третьем варианте катион бария в сложном соединении заряжен +2, следовательно, на каждом анионе хлора в соли BaCl2 сосредоточен отрицательный заряд −1. В хлорной кислоте HClO4 общий заряд 4 атомов кислорода составляет −2⋅4 = −8, на катионе водорода заряд +1. Чтобы молекула оставалась электронейтральной, заряд хлора должен составлять +7.
В четвертом варианте в молекуле перхлората магния Mg(ClO4)2 заряд магния +2 (во всех сложных соединениях магний проявляет степень окисления +2), поэтому на каждый анион ClO4−приходится заряд 1−. В общем 4 иона кислорода, где каждый проявляет степень окисления −2, заряжены −8. Следовательно, чтобы общий заряд аниона составлял 1−, на хлоре должен быть заряд +7. В оксиде хлора Cl2O7, как было объяснено выше, заряд хлора составляет +7.
В оксиде хлора Cl2O7, как было объяснено выше, заряд хлора составляет +7.
Возможные степени окисления элементовПеред тем как начать писать окислительно-восстановительные реакции, необходимо знать какие степени окисления может проявлять тот или иной химический элемент. Рассмотрим степени окисления, знание которых необходимо для успешной сдачи ЕГЭ. Элементы с постоянными степенями окисления в сложных соединениях:
Элементы с переменными степенями окисления:1. Водород Водород
2. Кислород Кислород
3. Сера Сера
4. Азот
5. Галогены* Галогены*
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
6. Углерод**
** В органических соединениях углерод проявляет все степени окисления от -4 (например, CH4) до +3 (например, CH3COOH).
7. Фосфор
8. Хром Хром
9. Железо Железо
10. Медь Медь
11. Марганец Марганец
|
Разработка теста «Степень окисления»
Правила определения степени окисления
Степень окисления – условный заряд aтома или группы атомов в молекуле, вычисленный из предположения, что молекула состоит только из ионов.
Правила определения степеней окисления.
1. В простом веществе степень окисления атомов равна 0N20, Cl20, H20, Ne0,Fe0, Cu0, O30, P40
2. Степень окисления более электроотрицательного атома обозначают со знаком «−», а менее электроотрицательного – со знаком «+»
Н+Сl−, K+F−, Ca+2S−2, Mg+2O−2
3. Cумма степеней окисления в нейтральном соединении равна 0, в многоатомном ионе равна заряду иона
Н+Сl−, Ca+2S−2, Mg+2O−2, Al+3Cl3−
(S+6O4−2)2−, (Mn+7O4−2)−, (H+1C+4O3−2)−
4. Cтепени окисления атомов некоторых элементов в соединениях:
Cтепени окисления атомов некоторых элементов в соединениях:
a) Фтора F -1;
b) Металлов IA – группы Li, Na, K, Rb, Cs +1;
c) Металлов IIA – группы Be, Mg, Ca, Sr, Ba + 2;
d) Алюминия Al +3;
e) Цинка Zn + 2;
f) Водород Н в соединениях с металлами −1, в остальных соединениях +1;
g) Кислорода О в ОF2 +2, в O2F2 +1; в остальных пероксидах (содержат группу -О-О- ) −1, в остальных соединениях −2
Н+1F−1, K+1F−1, O+2F2−1, N+3F3−1, C+4F4−1, C+2H+1F3−1.
Na2+1S−2, Li2+1S+6O4−2, K+1O−2H+1
Ca+2S−2, Mg+2O−2, Ba+2(O−2H+1)2
Al+3Cl3−, Al2+3(S+6O4−2)3
Zn+2S+4O3−2, Zn+2O−2, Zn+2(O−2H+1)2
Na+1H−1, Ca+2H2−1, C−4H4+1, Н+1F−1, K+1O−2H+1, Zn+2(O−2H+1)2
Na2+1O2−1, H2+1O2−1, Mg+2O−2, (Mn+7O4−2)−
5. Cтепень окисления гидроксильной группы ОН −1
Cтепень окисления гидроксильной группы ОН −1
Ca+2(OH)2−1
6. Степень окисления группы NH4 +1
(NH4)2+1S+6O4−2
7. Cтепень окисления кислотного остатка (продукта «отрыва» одного или нескольких Н – атомов от кислоты) отрицательна и равна числу «оторванных» Н — атомов
SO4−2, PO4−3, HCO3−, H2PO4−, MnO4−2
Названия элементов с отрицательной степенью окисления:
Cl — хлорид
О — оксид
Н — гидрид
S — сульфид
N — нитрид
P — фосфид
С — карбид
Br — бромид
Алгоритм составления формул бинарных соединений по степеням окисления атомов
Карточка-задание по теме «Степень окисления”.
Вариант 1.
1.Определите степени окисления элементов в следующих соединениях:
NH3, CaO, H2SO4, P2O5, K3PO4, MnO2, H2S, Al(NO3)3, ZnSiO3, Na.
2.Составьте формулы:
а) хлорида алюминия (с.о. +3)
б) оксида магния
в) оксида калия
Карточка-задание по теме «Степень окисления”.
Вариант 2.
1.Определите степени окисления элементов в следующих соединениях:
PH3, CO, H2SO3, P2O3, Na3PO4, Mn2O7, K2S, Fe(NO3)3, CaSiO3, Li.
2.Составьте формулы:
а) хлорида железа (с.о. +2)
б) оксида кремния
в) карбоната кальция
Карточка-задание по теме «Степень окисления”.
Вариант 3*.
1.Определите степени окисления элементов в следующих соединениях:
NH3, CO2, H3PO4, P2O5, K2SO4, SO3, HCI, Al(NO3)3, ZnSO3, К.
2.Составьте формулы:
а) хлорида алюминия
б) оксида углерода (с.о. +2)
в) оксида азота (с.о.+5)
Карточка-задание по теме «Степень окисления”.
Вариант 4**.
1.Определите степени окисления элементов в следующих соединениях:
AIH3, ZnO, H2SO4, N2O5, Li3PO4, SO2, HI, Fe(NO3)2, CaSiO3, KOH, О2.
2.Составьте формулы:
а) хлорида железа (с.о. +3)
б) оксида алюминия
в) оксида серы (с.о. +6)
г) бромид меди (с. о.+2)
о.+2)
Валентность химических элементов. Степень окисления химических элементов.
1 / 1
Поля, отмеченные звёздочкой (*), обязательны для заполнения!
Проверьте, пожалуйста, правильность заполнения всех полей!
Введите Ф. И. О.
*1. Степень окисления серы в сульфите железа (II)
*-1
+2
0
+4
2. Значения высшей и низшей степеней окисления хлора соответственно равны
*0 и -1
+5 и -3
+7 и -1
+7 и -7
3.
 Одинаковую степень окисления фосфор имеет в соединениях *
Одинаковую степень окисления фосфор имеет в соединениях *Ca 3P 2 и H 3PO 4
KH 2PO 4 и KPO 3
P 4O 6 и P 4O 10
H 3PO 4 и H 3PO 3
4. Наибольшую степень окисления марганец имеет в соединении
*MnSO4
MnO2
K2MnO4
Mn2O3
5.
 Степень окисления хрома в его амфотерных соединениях равна *
Степень окисления хрома в его амфотерных соединениях равна *+1
+2
+3
+6
6. Высшие степени окисления азота и алюминия соответственно равны
*+5 и +3
+5 и 0
-5 и +3
+2 и +5
7. Одинаковую степень окисления железо проявляет в соединениях:
*FeO и FeCO3
Fe(OH)3 и FeCl2
Fe2O3 и Fe(NO3)2
FeO и FePO4
8.
 Валентность IV и степень окисления -3 проявляет азот в соединении *
Валентность IV и степень окисления -3 проявляет азот в соединении *N2H4
NH3
NH4Cl
N2O5
9. Атомы азота и углерода имеют одинаковую степень окисления в соединениях
*NH3 и CO
NO2 и CCl4
N2O3 и CO2
Na3N и CH4
10.
 Валентность IV характерна для *
Валентность IV характерна для *Ca
P
O
Si
Степень окисления азота. Степень окисления азота
ОПРЕДЕЛЕНИЕ
Азот – седьмой по счету элемент Периодической таблицы. Расположен во втором периоде V группы A подгруппы. Обозначение – N.
Азот — типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду.
Природный азот состоит из двух устойчивых изотопов 14 N (99,635%) и 15 N (0,365%).
Молекула азота двухатомна. Между атомами азота в молекуле есть тройная связь, вследствие чего молекула N 2 исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.
В обычных условиях молекулярный азот — газ. Температуры плавления (-210 o С) и кипения (-195,8 o С) азота очень низкие; он плоха растворяется в воде и других растворителях.
Степень окисления азота в соединениях
Азот образует двухатомные молекулы состава N 2 за счет наведения ковалентных неполярных связей, а, как известно, в соединениях с неполярными связями степень окисления элементов равна нулю .
Для азота характерен целый спектр степеней окисления, среди которых есть как положительные, так и отрицательные.
Степень окисления (-3) азот проявляет в соединениях под названием нитриды (Mg +2 3 N -3 2 , B +3 N -3), самым известным из которых является аммиак (N -3 H +1 3).
Степень окисления (-2) азот проявляет в соединениях перикисного типа — пернитридах, простейшим представителем которых является гидразин (диамид/ пернитрид водорода) — N -2 2 H 2 .
В соединении под названием гидроксиламин — N -1 H 2 OH-азот проявляет степень окисления (-1) .
Наиболее устойчивые положительные степени окисления азота — это (+3) и (+5) . Первую из них он проявляет во фториде (N +3 F -1 3), оксиде (N +3 2 O -2 3), оксогалогенидах (N +3 OCl, N +3 OBr и т.д.), а также производных аниона NO 2 — (KN +3 O 2 , NaN +3 O 2 и др.). Степень окисления (+5) азот проявляет в оксиде N +5 2 O 5 , оксонитриде N +5 ON, диоксофториде N +5 O 2 F, а также в триоксонитрат (V) -ионе NO 3 — и динитридонитрат (V) -ионе NH 2 — .
Азот также проявляет степени окисления (+1) — N +1 2 O, (+2) — N +2 O и (+4) N +4 O 2 в своих соединениях, но значительно реже.
Примеры решения задач
ПРИМЕР 1
| Задание | Укажите степени окисления кислорода в соединениях: La 2 O 3 , Cl 2 O 7 , H 2 O 2 , Na 2 O 2 , BaO 2 , KO 2 , KO 3 , O 2 , OF 2 . |
| Ответ | Кислород образует несколько типов бинарных соединений, в которых проявляет характерные степени окисления. Так, если кислород входит в состав оксидов, то его степень окисления равна (-2), как в La 2 O 3 и Cl 2 O 7 . В пероксидах степень окисления кислорода равна (-1): H 2 O 2 , Na 2 O 2 , BaO 2 . В соединении с фтором (OF 2) степень окисления кислорода равна (+2). Степень окисления элемента в простом веществе всегда равна нулю (O o 2). Вещества состава KO 2 и KO 3 — это суперпероксид (надпероксид) и озонид калия, в которых кислород проявляет дробные значения степеней окисления: (-1/2) и (-1/3). |
| Ответ | (-2), (-2), (-1), (-1), (-1), (-1/2), (-1/3), 0 и (+2). |
ПРИМЕР 2
| Задание | Укажите степени окисления азота в соединениях:NH 3 , N 2 H 4 , NH 2 OH, N 2 , N 2 O, NO, N 2 O 3 , NO 2 , N 2 O 5 . |
| Решение | Степень окисления элемента в простом веществе всегда равна нулю (N o 2). Известно, что в оксидах степень окисления кислорода равна (-2). С помощью уравнения электронейтральности определяем, что степени окисления азота в оксидах равны: N +1 2 O, N +2 O, N +3 2 O 3 , N +4 O 2 , N +5 2 O 5 . |
Вариант 1.
1. Число нейтронов в атоме 4N14:
А. 7.
Б. Азоту.
3. Азот имеет степень окисления +5 в соединении с формулой:
Г. HN03.
4. Минимальная степень окисления азота в соединении (из перечисленных ниже) с формулой:
А. N2.
Б. Фосфор.
6. Наименьший радиус у атома:
Г. F.
Б. Са3Р2.
8. Азотистой кислоте соответствует оксид с формулой:
Б. N203.
10. Коэффициент перед окислителем в реакции, схема которой
Ag + HN03(KOHЦ) -> AgN03 + N02 + Н20:
Б. 4.
11. Составьте молекулярные уравнения реакций следующих превращений:
Р -> Р205 -> h4P04 -> Na3P04.
1. 4Р + 5О2 = 2Р2О5
P0 -5e →P+5 восстановитель
O20 + 2*2e→2O-2 окислитель
2. Р2О5 + 3Н2О = 2Н3РО4
3. Н3РО4 + 3NaOH = Na3PO4 + 3h3O
3Н+ + 3OH- = 3h3O
12. Дополните фразу: «Аллотропия — это…»
существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам.
13. С какими из веществ, формулы которых: КОН, С02, Zn, CuO, НС1, СаС03, взаимодействует разбавленная азотная кислота? Запишите уравнения возможных реакций в молекулярном виде.
HNO3 + КOH → КNO3 + h3O
3CuO + 6HNO3 = 3Cu(NO3)2 + 3h3O
10HNO3 разбавл. + 4Zn = 4Zn(NO3)2 + Nh5NO3 + 3h3O
2HNO3 + CaCO3 = Ca(NO3)2 + h3O + CO2
14. Закончите схему термического разложения нитрата меди (II):
Cu(N03)2 —> CuO + X + 02.
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Сумма коэфф. = 9
15. При взаимодействии 37 г гидроксида кальция с сульфатом аммония было получено 15 г аммиака. Вычислите массовую долю выхода аммиака от теоретически возможного.
Ca(OH) 2 +(Nh5)2 SO4 =CaSO4+2Nh4*h3O
M Ca(OH)2=40+32+2=74г/моль.
n Ca(OH)2 =37: 74=0.5 моль
1 моль Са(ОH)2: 2 моль Nh4
0.5:1 моль
M Nh4 = 17г \моль
масса 17*1=17 г.
выход (Nh4)=15: 17=0.88=88%
Вариант 2.
ЧАСТЬ А. Тестовые задания с выбором ответа
1.
 Число нейтронов в атоме 7N15:
Число нейтронов в атоме 7N15: А. 8.
В. Фосфору.
3. Азот имеет степень окисления +4 в соединении с формулой:
B. N02.
4. Минимальная степень окисления фосфора в соединении с формулой:
Б. РН3.
5. Из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
В. Сера
6. Наименьший радиус у атома, символ которого:
Г. С1.
7. Только восстановителем может быть вещество с формулой:
B. Nh4.
8. Фосфористой кислоте Н3Р03 соответствует оксид с формулой:
В. Р2О3
Сu + HN03(KOHЦ) -> CU(N03)2 + N02 + Н20:
Б. 4.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные уравнения реакций, идущих по схеме
NO → N02 → HN03 → NaN03.
1. 2NO + O2 = 2NO2
N+2 -2e→N+4 восстановитель
O20 +2*2e→2O-2 окислитель
2. 4NO2 + O2 + 2h3O = 4HNO3
3. HNO3 + NaOH = NaNO3 + h3O
H+ + OH- = h3O
12. Дополните следующую фразу: «Селитра — это…»
Дополните следующую фразу: «Селитра — это…»
Азотнокислая соль калия, натрия, аммония, употребляемая в технике взрывчатых веществ и в агрономии для удобрений.
13. С какими из веществ, формулы которых: Mg, Ag, AgN03, BaO, C02, KN03, NaOH, взаимодействует ортофосфорная кислота? Запишите уравнения возможных реакций в молекулярном виде.
3NaOH + h4PO4 = Na3PO4 + 3h3O
3 Mg + 2h4PO4 = Mg3(PO4)2↓ + 3h3
2h4PO4 +3BaO = Ba3(PO4)2 + 3h3O
Na3PO4 + 3AgNO3 = Ag3PO4↓ + 3NaNO3
14. Закончите схему термического разложения нитрата натрия
NaN03 → NaN02 + X.
Найдите сумму коэффициентов в уравнении.
2NaNO3 = 2NaNO2 + O2
Сумма коэффициентов – 5
15. Какой объем аммиака (н. у.) можно получить при взаимодействии 15 м3 азота с избытком водорода, если выход аммиака составляет 10% от теоретически возможного?
N2 + 3h3 = 2Nh4
n(N2) = 15 000 /22,4 = 669 (моль)
n(Nh4) = 2*669 = 1339,28 (моль)
Vтеор.(Nh4) = 1339,28*22,4= 29999 (дм3)
Vпракт.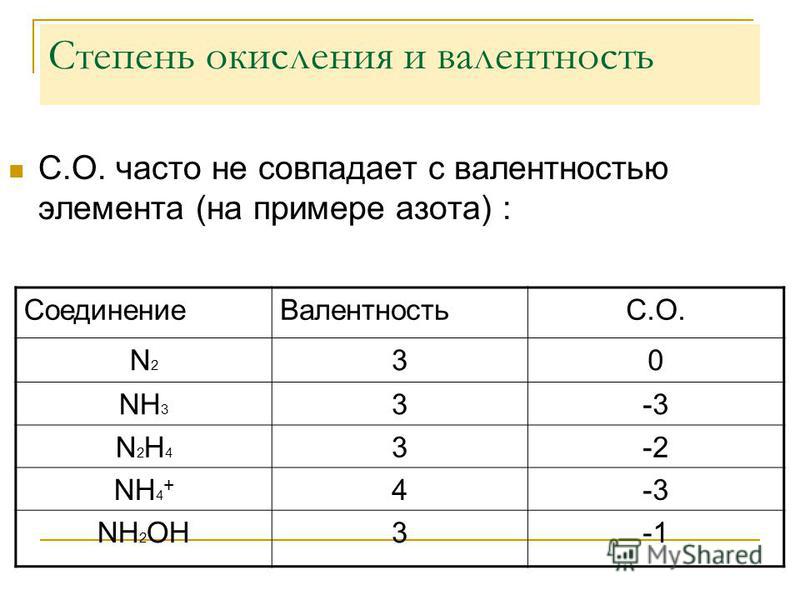 (Nh4) = 29999*0,9 = 26999 (дм3) = 26, 999 м3
(Nh4) = 29999*0,9 = 26999 (дм3) = 26, 999 м3
Вариант 3.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Число нейтронов в атоме 20Са40:
Б. 20.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 5е соответствует:
А. Азоту.
3. Азот имеет степень окисления +2 в соединении с формулой:
Б. NO.
4. Максимальная степень окисления азота в соединении с формулой:
Г. HN03.
А. Бор.
А. С.
Г. Н3Р04.
8. Азотной кислоте соответствует оксид с формулой:
Г. N205.
10. Коэффициент перед окислителем в схеме
Ag + HN03(paзб) -> AgN03 + NO + h30:
Б. 4.
ЧАСТЬ Б. Задания со свободным ответом
11. Составьте молекулярные уравнения реакций по схеме
N2 → Nh4 → Nh4 Н20 → (Nh5)2S04.
Уравнение 1 рассмотрите с точки зрения теории ОВР, уравнение 3 запишите в ионном виде.
1. N2 + 3h3 = 2Nh4
N20 +2*3е→2N-3 окислитель
h30 -2*1е→2H+1 восстановитель
2.
 Nh4 + h3O = Nh4*h30
Nh4 + h3O = Nh4*h303. 2Nh4*h30 + h3SO4 = (Nh5)2SO4 +2h3O
2Nh4*h30 + 2H+= 2Nh5+ +2h3O
12. Дополните фразу: «Число атомов, входящих в катион аммония…»
равно 5.
13. С какими из веществ, формулы которых: S03, КОН, CaO, Mg, N205, Na2C03, взаимодействует разбавленная азотная кислота? Запишите уравнения возможных реакций в молекулярном виде.
HNO3 (разб.) + КOH = КNO3 + h3O
2HNO3 + CaO = Ca(NO3)2 + h3O
10HNO3 разбавл. + 4Mg = 4Mg(NO3)2 + N2O + 3h3O
2HNO3 + Na2CO3 = 2NaNO3 + h3O + CO2
14. Закончите схему термического разложения нитрата серебра
AgNOg → Ag + X + 02.
Укажите сумму коэффициентов в уравнении.
2AgNO3 = 2Ag + 2NO2 + O2
7
15. Азот объемом 56 л (н. у.) прореагировал с избытком водорода. Объемная доля выхода аммиака составляет 50% от теоретически возможного. Рассчитайте объем полученного аммиака.
N2 + 3h3 = 2Nh4
n(N2) = 56 /22,4 = 2,5 (моль)
n(теор.)(Nh4) = 2*2,5 = 5 (моль)
Vпракт. (Nh4) = 5*22,4*0,5 = 56 л
Вариант 4.
ЧАСТЬ А. Тестовые задания с выбором ответа
1. Число нейтронов в изотопе 19K39:
В.20.
2. Распределение электронов по энергетическим уровням в атоме элемента 2е, 8е, 5е соответствует:
Б. Фосфору.
3. Азот имеет степень окисления 0 в соединении с формулой:
A. N2.
4. Максимальная степень окисления фосфора в соединении с формулой:
Г. Н3Р04.
5. Из перечисленных химических элементов наименьшей электроотрицательностью в соединениях обладает:
А. Бериллий.
6. Наибольший радиус у атома химического элемента, символ которого:
A. Si.
7. Только окислителем может быть вещество с формулой:
Г. HN03.
8. Ортофосфорной кислоте соответствует оксид с формулой:
Г. Р2О5.
10. Коэффициент перед окислителем в схеме
Си + HN03(paзб) -> CU(N03)2 + NO + Н20:
Г. 8.
ЧАСТЬ Б. Задания со свободным ответом
11.
 Составьте молекулярные уравнения реакций по схеме:
Составьте молекулярные уравнения реакций по схеме:NO → N02 → HN03 → Nh5N03.
Уравнение 1 рассмотрите с точки зрения ОВР, уравнение 3 запишите в ионном виде.
1. 2NO + O2 = 2NO2
N+2 -2e→N+4 восстановитель
O20 +2*2e→2O-2 окислитель
2. 4NO2 + O2 + 2h3O = 4HNO3
3. Nh4 + HNO3 = Nh5NO3
Nh4 + H+ = Nh5+
12. Дополните фразу: «Аллотропными видоизменениями фосфора являются…»
белый, красный и черный фосфор
13. С какими из веществ, формулы которых: Zn, CuO, Си, NaOH, S02, NaN03, K2C03, взаимодействует ортофосфорная кислота? Запишите уравнения возможных реакций в молекулярном виде.
3NaOH + h4PO4 = Na3PO4 + 3h3O
3 Zn + 2h4PO4 = Zn3(PO4)2↓ + 3h3
3CuO + 2h4PO4 = Cu3(PO4)2 + 3h3O
3K2CO3 + 2h4PO4 = 2K3PO4 + 3h3O + 3CO2
14. Закончите схему термического разложения нитрата железа (II):
Fe(N03)2 → FeO + N02 + X.
Найдите сумму коэффициентов в уравнении.
2Fe(NO3)2 = 2FeO + 4NO2 + O2
15. При сжигании в кислороде 62 г фосфора было получено 130 г оксида фосфора (V) от теоретически возможного. Вычислите массовую долю выхода оксида фосфора (V).
Вычислите массовую долю выхода оксида фосфора (V).
4P + 5O2 = 2P2O5
n(P) = 62/31 = 2 моль
nтеор.(P2O5) = 0,5*2 = 1 моль
mтеор.(P2O5) = 1*142 = 142 г
выход = mпракт./mтеор. = 130/142=0.92 = 92%
Азот — едва ли не самый распространенный химический элемент во всей Солнечной Системе. Если быть конкретнее, то азот занимает 4 место по распространенности. Азот в природе — инертный газ.
Этот газ не имеет ни цвета, ни запаха, его очень трудно растворить в воде. Однако соли-нитраты имеют свойство очень хорошо реагировать с водой. Азот имеет малую плотность.
Азот — удивительный элемент. Есть предположение, что свое название он получил из древнегреческого языка, что в переводе с него значит «безжизненный, испорченный». Отчего же такое негативное отношение к азоту? Ведь нам известно, что он входит в состав белков, а дыхание без него практически невозможно. Азот играет важную роль в природе. Но в атмосфере этот газ инертен. Если его взять таким, какой он есть в первозданном виде, то возможно множество побочных эффектов. Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.
Пострадавший может даже умереть от удушья. Ведь азот оттого и называется безжизненным, что не поддерживает ни горения, ни дыхания.
При обычных условиях такой газ реагирует только с литием, образовывая такое соединение, как нитрид лития Li3N. Как мы видим, степень окисления азота в таком соединении равна -3. С остальными металлами и конечно же, реагирует тоже, однако лишь при нагревании или при использовании различных катализаторов. К слову говоря, -3 — низшая степень окисления азота, так как только 3 электрона нужны для полного заполнения внешнего энергетического уровня.
Этот показатель имеет разнообразные значения. Каждая степень окисления азота имеет свое соединение. Такие соединения лучше просто запомнить.
5 — высшая степень окисления у азота. Встречается в и во всех солях-нитратах.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Химия азота и фосфора
Химия Азот и фосфор
The Химия азота
В химическом составе азота преобладает легкость, с которой атомы азота образуют двойные и тройные связи. Нейтральный азот Атом содержит пять валентных электронов: 2 s 2 2 p 3 . Следовательно, атом азота может достигать октета валентности. электронов, разделив три пары электронов с другим атом азота.
Поскольку ковалентный радиус атома азота относительно маленькие (всего 0,070 нм), атомы азота подходят достаточно близко друг к другу образовывать очень прочные связи. Энтальпия диссоциации связи для тройная связь азот-азот составляет 946 кДж / моль, что почти вдвое больше большие, как для двойной связи O = O.
Прочность тройной связи азот-азот делает N 2 молекула очень инертная. N 2 настолько инертен, что литий
один из немногих элементов, с которыми он реагирует в комнате
температура.
| 6 Li ( с ) | + | N 2 ( г ) | 2 Li 3 Н ( с ) |
Несмотря на то, что молекула N 2 является инертные, соединения, содержащие азот, существуют практически каждый элемент периодической таблицы, кроме элементов группы VIIIA (Он, Не, Ар и т. Д.).Это можно объяснить двумя способами. Во-первых, N 2 становится значительно более реактивным, чем температура повышается. При высоких температурах азот реагирует с водород с образованием аммиака и с кислородом с образованием оксида азота.
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) | |
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) |
Во-вторых, ряд катализаторов, встречающихся в природе, преодолевают
инертность N 2 при низких температурах.
Синтез Аммиак
Трудно представить живую систему, которая не содержат азот, который является важным компонентом белки, нуклеиновые кислоты, витамины и гормоны, которые делают жизнь возможный. Животные получают необходимый им азот из растений или других животных в их рационе. Растения должны собирать свои азота из почвы или абсорбировать его как N 2 из Атмосфера.Концентрация азота в почве довольно высокая. небольшой, поэтому процесс, с помощью которого растения восстанавливают N 2 до NH 3 или «исправить» N 2 крайне важно.
Хотя 200 миллионов тонн NH 3 производится
азотфиксации каждый год, растения сами по себе не могут уменьшить
N 2 к NH 3 . Эта реакция осуществляется
сине-зеленые водоросли и бактерии, связанные с определенными
растения.Наиболее понятный пример азотфиксации включает:
бактерии ризобий, обнаруженные в корневых клубеньках бобовых, таких
как клевер, горох и фасоль. Эти бактерии содержат нитрогеназу
фермент, который способен замечательно восстанавливать N 2 из атмосферы в NH 3 при комнатной температуре.
Эти бактерии содержат нитрогеназу
фермент, который способен замечательно восстанавливать N 2 из атмосферы в NH 3 при комнатной температуре.
Аммиак сначала производят в промышленных масштабах. разработан между 1909 и 1913 годами Фрицем Хабером. В Haber процесс , смесь N 2 и H 2 пропускают газ при температурах от 200 до 300 атм и от 400 до 600 o C катализатор из мелкодисперсного металлического железа.
| Fe | |||||
| N 2 ( г ) | + | 3 H 2 ( г ) | 2 NH 3 ( г ) |
Почти 20 миллионов тонн NH 3 производится в
Соединенные Штаты каждый год этим процессом. Около 80% этого стоит
более 2 миллиардов долларов используется для производства удобрений для растений, которые
не может исправить азот из атмосферы. Исходя из веса,
аммиак — второй по важности промышленный химикат в
Соединенные Штаты. (Только серная кислота производится в больших
количества.)
Около 80% этого стоит
более 2 миллиардов долларов используется для производства удобрений для растений, которые
не может исправить азот из атмосферы. Исходя из веса,
аммиак — второй по важности промышленный химикат в
Соединенные Штаты. (Только серная кислота производится в больших
количества.)
Две трети аммиака, используемого для производства удобрений, перерабатывается.
в твердые вещества, такие как нитрат аммония, NH 4 NO 3 ;
фосфат аммония, (NH 4 ) 3 PO 4 ;
сульфат аммония, (NH 4 ) 2 SO 4 ; и
мочевина, H 2 NCONH 2 .Другая треть применяется
прямо в почву как безводный (буквально,
«без воды») аммиак. Аммиак — это газ в комнате
температура. С ним можно обращаться как с жидкостью при растворении в
вода с образованием водного раствора. В качестве альтернативы это может быть
охлаждается до температуры ниже -33 o C, в этом случае
газ конденсируется с образованием безводной жидкости NH 3 ( л ).
Синтез Азотная кислота
NH 3 , произведенный по методу Габера, не используется в качестве удобрения, сжигается в кислороде для производства азота окись.
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НЕТ ( г ) | + | 6 H 2 O ( г ) |
Оксид азота или оксид азота, как его когда-то знали, бесцветный газ, который быстро реагирует с кислородом с образованием азота диоксид, темно-коричневый газ.
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) |
Двуокись азота растворяется в воде с образованием азотной кислоты и
НЕТ, который может быть уловлен и переработан.
| 3 НЕТ 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) | + | НЕТ ( г ) |
Таким образом, с помощью трехэтапного процесса, разработанного Фридрихом Оствальдом в 1908 г. аммиак можно превратить в азотную кислоту.
| 4 NH 3 ( г ) | + | 5 O 2 ( г ) | 4 НЕТ ( г ) | + | 6 H 2 O ( г ) | |
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НО 2 ( г ) | |||
| 3 НЕТ 2 ( г ) | + | H 2 O ( л ) | 2 HNO 3 ( водн. ) ) | + | НЕТ ( г ) |
Процесс Габера для синтеза аммиака в сочетании с процесс Оствальда для преобразования превращение аммиака в азотную кислоту произвело революцию в индустрии взрывчатых веществ.Нитраты были важным взрывчатым веществом со времен брата Роджера. Бэкон смешал серу, селитру и порошкообразный уголь, чтобы получить порох 1245.
| 16 KNO 3 ( с ) | + | S 8 ( S ) | + | 24 ° C ( с ) | 8 К 2 S ( с ) | + | 24 CO 2 ( г ) | + | 8 Н 2 ( г ) | H o = -571. 9 кДж / моль N 2 9 кДж / моль N 2 |
До того, как был разработан процесс Оствальда, единственный источник нитраты для использования во взрывчатых веществах — это природные минералы например, селитра, которая представляет собой смесь NaNO 3 и KNO 3 . Как только надежный запас азотной кислоты стал доступен из Процесс Оствальда, ряд нитратов может быть использован в качестве взрывчатые вещества. Объединение NH 3 из процесса Габера с HNO 3 из процесса Оствальда, например, дает аммиачная селитра, которая является одновременно отличным удобрением и дешевое и надежное взрывчатое вещество, обычно используемое в порохе.
| 2 NH 4 NO 3 ( с ) | 2 Н 2 ( г ) | + | O 2 ( г ) | + | 4 H 2 O ( г ) |
Разрушающая сила аммиачной селитры составляет
видно на фотографиях федерального здания имени Альфреда П. Мурры
в Оклахома-Сити, который был разрушен бомбой, сделанной из
аммиачная селитра 19 апреля 1995 г.
Мурры
в Оклахома-Сити, который был разрушен бомбой, сделанной из
аммиачная селитра 19 апреля 1995 г.
Средний Номера окисления
Азотная кислота (HNO 3 ) и аммиак (NH 3 ) представляют собой максимальное (+5) и минимальное (-3) степени окисления для азот. Азот также образует соединения при каждом окислении. число между этими крайними значениями (см. таблицу ниже).
Общие числа окисления для азота
| Окисление Число | Примеры | |
| -3 | NH 3 , NH 4 + , NH 2 — , Мг 3 N 2 | |
| -2 | N 2 H 4 | |
| -1 | NH 2 OH | |
| -1/3 | NaN 3 , HN 3 | |
| 0 | N 2 | |
| +1 | N 2 O | |
| +2 | НЕТ, N 2 O 2 | |
| +3 | HNO 2 , NO 2 — , N 2 O 3 , НЕТ + | |
| +4 | НЕТ 2 , Н 2 O 4 | |
| +5 | HNO 3 , NO 3 — , N 2 O 5 |
Отрицательный Число окисления азота помимо -3
Примерно в то время, когда Хабер разработал процесс изготовления
аммиак и Оствальд разработали процесс преобразования аммиака
в азотную кислоту, Рашиг разработал процесс, в котором
ион гипохлорита (OCl — ) для окисления аммиака с образованием
гидразин, N 2 H 4 .
| 2 NH 3 ( водн. ) | + | OCl — ( водн. ) | N 2 H 4 ( водн. ) | + | Класс — ( водн. ) | + | H 2 O ( л ) |
Эту реакцию можно понять, отметив, что OCl — ион — двухэлектронный окислитель.Потеря пары электронов и пары ионов H + соседними NH 3 молекулы образуют пару высокореакционных NH 2 молекулы, которые объединятся, чтобы сформировать молекулу гидразина как показано на рисунке ниже.
Гидразин — бесцветная жидкость со слабым запахом аммиака.
которые могут быть собраны при нагревании этого раствора до N 2 H 4 отгоняется из реакционной колбы. Многие физические
Свойства гидразина аналогичны свойствам воды.
Многие физические
Свойства гидразина аналогичны свойствам воды.
| H 2 O | N 2 H 4 | |||
| Плотность | 1.000 г / см 3 | 1.008 г / см 3 | ||
| Точка плавления | 0,00 o С | 1,54 o С | ||
| Температура кипения | 100 или С | 113,8 o С |
Существует значительная разница между химическими
свойства этих соединений, однако.Гидразин горит при
воспламеняется на воздухе с образованием газообразного азота, водяного пара и больших
количество энергии.
| N 2 H 4 ( л ) | + | O 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) | H o = -534.3 кДж / моль N 2 H 4 |
В основном гидразин используется в качестве ракетного топлива. это уступает только жидкому водороду по количеству килограмм тяги на килограмм сожженного топлива. Гидразин имеет ряд преимуществ перед жидким H 2 , тем не мение. Его можно хранить при комнатной температуре, тогда как жидкий водород необходимо хранить при температуре ниже -253 o C. Гидразин также более плотный, чем жидкий H 2 и поэтому требуется меньше места для хранения.
Чистый гидразин редко используется в качестве ракетного топлива, поскольку он
замерзает при температурах, встречающихся в верхних слоях атмосферы. Гидразин смешивают с N, N -диметилгидразином, (CH 3 ) 2 NNH 2 ,
образовывать раствор, который при низких температурах остается жидким.
Смеси гидразина и N, N -диметилгидразина были
использовались для заправки ракет Titan II, которые несли Project Gemini
космический аппарат, а также реакция производных гидразина с N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют
космический шаттл для маневра в космосе.
Гидразин смешивают с N, N -диметилгидразином, (CH 3 ) 2 NNH 2 ,
образовывать раствор, который при низких температурах остается жидким.
Смеси гидразина и N, N -диметилгидразина были
использовались для заправки ракет Titan II, которые несли Project Gemini
космический аппарат, а также реакция производных гидразина с N 2 O 4 до сих пор используется в качестве топлива для небольших ракетных двигателей, которые позволяют
космический шаттл для маневра в космосе.
Продукт сгорания гидразина необычный. Когда соединения углерода горят, углерод окисляется до CO или CO 2 . При горении соединений серы образуется SO 2 . Когда гидразин сжигается, продукт реакции N 2 из-за необычайно прочной тройной связи азот-азот в молекула N 2 .
| N 2 H 4 ( л ) | + | O 2 ( г ) | N 2 ( г ) | + | 2 H 2 O ( г ) |
Гидразин реагирует с азотистой кислотой (HNO 2 ) с образованием
азид водорода, HN 3 , в котором атом азота
формально имеет степень окисления — 1 / 3 .
| N 2 H 4 ( водн. ) | + | HNO 2 ( водн. ) | HN 3 ( водн. ) | + | 2 H 2 O ( л ) |
Чистый азид водорода — чрезвычайно опасное вещество. Четное с разбавленными растворами следует обращаться осторожно из-за риска взрывов.Азид водорода лучше всего описать как резонансный гибрид структур Льюиса, показанный на рисунке ниже. В соответствующий азид-ион, N 3 — , является линейным молекула, которая представляет собой резонансный гибрид трех структур Льюиса.
| HN 3 | |
| N 3 — |
Положительно Числа окисления азота: галогениды азота
Фтор, кислород и хлор — единственные элементы. электроотрицательный, чем азот.В результате положительное окисление
количества азота находятся в соединениях, которые содержат один или
больше этих элементов.
электроотрицательный, чем азот.В результате положительное окисление
количества азота находятся в соединениях, которые содержат один или
больше этих элементов.
Теоретически N 2 может реагировать с F 2 на образуют соединение с формулой NF 3 . На практике N 2 слишком инертен, чтобы проходить эту реакцию при комнатной температуре. NF 3 получается реакцией аммиака с F 2 в присутствии катализатор на основе металлической меди.
| Cu | ||||||
| NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 HF ( г ) |
HF, образующийся в этой реакции, соединяется с аммиаком с образованием
фторид аммония. Общая стехиометрия реакции составляет
поэтому написано так.
Общая стехиометрия реакции составляет
поэтому написано так.
| Cu | ||||||
| 4 NH 3 ( г ) | + | 3 F 2 ( г ) | NF 3 ( г ) | + | 3 NH 4 F ( с ) |
Структура Льюиса NF 3 аналогична Структура Льюиса NH 3 , и две молекулы имеют похожие формы.
Аммиак реагирует с хлором с образованием NCl 3 , который
на первый взгляд кажется тесно связанным с NF 3 .
Но между этими соединениями есть существенная разница. NF 3 практически инертен при комнатной температуре, тогда как NCl 3 это чувствительная к ударам, взрывоопасная жидкость, разлагающаяся до
форма N 2 и Cl 2 .
| 2 NCl 3 ( л ) | N 2 ( г ) | + | 3 Класс 2 ( г ) |
Аммиак реагирует с йодом с образованием твердого вещества, представляющего собой комплекс между NI 3 и NH 3 .Этот материал является предмет популярной, но опасной демонстрации, в которой заливают свежеприготовленные образцы НИ 3 в аммиаке. на фильтровальную бумагу, которой дают высохнуть на подставке для колец. После аммиак испаряется, NH 3 / NI 3 кристаллы касаются пером, прикрепленным к метровой палочке, приводя к детонации этого чувствительного к удару твердого тела, которое разлагается с образованием смеси N 2 и I 2 .
| 2 NI 3 ( с ) | N 2 ( г ) | + | 3 I 2 ( г ) |
Положительно Числа окисления азота: оксиды азота
Структуры Льюиса для семи оксидов азота с окислением
числа от +1 до +5 приведены в
Таблица ниже.
Все эти соединения имеют две общие черты: они содержат N = O двойные связи, и они менее стабильны, чем их элементы в газовой фазы, как показано данными по энтальпии образования в Таблица ниже.
Данные об энтальпии образования оксидов азота
| Соединение | H o f (кДж / моль) | |
| N 2 O ( г ) | 82.05 | |
| НЕТ ( г ) | 90,25 | |
| НЕТ 2 ( г ) | 33,18 | |
| N 2 O 3 ( г ) | 83,72 | |
| N 2 O 4 ( г ) | 9. 16 16 | |
| N 2 O 5 ( г ) | 11,35 |
Оксид диазота, N 2 O, также известный как закись азота, может быть получена осторожным разложением аммония нитрат.
| от 170 до 200 o C | ||||
| NH 4 NO 3 ( с ) | N 2 O ( г ) | + | 2 H 2 O ( г ) |
Закись азота — бесцветный газ со сладким запахом, наиболее известный
нехимики как «веселящий газ».»Еще в 1800 году
Хамфри Дэви отметил, что N 2 O, вдыхаемый в относительно
в небольших количествах, часто вызывает состояние явного опьянения
сопровождается судорожным смехом или плачем. Когда принято
в больших дозах закись азота обеспечивает быстрое и эффективное облегчение
от боли. Поэтому N 2 O использовался как первый
анестетик. Поскольку для анестезии необходимы большие дозы,
и продолжительное воздействие газа может быть фатальным, N 2 O is
сегодня используется только для относительно коротких операций.
Когда принято
в больших дозах закись азота обеспечивает быстрое и эффективное облегчение
от боли. Поэтому N 2 O использовался как первый
анестетик. Поскольку для анестезии необходимы большие дозы,
и продолжительное воздействие газа может быть фатальным, N 2 O is
сегодня используется только для относительно коротких операций.
Закись азота имеет несколько других интересных свойств. Первый, хорошо растворяется в сливках; по этой причине он используется как пропеллент в дозаторах для взбитых сливок. Во-вторых, хотя это так не гореть сам по себе, это лучше, чем воздух при поддержке возгорание других предметов. Это можно объяснить, отметив, что N 2 O может разлагаться с образованием атмосферы, которая одна треть O 2 по объему, тогда как обычный воздух составляет только 21% кислород по объему.
| 2 Н 2 O ( г ) | 2 Н 2 ( г ) | + | O 2 ( г ) |
Уже много лет окончания — ous и — ic использовались для различения самого низкого и самого высокого в паре
степени окисления. N 2 O — закись азота, поскольку
степень окисления азота +1.NO оксид азота
потому что степень окисления азота +2.
N 2 O — закись азота, поскольку
степень окисления азота +1.NO оксид азота
потому что степень окисления азота +2.
Огромные количества оксида азота или оксида азота генерируется каждый год реакцией между N 2 и O 2 в атмосфере, катализируемая ударом молния, проходящая через атмосферу или горячие стены двигатель внутреннего сгорания.
| N 2 ( г ) | + | O 2 ( г ) | 2 НЕТ ( г ) |
Одна из причин понижения степени сжатия автомобильных двигателей в последние годы является снижение температуры реакции горения, тем самым уменьшая количество NO выбрасывается в атмосферу.
NO может быть получен в лаборатории путем реакции металлической меди
с разбавленной азотной кислотой .
| 3 Cu ( с ) | + | 8 HNO 3 ( водн. ) | 3 Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ ( г ) | + | 4 H 2 O ( л ) |
Молекула NO содержит нечетное количество валентных электронов.В результате невозможно написать структуру Льюиса для этого молекула, в которой все электроны спарены (см. таблицу оксидов азота). Когда НЕТ газа При охлаждении пары молекул NO соединяются в обратимой реакции образуют димер (от греч. «два частей «), с формулой N 2 O 2 , в в котором все валентные электроны спарены, как показано в таблице оксидов азота.
NO быстро реагирует с O 2 с образованием диоксида азота
(когда-то известный как перекись азота), который представляет собой темно-коричневый газ при температуре
комнатная температура.
| 2 НЕТ ( г ) | + | O 2 ( г ) | 2 НЕТ 2 ( г ) |
NO 2 можно приготовить в лаборатории путем нагревания определенные нитраты металлов до их разложения.
| 2 Pb (НЕТ 3 ) 2 ( с ) | 2 PbO ( с ) | + | 4 НЕТ 2 ( г ) | + | O 2 ( г ) |
Его также можно получить реакцией металлической меди с концентрацией азотная кислота,
| Cu ( с ) | + | 4 HNO 3 ( водн. ) ) | Cu (NO 3 ) 2 ( водн. ) | + | 2 НЕТ 2 ( г ) | + | 2 H 2 O ( л ) |
NO 2 также имеет нечетное количество электронов и следовательно, содержит по крайней мере один неспаренный электрон в своей льюисовской конструкции.NO 2 димеризуется при низких температурах с образованием N 2 O 4 молекулы, в которых все электроны являются парными, как показано в таблице оксидов азот.
Смеси NO и NO 2 при охлаждении объединяются с образованием
триоксид диазота, N 2 O 3 , который является синим
жидкость. Образование голубой жидкости при НЕТ или НЕТ 2 охлаждается поэтому подразумевает наличие хотя бы небольшого
часть другого оксида, потому что N 2 O 2 и
N 2 O 4 оба бесцветны.
Путем осторожного удаления воды из концентрированной азотной кислоты при низкие температуры с дегидратирующим агентом мы можем образовывать диазот пентоксид.
| 4 HNO 3 ( водн. ) | + | P 4 O 10 ( с ) | 2 Н 2 O 5 ( с ) | + | 4 HPO 3 ( с ) |
N 2 O 5 — бесцветное твердое вещество, которое разлагается на свету или при нагревании до комнатной температуры.Как мог и следовало ожидать, N 2 O 5 растворяется в воде до образуют азотную кислоту.
| N 2 O 5 ( с ) | + | H 2 O ( л ) | 2 HNO 3 ( водн.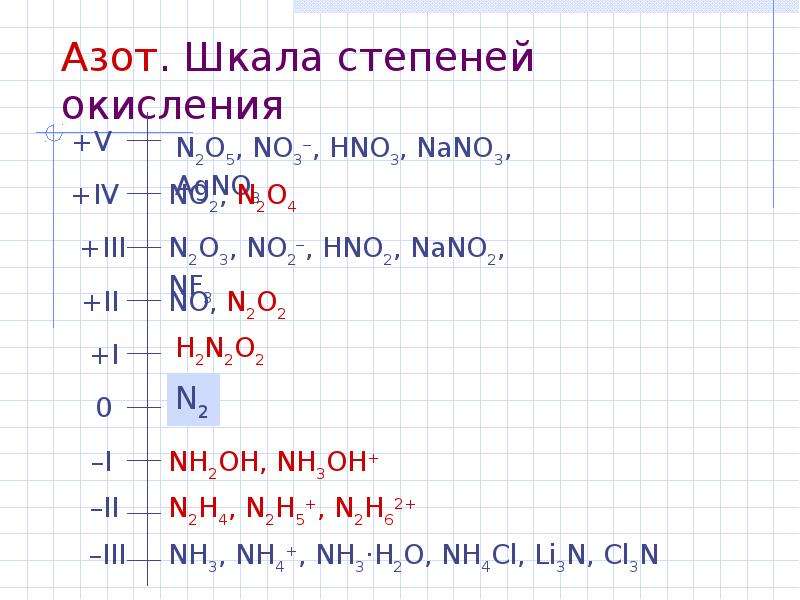 ) ) |
Химия Фосфор
Фосфор — первый элемент, открытие которого можно проследить одному человеку.В 1669 году в поисках пути к преобразовав серебро в золото, компания Hennig Brand получила белый восковой твердое вещество, которое светилось в темноте и самопроизвольно загоралось при контакте с воздухом. Бренд создал это вещество путем испарения вода из мочи и позволяя черному остатку разлагаться на несколько месяцев. Затем он смешал этот остаток с песком, нагрел это смесь в присутствии минимального количества воздуха, и собрана под вода летучие продукты, которые вышли из реакции колба.
Фосфор образует ряд соединений, являющихся прямыми аналогами
азотсодержащих соединений. Однако тот факт, что
элементарный азот практически инертен при комнатной температуре,
тогда как элементарный фосфор может самопроизвольно загореться
при контакте с воздухом показывает, что есть различия между
эти элементы тоже.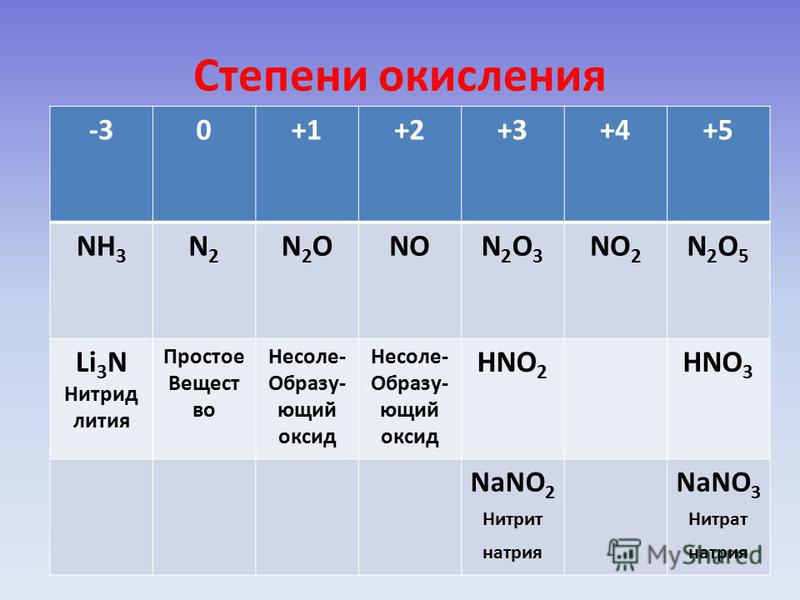 Фосфор часто образует соединения с
те же степени окисления, что и аналогичные соединения азота, но
с разными формулами, как показано в таблице ниже.
Фосфор часто образует соединения с
те же степени окисления, что и аналогичные соединения азота, но
с разными формулами, как показано в таблице ниже.
Соединения азота и фосфора с Те же числа окисления, но разные формулы
| Число окисления | Соединение азота | Фосфорное соединение | ||
| 0 | N 2 | п. 4 | ||
| +3 | HNO 2 (азотистая кислота) | H 3 PO 3 (фосфористая кислота) | ||
| +3 | N 2 O 3 | P 4 O 6 | ||
| +5 | HNO 3 (азотная кислота) | H 3 PO 4 (фосфорная кислота) | ||
| +5 | NaNO 3 (нитрат натрия) | Na 3 PO 4 (фосфат натрия) | ||
| +5 | N 2 O 5 | P 4 O 10 |
Те же факторы, которые объясняют разницу между серой
и кислород можно использовать для объяснения различий между
фосфор и азот.
1. Тройные связи азот-азот намного прочнее, чем тройные связи фосфор-фосфор.
2. Одинарные связи P-P прочнее одинарных связей N-N.
3. Фосфор ( EN = 2,19) намного меньше электроотрицательна, чем азот ( EN = 3,04).
4. Фосфор может расширять свою валентную оболочку, удерживая более восемь электронов, но не азот.
Эффект Различия в прочности одиночной и тройной связи
Отношение радиусов атомов фосфора и азота равно такое же, как отношение радиусов атомов серы и кислорода, в пределах экспериментальная ошибка.
В результате тройные связи фосфор-фосфор значительно
слабее, чем тройные связи азот-азот, по той же причине
что двойные связи S = S слабее, чем двойные связи O = O фосфора
атомы слишком велики, чтобы подходить достаточно близко друг к другу, чтобы образовать прочные
облигации.
Каждый атом в молекуле N 2 завершает свой октет валентных электронов, разделяя три пары электронов с единственный соседний атом. Поскольку фосфор не образует прочных кратные связи с собой, элементарный фосфор состоит из тетраэдрические P 4 молекулы, в которых каждый атом образует одинарные связи с тремя соседними атомами, как показано на рисунке ниже.
Фосфор — белое твердое вещество с восковым оттенком, которое плавится при 44,1 o C и кипит при 287 o C. производится путем восстановления фосфата кальция углеродом в присутствии кремнезем (песок) при очень высоких температурах.
| 2 Ca 3 (PO 4 ) 2 ( с ) | + | 6 SiO 2 ( с ) | + | 10 ° C ( с ) | 6 CaSiO 3 ( с ) | + | P 4 ( с ) | + | 10 CO ( г ) |
Белый фосфор хранится под водой, потому что элемент
самопроизвольно загорается в присутствии кислорода при
температура лишь немного выше комнатной. Несмотря на то что
фосфор не растворяется в воде, хорошо растворяется в углероде
дисульфид. Решения P 4 в CS 2 являются
достаточно стабильный. Как только CS 2 испарится,
однако фосфор воспламеняется.
Несмотря на то что
фосфор не растворяется в воде, хорошо растворяется в углероде
дисульфид. Решения P 4 в CS 2 являются
достаточно стабильный. Как только CS 2 испарится,
однако фосфор воспламеняется.
Валентный угол P-P-P в тетраэдрической молекуле P 4 составляет всего 60 o . Этот очень маленький угол дает
значительное количество деформации в молекуле P 4 ,
что можно уменьшить, разорвав одну из связей P-P.Таким образом, фосфор образует другие аллотропы, открывая P 4 .
тетраэдр. Когда белый фосфор нагревается до 300 o C,
одна связь внутри каждого тетраэдра P 4 разорвана, и
P 4 молекулы соединяются вместе, образуя полимер (от греческого pol — «многие» и meros ,
«части») со структурой, показанной на рисунке ниже.
Этот аллотроп фосфора темно-красный, и его присутствие в
небольшие следы часто придают белому фосфору светло-желтый цвет. Красный фосфор более плотный (2,16 г / см 3 ), чем белый
фосфор (1,82 г / см 3 ) и гораздо менее реакционноспособен при
нормальные температуры.
Красный фосфор более плотный (2,16 г / см 3 ), чем белый
фосфор (1,82 г / см 3 ) и гораздо менее реакционноспособен при
нормальные температуры.
Эффект Различия в сильных сторонах двойных облигаций P = X и N = X
Размер атома фосфора также влияет на его способность образовывать двойные связи с другими элементами, такими как кислород, азот, и сера.В результате фосфор имеет тенденцию образовывать соединения, которые содержат две одинарные связи P-O, где азот образует N = O двойная связь. Азот образует нитрат, NO 3 — , ион, например, у которого степень окисления +5. Когда фосфор образует ион с такой же степенью окисления, это фосфат, PO 4 3- , ион, как показано на рисунок ниже.
Аналогичным образом азот образует азотную кислоту HNO 3 , которая
содержит двойную связь N = O, тогда как фосфор образует фосфорную
кислота, H 3 PO 4 , содержащая одиночный P-O
облигации, как показано на рисунке ниже.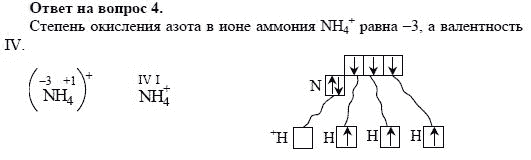
Эффект Различия в электроотрицательности фосфора и азота.
Разница между электроотрицательностями фосфора и азот ( EN = 0,85) такой же, как разница между электроотрицательностями серы и кислорода ( EN = 0,86), в пределах ошибки эксперимента. Потому что меньше электроотрицательный, фосфор с большей вероятностью, чем азот показывают положительную степень окисления.Наиболее важное окисление числа для фосфора -3, +3 и +5 (см. таблицу ниже).
Общее число окисления фосфора
| Окисление Число | Примеры | |
| -3 | Ca 3 P 2 , PH 3 | |
| +3 | PF 3 , P 4 O 10 , H 3 PO 3 | |
| +5 | PF 5 , P 4 O 10 , H 3 PO 4 , ПО 4 3- |
Поскольку он более электроотрицателен, чем большинство металлов,
фосфор реагирует с металлами при повышенных температурах с образованием
фосфиды, у которых степень окисления -3.
| 6 Ca ( с ) | P 4 ( с ) | 2 Ca 3 P 2 ( с ) |
Эти фосфиды металлов реагируют с водой с образованием ядовитый, высокоактивный, бесцветный газ, известный как фосфин (PH 3 ), который имеет самый отвратительный запах, с которым столкнулись авторы.
| Ca 3 P 2 ( с ) | + | 6 H 2 O ( л ) | 2 PH 3 ( г ) | + | 3 Ca 2+ ( водн. ) | + | 6 OH — ( водн. ) |
Образцы фосфорного аналога аммиака PH 3 ,
часто загрязнены следами P 2 H 4 ,
фосфорный аналог гидразина. Как будто токсичность и запах
PH 3 было недостаточно, смеси PH 3 и
P 2 H 4 самопроизвольно загорелся в
наличие кислорода.
Как будто токсичность и запах
PH 3 было недостаточно, смеси PH 3 и
P 2 H 4 самопроизвольно загорелся в
наличие кислорода.
Соединения (например, Ca 3 P 2 и PH 3 ) в которых фосфор имеет отрицательную степень окисления, далеко превосходит количество соединений, в которых степень окисления фосфор положительный. Фосфор горит в O 2 до производят P 4 O 10 в реакции, которая выделяет необычайное количество энергии в виде тепла и света.
| P 4 ( с ) | + | 5 O 2 ( г ) | P 4 O 10 ( с ) | H o = -2985 кДж / моль P 4 |
Когда фосфор горит в присутствии ограниченного количества O 2 ,
Произведено П 4 О 6 .
| P 4 ( с ) | + | 3 O 2 ( г ) | P 4 O 6 ( с ) | H o = -1640 кДж / моль P 4 |
P 4 O 6 состоит из тетраэдра, в котором атом кислорода вставлен в каждую связь P-P в P 4 молекула (см. рисунок ниже).P 4 O 10 имеет аналогичная структура, с дополнительным атомом кислорода, связанным с каждым четырех атомов фосфора.
P 4 O 6 и P 4 O 10 реагировать с водой с образованием фосфористой кислоты, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 соответственно.
| P 4 O 6 ( с ) | + | 6 H 2 O ( л ) | 4 H 3 PO 3 ( водн. ) ) | |
| P 4 O 10 ( с ) | + | 6 H 2 O ( л ) | 4 H 3 PO 4 ( водн. ) |
P 4 O 10 обладает таким высоким сродством к воде что он обычно используется как дегидратирующий агент.Фосфор кислота, H 3 PO 3 , и фосфорная кислота, H 3 PO 4 , являются примерами большого класса оксикислот фосфора. Льюис структуры для некоторых из этих оксикислот и связанных с ними оксианионов приведены в таблице ниже.
Эффект Различия в способности фосфора и азота расширяться Их валентная оболочка
Реакция аммиака с фтором останавливается при NF 3 поскольку азот использует 2 с , 2 p x , 2 p y и 2 p z орбиталей для удержания валентных электронов. Следовательно, атомы азота могут иметь максимум восемь валентностей.
электроны. Фосфор, однако, имеет пустое 3 d атомных
орбитали, которые можно использовать для расширения валентной оболочки до 10
или больше электронов. Таким образом, фосфор может реагировать с фтором с образованием
образуют как PF 3 , так и PF 5 . Фосфор может даже
образуют ион ПФ 6 —, в котором 12
валентные электроны на центральном атоме, как показано на рисунке
ниже.
Следовательно, атомы азота могут иметь максимум восемь валентностей.
электроны. Фосфор, однако, имеет пустое 3 d атомных
орбитали, которые можно использовать для расширения валентной оболочки до 10
или больше электронов. Таким образом, фосфор может реагировать с фтором с образованием
образуют как PF 3 , так и PF 5 . Фосфор может даже
образуют ион ПФ 6 —, в котором 12
валентные электроны на центральном атоме, как показано на рисунке
ниже.
Азот — химический состав и соединения — азот, белки, кислота и примеры
Хотя молекулярный азот относительно инертен, он может соединяться с рядом других элементов при высоких температурах. Когда он реагирует с металлами, такими как алюминий , магний, литий, кальций , барий, стронций и титан , продукты известны как нитриды. Нитрид лития (Li 3 N), например, используется для обеспечения азота в различных металлургических операциях.
Азот и кислород соединяются (опять же, при высоких температурах) прямо и косвенно с образованием ряда соединений, которые включают закись азота (или окись азота; N 2 O), окись азота (или окись азота; NO), диазот триоксид (или ангидрид азота; N 2 O 3 ), диоксид азота (NO 2 ) и пятиокись азота (или ангидрид азота; N 2 O 5 ).Азот и галогены также реагируют друг с другом с образованием ряда очень нестабильных взрывоопасных соединений, которые включают трифторид азота (NF 3 ), трихлорид азота (NCl 3 ) и трииодид азота (NI 3 ).
Наиболее распространенными соединениями азота являются те, в которых элемент демонстрирует степени окисления 3 — , 3 + или 5 + . Аммиак (NH 3 ) и его соединения (соединения аммония) являются примерами первого из них, нитриты (NO — 2 ) являются примерами 3 + степень окисления , а нитраты (NO — 3 ) являются примерами степени окисления 5 + .
Аммиак (NH 3 ) и его соединения (соединения аммония) являются примерами первого из них, нитриты (NO — 2 ) являются примерами 3 + степень окисления , а нитраты (NO — 3 ) являются примерами степени окисления 5 + .
Процесс, посредством которого азот циркулирует в окружающей среде, от растений к животным, в атмосферу и обратно к растениям, известен как цикл азота .В этом цикле газообразный азот в атмосфере преобразуется («фиксируется») в комбинированную форму под действием молнии , в которой он превращается в оксид азота, или с помощью определенных азотфиксирующих бактерий в почвы , которые превращают ее в нитраты и нитриты. Затем объединенный азот поглощается растениями и используется для образования растительных белков.
Растительные белки съедаются животными, которые превращают эти белки в животных белков. Когда животное умирает, белки возвращаются в почву, где денитрифицирующие бактерии расщепляют соединения азота и возвращают азот в атмосферу в виде элемента.
Когда животное умирает, белки возвращаются в почву, где денитрифицирующие бактерии расщепляют соединения азота и возвращают азот в атмосферу в виде элемента.
Три соединения азота традиционно входят в топ-25 химических веществ, производимых в наибольших объемах в США. Это аммиак (номер пять в 1988 году), азотная кислота, (номер 12 в 1988 году) и нитрат аммония (номер 14 в 1988 году). Все три этих соединения широко используются в сельском хозяйстве в качестве синтетических удобрений.Например, более 80% производимого аммиака идет на производство синтетических удобрений.
Помимо сельскохозяйственной роли, азотная кислота также является важным сырьем для производства взрывчатых веществ . Тринитротолуол (ТНТ), порох, нитроглицерин, динамит и бездымный порох — все это примеры взрывчатых веществ, изготовленных из азотной кислоты. Немногим более 5% произведенной азотной кислоты также используется в синтезе адипиновой кислоты и родственных соединений, используемых при производстве нейлона.
окислительных состояний | Введение в химию
Цель обучения
- Предскажите степени окисления обычных элементов по их групповому номеру.
Ключевые моменты
- Степень окисления чистого элемента всегда равна нулю.
- Степень окисления чистого иона эквивалентна его ионному заряду.
- Как правило, водород имеет степень окисления +1, а кислород — степень окисления -2.
- Сумма степеней окисления всех атомов нейтральной молекулы должна равняться нулю.
Условия
- уменьшение прироста электронов, что вызывает уменьшение степени окисления
- окисление: потеря электронов, вызывающая увеличение степени окисления .
Степень окисления указывает на степень окисления атома в химическом соединении; это гипотетический заряд, который имел бы атом, если бы все связи с атомами различных элементов были полностью ионными.Состояния окисления обычно представлены целыми числами, которые могут быть положительными, отрицательными или нулевыми. В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
В некоторых случаях средняя степень окисления элемента является дробной, например 8/3 для железа в магнетите (Fe 3 O 4 ).
Наивысшая известная степень окисления +8 у тетроксидов рутения, ксенона, осмия, иридия, хассия и некоторых комплексов с участием плутония; самая низкая известная степень окисления -4 для некоторых элементов углеродной группы.
Степени окисления плутония Здесь цвет плутония меняется в зависимости от степени окисления.Повышение степени окисления атома в результате химической реакции называется окислением, и оно включает потерю электронов; Уменьшение степени окисления атома называется восстановлением, и оно связано с увеличением количества электронов.
Общие правила, касающиеся состояний окисления
- Степень окисления свободного элемента (несоединенного элемента) равна нулю.
- Для простого (одноатомного) иона степень окисления равна чистому заряду иона. Например, Cl — имеет степень окисления -1.

- Когда он присутствует в большинстве соединений, водород имеет степень окисления +1, а кислород — степень окисления −2. Исключениями являются то, что водород имеет степень окисления -1 в гидридах активных металлов (таких как LiH) и степень окисления -1 в пероксидах (таких как H 2 O 2 ) или -1 / 2 в супероксидах (например, KO).
- Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле должна быть равна нулю. В ионах алгебраическая сумма степеней окисления составляющих атомов должна быть равна заряду иона.
Прогнозирование состояний окисления
Как правило, степень окисления большинства обычных элементов может быть определена по номеру их группы в периодической таблице. Это показано в следующей таблице:
Типичные степени окисления наиболее распространенных элементов по группе Переходные металлы не включены, поскольку они имеют тенденцию проявлять различные степени окисления. Из приведенной выше таблицы можно сделать вывод, что бор (элемент III группы) обычно имеет степень окисления +3, а азот (элемент V группы) — степень окисления -3. Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо фиксированных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Имейте в виду, что степени окисления могут измениться, и этот метод прогнозирования следует использовать только в качестве общего руководства; например, переходные металлы не придерживаются каких-либо фиксированных правил и имеют тенденцию проявлять широкий диапазон степеней окисления.
Как указано в правиле номер четыре выше, сумма степеней окисления для всех атомов в молекуле или многоатомном ионе равна заряду молекулы или иона. Это помогает определить степень окисления любого элемента в данной молекуле или ионе при условии, что мы знаем общие степени окисления всех других элементов.Например, в сульфит-ионе (SO 3 2- ) общий заряд иона равен 2-, и предполагается, что каждый кислород находится в своей обычной степени окисления -2. Поскольку в сульфите три атома кислорода, кислород вносит [латекс] 3 \ times-2 = -6 [/ latex] в общий заряд. Следовательно, сера должна иметь степень окисления +4, чтобы общий заряд сульфита составлял 2-: [латекс] (+ 4-6 = -2). [/ Latex]
[/ Latex]
Не путайте формальный заряд атома с его формальной степенью окисления, поскольку они могут быть разными (а часто и разными в многоатомных ионах).Например, заряд атома азота в ионе аммония NH 4 + равен 1+, но формальная степень окисления -3 — такая же, как у азота в аммиаке. В случае между аммиаком и аммиаком формальный заряд атома N изменяется, а его степень окисления — нет.
Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
| Атомный номер: | 7 |
| Атомный вес: | 14.0067 |
| Средняя концентрация в океане: | N 2 — 590 моль / л NO 3 — — 30 моль / л |
| Время пребывания: | НЕТ 3 — 10 000 лет |
Вид
Стабильная форма азота в присутствии кислорода — NO 3 — ,
с N в степени окисления + V. Фитопланктон должен добавить 8 электронов к
производят аммиак (NH 3 ) со степенью окисления -III, что
это форма азота, в которой они нуждаются. Когда органическое вещество
реминерализовано, бактерии окисляют NH 3 до NO 3 —.
В присутствии очень низких концентраций кислорода бактерии могут снижать NO 3 — согласно N 2 , чтобы потреблять органические вещества. Во время этих
процессов, многие соединения азота с промежуточными степенями окисления
производятся, в том числе нитриты (NO 2 — ) и закись азота (N 2 O).
Фитопланктон должен добавить 8 электронов к
производят аммиак (NH 3 ) со степенью окисления -III, что
это форма азота, в которой они нуждаются. Когда органическое вещество
реминерализовано, бактерии окисляют NH 3 до NO 3 —.
В присутствии очень низких концентраций кислорода бактерии могут снижать NO 3 — согласно N 2 , чтобы потреблять органические вещества. Во время этих
процессов, многие соединения азота с промежуточными степенями окисления
производятся, в том числе нитриты (NO 2 — ) и закись азота (N 2 O).
Распространение в океане
Растворенный нитрат NO 3 — имеет питательный вертикальный профиль.
Огромную изменчивость содержания нитратов показывает диаграмма север-юг.
разрез через Тихий океан. Концентрации истощены до
близкие к нулю значения (<10 нМ в некоторых областях) на поверхности океана (данные). Этот
может ограничить первичное производство. Редкие, вихревые явления, вызывающие выброс нитратов
в поверхностные воды может быть важным средством контроля за круговоротом углерода в
океан.Лучше всего их проверять с помощью автономных сенсорных систем в открытом море.
причалы. Временная изменчивость также может быть значительной в прибрежных районах.
зона. Годовой цикл температуры, солености
и питательные вещества в прибрежном районе центральной Калифорнии доступны (600 тыс.
скачать).
Этот
может ограничить первичное производство. Редкие, вихревые явления, вызывающие выброс нитратов
в поверхностные воды может быть важным средством контроля за круговоротом углерода в
океан.Лучше всего их проверять с помощью автономных сенсорных систем в открытом море.
причалы. Временная изменчивость также может быть значительной в прибрежных районах.
зона. Годовой цикл температуры, солености
и питательные вещества в прибрежном районе центральной Калифорнии доступны (600 тыс.
скачать).
Нитрат обычно хорошо коррелирует с фосфатом в океане. Эта корреляция нарушается, когда кислород падает ниже 20 моль / кг и расходуется NO 3 — как конечный акцептор электронов для окисления органического углерода.
Основной формой азота является газообразный азот (N 2 ). В
концентрация газообразного азота контролируется равновесием с частичным
давление N 2 в атмосфере. Вертикальный профиль концентрации
N 2 определяется растворимостью газа в
температура и соленость на каждой глубине (данные N2).
Основным промежуточным продуктом восстановления и окисления азота является NO 2 — . Вертикальный профиль НО 2 — май показывают два максимума концентрации. Один находится у основания эвфотической зоны, где NO 2 — образуется в виде нитрата, который фитопланктон преобразует в аммиак, а затем обратно бактерии. Второй максимум возникает, если есть кислородный минимум, где концентрации достаточно низкие, чтобы снизить содержание нитратов.
Время пребывания
Время пребывания оценивается по скорости потери нитратов из-за
денитрификация (Codispoti, 1989).
Анализ
Нитраты обычно определяют колориметрически восстановлением до нитрита и
затем образует розовый азокраситель с нитритом. Нитриты и нитраты могут быть
определяется на низких наномолярных уровнях за счет образования оксидов азота, которые
определяется хемилюминесценцией в газовой фазе. Нитраты также могут быть
определяется непосредственно путем измерения его спектра поглощения в далеком ультрафиолете.
Нитраты также могут быть
определяется непосредственно путем измерения его спектра поглощения в далеком ультрафиолете.
Ссылки
— MCAT Physical
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы вуза предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как
в качестве
ChillingEffects. org.
org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы искажать информацию о том, что продукт или действие нарушают ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного расположения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) что вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или агентом такого владельца; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении прав, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) что вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или агентом такого владельца; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении прав, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Число окисления и состояние окисления Chemistry Tutorial
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Что такое окислительное число?
Прежде чем мы рассмотрим, что такое степень окисления, стоит вспомнить, что такое ион и каково его зарядовое число.
Рассмотрим атом кислорода O, который имеет 6 валентных электронов.
Он имеет сильную тенденцию притягивать к себе 2 электрона, чтобы заполнить свой октет электронов (он считается электроотрицательным).
Если атом кислорода получает 2 электрона, он образует оксидный ион O 2- с зарядом 2- (зарядовое число 2-).
Это происходит, когда наш атом кислорода встречает атом, который намного, намного менее электроотрицателен (то есть более электроположительный атом), такой как атом магния, Mg.
Если мы взаимодействуем газообразный кислород и металлический магний вместе в реакции окисления, то атом кислорода оттягивает 2 электрона атома магния, образуя ион магния, Mg 2+ , и ион оксида, O 2-.
Вместе они составляют сложный оксид магния, в котором отношение Mg 2+ к O 2- составляет 1: 1, поэтому соединение может быть представлено как Mg 2+ O 2- , но обычно приводится в виде «молекулярной» формулы MgO.
Обратите внимание, что соединение Mg 2+ O 2- или MgO не имеет общего чистого заряда, потому что количество положительных зарядов равно количеству отрицательных зарядов в соединении.
Зарядное число соединения равно 0.
Но что произойдет, если наш атом кислорода столкнется с другим атомом, который не способен оттягивать электроны от атома кислорода?
Например, атом азота.
Представьте, что мы могли бы взаимодействовать газообразный азот и газообразный кислород вместе в реакции окисления с образованием новых соединений, которые являются оксидами азота.
Все эти новые соединения ковалентны, ионы отсутствуют.
Все эти новые соединения электрически нейтральны, у них нет общего заряда, зарядовое число каждого соединения равно 0.
Рассмотрим эти возможные соединения:
- NO (монооксид азота)
- НЕТ 2 (диоксид азота)
Монооксид азота (NO) — наименее окисленная форма азота, она содержит наименьшее количество атомов кислорода. Можно сказать, что атом азота в NO находится в более низкой степени окисления, более низкой степени окисления.
Можно сказать, что атом азота в NO находится в более низкой степени окисления, более низкой степени окисления.
Двуокись азота (NO 2 ) — наиболее окисленная форма азота, в ней содержится наибольшее количество атомов кислорода. Можно сказать, что атом азота в NO 2 находится в высшей степени окисления, высшей степени окисления.
Но подождите, а как насчет N 2 O (оксид диазота)? Является ли атом азота в N 2 O менее окисленным, чем NO, или более окисленным?
Чтобы ответить на этот вопрос, мы будем использовать понятие степени окисления, чтобы указать степень окисления (степень окисления) каждого атома азота в каждой указанной выше молекуле.
Степень окисления — это своего рода «учетная запись», помогающая нам понять, как электроны (отрицательные заряды) распределяются в молекуле.
Мы начнем с того, что скажем: «Давайте представим, что каждое из этих ковалентных соединений без суммарного общего заряда на самом деле является ионным, то есть в каждом соединении мы будем делать вид, что присутствует оксидный ион, O 2-. Затем мы сможем определить, каким будет заряд каждого из этих воображаемых «ионов азота» ».
Затем мы сможем определить, каким будет заряд каждого из этих воображаемых «ионов азота» ».
В этом сценарии NO представляет собой электрически нейтральную молекулу, у нее нулевой общий заряд, зарядовое число = 0
Ион оксида, O 2-, имеет зарядовое число 2-
Итак, какой «заряд» должен быть у «иона азота», чтобы сбалансировать заряд на ионе оксида?
Назовем неизвестный заряд х .
Чтобы молекула имела чистый заряд 0, сумма зарядов всех «анионов» и «катионов» должна быть 0
0 = заряд на ионе оксида + заряд на «ионе азота»
Заменитель 2- для заряда оксид-иона:
0 = 2- + х
Добавьте 2+ к обеим сторонам уравнения:
0 + 2+ = ( 2+ + 2-) + x
2+ = x
Если атом азота несет заряд, то заряд будет 2+.
Но это НЕ ионное соединение, поэтому атом азота НЕ несет заряда.
Вместо этого мы ссылаемся на атом азота как на находящийся в окисленном состоянии (НЕ в заряженном состоянии), и мы ссылаемся на «кажущийся заряд» атома как на его степень окисления.
Теперь ясно, что мы не можем использовать 2+ для обозначения степени окисления, потому что это будет указывать число заряда на ионе, поэтому мы используем либо:
- римская цифра (для положительной степени окисления знак не требуется, знак минус, — требуется перед римской цифрой для отрицательной степени окисления)
- арабское число (знак + или — перед номером)
Некоторые римские цифры и соответствующие им арабские числа приведены в таблице ниже:
| Арабский номер | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|
| Римская цифра | I | II | III | IV | В | VI | VII | VIII | IX | х |
Нам нужно преобразовать «заряд» атома азота, вычисленный выше (2+), в степень окисления:
- Римская цифра II (для положительной степени окисления знак не требуется)
- Арабское число: перед числом стоит знак +, то есть +2
Степень окисления азота в NO составляет II (или, альтернативно, +2)
Поскольку соединение NO НЕ является ионным, нам никогда не следовало называть атом кислорода в молекуле «оксидным ионом» с зарядовым числом 2-
Но мы МОЖЕМ называть каждый атом кислорода в соединении имеющим степень окисления -II (или, альтернативно, -2).
Рассчитаем степень окисления азота в наиболее окисленной форме NO 2 .
NO 2 — ковалентная молекула без общего суммарного заряда, зарядовое число = 0
Пусть каждый атом кислорода имеет степень окисления -II (в расчетах мы будем использовать -2)
Пусть x = степень окисления атома азота
Напишите выражение для расчета степени окисления атома азота:
зарядовое число молекулы = общее число степеней окисления кислорода + общее число степеней окисления азота
Так как в молекулярной формуле 2 атома кислорода и 1 атом азота:
зарядовое число молекулы = 2 × степень окисления кислорода + степень окисления азота
Подставьте степени окисления в уравнение:
0 = (2 × -2) + x
0 = -4 + х
Добавьте +4 к обеим сторонам уравнения:
+4 + 0 = +4 + -4 + х
+4 = х
Степень окисления азота в NO 2 составляет IV (или, альтернативно, +4)
Обратите внимание, что NO является менее окисленной формой азота, чем NO 2 , потому что:
- содержит меньше кислорода на атом азота
(так что валентные электроны азота испытывают меньшее притяжение со стороны атомов кислорода) Азот - имеет более низкую степень окисления, чем в NO 2
А как насчет N 2 O?
Степень окисления азота в N 2 O равна I (или, альтернативно, +1), что меньше степени окисления азота в NO (которая равна II или +2), поэтому N 2 O — менее окисленная форма азота, чем NO.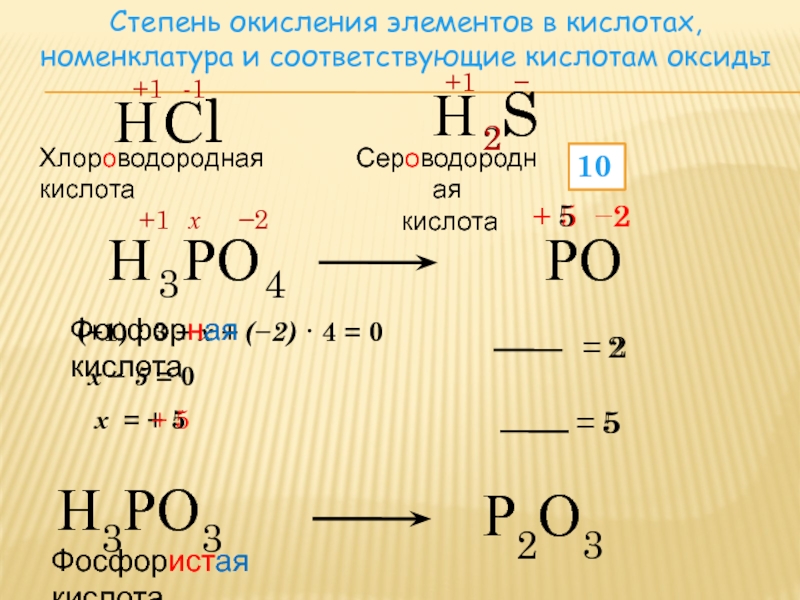
Вы увидите два разных метода, используемых для определения степени окисления атома в соединении, как указано ниже:
- В рекомендованных IUPAC степенях окисления используются римские цифры.
(a) Если степень окисления положительная, она обозначается степенью окисления ТОЛЬКО римской цифрой (без знака +), например I, II
(b) Если степень окисления отрицательная, она обозначается степенью окисления с использованием знака минус (-) непосредственно перед римской цифрой, например, -I, -II
(c) Если степень окисления равна нулю, она обозначается степенью окисления с использованием арабского числа 0.
- Альтернативный метод для указания степени окисления атома использует знаки и арабские числа для степени окисления (эти арабские числа проще использовать в расчетах):
(a) Если степень окисления положительная, она обозначается степенью окисления с использованием знака плюс (+) непосредственно перед арабским числом, например, +1, +2.

(b) Если степень окисления отрицательная, она обозначается степенью окисления со знаком минус (-) непосредственно перед арабским числом, например, -1, -2.
(c) Если степень окисления равна нулю, это указывается степенью окисления с использованием арабского числа 0
Мы можем использовать понятие степени окисления, даже если в молекуле нет кислорода!
Мы можем применить понятие степени окисления к атомам гидридов, фторидов, хлоридов, бромидов, йодидов, нитридов, сульфидов, фосфидов и т. Д.
Но прежде чем мы сможем это сделать, нам нужно будет изучить правила присвоения степеней окисления…


 Ca(OCl)2 и Cl2O7
Ca(OCl)2 и Cl2O7 ок. -1
ок. -1



 Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Вы должны отключить приложение при входе в систему или уточнить у системного администратора.

Leave A Comment