Степени окисления IV и выше
Как уже отмечалось, степень окисления +1 наиболее характерна для серебра. Поскольку у меди и золота более устойчивая степень окисления выше, большинство соединений одновалентных меди и золота во влажном воздухе неустойчиво они легко окисляются, переходя в устойчивые соединения Си» и Аи + . Соли Си+ постепенно окисляются кислородом воздуха, I апример [c.227]Объясните, почему кислород, находящийся в VI группе периодической системы, не проявляет в своих соединениях степени окисления выше двух. [c.117]
Комплексы с центральным ионом, обладающим степенью окисления выше -I- 3, довольно редки. Обычно они встречаются только с такими лигандами, как О» и F . По мере повышения степени окисления центрального иона следует ожидать повышения прочности связи в комплексе. Однако при слишком высокой степени окисления центральный ион настолько сильно притягивает электроны лигандов, что они полностью отрываются от лигандов. В результате комплекс оказывается неустойчивым, а металл восстанавливается, переходя в более низкое состояние окисления. По этой причине Fe не образует комплексов с I вместо этого он окисляет ион I в Ij. Поскольку О и F-сильно электроотрицательные элементы, а ионы О» и F , связанные с центральным ионом металла, очень трудно поддаются окислению, они могут существовать в комплексах, где центральный ион имеет более высокую степень окисления, чем обычная степень окисления + 2 или + 3.
Как уже было сказано, понятие об ионных радиусах во многих случаях условно постоянство радиуса одного и того же иона в различных соединениях соблюдается лишь приближенно. Обычно указываемый заряд иона следует понимать буквально только для одно- и двухзарядных ионов в соединениях, где велика доля ионной связи. Ионы с большим зарядом практически не встречаются в кристаллах (гидратированные одноатомные ионы с зарядами 2+, 2- и 3+, иногда и 4+ существуют в водных растворах).
Характеристика элементов. Радиусы атомов членов этого семейства, хотя и незначительно, уменьшаются от железа к никелю. Как следствие этого, уменьшается способность отдавать электроны. Поэтому максимальная степень окисления железа равна 6, а у кобальта и никеля 4. Устойчивое валентное состояние для железа +3, а для других двух элементов 4-2, причем у никеля в обычных условиях 01ю единственное, если не считать особые условия его существования в некоторых оксидных системах и комплексах типа K NiF6. Для кобальта степень окисления выше 4-4 неизвестна, состояние 4-3 устойчиво, но 4-2 более характерно. В некоторых слу-
Как уже было сказано, понятие об ионных радиусах во многих случаях условно постоянство величины л о в различных соединениях соблюдается лишь приближенно. Да и величину заряда иона следует понимать буквально только для однозарядных и двухзарядных ионов, так как ионы с большим зарядом практически не-встречаются в кристаллах. В соединениях, содержащих элементы в степени окисления выше 4-2, связь, как правило, не бывает ионной и поэтому понятие [c.84]
На внешнем энергетическом уровне атомов элементов восьмой группы находится не более двух электронов (кроме Р(1 — 18 электронов на четвертом уровне), поэтому все они являются металлами и проявляют только положительную степень окисления. В реакциях могут принимать участие не только электроны наружного слоя, но и -электроны соседнего с внешним уровня, однако большинство элементов восьмой группы не проявляет высшей степени окисления (+8) высшие оксиды, отвечающие формуле НО , известны только для рутения и осмия, остальные элементы могут находиться в степени окисления -Ь2, -1-3, реже 4-4 а степень окисления выше четырех и ниже двух встречается редко.
Замечено, что только элементы этой группы проявляют степень окисления выше, чем номер группы. Медь, серебро и золото проявляют степени окисления + 1, +11 и +111 (за исключением +11 для золота), хотя устойчивость этих степеней окисления неодинакова. Предполагают, что причиной является небольшое различие между энергией связи последнего -электрона на уровнях М, 4(1 и 5с( и внешних 4з-, бх- и бх-электронов. Сравнивая первые и вторые ионизационные потенциалы металлов подгруппы 1 Б (табл. 4-7), легко заметить некоторую непоследовательность в их изменении. Ниже приведены величины А1 == [ — г.
Медь из всех переходных металлов, пожалуй, наиболее электрохимически изученный металл в неводных средах [796, 681, 684, 766, 765, 689, 1118, 814, 74, 1009, 1153, 419, 1022, 714, 73, 351, 994, 722, 1052, 904, 906, 742, 745, 743, 712, 780, 1175, 1233, 837, 1134, 989, 680, 697, 718, 241, 885, 467, 1265, 913, 470, 247, 915, 1006, 68, 678, 428, 429, 430, 392, 391, 393, 394, 613, 841, 842, 720, 77, 78, 642, 353, 356, 354, 246]. Этому способствовала прежде всего стабилизация низщих степеней окисления меди в органических растворителях, что приводит при электрохимических измерениях к стадийному протеканию процессов разряда—ионизации меди, как и иных металлов со степенями окисления выше единицы [350, 304, 1078]. Закономерности протекания стадийных электродных процессов и устойчивости ионов низших валентностей широко изучены на примере переходных металлов, в первую очередь иона Сц2+ [681, 684, 689, 1118, 643, 419, 351, 904, 917, 1226, 942, 899, 679, 1000, 802 984, 354, 1078, 827, 498, 937].
Почему очень трудно окислить элемент до степени окисления выше номера его группы [c.309]
Характерная для ряда Ti, V, Сг, Мп, Fe тенденция к пониженной устойчивости высших состояний окисления и к повышенной устойчивости состояния окисления II по сравнению с состоянием III справедлива и для кобальта. Действительно, для кобальта вообще не известна степень окисления выше IV. Состояние окисления III обладает большей устойчивостью по сравнению с состоянием II в случае гидроокисей, фторидов и главным образом многочисленных комплексных соединений. Известны также довольно интересные комплексы Со это состояние окисления свойственно кобальту в гораздо большей степени, чем другим элементам первого ряда переходных элементов, за исключением меди.
Действительно, для кобальта вообще не известна степень окисления выше IV. Состояние окисления III обладает большей устойчивостью по сравнению с состоянием II в случае гидроокисей, фторидов и главным образом многочисленных комплексных соединений. Известны также довольно интересные комплексы Со это состояние окисления свойственно кобальту в гораздо большей степени, чем другим элементам первого ряда переходных элементов, за исключением меди.
В качестве катализаторов используют элементы, характеризующиеся высокими степенями окисления (выше трех), и железо (П1). К таким элементам относятся ТЫ «, Nb Та , Мо» , В некоторых окислительно-восстановительных реакциях катализаторами являются также соединения титана (IV), ванадия (V), хрома (VI), которые легко взаимодействуют с перекисью водорода, образуя комплексные соединения, или пероксосоединения. Образование комплексов с перекисью водорода для проявления катализа условие, по-видимому, необходимое, но недостаточное.
Строение внешних электронных оболочек атомов Хп 3 / 4у , d 4 / °54 , Hg 4г 5 °6 . Благодаря более высокому заряду ядра атомов элементов подфуппы ПБ, чем у атомов Си, Ае и Аи в предшествующих периодах, связь /-электронов у Хп, d, Hg с ядром прочнее, и эти элементы не проявляют степени окисления выше +2 (т. е. в образовании связей участвуют только два внешних ж-электрона). [c.562]
Электронный милливольтметр измеряет разность усиленных фототоков фотоэлементов колориметрических трубок датчика. При заданном соотношении окислов азота в газоходе стрелка электронного милливольтметра ЭРМ находится в зоне нечувствительности и заслонки окислительного объема неподвижны. При увеличении степени окисления выше заданной, стрелка регулирующего милливольтметра отклоняется влево и включается исполнительный ме-
Это вполне объяснимо, если принять во внимание, что образование соединений, в которых иридий проявляет степень окисления выше (IV), весьма затруднено [4]. [c.308]
[c.308]
При степени окисления выше 50% [c.22]
Определение при степени окисления выше 50% [c.53]
Из гидроксидов ЭОН устойчив AgOH, два других распадаются на воду и Э2О. Гидроксид серебра — амфолит — с сильнее выраженными основными свойствами. Так, рКь — 3,6, а рАд = 11,4. Поскольку для элементов подгруппы меди в образовании химических связей помимо из -электронов принимают участие сравнительно близкие по энергии электроны (и — 1) -оболочки, они проявляют степени окисления выше характеристической (так называемые экстравалентные состояния). Из оксидов в степени окисления +2 и +3 устойчивы СиО и AU2O3. Первый получается непосредственным взаимодействием компонентов, а второй — осторожным обезвоживанием Аи(ОН)з. Гидроксиды Си(ОН)г и Аи(ОН)з получают действием щелочи на растворимые соли Си и Аи . Гидроксиды Си(0Н)2 и Аи(ОН)з амфотерны
Элементы Zn, d и Hg обладают уникальными свойствами. Они напоминают щелочноземельные элементы, потому что не имеют степеней окисления выше -1-2, но отличаются от них тем, чтоне-посредственно под валентными орбиталями у них лежит слой который гораздо легче поляризуется, чем более плотная оболочка инертного газа. Химия этих элементов будет рассмотрена в последней главе ч. П вслед за элементами главных подгрупп, но перед переходными элементами.
Данные, полученные с помощью химических методов. Сопоставляя устойчивость актинидов с различными степенями окисления, можно видеть, что длж них наиболее характерна степень окисления 3. По мере перехода от меньших атомных номеров к большим состояние со степенью окисления -]-3 становитса все более устойчивым. Так, например, при переходе от урана к америцию трудность окисления в кислых средах от степени окисления — -3 до — — 4, а тем более от — — 4 до — — 6 возрастает. Кюрий же и вовсе не удалось окислить до степени окисления выше -р 3. В табл. 32 приведены значения молярных оки- [c. 194]
194]
Представляется весьма мало вероятным, чтобы Мп со степенью окисления выше -)-4 мог восстанавливать воду или ион гидроксила и при этом окисляться, и поэтому возрастание степени окисления атомов отдачи марганца могло бы происходить лишь в результате их окисления макроскопическими количествами ионов МПО4, присутствующих в растворе. Если бы такая реакция действительно имела место, то должна была бы наблюдаться зависимость величины неизвлекаемой части активного Мп от концентрации Мп01. Поскольку Либби не [c.209]
Для объяснения последнего результата Бергес и Кеннеди предполагают, что после позитронного распада происходит ионизация значительной части образующихся атомов и что в случае превращения твердого МпСОд часть образовавшихся атомов имеет степень окисления выше трех, и эти атомы легко обмениваются с хромом в степени окислегия — -6. Атомы Сг 1, образующиеся иа ионов Мп++ в водном растворе, очень сильно ионизированы, и, повидимому, в этом весьма возбужденном состоянии они восстанавливаются водой. Это предположение подтверждается тем фактом, что при распаде Мп++, растворенного в смесях ацетона с водой и диоксана с водой, от 5 до 15°/о было обнаружено во фракции хрома со степенью окисления шесть, тогда как в случае распада (Мп 1)++ в водных растворах меньше 3°/о активного хрома имело степень окисления шесть. [c.226]
Краткая характеристика актиноидов. Энергии подуровней 5f, Ы у этих элементов сближены сильнее, чем подуровней 4/, Ъс1 и б5 у лантаноидов. Следовательно, элементы должны проявлять степени окисления выше -ЬЗ чаще, чем в семействе лантаноидов. Все элементы радиоактивны и, начиная с нептуния, являются искусственно полученными. Свойства относительно хорошо изучены для элементов до америция. Для остальных элементов имеется только ограниченное число данных. Радиусы атомов и ионов установлены неточно и, по-видимому, лежат между актинием и лантаном, постепенно уменьшаясь от тория к лауренсию. [c.325]
[c.325]
Можно полагать, что в тех комплексах, в которых лиганды с сильно выраженными я-акцепторными свойствами отсутствуют, роль яр зр-орбит цианогрупп в образовании дативных связей будет значительно выше. Очевидно также, что в комплексных цианидах, в которых атом металла находится в низших степенях окисления, я-дативные связи М N более эффективны, чем в комплексах, в которых атом металла находится в состоянии с более высокой степенью окисления. Выше уже приводились примеры ферро- и феррицианид-ионов, а также комплексов двух-и четырехвалентной платины. Можно прибавить, что для ряда гексацианокомплексов металлов уменьшение степени окисления металла не приводит к существенному изменению величины А (или, что то же, силы поля лигандов), что можно объяснить [1452] усилением роли я-дативной компоненты. [c.116]
Вследствие легкого окисления титана, циркония и гафния до степеней окисления выше +2 окислительно-восстановительное и кислотно-основное поведение этих элементов более сложно, чем элементов групп IA, ПА, П1А. Это находит отражение на диаграммах Е—pH (см. рис. 38.12). Кислотные свойства усиливаются по мере увеличения положительной степени окисления, поэтому ТЮг, ZrO и Hf02 инертны если не ко всем, то по крайней мере к большинству кислотных реагентов. В самом деле 2гОг и НЮг настолько инертны, что занимают полностью Е—рН-область устойчивости в воде. Энергии решеток этих двух окислов очень высоки, поэтому они инертны к сильным основаниям и являются твердыми тугоплавкими веществами. Это прекрасные огнеупорные материалы, которые можно использовать для футеровки печей и изготовления тиглей, предназначенных для работы во многих необычных корродирующих средах при высоких температурах. MgO и AI2O3 также являются прекрас- [c.331]
Переходные металлы комплексы и строение
Переходные металлы, Переходные металлы. переходные металлы — простые и сложные комплексы переходных металлов. Переходные металлы (переходные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Переходные металлы (переходные элеме́нты) — элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d- и f-орбиталях. В общем виде электронное строение переходных элементов можно представить следующим образом: . На ns-орбитали содержится один или два электрона, остальные валентные электроны находятся на -орбитали. Поскольку число валентных электронов заметно меньше числа орбиталей, то простые вещества, образованные переходными элементами, являются металлами.
Общая характеристика переходных элементов. Все переходные элементы имеют следующие общие свойства:
Небольшие значения электроотрицательности.
Переменные степени окисления. Почти для всех d-элементов, в атомах которых на внешнем ns-подуровне находятся 2 валентных электрона, известна степень окисления +2.
Начиная с d-элементов III группы Периодической системы химических элементов Д. И. Менделеева, элементы в низшей степени окисления образуют соединения, которые проявляют основные свойства, в высшей — кислотные, в промежуточной — амфотерные. Например:
Для всех переходных элементов характерно образование комплексных соединений.
Подгруппа меди. Подгруппа меди, или побочная подгруппа I группы Периодической системы химических элементов Д. И. Менделеева, включает в себя элементы: медь Cu, серебро Ag и золото Au.
Для всех металлов характерны высокие значения плотности, температур плавления и кипения, высокая тепло- и электропроводность. [8]
Особенностью элементов подгруппы меди является наличие заполненного предвнешнего -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[9]
Медь, Медные группы. Медь представляет собой довольно мягкий металл красно-жёлтого цвета. В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
В электрохимическом ряду напряжений металлов она стоит правее водорода, поэтому растворяется только в кислотах-окислителях (в азотной кислоте любой концентрации и в концентрированной серной кислоте):
таб?
В отличие от серебра и золота, медь окисляется с поверхности кислородом воздуха уже при комнатной температуре. В присутствии углекислого газа и паров воды её поверхность покрывается зелёным налётом, представляющим собой основной карбонат меди (II).
Для меди наиболее характерна степень окисления +2, однако существует целый ряд соединений, в которых она проявляет степень окисления +1.
Платиновые металлы
Основная статья: Металлы платиновой группы
Платиновые металлы — семейство из 6 химических элементов побочной подгруппы VIII группы Периодической системы, включающее рутений Ru, родий Rh, палладий Pd, осмий Os, иридий Ir и платину Pt. Эти металлы подразделяются на две триады: лёгкие — триада палладия (Ru, Rh, Pd) и тяжёлые — триада платины (Os, Ir, Pt).
Нас находят по запросам:
— переходные металлы
— комплексы переходных металлов
— строение переходные металлы
— простые и переходные металлы
— галогениды переходных металлов
— нитриды переходных металлов
— комплексы переходных металлов
— сплав переходных металлов
— расчёт комплексов переходных металлов
— водорастворимые полимеры переходные металлы
— свойства комплексов переходных металлов
— структура переходных металлов
«Медь в окружающей среде и организме человека»
Муниципальное бюджетное образовательное учреждение
Средняя общеобразовательная школа №58
«Медь в окружающей среде и организме человека»
Выполнила: ученица 10А класса
Гришина Наталья
Научный руководитель:
Гаджиева Ольга Ивановна
г. Нижний Новгород.
Нижний Новгород.
2013 г.
Содержание
Введение
2
1
Характеристики элемента ПС Д. И. Менделеева — медь
3-10
1.1
Положение элемента. Строение меди
3
1.2
Степени окисления элемента
4
1.3
Характеристика элемента — медь
5
1.4
Химические свойства меди
6-10
2
Нахождение меди в мире
11-12
2.1
Нахождение меди в природе
11
2.2
Нахождение меди в продуктах питания
12
2.3
Нахождение меди в организме человека
12
3
Применение меди в медицинской практике
13-26
3.1
Физиологическая роль меди в организме человека
16-17
3.2
Функция меди
18-19
3.3
Избыток или недостаток в организме человека. Последствия.
20-24
3.4
Заболевания, связанные с недостатком меди в организме
25-26
4
Качественные химические реакции ионов меди
27-30
Заключение
31
Список использованной литературы
32
Введение
Моя работа весьма актуальна, так как я не просто знакомлюсь со строением атома меди, но и на протяжении всей работы отражаю химические свойства элемента, с помощью аналитических реакций.
Цель: глубже изучить химический элемент периодической системы Д. И. Менделеева – медь.
Задачи исследование:
— познакомиться со строением атома элемента медь;
— исследовать химические свойства;
— провести аналитические реакции;
-рассмотреть заболевание, возникающие за счёт недостатка меди в организме человека;
— затронуть применение микроэлемента в медицине;
— разобрать препараты (биологически активные добавки) в состав, которых входит медь;
— изучить научную литературу.
Характеристики элемента медь
Положение в Периодической системе элемента медь. Строение.
Медь (Cuprum), Сu — химический элемент побочной подгруппы первой группы четвертого периода периодической системы элементов Д.И. Менделеева. Порядковый номер 29, атомная масса 63,54. Распределение электронов в атоме меди — Is2 2s2 2p6 3s2 3p6 3d10 4s1.
Cu, химический элемент побочной подгруппы (семейства монетных металлов — Cu, Ag, Au) периодической системы элементов. Подобно атомам щелочных металлов, атомы всех этих элементов имеют в наружном слое по одному электрону; но последний их электронный слой содержит, в отличие от атомов щелочных металлов, восемнадцать электронов. Структура двух внешних электронных оболочек атомов этих элементов можно изобразить формулой (n -1)s2 (n -1)p6 (n-1)d10 ns1 (где n – номер периода, в котором находится данный элемент). Все элементы подгруппы меди – предпоследние члены декад d – элементов. Однако, как видно из приведенной формулы, их атомы содержат на (n — 1) d – подуровне не 9, а 10 электронов. Это объясняется тем, что структура (n — 1) d10 s1 более устойчива, чем структура (n — 1) d9 s2 .
Радиус атома меди меньше радиуса атома металла главной подгруппы. Это обуславливает значительно большую плотность, высокие температуры плавления и большие величины энтальпии атомизации рассматриваемого металла; меньшие по размеру атомы располагаются в решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металлов этой подгруппы, чем щелочных металлов. Это приводит к большим различиям в химических свойствах металлов обеих подгрупп. Элементы подгруппы меди – малоактивные металлы. Они с трудом окисляются, и, наоборот, их ионы легко восстанавливаются; они не разлагают воду, гидроксиды их являются сравнительно слабыми основаниями. В ряду напряжений они стоят после водорода. В то же время восемнадцатиэлектронный слой, устойчивый у других элементов, здесь ещё не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзарядные, которые для неё даже более характерны (устойчивы).
Переходный металл – медь проявляет степени окисления +1 и +2 (наиболее устойчива) и образует соответственно два ряда соединений. Но также существует у меди степень окисления +3 и +4, они являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Степени окисления элемента
У элементов подгруппы меди первая энергия ионизации существенно выше, чем у s- элементов I группы. Это объясняется проникновением внешнего n s-электрона под экран (n — 1) d10-электронов Уменьшение первой энергии ионизации при переходе от Си к Ag обусловлено большим значением главного квантового числа n. Дальнейшее же увеличение энергии ионизации у Аи обусловлено проникновением 6 s-электрона не только под экран 5d10-электронов, но и под экран 4f14— электронов. Что касается второй энергии ионизации [удаление электрона из (n — 1) d10-подслоя], то у всех трех элементов она близка и по значению заметно меньше, чем у щелочных металлов.
Что касается второй энергии ионизации [удаление электрона из (n — 1) d10-подслоя], то у всех трех элементов она близка и по значению заметно меньше, чем у щелочных металлов.
В соответствии со сказанным элементы подгруппы меди проявляют не только степень окисления +1, но и +2 и +3. Для меди наиболее характерна степень окисления +2. Медь образует много соединений в степени окисления +1 и +2, но известны и некоторые нестабильные соединения меди в степени окисления +3. Соединения в степени окисления +1 обычно плохо растворяются в воде, являются восстановителями, легко окисляются на воздухе и, как правило, менее практически ценны и реже используются по сравнению с соединениями, в которых медь находится в степени окисления +2.
Все это обусловливает большую склонность меди и ее аналогов к образованию ковалентной связи, чем у щелочных металлов.
Элементы подгруппы меди могут образовывать как катионные и анионные комплексы. Понятно, что по мере повышения степени окислении тенденция к образованию анионных комплексов возрастает. Степени окисления элементов подгруппы меди и отвечающие им координационные числа и пространственные конфигурации комплексов приведены в таблице.
Степень окисления и пространственная конфигурация структурных единиц соединений элемента меди.
Степень окисления
Координационное число
Пространств венная конфигурация
Примеры соединения
+1
2
3
4
Линейная
Треугольная
Тетраэдрическая
Cu2O
K[Cu (CN)2]
CuHal [Cu (CN)4]3-
+2
4
6
Квадратная
Октаэдрическая
CuO, CuCl2
CuC12 *2H20, K[Cu F3]
+3
4
Квадратная
KCu02
Все растворимые соединения меди ядовиты.
Характеристика элемента медь
Медь — мягкий, тяжелый, ковкий, тягучий, вязкий и достаточно прочный металл красновато-желтого цвета в отраженном свете и зеленый в проходящем (в очень тонком слое). Чистая медь очень хорошо проводит тепло и электрический ток, уступая в этом только серебру, но ее электрическая проводимость резко падает в присутствии примесей мышьяка, сурьмы, кремния и др. Расплавленная медь поглощает воздух и после затвердевания в отливке остаются пузырьки воздуха, затрудняющие обработку. В ряду напряжений медь стоит после водорода и при реакции с кислотами не вытесняет из них водород, поэтому медь широко используется в гальванических элементах.
Малый радиус атомов объясняет также более высокие значения энергии ионизации металла меди побочной подгруппы, чем щелочных металлов. Это приводит к большим различием в химических свойствах металлов обеих подгрупп. Медь, как элемент малоактивный металл. Он с трудом окисляется, и, наоборот, его ионы легко восстанавливаются; он не разлагает воду, его гидроксиды являются сравнительно слабыми основаниями. В ряду напряжений он стоит после водорода. В то же время восемнадцати электронный слой, устойчивый у других элементов, здесь ещё не вполне стабилизировался и способен к частичной потере электронов. Так, медь наряду с однозарядными катионами образует и двухзарядные, которые для неё даже более характерны.
Медь устойчива к коррозии при обычной температуре в сухом воздухе, но при нагревании окисляется, образуя оксиды меди(I) и меди(II): Cu2O и CuO. При долговременной атмосферной коррозии постепенно образует основной карбонат, по составу аналогичный малахиту: 2Cu + O2 + CO2 + H2O = Cu2(OH)2CO3. С галогенами медь соединяется уже при комнатной температуре, легко взаимодействует с серой и селеном; с водородом, азотом и углеродом не реагирует даже при высокой температуре. В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота.
В отсутствие кислорода медь не реагирует ни с хлороводородной (соляной) кислотой, ни с разбавленной серной, но растворяется в горячей концентрированной серной кислоте (Cu + 2H2SO4 (r) CuSO4 + SO2 + 2H2O) и хорошо в азотной, образуя нитрат меди и оксиды азота.
Химические свойства меди
В ряду напряжений металлов она стоит после водорода и является малоактивным металлом, который кислоты могут окислять лишь за счет аниона: Си и Ag растворяются в HNO3 и концентрированной H2SO4 .
Си + 2H2 S04 (конц.) = CuS04 + S02 + 2Н2 0
3Си + 8HN03 (paз6) = 3Cu (N03)2 + 2NO + 4Н2 0
или в присутствии дополнительного окислителя в среде:
2Cu + 02 + 4НС1 =2CuC12 + 2Н2 0
Химическая активность меди невелика и убывает с возрастанием порядкового номера элемента. Об этом, в частности, свидетельствуют значения энергии Гиббса образования её бинарных соединений. Медь при обычной температуре легче всего реагируют с галогенами.
С кислородом непосредственно взаимодействует медь. При температуре красного каления образуется СиО, а при более высокой температуре — Cu20, а также с серой взаимодействуют Си.
Вследствие окисления медь на воздухе покрывается плотной зелено-серой пленкой основного карбоната. С водородом медь не реагируют.
Производные Си (I) образуются при восстановлении соединений Си (II).
Катион Си+ при повышенных температурах склонен к окислительно-восстановительной дисмутации: 2Cu+ =Си + Си2+. Реакция обратима и равновесие может быть смещено в любом направлении в зависимости от природы лиганда.
Реакция обратима и равновесие может быть смещено в любом направлении в зависимости от природы лиганда.
Для Э (I) аквакомплексы малостойки и кристаллогидраты не характерны, но для Си (I) устойчивы аминокомплексы типа [Cu(NH3)2]. Поэтому большинство соединений Си (I) довольно легко растворяется в присутствии аммиака, например:
CuCl + 2NH3 = [Cu (NH3)2 ] Cl
Гидроксиды типа [Cu(NH3)2](OH) значительно устойчивее, чем CuОН, и по силе приближаются к щелочам. Это объясняется уменьшением поляризующего действия катиона Э+ на ионы ОН— за счет экранирования молекулами аммиака.
Гидроксиды ЭОН — основания они неустойчивы. При попытке их получения по обменным реакциям выделяются оксиды Cu20 (красный):
2 CuN03 + 2NaOH = Cu20 + 2NaN03 + H20
Кислотная природа бинарных соединений Э(I) проявляется при взаимодействии с соответствующими основными соединениями. При этом образуются различного рода купраты (I), аргентаты (I) и аураты (I). Так, Э20 несколько растворимы в концентрированных растворах щелочей:
Cu20 + 2NaOH + Н20 = 2Na [Cu (OH) 2]
Нерастворимые в воде и кислотах галогениды ЭНаI довольно значительно растворяются в растворах галогеноводородных кислот или основных галогенидов:
CuCl + НС1 = H [CuCl2];
Аналогично ведут себя нерастворимые в воде цианиды ЭCN, сульфиды Э2S и пр.
Большинство соединений Си (I) легко окисляется (даже молекулярным кислородом воздуха), переходя в устойчивые производные Си (II), например
4CuCl + 02 + 4НС1 = 4CuC12 + 2Н20
Для соединений Си (I) характерно диспропорционирование:
2Cu+ = Си2+ + Си, р°296 = 0,18 В
2СиС1(к) = СиС12(р. ) + Сu(к)
) + Сu(к)
Большинство соединений Э(I) при небольшом нагревании и при действии света легко распадается. Поэтому их обычно хранят в банках из темного стекла. Оксид меди (I) применяют для окрашивания стекла, эмалей, а также в полупроводниковой технике.
Соединения Си (П). Степень окисления +2 характерна только для меди. Максимальное координационное число Си (II) равно 6, что соответствует октаэдрическим комплексам.
Четыре лиганда в плоскости ху связаны с атомом Си прочнее, чем два лиганда, расположенные по оси х. Поэтому расстояние между атомами Си и лигандами в плоскости ху короче, чем между атомами Си и лигандами, расположенными по оси z, например, в кристалле СиСl2:
Иногда это различие столь велико, что комплексы Си (II) можно рассматривать как квадратные. Таким образом, чаще всего встречаются соединения, в которых координационное число равно четырем (квадрат) и шести (искаженный октаэдр).
Для меди (II) характерны как катионные, так и анионные комплексы. Так, при растворении солей Си (II) в воде или при взаимодействии СиО (черного цвета) и Си (ОН)2 (голубого цвета) с кислотами образуются голубые аквакомплексы [Си (ОН2)6]2+. Такую же окраску имеет большинство кристаллогидратов, например Cu(N03)2 • 6H20.
В медном купоросе CuS04 •5H20 вокруг Си (II) координированы четыре молекулы воды в плоскости и две SO42- -группы по оси. Пятая молекула Н2О играет роль мостика, объединяющего водородными связями молекулы Н20 в плоскости и SO24— -группу:
Часть молекул воды играет роль мостика и в других кристаллогидратах с учетным числом молекул воды (NiS04 •7H20, FeS04 •7H20).
Встречаются также кристаллогидраты Си (II), имеющие зеленую и темно- коричневую окраску. В этом случае кроме молекул воды роль лигандов играют соответствующие анионы. Так, в зеленом СиС12 •2Н20 атомы Си окружены двумя молекулами воды и четырьмя атомами хлора:
При прибавлении воды СиС12 • 2Н2О меняет окраску до голубой, т. е. при этом происходит образование аквакомплекса [Си (ОН2)6]2+.
В нейтральных и кислых растворах катион Си2+ гидратирован с образованием окрашенного в голубой цвет аквакомплекса [Cu(H20)6 ]2+, который довольно прочно удерживает молекулы воды.
Гидролиз солей Си (II) часто сопровождается образованием малорастворимых в воде гидроксосоединений состава Cu(N03)2 • 3Cu(OH)2, CuSO4 • 2Cu(OH)2, CuCl2 • 3Cu(OH)2. Большинство из этих соединений встречается в виде минералов.
Из других катионных комплексов меди (II) очень характерны комплексы с азотсодержащими лигандами, например [Cu(NH3)4(OH2)2]2+ и хелатный этилендиаминовый1 [Cu(en)2(OH)2)2]2+. Их константы устойчивости соответственно равны 1•1012 и 1•1020.
Амминокомплексы образуются при действии аммиака на растворы солей меди (II). Образованием аммиакатов, в частности, объясняется растворение
Сu (ОН)2 в водных растворах аммиака:
Cu (OH)2 + 4NH3 + 2Н20 = [Cu(NH3)4 (OH2)2 ](OH)2
Замена в аквакомплексе [Сu (ОН2)6]2+ молекул воды на азотсодержащие лиганды приводит к появлению более интенсивной синей окраски:
(Cu (OH2)6]2+ [Cu (NH3)4(OH2)2]2+ [Cu (en)2(OH2)2]2+
голубой синий интенсивно-синий
1 Этилен диамин en:
Это изменение цвета обязано усилению поля лигандов в ряду ОН2—NH3—еn, вызывающему смещение полосы поглощения из далёкой красной в среднюю красную область спектра.
Максимум поглощения иона [Си (ОН2)6]2+ наблюдается при ≈800 нм, а у [Cu(NH3)4(OH2)2]2+ — при ≈600 нм). С другой стороны, CuS04 бесцветен, так как поле иона SO2-4 настолько слабое, что d— d — переходу отвечает поглощение в инфракрасной области.
Соединения Си (II) в общем устойчивее, чем однотипные производные Си (I). Так Си(0Н)2 распадается на СиО и Н20 лишь при нагревании. Разложение CuF2 и СиС12 на CuHal и На12 начинается соответственно при 960 и 500С. Однако Cul2 (AGy 298 = -8,2 кДж/моль) разлагается уже при обычных температурах, переходя в Cul (AGy 2g8 = -71 кДж/моль). Поэтому при попытке получения Cul2 по обменной реакции протекает окислительно-восстановительная реакция
2Си2+ + 4I— = 2 Cul + 12
Аналогичным образом неустойчивы Cu(CN)2 и Cu(SCN)2:
2CuS04 + 4KCN = 2CuCN + (CN)2 + 2K2S04
Для меди (II) характерны также анионные комплексы — купраты (II). Так,
Си (ОН)2 при нагревании в концентрированных растворах щелочей частично растворяется, образуя синие гидроксокупраты (II) типа М2[Си (ОН)4 ]. Некоторые из них выделены в свободном состоянии. В водных растворах гидроксокупраты (II) легко разлагаются, что свидетельствует о слабости кислотных свойств
Си (ОН)2.
В избытке основных галогенидов CuHal2 образуют галогенокупраты (II) типа M+1 [CuHal3] и М2+1 [СиНа14]. В отличие от Cu(CN)2 вполне устойчивы и хорошо растворимы в воде цианокупраты (II) типа M2+1 [Cu(CN)4]. Анионные комплексы Си (II) известны также с карбонат -, сульфат — и другими анионами. Так, выделен темно-синий карбонатокупрат (II) калия К2[Си (С03)2]. Из растворов сульфатов щелочных металлов CuS04 кристаллизуется в виде М2+1СиSО4 •6Н2О.
В отличие от Cu(CN)2 вполне устойчивы и хорошо растворимы в воде цианокупраты (II) типа M2+1 [Cu(CN)4]. Анионные комплексы Си (II) известны также с карбонат -, сульфат — и другими анионами. Так, выделен темно-синий карбонатокупрат (II) калия К2[Си (С03)2]. Из растворов сульфатов щелочных металлов CuS04 кристаллизуется в виде М2+1СиSО4 •6Н2О.
Из соединений меди (II) теоритически более важен кристаллогидрат
CuSO4 •5H2O (медный купорос). Он применяется для получения минеральных красок, для борьбы с вредителями и болезнями растений в сельском хозяйстве, служит исходным продуктом для получения меди и её соединений и т. д.
Соединения Cu(III).
Для Си (III) и Ag (III) известны фторопроизводные: синий K3[CuF6] и желтый K[AgF4]. При окислении Си (ОН)2 в щелочной среде получаются гидроксо — и оксокупраты (III) типа KCu02 и К [Си (ОН)4]:
+2 +з
2Cu(OH)2 + NaCIO + 2NaOH = 2NaCu02 + NaCl + 3H20
Степень окисления +3 у меди и серебра стабилизируется в комплексах с иодат (VII) и теллурат (VI) лигандами, например, K7[Cu(I06)2] •7Н20,
Na9[Cu(TeO6)2] (коричневого цвета) и KH7[Ag(IO6)2]•10Н20,
Na6H3[Ag(TeO6)2] •20H20 (желтого цвета).
Соединения Си (III) — сильные окислители.
Нахождение меди в мире
Нахождение меди в природе
Медь это ковкий и пластичный металл красноватого цвета, с высокой электро и теплопроводностью. Медь устойчива к действию воздуха и воды. Природным источником меди являются минералы борнит, халькопирит, малахит, также встречается и самородная медь, масса отдельных скоплений может достигать 400 тонн. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Одним из крупнейших в мире также является перспективное медно-порфировое месторождение Песчанка на Чукотке.
Медь устойчива к действию воздуха и воды. Природным источником меди являются минералы борнит, халькопирит, малахит, также встречается и самородная медь, масса отдельных скоплений может достигать 400 тонн. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Одним из крупнейших в мире также является перспективное медно-порфировое месторождение Песчанка на Чукотке.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Среднее содержание в окружающей среде (% биосфера)
3*10-3
Содержание в атмосфере
Океаны:
1,1*10-3 мкг/м3
Южный полюс:
0,03 нг/м3
Острова:
0,01мкг/м3
Материки:
0,4мкг/м3
Пригород:
0,03 мкг/м3
Города (макс.)
1,2мкг/м3
Содержание в литосфере:
55мг/кг
Содержание в почве:
2 – 100 мг/кг
1 – 20 (30) мг/кг сухого веса
Содержание в морской воде:
8,0410 – 5 мг/л
<0,003 мг/л
Содержание в пресной воде:
0,01 – 2,8 мг/л
0,002 – 0,01 мг/л
Нахождение меди в продуктах питания
Овощи.
 Морковь, белокочанная капуста, а также пекинская, савойская, морская капуста, огурцы, болгарский перец, редис, свекла, практически вся зелень, включая листья салата.
Морковь, белокочанная капуста, а также пекинская, савойская, морская капуста, огурцы, болгарский перец, редис, свекла, практически вся зелень, включая листья салата.Фрукты и ягоды. Абрикос, авокадо, груши всех сортов, земляника, крыжовник, смородина, апельсины, мандарины, лимоны, свити, грейпфруты, памело, лимоны, яблоки
Орехи и семечки. Кунжут, орехи миндаля, грецкий орех, фундук, семечки подсолнечника, тыквенные семечки.
Бобовые и проростки. Фасоль, соя, зеленый горошек, пророщенная пшеница, пророщенный маш (дал), пророщенная чечевица.
Крупы и каши. Гречневая крупа, пшенная каша, овсяная, пшеничная.
Зерновые культуры. Черный и пшеничный хлеб.
Грибы. Свежие подберезовики, лисички, белые грибы, шампиньоны.
Лекарственные травы. Полынь, тысячелистник, зверобой, душица.
Дары моря. Осьминоги, устрицы, креветки, омары, кальмары, крабы, печень палтуса и трески.
Животные продукты. Баранина, телятина, говяжья и свиная печень.
Какао.
При кулинарной обработке продуктов медь, как правило, не разрушается. Она не усвоится организмом, если в рационе продукты, богатые ею, будут «соседствовать» с молоком: его белок казеин препятствует всасыванию этого минерала.
Нахождение меди в организме человека
В нашем организме медь почти что «родня» железу, и столь же активно она помогает кроветворению.
В организме взрослого человека содержится от 100 до 200 мг меди, в отличие от золота и серебра, которые обнаружены лишь в виде следов этих элементов.
Ежедневно мы должны получать с пищей еще около 2 мг, а при больших нагрузках — до 3 мг меди. В повышенных дозах минерала нуждаются страдающие ишемической болезнью сердца и перенесшие инфарктом миокарда. В паре с витамином С медь повышает сопротивляемость организма инфекциям, да и сама активно уничтожает «нехорошие» бактерии.
В повышенных дозах минерала нуждаются страдающие ишемической болезнью сердца и перенесшие инфарктом миокарда. В паре с витамином С медь повышает сопротивляемость организма инфекциям, да и сама активно уничтожает «нехорошие» бактерии.
Применение меди в медицинской практике
В античном мире медь была, пожалуй, самым популярным металлом в лечебной практике, поскольку являлась доступной даже для бедных слоев населения. Эскулапы древности были убеждены в разнообразных полезных свойствах этого микроэлемента. Древнегреческий врач, поэт и философ Эмпедокл для улучшения самочувствия носил медные сандалии, великий Аристотель называл этот металл прекрасным средством от отечности, синяков, ушибов и даже во время сна старался держать в руке медный шарик. Обращался к медетерапии Гален, а знаменитый Авиценна после оперативного удаления гнойных миндалин советовал полоскать полость рта холодной водой, в которой добавлен уксус, а после этого прикладывать к ране медный купорос.
В старину российские врачи отмечали: рабочие, связанные с добычей или производством меди, в годы холерных эпидемий не болели этим страшным заболеванием. Бурлаки, носившие медные кресты или подкладывавшие пятаки из меди под пятки, во время эпидемий заражались холерой и другими инфекционными болезнями значительно реже. Для профилактики рахита и эпилепсии доктора советовали надевать детям медные браслеты. Широко используется медетерапии и в наши дни. Очень часто медь прикладывают к соответствующим заболеванию биологически активным точкам. Однако перед применением меди обязательно следует уточнить диагноз заболевания, поскольку наложение должно точно соответствовать больному участку. Согласно представлениям восточной медицины болевые точки имеют пониженный электрический потенциал и пропускают направление тока одного знака. Поэтому ток меди сам выбирает нужную нездоровую точку.
Использовать для лечения можно медные пластины или монеты. Если они к телу прикрепляются, то их фиксируют пластырем и носят круглосуточно, даже если на коже под ними появляется пятно зеленоватого цвета. Народные целители считают: если монета с кожей не сцепляется, то закреплять ее лейкопластырем не рекомендуется, но медь можно приложить к больному участку и прибинтовать, и даже если он выбран не совсем точно, то металл сам переместится на нужное место. Лечение может длиться и неделю, и месяц, но в среднем курс терапии продолжается 3—5 дней. Сняв пластины, кожу следует вымыть теплой водой с мылом.
Если они к телу прикрепляются, то их фиксируют пластырем и носят круглосуточно, даже если на коже под ними появляется пятно зеленоватого цвета. Народные целители считают: если монета с кожей не сцепляется, то закреплять ее лейкопластырем не рекомендуется, но медь можно приложить к больному участку и прибинтовать, и даже если он выбран не совсем точно, то металл сам переместится на нужное место. Лечение может длиться и неделю, и месяц, но в среднем курс терапии продолжается 3—5 дней. Сняв пластины, кожу следует вымыть теплой водой с мылом.
При использовании в лечебных целях не стоит брать массивные, толстые куски металла — лучше воспользоваться тонкими, хорошо отшлифованными пластинками или дисками, которые делаются из красной меди. Самый лучший вариант — использовать для лечения монеты петровских времен, сделанные из чистой меди, но достать этот антиквариат почти невозможно. Зато можно найти монетки выпуска до 1961 г, для изготовления которых использовался медно-алюминиевый сплав (МАГ-1) с преимущественным содержанием меди.
Медь оказывает благотворное влияние на сердечно-сосудистую систему. При возникновении боли в сердце рекомендуется положить медную монетку или пластинку в подключичную ямку.
С помощью пояса из медной проволоки до сих пор лечат радикулит и ушибы.
При ангине монетки прикладывают за ухом, а также на место проекции миндалин на боковых участках шеи. При гайморите следует приложить медные монеты к глазам.
При шуме в ушах монеты прикладывают сзади на шею. Для улучшения слуха одну монету надо прикрепить на выпуклую кость за ухом, а другую — к уху со стороны лица.
При фиброме матки медные монетки или пластины прикладывают к низу живота.
При варикозном расширении вен на места появления кровеносных звездочек и вздутий прикрепляют медь под чулок или носок, выдерживая до тех пор, пока пластина не сползет с больного места. Если в результате ушиба образовался тромб на ноге, к месту ушиба также нужно прикрепить монету (но не к месту образования тромба).
Если в результате ушиба образовался тромб на ноге, к месту ушиба также нужно прикрепить монету (но не к месту образования тромба).
Медетерапии способствует водному и минеральному обмену, улучшает сон, успокаивает нервы. Народные целители считают, что аппликации из медных пластин снижают температуру, снимают воспалительные процессы в организме, включая воспаления суставов, ускоряют созревание нарывов, снимают болевые ощущения. С их помощью лечат гинекологические заболевания, они активизируют действие инсулина в крови, рассасывают доброкачественные опухоли, действуют кровоостанавливающе, улучшают постинфарктное состояние, помогают устранить грыжу, уменьшают вредный эффект от радиации при облучении. Медь, подобно золоту и серебру, обладает бактерицидными свойствами, а потому ее используют как антисептик и для стерилизации воды, которую полезно применять для лечения воспалительных процессов слизистой оболочки полости рта и глаз.
В официальной медицине также используется медь при приготовлении лекарственных препаратов. Раствор сульфата меди полезно применять при ожогах кожи фосфором. Иногда сульфат употребляют в качестве рвотного средства. При конъюнктивитах и для лечения трахомы применяют сульфат меди как антисептическое и вяжущее средство в виде глазных капель и глазных карандашей. При этих заболеваниях оказывает помощь нитрат меди, который употребляют в виде глазной мази.
Велика роль меди в организме человека: она входит в состав некоторых ферментов и участвует во многих физиологических процессах, оказывая влияние на обмен веществ и процессы роста. Медь участвует в процессах окисления и обеспечивает нас энергией, антиоксидантной защитой, чем продлевает нам жизнь, участвует в образовании соединительной ткани — эластина, коллагена и кожного пигмента меланина.
В таком случае железо, накопленное в печени, не смогло бы образовать гемоглобин. Кроме того, без меди невозможна деятельность некоторых ферментов, способствующих обмену веществ. Известны случаи, когда медь «спасает» от язвы желудка, вызнанной приемами доз ацетилсалициловой кислоты (аспирина).
Известны случаи, когда медь «спасает» от язвы желудка, вызнанной приемами доз ацетилсалициловой кислоты (аспирина).
Установлено, что если вместе с аспирином давать больному соответствующие дозы меди, то язвы желудка не будет, потому что медь, во-первых, блокирует воспаления ткани вокруг язвы, а во-вторых, способствует быстрому ее заживлению.
В 60 – 80 годы медный купорос использовали в медицине для лечения анемии, гипотрофии, тогда как в настоящее время в большой степени используется хелатные соединения меди.
Изотоп меди 64 Cu применяется в радиоизотопной диагностике опухолей мозга, в радиобиологических исследованиях.
В медицине применяют сернокислую медь (как противомикробное и прижигающее средство). Препараты различных солей меди используют наружно для промываний, спринцеваний, в виде мазей при воспалительных процессах слизистых оболочек, в физиотерапии. Медь в сочетании с железом используется при лечении детей с гипохромной анемией.
Медьсодержащие препараты и БАДП используются также в лечении и профилактике заболеваний опорно-двигательного аппарата, гипотиреоза. Широкое распространение получило использование медной внутриматочной спирали в качестве средства контрацепции.
Физиологическая роль меди
В организм медь поступает в основном с пищей. В некоторых овощах и фруктах содержится от 30 до 230 мг% меди. Много меди содержится в морских продуктах, бобовых, капусте, картофеле, крапине, кукурузе, моркови, шпинате, яблоках, какао-бобах.
В желудочно-кишечном тракте абсорбируется до 96% поступившей в организм меди (причем в желудке ее максимальное количество), затем в двенадцатиперстной кишке, тощей и подвздошной кишке. Лучше всего организмом усваивается двухвалентная медь. В крови медь связывается с сывороточным альбумином (12-17%), аминокислотами — гистидином, треонином, глутамином (10—15%), транспортным белком транскуприном (12-14%) и церулоплазмином (до 60-65%).
Считается, что оптимальная интенсивность поступления меди в организм составляет 2—3 мг/сутки. Дефицит меди в организме может развиваться при недостаточном поступлении этого элемента (1 мг/сутки и менее), а порог токсичности для человека равен 200 мг/сутки.
Медь способна проникать во все клетки, ткани и органы. Максимальная концентрация меди отмечена в печени, почках, мозге, крови, однако медь можно обнаружить и в других органах и тканях. Схема обмена меди в организме представлена на рис. 18.
Ведущую роль в метаболизме меди играет печень, поскольку здесь синтезируется белок церулоплазмин, обладающий ферментативной активностью и участвующий в регуляции гомеостаза меди.
Медь является жизненно важным элементом, который входит в состав многих витаминов, гормонов, ферментов, дыхательных пигментов, участвует в процессах обмена веществ, в тканевом дыхании и т. д. Медь имеет большое значение для поддержания нормальной структуры костей, хрящей, сухожилий (коллаген), эластичности стенок кровеносных сосудов, легочных альвеол, кожи (эластин). Медь входит в состав миелиновых оболочек нервов. Действие меди на углеводный обмен проявляется посредством ускорения процессов окисления глюкозы, торможения распада гликогена в печени. Медь входит в состав многих важнейших ферментов, таких как цитохромоксидаза, тирозиназа, аскорбиназа и др. Медь присутствует в системе антиоксидантной защиты организма, являясь кофактором фермента супероксиддисмутазы, участвующей в нейтрализации свободных радикалов кислорода. Этот биоэлемент повышает устойчивость организма к некоторым инфекциям, связывает микробные токсины и усиливает действие антибиотиков. Медь обладает выраженным противовоспалительным свойством, смягчает проявления аутоиммунных «заболеваний (напр., ревматоидного артрита), способствует усвоению железа.
Медь: основные эколого – физиологические данные
Суточное поступление с продуктами питания:
3,5 мг
Суточное поступление с воздухом:
0,02 мг
Резорбция (%)
5 -30%
Суточное выведение:
С мочой:
0,05 мг
С калом:
3,37 мг
С потом:
0,04 – 0,4 мг
Прочие (волосы и др. )
)
0,003мг
Период полувыведения из организма:
12 – 61 час
Токсическая доза для человека > 250 мг.
Функции меди в организме
МЕДЬ: помощь при ревматоидном артрите
Медь — могучий минерал. Она не только совершенно необходима, чтобы помогать сердцу правильно функционировать, но также контролирует уровни холестерина, сахара и мочевой кислоты. Вдобавок она укрепляет кости, усиливает выработку красных и белых клеток крови, поддерживает иммунную функцию, способствует росту маленьких детей и является глинным средством лечении ревматоидного артрита. Но, как и в случае железа, крайне важно поддерживать правильный баланс. Как недостаток, так и избыток меди могут усиливать активность свободных радикалом, тем самым повышая риск болезней сердца и других хронических дегенеративных заболеваний. Врач и лабораторные анализы могут определить, является ли содержание меди у вас в организме слишком высоким и слишком низким.
Многие американцы более склонны к дефициту, чем к избытку меди. Недавние опросы показывают, что лишь 25% американцев потребляют достаточно меди; большинство получают только 50—60% рекомендуемого ежедневного количества, которое составляет всего 2 мг. Вегетарианцы тоже могут испытывать нехватку этого минера, а наше растущее потребление кукурузных подсластителей с высоким содержанием фруктозы усиливает дефицит. Наконец, низкое содержание меди в организме широко распространено среди обитателей домов престарелых.
Медь и сердце: друг или враг?
Медь необходима для поддержания способности сердца перекачивать кровь, для предотвращения аневризм и обеспечения роста дачной артериальной соединительной ткани, устойчивой к разрывам. Соединительная ткань самой сердечной мышцы тоже нуждается в меди для предотвращения кардиомиопатии, связанной с неадекватным питанием. При ограничении потребления меди мы теряем фермент, именуемый церулоплазмином — жизненно важный антиоксидант, который защищает нас от угрозы свободного железа.
При ограничении потребления меди мы теряем фермент, именуемый церулоплазмином — жизненно важный антиоксидант, который защищает нас от угрозы свободного железа.
Существуют подозрения, что дефицит меди, возможно, вносит основной вклад в развитие коронарной болезни сердца. Но больше — не всегда лучше; высокие уровни меди в сыворотке крови тоже могут быть опасны. Избыток меди способствует прилипанию холестерина к внутренней поверхности стенок кровеносных сосудов, тем самым повышая риск сердечного приступа. Нормальный уровень меди оказывает противоположное действие. Финский кардиолог Юкка Салонен обнаружил, что у людей с высокими уровнями меди в организме чаще бывает повышенная концентрация окисленного ЛНП-холестерина, а его коллеги подтвердили, что высокие уровни меди (и низкие уровни цинка) прочно взаимосвязаны с ростом вероятности коронарной болезни сердца. Именно поэтому важно регулярно делать анализы крови на медь, чтобы контролировать содержание меди в своем организме.
Здоровье костей.
Поскольку медь необходима для выработки коллагена в костях, ее добавки играют ключевую роль в исцелении. Дефицит этого минерала часто встречается у пожилых женщин, подверженных переломам и трещинам костей ног. Использование добавок может снижать частоту этих травм.
Ревматоидный артрит.
Применение меди для лечения ревматоидного артрита может служить одним из лучших примеров того, как питательная добавка может превосходить медикаментозные методы лечения традиционной медицины.
Медь помогает организму вырабатывать пероксид – дисмутазу – самый целебный из его внутриклеточных противовоспалительных ферментов. Ключом к успеху стало обнаружение подходящего соединения меди: самыми эффективными оказались салицилат и ацетилсалицилат меди. Поскольку они также помогают исцелению пептических язв желудка и двенадцатиперстной кишки представляют собой прямую противоположность обычно используемых при артрите нестероидных противовоспалительных препаратов, провоцирующих образование таких язв.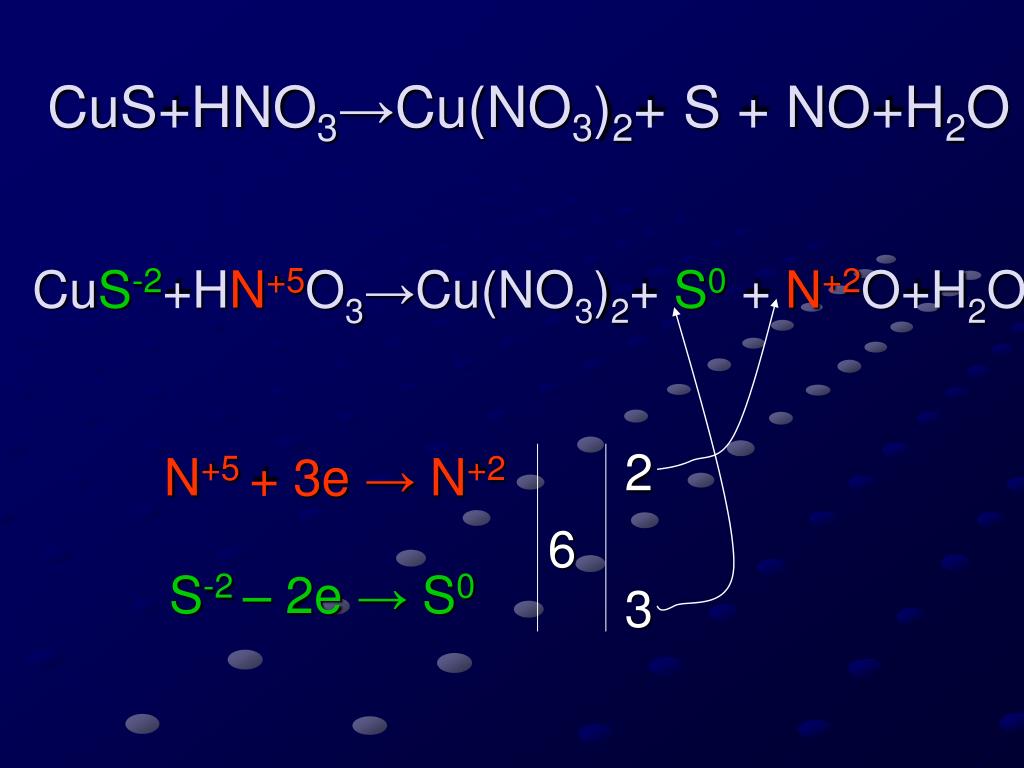
Дрожжевые инфекции.
Медь важна для поддержания баланса микрофлоры, сдерживающего рост дрожжевых микроорганизмом, однако ее избыточное количество, напротив, усиливает собственную патогенную природу дрожжей. Медные комплексы, наподобие себя цината меди, обладают непосредственным антибактериальным противогрибковым действием.
Другие болезни.
Дальнейшие исследования и клиническая практика помогут врачам полностью выявить лечебные свойства меди. Например, себацинат меди вроде бы обещает определенную помощь при диабете, радиационном поражении, раке и судорогах. Возможно, медь также улучшает заживление ран. Известно, что дефицит меди ослабляет иммунную систему. Значит, восстановление оптимального уровня минерала должно её укреплять.
Избыток или недостаток меди в организм человека. Последствия.
Роль меди в организме огромна. Прежде всего, она принимает активное участие в построении многих необходимых нам белков и ферментов, а также в процессах роста и развития клеток и тканей. Медь необходима для нормального процесса кроветворения и работы иммунной системы.
Без меди организму трудно и даже невозможно превращать железо в гемоглобин; аминокислота тирозин, являющаяся одним из основных факторов, отвечающих за цвет кожи и волос, тоже без меди не может в полной мере использоваться организмом.
Что касается процесса кроветворения, то медь, являясь частью ферментов, синтезирующих эритроциты и лейкоциты, для него действительно необходима.
Также она выполняет функцию снабжения клеток всеми веществами, необходимыми для нормального обмена: именно медь транспортирует железо из печени туда, куда нужно, поддерживая состав крови и нормальное состояние всех органов и тканей. Если меди не хватит, переносить железо будет некому, и оно останется лежать там, где накопилось – а это чревато серьёзными последствиями.
Участвуя в синтезе коллагена, необходимого для образования белкового каркаса скелетных костей, медь делает здоровыми и крепкими наши кости. Людям, имеющим хрупкие кости и склонным к переломам, часто бывает достаточно ввести в рацион питания добавки с медью – и переломы прекращаются, так как перестают вымываться минералы, укрепляется костная ткань, предотвращается развитие остеопороза.
Благодаря меди наши кровеносные сосуды принимают правильную форму, долго оставаясь прочными и эластичными. Медь способствует образованию эластина – соединительной ткани, образующей внутренний слой, выполняющий функцию каркаса сосудов.
Вместе с аскорбиновой кислотой медь поддерживает иммунную систему в активном состоянии, помогая ей защищать организм от инфекций; ферменты, отвечающие за защиту организма от свободных радикалов, тоже содержат в своём составе медь.
Особенно нужна медь для поддержания структуры фермента супероксиддисмутазы, обладающего мощным антиоксидантным действием. Этот фермент играет не последнюю роль в предупреждении преждевременного старения кожи – отвечает за целостность клеток, поэтому он часто входит в состав самых эффективных антивозрастных косметических средств.
Упругость и эластичность кожи поддерживается с помощью коллагена – в его составе тоже есть медь.
Медь стимулирует активность гормонов гипофиза и поддерживает в норме работу эндокринной системы. Так, белки и углеводы в присутствии меди усваиваются лучше, а активность инсулина повышается.
Улучшая работу желез внутренней секреции, способствуя выработке необходимых ферментов и соков, медь нормализует процесс пищеварения и защищает пищеварительную систему от повреждений и воспалений.
Некоторые специалисты отмечают, что медь может предотвратить возникновение язвы желудка при длительном приёме аспирина, назначаемого врачами для лечения различных заболеваний.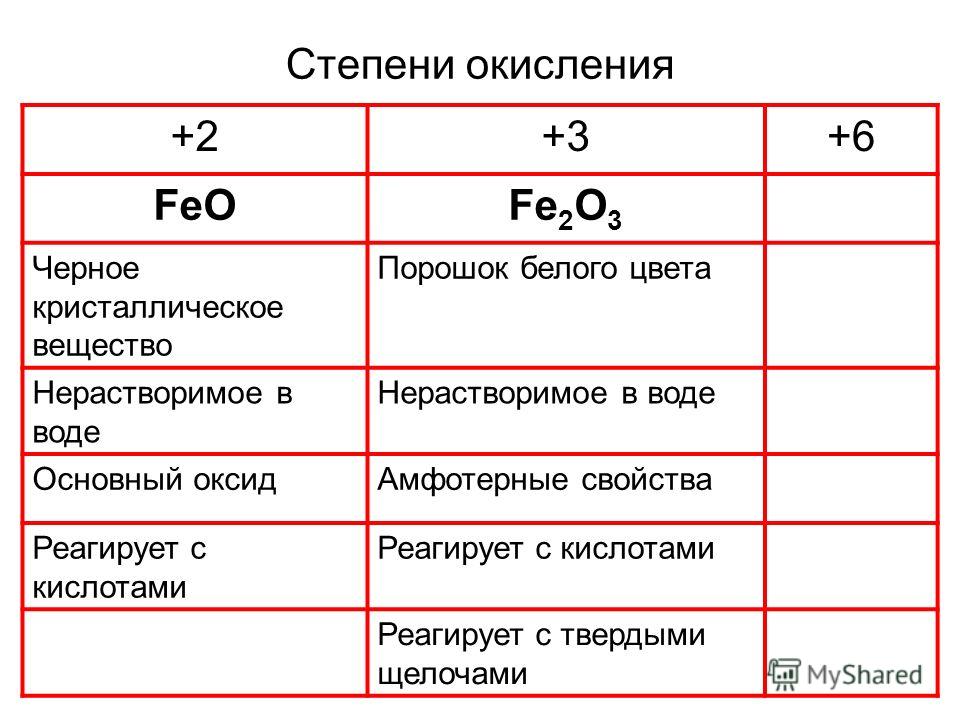 Если больной вместе с аспирином будет принимать медь, то язвенная болезнь не возникнет: медь останавливает воспаления и быстро заживляет образующиеся язвочки.
Если больной вместе с аспирином будет принимать медь, то язвенная болезнь не возникнет: медь останавливает воспаления и быстро заживляет образующиеся язвочки.
Без меди не может нормально формироваться мозг и нервная система – медь является основным компонентом миелиновых оболочек, без которых нервные волокна не могут проводить импульсы, а потом просто разрушаются.
Очень интересны сведения о лечебных свойствах меди, используемых с древних времён. Гален и Авиценна считали медь лекарственным средством, и именно с этой точки зрения описывали её свойства в своих научных трудах; Аристотель ложился спать, держа в руке медный шарик; египетская царица Клеопатра, известная не только своей красотой, но и познаниями в науках, вместо серебряных и золотых браслетов носила медные, понимая, что они помогают ей сохранять здоровье и красоту.
Воины античных армий имели гораздо больше шансов выиграть сражение, если были одеты в медные доспехи: они дольше не утомлялись, а их раны не гноились и заживали быстро.
Кочевники, используя медную посуду, предохраняли себя от пищевых отравлений и инфекций, а цыгане ещё и на голове носили медные обручи, чтобы защититься от вирусов и бактерий, хотя и не знали об их существовании.
О способности меди уничтожать возбудителей заболеваний красноречиво говорит история: во времена эпидемий чумы и холеры люди, работающие и живущие на медных рудниках, а позже на медных заводах, оставались здоровыми, тогда как вокруг все умирали тысячами. Наверное, из этих соображений в больницах дверные ручки раньше делали медными – так можно было уменьшить вероятность распространения инфекции.
В России медью лечили ушибы и переломы, артриты и радикулиты. Кузнецы, постоянно получающие нагрузку на суставы и позвоночник, не болели радикулитами, потому что подпоясывались медной проволокой. При болях в суставах пальцев носили медные кольца: боли уменьшались, и возвращалась подвижность; при эпилепсии больным давали в руки медные шарики, кольца, монеты. Удивительный и оригинальный метод лечения лихорадки применялся с XVIII века. Медный екатерининский пятак раскаляли и бросали в горячую воду, которой потом поили больного – во множестве случаев лихорадка отступала.
Удивительный и оригинальный метод лечения лихорадки применялся с XVIII века. Медный екатерининский пятак раскаляли и бросали в горячую воду, которой потом поили больного – во множестве случаев лихорадка отступала.
Чтобы удовлетворять потребность в меди, человеку достаточно просто разнообразно питаться. Взрослому человеку достаточно 2 мг меди в день, а с пищей обычно попадает в 2-3 раза больше – если питание правильное. Усваивается, как правило, только третья часть всей попадающей в организм меди, так что ни дефицита, ни переизбытка наблюдаться не должно. Переизбыток меди – вообще явление редкое, за исключением некоторых заболеваний, провоцирующих её накопление.
Дефицит тоже редок, однако сегодня нехватка меди наблюдается чаще, чем в прежние времена. Дело в том, что раньше в почву не вносили в таких количествах азотистые удобрения, образующие аммиак, способный «забирать» медь из почвы. К тому же азотистые удобрения не только лишают нас меди, но и часто образуют нитраты, известные своим негативным влиянием на здоровье.
Вегетарианство и различные диеты тоже могут уменьшать количество меди в организме. Это приводит к снижению уровня гемоглобина в крови, и таким заболеваниям, как аритмия, ишемия, нервно-психические расстройства и бесплодие.
Недостаток меди также приводит к задержке роста, развитию анемии, потере веса, накоплению холестерина, атрофии сердечной мышцы, остеопорозу, кожным заболеваниям, потере волос, утомляемости и частым инфекциям.
При хроническом дефиците может возникнуть опаснейшее заболевание – аневризма, характеризующееся расширением и выпячиванием стенок крупных кровеносных сосудов. Возникает также варикозное расширение вен, кожа рано покрывается морщинами, а волосы седеют.
Дополнительно медь назначается при различных хронических заболеваниях – например, анемии и воспалениях, физических нагрузках, а также в целях профилактики.
При нехватке меди следует отказаться от употребления чёрного чая, не принимать большие дозы препаратов железа, цинка и аскорбиновой кислоты. В этом случае лечащие врачи должны подробно объяснять, как питаться и что принимать, так что не стесняйтесь их расспрашивать.
Медь играет важную роль в поддержании нормального состава крови, а это значит, что в любом случае, чтобы не допустить анемии, в нашей пище необходимо присутствие меди. Медь необходима для того, чтобы лучше усваивалось железо, и для того, чтобы оно наиболее эффективно участвовало в создании гемоглобина.
Очень важная роль принадлежит меди в создании миелина — оболочки нервных волокон.
С недостатком меди белок коллаген меняет свою структура, то есть становиться не эластичным, дряхлым.
Из–за нехватки меди сильно страдает сердечно – сосудистая система. Сосуды становятся слабыми, сердце плохо выбрасывает кровь.
Симптомы недостаточности
Очаговое выпадение волос, анемия, сыпь, эмфизема, утомляемость, высокий холестерин, частые инфекции, маленькое количество белых кровяных клеток, депрессия, разрушение сердечной мышцы, остеопороз (тонкие, слабые кости).
Если в человеческом организме на протяжении более чем 2 недель идет недостача, то могут начаться такие процессы как:
нарушение работы нервной системы (зачастую появляется раздражительность, быстрая усталость, головная боль), грозит любителям рафинированной пищи и сторонникам молочной диеты.
слабость мышечной системы,
нарушения некоторых гормональных функций,
могут возникнуть проблемы с делением костных клеток.
Недостаток ее может привести к подагре.
Если чрезмерно употреблять пищу, содержащую медь, то может произойти избыток этого элемента в организме человека. Это, конечно же, достаточно редкое явление, но, все же, иногда бывает. Что же будет, если этого минерала накапливается слишком много? Идет влияние на:
Это, конечно же, достаточно редкое явление, но, все же, иногда бывает. Что же будет, если этого минерала накапливается слишком много? Идет влияние на:
Клетки (начинается неправильная работа клеток, что приводит к их ускоренному разрушению). В связи с этим ускоряется процесс их старения.
Белки. Начинается нарушение взаимодействия некоторых видов белковых соединений (аминокислот) с организмом, которые поступают с пищей.
Научными исследованиями доказано, что в темных волосах человека содержится больше меди, чем в светлых. При дефиците меди в организме появляются седины. Поэтому геронтологи советуют почаще употреблять такие продукты, как орехи, яичный желток, кислое молоко, ржаной хлеб, печень, в которых содержится достаточное количество меди.
Дефицит меди бывает редко, если у человека есть возможность нормально питаться; он наступает иногда у людей с белковой недостаточностью (сильная анорексия или голодание), при синдроме мальабсорбции и в других редких случаях, когда белок теряется через почки. Медь наряду с железом участвует в синтезе красных кровяных клеток; это основной компонент внешнего покрытия нервных волокон, коллагена, основного структурного белка организма; медь также играет важную роль в продуцировании пигментов кожных покровов.
Взаимодействия
1)Алкоголь может усугубить дефицит меди.
2)Яичный желток может связывать медь в кишечнике и препятствовать ее усвоению.
3)Высокое содержание в рационе фруктозы (компонент как фруктового, так и столового сахара) может внести вклад в дефицит меди.
4) Железо может уменьшить способность всасывать медь.
5) Молибден увеличивает потерю меди с мочой.
6) Связующие вещества зеленых овощных листьев и злаков могут снизить способность усваивать медь из пищи.
7) Дополнительный прием витамина С в высоких дозах может снизить поглощение меди из пищи, если вы принимаете витамин С в составе еды. Лучше принимать витамин С сам по себе.
8) Цинк в ионной форме может конкурировать с медью за всасывание по ионным каналам клеток. Если же принимать минеральные вещества в комплексной форме, дефицита, вызванного конкуренцией за всасывание, не будет.
Заболевание, связанные с недостатком меди, в организме человека
В 1998 году Всемирная организация здравоохранения заключила, что риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка.
ПричиныСамые распространенные причины недостатка меди в организме:
слишком редкое употребление в пищу медьсодержащих продуктов;
слишком раннее введение коровьего молока в рацион детей на первом году их жизни;
нарушение усвоения меди при хронических болезнях желудочно-кишечного тракта;
наследственная недостаточность медьсодержащих ферментов;
полное внутривенное питание.
Недостаток меди заметно отражается на внешнем виде человека:
преждевременно стареет и увядает кожа;
нарушается пигментация;
появляется перхоть;
легко возникают синяки;
долго заживают царапины и ссадины;
сохнут, ломаются и выпадают волосы.
Длительный дефицит меди может привести к анемии, ломкости костей, астме, витилиго, глаукоме, псориазу, диабету, эпилепсии, дегенеративным изменениям центральной нервной системы, а также к сердечно — сосудистым и онкологическим заболеваниям.
Чтобы восполнить небольшой дефицит меди в организме, надо есть больше содержащих ее продуктов. При необходимости врач может назначить прием медьсодержащих средств – из расчета не менее 2 мг меди в сутки. Курс длится 2-3 месяца и в случае необходимости повторяется после месячного перерыва.
ПричиныВнутренней причиной избытка меди у человека бывает наследственное нарушение ее обмена (болезнь Вильсона-Коновалова).
Но чаще излишняя концентрация металла в организме объясняется внешними факторами: длительным контактом с медью на производстве, отравлением медьсодержащими препаратами или многократными сеансами гемодиализа.
ПризнакиИзбыток меди проявляется мышечными болями, раздражительностью, депрессией и желтухой.
ПоследствияВысокая концентрация меди может усугубить течение болезней, при которых организм очень уязвим к ее избытку. Это воспаления, астма, заболевания почек и печени, лейкозы, анемии, пневмония, бронхит, сахарный диабет, зоб, шизофрения, инфаркт миокарда и т.д.
Для снижения уровня меди принимают энтеросорбенты (карбосфер, карболонг, энтеросгель и т.д.) В тяжелых случаях, например, при остром отравлении, пострадавшего госпитализируют в токсикологический центр или реанимацию.
Содержащие медь препараты (обычно, в составе мультивитаминно-минеральных комплексов) используются в лечении расстройств кроветворения, иммунитета, тяжелых нервных расстройств, эндокринных заболеваний, заболеваний скелета и суставов, атеросклероза, астмы, эмфиземы легких, туберкулеза и т.д.
Влияние обильного потребления микроэлементов на восстановление после обширных ожогов.
Поскольку медь, селен и цинк вовлечены в механизмы иммунной, антиоксидантной защиты и регенерации тканей, их дефицит может усугублять классические осложнения ожогов. Кроме оценки величины потерь микроэлементов через обожженную кожу у 10 обожженных пациентов, целью нашего исследования было проверить правильность предположения, что массивное внутривенное введение препаратов меди, цинка и селена может повлиять на концентрацию этих микроэлементов в сыворотке крови и на ход восстановительного процесса после обширных ожогов.
Кроме оценки величины потерь микроэлементов через обожженную кожу у 10 обожженных пациентов, целью нашего исследования было проверить правильность предположения, что массивное внутривенное введение препаратов меди, цинка и селена может повлиять на концентрацию этих микроэлементов в сыворотке крови и на ход восстановительного процесса после обширных ожогов.
Качественные химические реакции ионов меди
С едкими щелочами и аммиаком (фармакопейная).
а) NaOH и KOH образуют с Cu2+ голубой осадок Cu(OH)2 , чернеющий при нагревании вследствие превращения в CuO.
CuCl2 + 2 NaOH=Cu (OH) 2 + 2 NaCl
В ионной форме:
Cu2+ + 2 Cl— + 2 Na+ +2 OH— = Cu (OH) 2 + 2 Na+ + 2 Cl—
Cu (OH) 2 = CuO + H2O
Осадок Cu(OH)2 частично растворим в избытке щелочи (особенно при нагревании) с образованием купритов. В присутствии глицерина, а также винной или лимонной кислот ион меди образует комплексные соединения синего цвета, не осаждаемые щелочами.
б) небольшое количество NH4OH осаждает сначала основную соль
(CuOH)2 SO4 зеленоватого цвета, легко растворимую в избытке аммиака с образованием комплексного соединения (pH>9) интенсивно синего цвета.
2 CuSO4 + 2 NH4OH = (CuOH) 2 SO4 + (NH4)2SO4
в ионной форме:
2 Cu2+ + SO2-4 + 2 NH4OH = (CuOH) 2 SO4 + 2 NH+4
(CuOH) 2 SO4 + 8 NH4OH = 2 [Cu (NH3)4]2++SO22- + 2 OH— + 8H2O
При подкислении аммиачный комплекс меди разрушается вследствие связывания молекулы NH3 ионами H+ с образованием более устойчивого комплекса NH+4 . При этом синяя окраска раствора переходит в голубую (цвет свободного иона Cu2+ . Подобное разрушение комплекса [Cu (NH3)4]2+ вызывает действие H2S поскольку концентрация Cu2+ в растворе оказывается достаточной для превышения произведения растворимости CuS , который выпадает при этом в осадок.
При этом синяя окраска раствора переходит в голубую (цвет свободного иона Cu2+ . Подобное разрушение комплекса [Cu (NH3)4]2+ вызывает действие H2S поскольку концентрация Cu2+ в растворе оказывается достаточной для превышения произведения растворимости CuS , который выпадает при этом в осадок.
Выполнение: в пробирки поместить по 3 – 4 капли раствора соли меди, прибавить по 1 – 2 капли растворов щелочи или аммиака. Полученные осадки испытать на растворимость в HCl, NaOH, NH4OH и солях аммония.
С гексацианоферратом (II) калия K4 [Fe (CN)6]
Жёлтая кровяная соль осаждает из раствора солей меди красно – бурый осадок Cu2[Fe (CN)6], который нерастворим в разбавленных кислотах, но растворим в избытке аммиака, и разлагается щелочью. Поэтому реакцию необходимо вести при pH<=7.
2 CuSO4 + K4 [Fe (CN) 6] = Cu2 [Fe (CN) 6] + 2 K2 SO4
2 Cu2+ + [Fe (CN) 6]4- = Cu2 [Fe (CN) 6]
Cu2 [Fe (CN) 6] + 12 NH4OH = 2 [Cu (NH3)4] (OH) 2 + (NH4)4 [Fe (CN)6] + 8 H2O
Или
Cu2 [Fe (CN) 6] + 8 NH4OH = 2 [Cu (NH3)4]2+ + [Fe (CN) 6]4- + 8 H2O
Cu2 [Fe (CN) 6] + 4 OH— = 2 Cu (OH) 2 + [Fe (CN) 6]4-
Выполнение: к 3 – 4 каплям раствора соли меди добавить 3 – 4 капли раствора K4 [Fe (CN)6]. Полученный осадок проверить на растворимость в кислотах, аммиаке и щелочах.
Полученный осадок проверить на растворимость в кислотах, аммиаке и щелочах.
С тиосульфатом натрия Na2S2O3
Тиосульфат натрия обесцвечивает растворы солей меди за счёт образования комплексного соединения. При нагревании же этого раствора выпадает тёмно – бурый осадок смеси Cu2S с серой.
2 CuCl2 + 2 Na2S2O3 + 2 H2O = Cu2S + S + 4NaCl + 2 H2SO4
В ионном виде
2 Cu 2+ + 2 S2O32- + 2 H2O = Cu2S + S + 4 H+ + 2 SO42-
Так как Cd2+ при действии Na2S2O3 в кислой среде не образует осадка сульфида, эта реакция может быть использована для отделения Cu2+ от Cd2+
Выполнение: к 3 – 4 каплям раствора соли меди добавить 1 – 2 капли раствора серной кислоты и 2 – 3 кристаллика Na2S2O3, нагреть. Полученный осадок испытать на растворимость в HNO3.
Восстановление.
Металлические алюминий, железо и цинк восстанавливают Cu2+до металла, выпадающего в виде красной губчатой массы.
3 CuCl2 + 2 Al = 3 Cu + 2 AlCl3
3 Сu2+ + 2 Al = 3 Cu + 2 Al3+
Реакция также может быть использована для отделения Cu2+ от Cd2+. Судя по положению Cu и Cd в ряду напряжений, следует ожидать, что оба эти металла могут быть вытеснены алюминием, железом и цинком из раствора их солей. Однако в присутствии H2SO4 растворимый в кислотах металлический кадмий не выделяется. Наоборот, металлическая медь, соответственно своему положению в ряду напряжений правее водорода, в разбавленной H2SO4 на растворяется и поэтому осаждается в её присутствии.
Наоборот, металлическая медь, соответственно своему положению в ряду напряжений правее водорода, в разбавленной H2SO4 на растворяется и поэтому осаждается в её присутствии.
Осаждение меди не происходит в присутствии HNO3, легко растворяющей этот металл:
3 Cu + 2 NO3— + 8 H+ = 3 Cu2+ + 2 NO + 4 H2O
Следовательно, перед тем как отделить Cu2+ от Cd2+, необходимо полностью удалить HNO3 , что достигается выпариванием раствора с H2SO4.
Выполнение: к 3 – 4 каплям раствора соли меди прибавить 1 каплю раствора H2SO4 и немного железных опилок. Через несколько минут опилки покроются налетом металлической меди. Реакция ускоряется при нагревании.
5)Окрашивание пламени.
Растворы солей меди окрашивают бесцветное пламя горелки в синий или зелёный цвет.
6)Иодид калия KI
Окисляется солями меди (II) с выделением свободного иода. Одновременно выпадает малорастворимый осадок иодида меди (I):
2 CuSO4 + 4 KI = Cu2I2 + I2 + 2 K2SO4
2 Cu2+ + 4 I— = 2 Cu + I2
Выделяющийся свободный иод маскирует окраску – осадок кажется красновато – жёлтым.
7)Получение глицерата меди
Выполнение: в пробирку налейте около 1 мл 10% — ного раствора сульфата меди (II) и добавьте немного 10 % — ного раствора гидроксида натрия до образования голубого осадка гидроксида меди (II). К полученному осадку добавьте по каплям глицерин. Взболтайте смесь. Превращение голубого осадка в раствор тёмно – синего цвета.
CuSO4 + NaOH = Cu (OH) 2 + Na2SO4
8)Действие гидроксида меди (II) на глюкозу
а) В пробирку прилейте 0,5 мл. раствора глюкозы и 2 мл. раствора гидроксида натрия. К полученной смеси добавьте 1 мл. раствора медного купороса.
раствора глюкозы и 2 мл. раствора гидроксида натрия. К полученной смеси добавьте 1 мл. раствора медного купороса.
б) К полученному раствору аккуратно добавьте 1 мл. воды и нагрейте на пламени горелки пробирку, укрепив её наклонно так, чтобы нагревалась только верхняя часть раствора. Прекратите нагревание, как только начнется изменение цвета.
Оборудование: штатив для пробирок, пробирки, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с растворами щелочей.
СН2ОН – (СНОН)4 – СОН + Сu(ОН)2 = СН2ОН – (СНОН)4 – СООН + Сu2О↓+ Н2О
Глюкоза проявляет свойства многоатомных спиртов и альдегидов и относиться к альдегидоспиртам, так как молекулы глюкозы содержат пять гидроксильных групп и одну альдегидную группу. Реакция с гидроксидом меди (II) демонстрирует восстановительные свойства глюкозы. Прильем к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт. Нагреем раствор. Цвет раствора начинает изменяться. Сначала образуется желтый осадок Cu2O, который с течением времени образует более крупные кристаллы CuO красного цвета. Глюкоза при этом окисляется до глюконовой кислоты.
Заключение
На протяжении своей работы я изучила строение микроэлемента — медь, а также познакомилась с химическими свойствами;
Были изучены данные по содержанию меди в окружающей среде и организме человека;
Были рассмотрены: избыток и недостаток меди в организме человека и заболевания, связанные с этим;
Были затронуты продукты питания, содержащие медь;
Были проведены качественные химические реакции катионов меди.
Список использованной литературы
Авцын А.П. и др. микроэлементозы человека: этиология, классификация, органопатология/ А.П.Авцын, А.А.Жаворонков, М.А.Риш, Л.С. Строчкова; АМН СССР. – М.: Медицина, 1991,496с.:ил. ISBN 5 – 225 -02128 – x;
Алексеев В.Н. Курс качественного химического полумикроанализа. Изд. 5 – е, перераб. И доп. Под ред. Д – ра хим. наук П. К. Агасяна. М., «Химия», 1973. 584 с.; 39 табл.; 73 рис.; список литературы около 50 ссылок.
Аналитическая химия. Ч. I. Качественный анализ. Учеб. – метод. Пособие. – Нижний Новгород, 2005. 71с.
Аткинс Роберт. Биодобавки доктора Аткинса. Природная альтернатива лекарством при лечении и профилактике болезней. – Пер. с англ. А.П.Киселёва. – М.: «РИПОЛ КЛАССИК», Трансперсоначальный институт, 1999. – 480 с.;
Глинка Н.Л. Общая химия: Учебное пособие для вузов. – 23 – е изд., испр./ Под ред. В.А. Рабиновича. – Л.: Химия, 1983. – 704 с. Ил.;
Ерешов Ю.А., Плетенева Т.В. Механизмы токсического действия неорганических соединений. – М.: Медицина, 1989. – 272 с.: ил. – 5 – 225 – 01484 – 4;
Скальный А.В. Химические элементы в физиологии и экологии человека. – М.: Издательский дом «ЩНИКС 21 ВЕК»: Мир, 2004. – 216с., ил. ISBN 5 -329 – 00942 – 1(ОНИКС 21 век) ISBN (Мир).
Слесарев В.И. Химия: Основы химии живого: Учебник для вузов. – СПб: Хим. Издат., 2000. – 768с.: ил.
Третьяков Ю.Д. Химия: Справ. Материалы. Учеб. Пособие для учащихся / Ю. Д. Третьяков, В.И. Дайнеко, И.В. Казимирчик и др.; Под ред. Ю. Д. Третьякова. – М.: Просвещение, 1984. – 239 с., ил.
Медь 🎓²
| Внешний вид простого вещества | |
|---|---|
| Пластичный металл золотисто-розового цвета | |
| Свойства атома | |
| Имя, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) | 63, 546 а. |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Химические свойства | |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность | 1, 90 (шкала Полинга ) |
| Электродный потенциал | +0, 337 В/ +0, 521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745, 0 (7, 72) кДж/моль (эВ ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 8, 92 г/см³ |
| Температура плавления | 1356, 55 (1 083, 4 С ) |
| Температура кипения | 2840, 15 K |
| Теплота плавления | 13, 01 кДж/моль |
| Теплота испарения | 304, 6 кДж/моль |
| Молярная теплоёмкость | 24, 44[1] Дж/(K·моль ) |
| Молярный объём | 7, 1 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3, 615 Å |
| Температура Дебая | 315 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 401 Вт/(м·К ) |
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком
C давних пор широко применяется человеком
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век
).Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди
.У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков считают русское слово медь (польск. miedz, чешск. med) родственным древненемецкому smida (металл) и Schmied (кузнец, англ. Smith). От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars
). Самородная медьМедь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы.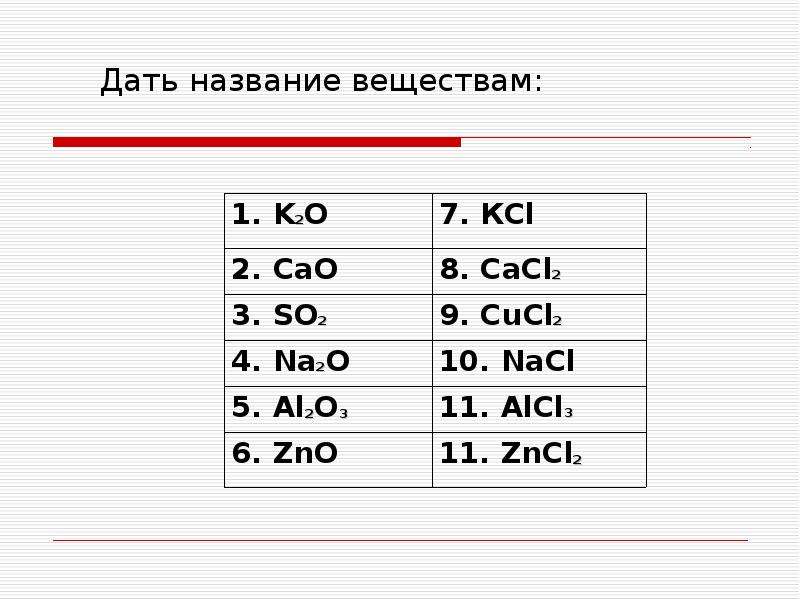 Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3]
Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3]
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0, 3 до 1, 0 %
.Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет
.Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвертой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота
.Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0, 36150 нм, Z = 4
.Медь обладает высокой тепло-[4] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C 55, 5-58 МСм/м[5]. Медь имеет относительно большой температурный коэффициент сопротивления: 0, 4 %/°С и в широком диапазоне температур слабо зависит от температуры
.Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие
.Природная медь состоит из двух стабильных изотопов — 63Cu 65Cu с распространённостью 69 и 31 атомных процентов соответственно. Известны более двух деясятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа
.Возможные степени окисления
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году
Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами
.На влажном воздухе медь окисляется, образуя основный карбонат меди(II
):Реагирует с концентрированной холодной серной кислотой
:С концентрированной горячей серной кислотой
:С безводной серной кислотой при 200 °C
:C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха
:Реагирует с концентрированной азотной кислотой
:С разбавленной азотной кислотой
:С царской водкой
:C разбавленной хлороводородной кислотой в присутствии кислорода
:С газообразным хлороводородом при 500—600 °C
:С бромоводородом
:Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода
:Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов
:Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C
:Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре
:При 300—400 °C реагирует с серой и селеном
:C оксидами неметаллов
:Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода
:С концентрированной соляной кислотой и хлоратом калия
:Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов
.Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют
:В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I
):Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I
)Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответсвует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет
:Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы
):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (Например, использование реактива Фелинга
).Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников
.Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов
.Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цветМедь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором
.В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0, 01724-0, 0180 мкОм·м[5]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, Например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0, 02 % алюминия снижает её электрическую проводимость почти на 10 %[6]
.Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках
.Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[7], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара
.Сплавы
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности
.Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8]
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8]
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости
.Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4, 4 %
).Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям
.Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей
.Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %
.Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9]
Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9]
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека
.Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 511 и 578 нм
.На 2011 год стоимость меди составляет около $8900 за тонну[10]
. Продукты, богатые медью.Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина
.Медь встречается в большом количестве ферментов, Например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных
.Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0, 9 мг в день
.При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[11]
.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка»
.В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[12]
.Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[12]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде
.Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[13] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[14]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[15]
.Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди
У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[16][17]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т подтверждённые запасы[16], на долю России приходилось 3, 2 % общих и 3, 1 % подтверждённых мировых запасов[16]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет
.Производство рафинированной меди в России в 2006 году составило 881, 2 тыс. тонн, потребление — 591, 4 тыс. тонн[18]. Основными производителями меди в России являлись
:К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[19]. Мировое производство меди в 2007 году составляло[20] 15, 4 млн т, а в 2008 году — 15, 7 млн т Лидерами производства были
:- Чили (5, 560 млн т в 2007 г. и 5, 600 млн т в 2008 г.),
- США (1, 170/1, 310),
- Перу (1, 190/1, 220),
- КНР (0, 946/1, 000),
- Австралия (0, 870/0, 850),
- Россия (0, 740/0, 750),
- Индонезия (0, 797/0, 650),
- Канада (0, 589/0, 590),
- Замбия (0, 520/0, 560),
- Казахстан (0, 407/0, 460),
- Польша (0, 452/0, 430),
- Мексика (0, 347/0, 270).
Смотрим также более полный список стран по производству меди
.По объёму мирового производства и потребления медь занимает третье место после железа и алюминия
.Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т
Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах
.Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди
:На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае
.В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров
.Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика
.Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили
.Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования
Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди
.Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига
.После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C
.С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98, 4—99, 4 % меди, 0, 01—0, 04 % железа, 0, 02—0, 1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине
.Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99, 0—99, 7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования
Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования
Электролитическое рафинирование проводят для получения чистой меди (99, 95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21]
.Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника
.- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99, 5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0, 5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[22].
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).
- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[23].
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С.
 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8 - ↑ Медь самородная в БСЭ
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны)
- ↑ при 20 °С 394, 279 Вт/(м·К), то есть 0, 941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1./ Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Применение меди
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа. Технические условия
- ↑ Смирягин А. П., Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. 3-е изд. — Металлургия, 1974. — С. 321. — 488 с.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди
- ↑ Цена меди
- ↑ Медь и рост человека// Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
- ↑ US EPA
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing
- ↑ 1 2 3 Производство меди
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15, 7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года. Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
- ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009
- ↑ Получение меди
- ↑ Espinoza Soriano, Waldemar.
 Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135. - ↑ Интересные факты о меди и медных трубах
| ;Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
Соединения меди
Химик РУДН создал новые катализаторы для клик-реакций
Химик РУДН создал серию катализаторов для клик-химии. Эти реакции широко используются в синтезе биологически активных веществ, а также в биологических и медицинских исследованиях. Новые катализаторы дают выход 99%. В их основе — циклодекстрин и ионы меди.
Методы клик-химии используются для синтеза библиотек веществ с высоким химическим разнообразием, что важно при разработке новых лекарственных препаратов. Такие реакции нужны для введения меток (например, флуоресцентных) в биологические макромолекулы, белки, молекулы ДНК. Это применяется в биологических и медицинских исследованиях.
Наиболее часто используемая реакция клик-химии — присоединение вещества, которое содержит тройную углерод-углеродную связь (алкин) к соединению, содержащему фрагмент с тремя атомами азота подряд (азид). В классическом варианте реакция катализируется медью в степени окисления (I). Для этого в реакцию вводят ионы меди (II) и избыток восстановителя. Или же используют медь (I) и проводят реакцию с защитой от кислорода, что накладывает ограничения на применение этой реакции.
Химик из РУДН Рафаэль Луке разработал серию катализаторов, где ионы меди были привязаны к поверхности частиц силикагеля при помощи циклического олигосахарида циклодекстрина. Циклодекстрин состоит из семи молекул глюкозы, замкнутых в цикл. Внутри цикла есть емкость, которая может удерживать ион меди и увеличивать его каталитическую активность. Для облегчения связывания циклодекстрина с поверхностью силикагеля использовали облучение ультразвуком.
Внутри цикла есть емкость, которая может удерживать ион меди и увеличивать его каталитическую активность. Для облегчения связывания циклодекстрина с поверхностью силикагеля использовали облучение ультразвуком.
Эффективность созданных катализаторов оценили на модельной реакции фенилацетилена с бензилазидом. Исследователям удалось добиться выхода продукта реакции более 99%. Выход с ацетатом меди (II) был 14%, а в случае сульфата меди (II) реакция не происходила вовсе. Способ получения катализатора прост, безопасен для окружающей среды и дёшев, его использование не требует добавок восстановителей или бескислородных условий. Созданные катализаторы могут найти применение фармацевтической промышленности и в биомедицинских исследованиях.
Работа опубликована в журнале Molecules.
Общая характеристика меди, цинка, хрома, железа
Кодификатор ЕГЭ. Раздел 1.2.3. Характеристика переходных элементов (меди, цинка, хрома, железа) по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов.
У атомов переходных элементов (меди, цинка, хрома и железа) происходит заполнение энергетического d-подуровня.
Рассмотрим строение электронной оболочки этих элементов. У атомов цинка и железа заполнение электронной оболочки происходит согласно энергетическому ряду орбиталей (подуровней), который рассмотрен в статье Строение атома. Электронная конфигурация атома железа:
+26Fe [Ar]3d64s2 [Ar] 4s 3d
У атома цинка на происходит полное заполнение 3d-подуровня:
+30Zn [Ar]3d104s2 [Ar] 4s 3d
У атомов хрома и меди наблюдается «проскок» или «провал» электрона, когда один электрон переходит с более энергетически выгодного 4s-подуровня на менее выгодный 3d-подуровень. Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди). Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
Этот переход обусловлен тем, что в результате образуются более устойчивые электронные конфигурации (3d5 у атома хрома и 3d10 у атома меди). Дело в том, что энергетически более выгодно, когда d-орбиталь заполнена наполовину или полностью.
| Элемент | Электронная конфигурация валентной зоны | |
| Теоретическая | Реальная | |
| Медь +29Cu | [Ar]3d104s1 [Ar] 4s 3d | |
| Хром +24Cr | [Ar]3d54s1 [Ar] 4s 3d | |
Мы используем, конечно же, реальную электронную конфигурацию меди и хрома, теоретическая будет неверной.
Обратите внимание! У всех 3d-элементов внешним энергетическим уровнем считается четвертый уровень и 4s-подуровень. При образовании катионов атомы металлов отдают электроны с внешнего энергетического уровня.
| Атом | Электронная конфигурация | Характерные валентности | Число электронов на внешнем энергетическом уровне | Характерные степени окисления |
| Хром | [Ar]3d54s1 | II, III. VI | 1 | +2, +3, +6 |
| Железо | [Ar]3d64s2 | II, III. VI | 2 | +2, +3, +6 |
| Медь | [Ar]3d104s1 | I, II | 1 | +1, +2 |
| Цинк | [Ar]3d104s2 | II | 2 | +2 |
Рассмотрим характеристики хрома, железа, меди и цинка:
| Название | Атомная масса, а. е.м. е.м. | Заряд ядра | ЭО по Полингу | Мет. радиус, нм | Энергия ионизации, кДж/моль | tпл, оС | Плотность, г/см3 |
| Хром | 51,996 | +24 | 1,66 | 0,130 | 652,4 | 1856,9 | 7,19 |
| Железо | 55.845 | +26 | 1.83 | 0,126 | 759,1 | 1538,85 | 7,874 |
| Медь | 63,546 | +29 | 1,90 | 0,128 | 745,0 | 1083,4 | 8,92 |
| Цинк | 65,38 | +30 | 1,65 | 0,138 | 905,8 | 419,6 | 7,133 |
Свойства соединений железа, меди, цинка и хрома.
Для хрома характерны степени окисления +2, +3 и +6. Оксид и гидроксид хрома (II) (CrO и Cr(OH)2) проявляют основные свойства. Степени окисления +3 соответствуют амфотерные оксид и гидроксид: Cr2O3 и Cr(OH)3 соответственно. Соединения хрома +6 проявляют сильные кислотные свойства: оксид CrO3 и сразу две сильных кислоты: хромовая H2CrO4 и дихромовая H2Cr2O7. Соединения хрома (II) проявляют сильные восстановительные свойства, соединения хрома (VI) проявляют только сильные окислительные свойства.
Характерные степени окисления железа: +2 и +3. Оксид и гидроксид железа (II) — основные (FeO и Fe(OH)2), а соединения железа (III) проявляют амфотерные свойства (Cr2O3 и Cr(OH)3 соответственно) с преобладанием основных. Соединения железа (II) проявляют также восстановительные свойства.
Для меди характерны степени окисления +1 и +2. Оксид меди (I) CuO и гидроксид меди (I) CuOH — основные. Оксид и гидроксид меди (II) проявляют амфотерные свойства с преобладанием основных: CuO и Cu(OH)2.
Характерная степень окисления цинка +2. Соединения цинка (II) проявляют амфотерные свойства: ZnO и Zn(OH)2.
| Элемент | Степень окисления | Тип и формула оксида | Тип и формула гидроксида | Окислительно-восстановительные свойства |
| Хром | +2 | CrO, основный | Cr(OH)2, основание | восстановитель, слабый окислитель |
| +3 | Cr2O3, амфотерный | Cr(OH)3, амфотерный гидроксид | окислитель и восстановитель | |
| +6 | CrO3, кислотный | H2CrO4 и H2Cr2O7, кислоты | окислитель | |
| Железо | +2 | FeO, основный | Fe(OH)2, основание | восстановитель и слабый окислитель |
| +3 | Fe2O3, амфотерный | Fe(OH)3, амфотерный гидроксид | окислитель, очень слабый восстановитель | |
| Медь | +1 | Cu2O, основный | CuOH, основание | восстановитель и слабый окислитель |
| +2 | CuO, основный | Cu(OH)2, основание | окислитель | |
| Цинк | +2 | ZnO, амфотерный | Zn(OH)2, амфотерный гидроксид | слабый окислитель |
Возможные степени окисления — Студопедия
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество[править | править вики-текст]
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Вступает в реакцию при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II) (внешний слой патины):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной горячей серной кислотой:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С «царской водкой»:
С концентрированной горячей соляной кислотой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I)[править | править вики-текст]
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I).
Соединения меди(II)[править | править вики-текст]
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, при которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды.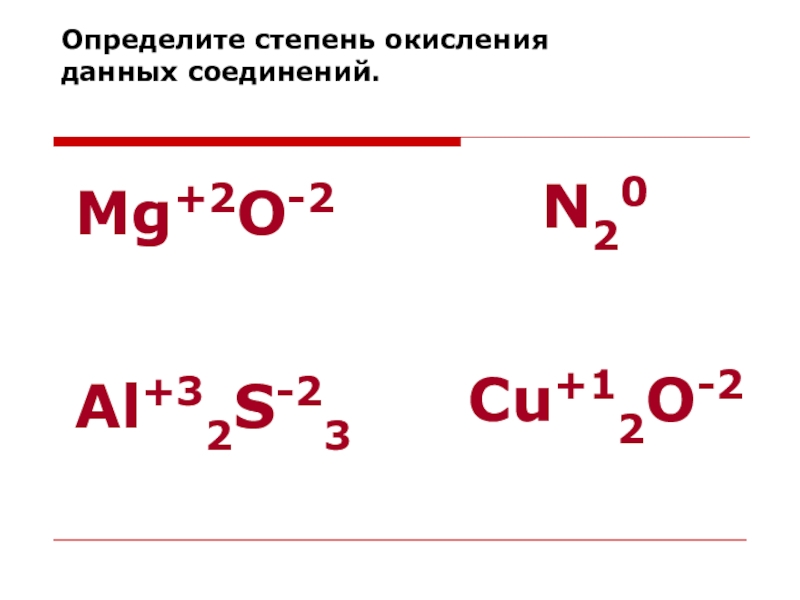 Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)[править | править вики-текст]
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с вашим системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
XPS Интерпретация меди
Первичная область XPS: Cu2p
Перекрывающиеся области: Pr3d
Энергии связи обычных химических состояний:
| Химическое состояние | Энергия связи Cu2p 3/2 |
|---|---|
| Cu металлический | 933 эВ |
| Оксид Cu (I) | 933 эВ |
| Оксид Cu (II) | ~ 933.5 эВ |
| Дигидроксид карбоната Cu (II) | 934,7 эВ |
Экспериментальная информация
- Соберите основной пик Cu LMM, а также Cu2p.

- Большие химические сдвиги наблюдаются для Cu LMM по сравнению с Cu2p.
- Дифференциация химического состояния может быть затруднена только с XPS.
- Длительное облучение рентгеновскими лучами или ионная бомбардировка могут уменьшить количество разлагаемых соединений Cu (II). Распыляйте кластеры Ar и / или минимизируйте рентгеновское облучение, чтобы предотвратить этот эффект.
Интерпретация XPS-спектров
- Пик Cu2p имеет значительно расщепленные спин-орбитальные компоненты (Δ = 19,75 эВ, отношение интенсивностей = 0,508)
- Можно различить степени окисления Cu, используя сателлитные характеристики Cu2p.
- Cu (II) имеет наблюдаемую совокупность спутниковых характеристик 943 эВ.
- Пик Cu2p3 / 2 в оксиде Cu (II) смещен и намного шире по сравнению с оксидом Cu (I).
Пик Cu2p3 / 2 в оксиде Cu (I) НЕ смещен, но является более широким по сравнению с металлической Cu.
- Небольшие сдвиги энергии связи некоторых соединений по сравнению с металлической медью.
- Дифференциация химического состояния может быть затруднена только с XPS.
- Соберите основной пик Cu LMM, а также Cu2p. Для Cu LMM наблюдаются большие химические сдвиги по сравнению с Cu2p.
- Используйте график Вагнера, чтобы определить химию.
Символ: Cu
Дата открытия: древний
Название Происхождение: Latin cyprium
Внешний вид: красный / оранжевый
Первооткрыватель: неизвестен
Получено от: Халькопирит, ковелин, халкозин
Точка плавления: 1358 К
Точка кипения: 2927 К
Плотность [кг / м3]: 8,96
Молярный объем: 7. 11 × 10-6 м3 / моль
11 × 10-6 м3 / моль
Протоны / электроны: 29
Нейтроны: 35
Структура оболочки: 2,8,18,1
Электронная конфигурация: [Ar] 3d104s1
Состояние окисления: 3,1
Кристаллическая структура: кубическая
Медь играет важную роль в истории на протяжении как минимум 10 000 лет. Она красноватого цвета и обладает высокой электрической и теплопроводностью. Медь используется во многих домашних хозяйствах, включая провода, дверные ручки и другие приспособления, сантехнику, кровлю и кухонные принадлежности.Большинство американских монет в значительной степени состоят из этого элемента, в то время как Статуя Свободы содержит 179 200 фунтов меди. Из него также делают несколько музыкальных инструментов, особенно духовых инструментов и тарелок. Медь необходима всем высшим растениям и животным и транспортируется в основном с кровотоком.
Return to Elements Table
Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +
Хаякава, Тецуичиро, Аракава, Масаси, Коно, Сатоши, Ханда, Такефуми, Хаяси, Нахо, Минамикава, Кенто, Хорио, Такуя и Терасаки, Акира.»Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +» Zeitschrift für Physikalische Chemie , vol. 235, нет. 1-2, 2021, стр. 213-224. https://doi.org/10.1515/zpch-2020-1668 Хаякава, Т., Аракава, М., Коно, С., Ханда, Т., Хаяси, Н., Минамикава, К., Хорио, Т. и Терасаки, А. (2021). Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +. Zeitschrift für Physikalische Chemie , 235 (1-2), 213-224. https://doi.org/10.1515/zpch-2020-1668
Хаякава, Т., Аракава, М., Коно, С., Ханда, Т., Хаяси, Н., Минамикава, К., Хорио, Т. и Терасаки, А. (2021) Спектроскопия поглощения рентгеновских лучей мелкой меди -оксидные кластерные ионы для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +. Zeitschrift für Physikalische Chemie, Vol. 235 (выпуск 1-2), стр. 213-224. https://doi.org/10.1515 / зпч-2020-1668
Хаякава, Тецуичиро, Аракава, Масаси, Коно, Сатоши, Ханда, Такефуми, Хаяси, Нахо, Минамикава, Кенто, Хорио, Такуя и Терасаки, Акира. «Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +» Zeitschrift für Physikalische Chemie 235, no. 1-2 (2021): 213-224. https://doi.org/10.1515/zpch-2020-1668
Хаякава Т., Аракава М., Коно С., Ханда Т., Хаяси Н., Минамикава К., Хорио Т., Терасаки А.Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +. Zeitschrift für Physikalische Chemie . 2021; 235 (1-2): 213-224. https://doi.org/10.1515/zpch-2020-1668
https://doi.org/10.1515/zpch-2020-1668
Хаякава, Т., Аракава, М., Коно, С., Ханда, Т., Хаяси, Н., Минамикава, К., Хорио, Т. и Терасаки, А. (2021) Спектроскопия поглощения рентгеновских лучей мелкой меди -оксидные кластерные ионы для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +. Zeitschrift für Physikalische Chemie, Vol. 235 (выпуск 1-2), стр. 213-224. https://doi.org/10.1515 / зпч-2020-1668
Хаякава, Тецуичиро, Аракава, Масаси, Коно, Сатоши, Ханда, Такефуми, Хаяси, Нахо, Минамикава, Кенто, Хорио, Такуя и Терасаки, Акира. «Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +» Zeitschrift für Physikalische Chemie 235, no. 1-2 (2021): 213-224. https://doi.org/10.1515/zpch-2020-1668
Хаякава Т., Аракава М., Коно С., Ханда Т., Хаяси Н., Минамикава К., Хорио Т., Терасаки А.Рентгеновская абсорбционная спектроскопия малых кластерных ионов оксида меди для анализа степени окисления Cu и комплексообразования Ar: CuOAr + и Cu2O2 +. Zeitschrift für Physikalische Chemie . 2021; 235 (1-2): 213-224. https://doi.org/10.1515/zpch-2020-1668Новые правила ЕС: вопросы степени окисления меди — Новости компании
Будут внесены следующие изменения:
— Максимальные уровни добавок меди в кормах для поросят будут еще более ограничены:
| До | После |
| Поросята до 12 недель: 170 мг / кг Cu (всего) | Кормление грудью и отъем до 4 недель после отъема: 150 мг / кг Cu (всего) |
| С 5-й недели после отлучения до 8 недель после отлучения: 100 мг / кг Cu (всего) |
— Степень окисления и концентрация меди в каждом соединении будут более строго определены:
| Степень окисления | Минимальное содержание меди | |
| Оксид меди (II) | Cu 2+ | 77% |
| Оксид меди (I) (CoRouge ® ) | Cu + | 73% |
| Карбонат меди (II) | Cu 2+ | 52% |
| Хлорид меди (II) | Cu 2+ | 36% |
| Диацетат меди (II) | Cu 2+ | 31% |
| Сульфат меди (II) | Cu 2+ | 24% |
| Медь (II) хелат глицина (твердый) | Cu 2+ | 15% |
| Хелат меди (II) аминокислот | Cu 2+ | 10% |
| Хелат меди (II) гидролизатов белка | Cu 2+ | 10% |
| Медь (II) хелат глицина (жидкость) | Cu 2+ | 6% |
— Соединения меди не будут использоваться в питьевой воде.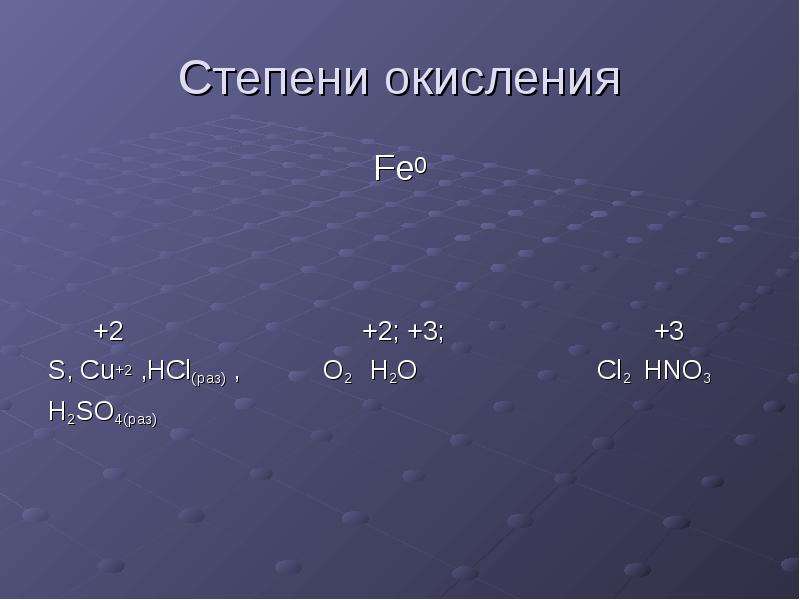
Благодаря такому прогрессу в определении и характеристике микроэлементов с добавками, европейское регулирование помогает кормовой промышленности выбирать лучший источник меди для оптимальной биодоступности и здоровья кишечника. CoRouge ® , как уникальная форма оксида меди (I), был разрешен в Европейском Союзе в декабре 2016 года с последними требованиями к удостоверениям личности, безопасности и эффективности.
26 июля 2018 г. — Animine
Исследования XANES состояния окисления ионов меди в силикатном стекле
[1] Л.Кормье, Г. Калас, Б. Бёнеу, Структурные изменения между натриево-известково-силикатным стеклом и расплавом, J. Non-Cryst. Твердые тела. 357 (2011) 926–931.
DOI: 10.1016 / j.jnoncrysol.2010.10.014
[2] Э.Рафи, С. Шахебрахими, Нанокремнезем с большой площадью поверхности из рисовой шелухи в качестве носителя для 12-вольфрамофосфорной кислоты: эффективный нанокатализатор в некоторых органических реакциях, Подборка. J. Catal. 33 (2012) 1326–1333.
DOI: 10.1016 / s1872-2067 (11) 60420-8
[3]
Ф. Х. Эльбаталь, М.А.Марзук, Х.А. Эльбаталь, Оптические и кристаллизационные исследования силикатных стекол натрия и калия, легированных диоксидом титана, J. Mol. Struct. 1121 (2016) 54-59.
Х. Эльбаталь, М.А.Марзук, Х.А. Эльбаталь, Оптические и кристаллизационные исследования силикатных стекол натрия и калия, легированных диоксидом титана, J. Mol. Struct. 1121 (2016) 54-59.
DOI: 10.1016 / j.molstruc.2016.05.052
[4] С.Ла Дельфа, Э. Силиберто, Л. Пирри, Поведение меди и свинца как хромофорных элементов в силикатных стеклах натрия, J. Cult. Herit. 9 (2008) 117-122.
DOI: 10.1016 / j.culher.2008.07.006
[5] Р.Арлетти, М. Далкони, римское цветное и непрозрачное стекло: химическое и спектроскопическое исследование, Прил. Phys. А. 83 (2006) 239–245.
DOI: 10.1007 / s00339-006-3515-2
[6]
С.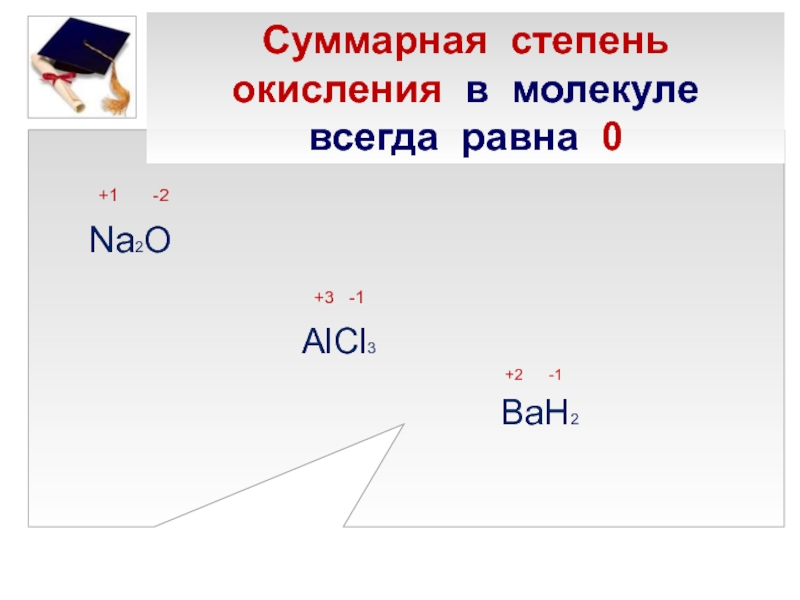 Ли, С. Хван, М. Ча, Роль иона меди в предотвращении образования наночастиц серебра в стекле Bi2O3-B2O3-ZnO, J. Phys. Chem. Твердые тела. 69 (2008) 1498–1500.
Ли, С. Хван, М. Ча, Роль иона меди в предотвращении образования наночастиц серебра в стекле Bi2O3-B2O3-ZnO, J. Phys. Chem. Твердые тела. 69 (2008) 1498–1500.
DOI: 10.1016 / j.jpcs.2007.10.118
[7] Ф.Х. Эльбаталь, С.Ю. Марзук, Н. Нада, С. Desouky, Взаимодействие гамма-лучей с висмут-боратными стеклами, легированными медью, Phys Б. 391 (2007) 88–97.
DOI: 10.1016 / j.physb.2006.09.001
[8] А.Quaranta, R. Ceccato, C. Menato, Формирование нанокристаллов меди в щелочно-известковом кварцевом стекле с помощью различных восстановителей, J. Non-Cryst. Твердые тела. 345 (2004) 671-675.
DOI: 10.1016 / j.jnoncrysol.2004.08.160
[9]
Т. Сом, Б. Кармакар, Одностадийный синтез и свойства монолитного фотолюминесцентного рубинового цвета, J. Alloy. Compd. 509 (2011) 4999–5007.
Сом, Б. Кармакар, Одностадийный синтез и свойства монолитного фотолюминесцентного рубинового цвета, J. Alloy. Compd. 509 (2011) 4999–5007.
DOI: 10.1016 / j.jallcom.2011.01.208
[10] Б.Равель и М. Ньювилл, ATHENA, ARTEMIS, HEPHAESTUS: анализ данных для рентгеновской абсорбционной спектроскопии с использованием IFEFFIT, J. Synchrotron. Radiat. 12 (2005) 537–541.
DOI: 10.1107 / s090
05012719
[11] W.Ми-танг, Ч. Цзинь-шу, Вязкость и термическое расширение редкоземельного элемента, содержащего натриево-известково-силикатное стекло, J. Alloy. Compd. 504 (2010) 273–276.
DOI: 10.1016 / j.jallcom.2010.05.111
[12]
Ф. Х. Эльбаталь, Э.М.А. Халил, Инфракрасная спектроскопия отражения для точного отслеживания коррозионного поведения в бинарном свинцово-силикатном стекле, легированном переходными 3d-металлами, Physica. Б. 405 (2010) 2648–2653.
Х. Эльбаталь, Э.М.А. Халил, Инфракрасная спектроскопия отражения для точного отслеживания коррозионного поведения в бинарном свинцово-силикатном стекле, легированном переходными 3d-металлами, Physica. Б. 405 (2010) 2648–2653.
DOI: 10.1016 / j.physb.2010.03.044
[13] Э.М.А. Халил, Ф.Х. ЭльБатал, Ю.М. Хэмди, Х. Зидан, М. Азиз, А. Абдельгани, Инфракрасные спектры поглощения кремнеземистых стекол, легированных переходными металлами, Физика. Б. 405 (2010) 1294–1300.
DOI: 10.1016 / j.physb.2009.11.070
[14] Дж.Роте, Дж. Хормс, Исследование in situ рентгеновской абсорбционной спектроскопии при образовании коллоидной меди, J. Am. Chem. Soc. 120 (1998) 6019-6023.
DOI: 10.1021 / ja972748w
[15]
С. Даенгсакул, П. Кидхунтход, О. Сойсанг, Т. Куенун, А. Бутчанонт, С. Маенсир, Влияние легирования Gd в соединении La1-x-yGdxSryMnO3 на нанокристаллическую структуру методом рентгеновской абсорбционной спектроскопии (XAS), Микроэлектрон. Англ. 146 (2015).
Даенгсакул, П. Кидхунтход, О. Сойсанг, Т. Куенун, А. Бутчанонт, С. Маенсир, Влияние легирования Gd в соединении La1-x-yGdxSryMnO3 на нанокристаллическую структуру методом рентгеновской абсорбционной спектроскопии (XAS), Микроэлектрон. Англ. 146 (2015).
DOI: 10.1016 / j.mee.2015.03.065
[16] Дж.Кауфманн, К. Рассел, Термодинамика Cu + / Cu2 + -редокс-равновесия в натриево-силикатных и натронно-известково-силикатных расплавах, J. Non-Cryst. Твердые тела. 355 (2009) 531–535.
DOI: 10.1016 / j.jnoncrysol.2009.02.004
[17] Р.Бунтем и К. Самконггам, Исследования XANES по степени окисления меди и железа в матрице силикатного стекла, Материалы PACCON 2015. (2015) 909-912.
DOI: 10.4028 / www.scientific.net / kem.757.9
Роль степени окисления меди в катализаторах Cu / ZnO / Al2O3 в гидрировании CO2 и производительности метанола
Автор
Включено в список:- Дасиредди, Венката Д.
 ДО Н.Э.
ДО Н.Э. - Ликозар, Блаж
Abstract
Гидрирование CO2 проводилось на серии катализаторов Cu / ZnO / Al2O3, которые были приготовлены различными методами синтеза (соосаждение, с помощью ультразвука, золь-гель и твердотельный). Исследованы прикладные физико-химические свойства материалов и их каталитические свойства. Впоследствии были детально оценены влияние методики приготовления на средний размер частиц Cu, взаимодействия металлов, площадь поверхности открытых фаз меди и соотношение Cu0 / Cu +, а также его специфическое влияние на реакции.Ультразвуковой метод синтеза обеспечил увеличенное количество основных активных центров и значительную селективность по метанолу по сравнению с традиционной процедурой осаждения, а также улучшил дисперсию отдельных металлических частиц Cu, что в конечном итоге изменило внутреннюю реактивную активность CuO – ZnO. Тенденция видимой производительности по Ch4OH также соответствовала соотношению или содержанию Cu + / CuO. Присутствие частиц Cu + при высоких уровнях концентрации, таким образом, имеет решающее значение для высокой селективности по метанолу и чрезвычайно низкой селективности по CO в анализируемых обычных промышленных рабочих условиях.Зависимость селективного образования метанола от доли определяемых щелочных фрагментов оказалась аналогичной для всех исследованных катализаторов. Таким образом, роль и распределение степени окисления Cu + / Cu0 могут помочь в разработке и оптимизации катализатора конверсии CO2.
Предлагаемое цитирование
DOI: 10.1016 / j.renene.2019.03.073
Скачать полный текст от издателя
Поскольку доступ к этому документу ограничен, вы можете поискать его другую версию.
Исправления
Все материалы на этом сайте предоставлены соответствующими издателями и авторами. Вы можете помочь исправить ошибки и упущения. При запросе исправления укажите идентификатор этого элемента: RePEc: eee: renene: v: 140: y: 2019: i: c: p: 452-460 .См. Общую информацию о том, как исправить материал в RePEc.
По техническим вопросам, касающимся этого элемента, или для исправления его авторов, названия, аннотации, библиографической информации или информации для загрузки, обращайтесь: (Nithya Sathishkumar). Общие контактные данные поставщика: http://www.journals.elsevier.com/renewable-energy .
Если вы создали этот элемент и еще не зарегистрированы в RePEc, мы рекомендуем вам сделать это здесь. Это позволяет связать ваш профиль с этим элементом.Это также позволяет вам принимать потенциальные ссылки на этот элемент, в отношении которых мы не уверены.
У нас нет ссылок на этот товар. Вы можете помочь добавить их, используя эту форму .
Если вам известно об отсутствующих элементах, цитирующих этот элемент, вы можете помочь нам создать эти ссылки, добавив соответствующие ссылки таким же образом, как указано выше, для каждого ссылочного элемента. Если вы являетесь зарегистрированным автором этого элемента, вы также можете проверить вкладку «Цитаты» в своем профиле RePEc Author Service, поскольку там могут быть некоторые цитаты, ожидающие подтверждения.
Обратите внимание, что исправления могут занять пару недель, чтобы отфильтровать различные сервисы RePEc.
.

 Морковь, белокочанная капуста, а также пекинская, савойская, морская капуста, огурцы, болгарский перец, редис, свекла, практически вся зелень, включая листья салата.
Морковь, белокочанная капуста, а также пекинская, савойская, морская капуста, огурцы, болгарский перец, редис, свекла, практически вся зелень, включая листья салата. е. м. (г/моль
е. м. (г/моль 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8 Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
 ДО Н.Э.
ДО Н.Э.
Leave A Comment