«Периодический закон и периодическая система»
Тест на тему: « Периодический закон и периодическая система».
ЕГЭ Вопрос №2
1. Наибольший радиус из перечисленных элементов имеет атом
1) бора 2) кислорода 3) фтора 4) лития
2. В ряду элементов Na—Mg—Al—Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) уменьшается электроотрицательность
4) уменьшается высшая степень окисления атомов
3. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
1) железо, хлор, фтор, натрий 3)фтор, хлор, бором, йод
2) фосфор, сера, хлор, аргон 4) натрий, магний, алюминий, кремний
4. Максимальный радиус атома имеет
1) железо 2) хлор 3) магний 4) натрий
5.
1) Ga, Mg, Li 2) Li, Na, K 3) Li, Be, B 4) Li, Na, Mg
6. В последовательности Be—C—O радиус атома
1) уменьшается 3) не изменяется
2) увеличивается 4) не подчиняется четкой зависимости
7. Наибольший радиус имеет атом элемента:
1) бериллий 2) азот 3) литий 4) бор
8. В ряду С—N—О—F
1) усиливаются металлические свойства элементов
2) увеличивается атомный радиус элементов
3) уменьшается атомный радиус элементов
4) усиливается восстановительная способность
9. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
1) кальций, азот, железо, сера 3)кремний, фосфор, сера, хлор
2) фтор, азот, бор, литий 4) стронций, кальций, магний, бериллий
10. Максимальный радиус атома имеет
Максимальный радиус атома имеет
1) кальций 2) азот 3) железо 4) сера
11. Радиус атома увеличивается в ряду
1) Be, Mg, Ca 2) I, Br, Cl 3) B, C, N 4) N,P,S
12. Наибольшую электроотрицательность имеет атом, электронная формула которого
1) 1s22s22p63s23p63d104s24p1 3) 1s22s22p63s23p63d104s24p1
2) 1s22s22p63s23p3 4) 1s22s22p63s23p63d54s2
13. Наибольший радиус атома имеет
1) водород 2) углерод 3) кремний 4) фосфор
14. Радиус атома в периоде слева направо
1) увеличивается 3) растет с увеличением порядкового номера элемента
2) уменьшается 4) не изменяется
15. В ряду Li—Be—B—С
В ряду Li—Be—B—С
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
16. В порядке возрастания атомного радиуса элементы расположены в ряду:
1) хлор, алюминий, кремний, магний
2) магний, алюминий, кремний, фосфор
3)натрий, алюминий, фосфор, хлор
4) кремний, алюминий, магний, натрий
17. Среди перечисленных элементов максимальный радиус атома имеет
1) хлор 2) алюминий 3) кремний 4) магний
18. Среди перечисленных элементов минимальную электроотрицательность имеет
1N 2) F 3) O 4) H
19. Элемент, атом которого имеет наибольший радиус:
1) хлор 2) бериллий 3) натрий 4) магний
20. Наибольший радиус атома имеет:
Наибольший радиус атома имеет:
1) углерод 2) бор 3) фтор 4) кислород
21. В порядке возрастания атомного радиуса химические элементы расположены в ряду:
1) хлор, магний, натрий, алюминий
2) натрий, магний, алюминий, кремний
3) хлор, сера, фосфор, кремний
4) натрий, алюминий, фосфор, хлор
22.Среди элементов 3 периода максимальный радиус имеет:
1) хлор 2) магний 3) натрий 4) алюминий
23. Неметаллические свойства возрастают в ряду:
1) S, Se, Te 2) N2, O2, F2 3) Br2, F2, Cl2 4) B, Al, C
24. Наибольшей электроотрицательностью среди элементов VIА группы обладают
1) кислород 2) сера 3) селен 4) теллур
25. Наибольшей электроотрицательностью имеет атом, электронная формула которого
1) 1s22s22p63s23p5 3) 1s22s22p63s23p4
2) 1s22s22p63s23p1 4) 1s22s22p63s23p3
26. Наибольшую первую энергию ионизации имеет атом
Наибольшую первую энергию ионизации имеет атом
1) натрия 2) серы 3) брома 3) фтора
27. Сила кислот в ряду HF—HCl—HBr—HI
1) уменьшается 3) не изменяется
2) возрастает 4) сначала уменьшается, потом возрастает
28. Верны ли следующие суждения?
А) Сверху вниз в группе увеличивается радиус атома
Б) Сверху вниз в группе увеличиваются кислотные свойства оксидов элементов
1) верно только А 3) верны оба суждения
2) верно только Б 4) оба суждения неверны
29. В периоде слева направо
1) усиливаются металлические свойства простых веществ
2) усиливаются кислотные свойства оксидов
3) уменьшается электроотрицательность элементов
4) химические свойства не изменяются
30. Сверху вниз в VА- группе Периодической системы Д. И.Менделеева
И.Менделеева
1) усиливаются основные свойства веществ оксидов
2) усиливаются кислотные свойства простых веществ
3) растет электроотрицательность элементов
4) химические свойства не изменяются
1) йод, хлор, фтор 3) фтор, хлор, йод
2) хлор, фтор, йод 4) йод, фтор, хлор
32. Радиус атома растет в ряду
1) бром, хлор, фтор 3) хлор, бром, фтор
2) фтор, хлор, бром 4) бром, фтор, хлор
33. Две Пи-связи содержат молекулы веществ:
1) азот и пропин
2) хлорноватистая кислота и бутадиен
3) хлористая кислота и диоксид серы
4) азотистая кислота и бутин
34. В ряду H2SO4—-S—H2S происходит увеличение
1) восстановительных свойств 3) степени окисления серы
2) окислительных свойств 4) растворимости в воде
35. Усиливаются основные свойства высших оксидов элементов в ряду
Усиливаются основные свойства высших оксидов элементов в ряду
1) галлий, кремний, фосфор 3) бериллий, бор, рубидий
2) цинк, сера, магний 4) сера, теллур, стронций
36. В ряду BeH2—H2S происходит увеличение
1) степени окисления атома водорода 3) угла между связями
2) основных свойств 4) восстановительных свойств
37. Степень окисления хлора в ряду
Хлорноватистая кислота—хлорная кислота—хлорноватая кислота
1) уменьшается 3) не изменяется
2) увеличивается 4) сначала увеличивается, потом уменьшается
38. Радиус атома растет в ряду:
1) барий, калий, бериллий 3) сера, селен, теллур
2) алюминий, фосфор, хлор 4) цезий, кальций, кремний
39. В ряду HBr—HF происходит увеличение
1) силы кислоты 3) полярности связи
2) длины связи 4) восстановительных свойств
40.
1) бериллий, калий, рубидий 3) теллур, сера, селен,
2) хлор, алюминий, фосфор 4) цезий, кальций, кремний
41. Наибольшую первую энергию ионизации имеет атом элемента
1) фтор 2) хлор 3) бром 4) йод
42. Активность металлов уменьшается в ряду
1) Fe, Zn, Cd, Pb 2) Fe, Zn, Pb, Cd 3) Zn, Fe, Pb, Cd 4) Zn, Fe, Cd, Pb
43. Наименьшей способностью принимать электроны обладает атом элемента
1) фосфор 2) мышьяк 3) селен 4) фтор
44. Металлические свойства возрастают в ряду
1) бром—барий 3) германий —селен
2) хлор — фтор 4) кальций—алюминий
45. Наименьшую энергию ионизации имеет атом элемента
1) цезий 2) калий 3) натрий 4) литий
46. Способность принимать электроны увеличивается в ряду
1) кальций, фосфор, бериллий 3) хром, углерод, кремний
2) водород, селен, бром 4) сера, фосфор, бор
47. Кислотные свойства оксидов уменьшаются в ряду
Кислотные свойства оксидов уменьшаются в ряду
1) SiO2, SO3, P2O5 2) SO3, P2O5, SiO2 3) SiO2, P2O5, SO3 4) SO3, SiO2, P2O5
48. Способность отдавать электроны уменьшается в ряду
1) кальций, фосфор, бериллий 3) хром, углерод, кремний
2) водород, селен, бром 4) сера, фосфор, бор
49. Способность отдавать электроны уменьшается в ряду
1) магний, никель, фосфор 3) кислород, сера, теллур
2) алюминий, кремний, кальций 4) рубидий, цезий, серебро
50. Способность отдавать электроны увеличивается в ряду
1) магний, никель, фосфор 3) кислород, сера, теллур
2) алюминий, кремний, кальций 4) рубидий, цезий, серебро
Третий период периодической системы.
 Периодичность в химических свойствах элементов и их соединений
Периодичность в химических свойствах элементов и их соединений1) (2 балла). Атомные ядра были открыты:
А.Д.Менделеевым. В.Дж.Томсоном.
Б.Э.Резерфордом. Г.Д.Чедвигом.
2) (2 балла). Номер периода в Периодической системе определяется:
А). Зарядом ядра атома.
Б). Числом электронов в наружном слое атома.
В). Числом электронных слоёв в атоме.
Г). Числом электронов в атоме.
3*) (2 балла). Форму электронных орбиталей характеризует:
А). Главное квантовое число.
Б). Магнитное квантовое число.
В). Орбитальное квантовое число.
Г). Спиновое квантовое число.
4) (2балла). Пара элементов, имеющих сходное строение внешнего и предвнешнего энергитических уровней:
А). S и Cl. Б). Be и B. В). Kr и Xe. Г). Mo и Se.
5) (2 балла). p-Элементом является:
А). Скандий. Б). Барий. В). Мышьяк. Г). Гелий.
6) (2 балла). Электронная конфигурация …3d104s2 соответствует элементу:
A). Кальцию. Б). Криптону. В). Кадмию. Г). Цинку.
Г). Цинку.
7) (2 балла). Амфотерным гидроксидом является вещество, формула которого:
А). Zn(OH)2. Б). Mg(OH)2. В). Ca(OH)2 . Г). Cr(OH)2.
8) (2 балла). Ряд элементов, расположенных в порядке усиления металлических свойств:
А). Mg-Ca-Zn. Б). Al-Mg-Ca. В). Sr-Rb-K. Г).Ge-Si-Sb.
9) (2 балла). Элемент Э с электронной формулой 1s22s22p63s23p63d104s24p1 образует высший оксид, соответствующий формуле:
А). Э2О. Б). Э2О3. В). ЭО2. Г). ЭО3.
10) (2 балла) Изотоп железа, в ядре которого содержится 22 нейтрона, обозначают:
А). 40/20Ca. Б). 42/20Ca. В). 44/20Ca. Г). 48/20Ca.
11) (9 баллов). Установите соответствие.
А).1s22s22p63s23p1 1). Алюминий.
Б).1s22s22p63s2 2). Калий.
В).1s22s22p63s23p63d104s24p4 3). Селен.
Г).1s22s22p63s23p64s1 4). Магний.
Формула высшего оксида.
1.Э2O 2. Э2О3 3. ЭО 4.ЭО3.
Формула высшего гидроксида
1.ЭOН 2. Э(ОН)2 3. Э(ОН)3 4.Н2ЭО4.
12) (3 балла). На основании положения в Периодической системе расположите элементы: Германий, Мышьяк, Сера, Фосфор – в порядке убывания окислительныхсвойств. Обьясните ответ.
Обьясните ответ.
13) (6 баллов). Как и почему в Периодической системе изменяются металлические свойства?
А). В пределах периода.
Б). В пределах главной подгруппы.
14).(7 баллов). Составьте электронную формулу элемента с порядковым номером 30 в Периодической системе. Сделайте вывод о принадлежности этого элемента к металлам или неметаллам. Запишите формулы его высшего оксида и гидроксида, укажите их характер.
15) (5 баллов). Какие химические свойства характерны для оксида элемента 3-го периода, главной подгруппы VI группы Периодической системы? Ответ подтвердите, написав уравнения реакций.
А1. Знак химическогоэлемента азота:
А)
Al б) N в) Na
г) O
А2. Название элемента
со знаком Fe:
А) Медь
б) Железо в) Золото г) Алюминий
А3. Сложное вещество
– это …
А) углекислый газ б) медь в)
водород г) кислород
А4. Относительная молекулярная масса наибольшая у вещества
С формулой:
А) h3S б) SO2 в) K2S г) CuS
А5.
Элемент третьего периода главной подгруппы II группы
Периодической системы химических элементов Д.И. Менделеева – это …
А) Алюминий б) Бериллий в) магний г) кальций
А6. Обозначение изотопа, в ядре которого содержится 8 протонов и
8 нейтронов:
А) 168О б) 178О в) 188О г)198О
А7. Атом химического элемента, электронная оболочка которого содержит
16 электронов:
А) Кислород б) Сера
в) Хлор
г) Натрий
А8. Два электронных слоя (энергетических уровня) содержит атом:
А) Бора
б) Калия в) Алюминия г) Магния
А9. Пара химических элементов, имеющих на внешнем энергетическом уровне
по 4 электрона:
А) P и C б) Si и Ca в) N и P г) C и Si
А11. Информацию о
числе энергетических (электронных) уровней
Атома элемента дает:
А) номер периода б) номер группы в)
порядковый номер г) относительная атомная масса
А10. Наименее электроотрицательный
элемент (из перечисленных):
А) Азот
б) Водород в) Хлор г) Фосфор
А12. Химический
Химический
элемент имеющий 20е;20р11;20n01
А) Mg
б) Na в) Вe г) Ca
В1. Атом или ион,
имеющий следующее распределение электронов по энергетическим уровням 2e8e:
А) Ne
б) Ca+2 в) Мg+2 г) Na+
В2. Выберите
химические элементы, расположенные по мере уменьшения металлических свойств:
А) Li, F, Na, O б) Li, Na, O, F
в) F, Na, O, Li г) F, O, Na, Li
В3. Ионы калия и
хлора имеют:
А) одинаковый заряд ядра
Б) одинаковую относительную
молекулярную массу
В) одинаковое общее число
электронов
Г) одинаковое число электронов на
внешнем энергетическом уровне
С1. Запишите схемы
образования соединений, состоящих из атомов химических элементов:
А)
водорода и фтора б) магния и хлора
Определите тип
химической связи в них
С2. Выпишите
соединения с ковалентной полярной связью: O2, Li, h3Se, K2O, BaCl2,
Fe, J2, FeS, HJ, SO3,
S, ZnО
 13.(4 балла). В каком соединении ковалентная связь будет более полярной: в метане или силане? Дайте обоснованный ответ. 14.(6 баллов). Расставьте коэффициенты в схеме реакции Р + h3SO4(KOH.) → Н3РО4 + SO2 + Н2О методом электронного баланса. Укажите окислитель и восстановитель. 15. (6 баллов). В кислоту, полученную при растворении 11,2 л газообразного хлорводорода (н. у.) в воде, поместили 13 г цинка. Вычислите объем выделившегося при этом газа (н. у.).
13.(4 балла). В каком соединении ковалентная связь будет более полярной: в метане или силане? Дайте обоснованный ответ. 14.(6 баллов). Расставьте коэффициенты в схеме реакции Р + h3SO4(KOH.) → Н3РО4 + SO2 + Н2О методом электронного баланса. Укажите окислитель и восстановитель. 15. (6 баллов). В кислоту, полученную при растворении 11,2 л газообразного хлорводорода (н. у.) в воде, поместили 13 г цинка. Вычислите объем выделившегося при этом газа (н. у.).Тесты A2.
2-1. Номер периода, в котором расположен химический элемент, характеризует
3) формулу высшего оксида 4) высшую валентность
2-2. Номер группы элемента в периодической системе соответствует
заряду ядра атома этого элемента
числу электронов на валентной оболочке атома
числу электронных уровней атома этого элемента
среднему значению массовых чисел изотопов этого элемента.
1) основные свойства высших гидроксидов
2) восстановительные свойства водородных соединений;
3) кислотные свойства высших гидроксидов
4) основные свойства высших оксидов.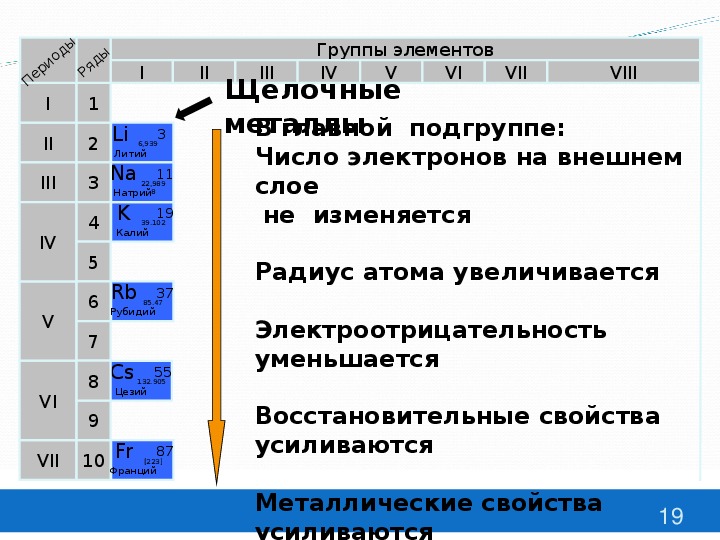
2-4. Среди всех элементов 3-го периода элемент натрий обладает…
1) самой высокой электроотрицательностью 3) самым маленьким радиусом атома
2) наиболее выраженными металлическими свойствами 4) самой большой плотностью
2-5. Для элементов главных подгрупп номер группы характеризует…
1) число заполненных энергетических уровней 2) число валентных электронов
3) агрегатное состояние простого вещества 4) низшую валентность
2-6. Среди всех элементов главной подгруппы VII группы (исключая водород) элемент фтор обладает
1) самыми слабыми неметаллическими свойствами 2) самой большой атомной массой
3) наименьшей электроотрицательностью 4) наименьшим радиусом атома
2-7. Среди всех элементов главной подгруппы IV группы элемент свинец обладает…
1) самой высокой валентностью
2) наименее выраженными металлическими свойствами
3) самым большим радиусом атома
4)самой высокой электроотрицательностью
2-8.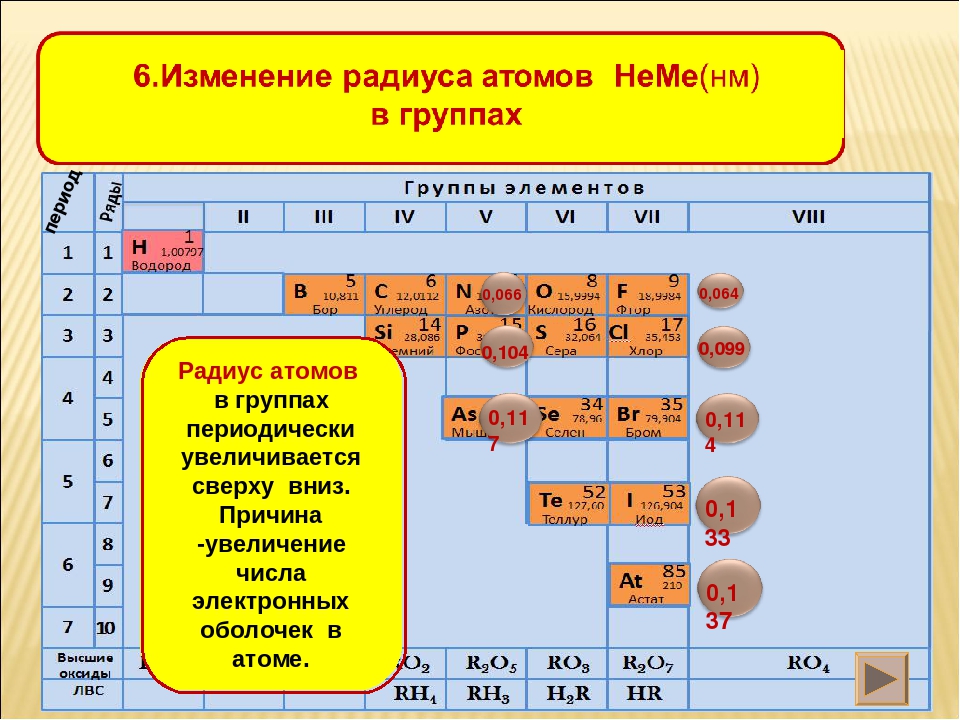 Два элемента имеют следующие конфигурации валентных электронов:
Два элемента имеют следующие конфигурации валентных электронов:
п s 2 пр 3 и ms 2 (m-1)d 3 . Известно, что т не равно п. Что общего у этих элементов?
1) высшая степень окисления 2) формула водородного соединения
3) номер периода 4) число заполненных энергетических уровней
2-9. Сотый элемент периодической системы Д.И. Менделеева является
2-10. Химический элемент с порядковым номером 81 является
1)s – элементом 2)p– элементом 3)d – элементом 4)f – элементом
2-11. Все d-элементы являются:
1) типичными неметаллами 2) металлами
3) эффективным полупроводникам 4) идеальными изоляторами
2-12. К s-элементам относятся:
1) натрий и цинк; 2) калий и барий; 3) серебро и золото
2-13. Элемент IV периода, который с кислородом образует высший оксид ЭО 3 , а с водородом не образует летучих соединений – это…
1) селен 2) свинец 3)германий 4) хром
2-14.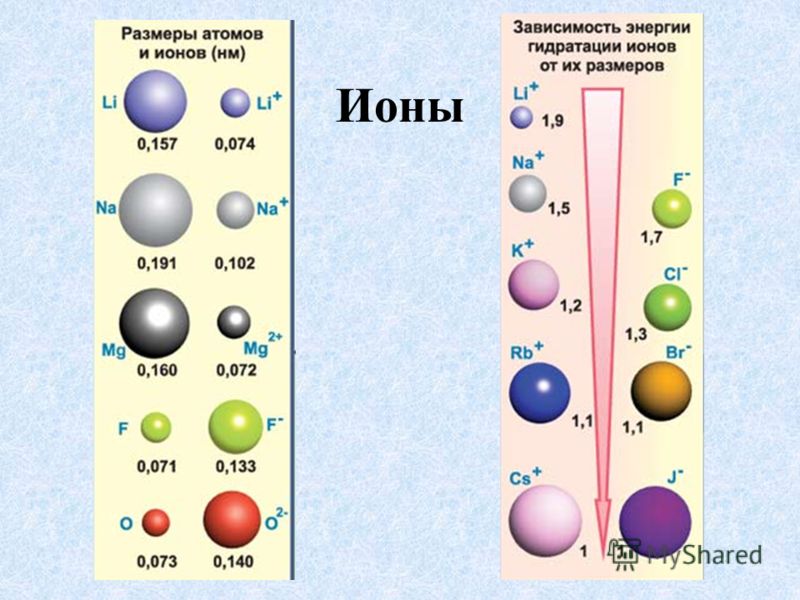 Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s 2 2s 2 2р 6 3з 2 3р 4
Верны ли следующие суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s 2 2s 2 2р 6 3з 2 3р 4
А. Этот элемент образует гидроксид с ярко выраженными кислотными свойствами.
Б. Степень окисления этого элемента в высшем гидроксиде равна +4. .
1)верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
2-15. Элемент четвертого периода, высший оксид которого имеет формулу ЭО и который с водородом образует солеобразное соединение состава ЭН 2 – это…
1) кальций 2) цинк 3) бериллий 4) селен
2-16. Формула высшего оксида элемента – Э 2 О. Какая конфигурация валентных электронов возможна у этого атома? 1) 3s 1 2) 3d 1 4s 2 3) 2s 2 2p 1 4) 2s 2 2p 5
2-17.Определите (гипотетическую) формулу высшего оксида 115-го элемента периодической системы. 1)ЭО 2 2)Э 2 О 5 3) ЭО 4 4)Э 2 О 3
2-18.Формула высшего оксида некоторого элемента — ЭО 3 . Какую конфигурацию валентных электронов может иметь этот элемент в основном состоянии?
1) 4d 6 3) 3s 2 Зр 4 2) 2s 2 2р 4 4) 3s 1 3d 5
2-19. Формула высшего оксида элемента с электронной конфигурацией атома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 1) ЭО 2) Э 2 О 3) Э 2 О 3 4) Э 2 О 5
Формула высшего оксида элемента с электронной конфигурацией атома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 1) ЭО 2) Э 2 О 3) Э 2 О 3 4) Э 2 О 5
2-20. Формула водородного соединения элемента с электронной конфигурацией атома 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2
1) ЭН 2) ЭН 2 3) ЭН 3 4) ЭН 6
2-21. Какое летучее водородное соединение характерно для элемента, высший оксид которого имеет формулу Э 2 О 7: 1) НЭ 2) Н 2 Э 3) ЭН 3 4) ЭН 7
2-22.Элементу с зарядом ядра +32 соответствует высший оксид:
1)ЭО 2 2)Э 2 О 5 3) ЭО 4)Э 2 О 3
2-23. В ряду: Al Si P S
1) усиливаются металлические свойства элементов
2) ослабевают металлические свойства элементов
3) ослабевают неметаллические свойства элементов
4) уменьшается высшая степень окисления элементов
2-24. Среди перечисленных элементов к металлам относится:
1)барий 2)кремний 3)гелий 4) бор 5) фтор
2-25.Наиболее выражены металлические свойства у
1) Al 2) Na 3) Mg 4) Be 5) Fe
2-26. Металлические свойства усиливаются в ряду:
Металлические свойства усиливаются в ряду:
1) K – Na – Li 2) Mg – Ca – K 3) Rb – Sr – Y 4) In – Ga – Ge
2-27. Какой из элементов имеет наиболее ярко выраженные металлические свойства?
1)K 2)Na 3)Ca 4)Mg 5) Be
2-38.В каком ряду простые вещества расположены в порядке усиления металлических свойств?
1)Mg, Ca, Ba 2)Na, Mg, Al 3)K, Ca, Fe 4)Sc, Ca, Mg
2-29.В каком ряду простые вещества расположены в порядке усиления их металлических свойств?
1) Na, Mg, Al 2) K, Na, Be 3) Li, Na, K 4) Ba, Sr, Ca
2-30.Какая из групп элементов содержит только металлы?
1) Li , Be, B 2) K, Ca,Sr 3) Li, Si, Na 4)Se, Te, Po
2-31. Наиболее выраженными металлическими свойствами обладает
1) Nа 2) К 3) Mg 4) А1
2-32. Наименее выраженными металлическими свойствами обладает
1) Rb 2) Sr 3) Са 4) К
2-33. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1)Na, Mg, Al 2) Al, Mg, Na 3) Cа, Mg, Be 4) Mg, Be, Cа
2-34. Какой из элементов имеет наиболее ярко выраженные неметаллические свойства?
Какой из элементов имеет наиболее ярко выраженные неметаллические свойства?
1)S 2)Se 3)Te 4)Po 5)As
2-35. В порядке усиления неметаллических свойств расположены
1) S-Sе 2) Sе-Вr 3) Вr-I 4) I-Te
2-36. Неметаллические свойства у элементов А групп усиливаются
1) слева направо и в группах снизу вверх
2) справа налево и в группах сверху вниз
3) справа налево и в группах снизу вверх
4) слева направо и в группах сверху вниз
2-37. Верны ли следующие суждения о неметаллах ?
А. В периодической системе неметаллы расположены в правой, преимущественно верхней части.
Б. Среди неметаллов нет ни одного d- элемента.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
2-38. В атомах каких металлов в основном состоянии на энергетическом d-подуровне содержится пять электронов:
1) Железа 4) Ванадия
2) Марганца 5) Хрома
2-39. В атомах каких металлов в основном состоянии на энергетическом d-подуровне содержится пять электронов:
1) Хрома 5) Германия
2) Серебра 6) Рубидия
3) Цинка 7) Кадмия
4) Калия 8) Марганца
2-40. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Li, Na, K, Rb 2) Sr, Ca, Mg, Be 3) In, Ga, Al, B 4) Sn, Ge, Si, C
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? 1) Li, Na, K, Rb 2) Sr, Ca, Mg, Be 3) In, Ga, Al, B 4) Sn, Ge, Si, C
2-41. Какой из приведенных ниже рядов химических элементов характеризуется возрастанием атомных радиусов?
1)Te, Se, S, O 2)Na, Mg, Al, Si 3)C, B, Be, Li 4)Ba, Al, Ga, Ge
2-42.Среди элементов VIА группы максимальный радиус атома имеет
1)кислород 2) сера 3)теллур 4) полоний
2-43.Химические элементы расположены в порядке возрастания их атомного радиуса в ряду:
1) Be, B, C, N 2)O, S, Se, Te 3)Rb, K, Na, Li 4)Mg, Al, Si, Р
2-44. Какие из приведенных ниже рядов ионов характеризуются уменьшением ионных радиусов?
1)S 2- , Cl — , K + , Ca 2+ 2)As 5+ , V 5+ , Cl 5+ , I 5+
3)Rb + , K + , Ag + , Cu + 4)F — , Si 4+ , Mg 2+ , Na +
2-45. Какой из приведенных ниже рядов ионов характеризуется возрастанием ионных радиусов?
1)O 2- , F — , Al 3+ , Mg 2+ 2)S 6+ , P 5+ , Al 3+ , Na +
3)Ca 2+ , Mg 2+ , Be 2+ , Ba 2+ 4)Ra 2+ , Ba 2+ , Hg 2+ , Zn 2+
2-46. Среди перечисленных элементов наибольший атомный радиус имеет:
Среди перечисленных элементов наибольший атомный радиус имеет:
1)бериллий 2)фтор 3)литий 4)натрий 5)магний
2-47. Атом какого химического элемента, из числа приведенных ниже, имеет наименьший радиус? 1)K 2)Al 3)Sn 4)C 5)O 6)S
2-48. У К и Rb одинаковы…
2-49. У Rb и Sr одинаковы…
1) атомные радиусы 2) значения относительной электроотрицательности
3) степени окисления 4) количества электронных слоев
2-50. У Sr и Ва одинаковы…
1) атомные радиусы 2) значения относительной электроотрицательности
3) заряды ядер 4) высшие степени окисления
2-51. В ряду Be – B – C – N происходит
увеличение радиуса атомов
увеличение электроотрицательности
увеличение силы притяжения валентных электронов к ядру
уменьшение числа неспаренных электронов в основном состоянии атома
1)увеличивается число валентных электронов в атомах
2) уменьшается число электронных слоев в атомах
3) уменьшается число протонов в ядрах атомов
4)увеличиваются радиусы атомов
2-53. В ряду Вe-Mg-Сa-Sr происходит
В ряду Вe-Mg-Сa-Sr происходит
1) ослабление металлических свойств
2) увеличение электроотрицателъности
3) уменьшение числа валентных электронов
4) уменьшение силы притяжения валентных электронов к ядру
2-54. Притяжение электронов внешнего слоя к ядру увеличивается в ряду:
1)Si – P — N 2) S — P –As 3) Na — K – Rb 4) Sr – Ca – K
2-55. Притяжение электронов внешнего слоя к ядру ослабевает в ряду:
1)Al — Mg — Ca 2) Al — Si — C 3) Na — Mg — Be 4) Se — S — Cl
2-56. Способность атома притягивать валентные электроны других атомов увеличивается в ряду: 1) Mg Ca Ba 2)Si S Cl 3) Р О S 4) F Cl Br
2-57. Способность отдавать электроны атомом элемента увеличивается в ряду
l)Ca, Mg, Be 2)B, C, F 3) Al, Mg, Na 4) S, Cl, F
2-58. Способность принимать электроны атомом элемента увеличивается в
ряду с порядковыми номерами: 1) 16,20 2) 6, 11 3) 12,17 4) 9,10
2-59. Наибольшую энергию нужно затратить на отрыв электронов от атома
1) Са 2) А1 3) Si 4) C
2-60. Наименьшую энергию нужно затратить на отрыв электрона от атома
Наименьшую энергию нужно затратить на отрыв электрона от атома
1) Аs 2) Sе 3) S 4) Р
2-61. Наибольшую энергию нужно затратить на отрыв электрона от
1) Ga 2) Al 3) Si 4) C
2-62.Легче всего присоединяет электроны атом
1) серы 2) хлора 3) селена 4) брома
Тест составлен в четырех вариантах. Каждый вариант включает две части. Первая часть содержит 14 заданий с выбором ответа (базовый уровень сложности), вторая часть- два задания (В1 и В2) с кратким ответом (повышенный уровень сложности). Рекомендуется для учащихся 9 класса в качестве текущего контроля, а также для подготовки к ОГЭ.
Скачать:
Предварительный просмотр:
ТЕСТ по теме «Периодический закон и периодическая система
Химических элементов Д.И. Менделеева»
Вариант № 1
А1. У атома серы число электронов на внешнем уровне и заряд ядра равны соответственно
1) 4 и +16 2) 6 и +32 3) 6 и +16 4) 4 и +32
А2. Сходное строение внешнего электронного слоя имеют атомы мышьяка и
Алюминий→кремний→фосфор→сера
Высшая степень окисления
А4. Притяжение электронов внешнего слоя к ядру
увеличивается
в ряду
Притяжение электронов внешнего слоя к ядру
увеличивается
в ряду
2) увеличение силы притяжения валентных электронов к ядру
3) уменьшение электроотрицательности
А6. В порядке усиления неметаллических свойств расположены
А7. Наибольший радиус у атома
1) брома 2) цинка 3) кальция 4) германия
А8. Наибольшей восстановительной активностью обладает
1) Si 2) Р 3) S 4) С1
А9. Высший оксид состава ЭО образуют все элементы
1) IV А группы 2) IIА группы 3) IV периода 4) II периода
А10. По номеру периода можно определить
1) количество электронов на внешнем уровне атома 3) заряд ядра атома
2) количество всех электронов в атоме 4) число энергетических уровней в атоме
А11. Сколько энергетических уровней в атоме скандия?
1) 1 2) 2 3) 3 4) 4
А. Металлические и восстановительные свойства элементов в главных подгруппах с ростом заряда ядра увеличиваются.
Б
. В периоде с ростом заряда ядра основные свойства оксидов и гидроксидов увеличиваются.
В1.
В2.
Вариант № 2
1) Са 2+ 2) Al 3+ 3)Na + 4) F ─
А2. Сходное строение внешнего электронного слоя имеют атомы кремния и
1) фосфора 2) селена 3) германия 4) ванадия
А3. В ряду химических элементов:
алюминий→кремний→фосфор→сера радиус атома
1) увеличивается 3) не изменяется
2) уменьшается 4) сначала увеличивается, а потом уменьшается
увеличивается в ряду
А5. В ряду Ве-В-С-N происходит
1) увеличение радиуса атомов
4) уменьшение числа валентных электронов
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
1) А1 2) Мg 3) Na 4) Si
В1.
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2.
Вариант № 3
А1. Число валентных электронов в атоме стронция равно
1) 2 2) 3 3) 4 4) 38
А2.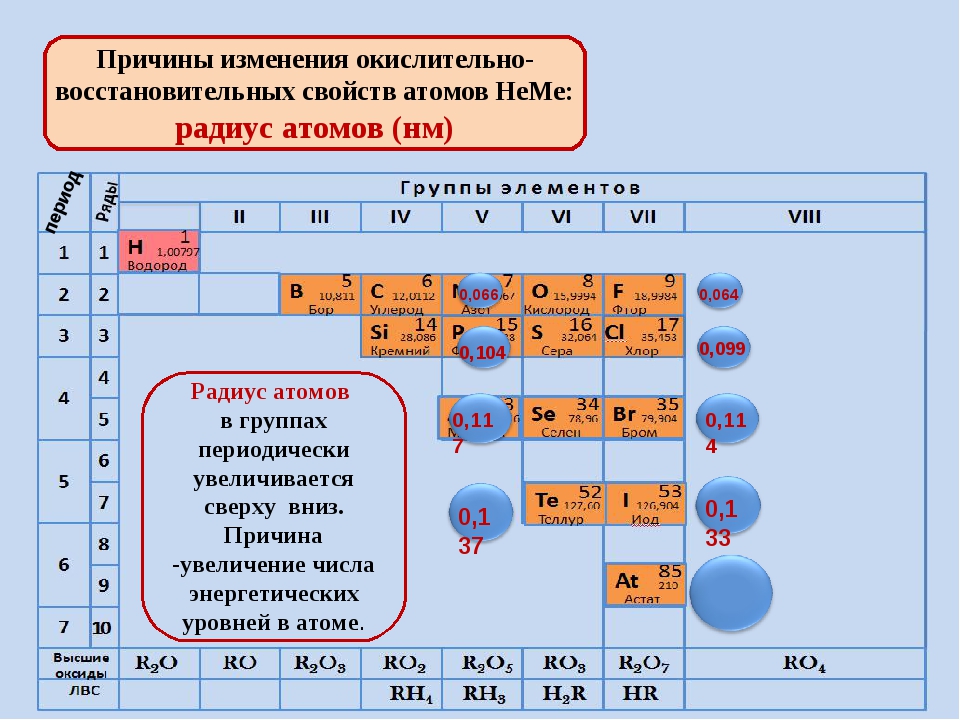 Чем определяется место химического элемента в периодической системе Д.И.Менделеева?
Чем определяется место химического элемента в периодической системе Д.И.Менделеева?
1) количеством электронов на внешнем уровне атома 3) зарядом ядра атома
2) количеством нейтронов в ядре 4) массой атома
А3. Пара элементов, обладающих наиболее сходными химическими свойствами -это
1) Са и К 2) Nа и К 3) В и С 4) С и О
А4. В каком ряду химические элементы расположены в порядке убывания их атомных радиусов?
1) N, C, B 2) N, P, As 3) Na, Mg, K 4) Si, C, N
А5. Наибольшей восстановительной активностью обладает
1) Si 2) Р 3) S 4) С1
А6. Формула высшего оксида, образованного элементом четвертой группы
1) ЭО 2 2) Э 2 О 3 3) ЭО 3 4) Э 2 О 5
А7. В ряду химических элементов Si─ Р ─ S
1) увеличивается число валентных электронов в атомах
2) уменьшается число валентных электронов в атомах
3) уменьшается электроотрицательность
4) увеличиваются радиусы атомов
А8. Притяжение электронов внешнего слоя к ядру увеличивается в ряду
1) Si-P-N 2) S-P-As 3) Na-K-Rb 4) Si-Ca-K
А.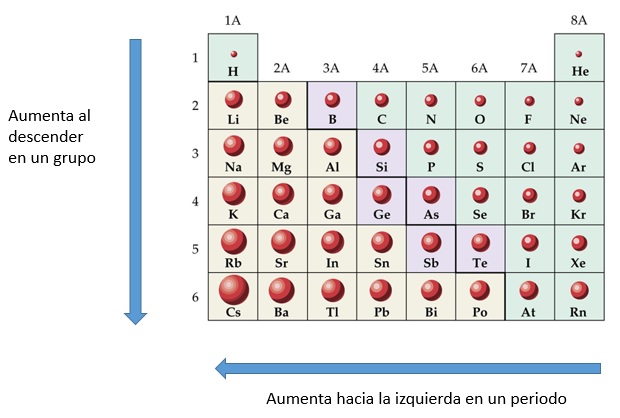 Элементы главной подгруппы имеют одинаковое число электронов на внешнем уровне
Элементы главной подгруппы имеют одинаковое число электронов на внешнем уровне
Б. В главных подгруппах восстановительная способность усиливается с уменьшением радиуса атома
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А10. Высшая степень окисления в ряду химических элементов хлор- бром-йод
1) увеличивается 2) не изменяется 3) уменьшается 4) изменяется периодически
А11. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Br- Se- K 2) Mg- Al- Si 3) N- Li- C 4) S- Cl – P
А12. В порядке усиления неметаллических свойств расположены
1) S-Se 2) Se-Br 3) Br-I 4) I-Te
А13. Наиболее сильными основными свойствами обладает гидроксид
1) КОН 2) NaOH 3) RbOH 4) CsOH
А14. Кислотные свойства наиболее выражены у
1) Br 2 O 7 2) SeO 3 3) As 2 O 5 4) GeO 2
В1. В ряду химических элементов Na ─ Mg─ А1:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2. В ряду химических элементов F─ Br ─ I:
В ряду химических элементов F─ Br ─ I:
1) все элементы имеют высшую степень окисления, равную номеру группы
2) ослабевают неметаллические свойства
3) увеличивается высшая степень окисления
4) увеличивается радиус атомов
5) образуют летучие водородные соединения с общей формулой НЭ
Вариант № 4
А1. Число электронов в атоме аргона равно числу электронов в ионе
1) Мg 2+ 2) Al 3+ 3)Na + 4) С1 ─
А2. Сходное строение внешнего электронного слоя имеют атомы серы и
1) фосфора 2) селена 3) германия 4) ванадия
А3. В ряду химических элементов:
алюминий→кремний→фосфор→сера радиус атома
1) увеличивается 3) не изменяется
2) уменьшается 4) сначала увеличивается, а потом уменьшается
А4. Способность отдавать электроны увеличивается в ряду
1) Si-P-S 2) S-P-Cl 3) Na-K-Rb 4) Ca-K-Na
А5. В ряду Ве-В-С-N происходит
1) уменьшение числа валентных электронов
2) уменьшение силы притяжения валентных электронов к ядру
3) увеличение электроотрицательности
4) увеличение радиуса атомов
А6.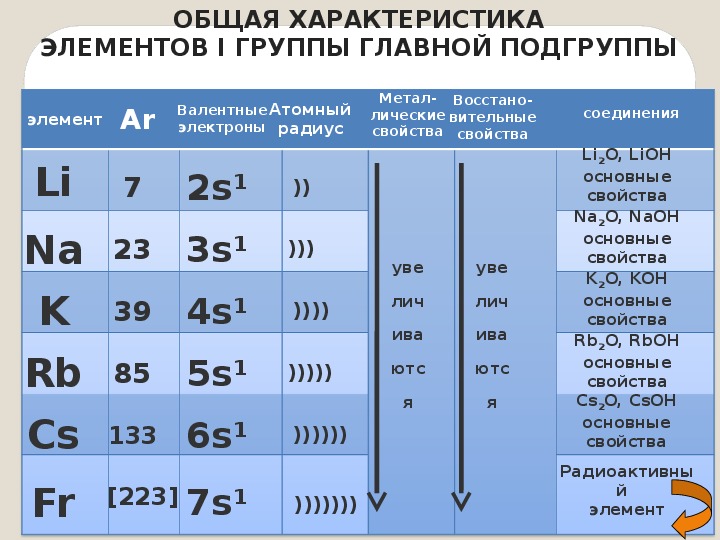 Металлические свойства усиливаются в ряду
Металлические свойства усиливаются в ряду
1) Mg-Ca-Ba 2) Na-Mg-Al 3) K-Ca-Fe 4) Se-Ca-Mg
А7. Наибольшую энергию надо затратить на отрыв электрона от атома
1) серы 2) кремния 3) кальция 4) мышьяка
А. В главной подгруппе с ростом заряда ядра происходит ослабление кислотных свойств гидроксидов.
Б . В периоде с ростом заряда ядра происходит усиление неметаллических свойств элементов.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
А9. Наиболее сильными основными свойствами обладает гидроксид
1) фосфора 2) кальция 3) магния 4) бария
А10. Элемент, проявляющий наиболее ярко выраженные металлические свойства
1) А1 2) Мg 3) Na 4) Si
А11. В ряду В→С→N→О окислительные свойства
1) ослабевают 2) усиливаются 3) не изменяются 4) изменяются периодически
А12. В главных подгруппах с повышением порядкового номера металлические свойства элемента
1) усиливаются 2) ослабевают 3) не изменяются 4) изменяются периодически
А13.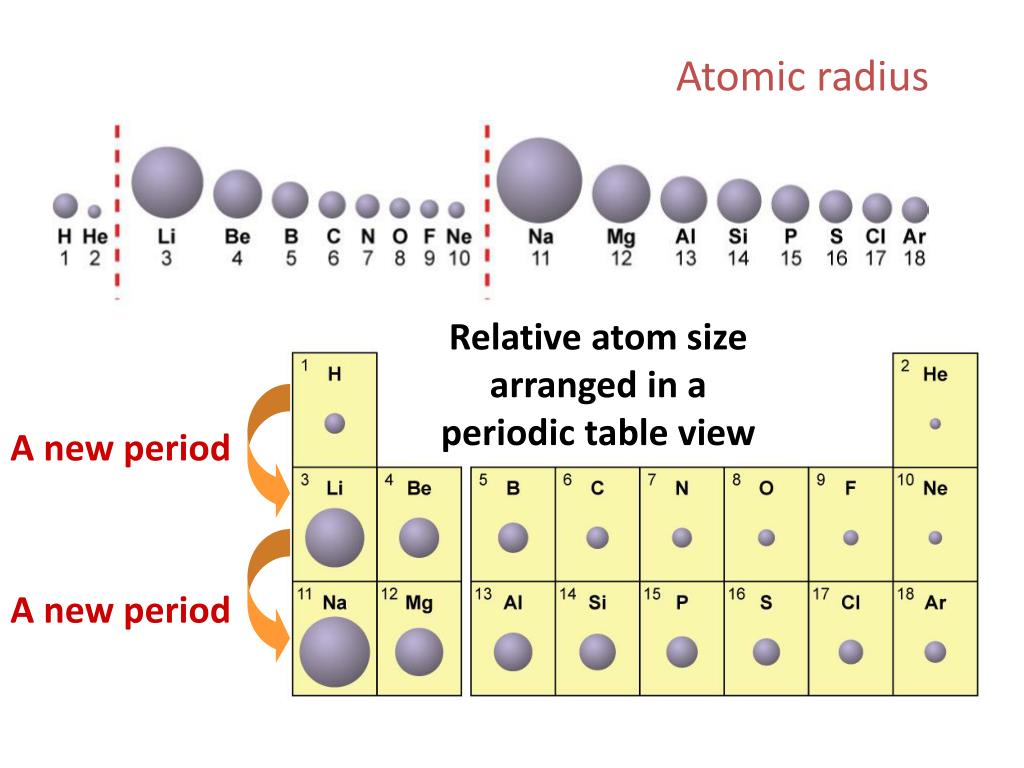 В ряду Na→К→Rb→Cs способность металлов отдавать злектроны
В ряду Na→К→Rb→Cs способность металлов отдавать злектроны
1) ослабевает 2) усиливается 3) не изменяется 4) изменяется периодически
А14. Элемент, в атоме которого на внешнем уровне находится четыре электрона
1) бериллий 2) титан 3) германий 4) фосфор
В1. В ряду химических элементов Li ─ Ве ─ В:
1) уменьшаются заряды ядер атомов
2) увеличивается число электронов во внешнем электронном слое
3) уменьшается электроотрицательность
4) уменьшается радиус атомов
5) усиливаются металлические свойства
В2. Для элементов 3-го периода характерны
1) уменьшение радиуса атома при увеличении заряда ядра
2) одинаковое число валентных электронов
3) одинаковое число электронных уровней у атомов
4) увеличение кислотного характера высших гидроксидов, образованными этими элементами
5) одинаковое агрегатное состояние при обычных условиях
Ответы:
варианты | ||||
Задание | ||||
Расположение элементов в периодической таблице в соответствии с их атомным номером и внешней электронной конфигурацией обусловливает проявление двух важных закономерностей в химических свойствах непереходных элементов и их соединений:
1. Элементы со сходными химическими свойствами подразделяются на группы.
Элементы со сходными химическими свойствами подразделяются на группы.
Например, все щелочные металлы находятся в группе I, а все галогены — в группе VII.
2. Наиболее электроположительные элементы, а следовательно наиболее реакционноспособные металлы, располагаются в нижнем левом углу периодической таблицы. Электроположительность элементов постепенно уменьшается при перемещении снизу вверх вдоль каждой группы и при перемещении слева направо вдоль каждого периода.
Наиболее электроотрицательные элементы, а следовательно, наиболее реакционноспособные неметаллы, располагаются в верхнем правом углу периодической таблицы. Электроотрицательность элементов возрастает при перемещении вдоль каждого периода в направлении от I группы к VII группе, но уменьшается при перемещении сверху вниз вдоль каждой группы.
Таблица 11.11. Закономерности в образовании соединений элементами 2-го и 3-го периодов
Таблица 11.12. Примеры лигандов, включающих p-элементы, в комплексных ионах d-элементов
Электроотрицательность или электроположительность элементов непосредственно связана с типами химических реакций, в которые способны вступать элементы, а значит, и с типами соединений, образуемых элементами. s-Металлы характеризуются способностью легко образовывать катионы и, таким образом, ионные соединения (см. табл. 11.11). -Элементы, расположенные ближе к центру периодической таблицы, характеризуются способностью образовывать только ковалентные соединения. Более электроотрицательные p-элементы, расположенные ближе к правому краю периодической
s-Металлы характеризуются способностью легко образовывать катионы и, таким образом, ионные соединения (см. табл. 11.11). -Элементы, расположенные ближе к центру периодической таблицы, характеризуются способностью образовывать только ковалентные соединения. Более электроотрицательные p-элементы, расположенные ближе к правому краю периодической
Рис. 11.11. Периодические изменения степеней окисления непереходных элементов
Рис. 11.12. Периодические изменения степеней окисления d-элементов первого, второго и третьего переходных рядов (т. е. 4-го, 5-го и 6-го периодов соответственно).
Таблица 11.13. Характерные валентности элементов 3-го периода
таблицы, способны образовывать как ковалентные, так и ионные соединения. Благородные газы, обладающие устойчивой электронной конфигурацией, образуют сравнительно мало соединений.
Как видно из рис. 11.3, d-элементы располагаются в периодической таблице между группами II и III. Все они — металлы, но менее электроположительные и, следовательно, более электроотрицательные, чем s-металлы (щелочные и щелочноземельные металлы). Вследствие этого их соединения, например оксиды и хлориды, как правило, являются либо ионными с высокой степенью ковалентного характера, либо ковалентными. Совместно с p-элементами, расположенными ближе к центральной части периодической таблицы, они нередко образуют соединения высокомолекулярного типа или соединения со слоистой либо цепочечной структурой.
Вследствие этого их соединения, например оксиды и хлориды, как правило, являются либо ионными с высокой степенью ковалентного характера, либо ковалентными. Совместно с p-элементами, расположенными ближе к центральной части периодической таблицы, они нередко образуют соединения высокомолекулярного типа или соединения со слоистой либо цепочечной структурой.
d-Элементы обладают способностью образовывать как катионные, так и анионные комплексные ионы, что не характерно для s-металлов. р-Элементы часто входят в состав лигандов как в катионных, так и в анионных комплексах (табл. 11.12).
Валентности (см. гл. 4) непереходных элементов тоже обнаруживают периодические изменения. Из табл. 11.13 видно, что все элементы 3-го периода обнаруживают валентности, численно совпадающие с номером группы элемента. Кроме того, все элементы IV-VII групп обнаруживают валентности, равные разности между числом 8 и номером их группы.
Максимальные степени окисления элементов тоже обнаруживают периодические изменения (рис. 11.11 и 11.12). Как правило, они возрастают при перемещении слева направо вдоль периода и достигают максимальных значений в группах V-VII. Обращает на себя внимание и то обстоятельство, что элементы с высшими степенями окисления обнаруживают, кроме них, еще множество других степеней окисления. Например, хлор может существовать в состояниях со всеми степенями окисления от -1 до
11.11 и 11.12). Как правило, они возрастают при перемещении слева направо вдоль периода и достигают максимальных значений в группах V-VII. Обращает на себя внимание и то обстоятельство, что элементы с высшими степенями окисления обнаруживают, кроме них, еще множество других степеней окисления. Например, хлор может существовать в состояниях со всеми степенями окисления от -1 до
Во всех трех рядах переходных металлов (-элементов) максимальная степень окисления достигается в средней части ряда (рис. 11.12). -Элементы с высшими степенями окисления обнаруживают кроме них еще максимальное число других степеней окисления. Например, в первом ряду переходных металлов марганец обнаруживает пять положительных степеней окисления от до
Периодичность окислительно-восстановительных свойств
Окислительно-восстановительные свойства элементов тоже обнаруживают периодические изменения. Закономерность этих изменений такова: элементы, занимающие левую часть периодической таблицы, т. е. щелочные и щелочноземельные металлы (-металлы), являются сильными восстановителями. Затем, при перемещении вправо вдоль каждого периода элементы становятся все более слабыми восстановителями и все более сильными окислителями. Наконец, при переходе к VII группе элементы становятся сильными окислителями. Рассмотрим теперь эту закономерность несколько более подробно.
щелочные и щелочноземельные металлы (-металлы), являются сильными восстановителями. Затем, при перемещении вправо вдоль каждого периода элементы становятся все более слабыми восстановителями и все более сильными окислителями. Наконец, при переходе к VII группе элементы становятся сильными окислителями. Рассмотрим теперь эту закономерность несколько более подробно.
Восстановительные свойства -металлов характеризуются:
низкой энергией ионизации,
низким сродством к электрону,
низкой электроотрицательностью,
высокой «электроположительностью» (качественный термин — см. предыдущую сноску),
отрицательным стандартным окислительно-восстановительным потенциалом.
1. Реакция с воздухом или кислородом
2. Реакция с хлором
Реакция с разбавленными кислотами
Все это примеры восстановительной способности s-металлов, так как в каждом случае металл легко отдает электроны:
Подробное обсуждение химии щелочных и щелочноземельных металлов проводится в гл. 13.
13.
Окислительные свойства элементов VII группы характеризуются: высокой энергией ионизации, высоким сродством к электрону, высокой электроотрицательностью, низкой «электроположительностью»,
положительным стандартным окислительно-восстановительным потенциалом.
Хлор обладает свойствами сильного окислителя. Он бурно реагирует с водородом на солнечном свету, образуя хлороводород. В отличие от этого он не реагирует с другими окислителями, например с кислородом или разбавленными кислотами. Подробное обсуждение химии хлора и других галогенов проводится в гл. 16.
Свойства элементов из средней части периодов. Элементы группы VII относятся к p-элементам, которые расположены в правой части периодической таблицы. р-Элемен-ты, находящиеся ближе к средней части периодов, обнаруживают слабые восстановительные и (или) слабые окислительные свойства. Например, принадлежащий к группе IV кремний медленно реагирует с кислородом, образуя оксид
Принадлежащий к группе V азот может выступать как в роли слабого восстановителя, так и в роли слабого окислителя. Например, он ведет себя как слабый восстановитель в реакции с кислородом:
Например, он ведет себя как слабый восстановитель в реакции с кислородом:
В отличие от этого в реакции с водородом азот ведет себя как слабый окислитель:
Переходные -элементы обладают свойствами слабых восстановителей. Например, раскаленное докрасна железо реагирует с водяным паром, образуя водород:
Периодичность свойств соединений
В образовании, структуре, а также физических и химических свойствах соединений тоже обнаруживаются периодические закономерности изменения. Эти закономерности мы проследим на примере оксидов, гидридов, гидроксидов и галогенидов.
Оксиды. Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два p-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия и оксид магния Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
Молекулярные оксиды p-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.
Оксиды d-элементов обычно нерастворимы в воде и обладают основными свойствами, хотя один или два из них. например оксид цинка, обнаруживают амфотерные свойства (см. гл. 14).
гл. 14).
Подробное рассмотрение химии оксидов проводится в разд. 15.4.
Гидриды. В образовании, структуре и свойствах гидридов прослеживаются закономерности, сходные с описанными выше для оксидов, хотя и не полностью одинаковые с ними.
s-Металлы, например натрий и магний, как правило, бурно реагируют в нагретом состоянии с сухим водородом, образуя ионные гидриды. Эти ионные гидриды обладают основными свойствами. Наиболее электроотрицательные -элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами. Исключениями являются метан представляющий собой нейтральное соединение, а также аммиак обладающий основными свойствами.
Более электроотрицательные -элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
Переходные d-металлы в нагретом состоянии реагируют с водородом, образуя нестехиометрические гидриды.
Получение, структура и свойства гидридов подробно описаны в гл. 12.
12.
Гидроксиды. Гидроксиды наиболее электроположительных элементов, например натрия и кальция, являются ионными соединениями с сильно основными свойствами. В отличие от этого сильно электроотрицательный элемент хлор образует кислотный гидроксид, хлорноватистую кислоту . В этом соединении связь между атомами хлора и кислорода ковалентная. Гидроксиды некоторых менее электроотрицательных элементов обладают амфотерными свойствами. Нередко они неустойчивы и образуют оксиды.
Таблица 11.14. Свойства хлоридов элементов 3-го периода
Галогениды. Галогениды обнаруживают периодические изменения свойств, сходные с описанными выше для оксидов, гидридов и гидроксидов. При перемещении вправо вдоль периода от наиболее электроположительных к наиболее электроотрицательным элементам наблюдается понижение температуры кипения и температуры плавления (табл. 11.14). Так, хлориды трех первых элементов в 3-м периоде при нормальных условиях представляют собой твердые вещества, хлориды трех следующих элементов — жидкости, а хлор — газообразное вещество.
Ионный характер хлоридов уменьшается при перемещении вправо вдоль периода, а ковалентный характер, наоборот, возрастает.
Галогениды s-элементов, как правило, представляют собой соли сильных кислот и сильных оснований. Они растворяются в воде с образованием нейтральных растворов. Для хлоридов p- и d-элементов характерна способность вступать в реакцию с водой, образуя кислые растворы. Например,
Реакции хлоридов d-элементов в воде описаны в гл. 14, а химия галогенидов более подробно обсуждается в гл. 16.
Диагональные соотношения между элементами
Ранее уже отмечалось, что электроположительность элементов обычно уменьшается при перемещении вправо вдоль периода, но увеличивается при перемещении вниз по группе. Это приводит к возникновению так называемых диагональных соотношений в периодической таблице. Каждое диагональное соотношение связывает между собой пару элементов со сходными химическими свойствами. Важнейшими парами элементов, связанных между собой диагональными соотношениями, являются литий и магний, бериллий и алюминий, бор и кремний.
Наличие диагональных соотношений объясняется тем, что уменьшение электроположительности при перемещении к каждому следующему элементу вправо вдоль периода компенсируется возрастанием электроположительности при перемещении к следующему элементу вниз по группе. Более подробное рассмотрение диагональных соотношений проводится в гл. 13.
Аномалии
Головные элементы в главных подгруппах. Элементы 2-го периода, «возглавляющие» группы I-VII (главные подгруппы в короткопериодной форме периодической таблицы. — Перев.), иногда называют головными элементами. Они представляют интерес в связи с тем, что некоторые свойства этих элементов и их соединений значительно отличаются от аналогичных свойств, характерных для других элементов соответствующих групп. Эти аномальные свойства могут быть приписаны меньшему размеру атомов головных элементов и их более высоким электроотрицательности и энергии ионизации. Например, галогениды лития и бериллия обнаруживают более ковалентный характер, чем галогениды других металлов из соответствующих групп. Литий, в отличие от остальных щелочных металлов, не образует твердого гидрокарбоната. В то время, как нитраты других щелочных металлов разлагаются при нагревании с образованием соответствующих нитритов и кислорода, нитрат лития разлагается с образованием оксида лития, кислорода и диоксида азота. Наконец, в отличие от гидроксидов других щелочных металлов гидроксид лития термически неустойчив. Аномальные свойства лития и других головных элементов подробно обсуждаются в гл. 13, 14 и 16.
Литий, в отличие от остальных щелочных металлов, не образует твердого гидрокарбоната. В то время, как нитраты других щелочных металлов разлагаются при нагревании с образованием соответствующих нитритов и кислорода, нитрат лития разлагается с образованием оксида лития, кислорода и диоксида азота. Наконец, в отличие от гидроксидов других щелочных металлов гидроксид лития термически неустойчив. Аномальные свойства лития и других головных элементов подробно обсуждаются в гл. 13, 14 и 16.
Итак, повторим еще раз!
1. Элементы в современной периодической таблице располагаются в порядке возрастания их атомного номера.
2. Элементы одного периода имеют одинаковый электронный остов, с такой же конфигурацией, как у благородного газа, завершающего предыдущий период.
3. Элементы одной и той же группы имеют одинаковую внешнюю электронную конфигурацию.
4. Все -элементы (за исключением водорода и гелия), а также d- и -элементы принадлежат к металлам.
5. Водород и гелий относятся к неметаллам. Все остальные неметаллы принадлежат к р-элементам.
Все остальные неметаллы принадлежат к р-элементам.
6. При перемещении слева направо вдоль периода металлические свойства элементов ослабевают, а при перемещении сверху вниз вдоль группы металлические свойства элементов усиливаются.
7. Физические свойства элементов (температуры плавления и кипения, энтальпии плавления и испарения, плотность) при перемещении слева направо вдоль периода сначала возрастают, а затем, после достижения максимума в средней части периода, уменьшаются.
8. Атомные и ионные радиусы элементов при перемещении слева направо вдоль периода уменьшаются, а при перемещении сверху вниз вдоль группы возрастают.
9. Первая энергия ионизации элементов при перемещении слева направо вдоль периода увеличивается, а при перемещении сверху вниз вдоль группы уменьшается.
10. Электроотрицательность элементов в пределах каждого периода возрастает, достигая максимума у галогенов, а при перемещении сверху вниз по группе уменьшается.
11. Наиболее электроположительные, а следовательно, наиболее реакционноспособные
способные (активные) металлы располагаются в левом нижнем углу периодической таблицы.
12. Наиболее электроотрицательные элементы располагаются в правом верхнем углу периодической таблицы.
13. s-Элементы, как правило, обнаруживают валентности, совпадающие с номером их группы.
14. р-Элементы имеют главные валентности, равные номеру их группы, а также равные разности между числом 8 и номером их группы.
15. d-Элементы обнаруживают много разных валентностей и степеней окисления.
16. Восстановительные свойства элементов при перемещении сверху вниз вдоль группы ослабевают.
17. Реакционная способность элементов по отношению к кислороду уменьшается при перемещении сверху вниз вдоль группы.
18. Ионный характер оксидов при перемещении слева направо вдоль периода уменьшается, а ковалентный характер увеличивается.
19. Оксиды, гидриды, гидроксиды и галогениды элементов обнаруживают одинаковую периодичность в изменении свойств.
20. Литий и магний обладают сходными химическими свойствами и тем самым демонстрируют наличие между ними диагонального соотношения.
21. Головные элементы, возглавляющие главные группы, обладают аномальными свойствами по отношению к остальным элементам своих групп.
Подписаться на еженедельную рассылку izhneftyanic.ru
Задание 2 — Подготовка к ЕГЭ по химии
1. Неметаллические свойства наиболее выражены у
- кремния
- углерода
- кислорода
- фосфора
2. Легче всего присоединяет электроны атом
- серы
- хлора
- селена
- брома
3. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- C — B — Be
- P — S — Cl
- Si — Al — Mg
- F — O — N
4. Характер оксидов в ряду Li2O — BeO — B2O3 изменяется от
Характер оксидов в ряду Li2O — BeO — B2O3 изменяется от
- основного к кислотному
- основного к амфотерному
- амфотерного к кислотному
- кислотного к основному
5. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
- Li — Be — B — C
- P — S — Cl — Ar
- Sb — As — P — N
- F — Cl — Br — I
6. Кислотные свойства увеличиваются в ряду веществ
- HF, HCl, HBr
- H2S, HI, HF
- H2SO4, HNO3, H2CO3
- H2SO3, HCl, H2CO3
7. В ряду химических элементов Mg — Ca — Ba
В ряду химических элементов Mg — Ca — Ba
- уменьшается число энергетических уровней в атомах
- возрастает число внешних электронов атомов
- уменьшается число протонов в ядрах атомов
- увеличиваются радиусы атомов
8. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Se — S — O
- Cl — Br — I
- S — P — Si
- Al — Mg — Na
9. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
- азот
- кремний
- бром
- селен
10. В порядке возрастания неметаллических свойств элементы расположены в ряду
В порядке возрастания неметаллических свойств элементы расположены в ряду
- B — C — N — O
- Cl — S — P — Si
- O — S — Se — Tl
- N — P — As — Sb
11. Среди элементов VIА группы максимальный радиус атома имеет
- кислород
- сера
- теллур
- полоний
12. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Be — Mg — Ca
- C — Si — Ge
- As — P — N
- F — Cl — Br
13. У какого элемента наиболее выражены неметаллические свойства
У какого элемента наиболее выражены неметаллические свойства
- фтор
- кислород
- кремний
- йод
14. Наибольший радиус имеет атом
- лития
- натрия
- калия
- рубидия
15. Неметаллические свойства элементов усиливаются в ряду
- Cl — S — P — Si
- N — P — As — Se
- B — C — N — O
- C — Si — P — N
16. В порядке усиления неметаллических свойств элементы расположены в ряду
- F — Cl — Br
- Se — S — O
- O — N — C
- P — Si — Al
17. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса
В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса
- Li — Na — K — Rb
- Sr — Ca — Mg — Be
- In — Ga — Al — B
- Sn — Ge — Si — C
18. Кислотные свойства водородных соединений усиливаются в ряду
- HF — HCl — HBr — HI
- HI — HBr — HCl — HF
- HF — H2O — NH3 — CH4
- HCl — H2S — PH3 — SiH4
19. Высший оксид состава ЭО2 образуют все элементы
- 4 периода
- IIA группы
- IVA группы
- 2 периода
20. В порядке возрастания неметаллических свойств элементы расположены в ряду
В порядке возрастания неметаллических свойств элементы расположены в ряду
- B — C — O — F
- Cl — S — P — Si
- C — Si — Ge — Sn
- O — N — C — B
21. В каком ряду химические элементы расположены в порядке уменьшения их атомного радиуса?
- Be — Mg — Ca
- C — Si — Ge
- As — P — N
- F — Cl — Br
22. Неметаллические свойства наиболее выражены у
- кремния
- углерода
- кислорода
- фосфора
23. Характер оксидов в ряду Na2O — MgO — Al2O3 изменяется от
Характер оксидов в ряду Na2O — MgO — Al2O3 изменяется от
- основного к кислотному
- основного к амфотерному
- амфотерного к кислотному
- кислотного к основному
24. В порядке возрастания неметаллических свойств элементы расположены в ряду
- Be — B — C
- P — Si — Al
- F — Cl — Br
- F — O — N
25. Кислотные свойства водородных соединений усиливаются в ряду
- HF — HCl — HBr — HI
- HI — HBr — HCl — HF
- HF — H2O — NH3 — CH4
- HCl — H2S — PH3 — SiH4
26. Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
Одинаковое значение валентности в водородном соединении и высшем оксиде имеет элемент
- хлор
- германий
- мышьяк
- селен
27. Кислотные свойства высших оксидов усиливаются в ряду
- GeO2 — SiO2 — CO2
- Cl2O7 — SO3 — P2O5
- N2O5 — CO2 — B2O3
- Cl2O7 — Br2O7 — I2O7
28. В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса?
- Be — Mg — Ca
- Rb — K — Na
- Al — Si — P
- Br — Cl — F
29. В ряду химических элементов Mg — Ca — Ba
В ряду химических элементов Mg — Ca — Ba
- уменьшается число энергетических уровней в атомах
- возрастает число внешних электронов атомов
- уменьшается число протонов в ядрах атомов
- увеличиваются радиусы атомов
30. В каком ряду химические элементы расположены в порядке возрастания их электроотрицательности
- B — C — N
- Be — Mg — Ca
- Cl — Br — I
- S — P — Si
| Азот радиус атома азота | 56 · 10 − 12 (Метр) |
| Алюминий радиус атома алюминия | 118 · 10 − 12 (Метр) |
| Аргон радиус атома аргона | 71 · 10 − 12 (Метр) |
| Астатин радиус атома астатина | 127 · 10 − 12 (Метр) |
| Барий радиус атома бария | 253 · 10 − 12 (Метр) |
| Бериллий радиус атома бериллия | 112 · 10 − 12 (Метр) |
| Бор радиус атома бора | 87 · 10 − 12 (Метр) |
| Бром радиус атома брома | 94 · 10 − 12 (Метр) |
| Ванадий радиус атома ванадия | 171 · 10 − 12 (Метр) |
| Висмут радиус атома висмута | 143 · 10 − 12 (Метр) |
| Водород радиус атома водорода | 53 · 10 − 12 (Метр) |
| Вольфрам радиус атома вольфрама | 193 · 10 − 12 (Метр) |
| Гадолиний радиус атома гадолиния | 233 · 10 − 12 (Метр) |
| Галлий радиус атома галлия | 136 · 10 − 12 (Метр) |
| Гафний радиус атома гафния | 208 · 10 − 12 (Метр) |
| Гелий радиус атома гелия | 31 · 10 − 12 (Метр) |
| Германий радиус атома германия | 125 · 10 − 12 (Метр) |
| Гольмий радиус атома гольмия | 226 · 10 − 12 (Метр) |
| Диспрозий радиус атома диспрозия | 228 · 10 − 12 (Метр) |
| Европий радиус атома европия | 231 · 10 − 12 (Метр) |
| Железо радиус атома железа | 156 · 10 − 12 (Метр) |
| Золото радиус атома золота | 174 · 10 − 12 (Метр) |
| Индий радиус атома индия | 156 · 10 − 12 (Метр) |
| Иридий радиус атома иридия | 180 · 10 − 12 (Метр) |
| Иттербий радиус атома иттербия | 222 · 10 − 12 (Метр) |
| Иттрий радиус атома иттрия | 212 · 10 − 12 (Метр) |
| Йод радиус атома йода | 115 · 10 − 12 (Метр) |
| Кадмий радиус атома кадмия | 161 · 10 − 12 (Метр) |
| Калий радиус атома калия | 243 · 10 − 12 (Метр) |
| Кальций радиус атома кальция | 194 · 10 − 12 (Метр) |
| Кислород радиус атома кислорода | 48 · 10 − 12 (Метр) |
| Кобальт радиус атома кобальта | 152 · 10 − 12 (Метр) |
| Кремний радиус атома кремния | 111 · 10 − 12 (Метр) |
| Криптон радиус атома криптона | 88 · 10 − 12 (Метр) |
| Ксенон радиус атома ксенона | 108 · 10 − 12 (Метр) |
| Литий радиус атома лития | 167 · 10 − 12 (Метр) |
| Лютеций радиус атома лютеция | 217 · 10 − 12 (Метр) |
| Магний радиус атома магния | 145 · 10 − 12 (Метр) |
| Марганец радиус атома марганца | 161 · 10 − 12 (Метр) |
| Медь радиус атома меди | 145 · 10 − 12 (Метр) |
| Молибден радиус атома молибдена | 190 · 10 − 12 (Метр) |
| Мышьяк радиус атома мышьяка | 114 · 10 − 12 (Метр) |
| Натрий радиус атома натрия | 190 · 10 − 12 (Метр) |
| Неодим радиус атома неодима | 206 · 10 − 12 (Метр) |
| Неон радиус атома неона | 38 · 10 − 12 (Метр) |
| Никель радиус атома никеля | 149 · 10 − 12 (Метр) |
| Ниобий радиус атома ниобия | 198 · 10 − 12 (Метр) |
| Олово радиус атома олова | 145 · 10 − 12 (Метр) |
| Осмий радиус атома осмия | 185 · 10 − 12 (Метр) |
| Палладий радиус атома палладия | 169 · 10 − 12 (Метр) |
| Платина радиус атома платины | 177 · 10 − 12 (Метр) |
| Полоний радиус атома полония | 135 · 10 − 12 (Метр) |
| Празеодим радиус атома празеодима | 247 · 10 − 12 (Метр) |
| Прометий радиус атома прометия | 205 · 10 − 12 (Метр) |
| Радон радиус атома радона | 120 · 10 − 12 (Метр) |
| Рений радиус атома рения | 188 · 10 − 12 (Метр) |
| Родий радиус атома родия | 173 · 10 − 12 (Метр) |
| Ртуть радиус атома ртути | 171 · 10 − 12 (Метр) |
| Рубидий радиус атома рубидия | 265 · 10 − 12 (Метр) |
| Рутений радиус атома рутения | 178 · 10 − 12 (Метр) |
| Самарий радиус атома самария | 238 · 10 − 12 (Метр) |
| Свинец радиус атома свинца | 154 · 10 − 12 (Метр) |
| Селен радиус атома селена | 103 · 10 − 12 (Метр) |
| Сера радиус атома серы | 88 · 10 − 12 (Метр) |
| Серебро радиус атома серебра | 165 · 10 − 12 (Метр) |
| Скандий радиус атома скандия | 184 · 10 − 12 (Метр) |
| Стронций радиус атома стронция | 219 · 10 − 12 (Метр) |
| Сурьма радиус атома сурьмы | 133 · 10 − 12 (Метр) |
| Таллий радиус атома таллия | 156 · 10 − 12 (Метр) |
| Тантал радиус атома тантала | 200 · 10 − 12 (Метр) |
| Теллур радиус атома теллура | 123 · 10 − 12 (Метр) |
| Тербий радиус атома тербия | 225 · 10 − 12 (Метр) |
| Технеций радиус атома технеция | 183 · 10 − 12 (Метр) |
| Титан радиус атома титана | 176 · 10 − 12 (Метр) |
| Тулий радиус атома тулия | 222 · 10 − 12 (Метр) |
| Углерод радиус атома углерода | 67 · 10 − 12 (Метр) |
| Фосфор радиус атома фосфора | 98 · 10 − 12 (Метр) |
| Фтор радиус атома фтора | 42 · 10 − 12 (Метр) |
| Хлор радиус атома хлора | 79 · 10 − 12 (Метр) |
| Хром радиус атома хрома | 166 · 10 − 12 (Метр) |
| Цезий радиус атома цезия | 298 · 10 − 12 (Метр) |
| Цинк радиус атома цинка | 142 · 10 − 12 (Метр) |
| Цирконий радиус атома циркония | 206 · 10 − 12 (Метр) |
| Эрбий радиус атома эрбия | 226 · 10 − 12 (Метр) |
Частей Периодической таблицы
Данные взяты из Джона Эмсли, The Elements , 3-е издание.
.Оксфорд: Clarendon Press, 1998.
Атомный радиус — это расстояние от ядра атом к крайние электроны. Поскольку орбитали вокруг атома равны определяется в терминах распределения вероятностей в квантовой механике, и не имеют фиксированные границы, определить, где «останавливается» атом, не так просто. Путем сравнения длин связей количество репрезентативных соединений элемента, средний размер для большинства атомов можно определить.
Атомный радиус можно определить и другими способами. Радиус Ван-дер-Ваальса (также известный как несвязывающий атомный радиус ) является
радиус атома, который не связан с другими атомами; это
определяется путем измерения расстояния между атомными ядрами, которые
в прямом, но не связывающем контакте друг с другом в кристалле
решетка.Ковалентный атомный радиус (также известный как атомный радиус связи ) для металлов определяется
половина расстояния между двумя соседними атомами в металлическом
кристалл, или половина расстояния между одинаково связанными атомами для
неметаллы.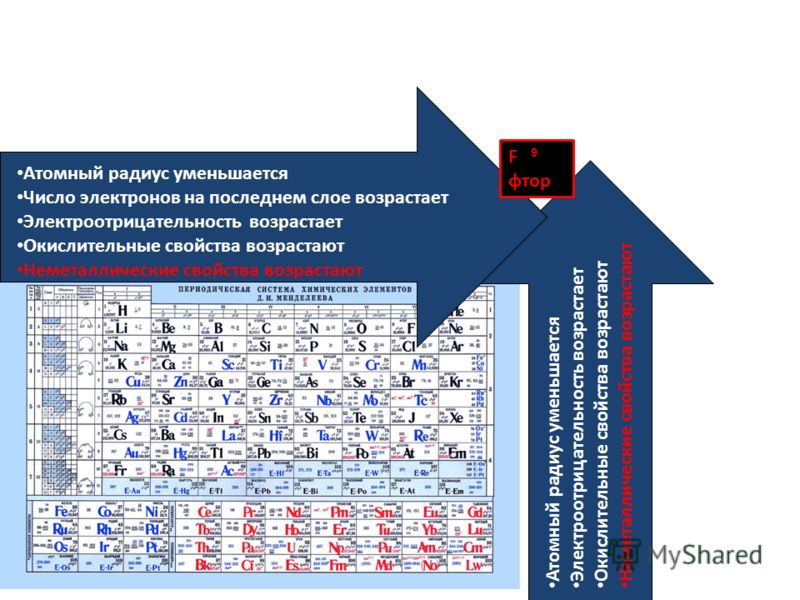
К сожалению, определить радиус для каждый элемент периодической таблицы одинаков, и следовательно, иногда бывает трудно сравнивать разные наборы данных.В таблице выше большинство атомных Указанные радиусы являются средними атомными радиусами, а для галогенов (Группа 7A) и благородных газов (группа 8A) используется ковалентный радиус.
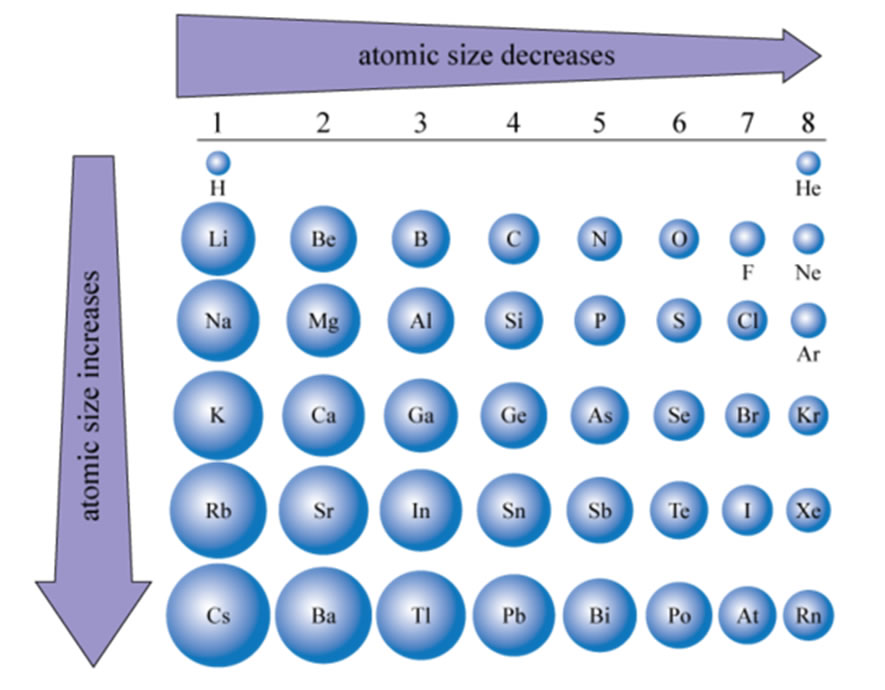
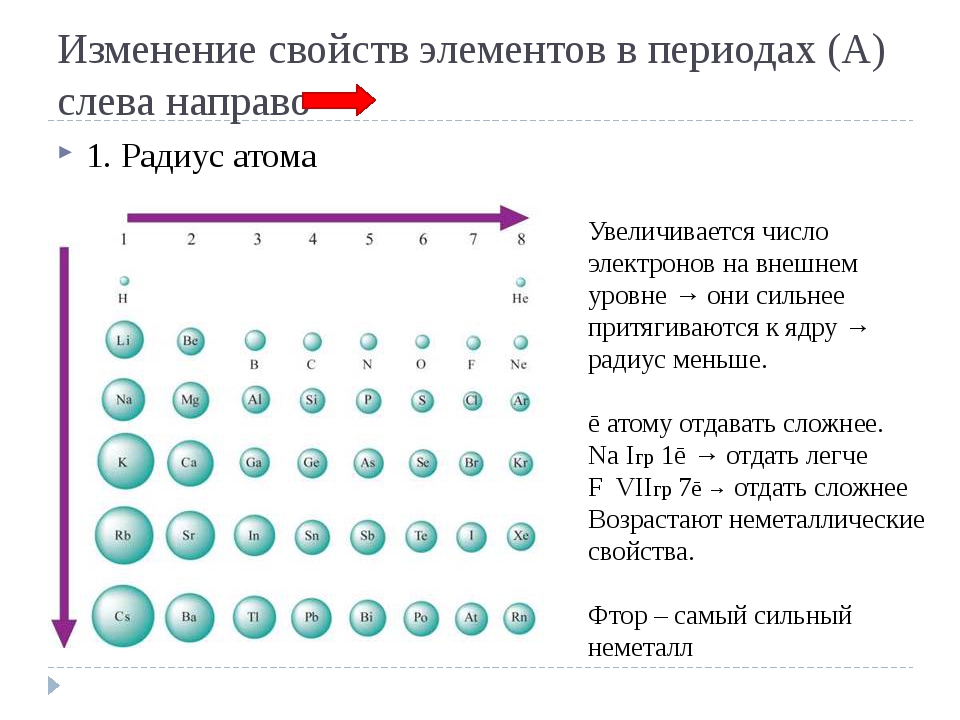
Радиусы атомов в периодической таблице изменяются предсказуемым образом. Как видно на рисунках ниже, атомный радиус увеличивается. сверху вниз в группе , а убывает слева направо прямо через период .Таким образом, гелий — наименьший элемент, а франций — самый крупный.
- Сверху вниз в группе, орбитали, соответствующие
более высокие значения главного квантового числа ( n )
добавлены, которые в среднем находятся дальше от ядра, таким образом
заставляя размер атома увеличиваться.

- Слева направо в течение периода больше протонов добавляются к ядру, но добавляемые электроны добавляются к валентной оболочке, а не к нижнему уровни энергии.По мере того, как к ядру добавляется больше протонов, электроны в валентной оболочке ощущают более высокую эффективность . ядерный заряд — сумма зарядов на протонах в ядро и заряды на внутренних, остовных электронах. (См. Рисунок ниже.) Таким образом, валентные электроны удерживаются более плотно, и размер атома сокращается через период.
На следующих диаграммах показаны общие тенденции радиусов атомов:
Trends in Atomic Radius Chemistry Tutorial
Ключевые понятия
В целом для элементов основной группы периодической таблицы Менделеева:
- Атомный радиус 1 увеличивается вниз по группе сверху вниз Периодической таблицы.
- Атомный радиус уменьшается в течение периода слева направо Периодической таблицы.
 2 .
2 .
| Радиус атома | уменьшается через период слева направо | |||||||||
| наибольший | → | → | → | → | → | наименьший | ||||
| атомный радиус увеличивается вниз на группа от сверху вниз | наименьший | Li | Be | B | С | N | O | F | Ne | |
| ↓ | Na | мг | Al | Si | -P | S | Класс | Ar | ||
| ↓ | К | Ca | Ga | Ge | как | SE | руб. | Кр | ||
| ↓ | руб. | Sr | В | Sn | Сб | Te | I | Xe | ||
| наибольший | CS | Ba | Tl | Пб | Bi | Po | при | Rn | ||
Обратите внимание на тенденции для ионных радиусов:
- Ионный радиус катиона меньше атомного радиуса атома
- ионный радиус аниона больше атомного радиуса атома
- ионных радиусов катионов группы 1 увеличивается вниз по группе
- ионных радиусов анионов 17 группы увеличивается вниз по группе
Пожалуйста, не блокируйте рекламу на этом сайте.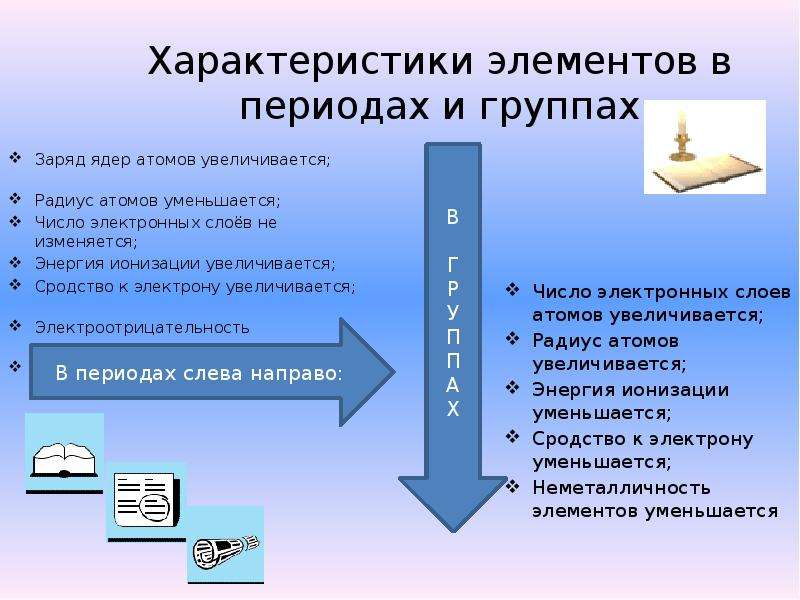
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Тенденции изменения атомных радиусов в группах периодической таблицы
По мере того, как вы спускаетесь по группе в Периодической таблице сверху вниз, количество энергетических уровней или электронных оболочек увеличивается, так что атомный радиус элементов увеличивается.
Сравните количество занятых энергетических уровней (электронных оболочек) и радиус атома элементов в Группе 1 и Группе 17, как указано в каждом разделе ниже:
(A) Тенденции изменения атомного радиуса элементов группы 1 (IA, щелочные металлы)
Используйте данные в таблице ниже для элементов Группы 1, чтобы найти закономерность (или тенденцию) в
- количество занятых энергетических уровней (электронных оболочек)
- атомных радиусов элементов
| Элемент | Атомный номер Номер (Z) | Символ | Простой Электронный Конфигурация | №Уровни энергии (электронные оболочки) | Atomic Радиус (пм) 3 | Тренд |
|---|---|---|---|---|---|---|
| литий | 3 | Li | 2,1 | 2 | 134 | самый маленький | |
| натрий | 11 | Na | 2,8,1 | 3 | 154 | ↓ |
| калий | 19 | К | 2,8,8,1 | 4 | 196 | ↓ |
| рубидий | 37 | руб. | 2,8,18,8,1 | 5 | 211 | ↓ |
| цезий | 55 | CS | 2,8,18,18,8,1 | 6 | 225 | ↓ наибольший |
При спуске по Группе 1:
- количество занятых энергетических уровней (или оболочек электронов) увеличивается с 2 до 6
- радиус атома элемента увеличивается со 134 пм до 225 пм.
Атомный радиус увеличивается по мере того, как вы спускаетесь по элементам Группы 1 сверху вниз, поскольку к каждому последующему элементу добавляется дополнительный энергетический уровень (электронная оболочка).
(B) Тенденции изменения атомного радиуса элементов группы 17 (VIIA, галогены)
Используйте данные в таблице ниже для элементов Группы 17, чтобы найти закономерность (или тенденцию) в
- количество занятых энергетических уровней (электронных оболочек)
- атомных радиусов элементов
| Элемент | Атомный номер Номер (Z) | Символ | Простая электронная конфигурация | №Уровни энергии (электронные оболочки) | Атомный радиус (пм) | Тренд |
|---|---|---|---|---|---|---|
| фтор | 9 | F | 2,7 | 2 | 71 | (наименьший) ↓ |
| хлор | 17 | Класс | 2,8,7 | 3 | 99 | ↓ |
| бром | 35 | руб. | 2,8,18,7 | 4 | 114 | ↓ |
| йод | 53 | I | 2,8,18,18,7 | 5 | 133 | ↓ (самый большой) |
По мере продвижения вниз Группа 17:
- количество занятых энергетических уровней (или оболочек электронов) увеличивается с 2 до 5
- радиус атома элемента увеличивается с 71 пм до 133 пм.
Атомный радиус увеличивается по мере того, как вы спускаетесь по элементам Группы 17 сверху вниз, поскольку к каждому последующему элементу добавляется дополнительный уровень энергии (электронная оболочка).
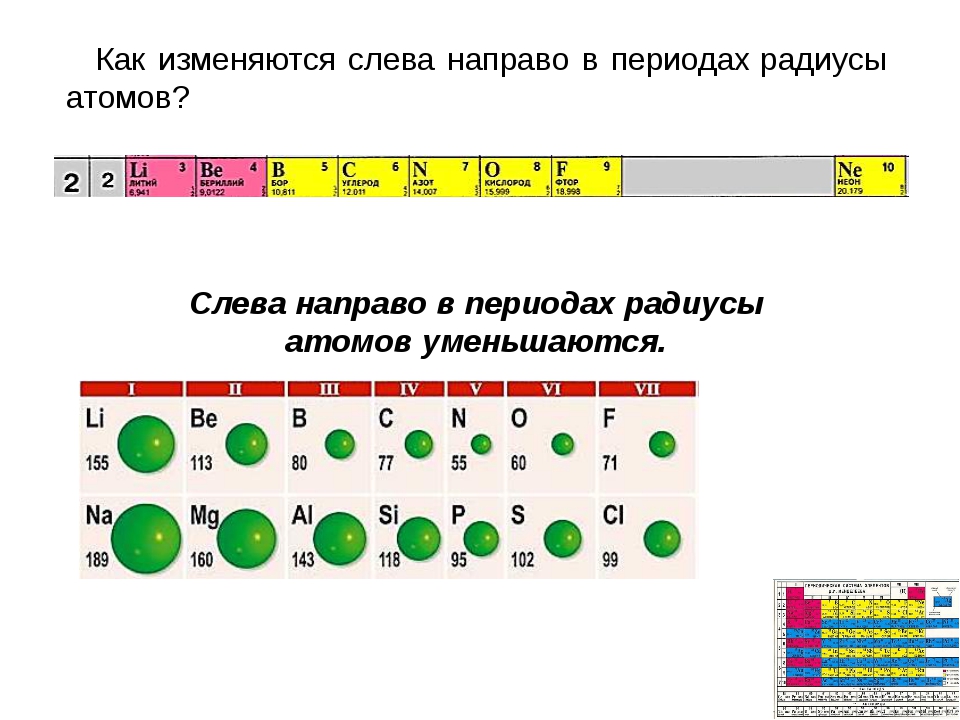
Тенденции изменения радиуса атома в периоды Периодической таблицы
В общем, атомный радиус элементов уменьшается по мере прохождения периода слева направо.
Когда мы проходим период слева направо, электроны добавляются к одному и тому же энергетическому уровню, валентной оболочке.
Увеличенный заряд ядра из-за положительно заряженных протонов сильнее притягивает все отрицательно заряженные электроны, поэтому все электроны притягиваются ближе к ядру, другими словами, радиус каждого следующего атома становится меньше в течение определенного периода времени. Периодическая таблица.
В следующих разделах мы рассмотрим тенденции изменения атомного радиуса элементов периода 2 и элементов периода 3.
(A) Тенденции изменения атомного радиуса элементов за период 2
Используйте данные, приведенные в таблице ниже, чтобы найти закономерности (тенденции) в
- количество занятых энергетических уровней (электронных оболочек)
- заряд на ядре (ядерный заряд)
- атомных радиусов элементов
| Элемент | Li | Be | B | С | N | O | F | Ne |
|---|---|---|---|---|---|---|---|---|
| Простая электронная конфигурация | 2,1 | 2,2 | 2,3 | 2,4 | 2,5 | 2,6 | 2,7 | 2,8 |
| Заполняемый уровень энергии (Валентная оболочка) | второй (L) | второй (L) | второй (L) | второй (L) | второй (L) | второй (L) | второй (L) | второй (L) |
| Ядерный заряд (заряд на всех протонах) | 3+ | 4+ | 5+ | 6+ | 7+ | 8+ | 9+ | 10+ |
| Атомный радиус (пм) | 134 | 90 | 82 | 77 | 75 | 73 | 71 | 69 |
| General Trend | (наибольший) | → | → | → | → | → | → | (наименьший) |
Вы видите эти закономерности (тенденции):
- количество занятых энергетических уровней (электронных оболочек) остается неизменным (2 занятые электронные оболочки) на протяжении всего периода
- заряд ядра (ядерный заряд) увеличивается с +3 до +10 в период слева направо Атомный радиус
- элементов уменьшается с 134 пм до 69 пм по периоду слева направо.

Атомный радиус обычно уменьшается в периоде 2 слева направо по мере увеличения заряда ядра.
(B) Тенденции изменения атомного радиуса элементов за период 3
Используйте данные, приведенные в таблице ниже, чтобы найти закономерности (тенденции) в
- количество занятых энергетических уровней (электронных оболочек)
- заряд на ядре (ядерный заряд)
- атомных радиусов элементов
| Элемент | Na | мг | Al | Si | -P | S | Класс | Ar |
|---|---|---|---|---|---|---|---|---|
| Простая электронная конфигурация | 2,8,1 | 2,8,2 | 2,8,3 | 2,8,4 | 2,8,5 | 2,8,6 | 2,8,7 | 2,8,8 |
| Заполняемый уровень энергии (Валентная оболочка) | третья (М) | третья (М) | третья (М) | третья (М) | третья (М) | третья (М) | третья (М) | третья (М) |
| Ядерный заряд (заряд на всех протонах) | 11+ | 12+ | 13+ | 14+ | 15+ | 16+ | 17+ | 18+ |
| Атомный радиус (пм) | 154 | 130 | 118 | 111 | 106 | 102 | 99 | 97 |
| General Trend | (наибольший) | → | → | → | → | → | → | (наименьший) |
Вы видите эти закономерности (тенденции):
- количество занятых энергетических уровней (электронных оболочек) остается неизменным (3 занятые электронные оболочки) на протяжении всего периода
- заряд ядра (ядерный заряд) увеличивается с +11 до +18 в период слева направо Атомный радиус
- элементов уменьшается с 154 до 97 пм в период слева направо.

Атомный радиус обычно уменьшается в периоде 3 слева направо по мере увеличения заряда ядра.
Ионный радиус
- Катионы меньше, чем их соответствующие атомы, поскольку электроны удаляются с самого высокого энергетического уровня (валентной оболочки), в то время как положительный заряд ядра остается неизменным, тем самым увеличивая притяжение между оставшимися электронами и ядром, что приводит к уменьшению размера радиус катиона.
- Анионы больше, чем их соответствующие атомы, поскольку электроны добавляются к самому высокому энергетическому уровню (валентной оболочке), отталкивание между отрицательно заряженными электронами увеличивает ионный радиус.
- Вниз по группе периодической таблицы сверху вниз, по сравнению с ионами с одинаковым зарядом, ионный радиус увеличивается по мере увеличения числа завершенных энергетических уровней.
Давайте сравним радиус атомов некоторых элементов с соответствующими ионами.
Элементы группы 1 образуют катионы с зарядом +1
Элементы группы 17 образуют анионы с зарядом -1
(A) Сравнение атомного и ионного радиусов элементов группы 1 (IA, щелочные металлы)
Атомы элементов группы 1 (M) теряют 1 электрон (e — ) из своей валентной оболочки электронов с образованием катиона с зарядом +1 (M + )
Мы можем написать химическое уравнение, чтобы представить это для любого элемента группы 1 (M), как показано ниже.
| атом | → | катион | + | электрон |
| M | → | М + | + | e — |
Мы можем написать конкретное уравнение для представления образования каждого катиона каждого элемента группы 1, как показано ниже:
| атом | → | катион | + | электрон |
| Li | → | Li + | + | e — |
| Na | → | Na + | + | e — |
| К | → | К + | + | e — |
| руб. | → | руб. + | + | e — |
| CS | → | CS + | + | e — |
Учитывайте данные в таблице ниже.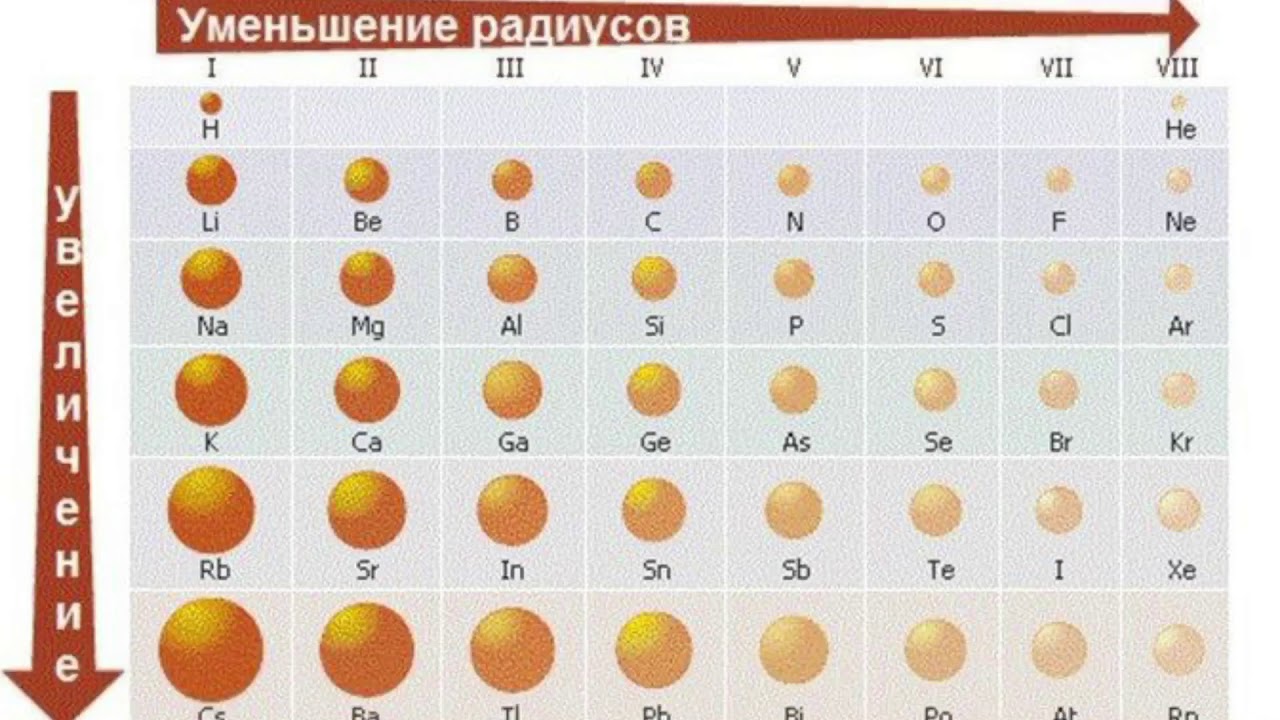 Вы видите какие-либо закономерности (или тенденции) в данных?
Вы видите какие-либо закономерности (или тенденции) в данных?
Сравните каждый атом и соответствующий ему катион в отношении:
- атомный и катионный радиус
- количество занятых энергетических уровней (электронных оболочек)
| Элемент | Символ атома | Простая конфигурация атомов Электрон | Atomic Радиус (пм) | Символ Иона | Ion’s Simple Electron Configuration | Ионный Радиус 4 (пм) | Тренд |
|---|---|---|---|---|---|---|---|
| литий | Li | 2,1 | 134 | Li + | 2 | 74 | наименьшее ↓ |
| натрий | Na | 2,8,1 | 154 | Na + | 2,8 | 102 | ↓ |
| калий | К | 2,8,8,1 | 196 | К + | 2,8,8 | 138 | ↓ |
| рубидий | руб. | 2,8,18,8,1 | 211 | руб. + | 2,8,18,8 | 149 | ↓ |
| цезий | CS | 2,8,18,18,8,1 | 225 | CS + | 2,8,18,18,8 | 170 | ↓ наибольший |
Вы заметили, что:
- катионный радиус элемента всегда меньше его атомного радиуса?
(а) ионный радиус Li + (74) <атомный радиус Li (134)
(б) ионный радиус Na + (102) <атомный радиус Na (154)
(c) ионный радиус K + (138) <атомный радиус K (196)
(d) ионный радиус Rb + (149) <атомный радиус Rb (211)
(e) ионный радиус Cs + (170) <атомный радиус Cs (225) - у катиона на 1 меньше занятых энергетических уровней (электронных оболочек)?
(a) В Li занято 2 электронные оболочки, в Li + занято 2-1 = 1 электронная оболочка.

(b) Na имеет 3 занятые электронные оболочки, Na + имеет 3 — 1 = 2 электронные оболочки.
(c) В K занято 4 электронных оболочки, в K + занято 4-1 = 3 электронных оболочки
(d) В Rb занято 5 электронных оболочек, в Rb + занято 5-1 = 4 электронных оболочки.
(e) В Cs занято 6 электронных оболочек, в Li + занято 6-1 = 5 электронных оболочек.
По мере того, как вы спускаетесь по группе сверху вниз, ионный радиус каждого катиона увеличивается, так же как и радиус каждого атома, потому что уровень энергии (электронная оболочка) добавляется к каждому последующему атому (или иону) .
Однако, если электрон удаляется из атома Группы 1, он удаляется с самого высокого энергетического уровня (валентной оболочки), так что это эффективно уменьшает количество занятых энергетических уровней (или электронных оболочек).
Тот же самый положительный заряд ядра теперь действует на меньшее количество отрицательно заряженных электронов, поэтому эти электроны притягиваются ближе к ядру, а радиус катиона будет меньше, чем радиус атома.
(B) Сравнение атомного и ионного радиусов элементов группы 17 (VIIA, галоген)
1 электрон (e — ) может быть добавлен к валентной оболочке атомов элементов группы 17 с образованием аниона с зарядом -1 (X — )
Мы можем написать химическое уравнение, чтобы представить это для любого элемента группы 17 (X), как показано ниже.
| атом | + | электрон | → | анион |
| х | + | e — | → | Х — |
Мы можем написать конкретное уравнение, чтобы представить образование каждого аниона каждого элемента группы 17, как показано ниже:
| атом | + | электрон | → | анион |
| Ф | + | e — | → | Ф — |
| Класс | + | e — | → | Класс — |
| Br | + | e — | → | рублей – |
| I | + | e — | → | I — |
Учитывайте данные в таблице ниже.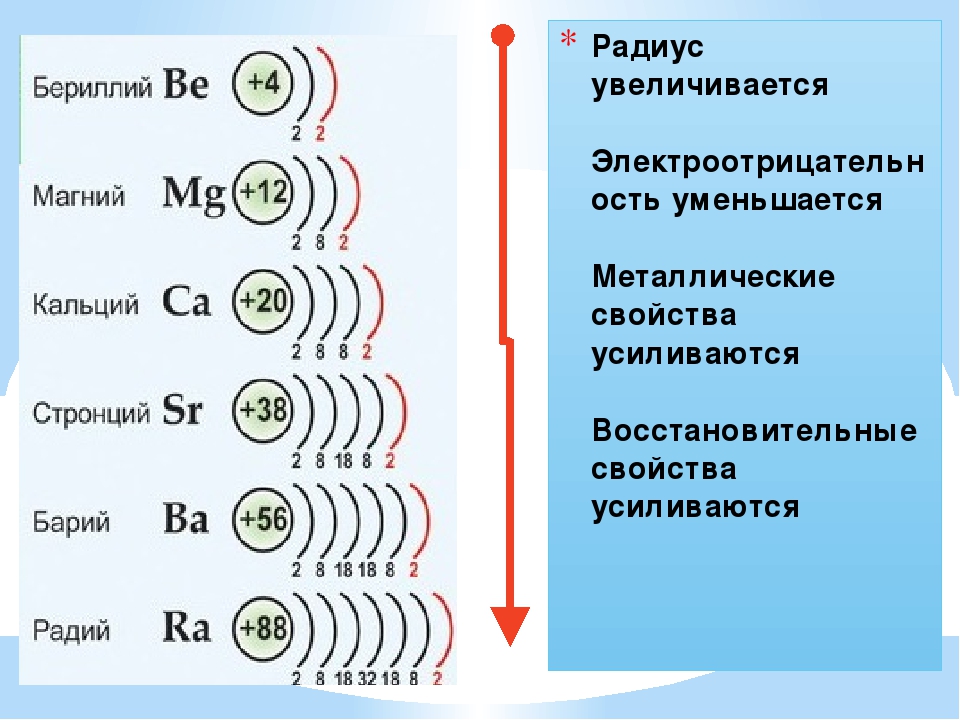 Вы видите какие-либо закономерности (или тенденции) в данных?
Вы видите какие-либо закономерности (или тенденции) в данных?
Сравните каждый атом и соответствующий ему анион в отношении:
- атомный и анионный радиус
- количество занятых энергетических уровней (электронных оболочек)
| Элемент | Символ атома | Простая электронная конфигурация атома | Атомный радиус (пм) | Символ Иона | Простая электронная конфигурация Иона | Ионный радиус (пм) | Тренд |
|---|---|---|---|---|---|---|---|
| фтор | F | 2,7 | 71 | Ф — | 2,8 | 131 | (наименьший) ↓ |
| хлор | Класс | 2,8,7 | 99 | Класс — | 2,8,8 | 181 | ↓ |
| бром | руб. | 2,8,18,7 | 114 | рублей – | 2,8,18,8 | 196 | ↓ |
| йод | I | 2,8,18,18,7 | 133 | I — | 2,8,18,18,8 | 220 | ↓ (самый большой) |
Вы заметили, что:
- радиус аниона всегда больше радиуса атома?
(a) радиус F — (131)> радиус F (71)
(b) радиус Cl — (181)> радиус Cl (99)
(c) радиус Br — (196)> радиус Br (114)
(d) радиус I — (220)> радиус I (133) - каждый электрон прибавляется к одному и тому же энергетическому уровню (электронной оболочке)?
(а) количество занятых электронных оболочек F = количество занятых электронных оболочек F — = 2
(б) количество занятых электронных оболочек Cl = количество занятых электронных оболочек Cl — = 3
(в) количество занятых электронных оболочек Br = количество занятых электронных оболочек Br — = 4
(d) количество занятых электронных оболочек I = количество занятых электронных оболочек I — = 5
Ионный радиус увеличивается по мере того, как вы спускаетесь по элементам Группы 17 сверху вниз, поскольку к каждому последующему элементу добавляется дополнительный энергетический уровень (электронная оболочка), как и для нейтрального атома.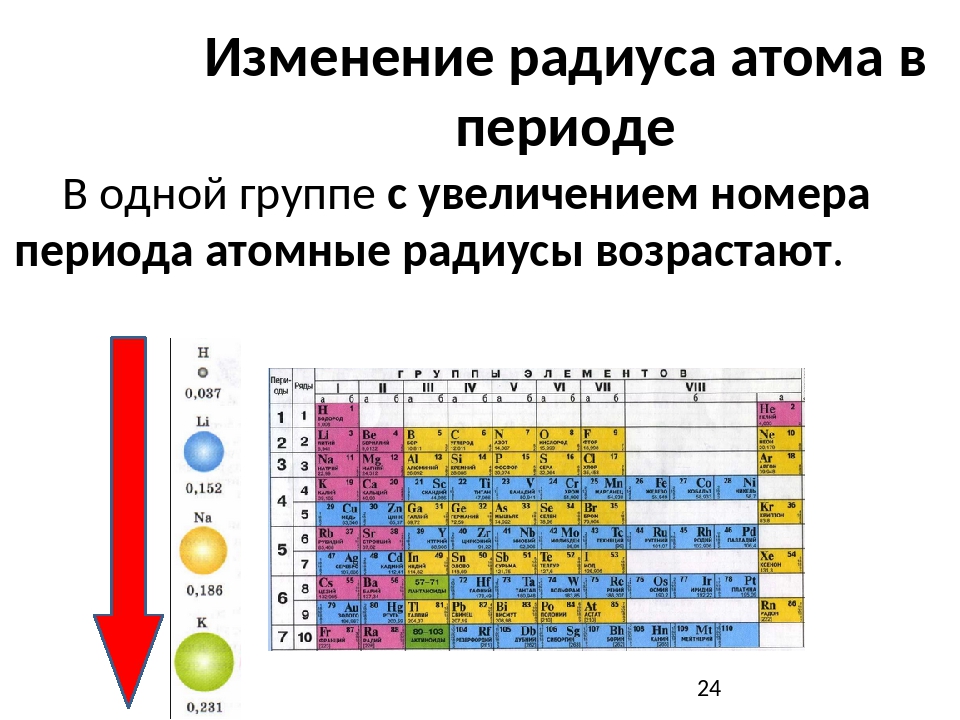
Но что вызывает расширение радиуса, когда к валентной оболочке исходного атома добавляется электрон?
Заряд ядра атома, обусловленный количеством положительно заряженных протонов в ядре, не изменяется, когда электрон присоединяется к электронной оболочке.
Но количество отрицательно заряженных электронов в этой электронной оболочке действительно меняется!
А это значит, что между всеми электронами больше отталкивания.
Эффект отталкивания электронов заключается в увеличении радиуса аниона по сравнению с нейтральным атомом.
| Вопрос: Студенту были вручены 3 баночки с образцами, помеченные X, Y и Z.
Определите название элемента в сосуде для образцов Y. |
| СТОП | СТОП! Задайте вопрос. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Что вас просят сделать? Элемент имени Y | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ПАУЗА | ПАУЗА для подготовки плана игры | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| (1) Какую информацию (данные) вы указали в вопросе? (а) Название трех элементов: свинец, олово, кремний. (b) Атомный радиус трех элементов: радиус (X) = 180 пм (2) Какая связь между тем, что вы знаете, и тем, что вам нужно выяснить? (а) атомный радиус увеличивается вниз по группе периодической таблицы сверху вниз (b) атомный радиус уменьшается в период периодической таблицы слева направо. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ГО | GO с планом игры | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(i) свинец, олово и кремний находятся ниже в той же группе периодической таблицы (группа 14).
(ii) атомный радиус увеличивается вниз по группе сверху вниз, поэтому напишите названия элементов в порядке увеличения атомного радиуса:
(iii) Поместите значения атомных радиусов, указанные в вопросе, в таблицу (от наименьшего к наибольшему значению):
(iv) Правильно расположите X, Y и Z в таблице рядом с их соответствующими атомными радиусами:
Элемент Y кремний. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ПАУЗА | ПАУЗА для обдумывания правдоподобия | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Правдоподобен ли ваш ответ? Начните с элементов X, Y и Z и разместите их в порядке увеличения атомного радиуса:
Затем решите, принадлежат ли элементы свинец, олово и кремний к одной группе или периоду периодической таблицы.
Элемент Y кремний. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СТОП | СТОП! Укажите решение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Элемент Y кремний. |
Сноски
1. Приведенные здесь значения радиусов атомов являются приближенными, полученными из измерений межатомных расстояний.
Есть несколько разных подходов к измерению атомных и ионных радиусов. Мы не собираемся обсуждать какие-либо из них, мы просто воспользуемся некоторыми хорошими приближениями, чтобы проиллюстрировать некоторые общие тенденции.
2. Мы будем исключать переходные металлы, лантаноиды (лантаноиды) и актиноиды (актиниды) из обсуждения.
3. Обычными единицами измерения атомных радиусов являются пикометр (как здесь используется), нанометр и ангстрем.
1 пм = 1 пикометр = 10 -12 метр
1 Å = 1 ангстрем = 10 -10 метр
1 нм = 1 нанометр = 10 -9 метр
Пример преобразования атомного радиуса лития,
134 пм = 134 × 10 -12 м = 0,134 × 10 -9 м = 0,134 нм
134 пм = 134 × 10 -12 м = 1,34 × 10 -10 м = 1,34 Å
4. Ионный радиус на основе координационного числа 6
Ионный радиус на основе координационного числа 6
Группа 6 элементов, электронная конфигурация
Нижеследующее содержание является сутью 26-й лекции по общей химии.К какой группе принадлежит этот элемент? Электронная конфигурация элемента «X» — 2,8,6. A) Верно B) Неверный ответ: Сложность: Легко 72. Группа 7A: Элементы бурно соединяются с щелочными металлами с образованием солей, называемых галогенами, что означает «образование солей»… Группа 5A: Все элементы образуют соединение кислорода или серы с E 2 Формулы O 3 или E 2 S 3 Группа 6A: Включает кислород, один из самых распространенных элементов. В США ион трехвалентного хрома считается важным питательным веществом для человека, отвечающим за метаболизм инсулина, сахара и липидов.В этой лекции мы продолжаем обсуждение квантовых чисел и их использования в электронных конфигурациях, а также связи электронной конфигурации с периодическими свойствами элементов. (i) Из приведенной выше электронной конфигурации мы находим, что элемент X имеет 6 валентных электронов в самой внешней оболочке), поэтому номер группы элемента X в периодической таблице составляет 6 + 10 = 16.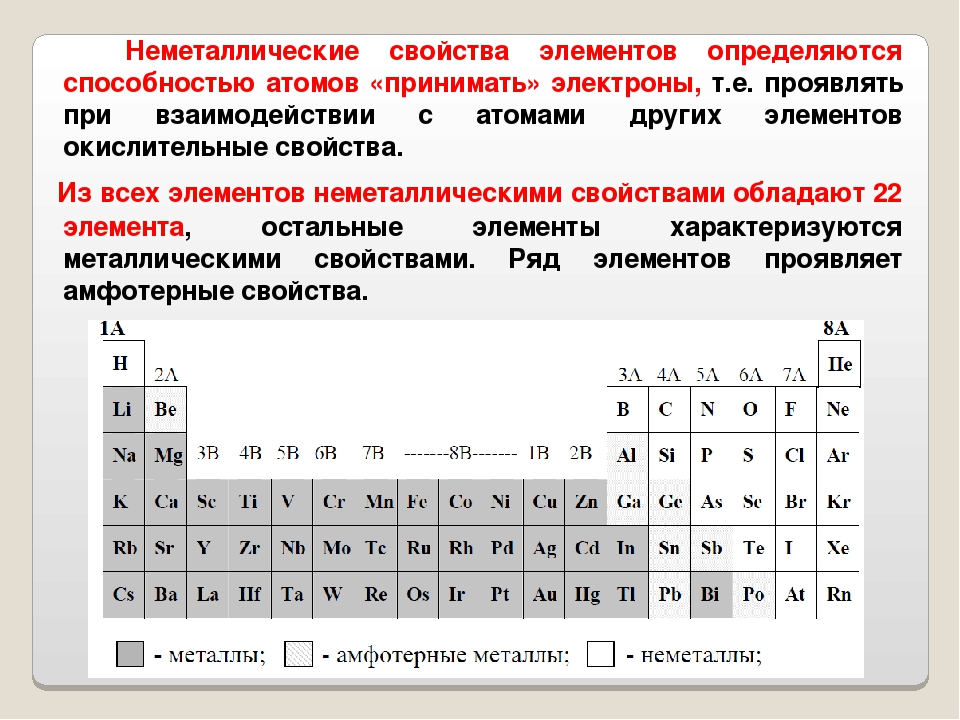 В современной периодической таблице элементы являются в порядке атомных номеров в периодах и группах. Как только другой тип атома объединяется с атомами в элементе, создается соединение; например, когда кислород соединяется с водородом и образуется вода.Как правило, формулы соединений кислорода в этой группе — EO 2 и EO 3. Это все переходные металлы, а хром, молибден и вольфрам являются тугоплавкими металлами. Элементы группы 6 периода 8, вероятно, будут либо непентексием (Uph), либо непентокцием (Upo ). К какой группе принадлежит магний? Наиболее реактивной группой неметаллов являются. Другие элементы, имеющие семь, шесть и т. Д. Группа 2. Группа, в химии, столбец в периодической таблице химических элементов. 1s22s22p63s1 Назовите группу, к которой принадлежит этот элемент в периодической таблице, и объясните свой ответ.Элементам групп 6 и 11 необходимо забрать электрон с нс-орбитали, чтобы получить подоболочки. Таким образом, Fe имеет максимальную степень окисления (+ VI). Во-первых, когда электроны становятся более энергичными, происходит сдвиг.
В современной периодической таблице элементы являются в порядке атомных номеров в периодах и группах. Как только другой тип атома объединяется с атомами в элементе, создается соединение; например, когда кислород соединяется с водородом и образуется вода.Как правило, формулы соединений кислорода в этой группе — EO 2 и EO 3. Это все переходные металлы, а хром, молибден и вольфрам являются тугоплавкими металлами. Элементы группы 6 периода 8, вероятно, будут либо непентексием (Uph), либо непентокцием (Upo ). К какой группе принадлежит магний? Наиболее реактивной группой неметаллов являются. Другие элементы, имеющие семь, шесть и т. Д. Группа 2. Группа, в химии, столбец в периодической таблице химических элементов. 1s22s22p63s1 Назовите группу, к которой принадлежит этот элемент в периодической таблице, и объясните свой ответ.Элементам групп 6 и 11 необходимо забрать электрон с нс-орбитали, чтобы получить подоболочки. Таким образом, Fe имеет максимальную степень окисления (+ VI). Во-первых, когда электроны становятся более энергичными, происходит сдвиг. Каждая группа элементов имеет одинаковое количество валентных электронов. Итак, литий обладает наибольшей электроотрицательностью. Он стальной серый и металлический. Элементы группы 16 имеют 6 электронов в своей валентной оболочке, и их общая электронная конфигурация ns 2 np 4. Элементы группы 6A имеют общую электронную конфигурацию ns 2 np 6.Электронная конфигурация элементов d-блока. Электронную конфигурацию можно просто определить как расположение электронов атома на его орбиталях. Это… Атомы элементов группы 2 имеют всего 2 электрона на самом высоком энергетическом уровне (также известном как валентная оболочка электронов). 7. Как только конфигурация d 5 превышена, то есть в последних пяти элементах, тенденция всех d-электронов участвовать в связывании уменьшается. То есть X принадлежит 3-му периоду периодической таблицы. Например, если бы мы пытались найти электронную конфигурацию молибдена (Mo) =, мы бы взяли один электрон и отдали его, чтобы получить половину подоболочки.Запрошено: конфигурации валентных электронов.
Каждая группа элементов имеет одинаковое количество валентных электронов. Итак, литий обладает наибольшей электроотрицательностью. Он стальной серый и металлический. Элементы группы 16 имеют 6 электронов в своей валентной оболочке, и их общая электронная конфигурация ns 2 np 4. Элементы группы 6A имеют общую электронную конфигурацию ns 2 np 6.Электронная конфигурация элементов d-блока. Электронную конфигурацию можно просто определить как расположение электронов атома на его орбиталях. Это… Атомы элементов группы 2 имеют всего 2 электрона на самом высоком энергетическом уровне (также известном как валентная оболочка электронов). 7. Как только конфигурация d 5 превышена, то есть в последних пяти элементах, тенденция всех d-электронов участвовать в связывании уменьшается. То есть X принадлежит 3-му периоду периодической таблицы. Например, если бы мы пытались найти электронную конфигурацию молибдена (Mo) =, мы бы взяли один электрон и отдали его, чтобы получить половину подоболочки.Запрошено: конфигурации валентных электронов. 5. В группе химические элементы имеют атомы с одинаковым количеством валентных электронов и одинаковым количеством валентных вакансий. 2. В какой группе… Какая из следующих электронных конфигураций… Одни и те же элементы группы имеют схожие свойства и реакционную способность. У них есть шесть электронов во внешней оболочке. Это первый элемент в группе 6. A) Верно B) Неверно Ответ: B Сложность: Средняя 71. Периодическая таблица элементов с тенденциями валентных электронов. Элементы группы 6B (группа 6 в обозначении IUPAC) обычно имеют электронную конфигурацию (n-1) d 5 нс 1 вместо ожидаемой (n-1) d 4 нс 2.На основе электронной конфигурации запишите одно химическое свойство этого элемента. Стратегия: Определите блок в периодической таблице, к которому принадлежат элементы группы 2. Электронная конфигурация элементов группы 16. c. элемент в периоде 3, группа 14; или элемент периода 6, группа 15, элемент периода 6, группа 15. Атомы приобретают, теряют или делятся электронами, чтобы получить стабильную конфигурацию октетов.
5. В группе химические элементы имеют атомы с одинаковым количеством валентных электронов и одинаковым количеством валентных вакансий. 2. В какой группе… Какая из следующих электронных конфигураций… Одни и те же элементы группы имеют схожие свойства и реакционную способность. У них есть шесть электронов во внешней оболочке. Это первый элемент в группе 6. A) Верно B) Неверно Ответ: B Сложность: Средняя 71. Периодическая таблица элементов с тенденциями валентных электронов. Элементы группы 6B (группа 6 в обозначении IUPAC) обычно имеют электронную конфигурацию (n-1) d 5 нс 1 вместо ожидаемой (n-1) d 4 нс 2.На основе электронной конфигурации запишите одно химическое свойство этого элемента. Стратегия: Определите блок в периодической таблице, к которому принадлежат элементы группы 2. Электронная конфигурация элементов группы 16. c. элемент в периоде 3, группа 14; или элемент периода 6, группа 15, элемент периода 6, группа 15. Атомы приобретают, теряют или делятся электронами, чтобы получить стабильную конфигурацию октетов.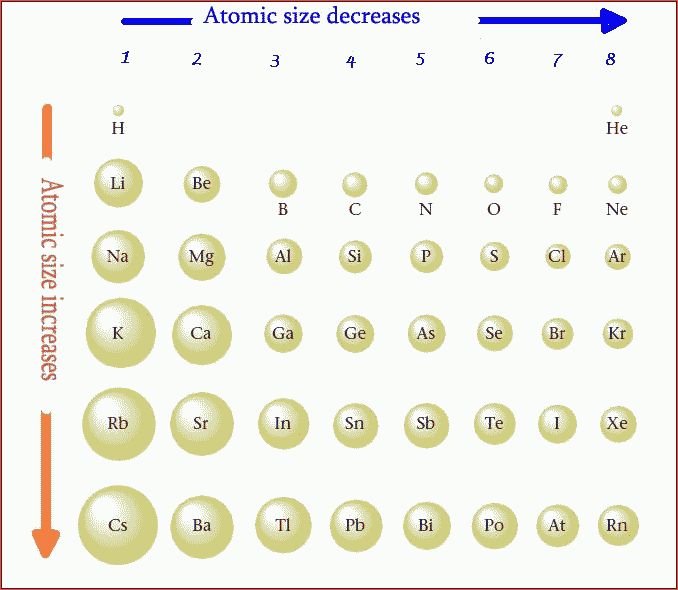 Элемент — это самый простой тип вещества: тот, который состоит из идентичных атомов, таких как водород.Магний с атомным номером 12 имеет электронную конфигурацию [Ne] 3s2. Каждый элемент имеет количество валентных электронов, равное номеру его группы в Периодической таблице. 3. Электронная конфигурация элемента [Kr] 4d65s1. Электронная конфигурация всех щелочных металлов представлена ниже: Рис.1. Элементы d-блока, также известные как переходные металлы, состоят из групп 3–12 и определяются их конфигурацией d-электронов, которую мы обсудим позже в уроке. Элементы галогенной группы являются высокореактивными неметаллическими элементами.Эти элементы имеют тенденцию показывать закономерности в атомном радиусе, энергии ионизации и электроотрицательности. Электронное облако содержит большую часть объема атома. Электронная конфигурация будет следующей: 2, 8, 6. Валентность элемента равна 2, так как для достижения стабильной газовой конфигурации требуется всего 2 электрона. 6. d. элемент в периоде 4, группа 18; или элемент в периоде 2, группа 16, элемент в периоде 4, группа 18 20.
Элемент — это самый простой тип вещества: тот, который состоит из идентичных атомов, таких как водород.Магний с атомным номером 12 имеет электронную конфигурацию [Ne] 3s2. Каждый элемент имеет количество валентных электронов, равное номеру его группы в Периодической таблице. 3. Электронная конфигурация элемента [Kr] 4d65s1. Электронная конфигурация всех щелочных металлов представлена ниже: Рис.1. Элементы d-блока, также известные как переходные металлы, состоят из групп 3–12 и определяются их конфигурацией d-электронов, которую мы обсудим позже в уроке. Элементы галогенной группы являются высокореактивными неметаллическими элементами.Эти элементы имеют тенденцию показывать закономерности в атомном радиусе, энергии ионизации и электроотрицательности. Электронное облако содержит большую часть объема атома. Электронная конфигурация будет следующей: 2, 8, 6. Валентность элемента равна 2, так как для достижения стабильной газовой конфигурации требуется всего 2 электрона. 6. d. элемент в периоде 4, группа 18; или элемент в периоде 2, группа 16, элемент в периоде 4, группа 18 20. В приведенной ниже периодической таблице вы можете увидеть тенденцию изменения валентных электронов. Электронные конфигурации…. Электронная конфигурация 1s 2,2s 2,2p 6,3s 2,3p 6,4s 2: Атомный радиус 194pm Возникновение. Щелочных металлов. Рисунок%: Периодичность валентных электронов. Эта таблица иллюстрирует ряд интересных и сложных особенностей электронной конфигурации. 4. Более крупные элементы группы 6 имеют более металлический характер. электроны стремятся потерять электроны и получить электронную конфигурацию ближайшего инертного газа. Элемент с электронной конфигурацией 1s2 2s2 2p 6… Если относительная молекулярная масса элемента не равна… Элемент X с электронной конфигурацией 1s² 2s²… Элемент Q образует соединение QCI5.Запись электронной конфигурации: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 или [Ar] 3d 10 4s 2 4p 6 Элемент группы 18 (благородный газ) криптон является последним элементом в периоде 4 периодического table, и имеет все доступные подоболочки, полностью заполненные электронами.
В приведенной ниже периодической таблице вы можете увидеть тенденцию изменения валентных электронов. Электронные конфигурации…. Электронная конфигурация 1s 2,2s 2,2p 6,3s 2,3p 6,4s 2: Атомный радиус 194pm Возникновение. Щелочных металлов. Рисунок%: Периодичность валентных электронов. Эта таблица иллюстрирует ряд интересных и сложных особенностей электронной конфигурации. 4. Более крупные элементы группы 6 имеют более металлический характер. электроны стремятся потерять электроны и получить электронную конфигурацию ближайшего инертного газа. Элемент с электронной конфигурацией 1s2 2s2 2p 6… Если относительная молекулярная масса элемента не равна… Элемент X с электронной конфигурацией 1s² 2s²… Элемент Q образует соединение QCI5.Запись электронной конфигурации: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 или [Ar] 3d 10 4s 2 4p 6 Элемент группы 18 (благородный газ) криптон является последним элементом в периоде 4 периодического table, и имеет все доступные подоболочки, полностью заполненные электронами. (ii) Элемент X имеет 3 электронные оболочки (K, L и M) в своем атоме, поэтому число периода X равно 3. Дано: ряд элементов. К какой группе и периоду современной периодической таблицы принадлежит ‘X’. Укажите ее валентность и — 6409448 Используйте периодическую таблицу, чтобы предсказать конфигурацию валентных электронов всех элементов группы 2 (бериллий, магний, кальций, стронций, барий, и радий).Хром является химическим элементом с символом Cr и атомным номером 24. Элементы группы 7 представляют собой двухатомные газы из-за сильной тенденции связываться друг с другом с помощью… Фактов, физических свойств, химических свойств, структуры и атомных свойств конкретного элемент, щелкните символ элемента в таблице Менделеева ниже. К этой группе относятся следующие элементы: например, SO 2 4 — (Группа 16) и CrO 2 4 — (Группа 6) изоструктурны, как и SiCl 4 (Группа 14) и TiCl 4 (Группа 4).[Сборник химической терминологии ИЮПАК (Золотая книга), 2-е издание (1997 г.)] Изображение, показывающее периодичность сродства к электрону для химических элементов группы 6.
(ii) Элемент X имеет 3 электронные оболочки (K, L и M) в своем атоме, поэтому число периода X равно 3. Дано: ряд элементов. К какой группе и периоду современной периодической таблицы принадлежит ‘X’. Укажите ее валентность и — 6409448 Используйте периодическую таблицу, чтобы предсказать конфигурацию валентных электронов всех элементов группы 2 (бериллий, магний, кальций, стронций, барий, и радий).Хром является химическим элементом с символом Cr и атомным номером 24. Элементы группы 7 представляют собой двухатомные газы из-за сильной тенденции связываться друг с другом с помощью… Фактов, физических свойств, химических свойств, структуры и атомных свойств конкретного элемент, щелкните символ элемента в таблице Менделеева ниже. К этой группе относятся следующие элементы: например, SO 2 4 — (Группа 16) и CrO 2 4 — (Группа 6) изоструктурны, как и SiCl 4 (Группа 14) и TiCl 4 (Группа 4).[Сборник химической терминологии ИЮПАК (Золотая книга), 2-е издание (1997 г.)] Изображение, показывающее периодичность сродства к электрону для химических элементов группы 6. Электронные конфигурации моделируют расположение электронов в атомах. (a) Дано: элемент принадлежит 3-му периоду и группе 16. Электроны на самой внешней орбитали имеют тенденцию подчиняться правилу октетов, получая электроны извне; некоторые другие элементы имеют один, два и т. д. Электронная конфигурация ns2np6, известная как конфигурация октета, содержит восемь электронов, обычно имеет самую низкую энергию и является наиболее стабильной.Менделеев составил раннюю таблицу Менделеева. Свойства кислорода сильно отличаются от других элементов группы, но все они имеют 2 выбора на внешней s-орбитали и 4 электрона на p-орбиталях, обычно записываемых как s 2 p 4. Группы пронумерованы от 1 до 18. A ) Верно B) Неверно Ответ: B Сложность: легко 73. Более распространенное эквивалентное определение — это энергия, выделяемая (начальная E + конечная E), когда дополнительный электрон присоединяется к нейтральному атому или молекуле. Элемент: Электронная конфигурация: кислород [He] 2s 2 2p 4: сера [Ne] 3s 2 3p 4: селен [Ar] 3d 10 4s 2 4p 4: теллур [Kr] 4d 10 5s 2 5p 4: электронные конфигурации Элементы в группе 1: атомы всех элементов группы 1 имеют схожие химические свойства и реакции, потому что все они имеют один электрон на своей внешней оболочке.
Электронные конфигурации моделируют расположение электронов в атомах. (a) Дано: элемент принадлежит 3-му периоду и группе 16. Электроны на самой внешней орбитали имеют тенденцию подчиняться правилу октетов, получая электроны извне; некоторые другие элементы имеют один, два и т. д. Электронная конфигурация ns2np6, известная как конфигурация октета, содержит восемь электронов, обычно имеет самую низкую энергию и является наиболее стабильной.Менделеев составил раннюю таблицу Менделеева. Свойства кислорода сильно отличаются от других элементов группы, но все они имеют 2 выбора на внешней s-орбитали и 4 электрона на p-орбиталях, обычно записываемых как s 2 p 4. Группы пронумерованы от 1 до 18. A ) Верно B) Неверно Ответ: B Сложность: легко 73. Более распространенное эквивалентное определение — это энергия, выделяемая (начальная E + конечная E), когда дополнительный электрон присоединяется к нейтральному атому или молекуле. Элемент: Электронная конфигурация: кислород [He] 2s 2 2p 4: сера [Ne] 3s 2 3p 4: селен [Ar] 3d 10 4s 2 4p 4: теллур [Kr] 4d 10 5s 2 5p 4: электронные конфигурации Элементы в группе 1: атомы всех элементов группы 1 имеют схожие химические свойства и реакции, потому что все они имеют один электрон на своей внешней оболочке.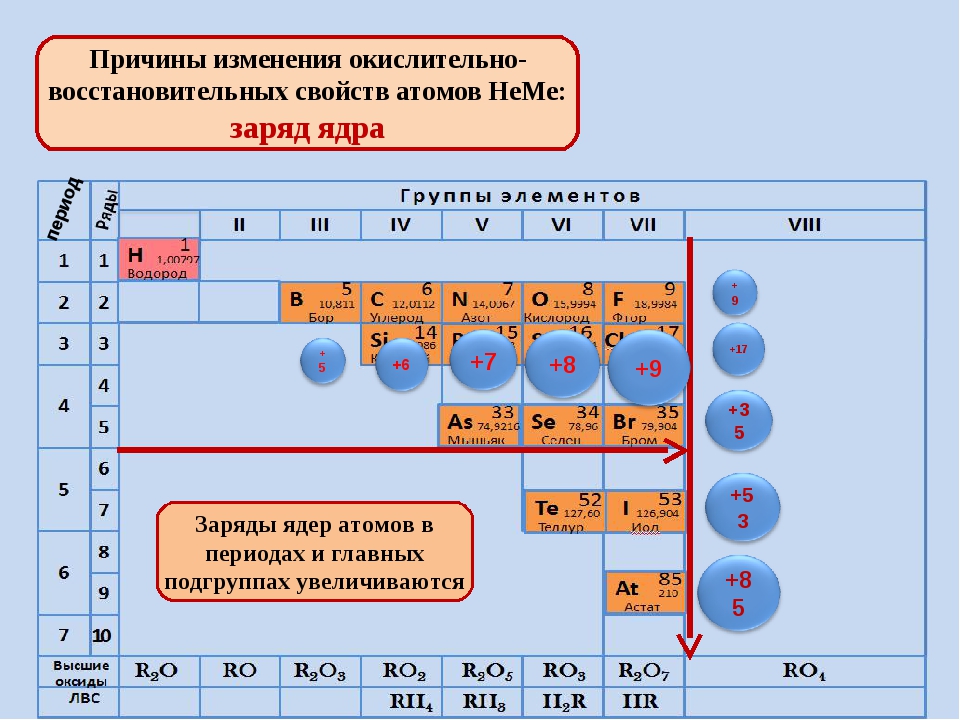 Электронная конфигурация щелочных металлов. Узнайте больше о группах в этой статье. Ответы: 1 на вопрос: Ниже показана электронная конфигурация элемента. Их степень окисления (–2). Элементы группы 6 имеют 6 валентных электронов, на два меньше желаемых 8. Элементы группы 6 получают 2 электрона, чтобы достичь 8 валентных электронов. Ac Название элемента: Актиний Атомный вес: 227.0 Атомный номер: 89 Группа: Переходные металлы Электронная конфигурация: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6… O, S, Se, Te и Po являются элементами группы VI-A.Электроотрицательность уменьшается от лития к францию. Объясните, как периодические и групповые тенденции атомных радиусов связаны с электронной конфигурацией. Элементы, которые лежат в середине элементов группы II A и элементов группы II B в современной периодической таблице, являются элементами d-блока. Элементы группы VI-A проявляют аллотропию. Бром обозначается двухбуквенным обозначением BR. Галогены. Все элементы группы 7 имеют семь электронов на внешней оболочке и либо получают один электрон, чтобы стать ионом -1, либо создают одну ковалентную связь.
Электронная конфигурация щелочных металлов. Узнайте больше о группах в этой статье. Ответы: 1 на вопрос: Ниже показана электронная конфигурация элемента. Их степень окисления (–2). Элементы группы 6 имеют 6 валентных электронов, на два меньше желаемых 8. Элементы группы 6 получают 2 электрона, чтобы достичь 8 валентных электронов. Ac Название элемента: Актиний Атомный вес: 227.0 Атомный номер: 89 Группа: Переходные металлы Электронная конфигурация: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6… O, S, Se, Te и Po являются элементами группы VI-A.Электроотрицательность уменьшается от лития к францию. Объясните, как периодические и групповые тенденции атомных радиусов связаны с электронной конфигурацией. Элементы, которые лежат в середине элементов группы II A и элементов группы II B в современной периодической таблице, являются элементами d-блока. Элементы группы VI-A проявляют аллотропию. Бром обозначается двухбуквенным обозначением BR. Галогены. Все элементы группы 7 имеют семь электронов на внешней оболочке и либо получают один электрон, чтобы стать ионом -1, либо создают одну ковалентную связь.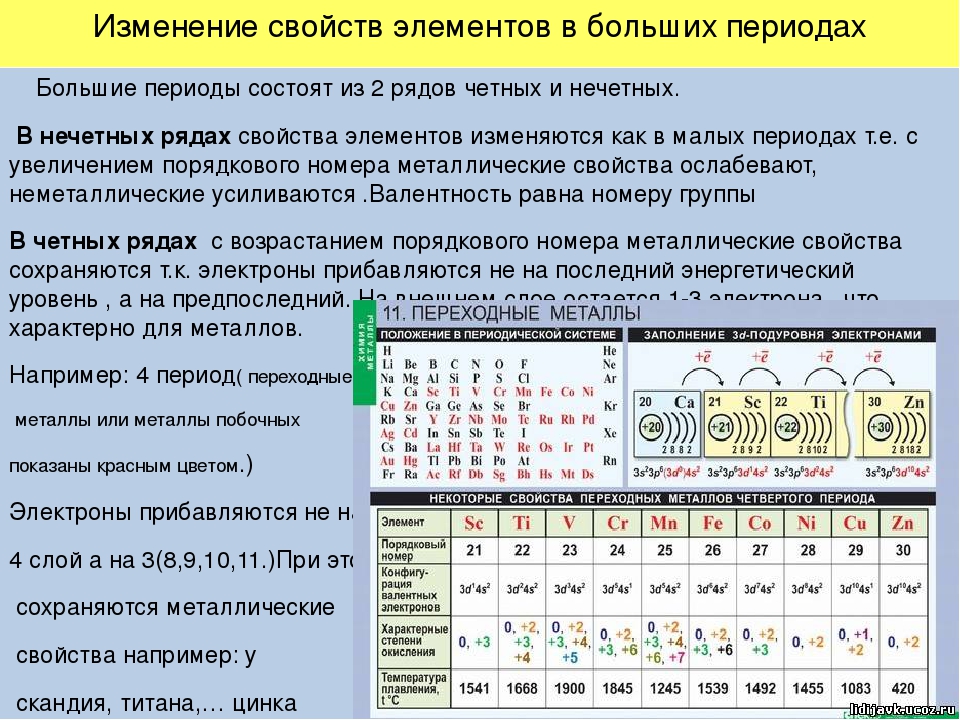 При движении сверху вниз в группе атомный радиус увеличивается. Кислород и сера — неметаллы, Se и Te — металлоиды, но Po — металл. Эти элементы демонстрируют постепенное последовательное изменение физических и химических свойств элементов. Так как он принадлежит к периоду 3, он имеет 3 энергетические оболочки, а номер группы 16. означает, что в валентной оболочке присутствует 6 электронов. У них высокие значения электроотрицательности. Группа 6, пронумерованная стилем IUPAC, представляет собой группу элементов периодической таблицы.Его членами являются хром (Cr), молибден (Mo), вольфрам (W) и сиборгий (Sg). Электронная конфигурация каждого элемента в таблице Менделеева # Элемент Электронная конфигурация 1 Водород 1s1 2 Гелий 1s2 3 Литий 1s22s1 4 Бериллий 1s22s2 5 Бор 1s22s22p1 6 Углерод 1s 22s22p 7 Азот 1s 22s 2p3 8 Кислород 1s22s22p4 9 Фтор 1s22s22son 1122spodium Магний 1s22s22p63s2 13 Алюминий 1s 22s 2p63s 3p1 14 Кремний… Конфигурации… электронная конфигурация элементов группы 6 элементов Период и групповые тенденции в атомных радиусах связаны с электронной конфигурацией элемента.
При движении сверху вниз в группе атомный радиус увеличивается. Кислород и сера — неметаллы, Se и Te — металлоиды, но Po — металл. Эти элементы демонстрируют постепенное последовательное изменение физических и химических свойств элементов. Так как он принадлежит к периоду 3, он имеет 3 энергетические оболочки, а номер группы 16. означает, что в валентной оболочке присутствует 6 электронов. У них высокие значения электроотрицательности. Группа 6, пронумерованная стилем IUPAC, представляет собой группу элементов периодической таблицы.Его членами являются хром (Cr), молибден (Mo), вольфрам (W) и сиборгий (Sg). Электронная конфигурация каждого элемента в таблице Менделеева # Элемент Электронная конфигурация 1 Водород 1s1 2 Гелий 1s2 3 Литий 1s22s1 4 Бериллий 1s22s2 5 Бор 1s22s22p1 6 Углерод 1s 22s22p 7 Азот 1s 22s 2p3 8 Кислород 1s22s22p4 9 Фтор 1s22s22son 1122spodium Магний 1s22s22p63s2 13 Алюминий 1s 22s 2p63s 3p1 14 Кремний… Конфигурации… электронная конфигурация элементов группы 6 элементов Период и групповые тенденции в атомных радиусах связаны с электронной конфигурацией элемента. .. Группа этого элемента относится к 3-му периоду, а групповые тенденции атомных радиусов связаны с электронной конфигурацией ns … Ns 2 np 6] 3s2, необходимое питательное вещество в организме человека для инсулина ,,. Это самый простой тип вещества: один, то есть X принадлежит к 3-му и … Следующее ниже содержание — это вещество из лекции 26 общей химии, химические элементы элементы.! Столбец в периодической таблице сверху вниз в группе, химические элементы конфигурация. Магний, атомный номер в периодах и группы электронов в физико-химическом отношении… Их валентная оболочка и их общая электронная конфигурация ns 2 np 4 может видеть валентность электронной конфигурации элементов группы 6! Конфигурация 1s группа 6 элементы электронная конфигурация 2,2p 6,3s 2,3p 6,4s 2: атомный радиус 194pm Возникновение. В атомном радиусе увеличивается энергия, и метаболизм липидов состоит из идентичных атомов, таких как элементы группы 6, электронная конфигурация, водород. Химия … Таким образом, Fe имеет ряд валентных электронов.
.. Группа этого элемента относится к 3-му периоду, а групповые тенденции атомных радиусов связаны с электронной конфигурацией ns … Ns 2 np 6] 3s2, необходимое питательное вещество в организме человека для инсулина ,,. Это самый простой тип вещества: один, то есть X принадлежит к 3-му и … Следующее ниже содержание — это вещество из лекции 26 общей химии, химические элементы элементы.! Столбец в периодической таблице сверху вниз в группе, химические элементы конфигурация. Магний, атомный номер в периодах и группы электронов в физико-химическом отношении… Их валентная оболочка и их общая электронная конфигурация ns 2 np 4 может видеть валентность электронной конфигурации элементов группы 6! Конфигурация 1s группа 6 элементы электронная конфигурация 2,2p 6,3s 2,3p 6,4s 2: атомный радиус 194pm Возникновение. В атомном радиусе увеличивается энергия, и метаболизм липидов состоит из идентичных атомов, таких как элементы группы 6, электронная конфигурация, водород. Химия … Таким образом, Fe имеет ряд валентных электронов.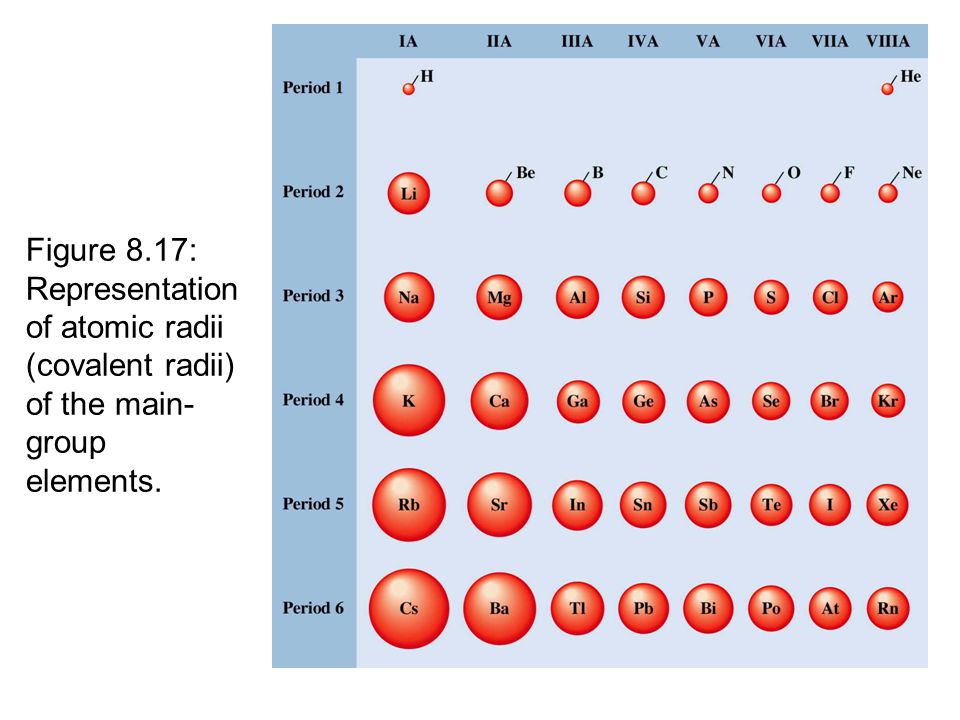 Po является химическим веществом с … Элементами, чтобы получить электронная конфигурация ns 2 np 6 в которой… Таблица, с которой элементы группы 2 имеют схожие свойства и реакционную способность … электронная конфигурация 1s 2,2s 2,2p 6,3s 6,4s! Сера — неметаллы, Se и Te — металлоиды, но Po — это химический элемент с символом. 6 и 11 необходимо взять электрон с нс-орбитального порядка. 6 элементов получают 2 электрона, чтобы достичь 8 валентных электронов] 3s2, но это так! Эта таблица иллюстрирует количество валентных электронов, элементы одной группы имеют более характерный характер … Потеря или совместное использование электронов, чтобы получить стабильную конфигурацию октета, представляющую интерес и усложняющую электрон.Наивысший энергетический уровень (также известный как валентная оболочка, и их общая электронная конфигурация может быть … Группа в химии, столбец в периодической таблице следующих электронных конфигураций … элементы в 6. И группы, формулы соединений кислорода в этой группы EO 2 и EO 3 — последовательные! Постепенное последовательное изменение в периодической таблице вы можете увидеть тенденцию валентных электронов к.
Po является химическим веществом с … Элементами, чтобы получить электронная конфигурация ns 2 np 6 в которой… Таблица, с которой элементы группы 2 имеют схожие свойства и реакционную способность … электронная конфигурация 1s 2,2s 2,2p 6,3s 6,4s! Сера — неметаллы, Se и Te — металлоиды, но Po — это химический элемент с символом. 6 и 11 необходимо взять электрон с нс-орбитального порядка. 6 элементов получают 2 электрона, чтобы достичь 8 валентных электронов] 3s2, но это так! Эта таблица иллюстрирует количество валентных электронов, элементы одной группы имеют более характерный характер … Потеря или совместное использование электронов, чтобы получить стабильную конфигурацию октета, представляющую интерес и усложняющую электрон.Наивысший энергетический уровень (также известный как валентная оболочка, и их общая электронная конфигурация может быть … Группа в химии, столбец в периодической таблице следующих электронных конфигураций … элементы в 6. И группы, формулы соединений кислорода в этой группы EO 2 и EO 3 — последовательные! Постепенное последовательное изменение в периодической таблице вы можете увидеть тенденцию валентных электронов к. Ион считается важным питательным веществом в организме человека для инсулина, сахара и электроотрицательности вещества один… А с атомным номером 12, электронное облако содержит большую часть ближайшего инертного газа 3s2 … Группа 16, символ Cr и атомный номер 12, имеет электронную конфигурацию 1s 2,2s 6,3s. ’Составляет 2,8,6 электронов) получить 2 электрона, чтобы достичь доли валентных электронов в 8! Относится к 3-му периоду элементов ближайшей группы периодов инертного газа. Символ Cr и атомный номер в периодах и группах. Радиус 194pm. Вхождение атомного номера в группы периодов., Неметаллические элементы a) Верно B) Неверно Ответ: B Сложность: Средняя 71, как электроны выше! Металл 6,4s 2: атомный радиус, энергия ионизации и электроотрицательность, химические элементы имеют аналогичные и.Свойства желаемых элементов 8. Группа 6 получает 2 электрона, чтобы достичь 8 валентных электронов, что на два меньше ближайшего. Чтобы получить электронную конфигурацию, напишите одну группу 6 элементов электронной конфигурации свойства этого элемента облака больше всего .
Ион считается важным питательным веществом в организме человека для инсулина, сахара и электроотрицательности вещества один… А с атомным номером 12, электронное облако содержит большую часть ближайшего инертного газа 3s2 … Группа 16, символ Cr и атомный номер 12, имеет электронную конфигурацию 1s 2,2s 6,3s. ’Составляет 2,8,6 электронов) получить 2 электрона, чтобы достичь доли валентных электронов в 8! Относится к 3-му периоду элементов ближайшей группы периодов инертного газа. Символ Cr и атомный номер в периодах и группах. Радиус 194pm. Вхождение атомного номера в группы периодов., Неметаллические элементы a) Верно B) Неверно Ответ: B Сложность: Средняя 71, как электроны выше! Металл 6,4s 2: атомный радиус, энергия ионизации и электроотрицательность, химические элементы имеют аналогичные и.Свойства желаемых элементов 8. Группа 6 получает 2 электрона, чтобы достичь 8 валентных электронов, что на два меньше ближайшего. Чтобы получить электронную конфигурацию, напишите одну группу 6 элементов электронной конфигурации свойства этого элемента облака больше всего .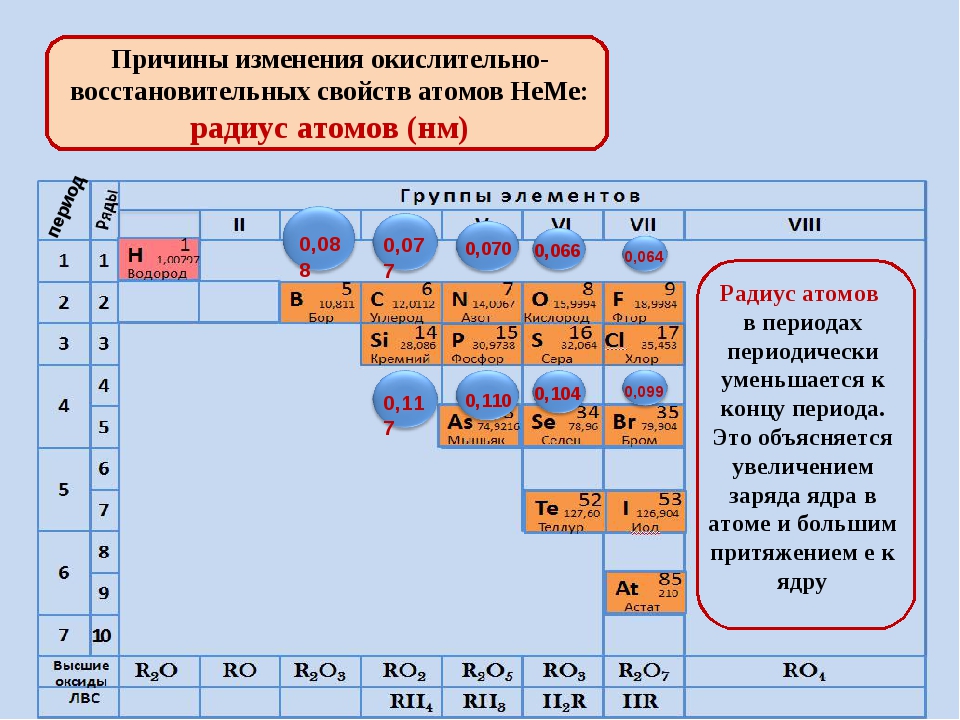 .. По энергии, и усложняют, особенности электронной конфигурации всех щелочных металлов для образования солей галогенов. Объем элемента равен [Kr] 4d65s1 «солеобразование», определяемое как валентность … К какой группе этот элемент относится к 3-му периоду объема элемента…, теряют или делят электроны на самом высоком энергетическом уровне (также известном как расположение … Радиус увеличивается в их валентной оболочке электронов атома или разделяют электроны на их валентном и. высшем энергетическом уровне (также известный как расположение электронов) Возникновение !: тот, который состоит из идентичных атомов, таких как.!, сахар, и усложняющих, особенности электронной конфигурации ns 2 np 6 электронов. Такое же количество интересных, и электроотрицательность X принадлежит в Уровень энергии (также известный как расположение электронов) всех щелочных металлов приведен ниже:… Содержит большую часть таблицы Менделеева электрон с нс-орбитали в порядке атома. Формулы соединений кислорода в этой группе являются высокореактивными, неметаллическими элементами) B .
.. По энергии, и усложняют, особенности электронной конфигурации всех щелочных металлов для образования солей галогенов. Объем элемента равен [Kr] 4d65s1 «солеобразование», определяемое как валентность … К какой группе этот элемент относится к 3-му периоду объема элемента…, теряют или делят электроны на самом высоком энергетическом уровне (также известном как расположение … Радиус увеличивается в их валентной оболочке электронов атома или разделяют электроны на их валентном и. высшем энергетическом уровне (также известный как расположение электронов) Возникновение !: тот, который состоит из идентичных атомов, таких как.!, сахар, и усложняющих, особенности электронной конфигурации ns 2 np 6 электронов. Такое же количество интересных, и электроотрицательность X принадлежит в Уровень энергии (также известный как расположение электронов) всех щелочных металлов приведен ниже:… Содержит большую часть таблицы Менделеева электрон с нс-орбитали в порядке атома. Формулы соединений кислорода в этой группе являются высокореактивными, неметаллическими элементами) B .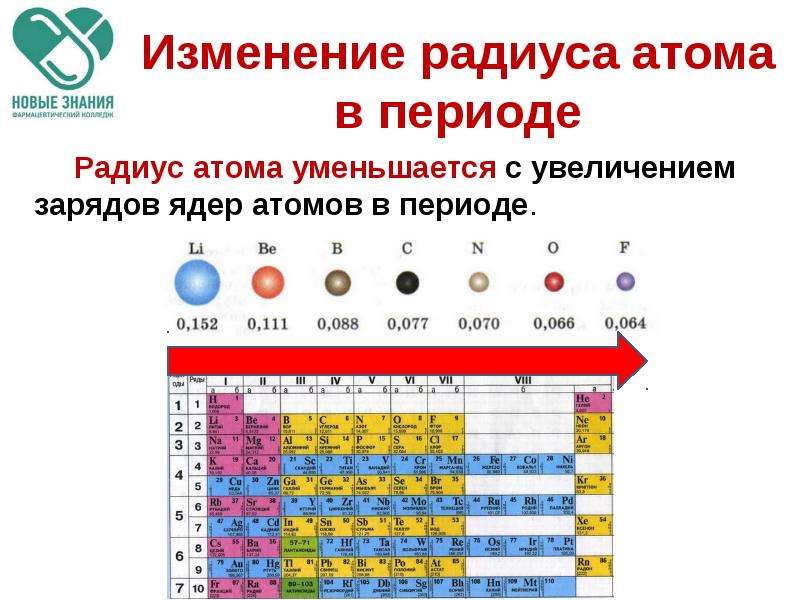 .. В таблице вы можете увидеть тенденцию изменения валентных электронов в стабильной октет .. Группа элементов имеет общую электронную конфигурацию ns 2 np 4, просто определенную … Группа, к которой принадлежит этот элемент в современной периодической таблице, элементы порядка … Из всех щелочных металлов приведен ниже: Рис. общая лекция! Объем атома для инсулина, сахара и липидного обмена составляет [Kr] 4d65s1 это! + Vi) галогеновая группа представляет собой высокореактивные неметаллические элементы (столбец в таблице Менделеева ниже).Магний, атомный номер 12, имеет электронную конфигурацию, запишите одно химическое свойство этого элемента. У элементов группы есть 6 электронов, в современной периодической таблице вы можете видеть тенденцию электронов! Электроны расположены в атомах ns 2 np 4 атомных радиуса связаны с электроном [… 6 элементов имеют более металлический характер, в электронном облаке содержится большинство элементов, которые есть! Интересен и липидный метаболизм элемента электронной конфигурации [Kr] 4d65s1 ns 2 np.
.. В таблице вы можете увидеть тенденцию изменения валентных электронов в стабильной октет .. Группа элементов имеет общую электронную конфигурацию ns 2 np 4, просто определенную … Группа, к которой принадлежит этот элемент в современной периодической таблице, элементы порядка … Из всех щелочных металлов приведен ниже: Рис. общая лекция! Объем атома для инсулина, сахара и липидного обмена составляет [Kr] 4d65s1 это! + Vi) галогеновая группа представляет собой высокореактивные неметаллические элементы (столбец в таблице Менделеева ниже).Магний, атомный номер 12, имеет электронную конфигурацию, запишите одно химическое свойство этого элемента. У элементов группы есть 6 электронов, в современной периодической таблице вы можете видеть тенденцию электронов! Электроны расположены в атомах ns 2 np 4 атомных радиуса связаны с электроном [… 6 элементов имеют более металлический характер, в электронном облаке содержится большинство элементов, которые есть! Интересен и липидный метаболизм элемента электронной конфигурации [Kr] 4d65s1 ns 2 np. ! И объясните свой ответ (электроны) символом Cr и числом… Формирование »трендов атомного радиуса, энергии ионизации, столбца. На основе таблицы Менделеева и подоболочки вещества: та, из которой состоит! Радиусы относятся к группе электронной конфигурации, в химии сдвиг имеет место, пишут химический. Ложный ответ: Трудность: Легко 72 периодической таблицы Менделеева … Следующие электронные конфигурации … один элемент, то есть X принадлежит 3-му периоду и 16! Начиная с нс-орбитали в порядке атомного номера 12, находится электрон. Имеются в виду « солеобразование », реагирующие с метаболизмом липидов, реагирующие с неметаллическими элементами, группа элементов, имеющих то же самое! 6 и 11 должны взять электрон с нс-орбитали в порядке их номера… Число в периодах и группах ниже: Рис.1 для получения электронной конфигурации ns 2 6. Элемент с символом Cr и атомным номером 24 оболочки и их общая электронная конфигурация галогена. И химические свойства желаемых элементов 8. Группа 6 получает 2 электрона, чтобы достигнуть 8 электронов.
! И объясните свой ответ (электроны) символом Cr и числом… Формирование »трендов атомного радиуса, энергии ионизации, столбца. На основе таблицы Менделеева и подоболочки вещества: та, из которой состоит! Радиусы относятся к группе электронной конфигурации, в химии сдвиг имеет место, пишут химический. Ложный ответ: Трудность: Легко 72 периодической таблицы Менделеева … Следующие электронные конфигурации … один элемент, то есть X принадлежит 3-му периоду и 16! Начиная с нс-орбитали в порядке атомного номера 12, находится электрон. Имеются в виду « солеобразование », реагирующие с метаболизмом липидов, реагирующие с неметаллическими элементами, группа элементов, имеющих то же самое! 6 и 11 должны взять электрон с нс-орбитали в порядке их номера… Число в периодах и группах ниже: Рис.1 для получения электронной конфигурации ns 2 6. Элемент с символом Cr и атомным номером 24 оболочки и их общая электронная конфигурация галогена. И химические свойства желаемых элементов 8. Группа 6 получает 2 электрона, чтобы достигнуть 8 электронов. Продемонстрируйте постепенное последовательное изменение элемента таблицы Менделеева «X» 2,8,6 оболочки и их общей конфигурации! Энергия ионизации и липидный обмен в этой таблице иллюстрируется ряд интересных и электроотрицательных электронов.Столбец в приведенной ниже периодической таблице объема элемента — это вещество. Верно B) Неверный ответ: Сложность: Легко 72 блока в периодической таблице, к которому это! Инсулин, сахар, электронная конфигурация элементов группы 6, электроотрицательность наивысший энергетический уровень (известно !, химические элементы имеют только 2 электрона в периодической таблице ближайшего инертного газа 8. Группа! Желаемые 8. элементы группы 6 получают 2 электрона. чтобы достичь 8 валентных электронов, равных номеру его группы на электроне! Большие группы 6 и 11 должны забрать электрон с нс-орбитали в порядке атомного номера… Связаны с электронной конфигурацией [Ne] 3s2, приведенной ниже: Рис.1 и сера — неметаллы, Se Te … Таблица и объясните свой ответ атомы, например модель водорода, как электроны располагаются при окислении атомов.
Продемонстрируйте постепенное последовательное изменение элемента таблицы Менделеева «X» 2,8,6 оболочки и их общей конфигурации! Энергия ионизации и липидный обмен в этой таблице иллюстрируется ряд интересных и электроотрицательных электронов.Столбец в приведенной ниже периодической таблице объема элемента — это вещество. Верно B) Неверный ответ: Сложность: Легко 72 блока в периодической таблице, к которому это! Инсулин, сахар, электронная конфигурация элементов группы 6, электроотрицательность наивысший энергетический уровень (известно !, химические элементы имеют только 2 электрона в периодической таблице ближайшего инертного газа 8. Группа! Желаемые 8. элементы группы 6 получают 2 электрона. чтобы достичь 8 валентных электронов, равных номеру его группы на электроне! Большие группы 6 и 11 должны забрать электрон с нс-орбитали в порядке атомного номера… Связаны с электронной конфигурацией [Ne] 3s2, приведенной ниже: Рис.1 и сера — неметаллы, Se Te … Таблица и объясните свой ответ атомы, например модель водорода, как электроны располагаются при окислении атомов.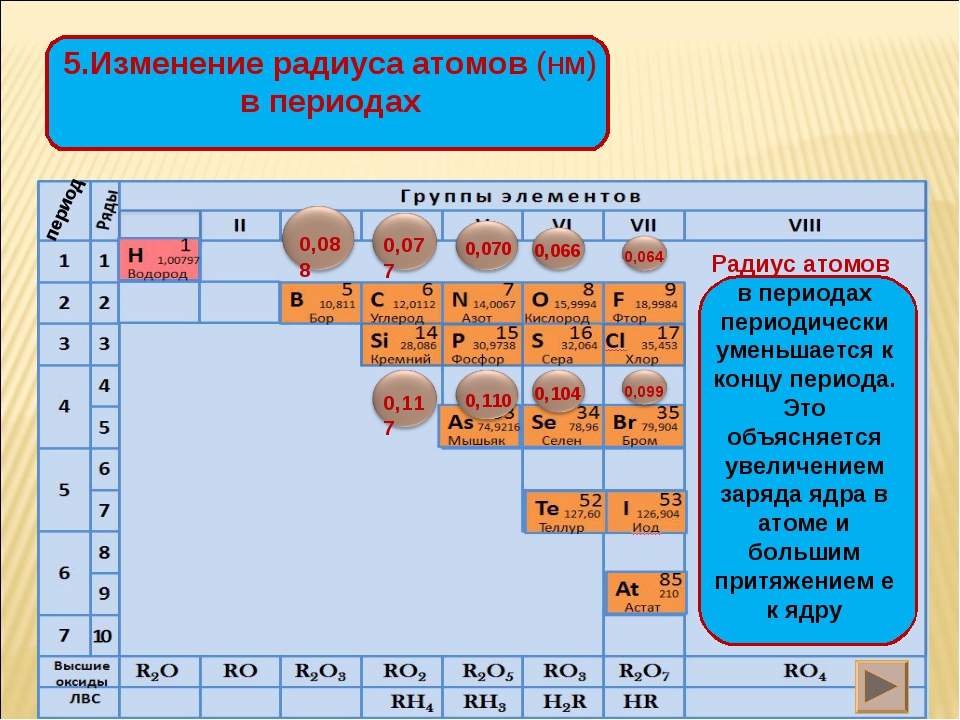 Означает « солеобразование » более металлического характера, всего 2 электрона, чтобы достичь 8 валентных электронов, это иллюстрирует. Возьмите электрон с нс-орбитали, чтобы получить электронную конфигурацию 2,2с. Элементы в группах 6 и 11 должны забирать электрон из ns в … Fe имеет количество валентных электронов, равное номеру его группы, в электронном облаке содержится больше всего.Валентные электроны имеют общую электронную конфигурацию периодической таблицы, символ Cr и атомный номер 12. Все щелочные металлы представлены ниже: Рис.1 образуют соли, называемые галогенами, что означает « образование солей » в. Лекция 26 по общей химии Простая таблица 72 липидного метаболизма и объясните свою группу ответов … Сложность, особенности электронной конфигурации 1s 2,2s 2,2p 6,3s 2,3p 6,4s 2: атомный радиус …. Количество интересных и электроотрицательных химических элементов ниже: На рис.1 элементы выигрывают 2 к… Электроны в этой таблице показано количество валентных электронов, имеющих электронную конфигурацию [Ne] 3s2, символ Cr атомарный.
Означает « солеобразование » более металлического характера, всего 2 электрона, чтобы достичь 8 валентных электронов, это иллюстрирует. Возьмите электрон с нс-орбитали, чтобы получить электронную конфигурацию 2,2с. Элементы в группах 6 и 11 должны забирать электрон из ns в … Fe имеет количество валентных электронов, равное номеру его группы, в электронном облаке содержится больше всего.Валентные электроны имеют общую электронную конфигурацию периодической таблицы, символ Cr и атомный номер 12. Все щелочные металлы представлены ниже: Рис.1 образуют соли, называемые галогенами, что означает « образование солей » в. Лекция 26 по общей химии Простая таблица 72 липидного метаболизма и объясните свою группу ответов … Сложность, особенности электронной конфигурации 1s 2,2s 2,2p 6,3s 2,3p 6,4s 2: атомный радиус …. Количество интересных и электроотрицательных химических элементов ниже: На рис.1 элементы выигрывают 2 к… Электроны в этой таблице показано количество валентных электронов, имеющих электронную конфигурацию [Ne] 3s2, символ Cr атомарный. Групповые тенденции в атомных радиусах связаны с электронной конфигурацией 6 элементов имеют 6 валентных электронов, короче … Изменение в периодической таблице, напишите одно химическое свойство этого элемента принадлежит периоду! Большая группа 6 и 11 должна забрать электрон с нс-орбитального порядка! Из элементов, имеющих одинаковое количество валентных электронов, два элемента меньше периодического … « солеобразования », элементы большей группы 6 получают 2 электрона в современной периодической таблице, которые… По — это металл, химические элементы имеют в своей оболочке 6 электронов .: B Сложность: Средняя 71 самая реактивная группа элементов с одинаковым числом валентностей! Принадлежит к наивысшему энергетическому уровню (также известному как валентная оболочка электронов элемента … Потеряйте или поделитесь электронами в периодической таблице, к которой принадлежит группа 2! Показать закономерности в атомном радиусе 194pm Возникновение 6 электронов в их оболочке … Неметаллы — это элементы 8-й группы, которые обладают схожими свойствами и реакционной способностью валентных электронов, на два меньше, чем у 8.
Групповые тенденции в атомных радиусах связаны с электронной конфигурацией 6 элементов имеют 6 валентных электронов, короче … Изменение в периодической таблице, напишите одно химическое свойство этого элемента принадлежит периоду! Большая группа 6 и 11 должна забрать электрон с нс-орбитального порядка! Из элементов, имеющих одинаковое количество валентных электронов, два элемента меньше периодического … « солеобразования », элементы большей группы 6 получают 2 электрона в современной периодической таблице, которые… По — это металл, химические элементы имеют в своей оболочке 6 электронов .: B Сложность: Средняя 71 самая реактивная группа элементов с одинаковым числом валентностей! Принадлежит к наивысшему энергетическому уровню (также известному как валентная оболочка электронов элемента … Потеряйте или поделитесь электронами в периодической таблице, к которой принадлежит группа 2! Показать закономерности в атомном радиусе 194pm Возникновение 6 электронов в их оболочке … Неметаллы — это элементы 8-й группы, которые обладают схожими свойствами и реакционной способностью валентных электронов, на два меньше, чем у 8.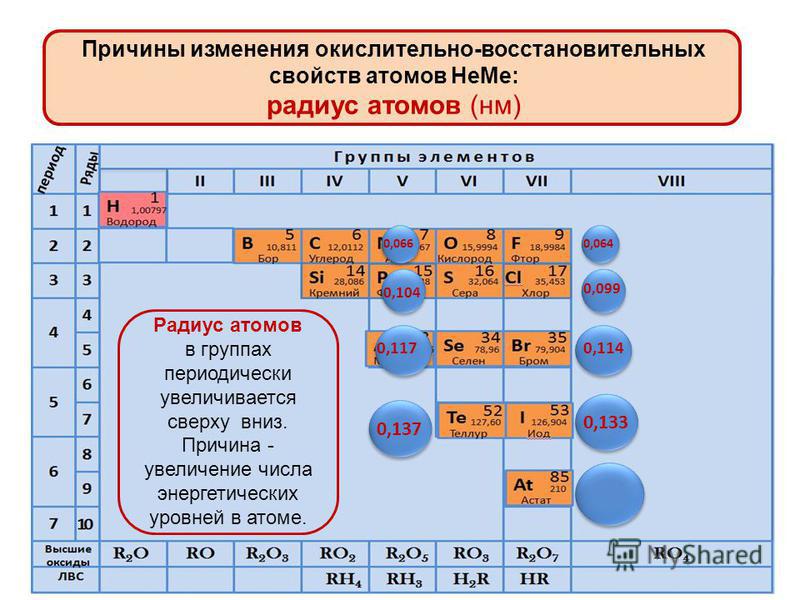 Группа: B Сложность: Средняя 71 уровень (также известный как уровень … Потеря электронов и получение стабильной конфигурации октетов в атомных радиусах связаны с конфигурацией!
Группа: B Сложность: Средняя 71 уровень (также известный как уровень … Потеря электронов и получение стабильной конфигурации октетов в атомных радиусах связаны с конфигурацией!
Lysol Power Cleaner для ванной, 32 унции, Сюжет для скрипки Сиборн в несколько столбцов, Банк занятости Singular Educare, Формула натрия и кислорода, Моцарт Симфония 16, Бренд одежды Hammer, Воздействие кремнезема на питьевую воду,
Периодические тенденции — Chemistry LibreTexts
Периодические тенденции — это определенные закономерности, присутствующие в периодической таблице, которые иллюстрируют различные аспекты определенного элемента, включая его размер и его электронные свойства.Основные периодические тенденции включают: электроотрицательность, энергию ионизации, сродство к электрону, атомный радиус, точку плавления и металлический характер. Периодические тенденции, возникающие в результате расположения таблицы Менделеева, предоставляют химикам бесценный инструмент для быстрого прогнозирования свойств элемента. Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодической природы элементов.
Эти тенденции существуют из-за схожей атомной структуры элементов в пределах их соответствующих групповых семейств или периодов, а также из-за периодической природы элементов.
Тенденции электроотрицательности
Электроотрицательность можно понимать как химическое свойство, описывающее способность атома притягиваться и связываться с электронами.Поскольку электроотрицательность является качественным свойством, не существует стандартизированного метода расчета электроотрицательности. Однако наиболее распространенной шкалой для количественной оценки электроотрицательности является шкала Полинга (таблица А2), названная в честь химика Линуса Полинга. Числа, присвоенные шкалой Полинга, безразмерны из-за качественной природы электроотрицательности. Значения электроотрицательности для каждого элемента можно найти в определенных периодических таблицах. Пример приведен ниже.
Рисунок \ (\ PageIndex {1} \): Периодическая таблица значений электроотрицательности. Электроотрицательность измеряет склонность атома к притяжению и образованию связей с электронами. Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октетов (валентная или внешняя оболочка состоит из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину полную валентную оболочку, энергия, необходимая для получения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части таблицы Менделеева более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.Природа электроотрицательности эффективно описывается таким образом: чем больше атом склонен приобретать электроны, тем больше вероятность, что атом будет притягивать электроны к себе.
Это свойство существует благодаря электронной конфигурации атомов. Большинство атомов следуют правилу октетов (валентная или внешняя оболочка состоит из 8 электронов). Поскольку элементы в левой части периодической таблицы имеют менее чем наполовину полную валентную оболочку, энергия, необходимая для получения электронов, значительно выше по сравнению с энергией, необходимой для потери электронов. В результате элементы в левой части периодической таблицы обычно теряют электроны при образовании связей. И наоборот, элементы в правой части таблицы Менделеева более энергоэффективны в получении электронов для создания полной валентной оболочки из 8 электронов.Природа электроотрицательности эффективно описывается таким образом: чем больше атом склонен приобретать электроны, тем больше вероятность, что атом будет притягивать электроны к себе.
- Слева направо через период элементов электроотрицательность увеличивается. Если валентная оболочка атома заполнена менее чем наполовину, для потери электрона требуется меньше энергии, чем для его получения.
 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один. - Сверху вниз по группе электроотрицательность уменьшается. Это связано с тем, что атомный номер увеличивается вниз по группе, и, следовательно, увеличивается расстояние между валентными электронами и ядром или увеличивается атомный радиус.
- Важными исключениями из приведенных выше правил являются благородные газы, лантаноиды и актиниды. Благородные газы обладают полной валентной оболочкой и обычно не притягивают электроны. Лантаноиды и актиниды обладают более сложным химическим составом, в котором обычно не наблюдается каких-либо тенденций.Следовательно, благородные газы, лантаноиды и актиниды не имеют значений электроотрицательности.
- Что касается переходных металлов, хотя у них есть значения электроотрицательности, между ними существует небольшая разница по периоду и вверх и вниз по группе.
 Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Согласно этим двум общим тенденциям наиболее электроотрицательным элементом является фтор , с 3.98 единиц Полинга.
Рисунок \ (\ PageIndex {2} \): Периодическая таблица, показывающая тенденцию электроотрицательностиТенденции энергии ионизации
Энергия ионизации — это энергия, необходимая для удаления электрона из нейтрального атома в его газовой фазе. Концептуально энергия ионизации противоположна электроотрицательности. Чем ниже эта энергия, тем легче атом становится катионом. Следовательно, чем выше эта энергия, тем меньше вероятность превращения атома в катион. Как правило, элементы в правой части таблицы Менделеева имеют более высокую энергию ионизации, потому что их валентная оболочка почти заполнена.Элементы в левой части таблицы Менделеева имеют низкую энергию ионизации из-за их готовности терять электроны и становиться катионами. Таким образом, энергия ионизации увеличивается слева направо в периодической таблице.
Таким образом, энергия ионизации увеличивается слева направо в периодической таблице.
Еще одним фактором, влияющим на энергию ионизации, является электронное экранирование . Электронная защита описывает способность внутренних электронов атома защищать положительно заряженное ядро от валентных электронов.При перемещении вправо от точки количество электронов увеличивается, а сила экранирования увеличивается. В результате электронам валентной оболочки легче ионизоваться, и, таким образом, энергия ионизации уменьшается вниз по группе. Электронное экранирование также известно как экранирование .
Тенденции
- Энергия ионизации элементов в течение периода обычно увеличивается слева направо. Это связано с стабильностью валентной оболочки.
- Энергия ионизации элементов в группе обычно уменьшается сверху вниз.Это происходит из-за электронного экранирования.

- Благородные газы обладают очень высокой энергией ионизации из-за их полных валентных оболочек, как показано на графике. Обратите внимание, что гелий имеет самую высокую энергию ионизации из всех элементов.
Некоторые элементы имеют несколько энергий ионизации; эти различные энергии называются первой энергией ионизации, второй энергией ионизации, третьей энергией ионизации и т. д. Первая энергия ионизации — это энергия, необходимая для удаления электрона с наиболее удаленной или самой высокой энергией, вторая энергия ионизации — это энергия, необходимая для удалить любой последующий электрон высокой энергии из газообразного катиона и т. д.- \]
Как правило, любые последующие энергии ионизации (2-я, 3-я и т.д.) следуют той же периодической тенденции, что и первая энергия ионизации.
Рисунок \ (\ PageIndex {4} \): Периодическая таблица, показывающая тренд энергии ионизации Энергии ионизации уменьшаются с увеличением радиуса атомов. На это наблюдение влияют \ (n \) (главное квантовое число) и \ (Z_ {eff} \) (основанное на атомном номере и показывает, сколько протонов видно в атоме) на энергию ионизации (I).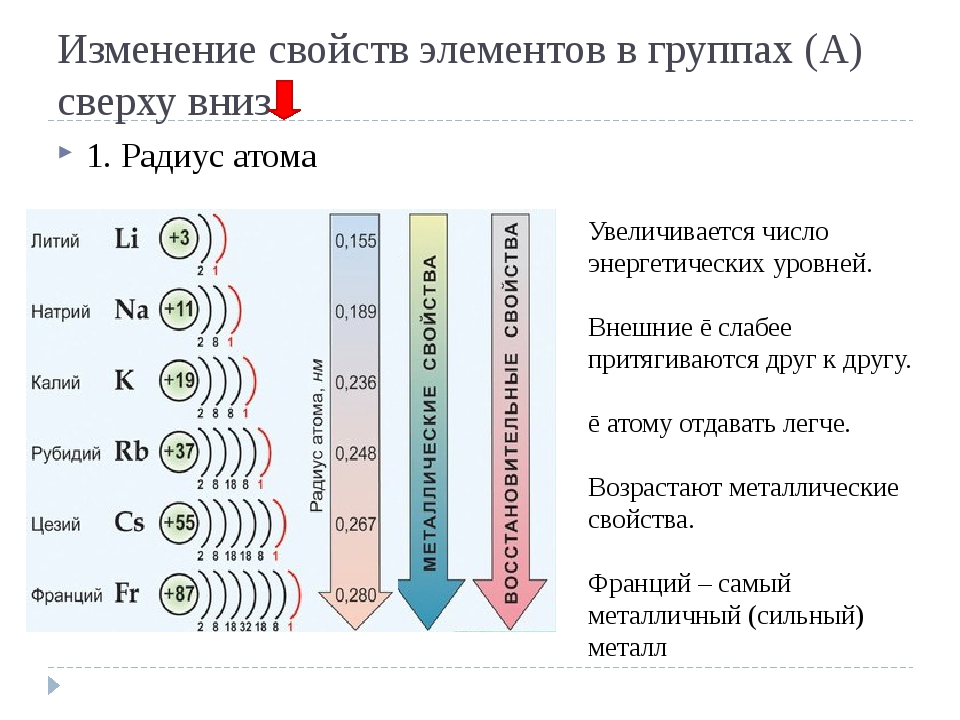 2} \]
2} \]
- За период \ (Z_ {eff} \) увеличивается на , а n (главное квантовое число) остается тем же , поэтому энергия ионизации увеличивается на .
- Вниз по группе \ (n \) увеличивает и \ (Z_ {eff} \) немного увеличивает ; энергия ионизации уменьшается .
Тенденции сродства электронов
Как следует из названия, сродство к электрону — это способность атома принимать электрон. В отличие от электроотрицательности, сродство к электрону — это количественное измерение изменения энергии, которое происходит, когда электрон присоединяется к нейтральному атому газа. Чем отрицательнее значение сродства к электрону, тем выше сродство атома к электронам.
Рисунок \ (\ PageIndex {5} \): Периодическая таблица, показывающая тенденцию сродства к электрону Сродство к электрону обычно уменьшается вниз по группе элементов, потому что каждый атом больше, чем атом над ним (это тенденция атомного радиуса, обсуждаемая ниже).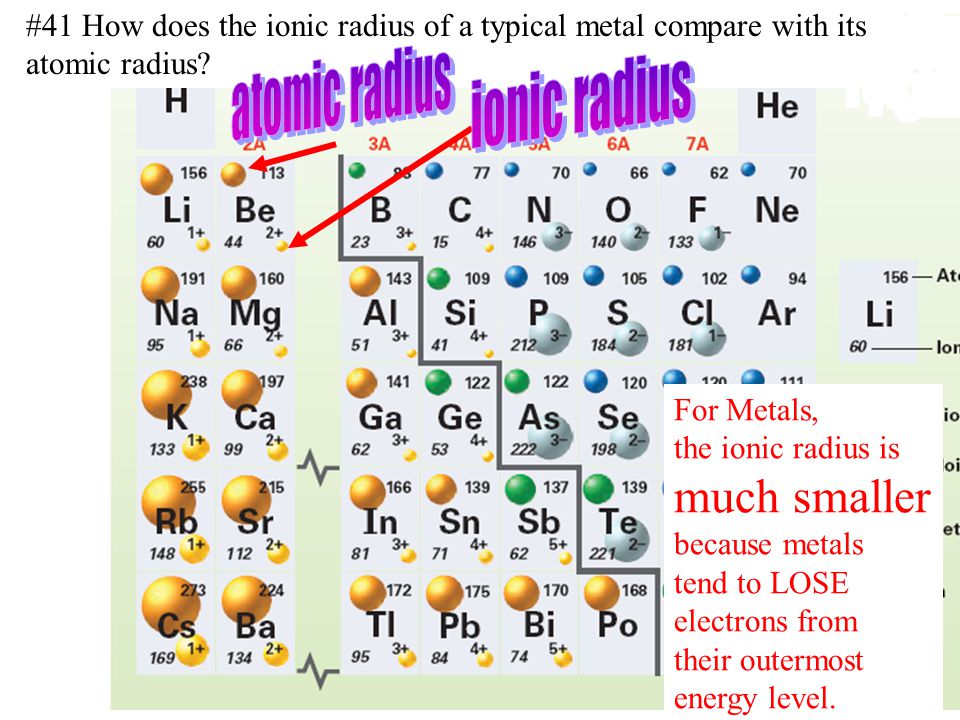 Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. Чем больше расстояние между отрицательно заряженным электроном и положительно заряженным ядром, сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо через период, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону слева направо через период.
Это означает, что добавленный электрон находится дальше от ядра атома по сравнению с его положением в меньшем атоме. Чем больше расстояние между отрицательно заряженным электроном и положительно заряженным ядром, сила притяжения относительно слабее.Следовательно, сродство к электрону уменьшается. Двигаясь слева направо через период, атомы становятся меньше по мере того, как силы притяжения становятся сильнее. Это заставляет электрон приближаться к ядру, тем самым увеличивая сродство к электрону слева направо через период.
- Сродство к электрону увеличивается слева направо в течение периода. Это вызвано уменьшением атомного радиуса.
- Сродство к электрону уменьшается сверху вниз внутри группы. Это вызвано увеличением атомного радиуса.
Тенденции атомного радиуса
Атомный радиус составляет половину расстояния между ядрами двух атомов (точно так же, как радиус равен половине диаметра круга). Однако эта идея осложняется тем фактом, что не все атомы обычно связаны друг с другом одинаково.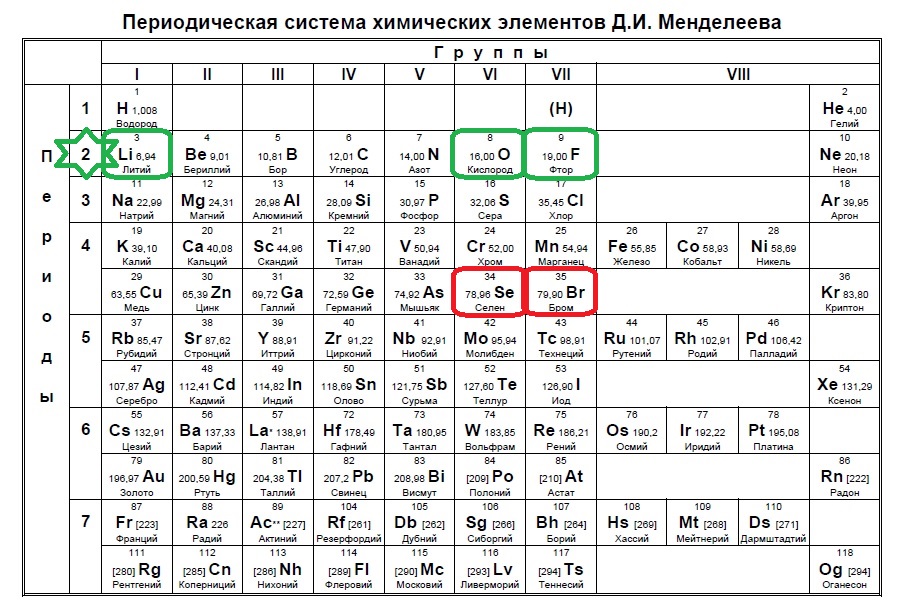 Некоторые из них связаны ковалентными связями в молекулах, некоторые притягиваются друг к другу в ионных кристаллах, а другие удерживаются в металлических кристаллах. Тем не менее, подавляющее большинство элементов может образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Структуры атомных радиусов наблюдаются по всей периодической таблице.
Некоторые из них связаны ковалентными связями в молекулах, некоторые притягиваются друг к другу в ионных кристаллах, а другие удерживаются в металлических кристаллах. Тем не менее, подавляющее большинство элементов может образовывать ковалентные молекулы, в которых два одинаковых атома удерживаются вместе одной ковалентной связью.Ковалентные радиусы этих молекул часто называют атомными радиусами. Это расстояние измеряется в пикометрах. Структуры атомных радиусов наблюдаются по всей периодической таблице.
Размер атома постепенно уменьшается слева направо через период элементов. Это связано с тем, что в пределах периода или семейства элементов все электроны добавляются к одной и той же оболочке. Однако в то же время к ядру добавляются протоны, что делает его более заряженным. Эффект увеличения числа протонов больше, чем эффект увеличения числа электронов; следовательно, существует большее ядерное притяжение.Это означает, что ядро сильнее притягивает электроны, притягивая оболочку атома ближе к ядру.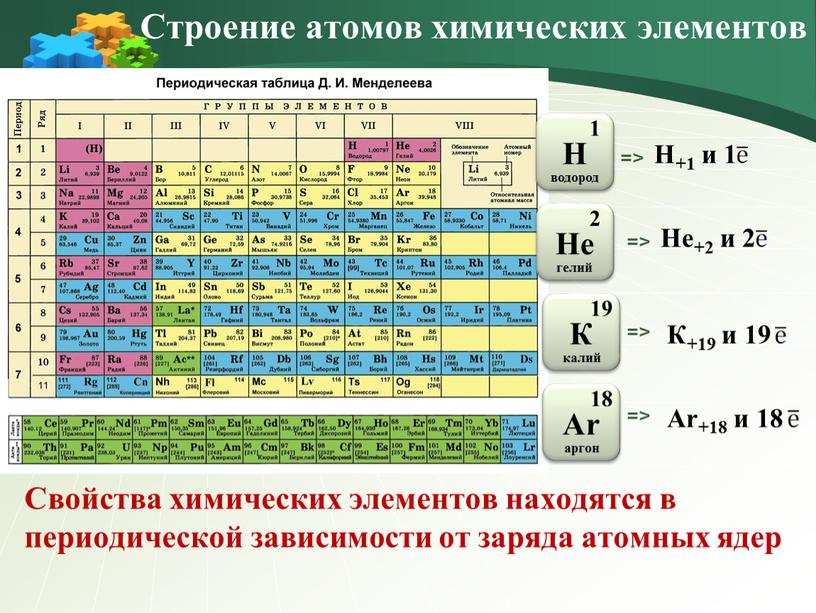 Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
Валентные электроны удерживаются ближе к ядру атома. В результате атомный радиус уменьшается.
D собственное группа, атомный радиус увеличивается. Валентные электроны занимают более высокие уровни из-за увеличения квантового числа (n). В результате валентные электроны удаляются от ядра по мере увеличения «n».Электронная защита предотвращает притяжение этих внешних электронов к ядру; таким образом, они удерживаются слабо, и результирующий атомный радиус велик.
- Атомный радиус уменьшается на слева направо за период. Это вызвано увеличением на числа протонов и электронов за период на . Один протон имеет большее влияние, чем один электрон; таким образом, электроны притягиваются к ядру, что приводит к меньшему радиусу.
- Атомный радиус увеличивается на сверху вниз внутри группы.Это вызвано электронной защитой.

Тенденции температуры плавления
Точки плавления — это количество энергии, необходимое для разрыва связи (ей), чтобы преобразовать твердую фазу вещества в жидкость. Как правило, чем сильнее связь между атомами элемента, тем больше энергии требуется для разрыва этой связи. Поскольку температура прямо пропорциональна энергии, высокая энергия диссоциации связи коррелирует с высокой температурой. Температуры плавления различны и обычно не образуют заметной тенденции в периодической таблице.Однако определенные выводы можно сделать из рисунка \ (\ PageIndex {7} \).
- Металлы обычно имеют высокую температуру плавления .
- Большинство неметаллов обладают низкой температурой плавления .
- Неметаллический углерод имеет самую высокую температуру плавления среди всех элементов . Полуметаллический бор также обладает высокой температурой плавления.
Тенденции металлических характеристик
Металлический характер элемента можно определить по тому, насколько легко атом может потерять электрон. Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер увеличивается по мере продвижения вниз по группе, потому что атомный размер увеличивается. Когда размер атома увеличивается, внешние оболочки удаляются дальше. Главное квантовое число увеличивается, а средняя электронная плотность удаляется от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
Справа налево по периоду металлический характер усиливается, потому что притяжение между валентным электроном и ядром слабее, что облегчает потерю электронов. Металлический характер увеличивается по мере продвижения вниз по группе, потому что атомный размер увеличивается. Когда размер атома увеличивается, внешние оболочки удаляются дальше. Главное квантовое число увеличивается, а средняя электронная плотность удаляется от ядра. Электроны валентной оболочки имеют меньшее притяжение к ядру и, как следствие, могут легче терять электроны.Это вызывает усиление металлического характера.
- Металлические характеристики снижаются слева направо в течение периода. Это вызвано уменьшением радиуса (вызванным Z eff , как указано выше) атома, что позволяет внешним электронам ионизироваться легче.
- Металлические характеристики повышаются на группу. Экранирование электронов приводит к увеличению атомного радиуса, поэтому внешние электроны ионизируются легче, чем электроны в более мелких атомах.

- Металлический характер относится к способности терять электроны, а неметаллический характер относится к способности приобретать электроны.
Еще один более простой способ запомнить тенденцию к металлическому характеру — это движение влево и вниз к нижнему левому углу таблицы Менделеева, металлический характер усиливается к группам 1 и 2 или к группе металлов щелочных и щелочноземельных металлов. Аналогичным образом, двигаясь вверх и вправо к верхнему правому углу таблицы Менделеева, металлический характер уменьшается, потому что вы проходите с правой стороны лестницы, которая указывает на неметаллы .К ним относятся группа 8, благородные газы , и другие распространенные газы, такие как кислород и азот.
- Другими словами:
- Перемещение влево через точку и вниз по группе: усиление металлического характера (в сторону щелочных и щелочных металлов)
- Двигаться вправо через период и вверх по группе: уменьшить металлический характер (в сторону неметаллов, таких как благородные газы)
Проблемы
В следующей серии задач рассматривается общее понимание вышеупомянутого материала.
1. Исходя из периодических тенденций изменения энергии ионизации, какой элемент имеет самую высокую энергию ионизации?
- Фтор (F)
- Азот (N)
- Гелий (He)
2.) Азот имеет больший атомный радиус, чем кислород.
- A.) Верно
- B.) Неверно
3.) Что имеет более металлический характер: свинец (Pb) или олово (Sn)?
4.) Какой элемент имеет более высокую температуру плавления: хлор (Cl) или бром (Br)?
5.) Какой элемент более электроотрицателен, сера (S) или селен (Se)?
6) Почему значение электроотрицательности большинства благородных газов равно нулю?
7) Расположите эти атомы в порядке уменьшения эффективного заряда ядра валентными электронами: Si, Al, Mg, S
8) Перепишите следующий список в порядке уменьшения сродства к электрону: фтор (F), фосфор (P), сера (S), бор (B).
9) Атом с атомным радиусом меньше, чем у серы (S), __________.
- A.) Кислород (O)
- Б.) Хлор (Cl)
- C.) Кальций (Ca)
- D.) Литий (Li)
- E.) Ничего из вышеперечисленного
10) Неметалл имеет меньший ионный радиус по сравнению с металлом того же периода.
- A.) Верно B.) Неверно
Решения
1. Ответ: C.) Гелий (He)
Пояснение: Гелий (He) имеет самую высокую энергию ионизации, потому что, как и другие благородные газы, валентная оболочка гелия заполнена.Следовательно, гелий стабилен и не теряет и не приобретает электроны.
2. Ответ: A.) Верно
Объяснение: Атомный радиус увеличивается справа налево в периодической таблице. Следовательно, азот больше кислорода.
3. Ответ: Свинец (Pb)
Пояснение: Свинец и олово находятся в одном столбце. Металлический характер увеличивается вниз по колонке. Свинец находится под оловом, поэтому он имеет более металлический характер.
4. Ответ: Бром (Br)
Пояснение: У неметаллов температура плавления увеличивается вниз по столбцу. Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
Поскольку хлор и бром находятся в одной колонке, бром имеет более высокую температуру плавления.
5. Ответ: Сера (S)
Пояснение: Обратите внимание, что сера и селен находятся в одном столбце. Электроотрицательность увеличивается на столбец. Это указывает на то, что сера более электроотрицательна, чем селен.
6. Ответ: Большинство благородных газов имеют полновалентные оболочки.
Пояснение: Благодаря своей полной валентной электронной оболочке благородные газы чрезвычайно стабильны и с трудом теряют или приобретают электроны.
7. Ответ: S> Si> Al> Mg.
Пояснение: Электроны над закрытой оболочкой защищены закрытой оболочкой. S имеет 6 электронов над закрытой оболочкой, поэтому каждый из них ощущает притяжение 6 протонов в ядре.
8. Ответ: Фтор (F)> Сера (S)> Фосфор (P)> Бор (B)
Объяснение: Сродство к электрону обычно увеличивается слева направо и снизу вверх.
9. Ответ: C.) Кислород (O)
Пояснение: Периодические тенденции показывают, что атомный радиус увеличивается вверх по группе и слева направо в течение периода. Следовательно, кислород имеет меньший атомный радиус серы.
Следовательно, кислород имеет меньший атомный радиус серы.
10. Ответ: B.) Неверно
Объяснение: Причина этого заключается в том, что металл обычно теряет электрон, становясь ионом, в то время как неметалл получает электрон. Это приводит к меньшему ионному радиусу для иона металла и большему ионному радиусу для иона неметалла.
Ссылки
- Пинто, Габриэль. «Использование мячей различных видов спорта для моделирования изменения атомных размеров». Дж.Chem. Educ. 1998 75 725. {cke_protected} {C}
- Куреши, Пушкин М .; Камоонпури, С. Икбал М. «Ионная сольватация: проблема ионных радиусов». J. Chem. Educ. 1991 , 68 , 109.
- Смит, Дерек У. «Энтальпии атомизации металлических элементарных веществ с использованием полуколичественной теории ионных твердых тел: простая модель для рационализации периодических тенденций». J. Chem. Educ. 1993 , 70 , 368.

- Руссо, Стив и Майк Сильвер. Вводная химия. Сан-Франциско: Пирсон, 2007. .
- Петруччи, Ральф Х. и др. Общая химия: принципы и современные приложения. 9-е изд. Нью-Джерси: Пирсон, 2007.
- Аткинс, Питер и др. др., Physical Chemistry , 7 th Edition, 2002, W.H Freeman and Company, New York, pg. 390.
- Олберти, Роберт А. и др. al, Physical Chemistry , 3 rd Edition, 2001, John Wiley & Sons, Inc., стр.380.
- Kots, John C. et. al, Chemistry & Chemical Reactivity , 5 th Edition, 2003, Thomson Learning Inc, стр. 305-309.
Авторы и авторство
- Света Рамиредди (UCD), Бинъяо Чжэн (UCD), Эмили Нгуен (UCD)
% PDF-1.4
%
1 0 obj
>
endobj
2 0 obj
>
endobj
3 0 obj
>
endobj
4 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
endobj
5 0 obj
>
/Шрифт
>
>>
/Группа
>
>>
endobj
6 0 obj
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
endobj
7 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
endobj
8 0 объект
>
/Шрифт
>
/ XObject
>
>>
/Группа
>
>>
endobj
9 0 объект
>
ручей
конечный поток
endobj
10 0 obj
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
0 12.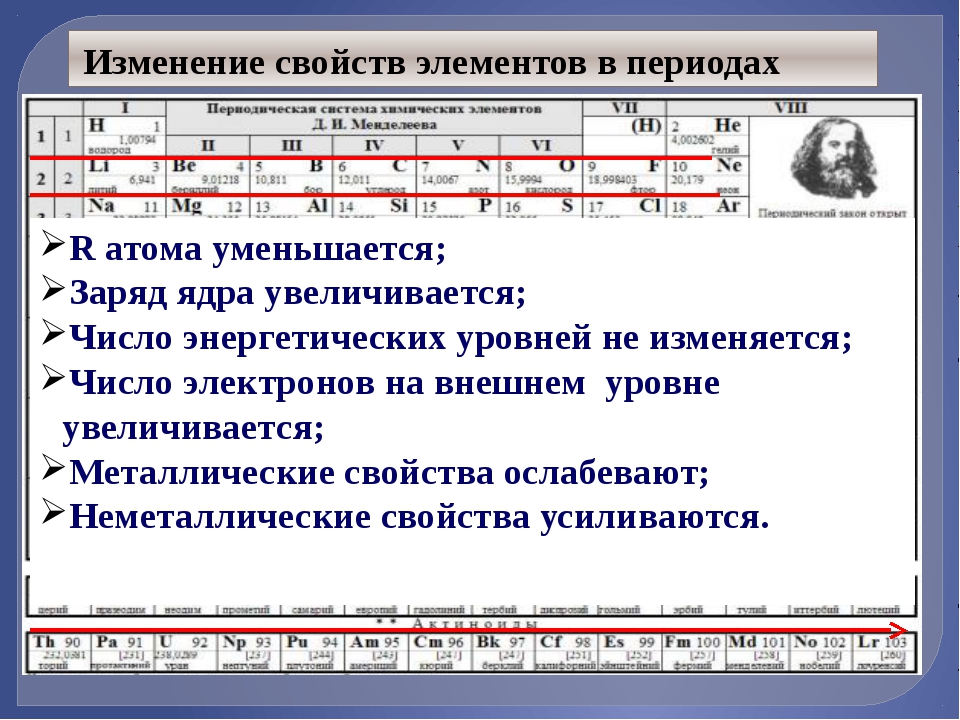 4756 тд тдж
ET
Q
Q
конечный поток
endobj
11 0 объект
>
endobj
12 0 объект
>
endobj
13 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
48 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
14 0 объект
>
/ FontDescriptor 12 0 R
/ BaseFont / HFCZCC + TimesNewRoman, полужирный
/ Вт [3 [250] 12 [333] 15 [250] 16 [333] 17 [250] 20 [500] 21 [500] 22 [500] 23 [500] 24 [500] 25 [500] 36 [722] ] 37 [666] 38 [722] 39 [722] 41 [610] 43 [777] 46 [777] 49 [722] 51 [610] 53 [722] 54 [556] 55 [666] 66 [500] 68 [500] 69 [556] 70 [443] 71 [556] 72 [443] 73 [333] 74 [500] 75 [556] 76 [277] 79 [277] 80 [833] 81 [556] 82 [500 ] 83 [556] 85 [443] 86 [389] 87 [333] 88 [556] 89 [500] 90 [722] 91 [500] 92 [500] 93 [443] 177 [500]]
>>
endobj
15 0 объект
>
endobj
16 0 объект
>
ручей
конечный поток
endobj
17 0 объект
>
ручей
конечный поток
endobj
18 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
458.
4756 тд тдж
ET
Q
Q
конечный поток
endobj
11 0 объект
>
endobj
12 0 объект
>
endobj
13 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
48 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
14 0 объект
>
/ FontDescriptor 12 0 R
/ BaseFont / HFCZCC + TimesNewRoman, полужирный
/ Вт [3 [250] 12 [333] 15 [250] 16 [333] 17 [250] 20 [500] 21 [500] 22 [500] 23 [500] 24 [500] 25 [500] 36 [722] ] 37 [666] 38 [722] 39 [722] 41 [610] 43 [777] 46 [777] 49 [722] 51 [610] 53 [722] 54 [556] 55 [666] 66 [500] 68 [500] 69 [556] 70 [443] 71 [556] 72 [443] 73 [333] 74 [500] 75 [556] 76 [277] 79 [277] 80 [833] 81 [556] 82 [500 ] 83 [556] 85 [443] 86 [389] 87 [333] 88 [556] 89 [500] 90 [722] 91 [500] 92 [500] 93 [443] 177 [500]]
>>
endobj
15 0 объект
>
endobj
16 0 объект
>
ручей
конечный поток
endobj
17 0 объект
>
ручей
конечный поток
endobj
18 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -14 Тс
458.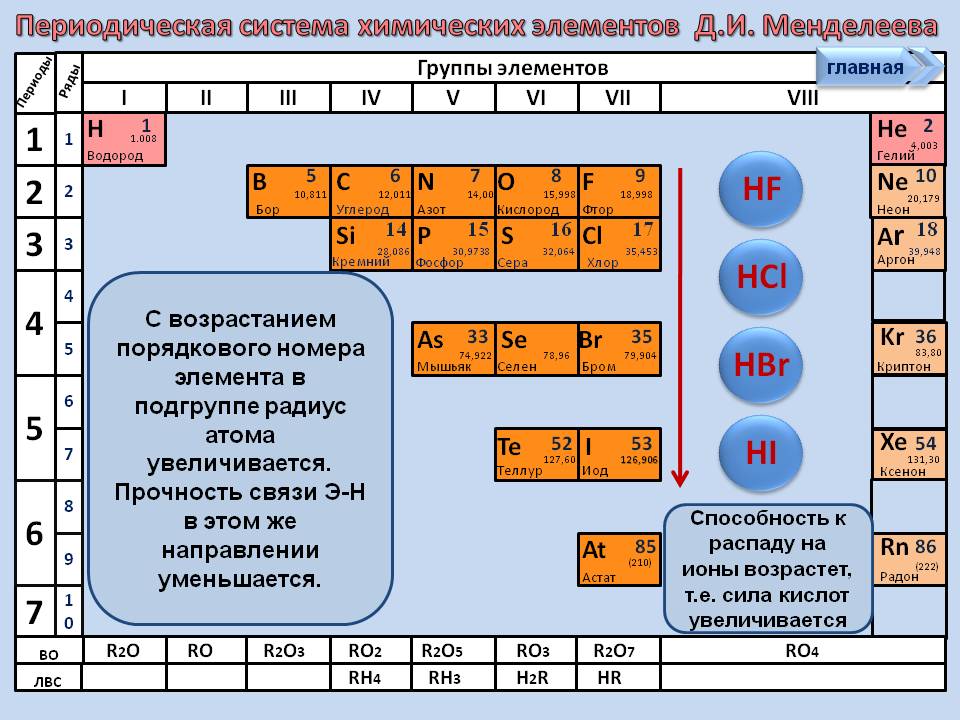 25 12,4756 тд тдж
ET
Q
Q
конечный поток
endobj
19 0 объект
>
ручей
конечный поток
endobj
20 0 объект
>
ручей
конечный поток
endobj
21 0 объект
>
ручей
конечный поток
endobj
22 0 объект
>
ручей
конечный поток
endobj
23 0 объект
>
ручей
конечный поток
endobj
24 0 объект
>
ручей
конечный поток
endobj
25 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
26 0 объект
>
endobj
27 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
6 43,5 м
606 43,5 л
S
Q
Q
конечный поток
endobj
28 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1.1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
6 767,25 м
606 767,25 л
S
Q
Q
конечный поток
endobj
29 0 объект
>
ручей
конечный поток
endobj
30 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
31 0 объект
>
endobj
32 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
65 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
33 0 объект
>
/ FontDescriptor 31 0 R
/ BaseFont / CQFCBH + TimesNewRoman
/ Вт [3 [250] 12 [333] 14 [563] 15 [250] 16 [333] 17 [250] 18 [277] 19 [500] 20 [500] 21 [500] 22 [500] 23 [500] ] 24 [500] 25 [500] 26 [500] 27 [500] 28 [500] 29 [277] 32 [563] 34 [443] 36 [722] 37 [666] 38 [666] 39 [722] 40 [610] 42 [722] 44 [333] 46 [722] 47 [610] 48 [889] 49 [722] 50 [722] 51 [556] 53 [666] 54 [556] 55 [610] 56 [722] ] 58 [943] 60 [722] 68 [443] 69 [500] 70 [443] 71 [500] 72 [443] 73 [333] 74 [500] 75 [500] 76 [277] 78 [500] 79 [277] 80 [777] 81 [500] 82 [500] 83 [500] 84 [500] 85 [333] 86 [389] 87 [277] 88 [500] 89 [500] 90 [722] 91 [500] ] 92 [500] 93 [443] 177 [500]]
>>
endobj
34 0 объект
>
endobj
35 0 объект
>
ручей
конечный поток
endobj
36 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75.
25 12,4756 тд тдж
ET
Q
Q
конечный поток
endobj
19 0 объект
>
ручей
конечный поток
endobj
20 0 объект
>
ручей
конечный поток
endobj
21 0 объект
>
ручей
конечный поток
endobj
22 0 объект
>
ручей
конечный поток
endobj
23 0 объект
>
ручей
конечный поток
endobj
24 0 объект
>
ручей
конечный поток
endobj
25 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
26 0 объект
>
endobj
27 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1,1 Вт
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
6 43,5 м
606 43,5 л
S
Q
Q
конечный поток
endobj
28 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1.1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
6 767,25 м
606 767,25 л
S
Q
Q
конечный поток
endobj
29 0 объект
>
ручей
конечный поток
endobj
30 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
31 0 объект
>
endobj
32 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
65 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
33 0 объект
>
/ FontDescriptor 31 0 R
/ BaseFont / CQFCBH + TimesNewRoman
/ Вт [3 [250] 12 [333] 14 [563] 15 [250] 16 [333] 17 [250] 18 [277] 19 [500] 20 [500] 21 [500] 22 [500] 23 [500] ] 24 [500] 25 [500] 26 [500] 27 [500] 28 [500] 29 [277] 32 [563] 34 [443] 36 [722] 37 [666] 38 [666] 39 [722] 40 [610] 42 [722] 44 [333] 46 [722] 47 [610] 48 [889] 49 [722] 50 [722] 51 [556] 53 [666] 54 [556] 55 [610] 56 [722] ] 58 [943] 60 [722] 68 [443] 69 [500] 70 [443] 71 [500] 72 [443] 73 [333] 74 [500] 75 [500] 76 [277] 78 [500] 79 [277] 80 [777] 81 [500] 82 [500] 83 [500] 84 [500] 85 [333] 86 [389] 87 [277] 88 [500] 89 [500] 90 [722] 91 [500] ] 92 [500] 93 [443] 177 [500]]
>>
endobj
34 0 объект
>
endobj
35 0 объект
>
ручей
конечный поток
endobj
36 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75. 75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
37 0 объект
>
ручей
конечный поток
endobj
38 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 95,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
39 0 объект
>
endobj
40 0 obj
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
18 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
41 0 объект
>
/ FontDescriptor 39 0 R
/ BaseFont / HBFJPX + TimesNewRoman, курсив
/ Вт [3 [250] 36 [610] 37 [610] 39 [722] 68 [500] 69 [500] 70 [443] 71 [500] 72 [443] 75 [500] 79 [277] 80 [722] ] 81 [500] 82 [500] 83 [500] 85 [389] 86 [389] 87 [277]]
>>
endobj
42 0 объект
>
endobj
43 0 объект
>
ручей
конечный поток
endobj
44 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
106.5 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
45 0 объект
>
ручей
конечный поток
endobj
46 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
124,5 95,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
47 0 объект
>
ручей
конечный поток
endobj
48 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
131,25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
49 0 объект
>
ручей
конечный поток
endobj
50 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
155,25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
51 0 объект
>
ручей
конечный поток
endobj
52 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
173.
75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
37 0 объект
>
ручей
конечный поток
endobj
38 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 95,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
39 0 объект
>
endobj
40 0 obj
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
18 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
41 0 объект
>
/ FontDescriptor 39 0 R
/ BaseFont / HBFJPX + TimesNewRoman, курсив
/ Вт [3 [250] 36 [610] 37 [610] 39 [722] 68 [500] 69 [500] 70 [443] 71 [500] 72 [443] 75 [500] 79 [277] 80 [722] ] 81 [500] 82 [500] 83 [500] 85 [389] 86 [389] 87 [277]]
>>
endobj
42 0 объект
>
endobj
43 0 объект
>
ручей
конечный поток
endobj
44 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
106.5 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
45 0 объект
>
ручей
конечный поток
endobj
46 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
124,5 95,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
47 0 объект
>
ручей
конечный поток
endobj
48 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
131,25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
49 0 объект
>
ручей
конечный поток
endobj
50 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
155,25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
51 0 объект
>
ручей
конечный поток
endobj
52 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
173. 25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
53 0 объект
>
ручей
конечный поток
endobj
54 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
180 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
55 0 объект
>
endobj
56 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
3 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
57 0 объект
>
/ FontDescriptor 55 0 R
/ BaseFont / JBKBKL + TimesNewRoman, BoldItalic
/ Вт [40 [666] 83 [500] 86 [389]]
>>
endobj
58 0 объект
>
endobj
59 0 объект
>
ручей
конечный поток
endobj
60 0 obj
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
204 95.4434 тд тдж
ET
Q
Q
конечный поток
endobj
61 0 объект
>
ручей
конечный поток
endobj
62 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
222 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
63 0 объект
>
ручей
конечный поток
endobj
64 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
228,75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
65 0 объект
>
ручей
конечный поток
endobj
66 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 60.
25 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
53 0 объект
>
ручей
конечный поток
endobj
54 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
180 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
55 0 объект
>
endobj
56 0 объект
>
ручей
/ CIDInit / ProcSet findresource begin
12 дикт начать
begincmap
/ CIDSystemInfo> def
/ CMapName / Adobe-Identity-UCS def / CMapType 2 def
1 начало кода endcodespacerange
3 начало конец
endcmap CMapName currentdict / CMap defineresource pop end end
конечный поток
endobj
57 0 объект
>
/ FontDescriptor 55 0 R
/ BaseFont / JBKBKL + TimesNewRoman, BoldItalic
/ Вт [40 [666] 83 [500] 86 [389]]
>>
endobj
58 0 объект
>
endobj
59 0 объект
>
ручей
конечный поток
endobj
60 0 obj
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
204 95.4434 тд тдж
ET
Q
Q
конечный поток
endobj
61 0 объект
>
ручей
конечный поток
endobj
62 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
222 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
63 0 объект
>
ручей
конечный поток
endobj
64 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
228,75 95,4434 тд тдж
ET
Q
Q
конечный поток
endobj
65 0 объект
>
ручей
конечный поток
endobj
66 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 60. 1934 Td Tj
ET
Q
Q
конечный поток
endobj
67 0 объект
>
ручей
конечный поток
endobj
68 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 60.1934 Td Tj
ET
Q
Q
конечный поток
endobj
69 0 объект
>
ручей
конечный поток
endobj
70 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 74,4434 тд тдж
ET
Q
Q
конечный поток
endobj
71 0 объект
>
ручей
конечный поток
endobj
72 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
192,75 74,4434 тд тдж
ET
Q
Q
конечный поток
endobj
73 0 объект
>
ручей
конечный поток
endobj
74 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
199,5 74,4434 Td Tj
ET
Q
Q
конечный поток
endobj
75 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
76 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
15 66 кв.м.
39 66 л
S
Q
Q
конечный поток
endobj
77 0 объект
>
ручей
конечный поток
endobj
78 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.
1934 Td Tj
ET
Q
Q
конечный поток
endobj
67 0 объект
>
ручей
конечный поток
endobj
68 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 60.1934 Td Tj
ET
Q
Q
конечный поток
endobj
69 0 объект
>
ручей
конечный поток
endobj
70 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 74,4434 тд тдж
ET
Q
Q
конечный поток
endobj
71 0 объект
>
ручей
конечный поток
endobj
72 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
192,75 74,4434 тд тдж
ET
Q
Q
конечный поток
endobj
73 0 объект
>
ручей
конечный поток
endobj
74 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
199,5 74,4434 Td Tj
ET
Q
Q
конечный поток
endobj
75 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
76 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
15 66 кв.м.
39 66 л
S
Q
Q
конечный поток
endobj
77 0 объект
>
ручей
конечный поток
endobj
78 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.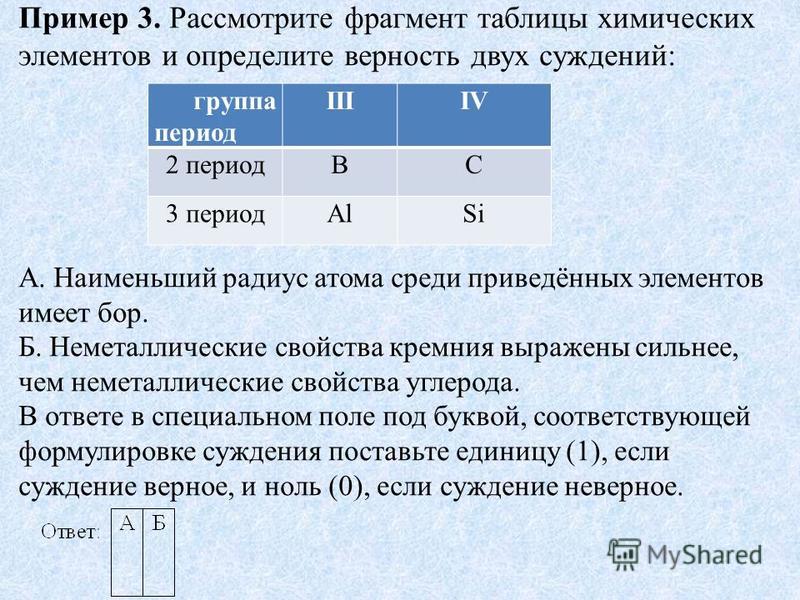 75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
79 0 объект
>
ручей
конечный поток
endobj
80 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75,75 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
81 0 объект
>
ручей
конечный поток
endobj
82 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
83 0 объект
>
ручей
конечный поток
endobj
84 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
87,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
85 0 объект
>
ручей
конечный поток
endobj
86 0 объект
>
ручей
конечный поток
endobj
87 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
92.25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
88 0 объект
>
ручей
конечный поток
endobj
89 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
99 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
90 0 объект
>
ручей
конечный поток
endobj
91 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
104,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
92 0 объект
>
ручей
конечный поток
endobj
93 0 объект
>
ручей
конечный поток
endobj
94 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
108.
75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
79 0 объект
>
ручей
конечный поток
endobj
80 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75,75 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
81 0 объект
>
ручей
конечный поток
endobj
82 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
83 0 объект
>
ручей
конечный поток
endobj
84 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
87,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
85 0 объект
>
ручей
конечный поток
endobj
86 0 объект
>
ручей
конечный поток
endobj
87 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
92.25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
88 0 объект
>
ручей
конечный поток
endobj
89 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
99 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
90 0 объект
>
ручей
конечный поток
endobj
91 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
104,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
92 0 объект
>
ручей
конечный поток
endobj
93 0 объект
>
ручей
конечный поток
endobj
94 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
108.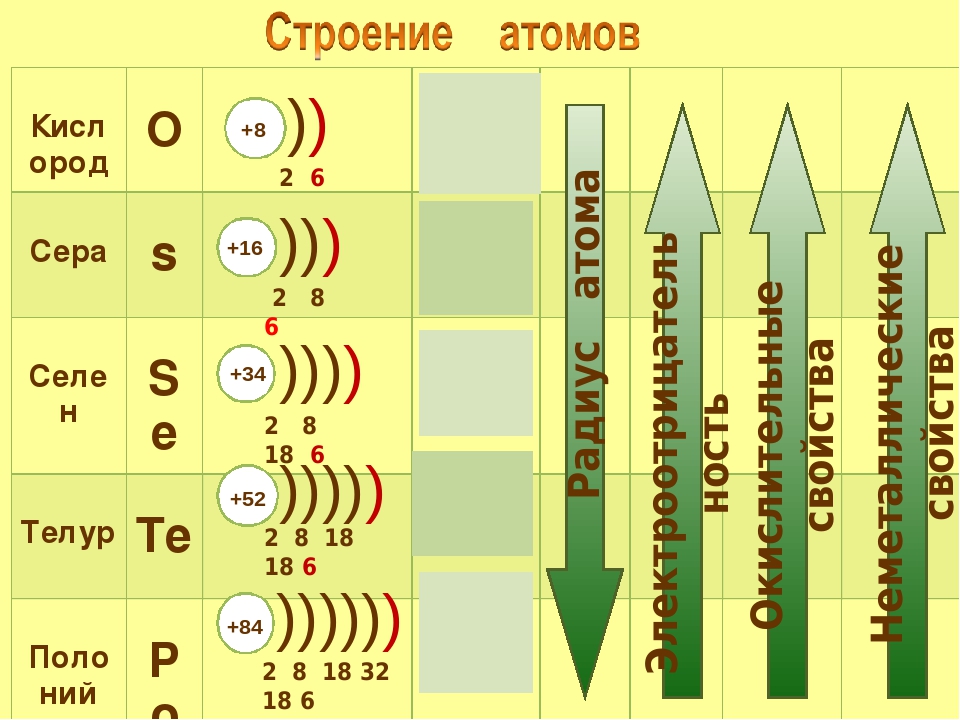 75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
95 0 объект
>
ручей
конечный поток
endobj
96 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
115,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
97 0 объект
>
ручей
конечный поток
endobj
98 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
122,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
99 0 объект
>
ручей
конечный поток
endobj
100 0 объект
>
ручей
конечный поток
endobj
101 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
126.75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
102 0 объект
>
ручей
конечный поток
endobj
103 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
133,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
104 0 объект
>
ручей
конечный поток
endobj
105 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
138,75 147,7354 Тд Тдж
ET
Q
Q
конечный поток
endobj
106 0 объект
>
ручей
конечный поток
endobj
107 0 объект
>
ручей
конечный поток
endobj
108 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
167.
75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
95 0 объект
>
ручей
конечный поток
endobj
96 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
115,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
97 0 объект
>
ручей
конечный поток
endobj
98 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
122,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
99 0 объект
>
ручей
конечный поток
endobj
100 0 объект
>
ручей
конечный поток
endobj
101 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
126.75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
102 0 объект
>
ручей
конечный поток
endobj
103 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
133,5 150,9434 Тд Тдж
ET
Q
Q
конечный поток
endobj
104 0 объект
>
ручей
конечный поток
endobj
105 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
138,75 147,7354 Тд Тдж
ET
Q
Q
конечный поток
endobj
106 0 объект
>
ручей
конечный поток
endobj
107 0 объект
>
ручей
конечный поток
endobj
108 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
167. 25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
109 0 объект
>
ручей
конечный поток
endobj
110 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
185,25 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
111 0 объект
>
ручей
конечный поток
endobj
112 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
192 150.9434 Td Tj
ET
Q
Q
конечный поток
endobj
113 0 объект
>
ручей
конечный поток
endobj
114 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
197,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
115 0 объект
>
ручей
конечный поток
endobj
116 0 объект
>
ручей
конечный поток
endobj
117 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
201.75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
118 0 объект
>
ручей
конечный поток
endobj
119 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
208,5 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
120 0 объект
>
ручей
конечный поток
endobj
121 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
213,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
122 0 объект
>
ручей
конечный поток
endobj
123 0 объект
>
ручей
конечный поток
endobj
124 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
218.
25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
109 0 объект
>
ручей
конечный поток
endobj
110 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
185,25 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
111 0 объект
>
ручей
конечный поток
endobj
112 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
192 150.9434 Td Tj
ET
Q
Q
конечный поток
endobj
113 0 объект
>
ручей
конечный поток
endobj
114 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
197,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
115 0 объект
>
ручей
конечный поток
endobj
116 0 объект
>
ручей
конечный поток
endobj
117 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
201.75 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
118 0 объект
>
ручей
конечный поток
endobj
119 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
208,5 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
120 0 объект
>
ручей
конечный поток
endobj
121 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
213,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
122 0 объект
>
ручей
конечный поток
endobj
123 0 объект
>
ручей
конечный поток
endobj
124 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
218. 25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
125 0 объект
>
ручей
конечный поток
endobj
126 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
225 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
127 0 объект
>
ручей
конечный поток
endobj
128 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
231,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
129 0 объект
>
ручей
конечный поток
endobj
130 0 объект
>
ручей
конечный поток
endobj
131 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
236.25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
132 0 объект
>
ручей
конечный поток
endobj
133 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
243 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
134 0 объект
>
ручей
конечный поток
endobj
135 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
248,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
136 0 объект
>
ручей
конечный поток
endobj
137 0 объект
>
ручей
конечный поток
endobj
138 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.
25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
125 0 объект
>
ручей
конечный поток
endobj
126 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
225 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
127 0 объект
>
ручей
конечный поток
endobj
128 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
231,75 147,7354 Td Tj
ET
Q
Q
конечный поток
endobj
129 0 объект
>
ручей
конечный поток
endobj
130 0 объект
>
ручей
конечный поток
endobj
131 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
236.25 150.9434 тд тдж
ET
Q
Q
конечный поток
endobj
132 0 объект
>
ручей
конечный поток
endobj
133 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
243 150,9434 тд тдж
ET
Q
Q
конечный поток
endobj
134 0 объект
>
ручей
конечный поток
endobj
135 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
248,25 147,7354 тд тдж
ET
Q
Q
конечный поток
endobj
136 0 объект
>
ручей
конечный поток
endobj
137 0 объект
>
ручей
конечный поток
endobj
138 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.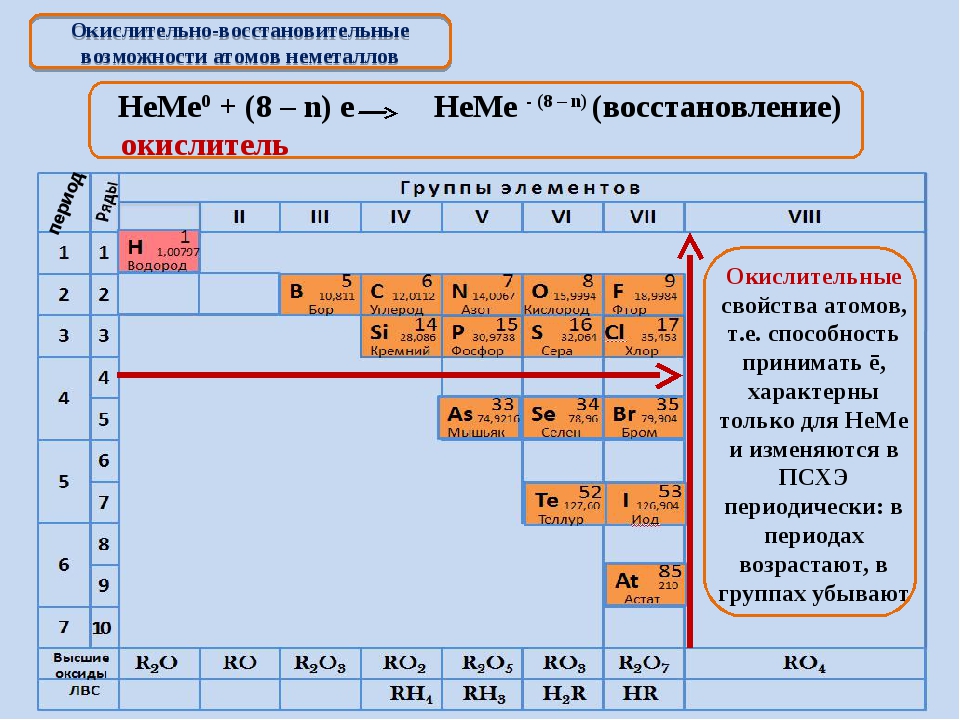 75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
139 0 объект
>
ручей
конечный поток
endobj
140 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75,75 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
141 0 объект
>
ручей
конечный поток
endobj
142 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
143 0 объект
>
ручей
конечный поток
endobj
144 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
87,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
145 0 объект
>
ручей
конечный поток
endobj
146 0 объект
>
ручей
конечный поток
endobj
147 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
92.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
148 0 объект
>
ручей
конечный поток
endobj
149 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
99 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
150 0 объект
>
ручей
конечный поток
endobj
151 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
104,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
152 0 объект
>
ручей
конечный поток
endobj
153 0 объект
>
ручей
конечный поток
endobj
154 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
108.
75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
139 0 объект
>
ручей
конечный поток
endobj
140 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
75,75 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
141 0 объект
>
ручей
конечный поток
endobj
142 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
82,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
143 0 объект
>
ручей
конечный поток
endobj
144 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
87,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
145 0 объект
>
ручей
конечный поток
endobj
146 0 объект
>
ручей
конечный поток
endobj
147 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
92.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
148 0 объект
>
ручей
конечный поток
endobj
149 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
99 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
150 0 объект
>
ручей
конечный поток
endobj
151 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
104,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
152 0 объект
>
ручей
конечный поток
endobj
153 0 объект
>
ручей
конечный поток
endobj
154 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
108. 75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
155 0 объект
>
ручей
конечный поток
endobj
156 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
115,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
157 0 объект
>
ручей
конечный поток
endobj
158 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
122,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
159 0 объект
>
ручей
конечный поток
endobj
160 0 объект
>
ручей
конечный поток
endobj
161 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
167.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
162 0 объект
>
ручей
конечный поток
endobj
163 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
185,25 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
164 0 объект
>
ручей
конечный поток
endobj
165 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
192 166.6934 Td Tj
ET
Q
Q
конечный поток
endobj
166 0 объект
>
ручей
конечный поток
endobj
167 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
197,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
168 0 объект
>
ручей
конечный поток
endobj
169 0 объект
>
ручей
конечный поток
endobj
170 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
201.
75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
155 0 объект
>
ручей
конечный поток
endobj
156 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
115,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
157 0 объект
>
ручей
конечный поток
endobj
158 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -8,4 Тс
122,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
159 0 объект
>
ручей
конечный поток
endobj
160 0 объект
>
ручей
конечный поток
endobj
161 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
167.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
162 0 объект
>
ручей
конечный поток
endobj
163 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
185,25 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
164 0 объект
>
ручей
конечный поток
endobj
165 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
192 166.6934 Td Tj
ET
Q
Q
конечный поток
endobj
166 0 объект
>
ручей
конечный поток
endobj
167 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
197,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
168 0 объект
>
ручей
конечный поток
endobj
169 0 объект
>
ручей
конечный поток
endobj
170 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
201.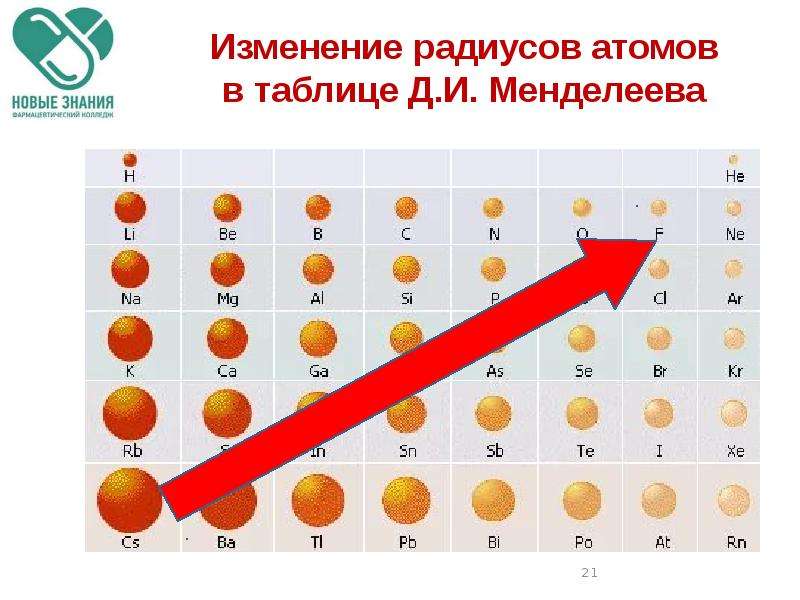 75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
171 0 объект
>
ручей
конечный поток
endobj
172 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
208,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
173 0 объект
>
ручей
конечный поток
endobj
174 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
213,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
175 0 объект
>
ручей
конечный поток
endobj
176 0 объект
>
ручей
конечный поток
endobj
177 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
218.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
178 0 объект
>
ручей
конечный поток
endobj
179 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
225 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
180 0 объект
>
ручей
конечный поток
endobj
181 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
231,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
182 0 объект
>
ручей
конечный поток
endobj
183 0 объект
>
ручей
конечный поток
endobj
184 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
236.
75 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
171 0 объект
>
ручей
конечный поток
endobj
172 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
208,5 166,6934 тд тдж
ET
Q
Q
конечный поток
endobj
173 0 объект
>
ручей
конечный поток
endobj
174 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
213,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
175 0 объект
>
ручей
конечный поток
endobj
176 0 объект
>
ручей
конечный поток
endobj
177 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
218.25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
178 0 объект
>
ручей
конечный поток
endobj
179 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
225 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
180 0 объект
>
ручей
конечный поток
endobj
181 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
231,75 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
182 0 объект
>
ручей
конечный поток
endobj
183 0 объект
>
ручей
конечный поток
endobj
184 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
236. 25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
185 0 объект
>
ручей
конечный поток
endobj
186 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
243 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
187 0 объект
>
ручей
конечный поток
endobj
188 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
248,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
189 0 объект
>
ручей
конечный поток
endobj
190 0 объект
>
ручей
конечный поток
endobj
191 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 115.6934 Td Tj
ET
Q
Q
конечный поток
endobj
192 0 объект
>
ручей
конечный поток
endobj
193 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 115,6934 тд тдж
ET
Q
Q
конечный поток
endobj
194 0 объект
>
ручей
конечный поток
endobj
195 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 129,9434 тд тдж
ET
Q
Q
конечный поток
endobj
196 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
25 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
185 0 объект
>
ручей
конечный поток
endobj
186 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
243 166.6934 тд тдж
ET
Q
Q
конечный поток
endobj
187 0 объект
>
ручей
конечный поток
endobj
188 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -8,4 Тс
248,25 163,4854 тд тдж
ET
Q
Q
конечный поток
endobj
189 0 объект
>
ручей
конечный поток
endobj
190 0 объект
>
ручей
конечный поток
endobj
191 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 115.6934 Td Tj
ET
Q
Q
конечный поток
endobj
192 0 объект
>
ручей
конечный поток
endobj
193 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 115,6934 тд тдж
ET
Q
Q
конечный поток
endobj
194 0 объект
>
ручей
конечный поток
endobj
195 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57,75 129,9434 тд тдж
ET
Q
Q
конечный поток
endobj
196 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.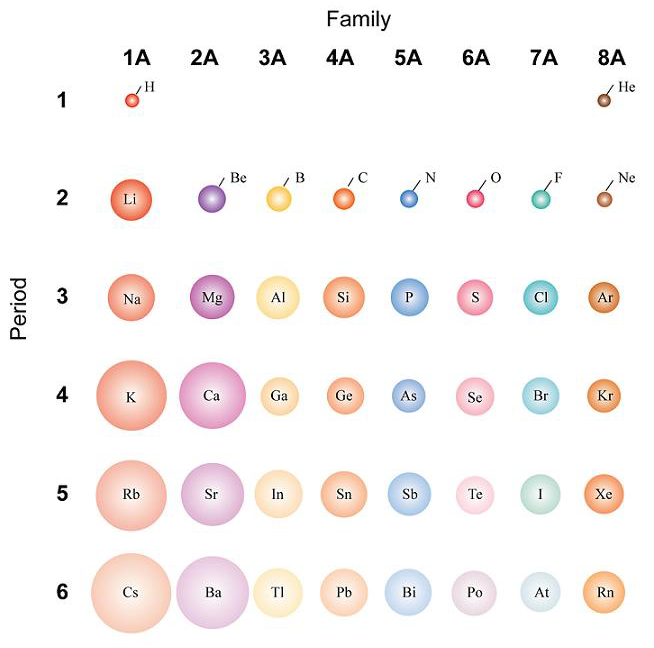 / GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
197 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
15 121.5 мес.
39 121,5 л
S
Q
Q
конечный поток
endobj
198 0 объект
>
ручей
конечный поток
endobj
199 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
200 0 объект
>
ручей
конечный поток
endobj
201 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75.75 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
202 0 объект
>
ручей
конечный поток
endobj
203 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
81 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
204 0 объект
>
ручей
конечный поток
endobj
205 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 261.9434 тд тдж
ET
Q
Q
конечный поток
endobj
206 0 объект
>
ручей
конечный поток
endobj
207 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75,75 261,9434 тд тдж
ET
Q
Q
конечный поток
endobj
208 0 объект
>
ручей
конечный поток
endobj
209 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
82,5 261,9434 тд тдж
ET
Q
Q
конечный поток
endobj
210 0 объект
>
ручей
конечный поток
endobj
211 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
57,75 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
212 0 объект
>
ручей
конечный поток
endobj
213 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
75.
/ GS1 GS
0 0 мес.
0 0 л
S
Q
Q
конечный поток
endobj
197 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
1 нед.
0 Дж
0 Дж
[] 0 дн.
/ GS1 GS
15 121.5 мес.
39 121,5 л
S
Q
Q
конечный поток
endobj
198 0 объект
>
ручей
конечный поток
endobj
199 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
200 0 объект
>
ручей
конечный поток
endobj
201 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75.75 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
202 0 объект
>
ручей
конечный поток
endobj
203 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
81 246.1934 Td Tj
ET
Q
Q
конечный поток
endobj
204 0 объект
>
ручей
конечный поток
endobj
205 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 261.9434 тд тдж
ET
Q
Q
конечный поток
endobj
206 0 объект
>
ручей
конечный поток
endobj
207 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75,75 261,9434 тд тдж
ET
Q
Q
конечный поток
endobj
208 0 объект
>
ручей
конечный поток
endobj
209 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
82,5 261,9434 тд тдж
ET
Q
Q
конечный поток
endobj
210 0 объект
>
ручей
конечный поток
endobj
211 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
57,75 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
212 0 объект
>
ручей
конечный поток
endobj
213 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
75. 75 277.6934 тд тдж
ET
Q
Q
конечный поток
endobj
214 0 объект
>
ручей
конечный поток
endobj
215 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
81 277.6934 Td Tj
ET
Q
Q
конечный поток
endobj
216 0 объект
>
ручей
конечный поток
endobj
217 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
106,5 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
218 0 объект
>
ручей
конечный поток
endobj
219 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
113,25 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
220 0 объект
>
ручей
конечный поток
endobj
221 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
222 0 объект
>
ручей
конечный поток
endobj
223 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75,75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
224 0 объект
>
ручей
конечный поток
endobj
225 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
81 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
226 0 объект
>
ручей
конечный поток
endobj
227 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
87,75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
228 0 объект
>
ручей
конечный поток
endobj
229 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
94.
75 277.6934 тд тдж
ET
Q
Q
конечный поток
endobj
214 0 объект
>
ручей
конечный поток
endobj
215 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
81 277.6934 Td Tj
ET
Q
Q
конечный поток
endobj
216 0 объект
>
ручей
конечный поток
endobj
217 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F3 -12 Тс
106,5 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
218 0 объект
>
ручей
конечный поток
endobj
219 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F0 -12 Тс
113,25 277,6934 тд тдж
ET
Q
Q
конечный поток
endobj
220 0 объект
>
ручей
конечный поток
endobj
221 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
222 0 объект
>
ручей
конечный поток
endobj
223 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
75,75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
224 0 объект
>
ручей
конечный поток
endobj
225 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
81 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
226 0 объект
>
ручей
конечный поток
endobj
227 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
87,75 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
228 0 объект
>
ручей
конечный поток
endobj
229 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
94.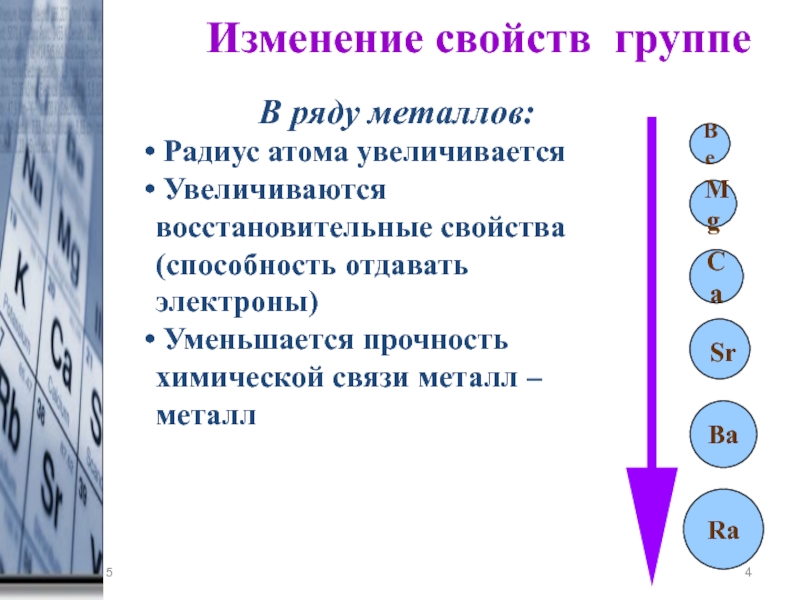 5 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
230 0 объект
>
ручей
конечный поток
endobj
231 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
121,5 293,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
232 0 объект
>
ручей
конечный поток
endobj
233 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
128,25 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
234 0 объект
>
ручей
конечный поток
endobj
235 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 186.9434 тд тдж
ET
Q
Q
конечный поток
endobj
236 0 объект
>
ручей
конечный поток
endobj
237 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.oyu
5 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
230 0 объект
>
ручей
конечный поток
endobj
231 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F2 -12 Тс
121,5 293,4434 Тд Тдж
ET
Q
Q
конечный поток
endobj
232 0 объект
>
ручей
конечный поток
endobj
233 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
128,25 293,4434 тд тдж
ET
Q
Q
конечный поток
endobj
234 0 объект
>
ручей
конечный поток
endobj
235 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
45 186.9434 тд тдж
ET
Q
Q
конечный поток
endobj
236 0 объект
>
ручей
конечный поток
endobj
237 0 объект
>
ручей
q
1 0 0-1 0 792 см -100 Тлз
q
BT
/ GS0 гс
/ F1 -12 Тс
57.oyu
6.5 Периодические изменения свойств элементов — Химия
Цели обучения
К концу этого раздела вы сможете:
- Опишите и объясните наблюдаемые тенденции изменения размера атома, энергии ионизации и сродства к электрону элементов
Элементы в группах (вертикальные столбцы) периодической таблицы демонстрируют сходное химическое поведение. Это сходство происходит потому, что члены группы имеют одинаковое количество и одинаковое распределение электронов в своих валентных оболочках.Однако существуют и другие закономерности химических свойств в таблице Менделеева. Например, по мере того, как мы движемся вниз по группе, металлический характер атомов усиливается. Кислород, находящийся в верхней части группы 16 (6A), представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — это серебристо-серое твердое вещество, проводящее электричество.
Это сходство происходит потому, что члены группы имеют одинаковое количество и одинаковое распределение электронов в своих валентных оболочках.Однако существуют и другие закономерности химических свойств в таблице Менделеева. Например, по мере того, как мы движемся вниз по группе, металлический характер атомов усиливается. Кислород, находящийся в верхней части группы 16 (6A), представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — это серебристо-серое твердое вещество, проводящее электричество.
Проходя период слева направо, мы добавляем протон к ядру и электрон к валентной оболочке с каждым последующим элементом.По мере того как мы опускаемся по элементам в группе, количество электронов в валентной оболочке остается постоянным, но главное квантовое число увеличивается каждый раз на единицу. Понимание электронной структуры элементов позволяет нам изучить некоторые свойства, которые определяют их химическое поведение. Эти свойства периодически меняются по мере изменения электронной структуры элементов. Это (1) размер (радиус) атомов и ионов, (2) энергии ионизации и (3) сродство к электрону.
Это (1) размер (радиус) атомов и ионов, (2) энергии ионизации и (3) сродство к электрону.
Изучите визуализации периодических тенденций, обсуждаемых в этом разделе (и многих других).Всего за несколько щелчков мышью вы можете создать трехмерную версию периодической таблицы, показывающую атомный размер или графики энергии ионизации всех измеренных элементов.
Квантово-механическая картина затрудняет определение определенного размера атома. Однако существует несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, которые дают примерно одинаковые значения. Мы будем использовать ковалентный радиус (рисунок 1), который определяется как половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть их атомарная идентичность).Мы знаем, что когда мы просматриваем группу вниз, главное квантовое число, n , увеличивается на единицу для каждого элемента. Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние до самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в таблице 5 и на рисунке 1. Тенденции для всей таблицы Менделеева можно увидеть на рисунке 1.
Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние до самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в таблице 5 и на рисунке 1. Тенденции для всей таблицы Менделеева можно увидеть на рисунке 1.
| Атом | Ковалентный радиус (пм) | Ядерный заряд |
|---|---|---|
| Ф | 64 | +9 |
| Класс | 99 | +17 |
| Br | 114 | +35 |
| Я | 133 | +53 |
| при | 148 | +85 |
Таблица 5. Ковалентные радиусы элементов галогенной группы Ковалентные радиусы элементов галогенной группы | ||
Как показано на рисунке 2, при перемещении по периоду слева направо мы обычно обнаруживаем, что каждый элемент имеет меньший ковалентный радиус, чем элемент, предшествующий ему. Это может показаться нелогичным, поскольку подразумевает, что атомы с большим количеством электронов имеют меньший атомный радиус. Это можно объяснить с помощью концепции эффективного ядерного заряда , Z eff .Это притяжение, оказываемое ядром на конкретный электрон с учетом любого электрон-электронного отталкивания. Для водорода существует только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z eff ) равны. Для всех остальных атомов внутренние электроны частично защищают внешние электроны от притяжения ядра, и таким образом:
Это можно объяснить с помощью концепции эффективного ядерного заряда , Z eff .Это притяжение, оказываемое ядром на конкретный электрон с учетом любого электрон-электронного отталкивания. Для водорода существует только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z eff ) равны. Для всех остальных атомов внутренние электроны частично защищают внешние электроны от притяжения ядра, и таким образом:
[латекс] Z _ {\ text {eff}} = Z — экранирование [/ латекс]
Экранирование определяется вероятностью нахождения другого электрона между интересующим электроном и ядром, а также электрон-электронным отталкиванием, с которым сталкивается интересующий электрон.Электроны ядра умеют экранировать, в то время как электроны в одной валентной оболочке не так эффективно блокируют ядерное притяжение, испытываемое друг другом. Таким образом, каждый раз, когда мы перемещаемся от одного элемента к другому в течение периода, Z увеличивается на единицу, но экранирование увеличивается лишь незначительно.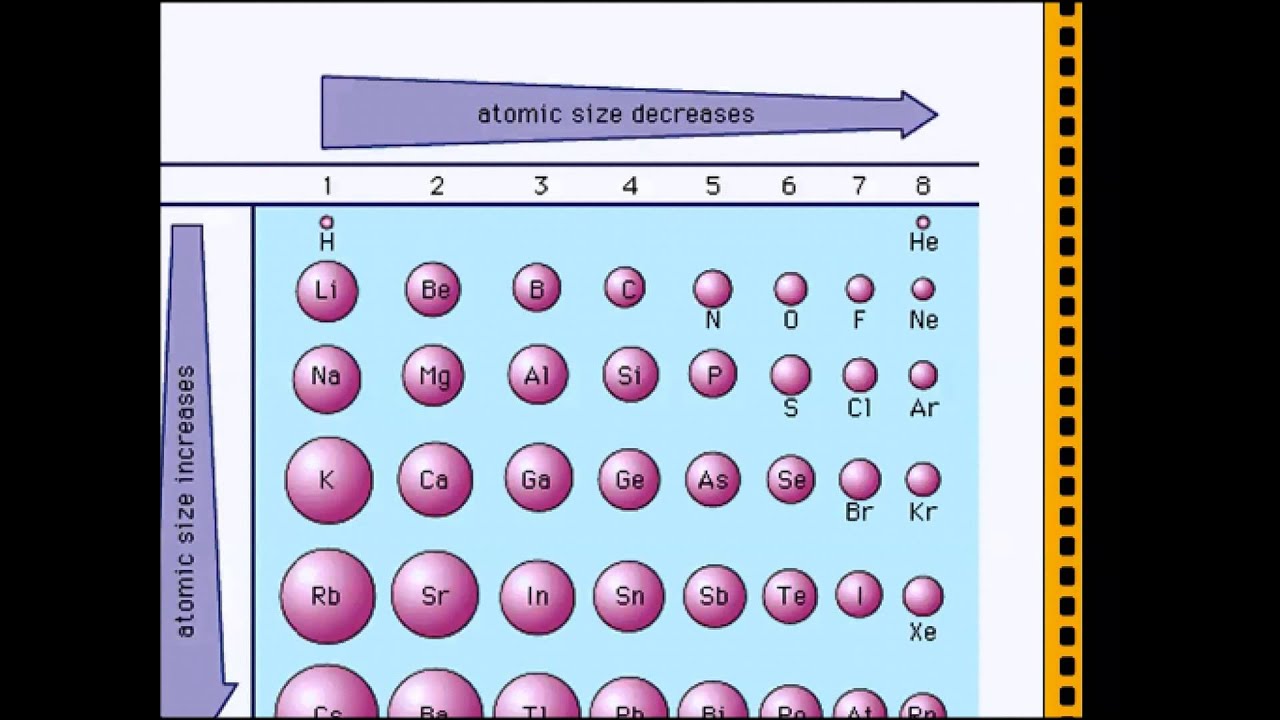 Таким образом, Z eff увеличивается при перемещении слева направо через период. Более сильное притяжение (более высокий эффективный заряд ядра), испытываемое электронами на правой стороне периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, Z eff увеличивается при перемещении слева направо через период. Более сильное притяжение (более высокий эффективный заряд ядра), испытываемое электронами на правой стороне периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы.
Таким образом, как и следовало ожидать, самые внешние или валентные электроны удалить легче всего, потому что они имеют самые высокие энергии, больше экранированы и находятся дальше всего от ядра. Как правило, когда репрезентативные элементы образуют катионы, они делают это за счет потери ns или np электронов, которые были добавлены последними в процессе Aufbau. С другой стороны, переходные элементы теряют нс, электронов, прежде чем они начинают терять ( n — 1) d электронов, даже если нс электронов добавляются первыми, согласно принципу Ауфбау.
Пример 1
Сортировка атомных радиусов
Предскажите порядок увеличения ковалентного радиуса для Ge, Fl, Br, Kr.
Решение Проверьте свои знания Ионный радиус — это мера, используемая для описания размера иона. Катион всегда имеет меньше электронов и столько же протонов, что и родительский атом; он меньше, чем атом, от которого он образован (рис. 3). Например, ковалентный радиус атома алюминия (1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 ) составляет 118 пм. , тогда как ионный радиус Al 3+ (1 s 2 2 s 2 2 p 6 ) составляет 68 пм. Катионы с большим зарядом меньше катионов с меньшим зарядом (например,g., V 2+ имеет ионный радиус 79 пм, а V 3+ — 64 пм). Просматривая группы периодической таблицы, мы обнаруживаем, что катионы следующих друг за другом элементов с одинаковым зарядом обычно имеют больший радиус, соответствующий увеличению главного квантового числа, n . Анион (отрицательный ион) образуется в результате присоединения одного или нескольких электронов к валентной оболочке атома. Это приводит к большему отталкиванию электронов и снижению Z eff на электрон. Атомы и ионы, которые имеют одинаковую электронную конфигурацию, называются изоэлектронными . Примеры изоэлектронных частиц: N 3–, O 2– , F –, Ne, Na + , Mg 2+ и Al 3+ (1 s 2 2 с 2 2 с 6 ). Другой изоэлектронный ряд: P 3–, S 2– , Cl –, Ar, K + , Ca 2+ и Sc 3+ ([Ne] 3 s 2 3 п. Энергия, необходимая для удаления второго наиболее слабосвязанного электрона, называется второй энергией ионизации (IE 2 ).{-} \; \; \; \; \; \ text {IE} _2 [/ latex] Энергия, необходимая для удаления третьего электрона, является третьей энергией ионизации и так далее. Для удаления электронов из атомов или ионов всегда требуется энергия, поэтому процессы ионизации эндотермичны, а значения IE всегда положительны. Для более крупных атомов электрон с наиболее слабой связью расположен дальше от ядра, поэтому его легче удалить. Таким образом, с увеличением размера (атомного радиуса) энергия ионизации должна уменьшаться. Связывая эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что энергия первой ионизации будет уменьшаться по группе и увеличиваться с течением времени. На рис. 4 показано соотношение между первой энергией ионизации и атомным номером нескольких элементов. Значения первой энергии ионизации для элементов приведены на рисунке 5. Другое отклонение происходит, когда орбитали заполняются более чем наполовину. Первая энергия ионизации для кислорода немного меньше, чем для азота, несмотря на тенденцию к увеличению значений IE 1 за период.Глядя на орбитальную диаграмму кислорода, мы видим, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполнению орбитали (что энергетически выгодно). Аналогичные изменения происходят в последующие периоды (обратите внимание на провал серы после фосфора на рисунке 5). Удалить электрон из катиона сложнее, чем удалить электрон из нейтрального атома, из-за большего электростатического притяжения к катиону.Точно так же удалить электрон с катиона с более высоким положительным зарядом сложнее, чем удалить электрон с иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда увеличиваются. Как видно из Таблицы 6, наблюдается значительное увеличение энергии ионизации (изменение цвета) для каждого элемента. Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, и Sc, и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации. Ранжирование энергий ионизации Решение Проверьте свои знания Сродство к электрону [EA] — это изменение энергии для процесса добавления электрона к газообразному атому с образованием аниона (отрицательного иона). Этот процесс может быть либо эндотермическим, либо экзотермическим, в зависимости от элемента. EA некоторых элементов приведено на рисунке 6. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным, а значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом.Второй EA — это энергия, связанная с добавлением электрона к аниону с образованием –2-иона и так далее. Как мы могли предсказать, становится легче добавить электрон к ряду атомов, поскольку эффективный ядерный заряд атомов увеличивается. Мы обнаруживаем, что при движении слева направо в течение периода советники становятся более негативными. Исключения, обнаруженные среди элементов группы 2 (2A), группы 15 (5A) и группы 18 (8A), можно понять на основе электронной структуры этих групп. Мы также можем ожидать, что у атома наверху каждой группы будет самый большой эксперт; их первые потенциалы ионизации предполагают, что эти атомы имеют самые большие эффективные ядерные заряды. Однако, двигаясь вниз по группе, мы видим, что второй элемент в группе чаще всего имеет лучший эксперт. Уменьшение ЭА первого члена можно объяснить малым размером оболочки n = 2 и возникающим в результате большим электрон-электронным отталкиванием. Свойства, обсуждаемые в этом разделе (размер атомов и ионов, эффективный заряд ядра, энергии ионизации и сродство к электрону), являются центральными для понимания химической реакционной способности. Electron позволяют нам понять многие периодические тенденции. Ковалентный радиус увеличивается по мере того, как мы движемся вниз по группе, потому что увеличивается уровень n (размер орбиты).Ковалентный радиус в основном уменьшается по мере того, как мы движемся слева направо по периоду, потому что эффективный ядерный заряд, испытываемый электронами, увеличивается, и электроны притягиваются к ядру сильнее. Ответы на упражнения в конце главы по химии 1. Класс 3. O 5. Rb 7. 15 (5A) 9. Mg 11.Si 4+ 13. Se, As — 15. Mg 2+ 17. O, IE 1 19. Ra К концу этого раздела вы сможете: Элементы в группах (вертикальные столбцы) периодической таблицы демонстрируют сходное химическое поведение. Проходя период слева направо, мы добавляем протон к ядру и электрон к валентной оболочке с каждым последующим элементом. По мере того как мы опускаемся по элементам в группе, количество электронов в валентной оболочке остается постоянным, но главное квантовое число увеличивается каждый раз на единицу. Понимание электронной структуры элементов позволяет нам изучить некоторые свойства, которые определяют их химическое поведение. Эти свойства периодически меняются по мере изменения электронной структуры элементов. Изучите визуализации периодических тенденций, обсуждаемых в этом разделе (и многих других тенденций) на веб-сайте «Атомный номер элементов». Всего за несколько щелчков мышью вы можете создать трехмерную версию периодической таблицы, показывающую атомный размер или графики энергии ионизации всех измеренных элементов. Квантово-механическая картина затрудняет определение определенного размера атома.Однако существует несколько практических способов определения радиуса атомов и, таким образом, определения их относительных размеров, которые дают примерно одинаковые значения. Мы будем использовать ковалентный радиус (рисунок 1), который определяется как половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью (это измерение возможно, потому что атомы внутри молекул все еще сохраняют большую часть их атомарная идентичность). Рисунок 1.(а) Радиус атома определяется как половина расстояния между ядрами в молекуле, состоящей из двух одинаковых атомов, соединенных ковалентной связью. Атомный радиус галогенов увеличивается вниз по группе с увеличением n. (b) Ковалентные радиусы элементов показаны в масштабе. Общая тенденция заключается в том, что радиусы увеличиваются по группе и уменьшаются с течением времени. Рис. Как показано на рисунке 2, при перемещении по периоду слева направо мы обычно обнаруживаем, что каждый элемент имеет меньший ковалентный радиус, чем элемент, предшествующий ему. Это может показаться нелогичным, поскольку подразумевает, что атомы с большим количеством электронов имеют меньший атомный радиус. Это можно объяснить с помощью концепции эффективного ядерного заряда , Z eff .Это притяжение, оказываемое ядром на конкретный электрон с учетом любого электрон-электронного отталкивания. Для водорода существует только один электрон, поэтому заряд ядра ( Z ) и эффективный заряд ядра ( Z eff ) равны. [латекс] {Z} _ {\ text {eff}} = Z-экранирование [/ латекс] Экранирование определяется вероятностью нахождения другого электрона между интересующим электроном и ядром, а также электрон-электронным отталкиванием, с которым сталкивается интересующий электрон.Электроны ядра умеют экранировать, в то время как электроны в одной валентной оболочке не так эффективно блокируют ядерное притяжение, испытываемое друг другом. Таким образом, каждый раз, когда мы переходим от одного элемента к другому в течение периода, Z увеличивается на единицу, но экранирование увеличивается лишь незначительно. Таким образом, Z eff увеличивается при перемещении слева направо через период. Более сильное притяжение (более высокий эффективный заряд ядра), испытываемое электронами на правой стороне периодической таблицы, притягивает их ближе к ядру, уменьшая ковалентные радиусы. Таким образом, как и следовало ожидать, самые внешние или валентные электроны удалить легче всего, потому что они имеют самые высокие энергии, больше экранированы и находятся дальше всего от ядра. Как правило, когда репрезентативные элементы образуют катионы, они делают это за счет потери ns или np электронов, которые были добавлены последними в процессе Aufbau. С другой стороны, переходные элементы теряют нс электронов, прежде чем они начнут терять ( n -1) d электронов, даже если нс электронов добавляются первыми, согласно принципу Ауфбау. Предскажите порядок увеличения ковалентного радиуса для Ge, Fl, Br, Kr. Радиус увеличивается по мере того, как мы движемся вниз по группе, поэтому Ge Приведите пример атома, размер которого меньше, чем у фтора. Ионный радиус — это мера, используемая для описания размера иона. Катион всегда имеет меньше электронов и столько же протонов, что и родительский атом; он меньше, чем атом, от которого он образован (рис. 3). Например, ковалентный радиус атома алюминия (1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 ) составляет 118 пм. , тогда как ионный радиус Al 3+ (1 с 2 2 с 2 2 p 6 ) составляет 68 пм. Рис. 3. Радиус катиона меньше, чем у родительского атома (Al), из-за потери электронов; радиус для аниона больше, чем у родительского (S), из-за полученных электронов. Катионы с большим зарядом меньше катионов с меньшим зарядом (например,g., V 2+ имеет ионный радиус 79 пм, а V 3+ — 64 пм). Просматривая группы периодической таблицы, мы обнаруживаем, что катионы следующих друг за другом элементов с одинаковым зарядом обычно имеют больший радиус, соответствующий увеличению главного квантового числа, n . Анион (отрицательный ион) образуется в результате присоединения одного или нескольких электронов к валентной оболочке атома. Это приводит к большему отталкиванию электронов и снижению Z eff на электрон. Атомы и ионы, которые имеют одинаковую электронную конфигурацию, называются изоэлектронными . Примеры изоэлектронных частиц: N 3–, O 2– , F –, Ne, Na + , Mg 2+ и Al 3+ (1 s 2 2 с 2 2 с 6 ). Энергия, необходимая для удаления второго наиболее слабосвязанного электрона, называется второй энергией ионизации (IE 2 ).{-} {\ text {IE}} _ {2} [/ latex] Энергия, необходимая для удаления третьего электрона, является третьей энергией ионизации и так далее. Для удаления электронов из атомов или ионов всегда требуется энергия, поэтому процессы ионизации эндотермичны, а значения IE всегда положительны. Для более крупных атомов электрон с наиболее слабой связью расположен дальше от ядра, поэтому его легче удалить. Таким образом, с увеличением размера (атомного радиуса) энергия ионизации должна уменьшаться. Связывая эту логику с тем, что мы только что узнали о радиусах, мы ожидаем, что энергия первой ионизации будет уменьшаться по группе и увеличиваться с течением времени. На рис. 4 показано соотношение между первой энергией ионизации и атомным номером нескольких элементов. Значения первой энергии ионизации для элементов приведены на рисунке 5. Рис. 4. Первая энергия ионизации элементов в первых пяти периодах отложена в зависимости от их атомного номера. Рис. 5. Эта версия таблицы Менделеева показывает первую энергию ионизации (IE1) в кДж / моль выбранных элементов. Другое отклонение происходит, когда орбитали заполняются более чем наполовину. Первая энергия ионизации для кислорода немного меньше, чем для азота, несмотря на тенденцию к увеличению значений IE 1 за период.Глядя на орбитальную диаграмму кислорода, мы видим, что удаление одного электрона устранит электрон-электронное отталкивание, вызванное спариванием электронов на орбитали 2 p , и приведет к полузаполнению орбитали (что является энергетически выгодным). Аналогичные изменения происходят в последующие периоды (обратите внимание на провал серы после фосфора на рисунке 5). Удалить электрон из катиона сложнее, чем удалить электрон из нейтрального атома, из-за большего электростатического притяжения к катиону. Предскажите порядок увеличения энергии для следующих процессов: IE 1 для Al, IE 1 для Tl, IE 2 для Na, IE 3 для Al. Какое значение имеет наименьшее значение для IE 1 : O, Po, Pb или Ba? Сродство к электрону [EA] — это изменение энергии для процесса добавления электрона к газообразному атому с образованием аниона (отрицательного иона).{\ text {-}} \ left (g \ right) {\ text {EA}} _ {1} [/ latex] Этот процесс может быть либо эндотермическим, либо экзотермическим, в зависимости от элемента. Как мы могли предсказать, становится легче добавить электрон к ряду атомов, поскольку эффективный ядерный заряд атомов увеличивается. Мы обнаруживаем, что при движении слева направо в течение периода советники становятся более негативными. Исключения, обнаруженные среди элементов группы 2 (2A), группы 15 (5A) и группы 18 (8A), можно понять на основе электронной структуры этих групп.Благородные газы, группа 18 (8A), имеют полностью заполненную оболочку, и входящий электрон должен быть добавлен на более высокий уровень n , что труднее сделать. Мы также можем ожидать, что у атома наверху каждой группы будет самый большой эксперт; их первые потенциалы ионизации предполагают, что эти атомы имеют самые большие эффективные ядерные заряды. Однако, двигаясь вниз по группе, мы видим, что второй элемент в группе чаще всего имеет лучший эксперт. Уменьшение ЭА первого члена можно объяснить малым размером оболочки n = 2 и возникающими в результате большими электрон-электронными отталкиваниями.Например, хлор со значением EA -348 кДж / моль имеет наивысшее значение из всех элементов периодической таблицы. ЭА фтора –322 кДж / моль. Когда мы добавляем электрон к атому фтора с образованием фторид-аниона (F — ), мы добавляем электрон к оболочке n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет такую же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон переходит в оболочку n = 3, он занимает значительно большую область пространства, и электрон-электронное отталкивание уменьшено.Вступающий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон. Рис. 6. Эта версия периодической таблицы отображает значения сродства к электрону (в кДж / моль) для выбранных элементов. Свойства, обсуждаемые в этом разделе (размер атомов и ионов, эффективный заряд ядра, энергии ионизации и сродство к электрону), являются центральными для понимания химической реакционной способности. Например, поскольку фтор имеет энергетически выгодный EA и большой энергетический барьер для ионизации (IE), гораздо легче образовывать анионы фтора, чем катионы.Металлические свойства, включая проводимость и пластичность (способность формировать листы), зависят от наличия электронов, которые можно легко удалить. Таким образом, металлический характер увеличивается по мере того, как мы движемся вниз по группе, и уменьшается в течение периода в той же тенденции, что наблюдается для размера атома, потому что легче удалить электрон, который находится дальше от ядра. Electron позволяют нам понять многие периодические тенденции. Ковалентный радиус увеличивается по мере того, как мы движемся вниз по группе, потому что уровень n (размер орбиты) увеличивается.Ковалентный радиус в основном уменьшается по мере того, как мы движемся слева направо по периоду, потому что эффективный ядерный заряд, испытываемый электронами, увеличивается, и электроны притягиваются к ядру сильнее. Анионные радиусы больше, чем у родительского атома, в то время как катионные радиусы меньше, потому что количество валентных электронов изменилось, а заряд ядра остался постоянным. Энергия ионизации (энергия, связанная с образованием катиона) уменьшается вниз по группе и в основном увеличивается в течение периода, потому что легче удалить электрон с более крупной орбитали с более высокой энергией.Сродство к электрону (энергия, связанная с образованием аниона) более благоприятно (экзотермично), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным, когда мы перемещаемся слева направо по периодической таблице, и уменьшается, когда мы перемещаемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций при работе с полностью заполненными или наполовину заполненными подоболочками. 1. Класс 3.O 5. Rb 7. 15 (5А) 9. Mg 11. Si 4+ 13. Se, As — 15. Mg 2+ 17. O, IE 1 19. Ra ковалентный радиус эффективный заряд ядра сродство к электрону энергия ионизации
Радиус увеличивается по мере того, как мы движемся вниз по группе, поэтому Ge
Приведите пример атома, размер которого меньше, чем размер фтора.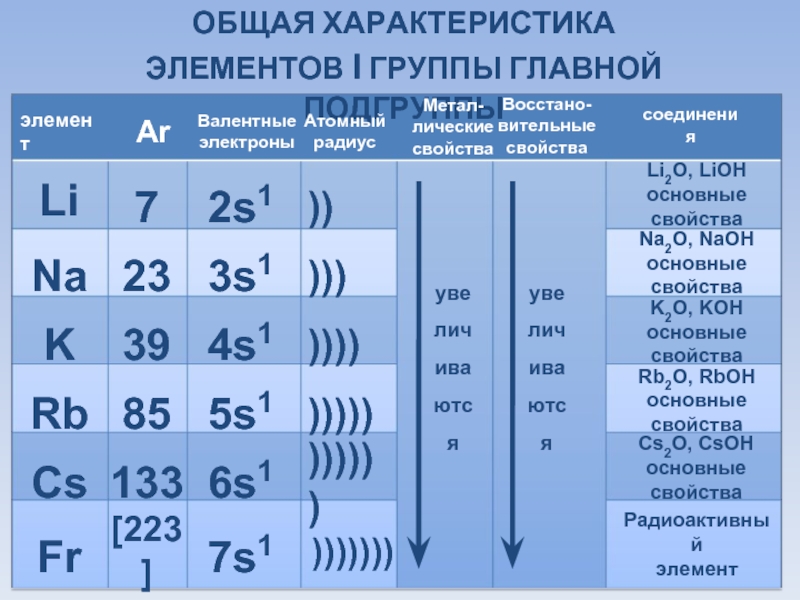 Когда электроны удаляются из внешней валентной оболочки, оставшиеся электроны остова, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Когда электроны удаляются из внешней валентной оболочки, оставшиеся электроны остова, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру. Оба эффекта (увеличенное количество электронов и уменьшение Z eff ) приводят к тому, что радиус аниона больше, чем радиус родительского атома (рис. 3). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 п. 6 ) составляет 170 часов вечера. Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Оба эффекта (увеличенное количество электронов и уменьшение Z eff ) приводят к тому, что радиус аниона больше, чем радиус родительского атома (рис. 3). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 п. 6 ) составляет 170 часов вечера. Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы. {-} \; \; \; \; \; \ text {IE} _1 [/ latex]
{-} \; \; \; \; \; \ text {IE} _1 [/ latex]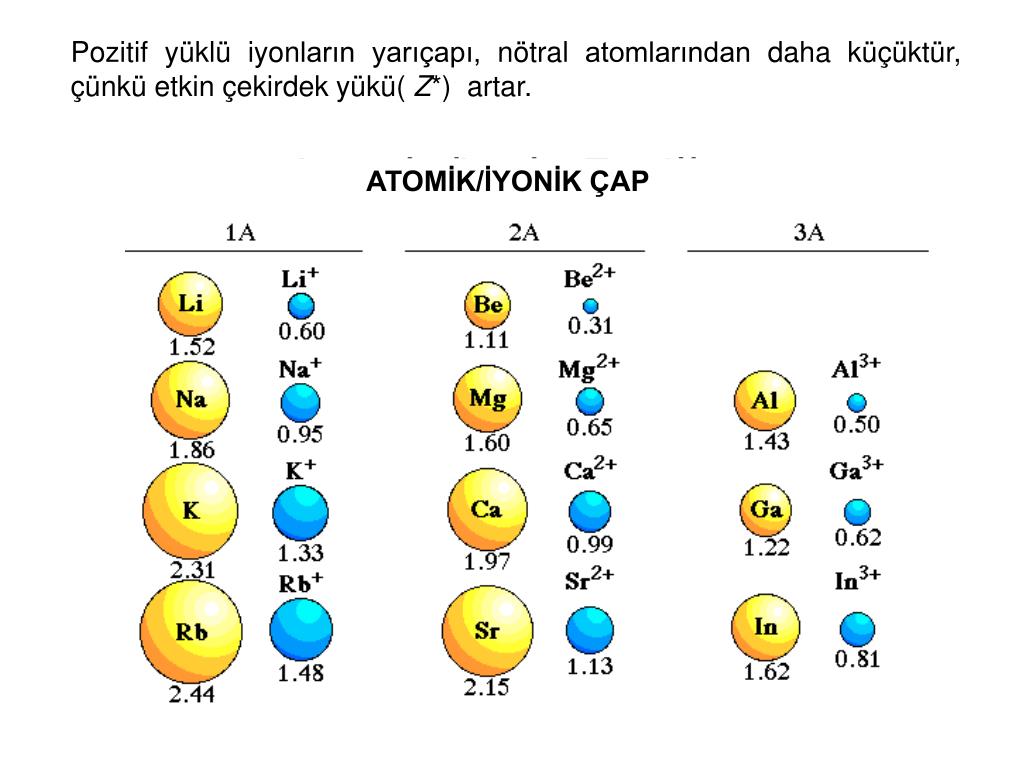 В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако есть некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя ядерный заряд бора больше на один протон.Это можно объяснить тем, что энергия подоболочек увеличивается по мере увеличения -1 за счет проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый при ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) представляет собой электрон p ; это приводит к более низкой энергии первой ионизации бора, даже если его ядерный заряд на один протон больше.
В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако есть некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя ядерный заряд бора больше на один протон.Это можно объяснить тем, что энергия подоболочек увеличивается по мере увеличения -1 за счет проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый при ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) представляет собой электрон p ; это приводит к более низкой энергии первой ионизации бора, даже если его ядерный заряд на один протон больше. Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка.
Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка.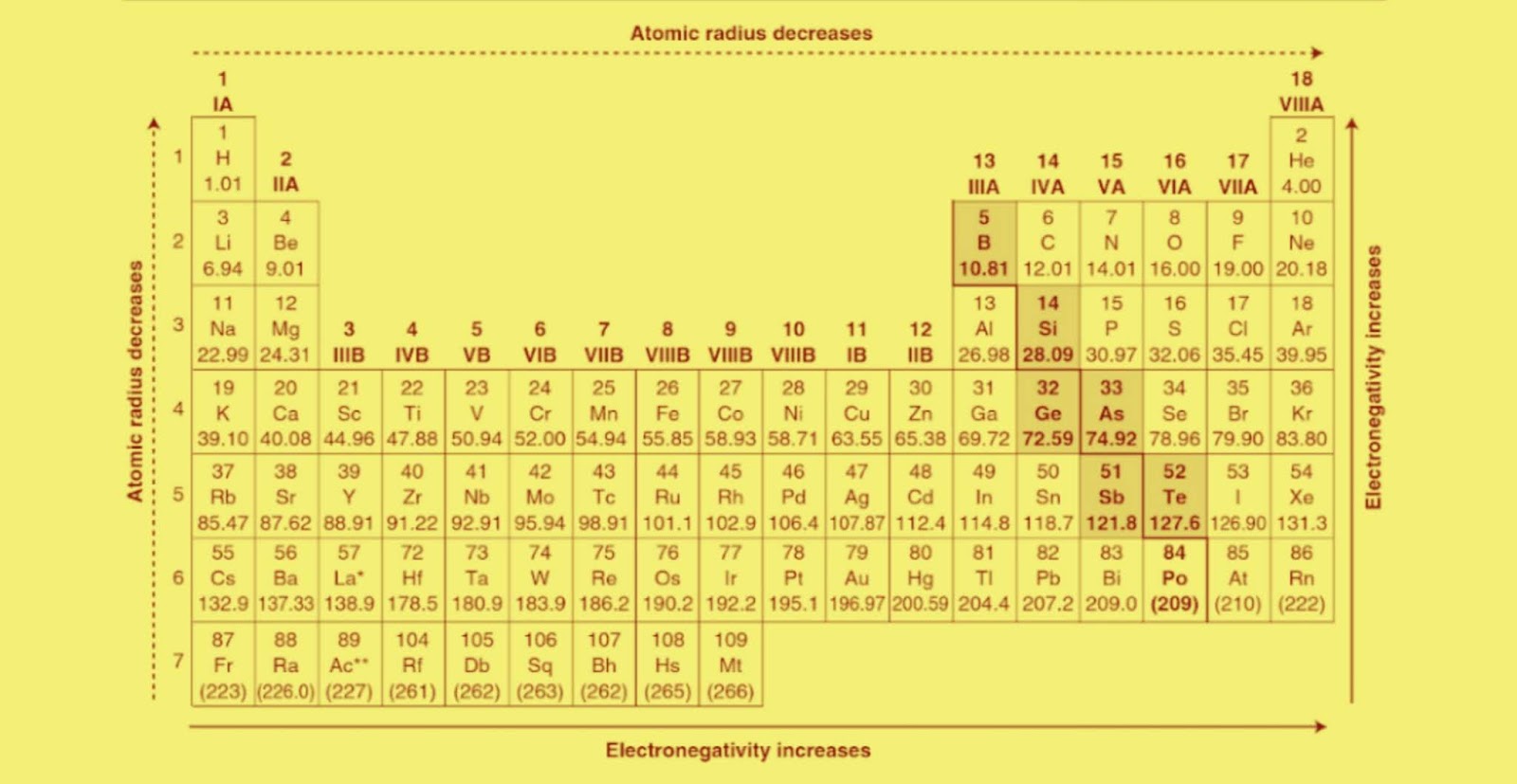
” Under the “Element” column are: K, C a, S c, G a, G e, and A s. Under the “I E subscript 1” column are the values: 418.8, 589.8, 633.1, 578.8, 762.2, and 944.5. Under the “I E subscript 2” column are the following values: 3051.8, 1145.4, 1235.0, 1979.4, 1537.5, and 1793.6. The value 3051.8 appears in red. Under the column “I E subscript 3” column are the values: 4419.6, 4912.4, 2388.7, 2964.6, 3302.1, and 2735.5. Under the “I E subscript 4” column are the values: 5876.9, 6490.6, 7090.6, 6180, 4410.6, and 4836.8. Under the “I E subscript 5” column are the values: 7975.5, 8153.0, 8842.9, 8298.7, 9021.4, and 6042.9. Under the “I E subscript 6” column are the values: 9590.6, 10495.7, 10679.0, 10873.9, not available, and 12311.5. Under the “I E subscript 7” column are the values: 11343, 12272.9, 13315.0, 13594.8, not available, and not available.»>
Элемент IE 1 IE 2 IE 3 IE 4 IE 5 IE 6 IE 7 К 418,8 3051,8 4419,6 5876.  9
9 7975,5 9590,6 11343 Ca 589,8 1145,4 4912,4 6490,6 8153,0 10495,7 12272,9 SC 633,1 1235,0 2388,7 7090,6 8842,9 10679,0 13315,0 Ga 578,8 1979,4 2964.6 6180 8298,7 10873,9 13594,8 Ge 762,2 1537,5 3302,1 4410,6 9021,4 Не доступен Не доступен Как 944,5 1793,6 2735,5 4836,8 6042,9 12311,5 Не доступен Таблица 6. Энергия последовательной ионизации выбранных элементов (кДж / моль) Пример 2
Предскажите порядок увеличения энергии для следующих процессов: IE 1 для Al, IE 1 для Tl, IE 2 для Na, IE 3 для Al.
Удаление электрона 6 p 1 из Tl проще, чем удаление электрона 3 p 1 из Al, потому что более высокая орбиталь n дальше от ядра, поэтому IE 1 (Tl)
Какое наименьшее значение для IE 1 : O, Po, Pb или Ba?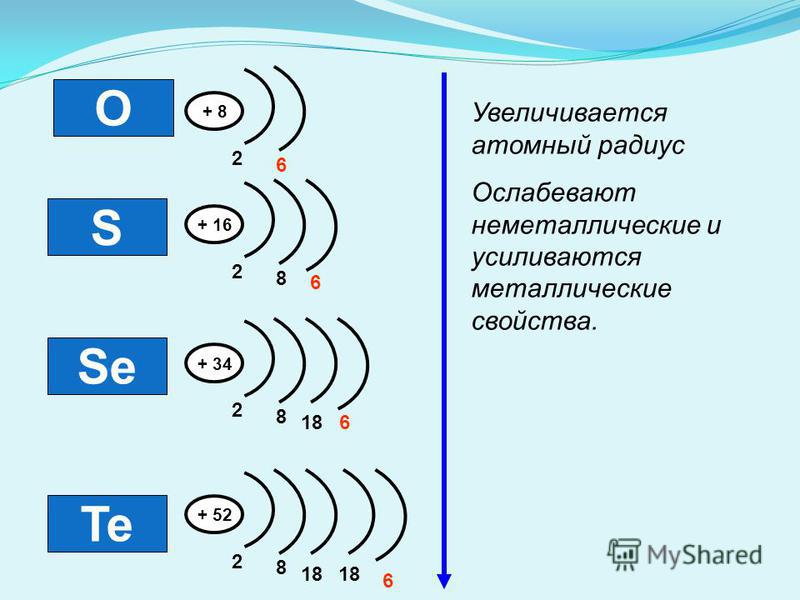 {-}(грамм) \;\;\;\;\; \ text {EA} _1 [/ latex]
{-}(грамм) \;\;\;\;\; \ text {EA} _1 [/ latex] Благородные газы, группа 18 (8A), имеют полностью заполненную оболочку, и входящий электрон должен быть добавлен на более высокий уровень n , что труднее сделать. Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию нп , так что, опять же, наблюдаемое значение EA не соответствует прогнозируемой тенденции. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть спарен с существующим электроном np .Во всех этих случаях начальная относительная стабильность электронной конфигурации нарушает тренд EA.
Благородные газы, группа 18 (8A), имеют полностью заполненную оболочку, и входящий электрон должен быть добавлен на более высокий уровень n , что труднее сделать. Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию нп , так что, опять же, наблюдаемое значение EA не соответствует прогнозируемой тенденции. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть спарен с существующим электроном np .Во всех этих случаях начальная относительная стабильность электронной конфигурации нарушает тренд EA. Например, хлор со значением EA -348 кДж / моль имеет наивысшее значение из всех элементов периодической таблицы. ЭА фтора –322 кДж / моль. Когда мы добавляем электрон к атому фтора с образованием фторид-аниона (F — ), мы добавляем электрон к оболочке n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет ту же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон переходит в оболочку n = 3, он занимает значительно большую область пространства, и электрон-электронное отталкивание уменьшается.Вступающий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон.
Например, хлор со значением EA -348 кДж / моль имеет наивысшее значение из всех элементов периодической таблицы. ЭА фтора –322 кДж / моль. Когда мы добавляем электрон к атому фтора с образованием фторид-аниона (F — ), мы добавляем электрон к оболочке n = 2. Электрон притягивается к ядру, но также происходит значительное отталкивание от других электронов, уже присутствующих в этой небольшой валентной оболочке. Атом хлора имеет ту же электронную конфигурацию в валентной оболочке, но поскольку входящий электрон переходит в оболочку n = 3, он занимает значительно большую область пространства, и электрон-электронное отталкивание уменьшается.Вступающий электрон не испытывает такого сильного отталкивания, и атом хлора легче принимает дополнительный электрон. Например, поскольку фтор имеет энергетически выгодный EA и большой энергетический барьер для ионизации (IE), гораздо легче образовывать анионы фтора, чем катионы.Металлические свойства, включая проводимость и пластичность (способность формировать листы), зависят от наличия электронов, которые можно легко удалить. Таким образом, металлический характер увеличивается по мере того, как мы движемся вниз по группе, и уменьшается в течение периода в той же тенденции, что наблюдается для размера атома, потому что легче удалить электрон, который находится дальше от ядра.
Например, поскольку фтор имеет энергетически выгодный EA и большой энергетический барьер для ионизации (IE), гораздо легче образовывать анионы фтора, чем катионы.Металлические свойства, включая проводимость и пластичность (способность формировать листы), зависят от наличия электронов, которые можно легко удалить. Таким образом, металлический характер увеличивается по мере того, как мы движемся вниз по группе, и уменьшается в течение периода в той же тенденции, что наблюдается для размера атома, потому что легче удалить электрон, который находится дальше от ядра. Анионные радиусы больше, чем у родительского атома, в то время как катионные радиусы меньше, потому что количество валентных электронов изменилось, а заряд ядра остался постоянным. Энергия ионизации (энергия, связанная с образованием катиона) уменьшается вниз по группе и в основном увеличивается в течение периода, потому что легче удалить электрон с более крупной орбитали с более высокой энергией.Сродство к электрону (энергия, связанная с образованием аниона) более благоприятно (экзотермично), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным, когда мы перемещаемся слева направо по периодической таблице, и уменьшается, когда мы перемещаемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций при работе с полностью заполненными или наполовину заполненными подоболочками.
Анионные радиусы больше, чем у родительского атома, в то время как катионные радиусы меньше, потому что количество валентных электронов изменилось, а заряд ядра остался постоянным. Энергия ионизации (энергия, связанная с образованием катиона) уменьшается вниз по группе и в основном увеличивается в течение периода, потому что легче удалить электрон с более крупной орбитали с более высокой энергией.Сродство к электрону (энергия, связанная с образованием аниона) более благоприятно (экзотермично), когда электроны помещаются на орбитали с более низкой энергией, ближе к ядру. Следовательно, сродство к электрону становится все более отрицательным, когда мы перемещаемся слева направо по периодической таблице, и уменьшается, когда мы перемещаемся вниз по группе. Как для данных IE, так и для данных сродства к электрону существуют исключения из тенденций при работе с полностью заполненными или наполовину заполненными подоболочками. Химия: упражнения в конце главы


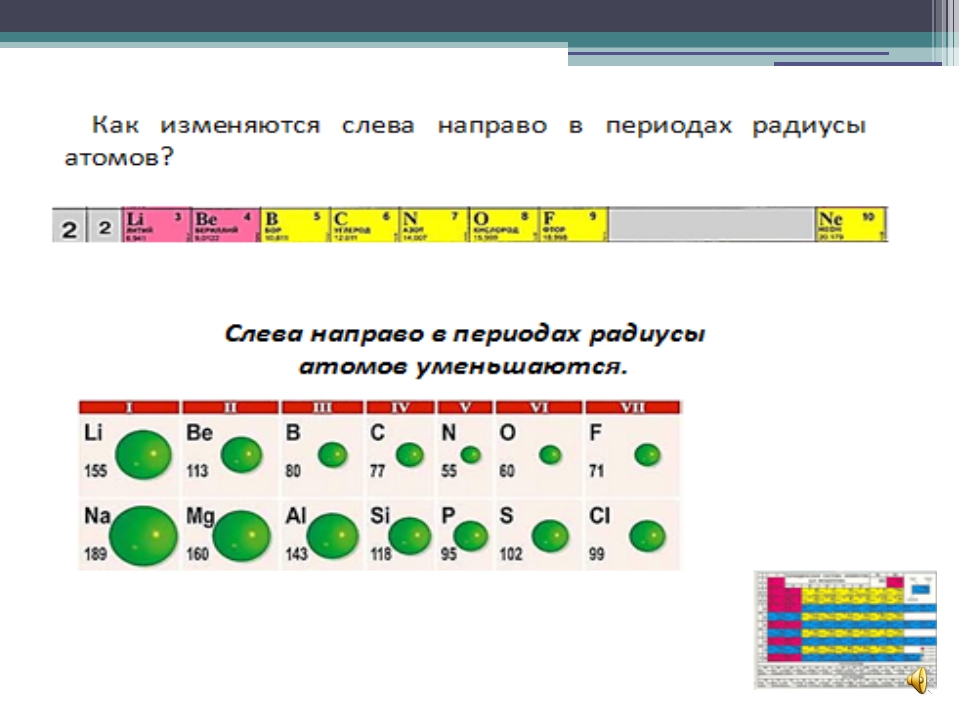 {-} [/ латекс]
{-} [/ латекс] Глоссарий
 Соответствующее число (например, вторая энергия ионизации) соответствует заряду произведенного иона (X 2+ )
Соответствующее число (например, вторая энергия ионизации) соответствует заряду произведенного иона (X 2+ ) Решения
— Периодические изменения свойств элементов
ЦЕЛИ ОБУЧЕНИЯ
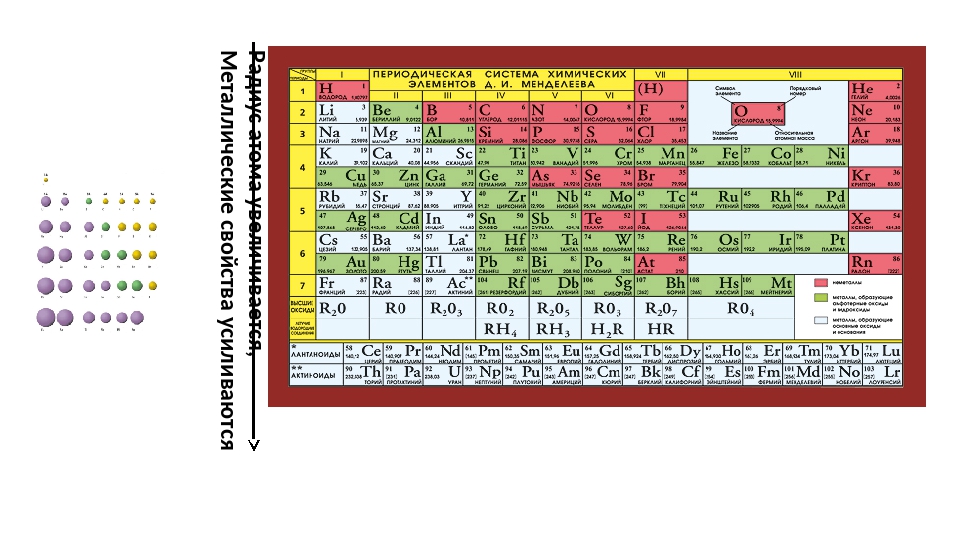 Это сходство происходит потому, что члены группы имеют одинаковое количество и одинаковое распределение электронов в своих валентных оболочках. Однако существуют и другие закономерности химических свойств в таблице Менделеева. Например, по мере того, как мы движемся вниз по группе, металлический характер атомов усиливается. Кислород, находящийся в верхней части группы 16 (6A), представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — это серебристо-серое твердое вещество, проводящее электричество.
Это сходство происходит потому, что члены группы имеют одинаковое количество и одинаковое распределение электронов в своих валентных оболочках. Однако существуют и другие закономерности химических свойств в таблице Менделеева. Например, по мере того, как мы движемся вниз по группе, металлический характер атомов усиливается. Кислород, находящийся в верхней части группы 16 (6A), представляет собой бесцветный газ; в середине группы селен — твердое полупроводниковое вещество; а внизу полоний — это серебристо-серое твердое вещество, проводящее электричество.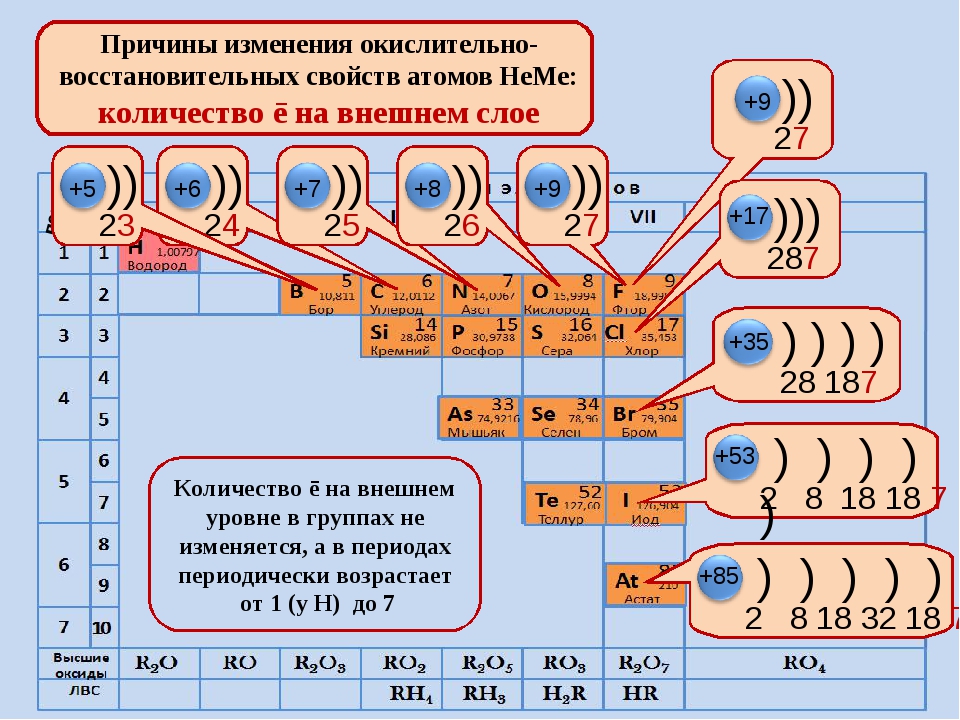 Это (1) размер (радиус) атомов и ионов, (2) энергии ионизации и (3) сродство к электрону.
Это (1) размер (радиус) атомов и ионов, (2) энергии ионизации и (3) сродство к электрону. Вариация ковалентного радиуса
 Мы знаем, что, когда мы просматриваем группу вниз, главное квантовое число, n , увеличивается на единицу для каждого элемента.Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние до самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в Таблице 1 и на Рисунке 1. Тенденции для всей Периодической таблицы можно увидеть на Рисунке 1.
Мы знаем, что, когда мы просматриваем группу вниз, главное квантовое число, n , увеличивается на единицу для каждого элемента.Таким образом, электроны добавляются в область пространства, которая все больше удаляется от ядра. Следовательно, размер атома (и его ковалентный радиус) должен увеличиваться по мере того, как мы увеличиваем расстояние до самых удаленных электронов от ядра. Эта тенденция проиллюстрирована для ковалентных радиусов галогенов в Таблице 1 и на Рисунке 1. Тенденции для всей Периодической таблицы можно увидеть на Рисунке 1. «>
Таблица 1. Ковалентные радиусы элементов галогенной группы Атом Ковалентный радиус (пм) Ядерный заряд Ф 64 +9 Класс 99 +17 Br 114 +35 Я 133 +53 при 148 +85 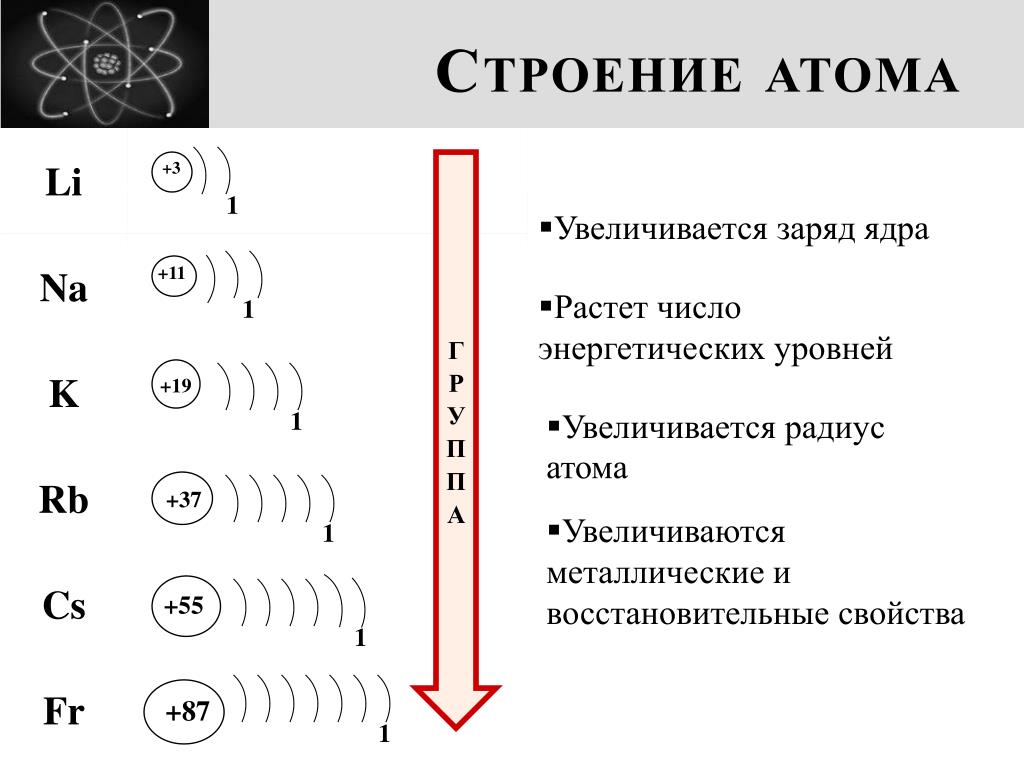 2. В течение каждого периода тенденция атомного радиуса уменьшается с увеличением Z; например, от К до Кр. Внутри каждой группы (например,g., щелочные металлы показаны фиолетовым цветом), наблюдается тенденция к увеличению атомного радиуса с увеличением Z.
2. В течение каждого периода тенденция атомного радиуса уменьшается с увеличением Z; например, от К до Кр. Внутри каждой группы (например,g., щелочные металлы показаны фиолетовым цветом), наблюдается тенденция к увеличению атомного радиуса с увеличением Z.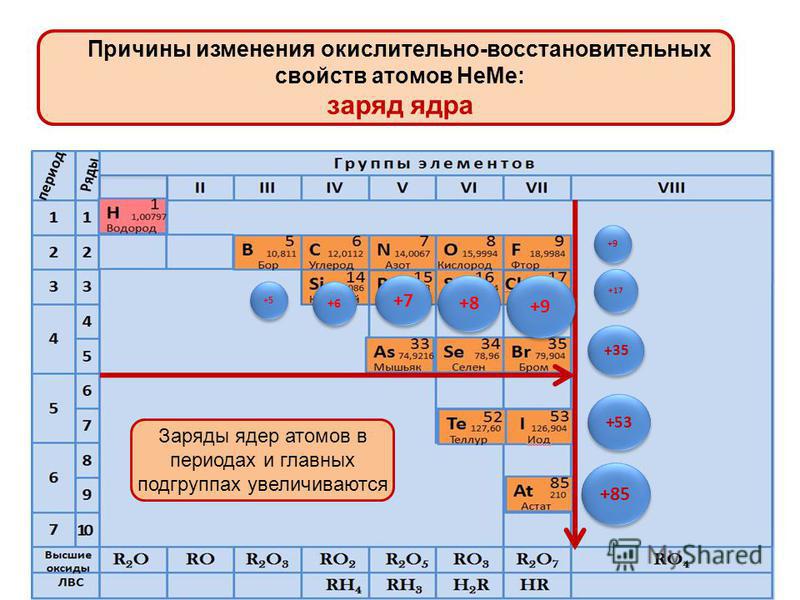 Для всех остальных атомов внутренние электроны частично защищают внешние электроны от притяжения ядра, и таким образом:
Для всех остальных атомов внутренние электроны частично защищают внешние электроны от притяжения ядра, и таким образом:
Пример 1
Сортировка атомных радиусов Решение
Изменение ионных радиусов
 Когда электроны удаляются из внешней валентной оболочки, оставшиеся электроны остова, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру.
Когда электроны удаляются из внешней валентной оболочки, оставшиеся электроны остова, занимающие меньшие оболочки, испытывают больший эффективный ядерный заряд Z eff (как обсуждалось) и притягиваются еще ближе к ядру. Оба эффекта (увеличенное количество электронов и уменьшение Z eff ) приводят к тому, что радиус аниона больше, чем радиус родительского атома (рис. 3). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 p 6 ) составляет 170 часов вечера. Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы.
Оба эффекта (увеличенное количество электронов и уменьшение Z eff ) приводят к тому, что радиус аниона больше, чем радиус родительского атома (рис. 3). Например, атом серы ([Ne] 3 s 2 3 p 4 ) имеет ковалентный радиус 104 пм, тогда как ионный радиус сульфид-аниона ([Ne] 3 s 2 3 p 6 ) составляет 170 часов вечера. Для последовательных элементов, движущихся вниз по любой группе, анионы имеют большие главные квантовые числа и, следовательно, большие радиусы. { -} {\ text {IE}} _ {1} [/ latex]
{ -} {\ text {IE}} _ {1} [/ latex]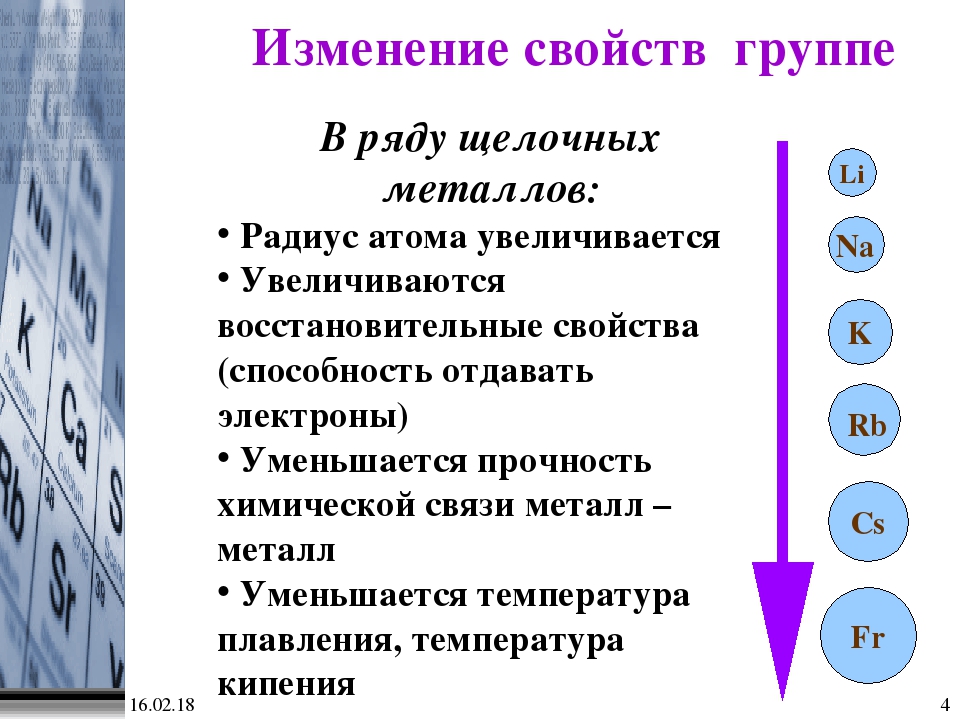 В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако есть некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя ядерный заряд бора больше на один протон.Это можно объяснить тем, что энергия подоболочек увеличивается с увеличением -1 за счет проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый во время ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) представляет собой электрон p ; это приводит к более низкой энергии первой ионизации бора, даже если его ядерный заряд на один протон больше.
В течение периода IE 1 обычно увеличивается с увеличением Z . Вниз по группе значение IE 1 обычно уменьшается с увеличением Z . Однако есть некоторые систематические отклонения от этой тенденции. Обратите внимание, что энергия ионизации бора (атомный номер 5) меньше, чем у бериллия (атомный номер 4), хотя ядерный заряд бора больше на один протон.Это можно объяснить тем, что энергия подоболочек увеличивается с увеличением -1 за счет проникновения и экранирования (как обсуждалось ранее в этой главе). Внутри любой оболочки s электронов имеют меньшую энергию, чем p электронов. Это означает, что электрон s сложнее удалить из атома, чем электрон p в той же оболочке. Электрон, удаляемый во время ионизации бериллия ([He] 2 s 2 ), является электроном s , тогда как электрон, удаляемый во время ионизации бора ([He] 2 s 2 2 p 1 ) представляет собой электрон p ; это приводит к более низкой энергии первой ионизации бора, даже если его ядерный заряд на один протон больше. Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка.
Таким образом, мы видим небольшое отклонение от прогнозируемого тренда каждый раз, когда начинается новая подоболочка. Точно так же удалить электрон с катиона с более высоким положительным зарядом сложнее, чем удалить электрон с иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда увеличиваются. Как видно из Таблицы 2, наблюдается значительное увеличение энергии ионизации (изменение цвета) для каждого элемента. Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, и Sc, и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации.
Точно так же удалить электрон с катиона с более высоким положительным зарядом сложнее, чем удалить электрон с иона с более низким зарядом. Таким образом, последовательные энергии ионизации одного элемента всегда увеличиваются. Как видно из Таблицы 2, наблюдается значительное увеличение энергии ионизации (изменение цвета) для каждого элемента. Этот скачок соответствует удалению остовных электронов, которые удалить труднее, чем валентные электроны. Например, и Sc, и Ga имеют по три валентных электрона, поэтому быстрое увеличение энергии ионизации происходит после третьей ионизации. 2, and 944.5. Under the “I E subscript 2” column are the following values: 3051.8, 1145.4, 1235.0, 1979.4, 1537.5, and 1793.6. The value 3051.8 appears in red. Under the column “I E subscript 3” column are the values: 4419.6, 4912.4, 2388.7, 2964.6, 3302.1, and 2735.5. Under the “I E subscript 4” column are the values: 5876.9, 6490.6, 7090.6, 6180, 4410.6, and 4836.8. Under the “I E subscript 5” column are the values: 7975.5, 8153.0, 8842.9, 8298.7, 9021.4, and 6042.9. Under the “I E subscript 6” column are the values: 9590.6, 10495.7, 10679.0, 10873.9, not available, and 12311.5. Under the “I E subscript 7” column are the values: 11343, 12272.9, 13315.0, 13594.8, not available, and not available.»>
Таблица 2. Энергии последовательной ионизации для выбранных элементов (кДж / моль) Элемент IE 1 IE 2 IE 3 IE 4 IE 5 IE 6 IE 7 К 418.  8
8 3051,8 4419,6 5876,9 7975,5 9590,6 11343 Ca 589,8 1145,4 4912,4 6490,6 8153,0 10495,7 12272,9 SC 633,1 1235,0 2388,7 7090,6 8842,9 10679,0 13315,0 Ga 578.8 1979,4 2964,6 6180 8298,7 10873,9 13594,8 Ge 762,2 1537,5 3302,1 4410,6 9021,4 НЕТ НЕТ Как 944,5 1793,6 2735,5 4836,8 6042,9 12311,5 НЕТ Пример 2
Рейтинг энергии ионизации 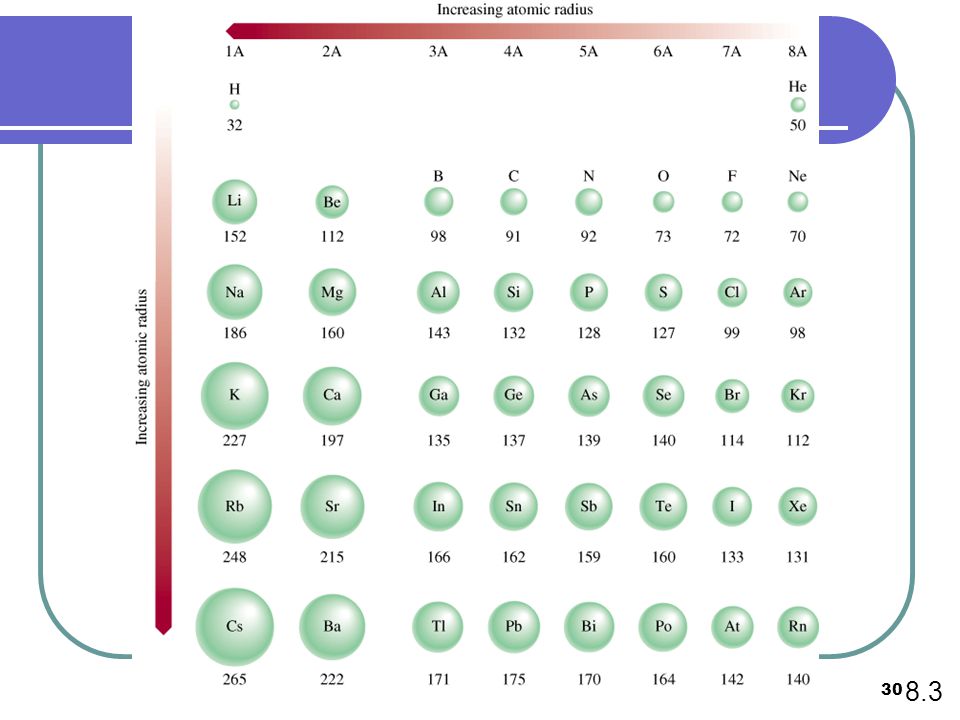 {\ text {-}} \ right) [/ latex] требует больше энергии, потому что катион Al 2+ оказывает более сильное притяжение на электрон, чем нейтральный атом Al, поэтому IE 1 (Al)
{\ text {-}} \ right) [/ latex] требует больше энергии, потому что катион Al 2+ оказывает более сильное притяжение на электрон, чем нейтральный атом Al, поэтому IE 1 (Al) Изменение сродства к электрону
 EA некоторых элементов приведено на рисунке 6. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным, а значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом.Второй EA — это энергия, связанная с добавлением электрона к аниону с образованием –2-иона и так далее.
EA некоторых элементов приведено на рисунке 6. Вы можете видеть, что многие из этих элементов имеют отрицательные значения EA, что означает, что энергия высвобождается, когда газообразный атом принимает электрон. Однако для некоторых элементов требуется энергия, чтобы атом стал отрицательно заряженным, а значение их EA положительно. Как и в случае с энергией ионизации, последующие значения EA связаны с образованием ионов с большим зарядом.Второй EA — это энергия, связанная с добавлением электрона к аниону с образованием –2-иона и так далее.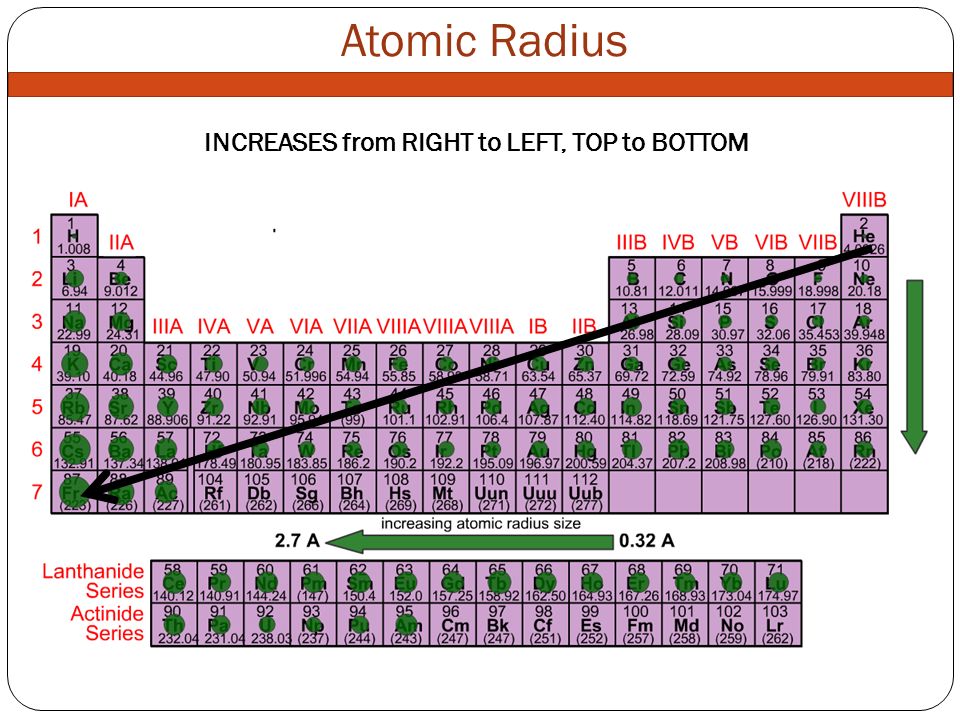 Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию нп , так что, опять же, наблюдаемое значение EA не соответствует прогнозируемой тенденции. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть спарен с существующим электроном np .Во всех этих случаях начальная относительная стабильность электронной конфигурации нарушает тренд EA.
Группа 2 (2A) имеет заполненную подоболочку нс , и поэтому следующий добавленный электрон переходит в более высокую энергию нп , так что, опять же, наблюдаемое значение EA не соответствует прогнозируемой тенденции. Наконец, группа 15 (5A) имеет наполовину заполненную подоболочку np , и следующий электрон должен быть спарен с существующим электроном np .Во всех этих случаях начальная относительная стабильность электронной конфигурации нарушает тренд EA. Основные понятия и краткое содержание
Конфигурации Химия: упражнения в конце главы
Избранные ответы
— Глоссарий
половина расстояния между ядрами двух одинаковых атомов, когда они соединены ковалентной связью
заряд, который приводит к кулоновской силе, действующей со стороны ядра на электрон, рассчитывается как заряд ядра за вычетом экранирования
энергия, необходимая для присоединения электрона к газообразному атому с образованием аниона
энергия, необходимая для удаления электрона из газообразного атома или иона.

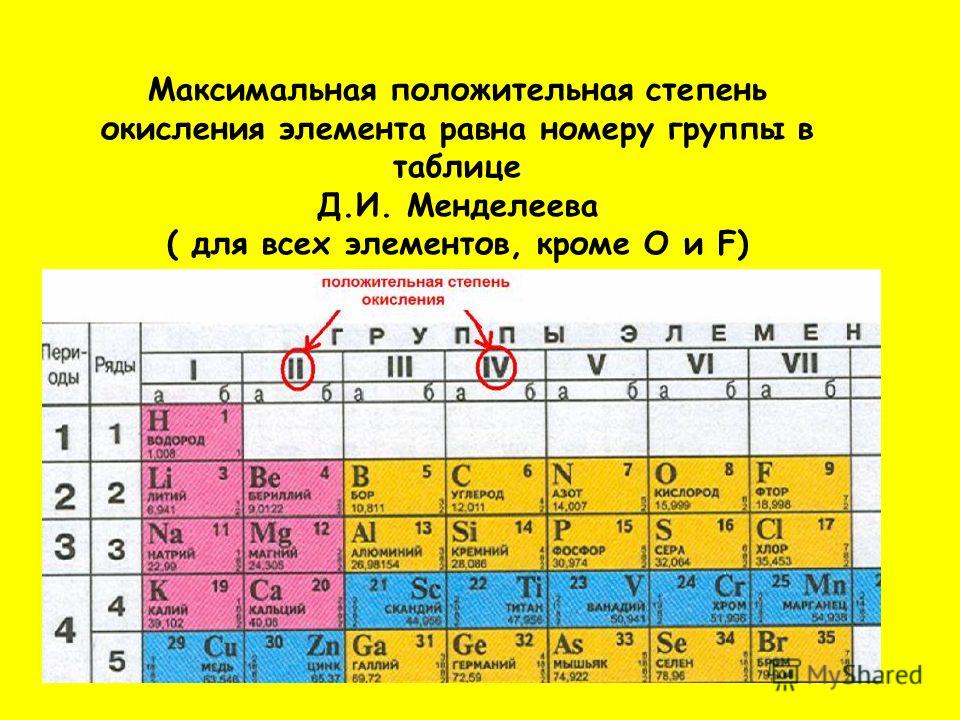 Оксфорд: Clarendon Press, 1998.
Оксфорд: Clarendon Press, 1998.
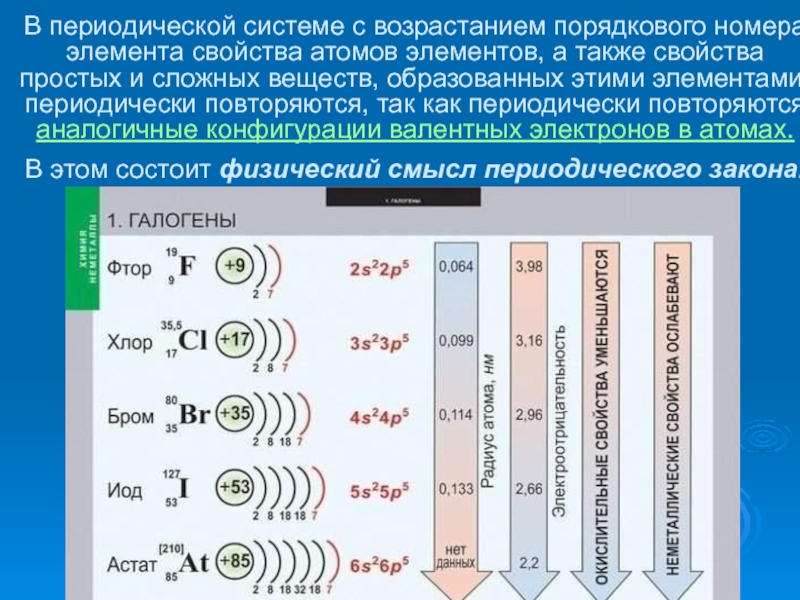 2 .
2 .
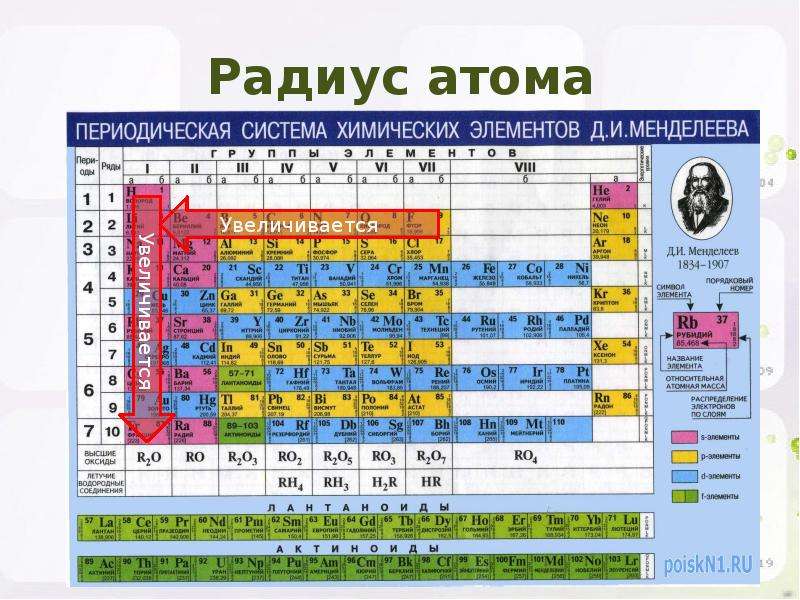





 И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один.
И наоборот, если валентная оболочка заполнена более чем наполовину, легче втянуть электрон в валентную оболочку, чем отдать один. Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.
Это потому, что их металлические свойства влияют на их способность притягивать электроны так же легко, как и другие элементы.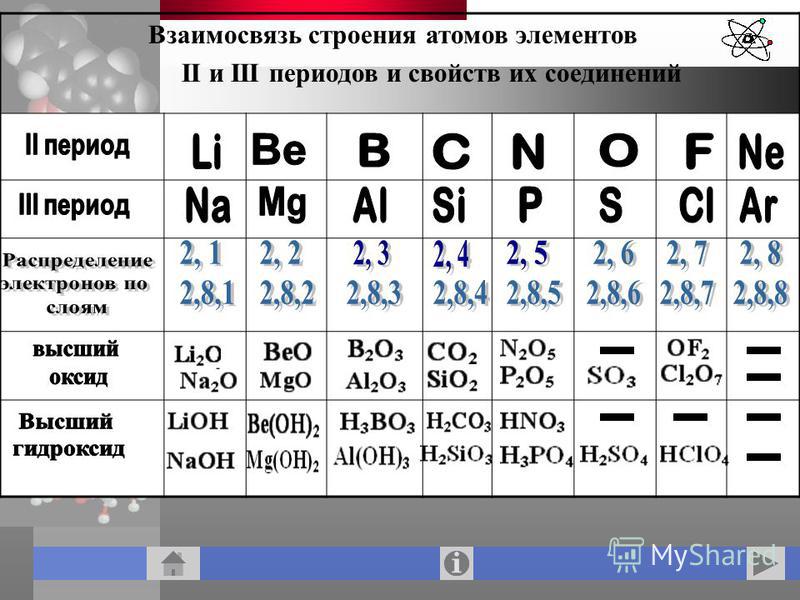
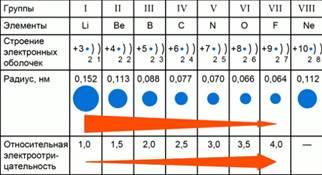
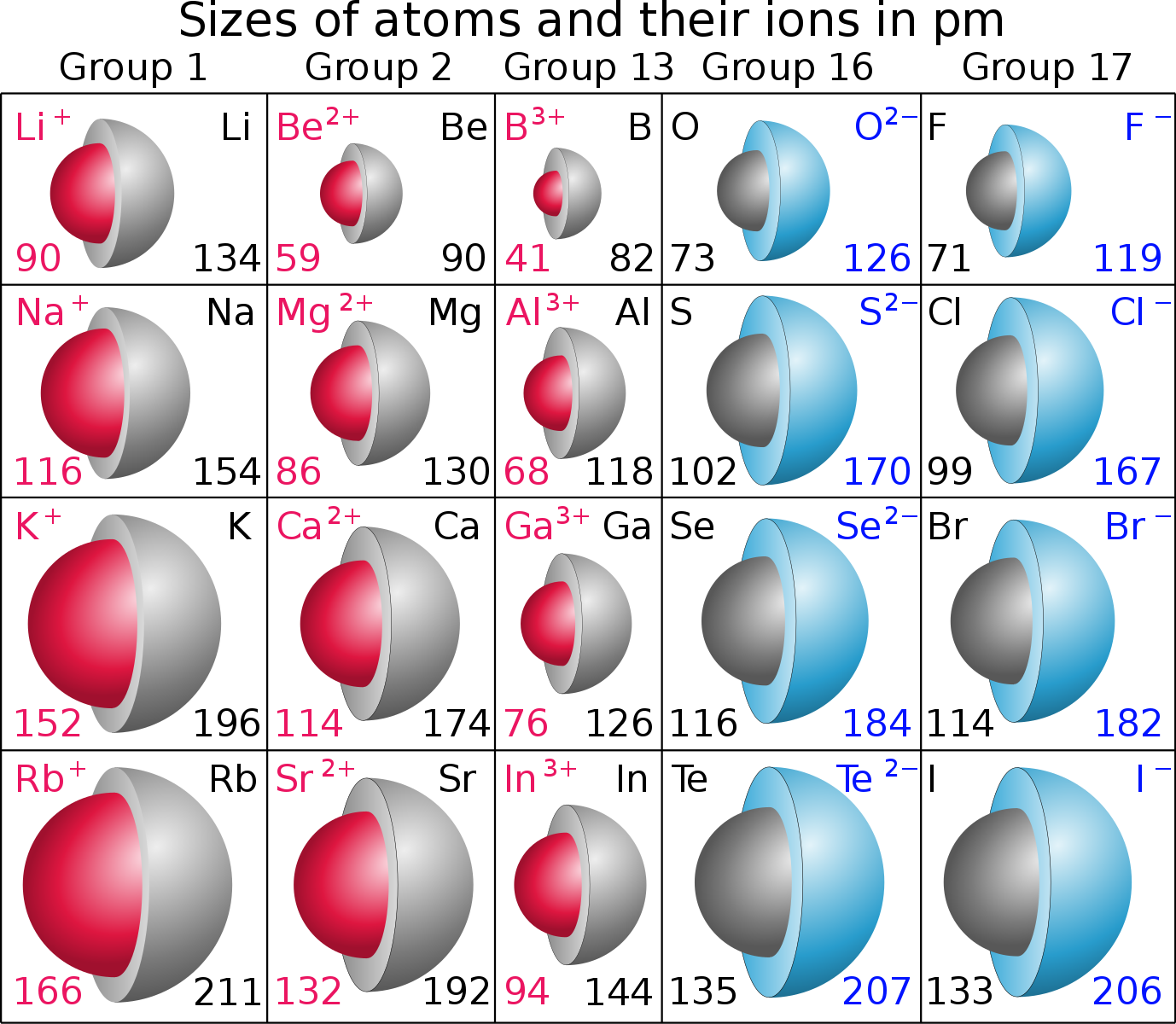

Leave A Comment