Азот — степени окисления, свойства и реакции
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
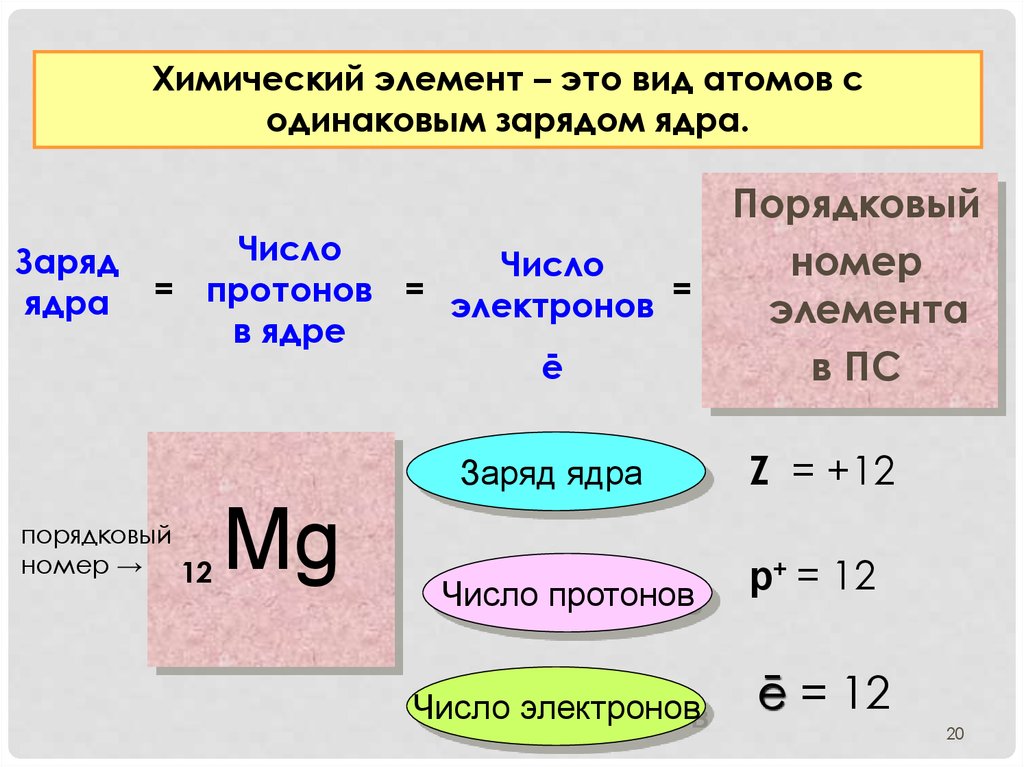
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
Длина связи — 0,110 нм.
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
youtube.com/embed/wBrC6oI6M8c» title=»YouTube video player» frameborder=»0″ allow=»accelerometer; autoplay; clipboard-write; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»» ssmarticle=»»>Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.

Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.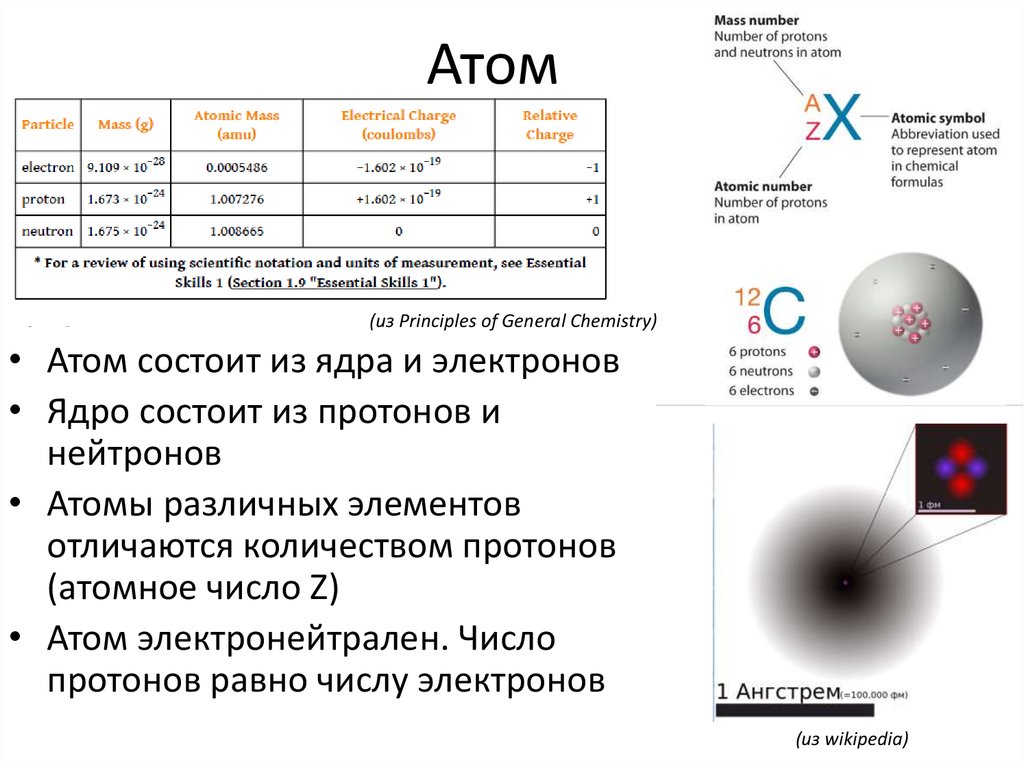
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.

Азотная кислота
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.

Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.

Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
c
a
c
b
c
Физика Открытие протона и нейтрона. Состав атомного ядра. Ядерные силы
com/embed/QGbhAuEsUKo» frameborder=»0″ allowfullscreen=»»>Материалы к уроку
Конспект урока
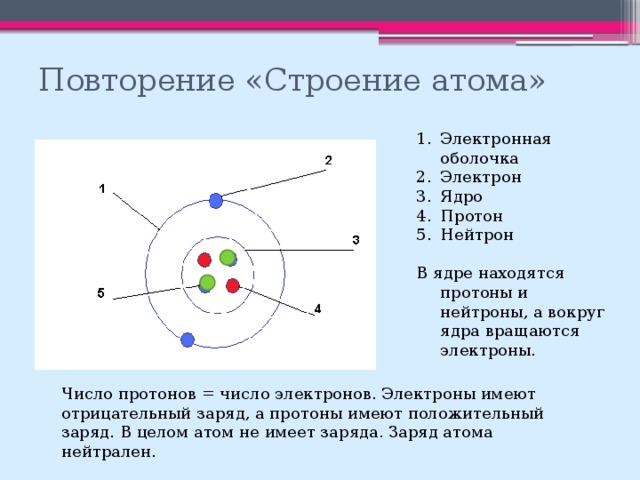
Опыт Резерфорда и открытие радиоактивности свидетельствуют о сложном строении атома.
Резерфорд обладал научной интуицией, и в 1913 году он предположил, что одна из частиц, входящих в состав каждого атома, есть ни что иное, как ядро атома водорода.
На какие же факты опирался ученый, когда сделал это гениальное предположение?
Оказывается, масса ядра любого химического элемента отличается от массы ядра водорода в целое число раз.
Убедится в истинности гипотезы, что одной из частиц атома является ядро водорода, удалось, когда с помощью камеры Вильсона сфотографировали треки (следы) альфа-частиц, которые взаимодействовали с атомами азота.На картинке, которую наблюдали ученые, видны следы альфа-частиц, которые, в большинстве своем, никак не изменяют своего движения. И только в одном месте наблюдается разветвление. Оно означает, что в этом месте альфа-частица «встретилась» с ядром атома азота.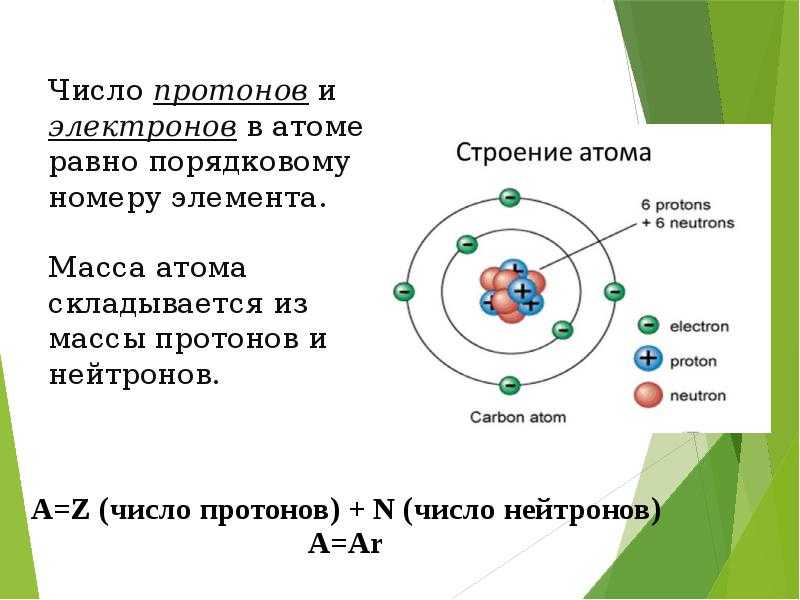 В результате такого столкновения образовались ядра атомов водорода и кислорода (в этом можно убедиться, если изучить траектории искривления треков, поместив всю систему в магнитное поле).
В результате такого столкновения образовались ядра атомов водорода и кислорода (в этом можно убедиться, если изучить траектории искривления треков, поместив всю систему в магнитное поле).
Атом водорода, то есть частица, которая, как мы уже убедились на опыте, входит в состав атома, Резерфорд назвал протоном. В переводе с греческого слово «протон» означает первый.
Запишем реакцию взаимодействия между атомами азота и альфа-частицами.
При взаимодействии азот с альфа частицей, а альфа частица есть ядро гелия, происходит преобразование в кислород и водород.
Протон обозначают символом «пэ», с массовым и зарядовым числами, равными единице. Величина заряда протона по модулю равна величине заряда электрона.
Ученые также обстреливали альфа частицами такие вещества, как бор, алюминий, натрий и многие другие. Во всех случаях в результате взаимодействия ядер выбивались протоны (ядра водорода). Это дало основание предположить, что протоны входят в состав всех химических элементов.
Чтобы упростить процесс понимания строения ядра, Резерфорд предложил следующую модель: ядро состоит из упругих сфер, похожих на бильярдные шары. Используя этот простой образ, ученый мог построить все элементы, поскольку все они состоят из одного базового компонента – протона. Водород состоит из одного такого элемента. Все остальные элементы образованы путем добавления протона в ядро. Гелий, второй элемент, так же очень легкий, состоит из двух протонов. У лития три протона, и так далее. Получалось, что каждый элемент определялся числом протонов в ядре.
После того, как ученым удалось взвесить атом, оказалось, что все ядра, кроме водорода, весили больше, чем должны были быть. Например, гелий, с двумя протонами, должен был весить как два ядра водорода, а весил в два раза больше. Значит, в ядре есть еще какие-то частицы. Тогда Резерфорд предположил, что существует нейтральная частица, то есть частица, у которой нет заряда. Эта частица входит в состав ядра. Она получила название нейтрон.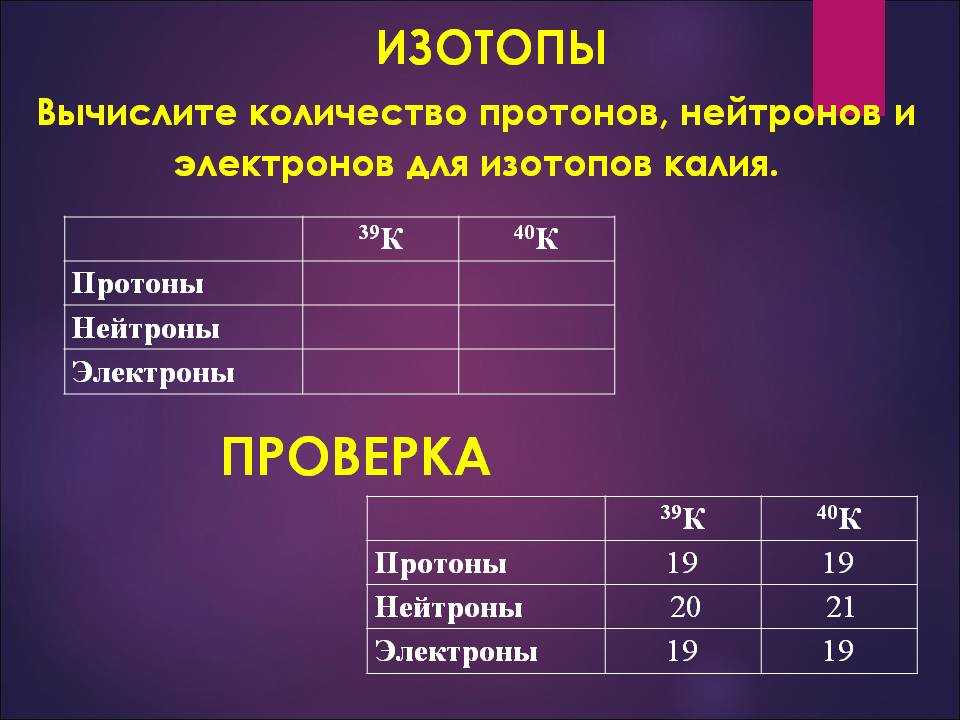 А масса этой частицы, приблизительно равна массе протона. Частицу обозначили буквой «эн». Как вы видите, зарядовое число частицы равно нулю. Зарегистрировать нейтрон было гораздо сложнее, так как он не имеет заряда, и это удалось сделать лишь в 1932 году Джеймсу Чедвику. Наличие в ядре нейтрона, сразу решило проблему веса атома. Гелий в четыре раза тяжелее водорода, так как кроме двух протонов он содержит два нейтрона. Литий в шесть раз тяжелее водорода, так как он содержит три протона и три нейтрона и так далее. Такая модель атома, получила название протонно-нейтронная модель строения ядра. Частицы, из которых состоит ядро, протоны и нейтроны, можно назвать одним словом — нуклоны. Общее число нуклонов обозначают буквой А, это массовое число. Например, в атоме лития число нуклонов равно шести. В азоте — четырнадцати. Число протонов в ядре обозначается буквой Z — это зарядовое число. Например, в литии, число протонов равно трем, значит и зарядовое число равно трем. Зарядовое число в азоте равно семи.
А масса этой частицы, приблизительно равна массе протона. Частицу обозначили буквой «эн». Как вы видите, зарядовое число частицы равно нулю. Зарегистрировать нейтрон было гораздо сложнее, так как он не имеет заряда, и это удалось сделать лишь в 1932 году Джеймсу Чедвику. Наличие в ядре нейтрона, сразу решило проблему веса атома. Гелий в четыре раза тяжелее водорода, так как кроме двух протонов он содержит два нейтрона. Литий в шесть раз тяжелее водорода, так как он содержит три протона и три нейтрона и так далее. Такая модель атома, получила название протонно-нейтронная модель строения ядра. Частицы, из которых состоит ядро, протоны и нейтроны, можно назвать одним словом — нуклоны. Общее число нуклонов обозначают буквой А, это массовое число. Например, в атоме лития число нуклонов равно шести. В азоте — четырнадцати. Число протонов в ядре обозначается буквой Z — это зарядовое число. Например, в литии, число протонов равно трем, значит и зарядовое число равно трем. Зарядовое число в азоте равно семи. Протонно-нейтронная модель атома так же объяснила существование изотопов, то есть разновидности одного и того же химического элемента, которые отличаются только массами атомных ядер. Оказывается, ядра изотопов содержат то же самое количество протонов, что и сам элемент, но разное число нейтронов. Например, в состав изотопа водорода дейтерия входят две частицы протон и нейтрон. Тогда, как сам водород,- это есть только один протон. Силы, благодаря которым нуклоны удерживаются в ядре, получили название ядерные силы. Это особый вид взаимодействия, который не встретишь в нашем макромире. Эти силы действуют только на очень малом расстоянии, но они очень велики.
Протонно-нейтронная модель атома так же объяснила существование изотопов, то есть разновидности одного и того же химического элемента, которые отличаются только массами атомных ядер. Оказывается, ядра изотопов содержат то же самое количество протонов, что и сам элемент, но разное число нейтронов. Например, в состав изотопа водорода дейтерия входят две частицы протон и нейтрон. Тогда, как сам водород,- это есть только один протон. Силы, благодаря которым нуклоны удерживаются в ядре, получили название ядерные силы. Это особый вид взаимодействия, который не встретишь в нашем макромире. Эти силы действуют только на очень малом расстоянии, но они очень велики.
Остались вопросы по теме? Наши репетиторы готовы помочь!
Подготовим к ЕГЭ, ОГЭ и другим экзаменам
Найдём слабые места по предмету и разберём ошибки
Повысим успеваемость по школьным предметам
Поможем подготовиться к поступлению в любой ВУЗ
Выбрать репетитораОставить заявку на подбор
Атомный номер азота 7.
 Сколько протонов, нейтронов и электронов составляют атом азота-15?
Сколько протонов, нейтронов и электронов составляют атом азота-15?Последняя обновленная дата: 27 февраля 2023 г.
•
Общее представление: 239,1K
•
Просмотр сегодня: 2,23K
Ответ
Проверено
239,1K+ виды
HINT . атом всегда равен своему атомному номеру, то есть Z, а количество электронов в атоме всегда равно количеству протонов, чтобы поддерживать электрическую нейтральность атома, и мы можем найти количество нейтронов, применяя формулу как: $ Z+N=А$. Теперь вы можете легко ответить на данное утверждение соответствующим образом.
Полный пошаговый ответ:
Азот-15 представляет собой изотоп атома азота и образуется, когда атом азота приобретает один нейтрон в ядре. Изотопы – это вещества, имеющие одинаковый атомный номер, но разные массовые числа. Так, в азоте-15 атомный номер азота равен 7, а массовое число азота равно 15.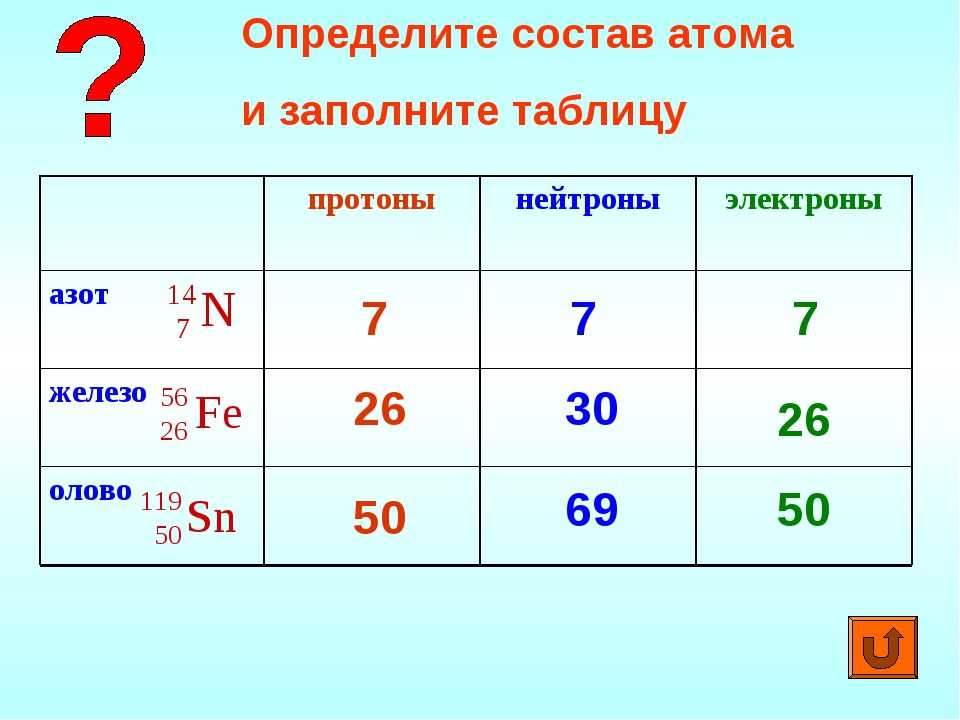
Число протонов в атоме равно атомному номеру, т. е. Z. А мы знаем, что атомный номер азота равен 7, значит, число протонов в азоте равно 7,9.0025 Количество электронов в атоме всегда равно количеству протонов. Итак, в азоте-15 число протонов в ядре равно семи и, следовательно, число электронов, вращающихся вокруг ядра, также равно семи.
Количество нейтронов в атоме можно рассчитать как;
$Z+N=A$
Здесь Z — атомный номер.
N представляет количество нейтронов
A представляет собой атомную массу атома.
Насколько нам известно;
Z=7
А=15 (дано)
Тогда;
$\begin{align}
& 7+N=15 \\
& N=15-7=8 \\
\end{align}$
Итак, число нейтронов в атоме азота равно восьми.
Следовательно, семь протонов, восемь нейтронов и семь электронов составляют атом азота-15.
Примечание: Протоны — это положительно заряженные частицы атома, электроны — отрицательно заряженные частицы атома, а нейтроны — нейтральные частицы атома, т. е. они не несут никакого заряда.
е. они не несут никакого заряда.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал 12 класса химии JEE_Main
Что из нижеперечисленного является истинным пероксидом A rmSrmOrm2 класс 12 по химии JEE_Main
Какой элемент обладает наибольшим атомным радиусом A 11 класс по химии JEE_Main
Фосфин получают из следующей руды A Кальций 12 класса по химии JEE_Main
Возникающие сомнения
Рассчитайте число протонов и нейтронов в изотопах азота 13N, 14N, 15N, 16N и 17N
сек) с массовыми числами 13, 14, 15, 16 и 17. Рассчитайте количество протонов и нейтронов в каждом из изотопов азота.
Рассчитайте количество протонов и нейтронов в каждом из изотопов азота.
Решение:
Атомный номер (Z) азота равен 7. Атомный номер всегда равен количеству протонов. А число протонов всегда равно числу электронов в незаряженном атоме, так что атом электрически нейтрален.
Следовательно, незаряженный атом азота всегда имеет 7 протонов и 7 электронов.
Изотоп образуется при изменении числа нейтронов в атоме одного и того же элемента. Это изменяет массовое число в ядре атома, поскольку массовое число А представляет собой сумму протонов и нейтронов. Число протонов остается неизменным.
массовое число A= количество протонов (p) + количество нейтронов (n)
массовое число записывается в виде надстрочного индекса рядом с символом элемента, например,
So, the number of neutrons in different Nitrogen isotopes 13 N, 14 N, 15 N, 16 N, and 17 N is-
13 N Изотоп:
Массовое число = 13 (Дано)
Массовое число (A) = число протонов (p) + число нейтронов (n)
A= p+ n
Следовательно, n= A-p = 13 -7 = 6.
Решение с использованием таблицы журнала-
n= A-p
Applying log 10 on both sides
log 10 n= log (A-Z)
log 10 n= log 10 (13-7) =log 10 6 =0.7782
Applying antilog,
n =Antilog (0.7782)
6.001 = 6
The number of neutrons in the 13 N Isotope is 6, and the number of protons is 7.
14 N Изотоп
Массовое число = 14 (Дано)
Массовое число (A) = число протонов (p) + число нейтронов (n)
A= p+ n
Следовательно, n= A-p = 14-7 = 7.
Решение с использованием журнала Table-
N = A-P
Применение LOG 10 с обеих сторон
Log 10 N = log (A-Z)
Log 10 n = log (9014 ( (a-z)
-7) = log 10 7 =0,8451
Применение антилогарифмического,
n = антилогарифмическое (0,8451) = 7
The number of neutrons in the 14 N Isotope is 7, and the number of protons is 7.
15 N Isotope
Mass number =15 (Given)
массовое число (A) = количество протонов (p) + количество нейтронов (n)
A= p+ n
Следовательно, n= A-p = 15 — 7 = 8.
Решение с использованием логарифмической таблицы- n= A-p
Бревно для нанесения 10 с обеих сторон
log 10 n = log (a-z)
log 10 n = log 10 (14-7) = log 10 8 = 0,9031
Применение Antilog,
N = 0,9031. = 8
Количество нейтронов в 15 N изотоп составляет 8, а количество протонов составляет 7.
16 N Изотоп
Mass Number = 16 (дано).
массовое число (A) = количество протонов (p) + количество нейтронов (n)
A = P+ N
Следовательно, n = A-P = 16- 7 = 9.
Решение с использованием Log Table-
N = A-P
Применение журнала 10 на обеих сторонах
Log 10 10 .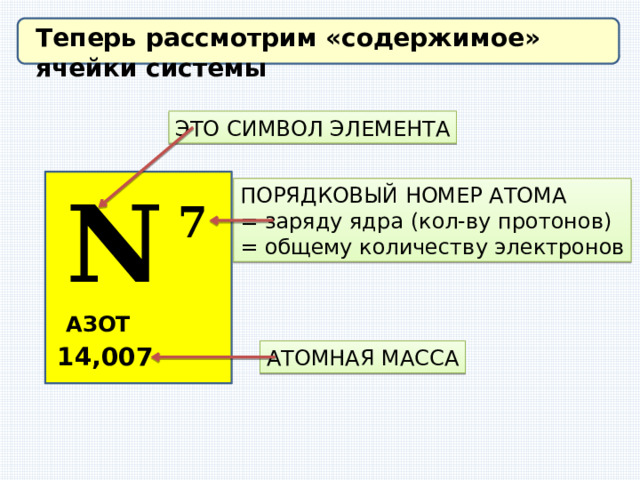


Leave A Comment