Вопрос: Сколько нуклеотидов составляют антикодон тРНК? Ответ на вопрос – iq2u
Точные науки Биология
Ответ:
3
Что? Где? Когда? Эрудит онлайн: ответы на вопросы:
- Выбери правильный ответ. Средняя скорость вертолёта 240 км/ч. Сколько километров от пролетит за 4 ч?
- При остывании на 15°С тело потеряло количество теплоты, равное 2500 Дж. Сколько теплоты оно потеряет, остывая на 45°С?
- Сколько фаз работоспособности существует?
- Сколько десятичных дробей расположено между дробями 5,61 и 5,62?
- Сколько фосфолипидных слоев содержит мембрана?
- Мы знаем, что на Земле более 240 государств, а сколько народов?
- Какое число нуклеотидов в ДНК кодируют 40 аминокислот? Оля нарисовала 6 кружков, это на 4 больше, чем треугольников. Сколько треугольников нарисовала Оля?»>
- От куска ткани отрезали 4 м. Это составило 20% длины всего куска. Сколько ткани было в куске?
- Какое число нуклеотидов в иРНК шифруют 20 аминокислот?
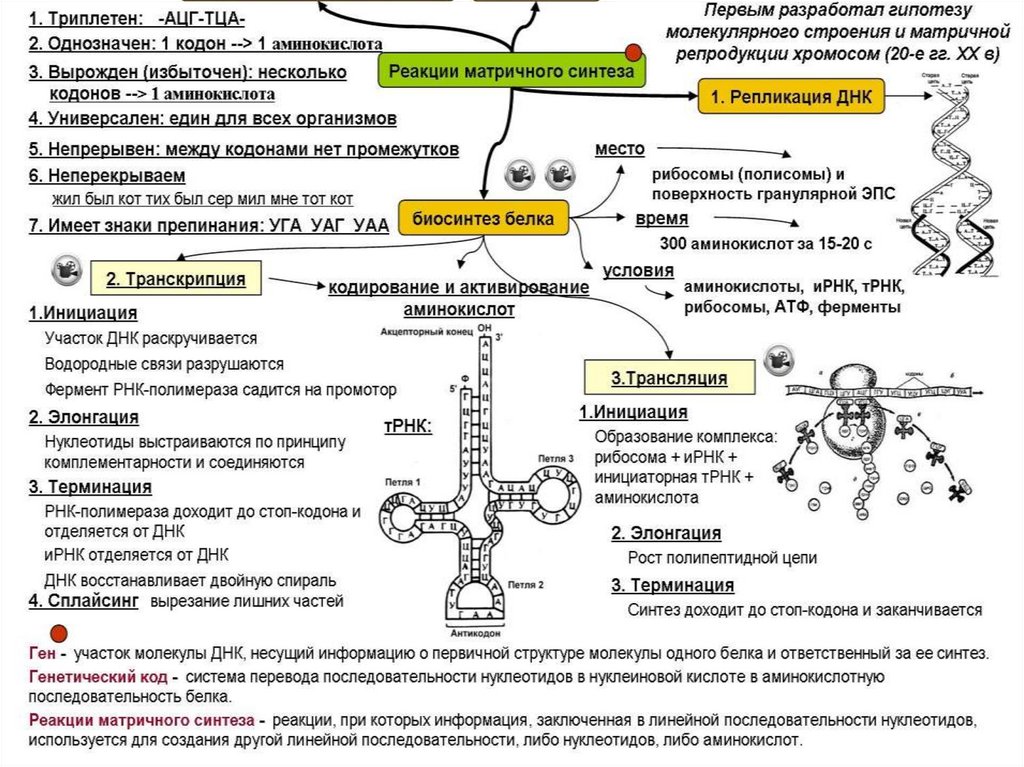
Свойства генетического кода. Задачи 119
Задача 119.
Участок молекулы ДНК имеет следующую последовательность нуклеотидов:
Г-Т-Г-Т-А-Т-Г-Г-А-А-Г-Т
Определите последовательность нуклеотидов на и-РНК, антикодоны соответствующих т-РНК и последовательность аминокислот в фрагменте молекулы белка, используя таблицу генетического кода.
Решение:
По принципу комплементарности (Г = Ц, А = У) с генетического кода ДНК выстраиваются нуклеотиды иРНК (транскрибция). К кодонам иРНК подбираются комплементарные антикодоны-триплеты нуклеотидов тРНК, и соединяются водородными связями (кодон = антикодон) тоже по принципу комплементарности. Каждый триплет тРНК приносит определенную аминокислоту, согласно генетическому коду. Цепь аминокислот и есть синтезируемый белок.
ДНК: Г-Т-Г-Т-А-Т-Г-Г-А-А-Г-Т
иРНК: Ц-А-Ц-А-У-А-Ц-Ц-У-У-Ц-А
тРНК: ГУГ, УАУ, ГГА, АГУ
Зная последовательность нуклеотидов в иРНК разобъём её на триплеты, получим:
ЦАЦ-АУА-ЦЦУ-УЦА, и затем по таблице «Генетический код» определим последовательность аминокислот в полипептидной цепи.
Участок полипептидной цепи будет состоять из следующей последовательности аминокислот:
гистидин — изолейцин — пролин — серин.
Задача 120.
Участок молекулы ДНК:
АЦЦ-АТА-ГТЦ-ЦАА-ГГА
Определите последовательность аминокислот в полипептиде.
Решение:
По принципу комплементарности (Г = Ц, А = У) с генетического кода ДНК выстраиваются нуклеотиды иРНК (транскрибция), получим:
ДНК: АЦЦ-АТА-ГТЦ-ЦАА-ГГА
иРНК: УГГ-УАУ-ЦАГ-ГУУ-ЦЦУ
На основе триплетов иРНК и используя таблицу «Генетический код», можно построить белковую молекулу с соответствующими аминокислотами, получим:
триптофан — тирозин — глицин — валин — пролин.
Задача 121.
В биосинтезе полипептида участвуют молекулы тРНК с антикодонами УАЦ, УУУ, ГЦЦ, ЦАА в данной последовательности. Определите соответствующую последовательность нуклеотидов на иРНК, ДНК и последовательность аминокислот во фрагменте молекулы белка, используя таблицу генетического кода.
Решение:
Пользуясь принципом комплементарности, по тРНК можно восстановить иРНК (антикодону УАЦ комплементарен кодон АУГ, антикодону УУУ комплементарен кодон ААА, антикодону
последовательность нуклеотидов одной цепи ДНК: ТАЦ-ТТТ-ГЦЦ-ЦАА (надо помнить, что в ДНК отсутствует урацил, вместо него становится тимин).
Следовательно, необходимо записать:
тРНК: УАЦ, УУУ, ГЦЦ, ЦАА
иРНК: АУГ- ААА -ЦГГ- ГУУ
ДНК: ТАЦ -ТТТ -ГЦЦ -ЦАА
Зная последовательность кодонов в иРНК: АУГ-ААА-ЦГГ-ГУУ по таблице «Генетический код» определим кодируемый белок, получим:
метионин — изолейцин — аргинин — валин.
Задача 122.
В молекуле ДНК обнаружено 880 гyаниловых нуклеотидов, которые составляют 22% от общего количества нуклеотидов этой ДНК. Определите: а) сколько содержится других нуклеотидов (по отдельности) в этой молекуле ДНК; б) какова длина ДНК.
Определите: а) сколько содержится других нуклеотидов (по отдельности) в этой молекуле ДНК; б) какова длина ДНК.
Решение:
Длина нуклеотида = 0,34 нм.
Согласно принципу комплементарности гуанил всегда стоит в паре с цитозином, значит их количество одинаково, т.е. Г = Ц = 22%, а вместе они составляют 44%.
Тогда на долю остальных нуклеотидов приходится 100% — 44% = 56%. Поскольку аденин всегда находится в паре с тимином, то А = Т = 56%, а на каждого из них приходится 56 : 2 = 28%.
Nобщ. = (80 * 100)/22 = 4000.
а) Рассчитаем количество нуклеотидов по отдельности
Г = Ц по 880 каждого;
А = Т = 28%
Отсюда
А = Т = (28 * 4000)/100 = 1120, по 1120 каждого.
б) Рассчёт длины молекулы ДНК
Поскольку молекула ДНК двухцепочечная, то чтобы узнать, сколько нуклеотидов в одной цепи, надо 4000 : 2 = 2000 пар нуклеотидов.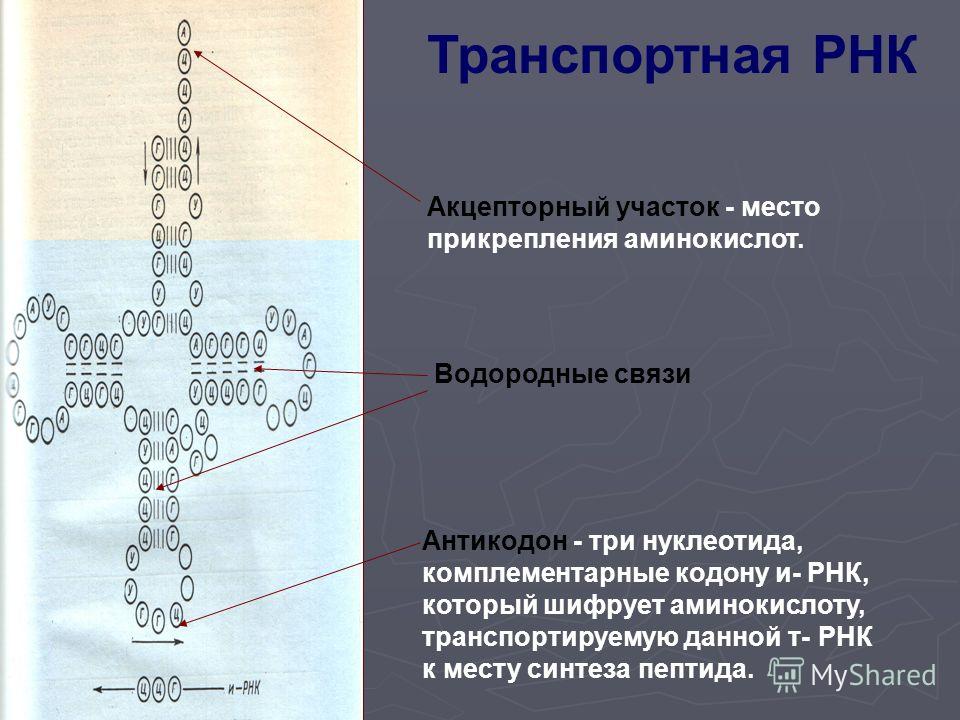
цепи, можно вычислить длину ДНК : 2000 х 0,34 нм = 680 нм.
Задача 123.
Вирус коровьей оспы содержит двухцепочную ДНК. После внедрения в клетку-хозяина при участии собственной транскриптазы происходит синтез как вирусной РНК, так и репликация вирусной ДНК. Составьте схему репликации ДНК, транскрипции и трансляции белков капсулы следующих участков вирусной ДНК:
ГГТ ТЦА АЦЦ ТАЦ ГТА ЦЦА ЦАЦ.
Решение:
1. Репликация ДНК
Правая цепь молекулы ДНК комплементарна левой (А — Т, Г — Ц). Используя правило комплементарности, в соответствии с кодом известной цепи вирусной ДНК
записываем нуклеотиды второй цепи, получим: ЦЦА АГТ ТГГ АТГ ЦАТ ГГТ ГТГ.
Следовательно, необходимо записать:
ДНК: 5′ ГГТ ТЦА АЦЦ ТАЦ ГТА ЦЦА ЦАЦ 3′
ДНК: 3′ ЦЦА АГТ ТГГ АТГ ЦАТ ГГТ ГТГ 5′
2. Транскрипция иРНК
При участии собственной транскриптазы происходит синтез вирусной иРНК по принципу комплементарности (Г = Ц, А = У) с генетического кода вирусно ДНК выстраиваются нуклеотиды иРНК (транскрипция):
ДНК: ГГТТЦААЦЦ ТАЦ ГТАЦЦА ЦАЦ
иРНК: ЦЦА АГУ УГГ АУГ ЦАУ ГГУ ГУГ
3. Трансляции белков вирусной капсулы
Трансляции белков вирусной капсулы
Зная последовательность триплетов в иРНК и используя таблицу «Генетический код», можно построить белковую молекулу с соответствующими аминокислотами:
пролин — серин — триптофан — метионин — гистидин — глицин — валин.
Задача 124.
В биосинтезе фрагмента молекулы белка последовательно участвовали тРНК с антикодонами ЦЦА, УЦУ, ГЦА, ААУ. Определите состав фрагментов молекул ДНК, иРНК, синтезируемого белка. Ответ поясните. Для решения задания используйте таблицу генетического кода.
Решение:
Пользуясь принципом комплементарности, по тРНК можно восстановить иРНК (антикодону ЦЦА комплементарен кодон ГГУ, антикодону УЦУ комплементарен кодон АГА, антикодону
ГЦА комплементарен кодон ЦГУ, антикодону ААУ комплементарен кодон УУА. Используя принцип комплементарности, по иРНК можно восстановить последовательность нуклеотидов одной цепи ДНК: ЦТА-АГЦ-ЦГТ-АГТ (надо быть внимательными и помнить, что в ДНК отсутствует урацил, вместо него становится тимин).
Следовательно, необходимо записать:
тРНК: ЦЦА, УЦУ, ГЦА, ААУ
иРНК: ГГУ АГА ЦГУ УУА
ДНК: ЦЦА ТЦТ ГЦА ААТ
Зная последовательность кодонов в иРНК: ГГУ АГА ЦГУ УУА по таблице «Генетический код» определим кодируемый белок, получим:
глицин — аргинин — аргинин — лейцин.
Задача 125.
Ген содержит 1200 нуклеотидов. В одной из цепей содержится 130 нуклеотидов А, 150 нуклеотидов Т, 210 нуклеотидов Г и 110 нуклеотидов Ц. Сколько нуклеотидов каждого вида будет в фрагменте ДНК, кодирующей белок? Сколько аминокислот будет закодировано данным фрагментом ДНК?
Решение:
Согласно принципу комплементарности во второй цепи ДНК содержится нуклеотидов: А — 150, Т — 130, Г — 110, Ц – 210. В двух цепях ДНК содержится нуклеотидов:
А = 130 + 150 = 280, значит Т = А = 280; Ц = 210 + 110 = 320, значит Г = Ц = 320. Общее число нуклеотидов будет 1200 (А + Т + Ц + Г = 280 + 280 + 320 + 320 = 1200).
Информацию о структуре белка несет одна из двух цепей, число нуклеотидов в одной цепи ДНК равно 600 (1200/2 = 600), поскольку одну аминокислоту кодирует 3 нуклеотида, поэтому в белке должно содержаться 600 : 3 = 200 аминокислот.
Ответ: 200 аминокислот.
Задача 126.
В одной молекуле ДНК нуклеотиды с аденином (А) составляют 31% от общего числа нуклеотидов. Определите количество (в %) нуклеотидов с тимином (Т), гуанином (Г), цитозином (Ц) в молекуле ДНК и объясните полученные результаты.
Решение:
Согласно принципу комплементарности аденин всегда стоит в паре с тимином, значит их количество одинаково, т.е. А = Т = 31%, а вместе они составляют 61%.
Тогда на долю остальных нуклеотидов приходится 100% — 62% = 38%. Поскольку гуанин всегда находится в паре с цитозином, то Г = Ц = 38%, а на каждого из них приходится 38 : 2 = 19%.
Ответ: Т = А = 31%; Г = Ц = 19%.
Задача 127.
Полипептидная цепь состоит из остатков аминокислот: валин-лейцин-гистидин-серин-изолейцин. Какова последовательность нуклеотидов на участке днк, кодирующем синтез этого полипептида? Какова длина данного участка днк?
Решение:
Длина нуклеотида = 0,34 нм.
Воспользуемся генетическим кодом для построения иРНК. Можно брать из него любой триплет, соответствующий аминокислоте. Например, иРНК может быть
такой: ГУУ-ЦУУ-ЦАЦ-АГЦ-АУУ. По принципу комплементарности ей будет соответствовать ДНК: ЦАА-ГАА-ГТГ-ТЦГ-ТАА.
Так как общее число нуклеотидов участка ДНК равно 15, то, зная длину одного нуклеотида определим длину участка ДНК, получим:
L(ДНК) = 15 * 0,34 = 5,1 нм.
Ответ: ДНК: ЦАА-ГАА-ГТГ-ТЦГ-ТАА; L(ДНК) = 5б1 нм.
Происхождение и ранняя эволюция молекулы тРНК
1. Crick F.H.C. Генетический код — вчера, сегодня и завтра. Харб Колд Спринг. Квант. биол. 1966; 31: 1–9. doi: 10.1101/SQB.1966.031.01.007. [PubMed] [CrossRef] [Google Scholar]
Харб Колд Спринг. Квант. биол. 1966; 31: 1–9. doi: 10.1101/SQB.1966.031.01.007. [PubMed] [CrossRef] [Google Scholar]
2. Hoagland M.B., Stephenson M.L., Scott J.F., Hecht L.I., Zamecnik P.C. Растворимый интермедиат рибонуклеиновой кислоты в синтезе белка. Дж. Биол. хим. 1958; 231: 241–257. [PubMed] [Google Scholar]
3. Crick F.H.C. О вырожденных шаблонах и гипотезе адаптера. [(по состоянию на 27 ноября 2015 г.)];1955 Доступно в Интернете: https://profiles.nlm.nih.gov/ps/access/SCBBGF.pdf
4. Кузон Дж. Малые РНК вызывают большой всплеск. Наука. 2002; 298:2296–2297. doi: 10.1126/science.298.5602.2296. [PubMed] [CrossRef] [Google Scholar]
5. Jühling F., Mörl M., Hartmann R.K., Sprinzl M., Stadler P.F., Pütz J. tRNAdb 2009: Компиляция последовательностей тРНК и генов тРНК. Нуклеиновые Кислоты Res. 2009; 37: Д159–Д162. doi: 10.1093/nar/gkn772. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
6. Kim S.H., Suddath F.L., Quigley G.J., McPherson A.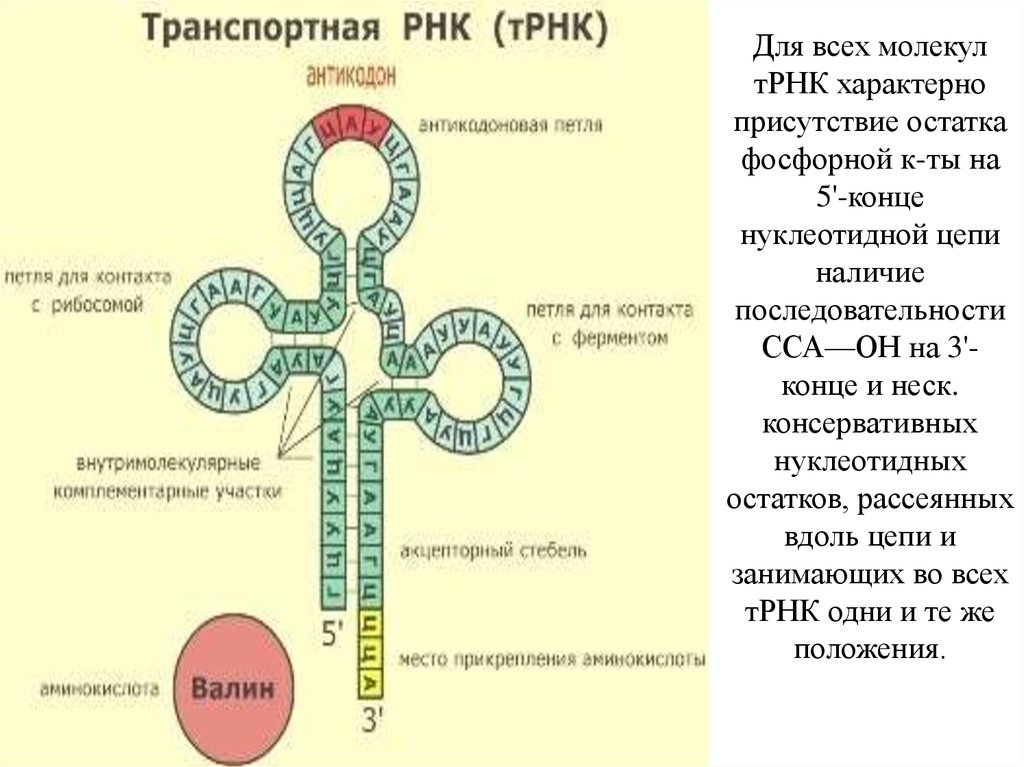 , Sussman J.L., Wang A.H., Seeman N.C., Rich A. Трехмерная третичная структура РНК-переносчика фенилаланина дрожжей. Наука. 1974; 185: 435–440. doi: 10.1126/science.185.4149.435. [PubMed] [CrossRef] [Google Scholar]
, Sussman J.L., Wang A.H., Seeman N.C., Rich A. Трехмерная третичная структура РНК-переносчика фенилаланина дрожжей. Наука. 1974; 185: 435–440. doi: 10.1126/science.185.4149.435. [PubMed] [CrossRef] [Google Scholar]
7. Робертус Дж. Д., Ладнер Дж. Э., Финч Дж. Т., Родс Д., Браун Р. С., Кларк Б. Ф., Клуг А. Структура дрожжевой фенилаланиновой тРНК с разрешением 3 Å. Природа. 1974; 250: 546–551. doi: 10.1038/250546a0. [PubMed] [CrossRef] [Академия Google]
8. Гилберт В. Происхождение жизни: мир РНК. Природа. 1986; 319: 618. doi: 10.1038/319618a0. [CrossRef] [Google Scholar]
9. Kruger K., Grabowski P.J., Zaug A.J., Sands J., Gottschling D.E., Cech T.R. Самосплайсинг РНК: аутоэксцизия и аутоциклизация промежуточной последовательности рибосомной РНК Tetrahymena. Клетка. 1982; 31: 147–157. doi: 10.1016/0092-8674(82)-7. [PubMed] [CrossRef] [Google Scholar]
10. Guerrier-Takada C., Gardiner K., Marsh T., Pace N., Altman S. Фрагмент РНК рибонуклеазы P является каталитической субъединицей фермента. Клетка. 1983;35:849–857. doi: 10.1016/0092-8674(83)
Клетка. 1983;35:849–857. doi: 10.1016/0092-8674(83)
11. Эйген М. Самоорганизация материи и эволюция биологических макромолекул. Натурвиссеншафтен. 1971; 58: 465–523. doi: 10.1007/BF00623322. [PubMed] [CrossRef] [Google Scholar]
12. Эйген М., Шустер П. Гиперцикл. Принцип естественной самоорганизации. Часть A: Возникновение гиперцикла. Натурвиссеншафтен. 1977; 64: 541–565. doi: 10.1007/BF00450633. [PubMed] [CrossRef] [Академия Google]
13. Шиммель П., Жиже Р., Морас Д., Йокояма С. Оперативный код РНК для аминокислот и возможная связь с генетическим кодом. проц. Натл. акад. науч. США. 1993; 90: 8763–8768. doi: 10.1073/pnas.90.19.8763. [Статья PMC бесплатно] [PubMed] [CrossRef] [Google Scholar]
14. Schimmel P., Ribas de Pouplana L. Перенос РНК: от миниспирали к генетическому коду. Клетка. 1995; 81: 983–986. doi: 10.1016/S0092-8674(05)80002-9. [PubMed] [CrossRef] [Google Scholar]
15. Francklyn C., Shi J. -P., Schimmel P. Перекрывающиеся нуклеотидные детерминанты для специфического аминоацилирования микроспиралей РНК. Наука. 1992;255:1121–1125. doi: 10.1126/science.1546312. [PubMed] [CrossRef] [Google Scholar]
-P., Schimmel P. Перекрывающиеся нуклеотидные детерминанты для специфического аминоацилирования микроспиралей РНК. Наука. 1992;255:1121–1125. doi: 10.1126/science.1546312. [PubMed] [CrossRef] [Google Scholar]
16. Frugier M., Florentz C., Giegé R. Эффективное аминоацилирование резецированных спиралей РНК аспартил-тРНК-синтетазой класса II, зависящее от одного нуклеотида. EMBO J. 1994; 13: 2218–2226. [Статья бесплатно PMC] [PubMed] [Google Scholar]
17. Сакс М.Е., Сэмпсон Дж.Р. Варианты миниспиральных РНК обнаруживают специфичное для последовательности распознавание спиральной тРНК акцепторного стержня Ser серил-тРНК-синтетазой E. coli . EMBO J. 1996;15:2843–2849. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Schimmel P. Аминоацил-тРНК-синтетазы: общая схема структурно-функциональных отношений в полипептидах и распознавание транспортных РНК. Анну. Преподобный Биохим. 1987; 56: 125–158. doi: 10.1146/annurev.bi.56.070187.001013. [PubMed] [CrossRef] [Google Scholar]
19. Eriani G., Delarue M., Poch O., Gangloff J., Moras D. Разделение тРНК-синтетаз на два класса на основе взаимоисключающих наборов мотивов последовательностей. Природа. 1990;347:203–206. дои: 10.1038/347203a0. [PubMed] [CrossRef] [Google Scholar]
Eriani G., Delarue M., Poch O., Gangloff J., Moras D. Разделение тРНК-синтетаз на два класса на основе взаимоисключающих наборов мотивов последовательностей. Природа. 1990;347:203–206. дои: 10.1038/347203a0. [PubMed] [CrossRef] [Google Scholar]
20. Арнез Дж. Г., Морас Д. Структурные и функциональные аспекты реакции аминоацилирования. Тенденции биохим. науч. 1997; 22: 211–216. doi: 10.1016/S0968-0004(97)01052-9. [PubMed] [CrossRef] [Google Scholar]
21. Симидзу М., Асахара Х., Тамура К., Хасегава Т., Химено Х. Роль оснований антикодона и дискриминаторного нуклеотида в распознавании некоторых E. coli тРНК их аминоацил-тРНК-синтетазами. Дж. Мол. Эвол. 1992;35:436–443. doi: 10.1007/BF00171822. [PubMed] [CrossRef] [Google Scholar]
22. Морас Д. Структурные и функциональные взаимоотношения между аминоацил-тРНК-синтетазами. Тенденции биохим. науч. 1992; 17: 159–164. doi: 10.1016/0968-0004(92)-5. [PubMed] [CrossRef] [Google Scholar]
23. Ribas de Pouplana L.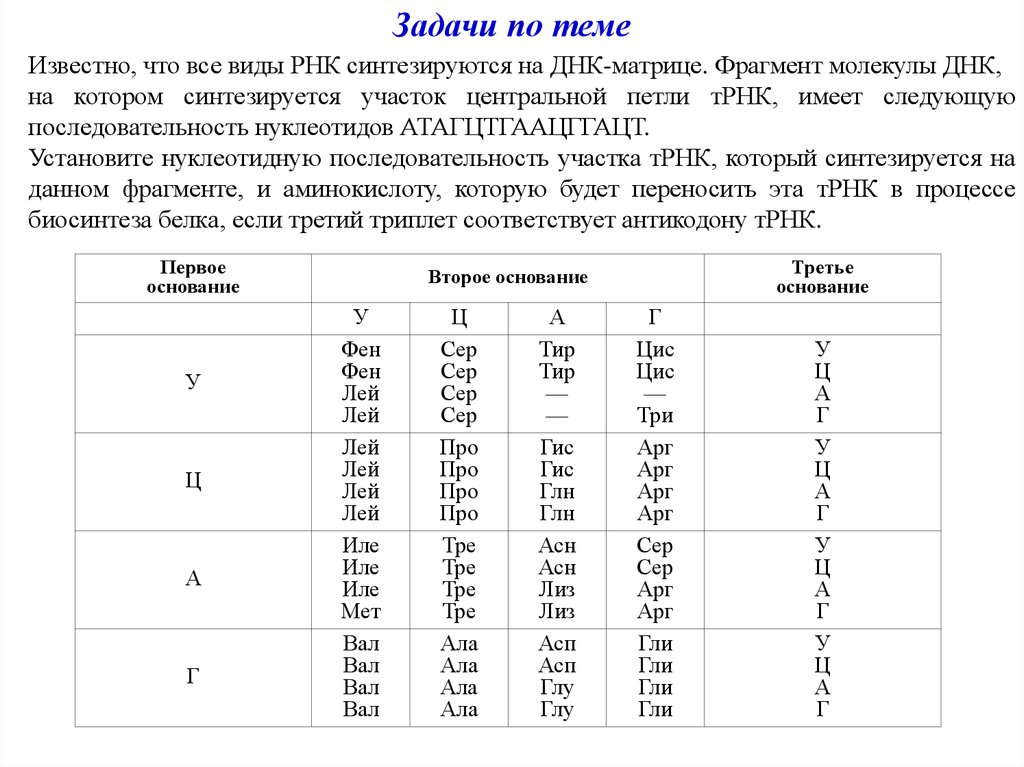 , Schimmel P. Синтетазы аминоацил-тРНК: потенциальные маркеры развития генетического кода. Тенденции биохим. науч. 2001; 26: 591–596. doi: 10.1016/S0968-0004(01)01932-6. [PubMed] [CrossRef] [Академия Google]
, Schimmel P. Синтетазы аминоацил-тРНК: потенциальные маркеры развития генетического кода. Тенденции биохим. науч. 2001; 26: 591–596. doi: 10.1016/S0968-0004(01)01932-6. [PubMed] [CrossRef] [Академия Google]
24. Ribas de Pouplana L., Schimmel P. Два класса тРНК-синтетаз, предполагаемые стерически совместимыми стыковками на акцепторном стержне тРНК. Клетка. 2001; 104: 191–193. doi: 10.1016/S0092-8674(01)00204-5. [PubMed] [CrossRef] [Google Scholar]
25. Родин С.Н., Оно С. Четыре первичных режима распознавания тРНК-синтетаз, определяемые операционным кодом (G,C). проц. Натл. акад. науч. США. 1997; 94: 5183–5188. doi: 10.1073/pnas.94.10.5183. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
26. Родин А.С., Сатмари Э., Родин С.Н. Один предок для двух кодов с точки зрения двух комплементарных способов аминоацилирования тРНК. биол. Прямой. 2009;4:4. doi: 10.1186/1745-6150-4-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
27. Martinez-Rodriguez L. , Erdogan O., Jimenez-Rodriguez M., Gonzalez-Rivera K., Williams T., Li L., Weinreb V., Collier M., Chandrasekaran S.N., Ambroggio X. и соавт. Функциональные ферменты, активирующие аминокислоты классов I и II, могут кодироваться противоположными цепями одного и того же гена. Дж. Биол. хим. 2015;290:19710–19725. doi: 10.1074/jbc.M115.642876. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
, Erdogan O., Jimenez-Rodriguez M., Gonzalez-Rivera K., Williams T., Li L., Weinreb V., Collier M., Chandrasekaran S.N., Ambroggio X. и соавт. Функциональные ферменты, активирующие аминокислоты классов I и II, могут кодироваться противоположными цепями одного и того же гена. Дж. Биол. хим. 2015;290:19710–19725. doi: 10.1074/jbc.M115.642876. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
28. Карпентер Ф. Х. Свободная энергия в гидролитических реакциях: соглашение о неионизированных соединениях. Варенье. хим. соц. 1960; 82: 1111–1122. doi: 10.1021/ja01490a024. [CrossRef] [Google Scholar]
29. Пахт-Горовиц М., Качальский А. Синтез аминоациладенилатов в пребиотических условиях. Дж. Мол. Эвол. 1973; 2: 91–98. doi: 10.1007/BF01653989. [PubMed] [CrossRef] [Академия Google]
30. Тамура К., Шиммель П. Хирально-селективное аминоацилирование миниспирали РНК. Наука. 2004; 305:1253. doi: 10.1126/science.1099141. [PubMed] [CrossRef] [Google Scholar]
31. Бюрги Х.Б., Дуниц Дж.Д., Лен Дж.М., Випфф Г. Стереохимия путей реакции в карбонильном центре. Тетраэдр. 1974; 30: 1563–1572. [Google Scholar]
Бюрги Х.Б., Дуниц Дж.Д., Лен Дж.М., Випфф Г. Стереохимия путей реакции в карбонильном центре. Тетраэдр. 1974; 30: 1563–1572. [Google Scholar]
32. Тамура К., Шиммель П.Р. Хирально-селективное аминоацилирование миниспирали РНК: механистические особенности и хиральная супрессия. проц. Натл. акад. науч. США. 2006; 103:13750–13752. doi: 10.1073/pnas.0606070103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Тамура К. Происхождение гомохиральности аминокислот: связь с миром РНК и происхождение аминоацилирования тРНК. Биосистемы. 2008; 92:91–98. doi: 10.1016/j.biosystems.2007.12.005. [PubMed] [CrossRef] [Google Scholar]
34. Тамура К. Молекулярная направленность жизни: значение аминоацилирования РНК. Дж. Биоци. 2009; 34: 991–994. doi: 10.1007/s12038-009-0113-4. [PubMed] [CrossRef] [Google Scholar]
35. Тамура К. Молекулярная основа хирального отбора при аминоацилировании РНК. Междунар. Дж. Мол. науч. 2011; 12:4745–4757. дои: 10.3390/ijms12074745. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
36. Bolli M., Micura R., Eschenmoser A. Пиранозил-РНК: хироселективная самосборка последовательностей оснований путем лигативной олигомеризации тетрануклеотида-2 ‘, 3’-циклофосфаты (с комментарием о происхождении биомолекулярной гомохиральности) Chem. биол. 1997; 4: 309–320. doi: 10.1016/S1074-5521(97)
-0. [PubMed] [CrossRef] [Google Scholar]
37. Weiner AM, Maizels N. ТРНК-подобные структуры помечают 3′-концы молекул геномной РНК для репликации: последствия для происхождения синтеза белка. проц. Натл. акад. науч. США. 1987;84:7383–7387. doi: 10.1073/pnas.84.21.7383. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
38. Акинс Р.А., Келли Р.Л., Ламбовиц А.М. Характеристика мутантных митохондриальных плазмид Neurospora spp. которые включают тРНК путем обратной транскрипции. Мол. Клетка. биол. 1989; 9: 678–691. doi: 10.1128/MCB.9.2.678. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
39. Saville B.J., Collins R.A. Сайт-специфическая реакция саморасщепления, осуществляемая новой РНК в митохондриях Neurospora. Клетка. 1990;61:685–696. doi: 10.1016/0092-8674(90)
Saville B.J., Collins R.A. Сайт-специфическая реакция саморасщепления, осуществляемая новой РНК в митохондриях Neurospora. Клетка. 1990;61:685–696. doi: 10.1016/0092-8674(90)
40. Блэкберн Э.Х. Структура и функция теломер. Природа. 1991; 350: 569–573. doi: 10.1038/350569a0. [PubMed] [CrossRef] [Google Scholar]
41. Фрейер С.М., Алкема Д., Синклер А., Нейлсон Т., Тернер Д.Х. Вклад укладки оборванных концов и формирования терминальной пары оснований в стабильность XGGCCp, XCCGGp, XGGCCYp и XCCGGYp спирали. Биохимия. 1985; 24:4533–4539. doi: 10.1021/bi00338a008. [PubMed] [CrossRef] [Академия Google]
42. SantaLucia J., Jr., Kierzek R., Turner D.H. Влияние несовпадений GA на структуру и термодинамику внутренних петель РНК. Биохимия. 1990; 29:8813–8819. doi: 10.1021/bi00489a044. [PubMed] [CrossRef] [Google Scholar]
43. Limmer S., Hofmann H.P., Ott G., Sprinzl M. 3′-концевой конец (NCCA) тРНК определяет структуру и стабильность аминоацильного акцепторного стебля. проц. Натл. акад. науч. США. 1993;90:6199–6202. doi: 10.1073/pnas.90.13.6199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
проц. Натл. акад. науч. США. 1993;90:6199–6202. doi: 10.1073/pnas.90.13.6199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Тамура К. Эволюция рибосом: появление механизма синтеза пептидов. Дж. Биоци. 2011; 36: 921–928. doi: 10.1007/s12038-011-9158-2. [PubMed] [CrossRef] [Google Scholar]
45. Тамура К. Эволюция РНК, предполагаемая из тРНК и рибопереключателей. Гипотеза. 2015;13:e3. doi: 10.5779/hypothesis.v13i1.380. [CrossRef] [Google Scholar]
46. Tamura K. Роль последовательности CCA тРНК в реакции переноса пептидила. ФЭБС лат. 1994; 353: 173–176. дои: 10.1016/0014-5793(94)01038-2. [PubMed] [CrossRef] [Google Scholar]
47. Nissen P., Hansen J., Ban N., Moore P.B., Steitz T.A. Структурные основы активности рибосом в синтезе пептидных связей. Наука. 2000; 289:920–930. doi: 10.1126/science.289.5481.920. [PubMed] [CrossRef] [Google Scholar]
48. Tamura K., Nameki N., Hasegawa T., Shimizu M., Himeno H. Роль CCA-концевой последовательности тРНК Val в аминоацилировании валил-тРНК синтетаза. Дж. Биол. хим. 1994; 269:22173–22177. [PubMed] [Академия Google]
Дж. Биол. хим. 1994; 269:22173–22177. [PubMed] [Академия Google]
49. Бернхардт Х.С., Тейт В.П. Доказательства переноса глицина РНК застывшей аварии на заре генетического кода. биол. Прямой. 2008;3:53. doi: 10.1186/1745-6150-3-53. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
50. Bernhardt H.S., Tate W.P. Переход от некодируемого к кодируемому синтезу белка: возникли ли кодирующие мРНК из усиливающих стабильность партнеров по связыванию с тРНК? биол. Прямой. 2010;5:16. doi: 10.1186/1745-6150-5-16. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
51. Пуглиси Э.В., Пуглиси Дж.Д., Уильямсон Дж.Р., РаджБхандари У.Л. ЯМР-анализ микроспиралей акцепторного стержня тРНК: изменение основания дискриминатора влияет на конформацию тРНК на 3′-конце. проц. Натл. акад. науч. США. 1994; 91:11467–11471. doi: 10.1073/pnas.91.24.11467. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
52. Тамура К. За пределами замороженной аварии: Назначение глицина в генетическом коде. Дж. Мол. Эвол. 2015; 81: 69–71. doi: 10.1007/s00239-015-9694-8. [PubMed] [CrossRef] [Академия Google]
Дж. Мол. Эвол. 2015; 81: 69–71. doi: 10.1007/s00239-015-9694-8. [PubMed] [CrossRef] [Академия Google]
53. Квенволден К., Лоулесс Дж., Перинг К., Петерсон Э., Флорес Дж., Поннамперума С., Каплан И.Р., Мур С. Доказательства внеземных аминокислот и углеводородов в метеорите Мерчисон. Природа. 1970; 228: 923–926. дои: 10.1038/228923a0. [PubMed] [CrossRef] [Google Scholar]
54. Миллер С.Л. Производство аминокислот в возможных первобытных земных условиях. Наука. 1953; 117: 528–529. doi: 10.1126/science.117.3046.528. [PubMed] [CrossRef] [Google Scholar]
55. Вонг Дж.Т. Коэволюционная теория генетического кода. проц. Натл. акад. науч. США. 1975;72:1909–1912. doi: 10.1073/pnas.72.5.1909. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
56. Wong J.T. Коэволюционная теория генетического кода в тридцать лет. Биоэссе. 2005; 27: 416–425. doi: 10.1002/bies.20208. [PubMed] [CrossRef] [Google Scholar]
57. Кагава Ю., Нодзима Х., Нукива Н., Ишизука М. , Накадзима Т., Ясухара Т., Танака Т., Осима Т. Высокое содержание гуанина и цитозина в третьей букве кодонов экстремального термофила. Последовательность ДНК изопропилмалатдегидрогеназы Термус термофильный . Дж. Биол. хим. 1984; 259: 2956–2960. [PubMed] [Google Scholar]
, Накадзима Т., Ясухара Т., Танака Т., Осима Т. Высокое содержание гуанина и цитозина в третьей букве кодонов экстремального термофила. Последовательность ДНК изопропилмалатдегидрогеназы Термус термофильный . Дж. Биол. хим. 1984; 259: 2956–2960. [PubMed] [Google Scholar]
58. Vieille C., Zeikus G.J. Гипертермофильные ферменты: источники, использование и молекулярные механизмы термостабильности. микробиол. Мол. биол. 2001; 65:1–43. doi: 10.1128/MMBR.65.1.1-43.2001. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
59. Чакраварти С., Варадараджан Р. Выяснение факторов, ответственных за повышенную термостабильность белков: исследование, основанное на структурной геномике. Биохимия. 2002;41:8152–8161. doi: 10.1021/bi025523t. [PubMed] [CrossRef] [Академия Google]
60. Онума М., Ганбе Т., Теруи Ю., Ниицу М., Сато Т., Танака Н., Тамакоши М., Самедзима К., Кумасака Т., Осима Т. Кристаллические структуры и ферментативные свойства триамин/агматинаминопропилтрансфераза из Thermus thermophiles . Дж. Мол. биол. 2011; 408:971–986. doi: 10.1016/j.jmb.2011.03.025. [PubMed] [CrossRef] [Google Scholar]
Дж. Мол. биол. 2011; 408:971–986. doi: 10.1016/j.jmb.2011.03.025. [PubMed] [CrossRef] [Google Scholar]
61. Jaenicke R., Bohm G. Стабильность белков в экстремальных условиях. Курс. мнение Структура биол. 1998; 8: 738–748. дои: 10.1016/S0959-440Х(98)80094-8. [PubMed] [CrossRef] [Google Scholar]
62. Terasaka N., Hayashi G., Katoh T., Suga H. Ортогональная пара рибосома-тРНК с помощью инженерии пептидилтрансферазного центра. Нац. хим. биол. 2014;10:555–557. doi: 10.1038/nchembio.1549. [PubMed] [CrossRef] [Google Scholar]
63. Хопфилд Дж.Дж. Происхождение генетического кода: проверяемая гипотеза, основанная на структуре, последовательности и кинетической корректуре тРНК. проц. Натл. акад. науч. США. 1978; 75: 4334–4338. doi: 10.1073/pnas.75.9.4334. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
64. Симидзу М. Молекулярная основа генетического кода. Дж. Мол. Эвол. 1982; 18: 297–303. doi: 10.1007/BF01733895. [PubMed] [CrossRef] [Google Scholar]
65. Лейси Дж. К., мл., Маллинс Д. У., мл. Экспериментальные исследования, связанные с происхождением генетического кода и процессом синтеза белка. Ориг. Жизнь. 1983; 13:3–42. doi: 10.1007/BF00928761. [PubMed] [CrossRef] [Google Scholar]
Лейси Дж. К., мл., Маллинс Д. У., мл. Экспериментальные исследования, связанные с происхождением генетического кода и процессом синтеза белка. Ориг. Жизнь. 1983; 13:3–42. doi: 10.1007/BF00928761. [PubMed] [CrossRef] [Google Scholar]
66. Ярус М. Аминокислоты как лиганды РНК: Теория прямого РНК-шаблона для происхождения кода. Дж. Мол. Эвол. 1998;47:109–117. doi: 10.1007/PL00006357. [PubMed] [CrossRef] [Google Scholar]
67. Fontecilla-Camps J.C. Стереохимическая основа генетического кода и (в основном) автотрофное происхождение жизни. Жизнь. 2014;4:1013–1025. doi: 10.3390/life4041013. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
68. Komatsu R., Sawada R., Umehara T., Tamura K. Пролин мог быть первой аминокислотой в примитивном генетическом коде. Дж. Мол. Эвол. 2014;78:310–312. doi: 10.1007/s00239-014-9629-9. [PubMed] [CrossRef] [Google Scholar]
69. Ban N., Nissen P., Hansen J., Moore P.B., Steitz T.A. Полная атомная структура большой субъединицы рибосомы с разрешением 2,4 Å. Наука. 2000; 289:905–920. doi: 10.1126/science.289.5481.905. [PubMed] [CrossRef] [Google Scholar]
Наука. 2000; 289:905–920. doi: 10.1126/science.289.5481.905. [PubMed] [CrossRef] [Google Scholar]
70. Ноллер Х.Ф., Хоффарт В., Зимняк Л. Необычная устойчивость пептидилтрансферазы к процедурам экстракции белка. Наука. 1992; 256:1416–1419. doi: 10.1126/science.1604315. [PubMed] [CrossRef] [Академия Google]
71. Тамура К., Шиммель П. Олигонуклеотид-направленный синтез пептидов в системе без рибосом и рибозимов. проц. Натл. акад. науч. США. 2001; 98: 1393–1397. doi: 10.1073/pnas.98.4.1393. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
72. Агмон И., Башан А., Заривач Р., Йонат А. Симметрия в активном сайте рибосомы: структурные и функциональные последствия. биол. хим. 2005; 386: 833–844. doi: 10.1515/BC.2005.098. [PubMed] [CrossRef] [Академия Google]
73. Агмон И. Димерная проторибосома: структурные детали и возможные последствия для происхождения жизни. Междунар. Дж. Мол. науч. 2009;10:2921–2934. doi: 10.3390/ijms10072921. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
74. Moore P.B. Рибосомы. Курс. мнение Структура биол. 1991; 1: 258–263. doi: 10.1016/0959-440X(91)
Moore P.B. Рибосомы. Курс. мнение Структура биол. 1991; 1: 258–263. doi: 10.1016/0959-440X(91)
75. Ито К., Эбихара К., Уно М., Накамура Ю. Консервативные мотивы в прокариотических и эукариотических факторах высвобождения полипептидов: гипотеза мимикрии тРНК-белков. проц. Натл. акад. науч. США. 1996;93:5443–5448. doi: 10.1073/pnas.93.11.5443. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
76. Ито К., Уно М., Накамура Ю. Трипептид «антикодон» расшифровывает стоп-кодоны в матричной РНК. Природа. 2000; 403: 680–684. doi: 10.1038/35003097. [PubMed] [CrossRef] [Google Scholar]
77. Родин С., Родин А., Оно С. Наличие пар кодон-антикодон в акцепторном стебле тРНК. проц. Натл. акад. науч. США. 1996; 93:4537–4542. doi: 10.1073/pnas.93.10.4537. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
78. Hou Y.M., Schimmel P. Простая структурная особенность является основным фактором, определяющим идентичность транспортной РНК. Природа. 1988; 333: 140–145. дои: 10.1038/333140a0. [PubMed] [CrossRef] [Google Scholar]
Природа. 1988; 333: 140–145. дои: 10.1038/333140a0. [PubMed] [CrossRef] [Google Scholar]
79. McClain WH, Foss K. Изменение идентичности тРНК путем введения пары колебаний GU вблизи 3′-конца акцептора. Наука. 1988; 240:793–796. doi: 10.1126/science.2452483. [PubMed] [CrossRef] [Google Scholar]
80. де Дюв К. Транспортные РНК: второй генетический код. Природа. 1988;333:117–118. дои: 10.1038/333117a0. [PubMed] [CrossRef] [Google Scholar]
81. Ди Джулио М. О происхождении транспортной молекулы РНК. Дж. Теор. биол. 1992; 159:199–214. doi: 10.1016/S0022-5193(05)80702-7. [PubMed] [CrossRef] [Google Scholar]
82. Танака Т., Кикучи Ю. Происхождение формы клеверного листа транспортной РНК — модель двойной шпильки: влияние на роль интро тРНК и длинной дополнительной петли. Вива ориг. 2001; 29: 134–142. [Google Scholar]
83. Нагасвами У., Фокс Г.Е. Лигирование РНК и происхождение тРНК. Ориг. Жизнь Эвол. биосф. 2003;33:199–209. doi: 10.1023/A:1024658727570. [PubMed] [CrossRef] [Google Scholar]
84. Видманн Дж., Ди Джулио М., Ярус М., Найт Р. Создание тРНК путем дублирования шпилек. Дж. Мол. Эвол. 2005; 61: 524–530. doi: 10.1007/s00239-004-0315-1. [PubMed] [CrossRef] [Google Scholar]
Видманн Дж., Ди Джулио М., Ярус М., Найт Р. Создание тРНК путем дублирования шпилек. Дж. Мол. Эвол. 2005; 61: 524–530. doi: 10.1007/s00239-004-0315-1. [PubMed] [CrossRef] [Google Scholar]
85. Crick F.H.C. Происхождение генетического кода. Дж. Мол. биол. 1968; 38: 367–379. doi: 10.1016/0022-2836(68)
-6. [PubMed] [CrossRef] [Google Scholar]86. Бернхардт Х.С., Патрик В.М. Эволюция генетического кода началась с включения глицина, за которым последовали другие малые гидрофильные аминокислоты. Дж. Мол. Эвол. 2014; 78:307–309. doi: 10.1007/s00239-014-9627-y. [PubMed] [CrossRef] [Google Scholar]
87. Оргель Л.Е. β-повороты и эволюция синтеза белка. В: Брэдбери Э.М., Джавахериан К., редакторы. Организация и экспрессия эукариотического генома , Материалы Международного симпозиума; Тегеран, Иран. 3–6 мая 1976 г .; Лондон, Великобритания: Academic Press; 1997. С. 499–504. [Google Scholar]
88. Юрка Дж., Смит Т.Ф. Ранняя эволюция, управляемая β-поворотом: генетический код и пути биосинтеза. Дж. Мол. Эвол. 1987;25:15–19. doi: 10.1007/BF02100036. [PubMed] [CrossRef] [Google Scholar]
Дж. Мол. Эвол. 1987;25:15–19. doi: 10.1007/BF02100036. [PubMed] [CrossRef] [Google Scholar]
89. Wilmot C.M., Thornton J.M. Анализ и предсказание различных типов β-поворота в белках. Дж. Мол. биол. 1988; 203: 221–232. doi: 10.1016/0022-2836(88)
-9. [PubMed] [CrossRef] [Google Scholar]90. Хупперт Дж.Л., Бугаут А., Кумари С., Баласубраманиан С. G-квадруплексы: начало и конец UTR. Нуклеиновые Кислоты Res. 2008; 36: 6260–6268. doi: 10.1093/nar/gkn511. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
91. Умехара Т., Китагава Т., Наказава Ю., Йошино Х., Немото Р., Тамура К. Тетраплекс РНК как первичный каркас для синтеза пептидов. Биосистемы. 2012; 109: 145–150. doi: 10.1016/j.biosystems.2012.03.003. [PubMed] [CrossRef] [Google Scholar]
92. Pauling L. Arbeiten aus dem Gebiet der Naturstoffchemie, Festschrift Arthur Stroll. Биркхойзер-Верлаг; Базель, Швейцария: 1957. Вероятность ошибок в процессе синтеза белковых молекул; стр. 597–602. [Академия Google]
93. Фрейст В., Пардовиц И., Крамер Ф. Изолейцил-тРНК-синтетаза пекарских дрожжей: многоступенчатая корректура при различении изолейцина и валина с регулируемой точностью, схема молекулярного распознавания путем рассеяния энергии. Биохимия. 1985; 24:7014–7023. doi: 10.1021/bi00345a040. [PubMed] [CrossRef] [Google Scholar]
Фрейст В., Пардовиц И., Крамер Ф. Изолейцил-тРНК-синтетаза пекарских дрожжей: многоступенчатая корректура при различении изолейцина и валина с регулируемой точностью, схема молекулярного распознавания путем рассеяния энергии. Биохимия. 1985; 24:7014–7023. doi: 10.1021/bi00345a040. [PubMed] [CrossRef] [Google Scholar]
Кодон — определение и примеры
Кодон
н., множественное число: кодоны
[ˈkəʊdɒn]
Определение: серия нуклеотидов, определяющая конкретную аминокислоту во время трансляции (этап синтеза белка)
Содержание
Что означает кодон? Кодон , в биологии , является основной генетической единицей жизни, которая действует как матрица для синтеза аминокислот, необходимых для экспрессии белка. Вся информация, необходимая для жизни, хранится в генах, а экспрессия белков — это модальность, с помощью которой выражается информация, закодированная в генах. Таким образом, кодон действует как необходимая генетическая единица жизни .
Знаете ли вы, почему мРНК, а не фрагмент ДНК несет код синтеза белка? Наш эксперт делится мнениями на Форуме: Что делает мРНК в синтезе белка? Приходите и поделитесь своими мыслями!
Определение кодона
Что такое кодоны? Кодон — это определенная последовательность нуклеотидов на мРНК, которая соответствует определенной аминокислоте или стоп-сигналу во время трансляции белка. Нуклеотид , в свою очередь, состоит из азотистого основания (или просто основание ), сахар и фосфатную группу.
Сколько нуклеотидов составляют кодон? Хорошо, последовательность из трех нуклеотидов составляет кодон, или мы можем сказать, что тринуклеотидная последовательность составляет кодон на мРНК. Основные азотистые основания нуклеотидов РНК:
- Аденин (А)
- Урацил (У)
- Гуанин (G)
- Цитозин (С)
Следовательно, сколько оснований в кодоне? Поскольку кодон состоит из трех нуклеотидов, кодон будет состоять из трех оснований. Таким образом, типичным примером генетического кодона может быть триплетный код, например, аденин-урацил-гуанин (AUG), урацил-цитозин-цитозин (UCC), урацил-гуанин-аденин (UGA) и т. конкретной аминокислоты.
Таким образом, типичным примером генетического кодона может быть триплетный код, например, аденин-урацил-гуанин (AUG), урацил-цитозин-цитозин (UCC), урацил-гуанин-аденин (UGA) и т. конкретной аминокислоты.
Для чего кодируют кодоны? Поскольку набор кодонов на мРНК образует генетический код, кодон является наименьшей единицей генетического кода. Проще говоря, каждый кодон на самом деле шифрует определенную аминокислоту. Он также может кодировать сигнал остановки или запуска процесса синтеза белка в клетке. См. рис. 1.
Рис. 1: Кодоны, транслируемые в конкретные аминокислоты, или «стоп-сигнал». Предоставлено: Томас Сплеттстессер, CC BY-SA 4.0. Биологическое определение:
A codon is the amino acid coding unit in DNA or messenger RNA (mRNA). The string of codons in the mRNA specifies the order of amino acids in the encoded protein. Apart from amino acids, there are also codons that specify start/stop signals . Each codon consists of a set of three adjacent nucleotides (also called triplets) in mRNA that base-pair with the three bases of the corresponding anticodon of a tRNA molecule that carries a particular amino acid. The ribosome, where protein synthesis occurs, has binding sites where the tRNAs can match up with their corresponding codons in the mRNA. Синоним: кодовая тройка. Сравните: антикодон. Примеры кодонов:
Apart from amino acids, there are also codons that specify start/stop signals . Each codon consists of a set of three adjacent nucleotides (also called triplets) in mRNA that base-pair with the three bases of the corresponding anticodon of a tRNA molecule that carries a particular amino acid. The ribosome, where protein synthesis occurs, has binding sites where the tRNAs can match up with their corresponding codons in the mRNA. Синоним: кодовая тройка. Сравните: антикодон. Примеры кодонов:
- GCC (гуанин-цитозин-цитозин) → аланин
- GUU (гуанин-урацил-урацил) → валин
- CUA (цитозин-урацил-аденин) → лейцин
- УЦА (урацил-цитозин-аденин) → серин
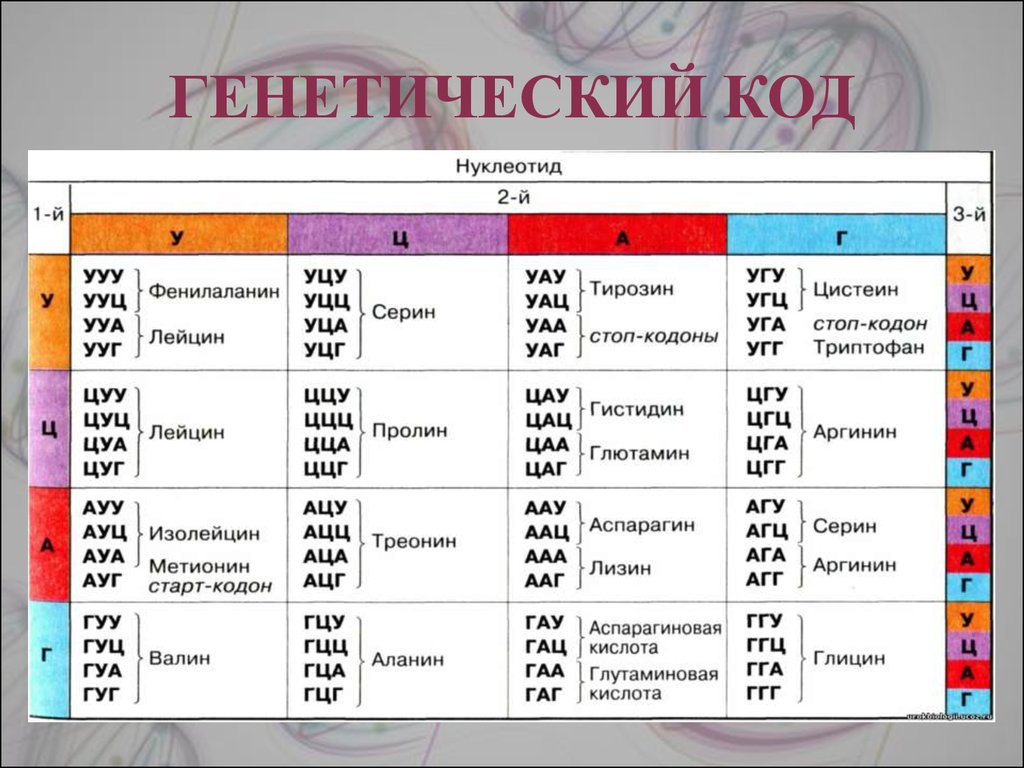
Свойства генетического кода
Генетические коды представляют собой основную связь между последовательностью аминокислот в белках и последовательностью нуклеотидов РНК или ДНК. Тщательные исследования установили несколько основных свойств генетических кодов.
Тщательные исследования установили несколько основных свойств генетических кодов.
- Генетический код представляет собой триплетный код. Каждая аминокислота кодируется последовательностью из трех нуклеотидов, т. е. кодоном или последовательностью из трех оснований, расшифровываемых с образованием аминокислоты.
- Каждый код не содержит знаков препинания , что означает, что каждый генетический код читается последовательно.
- Генетический код не перекрывается. В последовательности кодонов, например, ABCDEFGHI , « ABC» будет кодировать первую аминокислоту, за которой следует « DEF” для второй аминокислоты и “ GHI” для последующей аминокислоты. Таким образом, каждая аминокислота кодируется неперекрывающимся генетическим кодом.
- Генетический код вырожден. Одна аминокислота кодируется более чем одним кодоном. Кодоны, кодирующие одну и ту же аминокислоту, известны как « синонимов ».
 Например: UGU и UGC являются синонимами цистеина; оба кодируют цистеин.
Например: UGU и UGC являются синонимами цистеина; оба кодируют цистеин.
Хотите узнать больше о генетическом коде? Присоединяйтесь к нам на форуме: Что делает мРНК в синтезе белка? Давай поговорим об этом!
Функция кодона
Какова функция кодона ? Чтобы понять это, мы должны знать о переводе. Базовое понимание этого клеточного процесса объяснит связь между кодоном и аминокислотой. Каждая ДНК имеет ряд генов, которые выполняют жизненно важные функции, создавая необходимые белковые молекулы. Таким образом, экспрессия генов влечет за собой продукцию через них кодируемого белка.
Процесс синтеза белка по существу осуществляется в два этапа. Это транскрипция и транскрипция .
Рисунок 2: Процессы транскрипции и трансляции.Транскрипция
Рисунок 3: Этапы транскрипции. Транскрипция — это первый этап синтеза белка, при котором ДНК действует как матрица для создания мРНК или матричной РНК. Во время этого процесса информация, закодированная в ДНК для каждого белка, переносится на мРНК. ДНК функционирует как матрица для комплементарного спаривания оснований для передачи информации об экспрессии белка на мРНК.
Во время этого процесса информация, закодированная в ДНК для каждого белка, переносится на мРНК. ДНК функционирует как матрица для комплементарного спаривания оснований для передачи информации об экспрессии белка на мРНК.
Перевод
Рисунок 4: Процесс перевода.Где находятся кодоны? кодонов присутствуют на мРНК . Как насчет антикодонов? Антикодоны присутствуют в тРНК.
мРНК представляет собой одноцепочечную нуклеиновую кислоту. Генетическая информация, которую он несет, получена из молекулы ДНК посредством транскрипции. Генетический код включает кодоны, которые будут транслироваться в белки. Таким образом, кодоны и аминокислоты тесно связаны друг с другом и необходимы для всех жизненных процессов.
Антикодон также состоит из тринуклеотидных последовательностей; однако они обнаруживаются на транспортной РНК (тРНК). Антикодоны представляют собой последовательности нуклеотидов, комплементарные последовательности оснований мРНК. Наличие антикодонов на тРНК гарантирует, что подходящая аминокислота будет введена в структуру белка. Теперь у нас есть ясность, что кодоны присутствуют на мРНК, а антикодоны присутствуют на тРНК.
Наличие антикодонов на тРНК гарантирует, что подходящая аминокислота будет введена в структуру белка. Теперь у нас есть ясность, что кодоны присутствуют на мРНК, а антикодоны присутствуют на тРНК.
Посмотрите это видео, демонстрирующее процесс синтеза белка.
Вся генетическая информация зашифрована в молекуле ДНК. Затем генетическая информация переносится на мРНК в виде кодонов. Кодоны в конечном итоге экспрессируются в виде белка. Таким образом, основная функция кодона заключается в кодировании аминокислоты, которая в конечном итоге образует белки.
Хотите узнать больше о роли мРНК в синтезе белка? Присоединяйтесь к нам на форуме: Что делает мРНК в синтезе белка? Давайте разберемся!
Типы кодонов
Существует два основных типа кодонов: сигнальных кодонов и несигнальных кодонов . Сигнальные кодоны — это кодоны, передающие сигнал в процессе трансляции; эти сигнальные кодоны можно дополнительно классифицировать как стартовых кодонов (т. е. кодонов, которые кодируют сигнал для инициации трансляции белка, например, AUG) и стоп-кодонов (т. е. кодонов, которые терминируют процесс трансляции белка, известных как стоп-кодоны). кодоны, например, UAG, UAA и UGA). Несигнальные кодоны — это кодоны, которые в первую очередь предназначены для трансляции, обычно после трансляции стартового кодона.
Сигнальные кодоны — это кодоны, передающие сигнал в процессе трансляции; эти сигнальные кодоны можно дополнительно классифицировать как стартовых кодонов (т. е. кодонов, которые кодируют сигнал для инициации трансляции белка, например, AUG) и стоп-кодонов (т. е. кодонов, которые терминируют процесс трансляции белка, известных как стоп-кодоны). кодоны, например, UAG, UAA и UGA). Несигнальные кодоны — это кодоны, которые в первую очередь предназначены для трансляции, обычно после трансляции стартового кодона.
Другой способ классификации кодонов заключается в том, кодируют ли они аминокислоту или нет. Те, которые кодируют определенную аминокислоту, называются смысловым кодоном , тогда как те, которые не кодируют аминокислоту, называются бессмысленным кодоном (например, стоп-кодоны).
Идем дальше, теперь нам нужно понять, сколько кодонов в генетическом коде. Всего имеется 64 кодона, т. е. присутствует 4X4X4. Итак, сколько различных кодонов кодируют аминокислоты? Из 64 кодонов 61 кодон кодирует 20 аминокислот, а остальные кодируют сигналы кодонов. Разве это не удивительно? 61 кодон кодирует только двадцать аминокислот, а не 61! Ну, это потому, что если вы помните, генетический код вырожден. Это означает, что существуют аминокислоты, которые определяются более чем одним кодоном. Как это возможно? Давайте прочитаем следующий раздел ниже.
Разве это не удивительно? 61 кодон кодирует только двадцать аминокислот, а не 61! Ну, это потому, что если вы помните, генетический код вырожден. Это означает, что существуют аминокислоты, которые определяются более чем одним кодоном. Как это возможно? Давайте прочитаем следующий раздел ниже.
Трансляция нуклеотидов в аминокислоту
Как начинается трансляция тРНК?
ТРНК должна обнаруживать рамку считывания. Рамка считывания будет состоять из последовательности триплетов нуклеотидов (смысловых кодонов) для трансляции. ТРНК распознает рамку считывания для трансляции, если стартовый кодон предшествует смысловым кодонам.
У эукариот наиболее распространенным стартовым кодоном является 9-й0037 кодон AUG . Он специально кодирует аминокислоту метионин (Met). У прокариот это также обычный стартовый кодон, но он кодирует формилметионин (fMet). Таким образом, многие белки начинаются с Met (у эукариот) или fMet (у прокариот).
Другие стартовые кодоны также возможны, хотя и редко. Примером стартового кодона, отличного от AUG, является кодон CUG, кодирующий лейцин (Leu). У прокариот стартовые кодоны могут быть GUG или UUG, а в эукариотическом митохондриальном геноме стартовые кодоны могут быть AUA или AUU.
Если тРНК начинает трансляцию, то как тРНК узнает, когда ее нужно остановить?
Существуют три специфических кодона, сигнализирующих об окончании трансляции белка. Это UAG , , UAA , и UGA. Эти кодоны, сигнализирующие об остановке трансляции, называются стоп-кодонами (или бессмысленными кодонами). Они сигнализируют о высвобождении белка, образующегося на матрице мРНК. Таким образом, эти стоп-кодоны также известны как высвобождающие кодоны . Это прекращение трансляции белка, которое впоследствии вызывает высвобождение белка, объясняется отсутствием комплементарных антикодонов на тРНК. Роль стартового и стоп-кодонов схематически представлена на рисунке 5.
Последовательность кодона между стартовым кодоном и стоп-кодоном в кодирующей области известна как открыть рамку считывания . Стартовые кодоны вместе с соседними инициирующими факторами инициируют процесс трансляции белка.
Из 64 кодонов три кодона кодируют терминацию трансляции белка; остальные 61 кодон экспрессируются в виде белков. Все 64 кодона были расшифрованы до соответствующих аминокислот и систематически представлены в таблице кодонов аминокислот. Для определения и стандартизации представления этих 61 кода соответствующей аминокислоте была разработана таблица кодонов или таблица кодонов аминокислот. Кодоны стандартных аминокислот представлены в таблице ниже (рисунок).
Рисунок 6: Таблица кодонов мРНК: таблица кодонов мРНК, которая дает схему аминокислотной последовательности. Предоставлено: Скотт Генри Максвелл, CC BY-SA 4.0. Теперь давайте разберемся, как расшифровать или прочитать эту таблицу кодонов. Самое важное, что следует помнить, это то, что вся таблица кодонов основана на последовательности нуклеотидов UCAG на каждой оси. Ось Y представляет первый нуклеотид в кодоне, а ось X представляет второй нуклеотид кодона. Обе оси Y и X образуют 12 квадрантов последовательности UCAG. Ось Z представляет третий нуклеотид, в котором каждый из 12 квадрантов сначала подразделяется в соответствии с последовательностью UCAG.
Самое важное, что следует помнить, это то, что вся таблица кодонов основана на последовательности нуклеотидов UCAG на каждой оси. Ось Y представляет первый нуклеотид в кодоне, а ось X представляет второй нуклеотид кодона. Обе оси Y и X образуют 12 квадрантов последовательности UCAG. Ось Z представляет третий нуклеотид, в котором каждый из 12 квадрантов сначала подразделяется в соответствии с последовательностью UCAG.
Теперь посмотрим. Что будет кодировать кодон UCG?
Сначала , найдите U (первый нуклеотид) по оси Y, а затем C (второй нуклеотид) по оси X.
В результате мы дойдем до первой строки и второго столбца. Теперь в этом квадранте третий нуклеотид будет определять положение кодона из четырех квадрантов.
Таким образом, мы дойдем до 4-го квадранта первой строки, второго столбца, который согласно таблице кодонов кодирует аминокислоту серин. Эти шаги представлены схематически на рисунке ниже.
Рисунок 7: Схематическое изображение последовательности, которой необходимо следовать, чтобы объяснить аминокислоту с использованием таблицы кодонов. Источник: д-р Амита Джоши из Biology Online.
Источник: д-р Амита Джоши из Biology Online.Выяснение аминокислот с помощью секвенирования кодонов также может быть выполнено с использованием таблицы кодонов или таблицы кодов аминокислот (рис. 8).
Рисунок 8: Таблица кодонов для определения аминокислоты по кодонам. Предоставлено: Onie~commonswiki, CC BY-SA 3.0.В таблице кодонов самый внутренний круг представляет первый нуклеотид. Второй внутренний круг представляет второй нуклеотид, а самый внешний круг представляет третий нуклеотид в кодоне.
Теперь, чтобы расшифровать аминокислоту из кодона, нужно перейти от самого внутреннего круга к самому внешнему кругу, таким образом расшифровав аминокислоту из кодона.
Подобно таблице/таблице кодонов РНК, имеется таблица кодонов ДНК. Единственное различие между последовательностями нуклеотидных оснований РНК и ДНК состоит в том, что в ДНК вместо урацила (U) присутствует тиамин (T). Соответственно, таблица кодонов ДНК меняет с U на T . Чтение или схема разъяснения аминокислот для таблицы кодонов ДНК остается прежней. Несмотря на то, что урацил заменен тиамином в последовательности оснований ДНК, кодируемая аминокислота остается прежней. Это важный момент, который следует помнить, чтобы избежать путаницы между таблицей кодонов ДНК и таблицей кодонов РНК.
Несмотря на то, что урацил заменен тиамином в последовательности оснований ДНК, кодируемая аминокислота остается прежней. Это важный момент, который следует помнить, чтобы избежать путаницы между таблицей кодонов ДНК и таблицей кодонов РНК.
В прошлом генетические коды считались универсальными; однако исследования обнаружили небольшое изменение в генетическом коде митохондрий и некоторых инфузорий. В митохондриях человека кодон UGA не декодируется как стоп-сигнал. Напротив, UGA в митохондриях человека кодирует аминокислоту триптофана . В митохондриях AGA и AGG являются стоп-сигналами; вне митохондрий, AGA и AGG кодируют аргинин. Точно так же 9Кодон 0218 AUA в митохондриях кодирует метионин вместо изолейцина . Таким образом, существует множество примеров, доказывающих, что митохондриальный генетический код отличается от остальной части клетки. Различия в генетическом коде митохондрий представлены в таблице ниже.
Таблица 1: Уникальные митохондриальные кодоны и соответствующие им аминокислоты/стоп-сигналы. (Источник)
| Таблица: | ||
|---|---|---|
| Кодон | Стандартный код | Митохондриальный код |
| УГА | Стоп | Триптофан |
| УГГ | Триптофан | Триптофан |
| АУА | Изолейцин | Метионин |
| АВГ | Метионин | Метионин |
| АГА | Аргинин | Стоп |
| АГГ | Аргинин | Стоп |
Подобно митохондриям, у некоторых инфузорий кодоны UAA и UAG кодируют аминокислоты и не кодируют стоп-сигналы. У таких инфузорий сигнал терминации или стоп-кодон кодируется кодоном UGA . Таким образом, генетические коды сейчас не считаются универсальными. Ранее считалось, что генетические коды универсальны; однако эти открытия опровергли это свойство генетического кода.
Ранее считалось, что генетические коды универсальны; однако эти открытия опровергли это свойство генетического кода.
Примеры кодонов
На основании схемы/таблицы кодонов приведены некоторые примеры кодонов:
- CUU-Кодон лейцина
- CUA-Кодон лейцина
- UCU- Цистеиновый кодон
- UGC-цистеиновый кодон
- CGG-Кодон аргинина
- AGC-сериновый кодон
Из приведенных выше примеров кунов, а также из таблиц кодонов ясно видно, что несколько кодонов кодируют одну аминокислоту.
Эволюционное значение вырождения
Почему повторяются кодоны одной и той же аминокислоты?
Простой причиной этого является обеспечение устойчивости к мутациям, которые могут возникать в ходе различных жизненных процессов, а также к воздействию различных мутагенов в нашей повседневной жизни. Мутации часто происходят в жизни живого существа; тем не менее, все мутации не очевидны и не вредны, вы думали об этом?
Ну, мутации изменяют последовательности кодонов, и это изменение может изменить результирующее образование аминокислот. Однако изменение или мутация третьего нуклеотида в большинстве случаев не влияет на аминокислоту.
Однако изменение или мутация третьего нуклеотида в большинстве случаев не влияет на аминокислоту.
Например, ЕГДС кодирует аргинин. Если он мутировал в CGA или CGC или CGG, мутировавшие кодоны все равно будут приводить к образованию аргинина; таким образом, делая мутантный кодон избыточным.
повторяемость кодонов приводит к трансляции одной и той же последовательности аминокислот . Это обеспечивает устойчивость генов к нормальному функционированию, даже если они могли подвергнуться какой-либо мутации. Кодоновая избыточность также часто известна как вырождение .
Несмотря на это, некоторые мутации все еще оказываются смертельными. Мутация, при которой последовательность аминокислот рано остановилась, может быть летальной. Это происходит, когда смысловой кодон мутирует и становится стоп-кодоном. Этот кодон в конечном итоге остановит процесс трансляции, что приведет к отсутствию экспрессии необходимой или незаменимой аминокислоты в белок.
Попробуйте ответить на приведенный ниже тест, чтобы проверить, что вы уже узнали о кодонах.
Викторина
Выберите лучший ответ.
1. Что такое кодон?
Последовательность из трех нуклеотидов
Последовательность из двух нуклеотидов
Один нуклеотид
2. Кодоны кодонов для …
аминокислота
жирная кислота
нуклеотид
3. Где находится кодон?
рРНК
мРНК
тРНК
4.

Leave A Comment