Этанол, C2H5OH, химические свойства, производство, применение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Механизм и кинетика реакции получения этилового эфира из уксусной кислоты
АННОТАЦИЯ
В данной работе изучены влияние температуры, количественное соотношение исходных веществ, количество катализатора и других факторов на выход этилацетата. Установлено на основе изучения влияние температуры, количественное соотношение исходных веществ,количество катализатора и других факторов на выход этилацетата при повышении содержание серной кислоты на 1,0%. Результаты опыта показали что чем меньше температура катализата, тем выше в нём содержание этилацетата и меньше этилового спирта и воды. На основе кинетических исследований создана кинетическая модель реакции этерификации уксусной кислоты и этилового спирта. В результате проведенных исследований разработана кинетическая модель реакции этерификации уксусной кислоты и этилового спирта и на основе данной модели рассчитана энергия активации процесса (Еа=37,9+1,2кДж/mol).
В качестве критерия адекватности было принято выполнение следующего условия:
ABSTRACT
In this work, we studied the effect of temperature, the quantitative ratio of starting materials, the amount of catalyst, and other factors on the yield of ethyl acetate. Based on the study, the influence of temperature, the quantitative ratio of the starting materials, the amount of catalyst and other factors on the yield of ethyl acetate with an increase in sulfuric acid content by 1.0% was established. The results of the experiment showed that the lower the temperature of the catalysis, the higher the content of ethyl acetate and less ethyl alcohol and water. As a result of the studies, a kinetic model of the reaction of esterification of acetic acid and ethyl alcohol was developed and, on the basis of this model, the activation energy of the process was calculated (Ea = 37.9 + 1.2 kJ / mol)
The following condition was taken as an adequacy criterion:
Ключевые слова: уксусная кислота, фракция, этилацетат, температура, катализатор, кинетическая модель, энергия активации
Keywords: acetic acid, fraction, ethyl acetate, temperature, catalyst, kinetic model, activation energy
Этилацетат является одним из важнейших продуктов современной химической промышленности.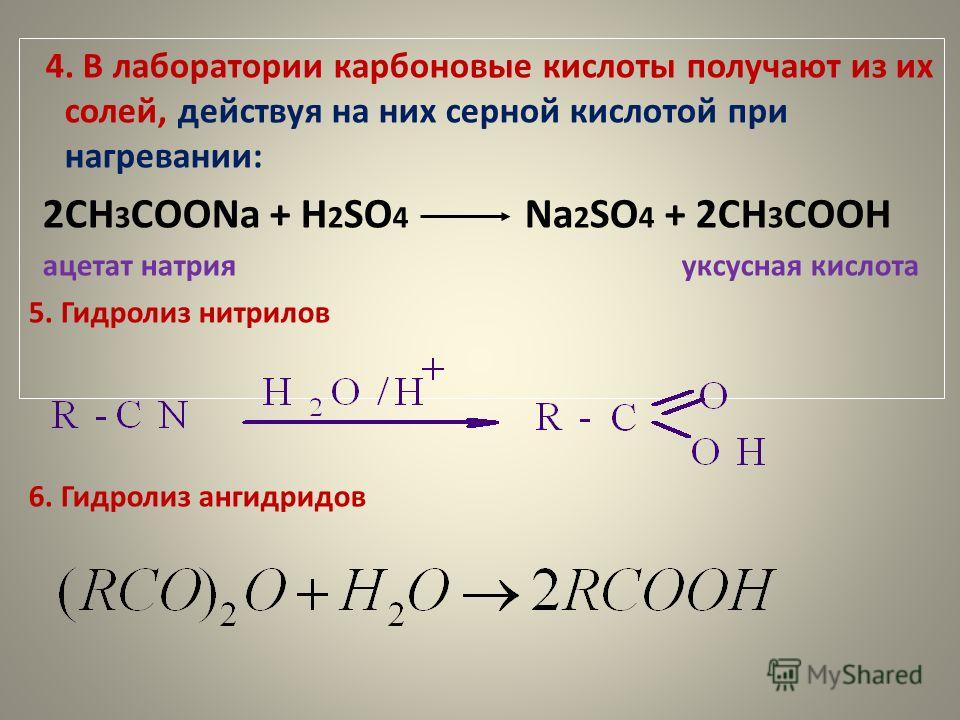 Он находит широкое применение при производстве лакокрасочной продукции, изделий из полимерных материалов, лекарственных препаратов, в качестве растворителя, экстрагента и.т.д. [3].
Он находит широкое применение при производстве лакокрасочной продукции, изделий из полимерных материалов, лекарственных препаратов, в качестве растворителя, экстрагента и.т.д. [3].
В настоящее время в мировом масштабе уксусная кислота применяется для получения винилэфиров, в том числе эфиров винилацетата, полиэфиров этилацетата и сополимеров на их основе. Наряду с этим они широко применяются в медицине, в сельском хозяйстве для производства пластмасс, синтетических каучуков, искусственных волокон, биологически активных веществ и пластмассовых модификатор-термостабилизаторов, пластификаторов и других побочных продукций [12-14].
Ежегодно в республике производится 10 млн декалитров этилового спирта. При этом в качестве отходов образуется около 300 тыс.тонн фракции эфиральдегида (ЭАФ).ЭАФ состоит из 90-95% этанола, 0,6-1,2% метанола, 0,15-15% и других спиртов, 0,45-0,8% органических кислот, 4-6,5% воды, 0,75-1,5% альдегидов, кетонов и других легколетучих примесей.
Мировое производство этилацетата в 2018 г. составляло около 1,9 млн т. В Узбекистане выработка этилацетата в 2018 г. достигла 15 тыс. т/год, причем весь этилацетат производили путем этерификации уксусной кислоты осушенным этанолом в присутствии серной кислоты [16]. В связи с высокой коррозионной активностью уксусной и серных кислот большая часть оборудования в этом процессе выполнена из высоколегированной стали. Кроме того, в процессе этерификации образуется вода, следовательно, существует необходимость утилизации сточных вод [3]. Взаимодействие уксусной кислоты с этанолом является равновесным процессом:
составляло около 1,9 млн т. В Узбекистане выработка этилацетата в 2018 г. достигла 15 тыс. т/год, причем весь этилацетат производили путем этерификации уксусной кислоты осушенным этанолом в присутствии серной кислоты [16]. В связи с высокой коррозионной активностью уксусной и серных кислот большая часть оборудования в этом процессе выполнена из высоколегированной стали. Кроме того, в процессе этерификации образуется вода, следовательно, существует необходимость утилизации сточных вод [3]. Взаимодействие уксусной кислоты с этанолом является равновесным процессом:
(1)
А также известен способ получения этилацетата дегидрированием этанола по следующим реакциям [3]:
(2)
(3)
В настоящее время самым распространенным способом получения сложных эфиров является реакция этерификации карбоновых кислот со спиртами в присутствии минеральных кислот.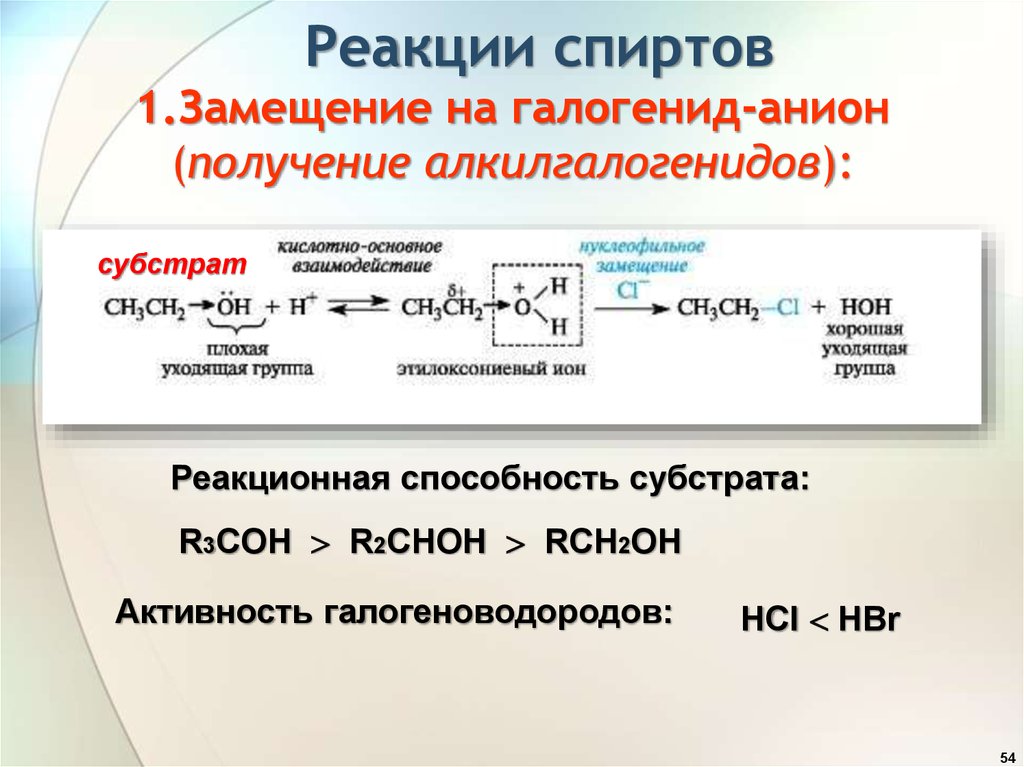 Кислота активирует карбоксильную группу и облегчает атаку слабого нуклеофильного реагента-спирта[2]:
Кислота активирует карбоксильную группу и облегчает атаку слабого нуклеофильного реагента-спирта[2]:
Применением в качестве катализатора концентрированных минеральных кислот, реакция протекает в жидкой фазе по следующему механизму: при этом кислород карбоксильной группы кислоты присоединяя протона, образует карбокатиона (1) по схеме:
(1)
Карбокатион (1) за счет нераспределенных электронов присоединяет молекулу спирта и образует промежуточный комплекс:
Комплекс (II) способен образовать карбокатиона сложного эфира и катализатор-протон переходит на свободное состояние:
Закономерности реакций этерификаций изучены Н .А. Меншуткином и он доказал что с увеличением молекулярной массы первичного спирта скорость реакции понижается, у первичных изомерных спиртах скорость реакции при этом повышается, а у третьичных понижается.
Наиболее экспрессным и информативным при анализе сложных органических смесей является хроматографический метод. Универсальными сорбентами, позволяющими разделять воду и сильнополярные вещества, являются полимерные макропористые сорбенты [2-8].
Универсальными сорбентами, позволяющими разделять воду и сильнополярные вещества, являются полимерные макропористые сорбенты [2-8].
Продукты синтеза и анализ состава технологических фракций подвергали газохроматографическому анализу методом газо-адсорбционной хроматографии на хроматографе ЦВЕТ-800 с катарометром и следующих оптимальных условиях: на колонке с сорбентом Полисорб-1 (длина колонки — 2м, диаметр — 3мм, размер частиц сорбента — не более 0,2 мм.).
Температура термостата колонок начальная т-105°С, температура термостата колонок конечная — 150°C, Скорость повышения температуры -5°C т/мин, температура детектора-100°C, температура испарителей-180°C, расход газа-носителя (гелия)- 30см3/мин, объем вводимой пробы-3-5 мкл.
Приведена типичная хроматограмма эфиральдегидных фракций на рисунке-1.
Рисунок 1. Типичная хроматограмма эфиральдегидного фракция.
(1-воздух, 2-вода, 3-уксусный альдегид, 4-этанол, 5-этилформиат, метилацетат, 6-диэтиловый эфир, 7-этилацетат)
Для получения чистого этилацетата необходимо использовать этиловый спирт с содержанием основного вещества не менее 85%. Поэтому дальнейшие исследования были направлены на очистку эфироальдегидной фракции от сопутствующих примесей и получение очищенного эфироальдегидной фракции [6].
Поэтому дальнейшие исследования были направлены на очистку эфироальдегидной фракции от сопутствующих примесей и получение очищенного эфироальдегидной фракции [6].
Для очистки эфироальдегидной фракции была собрана лабораторная установка (рис. 2). На электрическую плитку с регулируемой скоростью нагрева (поз. 1) была установлена плоскодонная колба объемом 500 мл (поз. 2). На колбу установлен дефлегматор со шлифом (поз. 3) и уровнемером (поз. 4). Сверху дефлегматора со шлифом установлен термометр (поз. 5) и два холодильника (поз. 7) объединенных через кранник (поз. 6). На первом этапе водный раствор эфироальдегидной фракции очищали от легко кипящих веществ, на втором этапе выделяли основной продукт с верхней части колонны, тяжело-кипящие примеси и вода оставались в колбе (поз. 2).
Первый метод требует много времени и энергоемкий, поэтому экономически не целесообразен. Но второй метод – аппарат непрерывного действия компактен и время энергосберегаемый и проведения начальных исследований с малым количеством сырья и установления основных технологических параметров процессов, не требует особых условий и хорошо воспроизводит протекающие процессы [1-4].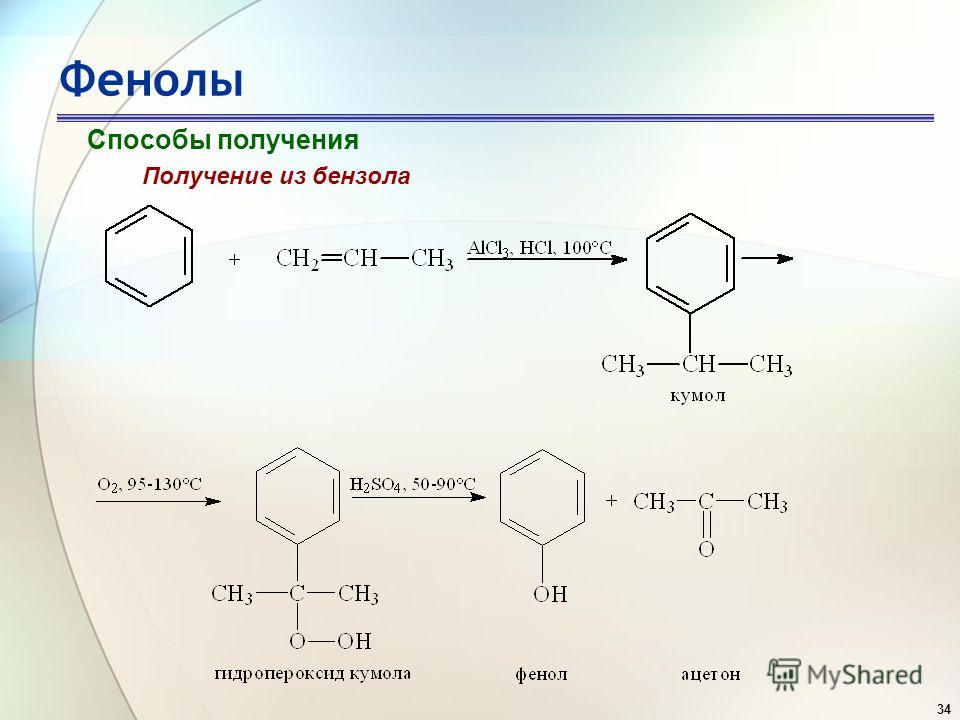
Проведенные исследования показали, что головная фракция – легколетучие компоненты метиловый спирт, альдегиды, кетоны выделяются из эфироальдегидной фракции при температурах 65°C -74°C. Начиная с 75°C до 85°C выделяется основная фракция — этиловый спирт.
Рисунок 2. Аппарат периодического действия очистки эфироальдегидной фракции
После 85°C — тяжелая фракция – кислоты, сивушные спирты, вода. Следовательно, для очистки эфироальдегидной фракции и выделения этилового спирта в первую очередь необходимо удалять основную фракцию эфироальдегидной фракции и только потом выделять основную фракцию. Тяжело-кипящая фракция остается в колбе.
Рисунок 3. Прибор для синтез этилацетата
1-штатив; 2-электрическая плитка; 3-водная баня; 4-плоскодонная колба; 5-кипятильные камешки; 6-г-образная трубка; 7-холодильник с водяным охлаждением; 8-форштос; 9-муфта холодильника; 10-аллонж; 11-приемник.
Найдено, что оптимальным соотношением реагирующих веществ является молярное соотношение уксусная кислота:этанол — 1:1,5, продолжительность 2 мин, соотношение катализатора от общей массы реагирующих веществ 1%, при этих условиях выход целевого продукта составляет 96,98 % .
Рисунок 4. ИК-спектр этилацетата
В ИК-спектрах полученного продукта наблюдается характеристичная полоса поглощения карбонильных групп при 1735 см-1, также в области 1043, 1232 см-1 проявляются интенсивные эфирные полосы, вызванная колебаниями С-О-С (рисунок 3).
Таким образом, нами был синтезирован этилацетат прямой этерификацией уксусной кислоты этанолом в условиях сверхвысокочастотного облучения в присутствии серной кислотой (1% от общей массы серной кислоты). Найдены оптимальные условия проведения процесса, максимальный выход продукта составляет 96,98%. Предлагаемый нами способ получения этилацетата по сравнению с промышленным способом позволяет сократить продолжительность процесса в 60 раз.
В результате проведенных исследований установлено, что на результат выхода этилацетата существенное влияние оказывает температура, количественное соотношение исходных веществ, количество катализатора и другие параметры. С целью изучения влияние количества катализатора на выход этилацетата, нами проведены опыты с изменением содержание серной кислоты от 0,25 до 2,0% относительно к массе реакционной смеси.
Выход этилацетата является самым высоким при 70°C, и выход реакции уменьшается с ростом температуры. Снижение выхода этилацетата при повышении температуры обусловлено противоположным процессом.
Скорость реакции увеличивается с увеличением концентрации серной кислоты в реакционной смеси до 0,2 моль / л. На основании экспериментальных результатов доказано, что дальнейшее увеличение концентрации катализатора не влияет на скорость реакции.
Кинетика реакции:
Кинетическое уравнение может быть написано в таком виде:
где СА,-концентрации уксусной кислоты,этилового спирта,этилацетата и воды. k1 –константа скорости прямой реакции,k2-константа скорости обратной реакции
k1 –константа скорости прямой реакции,k2-константа скорости обратной реакции
где ХА-конверсия уксусной кислоты.САО-начальная концентрация уксусной кислоты, Км-константа равновесия,М-соотношение этанола и уксусной кислоты. Здесь
Кинетическая модель реакции этерификации уксусной кислоты с этиловым спиртом в присутствии серной кислоты:
В качестве критерия адекватности кинетического уравнения принять следующее условие:
На основе изучения влияния температуры, количественное соотношение исходных веществ, количество катализатора и других факторов на выход этилацетата установлено, что максимальный эффект наблюдается при добавлении в реакционную смесь до 1% серной кислоты.
Результаты проведенных опытов показали ,что чем ниже температуры перегонки катализата, тем больше в нем содержание этилацетата и меньше этанола и воды.
В результате проведенных исследований разработана кинетическая модель реакции этерификации уксусной кислоты и этилового спирта и на основе данной модели рассчитана энергия активации процесса (Еа=37,9+1,2кДж/mol)
В качестве критерия адекватности кинетического уравнения принять выполнения следующего условия:
Список литературы:
- Артамонов А.
 М. Влияние номера тарелки отбора фракции сивушных масел на показатели работы брагоректификационной установки // А.М. Артамонов, Х.Р. Сиюхов//Изв. вузов. Пищ. технология. — 2010. — № 2-3. — С. 76-79.
М. Влияние номера тарелки отбора фракции сивушных масел на показатели работы брагоректификационной установки // А.М. Артамонов, Х.Р. Сиюхов//Изв. вузов. Пищ. технология. — 2010. — № 2-3. — С. 76-79. - Гольберг К.А., Виндергауз М.С. Курсгазовойхроматографии. М.: Химия, 1990. – 376 с.
- Жумаева З.Э., Юсупов Д., Миркамилов Т.М., Турабджанов С.М. Технология переработки отходов биохимических производств. //Экологическое образование и проблемы охраны окружающей среды в промышленности: Международная научно-техническая конференция. Ташкент. 1997. С.228-230.
- Константинов, Е.Н. Двухзонная модель UNIQUAC для моделирования процессов разделения эфиро-альдегидной фракции//Е.Н. Константинов, Т.Г. Короткова, Т.А. Устюжанинова// Изв. вузов. Пищ. технология. — 2004. — №5-6. — С.88.
- Моделирование и оптимизация технологической схемы разделения эфиро-альдегидной фракции// Константинов Е.Н. [и др.] // Изв. вузов. Пищ. технология. — 2006. — № 1. — С. 89-91.

- Патент РФ. № 2127722. Жуков В.И.; Валькович Г.В.; Гершберг М.И.; СаушкинЮ.И. идр.Способ получения сложных эфиров и/или их смесей. Б.И. № 7, 1999.
- Панеш, Р.Н. Научное обоснование и разработка квазистационарного технологического режима получения пищевого спирта при импульсном отборе сивушных масел: автореф. дис…канд. техн. Наук /Панеш Раиса Нальбиевна. — Краснодар, 2009. — 23 с.
- Сакодынский К.И., Бражников В. В., ВолкоС. А. и др. Аналитическая хроматография. М.: Химия, 1993. – 464 с.
- Тимофеев В.С. Принципы технологии основного органического и нефтехимического синтеза. : Учеб.пособие для вузов//В.С.Тимофеев, Л.А.Серафимов. – 2-е изд., перераб. – М.: Высш.шк. 2003, 203 – 536 с.
- Термодинамический базис моделирования технологии разделения сивушных смесей спиртового производства // Сиюхов Х.Р. [и др.]// Изв. вузов. Пищ. технология. — 2009. — № 4. — С.110 — 113.
- Файзуллаев Н.И., Фозилов С.Ф., Ибодуллаева М.
 Н., Хотамов К.Ш. Гетерогенно-каталитический синтез винилацетата из ацетилена// «Научный аспект». -№1. -2019. -С-373-374
Н., Хотамов К.Ш. Гетерогенно-каталитический синтез винилацетата из ацетилена// «Научный аспект». -№1. -2019. -С-373-374 - Файзуллаев Н.И., Курбанов А.М., Шугаепов Н.А, Турдиев М.Ф. Каталитическое ацетилирование ацетилена в паровой фазе в присутствии нанокатализатора.//. ВестникАИНГ, 2016 г., No4(40). –С-24-29.
- Файзуллаев Н.И. Каталитический синтез винилацетата из ацетилена. // Материалы Всероссийской конференции с международным участием “Современные достижения химии непредельных соединений: алкенов, алкенов, аренов и гетероаренов”. — Санкт-Петербург, 2014. – С. 182.
- Шаззо, Р.С. Моделирование процессов брожения и брагоректификации при производстве пищевого спирта из продуктов помола зерна пшеницы: автореф. дис…канд. техн. наук//Шаззо Руслан Станиславович. — Краснодар, 2008. — 24 с.
- Юсупов Д., Миркамилов Т.М., Турабджанов С.М., Жумаева З.Э. Совершенствование технологии производства этилацетата //Узб. хим. журн., 1998, № 1. С.31-33.

Грубая наука. Ice Challenge
Грубая наука. Ледяной вызов | PBS
|
| ||||||||||||||||||||||
Дегидратация спиртов для получения алкенов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3901
- Джим Кларк
- Школа Труро в Корнуолле
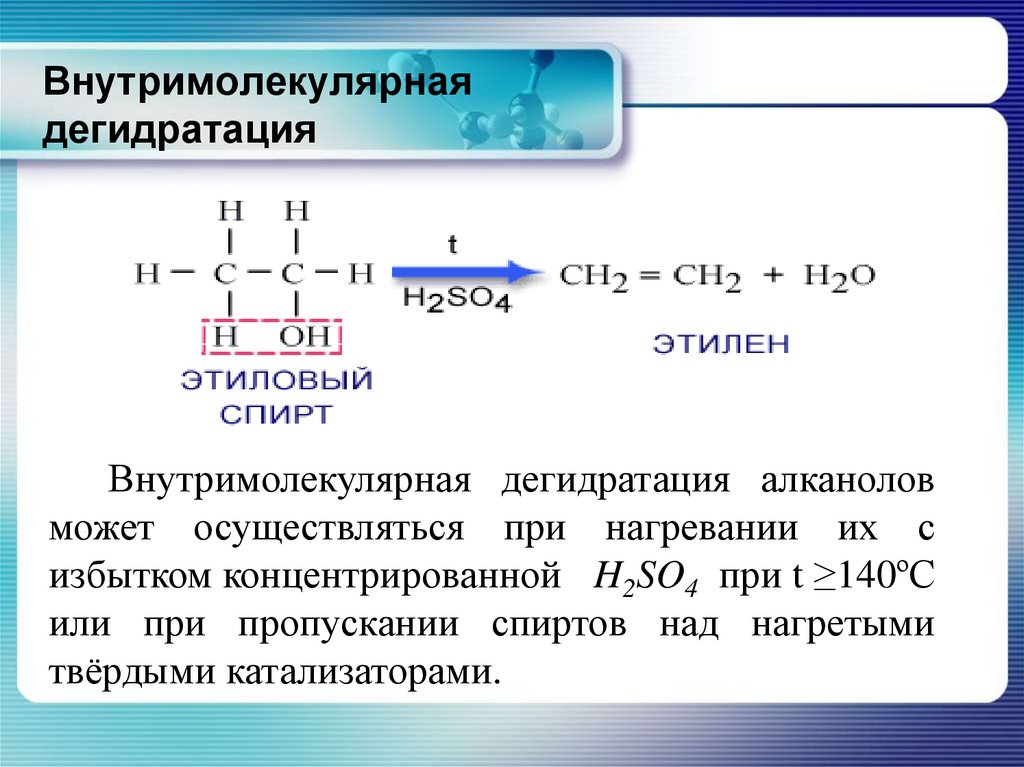
На этой странице обсуждается дегидратация спиртов в лаборатории для получения алкенов, например дегидратация этанола для получения этилена.
Дегидратация этанола с получением этилена
Это простой метод получения газообразных алкенов, таких как этилен. Если пары этанола пропускают через нагретый порошок оксида алюминия, этанол по существу расщепляется с образованием этилена и водяного пара.
Для производства нескольких пробирок с этеном можно использовать следующее оборудование:
Масштаб этой системы можно увеличить, кипя этанол в колбе и пропуская пары над оксидом алюминия, который нагревают в длинной трубке. .
Дегидратация спиртов с использованием кислотного катализатора
Кислотными катализаторами, обычно используемыми при дегидратации спиртов, являются либо концентрированная серная кислота, либо концентрированная фосфорная (V) кислота, H 3 PO 4 . Концентрированная серная кислота дает грязные результаты. Поскольку серная кислота также является сильным окислителем, она окисляет часть спирта до двуокиси углерода и одновременно сама восстанавливается до двуокиси серы. Оба эти газа должны быть удалены из алкена. Серная кислота также реагирует со спиртом с образованием массы углерода. Есть и другие побочные реакции (здесь не обсуждаются).
Оба эти газа должны быть удалены из алкена. Серная кислота также реагирует со спиртом с образованием массы углерода. Есть и другие побочные реакции (здесь не обсуждаются).
Дегидратация этанола с получением этилена
В этом процессе этанол нагревают с избытком концентрированной серной кислоты до температуры 170°C. Образовавшиеся газы пропускают через раствор гидроксида натрия для удаления двуокиси углерода и двуокиси серы, образующихся в результате побочных реакций. Этен собирают над водой.
Концентрированная серная кислота является катализатором. Поэтому он написан над стрелкой реакции, а не в уравнении.
Дегидратация циклогексанола с получением циклогексена
Это препарат, обычно используемый для иллюстрации образования и очистки жидкого продукта. Тот факт, что атомы углерода соединены в кольцо, не имеет отношения к химическому составу реакции. Циклогексанол нагревают с концентрированной фосфорной (V) кислотой, жидкий циклогексен отгоняют, собирают и очищают.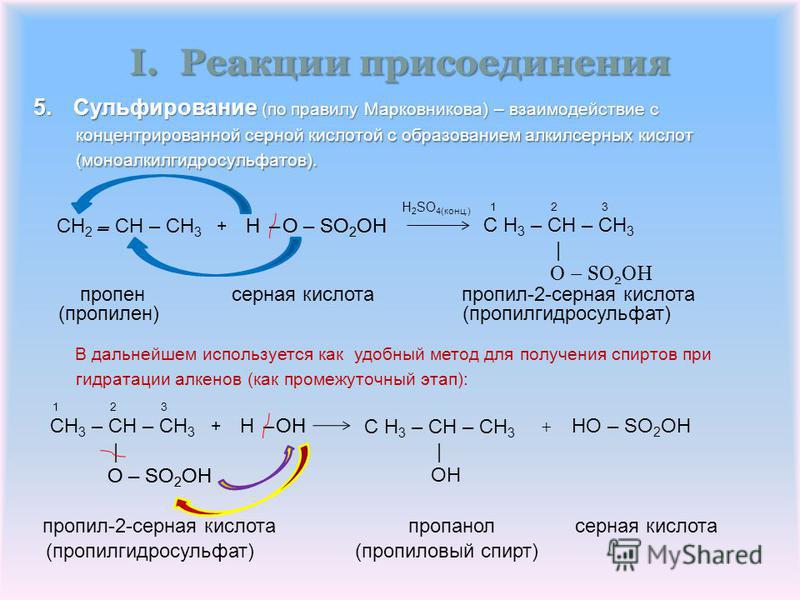 Фосфорную (V) кислоту обычно используют вместо серной, поскольку она более безопасна и способствует менее сложной реакции.
Фосфорную (V) кислоту обычно используют вместо серной, поскольку она более безопасна и способствует менее сложной реакции.
Дегидратация более сложных спиртов
С более сложными спиртами возможно образование более чем одного алкена. Хорошим примером этого является бутан-2-ол, при дегидратации которого образуются три разных алкена.
При дегидратации спирта группа -ОН и атом водорода от следующего атома углерода в цепи удаляются. С такими молекулами, как бутан-2-ол, для этого есть две возможности.
Образуются следующие продукты:
Продуктами являются бутен-1, CH 2 =CHCH 2 CH 3 и бутен-2, CH 3 CH=CHCH 3 .
Эта ситуация еще более осложняется тем фактом, что бутен-2-ен проявляет геометрическую изомерию; при этом образуется смесь двух изомеров: цис -бут-2-ен и транс -бут-2-ен.
Соединение цис -бут-2-ен также известно как (Z)-бут-2-ен; транс -бут-2-ен также известен как (Е)-бут-2-ен.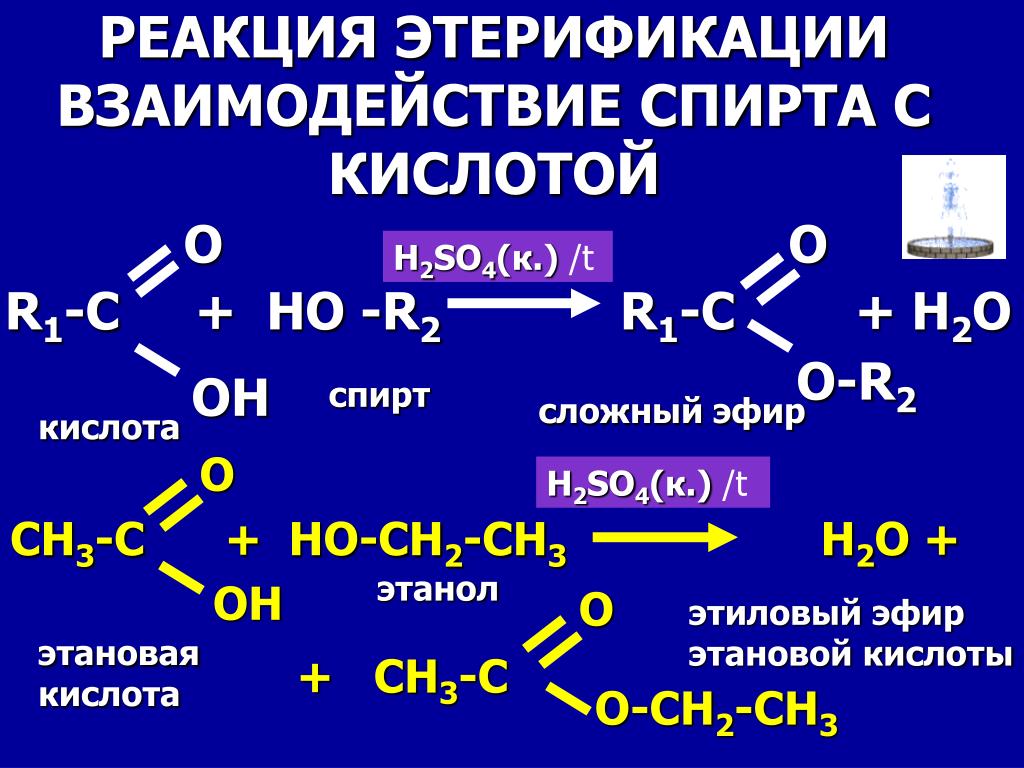

 М. Влияние номера тарелки отбора фракции сивушных масел на показатели работы брагоректификационной установки // А.М. Артамонов, Х.Р. Сиюхов//Изв. вузов. Пищ. технология. — 2010. — № 2-3. — С. 76-79.
М. Влияние номера тарелки отбора фракции сивушных масел на показатели работы брагоректификационной установки // А.М. Артамонов, Х.Р. Сиюхов//Изв. вузов. Пищ. технология. — 2010. — № 2-3. — С. 76-79.
 Н., Хотамов К.Ш. Гетерогенно-каталитический синтез винилацетата из ацетилена// «Научный аспект». -№1. -2019. -С-373-374
Н., Хотамов К.Ш. Гетерогенно-каталитический синтез винилацетата из ацетилена// «Научный аспект». -№1. -2019. -С-373-374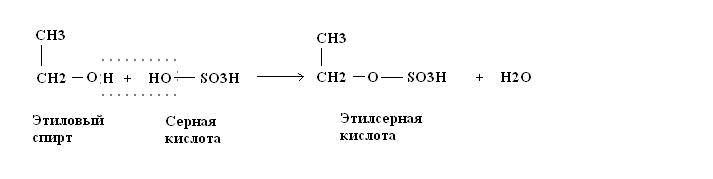
 Так
мы перешли к попытке сделать лед, используя эфир в качестве охлаждающей жидкости. С
более низкая температура кипения 34,5 ° C, это может просто нарушить баланс
между водой и льдом, хотя значения скрытой теплоты показывают, что
эфира нужно выпарить больше, чем метанола, чтобы удалить то же самое
количество тепла.
Так
мы перешли к попытке сделать лед, используя эфир в качестве охлаждающей жидкости. С
более низкая температура кипения 34,5 ° C, это может просто нарушить баланс
между водой и льдом, хотя значения скрытой теплоты показывают, что
эфира нужно выпарить больше, чем метанола, чтобы удалить то же самое
количество тепла. в ванне с холодной водой. Поскольку эфир кипит при 34,5°C (94,1°F), ему необходимо
быть охлажденным, чтобы сконденсировать его из газа в жидкость и хранить в прохладном месте
поэтому он остается жидким. Ниже примерно 120°C (248°F) реакция не идет.
происходит при температуре выше 160°C вместо эфира вместо эфира
образовалась, поэтому 140°C была выбрана как компромисс между отсутствием реакции
и неправильная реакция.
в ванне с холодной водой. Поскольку эфир кипит при 34,5°C (94,1°F), ему необходимо
быть охлажденным, чтобы сконденсировать его из газа в жидкость и хранить в прохладном месте
поэтому он остается жидким. Ниже примерно 120°C (248°F) реакция не идет.
происходит при температуре выше 160°C вместо эфира вместо эфира
образовалась, поэтому 140°C была выбрана как компромисс между отсутствием реакции
и неправильная реакция.
Leave A Comment