Серебро: свойства, пробы, покрытия и особенности драгоценного металла
В предыдущей статье ТД Серебро рассказал о том, почему некоторые металлы считаются драгоценными. Оказалось, этому есть простое объяснение: они обладают уникальными химическими, физическими и эстетическими свойствами.
Каждый металл уникален по-своему, но в нашей компании с особым уважением относятся к благородному серебру. Оно стало основой ассортимента торгового дома, является одним из главных металлов ювелирного дела и очень широко востребовано в лёгкой и тяжёлой промышленности. С серебром связаны удивительные факты и несколько мифов — некоторые мы подтвердим, другие развеем, и всё это будет интересно.
Дисклеймер: мы не стремимся рассказать всё, а хотим дать вам общее понимание тех вещей, которые будут полезны при выборе украшений. Мы же ювелирная компания. Если вы хотите глубоко разобраться в этих вопросах, стоит подумать о специальном образовании.
Физика
Отжиг — это высокотемпературная обработка для придания металлу более устойчивого состояния, устранения неоднородностей, снятия напряжений из-за деформации. Сплавы серебра отжигаются при температуре 600–650°С с выдержкой до десяти минут в зависимости от массы и с резким охлаждением. Отжигу подвергаются практически все ювелирные украшения из серебра.
Серебро хорошо полируется, имеет высокую отражательную способность, обладает хорошей ковкостью и самыми высокими из всех металлов тепло- и электропроводностью.
Химия
Серебро устойчиво в воде, практически не реагирует с кислородом воздуха при комнатной температуре, но из-за наличия в воздухе сероводорода со временем покрывается тончайшим тёмным налётом сульфида серебра. Также серебро реагирует с озоном, образуя налёт оксида серебра. Вот то самое потемнение, которое считают главным недостатком этого металла.
Медь, которая является наиболее распространённой лигатурой сплавов серебра, тоже образует налёт — из сульфида меди. Чем больше содержание меди в сплаве, тем быстрее потемнеет изделие, а чем меньше, тем менее сплав подвержен потускнению, поэтому наиболее устойчивыми считаются сплавы от 875 до 960 пробы.
Лигатура — сплав из двух и более компонентов, который добавляется к драгоценному металлу для доведения ювелирного сплава до определённой пробы, изменения цвета сплава, а также придания различных полезных свойств. Процесс добавления лигатуры называют легированием.
Серебро растворяется в азотной и горячей концентрированной серной кислоте. Как и золото, оно взаимодействует со щёлочными растворами цианидов. Вероятно, с этими вещами вы никогда не столкнётесь. А если столкнётесь, будьте очень осторожны.
Сплавы серебра
Чистое серебро — тяжёлый (легче свинца, но тяжелее меди и твёрже золота), необычайно пластичный серебристо-белый металл с коэффициентом отражения света около 100%, поэтому в чистом виде серебро обычно используют только для покрытия украшений из сплавов серебра, из недрагоценных металлов, как компонент золотых и серебряных лигатур и припоев.
В изготовлении ювелирных украшений, чтобы повысить твёрдость и прочность материала, серебро обрабатывают в сплавах с другими металлами. Чаще всего это двухкомпонентные сплавы серебра с медью в различном процентном соотношении и с незначительным количеством примесей.
Серебряные сплавы слегка различаются по оттенкам и обладают приблизительно одинаковыми механическими свойствами. Из сплавов с низким содержанием серебра изготавливают предметы сервировки стола, декоративные настольные украшения. Для производства ювелирных изделий используют сплавы высокой пробы. Они достаточно пластичны, хорошо сочетаются с цветными камнями, жемчугом и эмалью.
Из сплавов с низким содержанием серебра изготавливают предметы сервировки стола, декоративные настольные украшения. Для производства ювелирных изделий используют сплавы высокой пробы. Они достаточно пластичны, хорошо сочетаются с цветными камнями, жемчугом и эмалью.
Пробы серебра
В Российской Федерации принята метрическая система проб. Метрическая проба — это количество миллиграммов основного благородного металла, не менее которого содержит один грамм сплава.
Например, в серебряном сплаве 925 пробы на грамм приходится 925 миллиграммов серебра. Для простоты можно считать, что при 925 пробе в сплаве 92,5% серебра.
- 800. Сплав с высоким содержанием меди, из-за чего имеет желтоватый оттенок. Подходит для столовых приборов.
- 830. Свойства идентичны 800-й пробе. Применяется для декоративных украшений.
- 875. Используется при промышленном изготовлении ювелирных и бытовых изделий — например, ручек.

- 916. Применяется для производства предметов столовой сервировки с покрытием эмалью.
- 925. По цвету и антикоррозийным свойствам не отличается от чистого серебра. Этот сплав широко применяется для изготовления ювелирных украшений.
- 960. Применяется для изготовления филигранных изделий.
- 999. Подходит для хранения металла в слитках и серебрения, то есть покрытия украшений тонким слоем серебра для защиты и улучшения декоративных свойств.
В производстве ювелирных украшений наиболее распространены 875 и 925 пробы. Современный российский ГОСТ 30649-99 описывает пять марок сплавов на основе серебра. Во всех лигатурой является медь.
Покрытия изделий из серебра
В настоящее время наиболее технологичными видами и способами покрытий изделий из серебра являются:
- «Белое» кипячение — кипячение в серной или соляной кислоте для снижения содержания реагирующей с сероводородом меди в тонком поверхностном слое изделия.

- Гальваническое покрытие — нанесение тонкого слоя драгоценного металла электрогальваническим методом. В настоящее время гальваника является самым популярным способом защиты и декорирования ювелирных изделий из серебра. В зависимости от металла, выполняющего функцию защитного слоя, используют следующие виды покрытий:
- Серебрение — покрытие тонким слоем чистого серебра, которое слабее сплавов реагирует с сероводородом воздуха.
- Родирование — покрытие слоем белого, и, реже, чёрного или жёлтого родия. Родий является драгоценным металлом платиновой группы. Он износостоек, не темнеет, обладает красивым зеркальным светло-стальным блеском, поэтому в последние 10–15 лет стал одним из самых популярных покрытий на ювелирном рынке. Родиевое покрытие в случае ремонта при пайке чернеет и трескается. В этом случае старое покрытие приходится снимать и наносить новое.
- Золочение — покрытие золотом.
 Активно применяется для полного или частичного декорирования изделий из серебра.
Активно применяется для полного или частичного декорирования изделий из серебра.
- Пассивирование (пассивация) — перевод верхнего слоя сплава в пассивное состояние, резко замедляющее коррозийные процессы. Выполняет исключительно защитную функцию.
- Оксидирование — разновидность пассивирования, создание на поверхности металла плотной плёнки оксидов, предохраняющих его от коррозии. Является одновременно методом декоративного и защитного покрытия.
- Электорофорезное осаждение — покрытие органическим пенополиуретаном или акрилом путём погружения в водный раствор эпоксидной или акриловой смолы под воздействием напряжения. Выполняет только защитную функцию.
Применение
Из серебра изготавливают украшения, часы, предметы сервировки стола, украшения для интерьера, письменные принадлежности, декоративные элементы оружия. Серебро можно сочетать с золотом, эмалью, чернью, драгоценными и полудрагоценными камнями, жемчугом, кораллами, слоновой костью.
Мифы о серебре
- Чернеет поддельное серебро, а настоящее (старое, качественное) не чернеет
Подделка тоже может чернеть по самым разным причинам, но если вы внимательно прочитали нашу статью, то поняли, что образование тонкого слоя оксида или сульфида серебра нормально для этого металла, это его химическая особенность. А в старых украшениях в качестве лигатур использовали не медь, а палладий и платину. Такой сплав действительно не темнел, зато был намного дороже. Это химия, ничего личного.
- Серебро обеззараживает
Это чистая правда, серебро обладает бактериостатическими свойствами, замедляя развитие бактерий, и бактерицидным эффектом, убивая бактерии с помощью ионов серебра. Но это проявляется только в концентрации, которая может оказаться вредной и для нас с вами, ведь серебро — тяжёлый металл, оно откладывается в организме и может вызвать отравление. Носить его безопасно, а вот есть мы не рекомендуем.
Но это проявляется только в концентрации, которая может оказаться вредной и для нас с вами, ведь серебро — тяжёлый металл, оно откладывается в организме и может вызвать отравление. Носить его безопасно, а вот есть мы не рекомендуем.
А ещё вы можете вытащить ложки, кольца и подвески из воды: в таком случае выделяется так мало ионов серебра, что они не в состоянии ничего обеззаразить. Это также значит, что можно не бояться серебряной посуды и столовых приборов. Если пользоваться специальным ионизатором, эффект будет, но с ним легко превысить допустимую концентрацию и опять же получить отравление.
Если вы читаете на английском, вот отчёт ВОЗ о применении серебра для обеззараживания, который в целом повторяет вышеприведённые выводы и говорит о недостатке информации для далекоидущих выводов в большинстве исследований на эту тему.
- Серебро прогоняет нечисть
Этот миф мы предлагаем вам проверить самостоятельно. Найдите вампира и пронзите серебряным мечом, но соблюдайте меры предосторожности: если меч родированный, эффект может разочаровать.
Найдите вампира и пронзите серебряным мечом, но соблюдайте меры предосторожности: если меч родированный, эффект может разочаровать.
Ионы серебра в фильтрах для воды
Москва
Эксперты Аквафор
Наука
Aqualen™ (структурная формула)
Фильтр не «цветет», вода обработана связанным серебром, но самого серебра не содержит, то есть — безопасна для человека.
АКВАФОР Орлеани — сверхпрочный фильтр-кувшин с объемным рисунком из материала Tritan™.
J.SHMIDT 500 мобильная система фильтрации — мобильная альтернатива системе под мойку. Глубокая очистка водопроводной воды от токсичных химических примесей, защита от бактерий без бактерицидов.
Глубокая очистка водопроводной воды от токсичных химических примесей, защита от бактерий без бактерицидов.
АКВАФОР Кристалл Эко — безопасная вода для детей, аллергиков и пожилых людей.
Эксперты Аквафор
28 ноября 2018
91
Измеритель качества воды TDS-метр
08 июля 2019
92
Лаборатория АКВАФОР взяла «серебро» по точности среди 53 лабораторий России
Наука
Новости
Эксперты Аквафор
24 января 2022
66
Можно ли смешивать кипяченую и некипяченую воду
Эксперты Аквафор
03 декабря 2021
95
Можно ли второй раз кипятить воду?
16 ноября 2020
79
Лаборатория АКВАФОР: на страже вашего здоровья
Наука
Новости
Эксперты Аквафор
26 декабря 2018
109
Какая вода полезнее «кислотная» или «щелочная»?
Эксперты Аквафор
26 декабря 2018
117
Какой уголь подходит к фильтру для воды?
Эксперты Аквафор
15 апреля 2021
91
Запах сероводорода в воде из скважины
Наука
Дача
22 декабря 2022
108
АКВАФОР на Инженерном хакатоне-2022: осторожно, инновации!
Заявка на видеоконсультацию
1
мессенджер для связи
2
контактные данные
3
выбор даты
Заявка отправлена
Наш сотрудник проведет видеоконсультацию в выбранное время
Воздействие серебра на воду
Серебро встречается в природе в окружающей среде, в основном в виде очень нерастворимых и неподвижных оксидов, сульфидов и некоторых солей.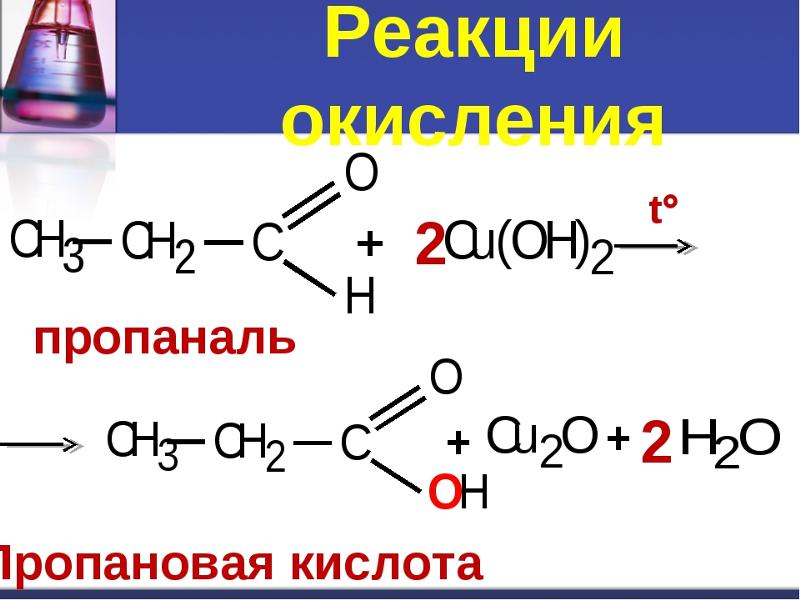 Поскольку ионы серебра являются бактериостатическими, серебро используется как в качестве аварийного дезинфицирующего средства для питьевой воды, так и для пропитки некоторых фильтров для воды для предотвращения повторного роста микробов.
Поскольку ионы серебра являются бактериостатическими, серебро используется как в качестве аварийного дезинфицирующего средства для питьевой воды, так и для пропитки некоторых фильтров для воды для предотвращения повторного роста микробов.
Серебро используется в Соединенных Штатах для дезинфекции воды с 1950-х годов, и в настоящее время на рынке продаются многочисленные коммерческие фильтры для воды, использующие серебро.
Бытовые фильтрующие системы, использующие керамические фильтры, покрытые антибактериальным коллоидным серебром, доказали свою эффективность в уничтожении бактерий в загрязненной бытовой воде в различных местах по всему миру.
В частности, положительные результаты использования недорогой технологии фильтрации в подверженных наводнениям районах Юго-Восточной Азии были недавно отмечены в отчете International Development Enterprises об испытаниях технологии фильтрации для Международной федерации обществ Красного Креста и Красного Полумесяца.
Антибактериальные свойства
Конкретный антибактериальный механизм серебра не совсем ясен, но исследования E. coli и S. aureus показали, что обработка серебром этих микроорганизмов приводит к потере ДНК способности к репликации.
coli и S. aureus показали, что обработка серебром этих микроорганизмов приводит к потере ДНК способности к репликации.
Исследования систем дезинфекции питьевой воды показали, что серебро можно успешно использовать для контроля роста бактерий. Также было обнаружено, что добавление меди и серебра в водные системы может позволить снизить концентрацию свободного хлора, сохраняя при этом сравнимое санитарное качество воды.
Еще одно исследование показало, что серебро можно использовать в системах водоснабжения больниц для борьбы с легионеллой и в градирнях для контроля роста бактерий. Серебро также использовалось для повышения эффективности ультрафиолетового (УФ) излучения при инактивации вирусов в воде.
Многие коммерческие фильтры для воды POU используют активированный уголь, импрегнированный серебром, для удаления загрязняющих веществ из бытовых систем водоснабжения.
Бактерии могут размножаться на углеродных средах, не содержащих серебра, и впоследствии попадать в воду. Серебряная пропитка предотвращает загрязнение угольного фильтра и обеспечивает дополнительный бактерицидный эффект.
Серебряная пропитка предотвращает загрязнение угольного фильтра и обеспечивает дополнительный бактерицидный эффект.
Проблемы со здоровьем
Рекомендации Всемирной организации здравоохранения (ВОЗ) по качеству питьевой воды указывают на отсутствие адекватных данных, на основании которых можно было бы определить значение содержания серебра в питьевой воде с точки зрения здоровья.
Эти руководящие принципы гласят, что «в тех случаях, когда соли серебра используются для поддержания бактериологического качества питьевой воды, уровни серебра до 0,1 мг/л могут допускаться без риска для здоровья».
Серебро регулируется Национальным нормативным актом по вторичной питьевой воде Агентства по охране окружающей среды США (EPA).
Вторичный максимальный уровень загрязняющих веществ в водопроводной воде составляет 0,1 мг/л, что является неисполнимой нормой, основанной на возможных косметических эффектах, таких как обесцвечивание кожи.
Каталожные номера
- Баяти, Массачусетс, 1997 г.
 Даже у углерода есть серебряная подкладка: фильтры, пропитанные серебром, обеспечивают дополнительную защиту от бактерий. Водные технологии, июль 1997 г.
Даже у углерода есть серебряная подкладка: фильтры, пропитанные серебром, обеспечивают дополнительную защиту от бактерий. Водные технологии, июль 1997 г. - Буллард, М. 2002. Недорогие бытовые водоочистители для районов, подверженных наводнениям: Международные предприятия по развитию (IDE) отчитываются перед Международной федерацией обществ Красного Креста и Красного Полумесяца (IFRC) об испытаниях технологии фильтрации. http://www.potpaz.org/Mekong.doc
- Буткус М. А., Лабаре М. П., Старке Дж. А., Мун К., Талбот М. Использование водного раствора серебра для усиления инактивации колифага MS-2 с помощью УФ-дезинфекции. Appl Environ Microbiol. 2004 г., май; 70(5):2848-53.
- Codony F, Domenico P, Mas J. 2003. Оценка тиолов висмута и обычных дезинфицирующих средств на биопленках питьевой воды. J Appl Microbiol. 2003;95(2):288-93.
- Фэн, К. Л., Дж. Ву, Г. К. Чен, Ф. З. Цуй, Т. Н. Ким, Дж. О. Ким. 2000. Механистическое исследование антибактериального действия ионов серебра на кишечную палочку и золотистый стафилококк.
 J Biomed Mater Res, 52, 662-668, 2000.
J Biomed Mater Res, 52, 662-668, 2000. - Ким Дж., Чо М., О Б., Чой С., Юн Дж. 2004. Контроль роста бактерий в воде с помощью синтезированного неорганического дезинфицирующего средства. Хемосфера. 2004 г., май; 55 (5): 775-80.
- Стаут Дж. Э., Ю В. Л. 2003. Опыт первых 16 больниц, использующих ионизацию медь-серебро для борьбы с легионеллой: последствия для оценки других методов дезинфекции. Infect Control Hosp Epidemiol. 2003 авг; 24 (8): 563-8.
- АООС США. 1992. Вторичные правила питьевой воды: Руководство по неприятным химическим веществам. ЭПА 810/К-92-001. http://www.epa.gov/safewater/consumer/2ndstandards.html
- ВОЗ. 2004 г. Проект третьего издания Руководства ВОЗ по качеству питьевой воды. Женева, Всемирная организация здравоохранения. http://www.who.int/water_sanitation_health/dwq/guidelines3rd/en/
- Yahya MT, Landeen LK, Messina MC, Kutz SM, Schulze R, Gerba CP. 1990. Дезинфекция от бактерий в системах водоснабжения с использованием электролитического производства меди: серебра и пониженного уровня свободного хлора.
 Может J Microbiol. 1990 февраль; 36 (2): 109-16.
Может J Microbiol. 1990 февраль; 36 (2): 109-16.
Грегори Д. Дженнингс — специалист по распространению знаний в области биологической и сельскохозяйственной инженерии в Кооперативной службе распространения знаний Северной Каролины в Университете штата Северная Каролина, Роли, Северная Каролина.
Общая реакция между нитратом серебра и водой
Химическая реакция — это процесс, который приводит к превращению одного набора химических веществ в другой. В химической реакции атомы или группы атомов перестраиваются с образованием новых веществ с другими химическими свойствами. В общем, химическая реакция включает разрыв химических связей в реагентах и образование новых связей в продуктах. Энергия либо поглощается, либо высвобождается в результате химической реакции, в зависимости от общего изменения энтальпии или теплоемкости системы. При реакции между нитратом серебра и водой нитрат серебра разлагается на металлическое серебро и азотную кислоту. $$\ce{2 AgNO3 -> 2 Ag + O2 + 2 NO2}$$ Полученное металлическое серебро имеет блеск и блеск, а азотная кислота является сильной кислотой. Эта реакция является экзотермической, что означает выделение тепла.
$$\ce{2 AgNO3 -> 2 Ag + O2 + 2 NO2}$$ Полученное металлическое серебро имеет блеск и блеск, а азотная кислота является сильной кислотой. Эта реакция является экзотермической, что означает выделение тепла.
Нитрат серебра, помимо того, что он является предшественником многих других соединений серебра , также используется в фотографии. Применение нитрата серебра в биологии, химическом синтезе и медицине многочисленно. Он легко растворяется и диссоциирует в воде, превращаясь в бесцветное вещество. Поскольку нитрат серебра является окислителем, его нельзя синтезировать в органические соединения. Нитрат серебра не имеет известных побочных эффектов при кратковременном воздействии, но длительное воздействие может вызвать повреждение глаз. Он используется для лечения как гонореи, так и носовых кровотечений.
Нитрат серебра — неорганический химикат с антисептическими свойствами, который можно найти в растворе нитрата серебра. Нитрат серебра можно использовать для прижигания или склерозирования в лаборатории. Нитрат серебра представляет собой соединение с химической формулой AgNO3 , которое является неорганическим соединением. Плоский нитрат серебра в твердой форме имеет тригональное расположение.
Нитрат серебра представляет собой соединение с химической формулой AgNO3 , которое является неорганическим соединением. Плоский нитрат серебра в твердой форме имеет тригональное расположение.
Кристаллы серебра образуются в результате реакции нитрата серебра с медью, в результате чего получается синий раствор нитрата меди. При нагревании нитрат серебра начинает разлагаться.
В результате данная реакция является примером осаждения.
При реакции AgNO3 и Cl2 в водопроводной воде появляется белая мутная дымка при добавлении каждой капли. После первой капли раствор может временно стать красным, но при перемешивании он исчезнет.
Что происходит с нитратом серебра в воде?
Фото: sciencephoto.comПри добавлении нитрата серебра в воду он растворяется и образует ионы нитрата серебра . Затем эти ионы способны взаимодействовать с другими молекулами в воде, образуя новые соединения.
Нитрат серебра может раздражать дыхательные пути и вызывать рвоту и тошноту, которые могут возникнуть при вдыхании. Нитрат серебра при нанесении на кожу может вызвать раздражение, поэтому будьте осторожны при его использовании. Если вы испытываете какие-либо побочные эффекты от нитрата серебра, вам следует прекратить его использование и проконсультироваться с вашим лечащим врачом.
Нитрат серебра при нанесении на кожу может вызвать раздражение, поэтому будьте осторожны при его использовании. Если вы испытываете какие-либо побочные эффекты от нитрата серебра, вам следует прекратить его использование и проконсультироваться с вашим лечащим врачом.
Является ли нитрат серебра физическим или химическим изменением?
Когда нитрат серебра вступает в реакцию с другими соединениями, происходит химическое изменение. Новые вещества обладают свойствами, отличными от исходных нитрата серебра и других соединений.
Химические реакции необходимы для функционирования мира. Эти вещества, которые мы используем ежедневно, отвечают за построение веществ, которые мы используем, а также за то, что позволяют нам понимать и контролировать мир вокруг нас. Превращение одного химического вещества в другое является распространенной и важной химической реакцией. Эта реакция приводит к переходу исходных химических веществ в другое состояние. Эта реакция может быть использована для создания новых продуктов или для изменения свойств существующих. Например, бумага и другие изделия из нитрата серебра превращаются в хлорид серебра , который проводит электричество. Химические реакции, помимо изменения окружающего мира, играют важную роль в жизни общества. При разбавлении нитрата серебра соляной кислотой выпадает белый осадок. Этот осадок приводит к появлению характерного цвета хлорида серебра. Химические реакции являются важнейшими компонентами мира, в котором мы живем, и именно они позволяют нам понимать и контролировать его.
Например, бумага и другие изделия из нитрата серебра превращаются в хлорид серебра , который проводит электричество. Химические реакции, помимо изменения окружающего мира, играют важную роль в жизни общества. При разбавлении нитрата серебра соляной кислотой выпадает белый осадок. Этот осадок приводит к появлению характерного цвета хлорида серебра. Химические реакции являются важнейшими компонентами мира, в котором мы живем, и именно они позволяют нам понимать и контролировать его.
Нитрат серебра Реакция с водой
Фото: cheggcdn.com В результате растворения нитрата серебра в воде положительные ионы серебра приобретают положительный заряд, который может связываться с другими отрицательно заряженными ионами, такими как галогениды. Это также полезно для множества других приложений, включая фотографию, медицину, биологию и множество других областей.
Нитрат серебра можно получить путем реакции серебряной фольги или серебряного слитка с азотной кислотой. При протекании реакции под вытяжным шкафом токсичные оксиды азота не выделяются. Нитрат серебра реагирует с медью в синем растворе нитрата меди с образованием кристаллов серебра. Нитрат серебра представляет собой коррозионно-активный металл, который вводят в виде жидкости или палочки, разбавленной водой. Гонорея не опасна для человека, если раствор содержит от 1% до 2% гонококковых бактерий. Этот продукт можно использовать в производстве перманентных маркеров для ткани и красок для волос.
Какой тип смеси представляет собой нитрат серебра в воде
Смесь нитрата серебра в воде представляет собой химическое соединение, которое используется в различных областях. Чаще всего он используется в качестве фотопроявителя, но также может использоваться в качестве дезинфицирующего средства и при производстве некоторых химических веществ.
Формула AgNO3 содержит нитрат серебра. Между анионами серебра и нитрата образуется ионная связь, катализатором выступает NO3. Нитрат серебра можно использовать в различных областях, включая биологию, химический синтез и медицину. Нитрат серебра нельзя употреблять, потому что это окислитель, который следует держать вдали от органических соединений. Это соединение оказывает широкий спектр воздействия на здоровье, помимо раздражения кожи и глаз. В краткосрочной перспективе это соединение не вызывает немедленных побочных эффектов, кроме фиолетового, коричневого или черного пятна на коже.
Между анионами серебра и нитрата образуется ионная связь, катализатором выступает NO3. Нитрат серебра можно использовать в различных областях, включая биологию, химический синтез и медицину. Нитрат серебра нельзя употреблять, потому что это окислитель, который следует держать вдали от органических соединений. Это соединение оказывает широкий спектр воздействия на здоровье, помимо раздражения кожи и глаз. В краткосрочной перспективе это соединение не вызывает немедленных побочных эффектов, кроме фиолетового, коричневого или черного пятна на коже.
Смешивается ли нитрат серебра с водой?
Нитрат серебра хорошо растворим в воде, но трудно растворим в большинстве органических растворителей, за исключением ацетонитрила (111,8% г/100 г, 25°С).
Является ли серебро гомогенной или гетерогенной смесью?
Кольцо из чистого серебра является элементом, потому что в нем содержится только серебро. Соединения, с другой стороны, содержат более одного типа атомов. Поскольку кольцо из чистого серебра содержит как один, так и два составляющих элемента, его нельзя смешивать с другими компонентами.
Нитрат серебра, растворенный в воде
Нитрат серебра, растворенный в воде, используется для создания химического соединения, которое используется в различных промышленных и химических целях. Соединение нитрата серебра создается путем объединения нитрата серебра с водой. Это химическое соединение используется в различных отраслях промышленности, включая фармацевтическую, косметическую и пищевую промышленность.
Нитрат серебра диссоциирует с образованием хлорида серебра
При растворении нитрата серебра в воде образуется творожистый белый осадок хлорида серебра. Катион серебра диссоциирует от нитрат-аниона, что приводит к растворению катиона серебра. Нитрат серебра диссоциирует с входящими в его состав ионами в воде в результате его диссоциации. Слабое основание нитрата серебра связано с его гидратированной ионной природой, что означает, что это чрезвычайно слабый материал. В результате катионы серебра могут легко отрываться от нитрат-аниона, вызывая образование хлорида серебра.
Растворим ли нитрат серебра в воде
Да, нитрат серебра растворим в воде.
Опасность нитрида серебра
Нитрат серебра, растворимое ионное соединение, легко растворяется в воде благодаря высокой концентрации железа. Когда серебро растворяется в воде, образуются положительно заряженные ионы серебра, которые могут связываться с отрицательно заряженными ионами, такими как галогениды. Когда нитрид серебра растворяется в воде, он растворяется и разлагается. Кроме того, он разлагается на воздухе при комнатной температуре и взрывается при нагревании до 165 градусов Цельсия. Нитрид серебра обладает взрывчатыми и разлагающими свойствами, которые не следует использовать во взрывчатых веществах.
Уравнение баланса нитрата серебра и воды
Нитрат серебра и воду можно комбинировать для создания сбалансированного уравнения. Когда эти два вещества объединяются, они создают химическую реакцию, которая используется для производства металлического серебра. Эта реакция используется в фотографии и других промышленных приложениях.
Эта реакция используется в фотографии и других промышленных приложениях.
Химические свойства нитрата серебра
Нитрат серебра представляет собой белое блестящее соединение с формулой AgNO3. Он растворим в воде и образует стабильный раствор голубого цвета. Нитрат серебра используется в фотографии, как реагент при производстве других соединений серебра и в медицине.
Нитрат серебра представляет собой неорганическое соединение, которое содержится в соединениях, содержащих серебро. Он содержит соединение AgNO3 в своей химической формуле. При взаимодействии серебра с горячей и концентрированной азотной кислотой образуется диоксид азота. В неумелых руках Лунный каустик может нанести существенный вред организму. Алхимики считали, что серебро всегда ассоциировалось с луной. Впервые он был использован в производстве глазных капель в 1881 году. Химическое вещество устраняло бактерии, такие как гонококковые бактерии, из организма, делая их безвредными для глаз.
Кроме того, он используется в лабораториях для количественного анализа галогенидов, тиоцианатов и других соединений. Нитрат серебра добавляют в керамические изделия для изменения цвета. Другой метод создания фотографии — использование другого типа химикатов. Пестициды с нитратом серебра используются в производстве срезанных цветов в качестве активного ингредиента. Очень важно соблюдать осторожность при обращении с этим химическим веществом, поскольку при неправильном обращении оно может привести к повреждению. Для очистки контактной части нитрата серебра необходимо использовать большое количество воды. Это может вызвать судороги и рвоту, а также кровавый понос, головокружение и рвоту.
Это химическое вещество также следует утилизировать надлежащим образом в соответствии с местными нормами и законами. Химия: нитрат серебра – свойства и структура Нитрат серебра представляет собой соединение с многочисленными применениями и свойствами. Вы должны тщательно изучить каждую тему, затронутую в примечаниях, чтобы понять ее. Потратьте время, чтобы попытаться ответить на вопросы в упражнениях учебника и справочниках.
Потратьте время, чтобы попытаться ответить на вопросы в упражнениях учебника и справочниках.
Медицинские преимущества нитрата серебра
Нитрат серебра благодаря своим физическим свойствам является эффективным средством для прижигания, удаления тканей и бородавок. Атом нитрата серебра представляет собой ион металла с отрицательным зарядом, который может образовывать сложные молекулы с другими атомами. Ион металла серебра представляет собой мягкое серебристо-белое твердое вещество с большой площадью поверхности, хорошо растворимое в воде и органических растворителях.
Нитрат серебра растворяется
Когда нитрат серебра растворяется в воде, он распадается на ионы серебра и ионы нитрата. Ионы серебра притягиваются к отрицательным атомам кислорода в молекулах воды, а ионы нитрата притягиваются к положительным атомам водорода. Это создает раствор нитрата серебра в воде.
Опасность нитрида серебра
Нитрат серебра растворяется в воде и образует положительно заряженные ионы серебра, которые могут связываться с другими отрицательно заряженными ионами, такими как галогениды.




 Активно применяется для полного или частичного декорирования изделий из серебра.
Активно применяется для полного или частичного декорирования изделий из серебра. Даже у углерода есть серебряная подкладка: фильтры, пропитанные серебром, обеспечивают дополнительную защиту от бактерий. Водные технологии, июль 1997 г.
Даже у углерода есть серебряная подкладка: фильтры, пропитанные серебром, обеспечивают дополнительную защиту от бактерий. Водные технологии, июль 1997 г. J Biomed Mater Res, 52, 662-668, 2000.
J Biomed Mater Res, 52, 662-668, 2000. Может J Microbiol. 1990 февраль; 36 (2): 109-16.
Может J Microbiol. 1990 февраль; 36 (2): 109-16.
Leave A Comment