Лучший ответ по мнению автора | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||
|
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Посмотреть всех экспертов из раздела Учеба и наука > Химия
| Похожие вопросы |
h3SO4+Ba(OH)2=BaSO4+h3O
Определите стандартную теплоту образования сероуглерода. ..
..
Решено
В сосуде находится смесь водорода…
Надо срочно решить!
Как очистить воду от нефти?
Пользуйтесь нашим приложением
Контрольная работа по химии в 8 классе на тему «Соединения химических элементов»
Соединения химических элементов
Вариант 1
ЧАСТЬ А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1. (2 балла). Ряд формул, в котором все вещества — оксиды:
А. ZnО, ZnС12, Н2O Б. SO3, МgО, СuО. B. KOH, К2O, МgO.
2. (2 балла). Азот проявляет наибольшую степень окисления в соединении с формулой:
А. NH3 Б. NО2 В. N2O5
3. (2 балла). Число формул кислот в следующем списке:
H2СО3, Fе(ОН)2, NаОН, Н2SiО3, Ва(ОН)2, Са(ОН)2, СаО, SO2 равно:
А. 1. Б.2. В.3. Г.4.
1. Б.2. В.3. Г.4.
4. (2 балла). Массовая доля серы в серной кислоте Н2SO4 равна:
А. 2,04%. Б. 65,31%. В. 32,65%.
5. (2 балла). В 80 г воды растворили 20 г соли. Массовая доля соли в полученном растворе равна: А.20%. Б.25%. В.40%.
6. (2 балла). Формула сульфата железа (II):
А .FeS. Б. Fe2 (SО4)3. В. FеSО4
7. (2 балла). Формула кислоты, в которой заряд иона кислотного остатка равен 2-:
А. НСI. Б. Н2SO4 В. Н3PO4
8. (2 балла). Щелочью является вещество с формулой: А. Fе(ОН)2 Б. КОН. В. Сu(ОН)2
9. (6 баллов). Установите соответствие.
Формула соединения:
1. Nа2О. 2. МgSО4. 3. NаОН. 4.НСI. 5.CO2. 6. Н3РO4
Класс соединений:
А. Оксиды. Б. Основания. В. Кислоты. Г. Соли.
10. (4 балла). Соотнесите.
Формула соединения:
1. НNO3. 2. А12O3. 3.Са(ОН)2 4.СаSO4. 5.СаО. 6. Н3РO4. 7. А1(ОН)3. 8. K2SО4.
НNO3. 2. А12O3. 3.Са(ОН)2 4.СаSO4. 5.СаО. 6. Н3РO4. 7. А1(ОН)3. 8. K2SО4.
Название вещества:
А. Оксид кальция. Б. Азотная кислота. В. Гидроксид алюминия. Г. Сульфат калия.
ЧАСТЬ Б. Задания со свободным ответом
11. (6 баллов). Для гидроксидов (кислоты или основания) напишите формулы соответствующих оксидов: А. Н2СO3 Б. Мg(ОН)2. В. А1(ОН)3.
12. (8 баллов). Составьте химические формулы соединений:
А. Оксид калия. Б. Соляная кислота. В. Фосфат кальция. Г. Гидроксид бария.
13. (6 баллов). Рассчитайте объем кислорода, полученного из 200 л воздуха, если известно, что объемная доля кислорода в воздухе составляет 21%
Соединения химических элементов
Вариант 2
ЧАСТЬ А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1. (2 балла). Ряд формул, в котором все вещества — основания
(2 балла). Ряд формул, в котором все вещества — основания
А. СuОН, СuСI2, NаОН.
Б. Са(ОН)2, Мg(ОН)2, МgОНС1.
В. КОН, Ва(ОН)2, Сu(ОН)2.
2.(2 балла). Углерод проявляет наименьшую степень окисления в соединении с формулой:
А. СН4. Б. СО2. В. СО.
3. (2 балла). Число формул солей в следующем списке:
Н 2СO3, Fе(ОН)3, КNО3, NаОН, Ва(ОН)2, СаО, SO2, СаСО3 равно:
А.1. Б.2. В.3. Г.4.
4.(2 балла). Массовая доля алюминия в оксиде алюминия А12O3 равна:
А. 52,94% Б. 0,36%. В. 73,00%.
5.(2 балла). В 180 г воды растворили 20 г NаС1. Массовая доля хлорида натрия в полученном растворе равна:
А.15%. Б.20%. B.10%
6. (2 балла). Формула хлорида меди (II):
А. СuСI. Б. СuСI2. В. СuSO4.
7. (2 балла). Формула кислоты, в которой заряд иона кислотного остатка равен 3-:
(2 балла). Формула кислоты, в которой заряд иона кислотного остатка равен 3-:
А. НСI. Б. Н3РO4 В. Н2SО4.
8. (2 балла). Нерастворимое в воде основание это вещество с формулой:
А. NаОН. Б. Fе(ОН)3. В. Ва(ОН)2.
9. (6 баллов). Соотнесите.
Формула соединения:
1. К2O. 2. СаSO4. 3. Н2SO4 4. КОН. 5.SO2. 6. HNO3.
Класс соединений:
А. Оксиды. Б. Основания. В. Кислоты. Г. Соли.
10. (4 балла). Соотнесите.
Формула соединения:
1. МnCl2. 2. Fе(ОН)2. З. Fе(ОН)3. 4. Н 2SО4. 5. МgCl2. 6. МgO. 7. Мg(ОН)2. 8. Н2SO3.
Название вещества:
А. Оксид магния. Б. Серная кислота. В. Гидроксид железа (III) . Г. Хлорид магния.
ЧАСТЬ В. Задания со свободным ответом
11. (6 баллов). Для гидроксида (кислоты или основания) напишите формулу соответствующего ему оксида:
(6 баллов). Для гидроксида (кислоты или основания) напишите формулу соответствующего ему оксида:
А. Н2SiO3. Б. Са(ОН)2. В. Fе(ОН)3.
12. (8 баллов). Составьте химические формулы соединений:
А. Оксид алюминия. Б. Азотная кислота.
В. Сульфат натрия. Г. Гидроксид цинка.
13. (6 баллов). Рассчитайте объем азота, полученного из 200 л воздуха, если известно, что объемная доля азота в воздухе составляет 78%
Соединения химических элементов
Вариант 3
ЧАСТЬ А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1.(2 балла). Ряд формул, в котором все вещества — кислоты
А. НСI, СаСI2, Н2SO4
Б. НNO3, Н2SO3, Н3PO4
В. NаОН. Н2CO3, Н 2S.
2.(2 балла). Сера проявляет наибольшую степень окисления в соединении, формула которого:
А. Н2S. Б. SO2. В. SО3.
Н2S. Б. SO2. В. SО3.
3.(2 балла) Число формул оксидов в следующем списке:
NаОН, К2O, МgС12, SO2, ВаSО4, OF2, Са(ОН)2, Н2O равно
А.1. Б.2. B.3. Г.4
4. (2 балла). Массовая доля азота в азотной кислоте НNO3 равна:
А. 22,2%. Б. 25,4%. В. 76,2%.
5. (2 балла), В 120 г воды растворили 30 г соли. Массовая доля соли в полученном раствора равна: А. 20%. Б. 25%. В. 30%.
6. (2 балла). Формула сульфата хрома (III):
A.Cr2S3 Б. CrSO4 B. Cr2(SO4)3
7. (2 балла). Кислота, в которой заряд иона кислотного остатка равен 2-, имеет формулу:
А. НВг. Б. НNО3. В. Н2SO3.
8. (2 балла). Нерастворимое в воде основание это вещество с формулой:
А. КОН. Б. Сu(ОН)2 В. Ва(ОН)2
9. (б баллов). Соотнесите.
(б баллов). Соотнесите.
Формула соединения:
1.Н2 SО3. 2.SО3. З. ВаСI2. 4. Са(ОН)2 5. ZnO 6. АI(ОН)3.
Класс соединений:
А. Оксиды. Б. Основания. В. Кислоты Г. Соли.
10.(4 балла). Соотнесите.
Формула соединения:
1. КОН. 2. А12(SO4)3. 3. Н2SО4. 4. Сu(ОН)2. 5. А1(NO3)3. 6. Н3РО4. 7. К2О. 8. СuОН.
Название вещества:
А. Оксид калия. Б. Фосфорная кислота. В. Гидроксид меди (II). Г. Нитрат алюминия.
ЧАСТЬ Б. Задания со свободным ответом
11. (6 баллов). Для гидроксида (кислоты или основания) напишите формулу соответствующего ему оксида:
А. Н2SO4. Б. КОН. В. Сu(ОН)2
12. (8 баллов). Составьте химические формулы соединений:
А. Оксида серебра. Б. Гидроксида цинка. В. Серной кислоты. Г. Хлорида алюминия.
Г. Хлорида алюминия.
13. (6 баллов). Рассчитайте объем газа метана СН4, полученного из 500 л природного газа, если известно, что объемная доля метана в природном газе составляет 95%.
Соединения химических элементов
Вариант 4
ЧАСТЬ А. Тестовые задания с выбором одного правильного ответа и на соотнесение
1. (2 балла). Ряд формул, в котором все вещества — соли:
А. NаС1, ВаSO4, КNО3.
Б. МgSО3, СаО, АIСI3.
В. СаSO4, Nа2СО3, Н 2СO3
2. (2 балла). Фосфор проявляет наименьшую степень окисления в соединении с формулой: A. Р2O5. Б. РH3. В. Р2O3
3. (2 балла). Число формул оснований в следующем списке:
Н2SO3, Fе(ОН)2, К2S, NаОН, MgO, Ва(ОН)2, SО2, СаСО3 равно:
А. 1. Б.2. В.3. Г.4.
1. Б.2. В.3. Г.4.
4. (2 балла). Массовая доля кислорода в карбонате кальция СаСО3 равна:
А.1б%. Б.48%. В.52%.
5. (2 балла). В 450 г воды растворили 50 г соли. Массовая доля соли в полученном растворе:
А.9%. Б.10%. В.11%.
6. (2 балла). Формула нитрата железа (II):
А. Fе(NО3)2. Б. Fе(NО3)3. В. Fе3N2.
7. (2 балла). Кислота, в которой заряд нона кислотного остатка равен 1-, имеет формулу:
А. HF. Б. Н 3РO4. В. Н2СO3.
8. (2 балла). Щелочью является вещество с формулой:
А. Ва(ОН)2. Б. Fе(ОН)3. В. А1(ОН)3
9. (6 баллов). Соотнесите.
Формула соединения:
1. Н 2СO3. 2. Мg(ОН)2 3. ZnС12. 4. АIСI3. 5. MgO. 6. H2O.
Класс соединений:
А. Оксиды. Б. Основания. В. Кислоты. Г. Соли.
В. Кислоты. Г. Соли.
10. (4 балла). Соотнесите.
Формула соединения:
1. Н2SO4. 2. СuSO4. 3. ВаSO3. 4. ВаО. 5. ВаSO4 6. Мg(ОН)2 7. Н2SO3. 8. Ва(ОН)2.
Название вещества:
А. Оксид бария. Б. Сернистая кислота. В. Гидроксид магния. Г. Сульфат бария.
ЧАСТЬ Б. Задания со свободным ответом
11. (6 баллов). Для гидроксида (кислоты или основания) напишите формулу соответствующего ему оксида:
А. Н2SO3. Б. NаОН. В. Fе(ОН)2.
12. (8 баллов). Составьте формулы химических соединений:
А. Гидроксида алюминия. Б. Оксида меди (I).
В. Сульфата цинка. Г. Фосфорной кислоты.
13. (6 баллов). Рассчитайте объем кислорода, полученного из 1 м3 воздуха, если известно, что объемная доля кислорода в воздухе составляет 21%
Материал в конце главы
Проблемы с применением
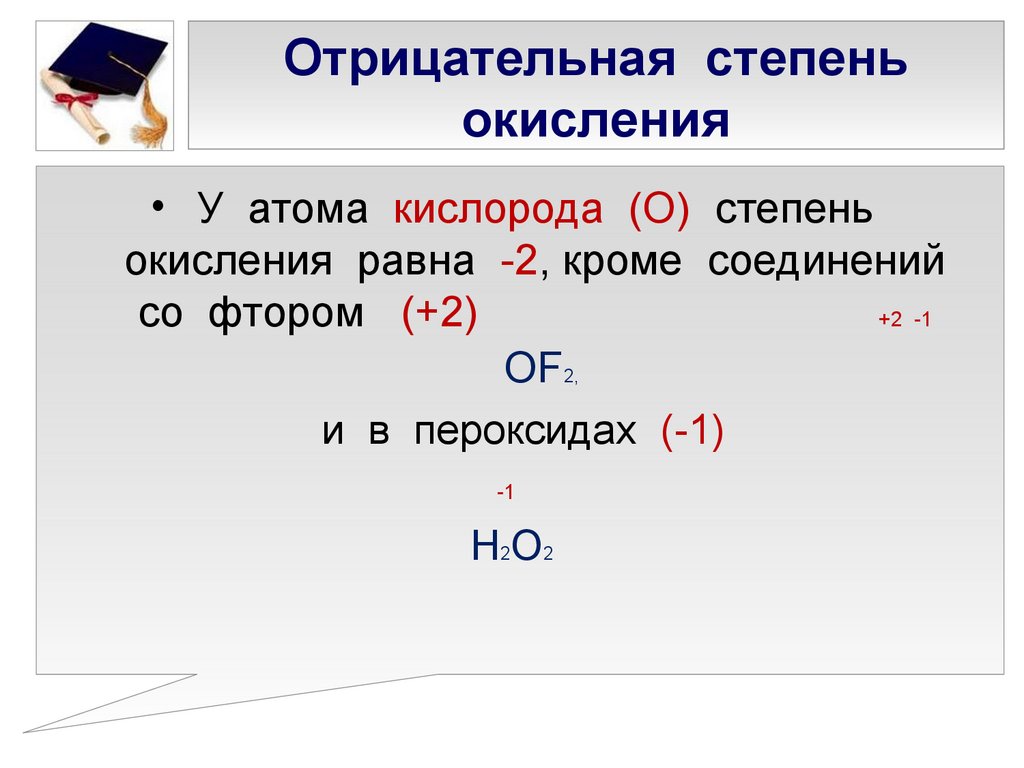
♦ Большинство растений, животных и бактерий используют кислород в качестве конечного окислителя в процессе дыхания. Однако в некоторых местах целые экосистемы развились в отсутствие кислорода и содержат существ, которые могут использовать соединения серы вместо кислорода. Перечислите распространенные степени окисления серы, приведите примеры любых оксоанионов, содержащих серу в этих степенях окисления, и назовите ионы. Какой ион будет лучшим окислителем?
- Титан
в настоящее время используется в авиационной промышленности и в настоящее время используется на кораблях, которые работают в высококоррозионной среде. Интерес к этому металлу обусловлен тем, что титан прочен, легок и устойчив к коррозии. Плотности выбранных элементов приведены в следующей таблице. Почему элемент с еще более низкой плотностью, такой как кальций, нельзя использовать для производства еще более легкого конструкционного материала?
Элемент Плотность (г/см 3 ) Элемент Плотность (г/см 3 ) К 0,865 Кр  140
140Ca 1,550 Мн 7.470 Sc 2,985 Фе 7,874 Ти Ко 8.900 В 6.110 Ni 8.908 ♦ Соединение Fe 3 O 4 в древние времена называли магнитным камнем, потому что он реагирует на магнитное поле Земли и может быть использован для создания примитивного компаса.

♦ Понимание тенденций в периодических свойствах позволяет нам предсказывать свойства отдельных элементов. Например, если нам нужно знать, является ли франций жидкостью при комнатной температуре (приблизительно 20°C), мы могли бы получить эту информацию, нанеся на график зависимости температур плавления других щелочных металлов от атомного номера. Основываясь на данных в следующей таблице, можете ли вы предположить, что франций будет твердым, жидким или газообразным при 20°C?
Ли На К руб цезий Температура плавления (°C) 180 97,8 63,7 39,0 28,5 Франций содержится в мельчайших следах в урановых рудах.
 Это согласуется с вашим выводом? Почему или почему нет? Почему в этих рудах можно найти франций, но только в небольших количествах?
Это согласуется с вашим выводом? Почему или почему нет? Почему в этих рудах можно найти франций, но только в небольших количествах?
Проблемы, отмеченные знаком ♦, связаны с несколькими понятиями.
Ответы
Из-за своей электронной конфигурации 3 s 2 3 p 4 сера имеет три общие степени окисления: +6, +4 и -2. Примерами каждого из них являются: -2 степень окисления, анион сульфида, S 2- или сероводород, H 2 S; степень окисления +4, сульфит-ион, SO 3 2− ; степень окисления +6, сульфат-ион, SO 4 2− . Сульфат-ион был бы лучшим биологическим окислителем, потому что он может принять наибольшее количество электронов.
Железо(II) имеет четыре неспаренных электрона, а железо(III) – пять неспаренных электронов. Соединения Zn 2+ не проявляют магнитного поведения, поскольку ион Zn 2+ не имеет неспаренных электронов.
 Третий потенциал ионизации цинка больше, чем у железа, так как удаление третьего электрона у цинка требует взлома замкнутого 3 d 10 9подоболочка 0024.
Третий потенциал ионизации цинка больше, чем у железа, так как удаление третьего электрона у цинка требует взлома замкнутого 3 d 10 9подоболочка 0024.
Какая степень окисления у серы?
Ответ
Проверено
190,2 тыс.+ просмотров
Подсказка: Для ответа на этот вопрос нам нужно знать степень окисления атома. Степень окисления серы зависит от образовавшегося соединения. Поскольку Sulphur больше по размеру, у него есть пустая $d$-орбиталь, благодаря которой он может расширять свои валентности. Таким образом, он проявляет степени окисления $-2$, $+2$, $+4$ и $+6$ соответственно. 9{2 — }$ ион равен $ + 6$ .
Сера имеет различные степени окисления из-за своего большего размера. Сера имеет пустую $d$-орбиталь, которую можно использовать для связывания, и они могут образовывать четыре или шесть связей с помощью неспаренных электронов.
Атом S в основном состоянии:
Таким образом, два неспаренных электрона могут образовывать две связи и четыре электронные пары.
Возбужденное состояние:
Таким образом, четыре неспаренных электрона могут образовывать четыре связи и пять электронных пар.
Дальнейшее возбужденное состояние:
Таким образом, шесть неспаренных электронов могут образовывать шесть связей и шесть электронных пар. 9{2 — }$
Степень окисления $O$ $-2$. Итак, степень окисления S равна:
$x + 4 \times ( — 2) = — 2$
$ \Rightarrow x — 8 = — 2$
$ \Rightarrow x = + 6$
2.In ${ H_2}S{O_3}$ , пусть $x$ — степень окисления $S$ в ${H_2}S{O_3}$
Степень окисления $O$ $ — 2$, для водорода $ + 1 $ . Итак, степень окисления S равна:
$2 \times 1 + x + 3 \times ( — 2) = 0$
$ \Rightarrow 2 + x — 6 = 0$
$ \Rightarrow x = + 4$
Примечание:
Соединения серы обычно четырехвалентны.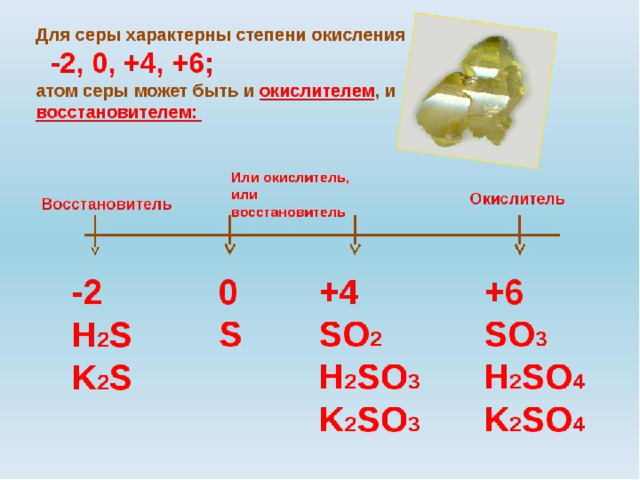

 03.14
03.14 140
140
 Это согласуется с вашим выводом? Почему или почему нет? Почему в этих рудах можно найти франций, но только в небольших количествах?
Это согласуется с вашим выводом? Почему или почему нет? Почему в этих рудах можно найти франций, но только в небольших количествах? Третий потенциал ионизации цинка больше, чем у железа, так как удаление третьего электрона у цинка требует взлома замкнутого 3 d 10 9подоболочка 0024.
Третий потенциал ионизации цинка больше, чем у железа, так как удаление третьего электрона у цинка требует взлома замкнутого 3 d 10 9подоболочка 0024.
Leave A Comment