Химия — 9
Химические свойства. Серная кислота, наряду с общими свойствами кислот, обладает и специфическими свойствами.
I. Химические свойства разбавленной серной кислоты. Как сильная двухосновная кислота, серная кислота в водном растворе диссоциирует в две ступени:
Металлы, расположенные в электрохимическом ряду металлов до водорода, из разбавленной серной кислоты вытесняют водород. (В этих реакциях роль окислителя играют ионы водорода – Н+). Металлы (Cu, Hg, Ag, Au), расположенные справа от водорода, с разбавленной кислотой не реагируют. Серная кислота взаимодействует с основаниями, основными и амфотерными оксидами, солями и аммиаком.
Серная кислота и ее соли с растворимыми солями бария образуют нерастворимый в воде и кислотах
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
Химические свойства концентрированной серной кислоты.
Эта реакция, характерная для серной кислоты и ее солей, используется для определения ионов SO42– в растворе.
II. Химические свойства концентрированной серной кислоты.
Специфические свойства
A) Окислительные свойства. Концентрированная серная кислота – сильный
окислитель. При нагревании она реагирует со многими металлами (исключение
– Au, Pt и некоторые другие металлы). В этих реакциях роль окислителя играет
не ион H+, а сера со степенью окисления +6 (ион SO42–). Поэтому при взаимодействии металлов с концентрированной серной кислотой водород не выделяется.
При взаимодействии концентрированной серной кислоты с активными металлами (Li, Na, K, Ca, Sr, Ba) выделяется H2S, а с металлами – Cu, Hg, Ag – сернистый газ SO2. Во втором случае реакция протекает при нагревании:
В реакциях с другими металлами серная кислота, в зависимости от своей концентрации, активности металла и температуры, восстанавливается до SO2, S и H2S.
При обычных условиях концентрированная серная кислота не действует на
железо, хром, алюминий и никель; она
Свинец с концентрированной серной кислотой реагирует с выделением SO2
и образованием кислой соли Pb(HSO4)2 (при нагревании).
B) Дегидратирующее (водоотнимающее) свойство.
H2SO4 + nH2O → H2SO4 · nH2O + Q
реакции разбавленного и концентрированного соединения
Химия
12.11.21
9 мин.
Серная кислота — самая известная из всех существующих. Известна ее опасность: растворяет она все едва ли не мгновенно, стоит только к ней подойти, и даже стоять рядом с этим реагентом нельзя. Отчасти все это правда, но взаимодействие серной кислоты с металлами, неметаллами, водой и прочими соединениями подчинено определенным «правилам». К тому же это вещество находит свое применение и в повседневной жизни.
Оглавление:
- Описание соединения
- Химические характеристики
- Получение и применение
Описание соединения
Серная кислота (формула h3SO4) — вещество, отвечающее максимальной степени окисления серы +6. Ей соответствует оксид SO3, который сам по себе является нестойким, и при присоединении воды образует указанное вещество.
Ей соответствует оксид SO3, который сам по себе является нестойким, и при присоединении воды образует указанное вещество.
Безводная h3SO4 — жидкость, тяжелее воды, маслянистая на вид, не имеющая цвета, затвердевающая при температуре 10,4°C. Она очень гигроскопична (сильно поглощает влагу из воздуха), жадно соединяется с водой, причем может отнимать даже ту, что находится в химически связанном состоянии, поэтому вещество быстро обугливает сахар и бумагу. Все эти свойства более сильно выражены у олеума (раствор серного ангидрида SO3 в концентрированной h3SO4).
При химических опытах, в которых участвует серная кислота, обязательно соблюдать последовательность: наливать в воду кислоту, но не наоборот. В противном случае вода моментально разогреется (иногда сразу до кипения) и произойдет выброс едкого вещества.
Примечание: у химиков есть особая «поговорка», которая не позволит забыть правильную последовательность. Звучит она так: «Сначала вода, потом — кислота. А если ты спутаешь, будет беда».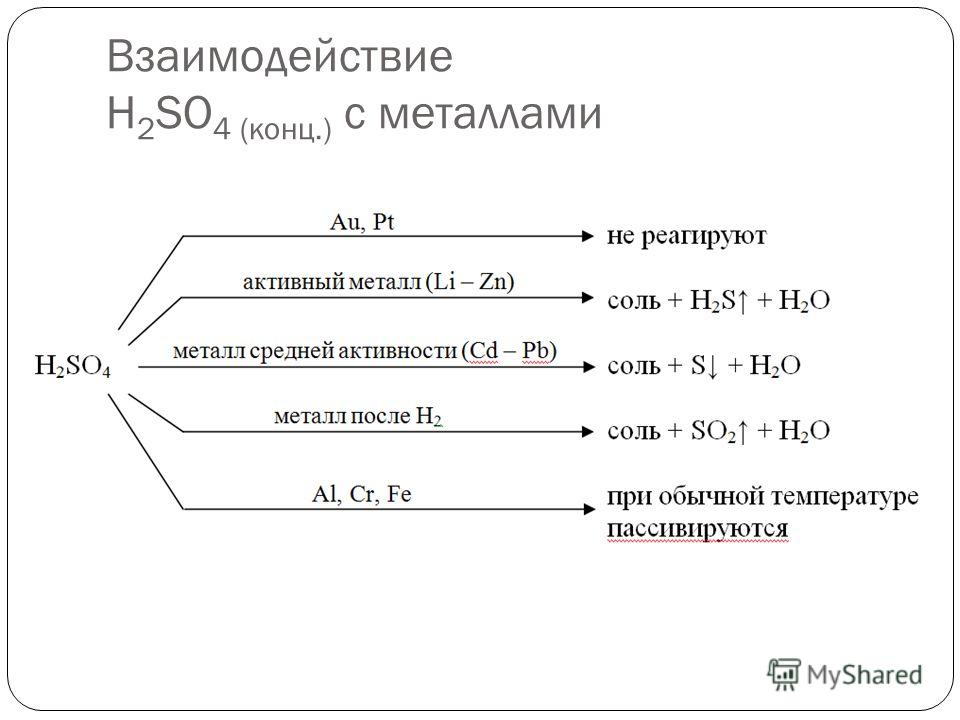
При нагревании концентрированной (100%) выше 300 °C она частично разлагается, при этом выделяется сернистый ангидрид (SO2). Раствор, содержащий 98,3% h3SO4, имеющий плотность 1,841 г/см3, перегоняется без разложения при t=336,5°C.
Химические характеристики
С точки зрения химии — это сильная двухосновная кислота, поэтому может образовывать 2 вида солей: кислые — гидросульфаты и средние — сульфаты. Для h3SO4 характерны все свойства, присущие сильным кислотным соединениям. В разбавленном состоянии она реагирует с основными оксидами, основаниями и солями. В ней растворяются металлы, находящиеся в ряду напряжений левее водорода (то есть в реакции не будут вступать только медь, ртуть, палладий, платина, золото, сурьма, висмут, серебро).
- Свинец.
- Олово;
- Никель;
- Кобальт;
- Кадмий.

- Железо.
- Цинк.
- Хром и прочие.
При взаимодействии образуются сульфаты и выделяется водород (газообразный) или вода — все будет зависеть от концентрации серной кислоты: Zn + h3SO4 (разб.) → ZnSO4 + h3; 4h3SO4 + 3Zn → 3ZnSO4 + 4h3O + S.
При растворении металлов, имеющих несколько степеней окисления, образуются сульфаты металлов с низшей степенью окисления: Sn + h3SO4 → SnSO4 + h3. Концентрированная серная кислота по своим свойствам резко отличается от разбавленной. Она почти не диссоциирует, не взаимодействует с железом без нагревания (пассивирует его): 2Fe + 6h3SO4 (к) → Fe2 (SO4)3 + 3SO2 + 6h3O. Это дает возможность перевозить и хранить это вещество в стальных цистернах.
Пассивация —переход поверхности металла в неактивное состояние. Процесс применяют в промышленности, чтобы защитить металлические детали от коррозии.
Аналогично будут протекать процессы и с участием металлического Cr (хром) и Al (алюминий). Здесь также потребуется нагревание. Реакции можно записать так:
Здесь также потребуется нагревание. Реакции можно записать так:
- 2Cr + 6h3SO4 (к) → Cr2 (SO4)3 + 3SO2 + 6h3O.
- 2Al + 6h3SO4 (к) → Al2 (SO4)3 + 6h3O + 3SO2.
Неметаллы реагируют с серной кислотой почти по аналогичному принципу: они окисляются до высшей степени окисления, образуя сульфаты. Побочным продуктом процесса будет выделение воды и SO2 (оксид серы с валентностью 4, другое название — сернистый ангидрид):
- S + 2h3SO4 → 3SO2 + 2h3O.
Неактивные металлы с разбавленной серной кислотой не взаимодействуют. В концентрированном виде это соединение — сильный окислитель, способное вступать в реакцию с некоторыми металлами, находящимися в ряду напряжений справа от водорода (например, Cu, Ag, Hg), и многими неметаллами, например, с углеродом: C + h3SO4 (к., горячая) → CO2 + 2SO2 + 2h3O.
Получение и применение
Существует 2 промышленных способа получения соединения: контактный и нитрозный.
- 2SO2 + O2 → 2SO3 — каталитический процесс, в качестве вещества, ускоряющего реакцию, используются оксид ванадия V2O5.
- SO3 + h3O → h3SO4.
Второй способ — нитрозный (другое название башенный) заключается в окислении сернистого газа оксидами азота. Процесс происходит по реакциям:
- SO2 + h3O → h3SO3 (сернистая кислота).
- 2NO + O2 → 2NO2 (двуокись азота).
- h3SO3 + NO2 → h3SO4 + NO.
Концентрация получаемого вещества при таком способе достигает 78%. Часто именно этот продукт называют аккумуляторным: его используют для заливки свинцовых аккумуляторов. Правда, перед использованием разбавляют дистиллированной водой до 30−40%.
h3SO4 находит широкое применение:
- Получение других кислот (азотной, плавиковой, соляной, фосфорной), сульфатов, простых и сложных эфиров.
- Органический синтез: в качестве дегидратирующего агента при получении сложных эфиров, этоксиэтана, в процессах алкилирования, сульфирования, восстановления смол при производстве дистиллированной воды.
- Очистка газов (осушающий агент).
- Производство красителей, взрывчатки.
- Пищевая промышленность — в качестве эмульгатора E513.
- Обработка руд, особенно при добыче редких элементов, включая уран, цирконий, иридий, осмий.
- Нефтяная промышленность, текстильная, кожевенная.
- Металлообрабатывающая индустрия и прочие.
youtube.com/embed/oYPTLs4d6pg» allowfullscreen=»allowfullscreen»>Однако наибольший потребитель этого соединения — отрасль производства минеральных удобрений — азотные, фосфорные, поэтому заводы по их изготовлению обычно находятся вблизи с сернокислотными предприятиями.
неорганическая химия — Почему горячая концентрированная серная кислота предпочтительнее холодной?
спросил
Изменено 1 год, 2 месяца назад
Просмотрено 17 тысяч раз
$\begingroup$
Почему для реакции с металлами иногда используют горячую концентрированную серную кислоту вместо концентрированной серной кислоты комнатной температуры?
Я установил, что концентрированная серная кислота обладает довольно сильными окислительными свойствами. Тем не менее, некоторые металлы, находящиеся ниже водорода в электрохимическом ряду, не реагируют с концентрированной серной кислотой, хранящейся при комнатной температуре. Когда кислота теплая/горячая, происходит реакция.
Когда кислота теплая/горячая, происходит реакция.
Все, что я хочу знать, это как температура влияет на его окислительные свойства?
- неорганическая химия
- кислотно-основная
- окислительно-восстановительная
$\endgroup$
$\begingroup$
Очень короткий ответ — кинетика. Нагрев химических веществ добавляет в систему больше энергии, позволяя молекулам сталкиваться с большей силой, увеличивая вероятность протекания реакции.
$\endgroup$
$\begingroup$
Во-первых, эти металлы не вступают в реакцию с концентрированной серной кислотой, а образуют защитные слои, будь то сульфат или оксид, которые снижают скорость реакции (кинетику).
Эффект нагревания серной кислоты зависит от металла (например, сталь пригодна для 60-95% серной кислоты до 25°C), но существует транспассивная область, где металлы, такие как железо, больше не имеют защитного слоя. Это происходит из-за нестабильности оксидно-сульфатного слоя, поэтому он растворяется или отваливается.
Это происходит из-за нестабильности оксидно-сульфатного слоя, поэтому он растворяется или отваливается.
$\endgroup$
$\begingroup$
Когда мы говорим, что металл находится ниже водорода в электрохимическом ряду, мы обычно имеем в виду окислительную способность иона водорода при 1 молярной концентрации в водном растворе. Окислительная способность концентрированной серной кислоты, образующей при реакции двуокись серы и воду, может быть выше, чем у водных ионов водорода; если это так, то термодинамически некоторые благородные металлы могут реагировать с концентрированной серной кислотой. Тогда это вопрос кинетики: заставить окислительно-восстановительную реакцию протекать достаточно быстро и добиться достаточной растворимости любых пассивирующих пленок, которые могут образоваться, и именно здесь вступает в действие нагрев кислоты.0005
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.


Leave A Comment