Опыты по химии. Железо | Подготовка к ЦТ и ЕГЭ по химии
Чтобы поделиться, нажимайте
Взаимодействие железа с концентрированными кислотами
Безводная серная и азотная кислоты пассивируют железо, не реагируют с ним. Однако концентрированные растворы этих кислот растворяют железо. Приготовим две колбы с кусочками железа. Концентрированная азотная кислота бурно реагирует с железом. Продукты реакции – нитрат железа (III) и бурый газ – диоксид азота (IV).
Fe + 6HNO3 = Fe(NO3)3 + 3NO2↑ + 3H2O
Концентрированная серная кислота тоже реагирует с железом. Выделяется сернистый газ.
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO
И в том, и в другом случае происходит окисление железа до степени окисления +III. Даже небольшие количества воды, содержащиеся в концентрированных кислотах, сильно влияют на их свойства. Концентрированные и безводные кислоты – не одно и то же.
Даже небольшие количества воды, содержащиеся в концентрированных кислотах, сильно влияют на их свойства. Концентрированные и безводные кислоты – не одно и то же.
Оборудование: колбы, пинцет.
Техника безопасности. Соблюдать правила работы с концентрированными кислотами. Опыт проводится под тягой, так как выделяются ядовитые оксиды азота и оксид серы.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Качественные реакции на железо (II)
Как определить в растворе ионы железа (II)? Возьмем для опытов сульфат железа (II).
- Качественная реакция на ион железа (II) – реакция с красной кровяной солью.
Добавим красную кровяную соль ‑ гексацианоферрат калия K3[Fe(CN)6]. (Для определения железа (III) используют желтую кровяную соль K4[Fe(CN)6
(Для определения железа (III) используют желтую кровяную соль K4[Fe(CN)6
Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II).
2 К3[Fe(CN)6 ] +3 Fe SO4 = KFe[Fe(CN)6])↓ + 3K2SO4
Турнбуллева синь очень похожа по свойствам на берлинскую лазурь и тоже служила красителем. Названа по имени одного из основателей шотландской фирмы по производству красителей «Артур и Турнбуль».
- Качественная реакция на ион железа (
Реакция со щелочью – еще один способ обнаружения ионов железа (II). Гидроксид железа (II) Fe(OH)2 — серо-зеленого цвета, гидроксид железа (III) Fe(OH)3 — бурый. Добавим щелочь (NaOH) в колбу с солью железа — образуется серо-зеленый осадок. Значит, в растворе присутствуют ионы железа (II). Образовавшийся осадок – гидроксид железа (II) Fe(OH)2.
Добавим щелочь (NaOH) в колбу с солью железа — образуется серо-зеленый осадок. Значит, в растворе присутствуют ионы железа (II). Образовавшийся осадок – гидроксид железа (II) Fe(OH)2.
Fe SO4 +2 NaOH = Fe(OH)2 ↓ + Na2 SO4
Оборудование:
Техника безопасности. Соблюдать правила обращения с растворами щелочей и растворами гексацианоферратов. Не допускать контакта растворов гексацианоферратов с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Качественные реакции на железо (III)
Ионы железа (III) в растворе можно определить с помощью качественных реакций. Проведем некоторые из них. Возьмем для опыта раствор хлорида железа (III).
- Качественная реакция на ион железа (III)– реакция со щелочью.
Если в растворе есть ионы железа (III), образуется гидроксид железа (III) Fe(OH)3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа (II) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа (III).
- Качественная реакция на ион железа (III) – реакция с желтой кровяной солью.
Желтая кровяная соль – это гексацианоферрат калия K4[Fe(CN)6
3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 KCl
- Качественная реакция на ион железа (III) – реакция с роданидом калия.

Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа (III) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа (III). Роданид от греческого «родеос» — красный.
FeCl3 + 3 КCNS = Fe(CNS)3 + 3 KCl
Берлинская лазурь была получена случайно в начале 18 века в Берлине красильных дел мастером Дисбахом. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей: яркой, устойчивой и недорогой. Вскоре стал известен и рецепт получения краски: поташ сплавляли с высушенной кровью животных и железными опилками. Выщелачиванием такого сплава получали желтую кровяную соль.
Оборудование:
Техника безопасности. Соблюдать правила обращения с растворами щелочей и растворами гексацианоферратов. Не допускать контакта растворов гексацианоферратов с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение гидроксида железа (II) и взаимодействие его с кислотами
Получим гидроксид железа (II) Fe(OH)2. Для этого воспользуемся реакцией растворимой соли железа (II) со щелочью: соединим сульфат железа (II) и гидроксид калия.
FeSO4 + 2KOH = Fe(OH)2↓ + K2SO4
Образуется серо-зеленый осадок гидроксида железа (II).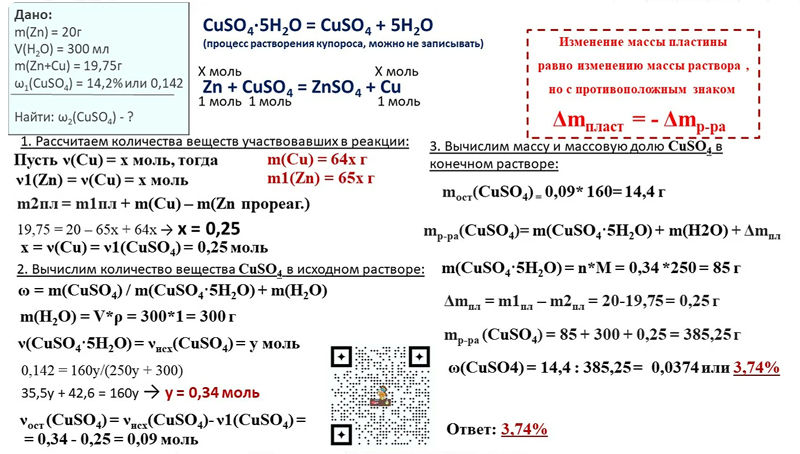 Вспомним, что гидроксид железа (III) – бурый. По цвету получаемого осадка гидроксида различают соли железа (II) и железа (III). Как подействует кислота на серо-зеленый осадок гидроксида? Добавляем раствор соляной кислоты.
Вспомним, что гидроксид железа (III) – бурый. По цвету получаемого осадка гидроксида различают соли железа (II) и железа (III). Как подействует кислота на серо-зеленый осадок гидроксида? Добавляем раствор соляной кислоты.
Fe(OH)2 + 2HCl = FeCl2 + 2H2O
Осадок гидроксида растворяется. Образуется раствор хлорида железа (II).
Оборудование: колба, пипетка.
Техника безопасности. Соблюдать правила обращения с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение гидроксида железа (III) и взаимодействие его с кислотами
Получим гидроксид железа (III) Fe(OH)3 взаимодействием растворов хлорида железа (III) FeCl3 и гидроксида калия KOH. Это обычный способ получения нерастворимых оснований – реакция обмена растворимой соли и щелочи.
Это обычный способ получения нерастворимых оснований – реакция обмена растворимой соли и щелочи.
FeCl3 + 3KOH = Fe(OH)3 ↓+ 3KCl
Выпадает бурый осадок. Это гидроксид железа (III). Как гидроксид реагирует с кислотами? Добавим раствор соляной кислоты.
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Осадок гидроксида железа растворяется, образуется желтый раствор хлорида железа (III). Реакции обмена с кислотами могут превращать нерастворимые основания в растворимые соли.
Оборудование: колба, пипетка.
Техника безопасности.
Соблюдать правила обращения с растворами кислот и щелочей. Избегать попадания кислот и щелочей на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Получение железа алюминотермией
Алюминий используется для получения некоторых металлов. Этот метод называется алюминотермией. Метод основан на том, что порошкообразный алюминий при воспламенении восстанавливает оксиды многих металлов. При этом образуется очень чистый, свободный от углерода металл. Получим железо способом алюминотермии. Смесь порошкообразного алюминия и оксидов железа называется термитом. Приготовим термит и подожжем его. При горении термита алюминий восстанавливает железо из его оксида.
Fe2O3 + 2 AI = AI2O3 + 2 Fe
После окончания реакции извлечем железо. Оно образуется на дне тигля в виде отдельных застывших капель. Металл притягивается к магниту.
Оно образуется на дне тигля в виде отдельных застывших капель. Металл притягивается к магниту.
Оборудование: тигель, ступка, металлическая чашка с песком, щипцы, пробирка, фильтровальная бумага, магнит.
Техника безопасности. Соблюдать правила пожарной безопасности и правила безопасности при работе с нагревательными приборами.
Постановка опыта и текст – к.п.н. Павел Беспалов.
Роль кислорода в процессе коррозии железа
Коррозия – это разрушение металлов под действием кислорода и воды. Попробуем установить зависимость степени коррозии железа от степени аэрации – то есть от доступа кислорода к поверхности металла. Опустим в пробирки железные гвозди и добавим воды: в первую пробирку – до половины, во вторую и в третью – до верха. В третью пробирку нальем слой растительного масла. Сплошной слой масла блокирует поступление кислорода в толщу воды. Посмотрим, что произошло с гвоздями через некоторое время. Больше всего ржавчины оказалось на гвозде из первой пробирки, этот гвоздь соприкасался и с водой, и с воздухом. Доступ кислорода к поверхности металла был свободным. На гвозде из второй пробирки коррозии меньше, так как железо взаимодействовало только с небольшим количеством растворенного в воде кислорода. Гвоздь из третьей пробирки почти не поржавел. Кислород не мог пройти через слой растительного масла, а без кислорода коррозия не развивается.
Сплошной слой масла блокирует поступление кислорода в толщу воды. Посмотрим, что произошло с гвоздями через некоторое время. Больше всего ржавчины оказалось на гвозде из первой пробирки, этот гвоздь соприкасался и с водой, и с воздухом. Доступ кислорода к поверхности металла был свободным. На гвозде из второй пробирки коррозии меньше, так как железо взаимодействовало только с небольшим количеством растворенного в воде кислорода. Гвоздь из третьей пробирки почти не поржавел. Кислород не мог пройти через слой растительного масла, а без кислорода коррозия не развивается.
4 Fe + 6H2O + 3O2 = 4 Fe(OH)3
Оборудование: пробирки, штатив для пробирок.
Техника безопасности. Опыт не опасен.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Тренажер задания 31 ЕГЭ по химии железа
Тренажер задания 31 из ЕГЭ по химии железа, задачи на неорганическую химию (мысленный эксперимент) из экзамена ЕГЭ по химии, задания 31 по химии железа с текстовыми решениями и ответами.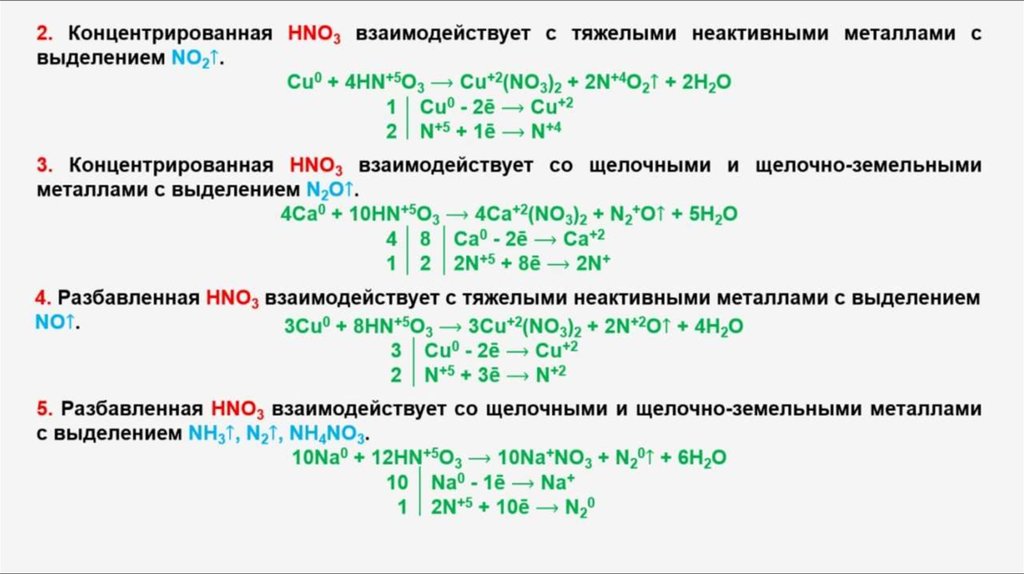
1. Соль, полученную при растворении железа в концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом. Напишите уравнения описанных реакций.
2. Осадок, полученный при взаимодействии хлорида железа (III) и нитрата серебра отфильтровали. Фильтрат обработали раствором едкого кали. Выпавший осадок бурого цвета отделили и прокалили. Полученное вещество при нагревании реагирует с алюминием с выделением тепла и света. Напишите уравнения описанных реакций.
3. Газ, выделившийся при взаимодействии хлористого водорода с перманганатом калия, реагирует с железом. Продукт реакции растворили в воде и добавили к нему сульфид натрия. Более легкое из образовавшихся нерастворимых веществ отделили и ввели в реакцию с горячей концентрированной азотной кислотой. Напишите уравнения описанных реакций.
4. Зловонную жидкость, образовавшуюся при взаимодействии бромистого водорода с перманганатом калия, отделили и нагрели с железной стружкой. Продукт реакции растворили в воде и добавили к нему раствор гидроксида цезия. Образовавшийся осадок отфильтровали и прокалили. Напишите уравнения описанных реакций.
5. Простое вещество, полученное при нагревании железной окалины в токе угарного газа, сплавили с серой, и продукт этой реакции подвергли обжигу. Образовавшийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
6. Раствор хлорида железа (III) обработали избытком раствора гидроксида калия. Осадок бурого цвета, образовавшийся в качестве продукта реакции, отфильтровали и прокалили. Вещество, образовавшееся при прокаливании, растворили в концентрированной азотной кислоте. Полученную соль обработали раствором гидрокарбоната калия. Напишите уравнения описанных реакций.
7. На раствор хлорного железа подействовали раствором едкого натра, выпавший осадок отделили и нагрели. Твердый продукт реакции смешали с кальцинированной содой и прокалили. К оставшемуся веществу добавили нитрат и гидроксид натрия, и длительное время нагревали при высокой температуре. Напишите уравнения описанных реакций.
8. Оксид двухвалентного железа нагрели с разбавленной азотной кислотой. Раствор осторожно выпарили, твердый остаток растворили в воде, в полученный раствор внесли железный порошок и через некоторое время профильтровали. К фильтрату добавили раствор едкого кали, выпавший осадок отделили и оставили на воздухе, при этом цвет вещества изменился. Напишите уравнения описанных реакций.
9. Хлористое железо обработали при нагревании концентрированной азотной кислотой и раствор осторожно выпарили. Твердый продукт растворили в воде, добавили к полученному раствору поташ и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании газообразный водород. При этом образовалось вещество бурого цвета. Напишите уравнения описанных реакций.
Над полученным веществом пропустили при нагревании газообразный водород. При этом образовалось вещество бурого цвета. Напишите уравнения описанных реакций.
10. К раствору хлорного железа добавили кальцинированную соду и выпавший осадок отделили и прокалили. Над полученным веществом пропустили при нагревании угарный газ и твердый продукт последней реакции ввели во взаимодействие с бромом. Напишите уравнения описанных реакций.
11. Железную окалину растворили в концентрированной азотной кислоте при нагревании. Раствор осторожно выпарили, и продукт реакции растворили в воде. К полученному раствору добавили железный порошок, через некоторое время раствор отфильтровали, и фильтрат обработали раствором едкого кали, в результате выделился осадок светло-зеленого цвета, который быстро темнеет на воздухе. Напишите уравнения описанных реакций.
12. К раствору хлорного железа добавили железный порошок и через некоторое время раствор профильтровали. К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
К фильтрату добавили гидроксид натрия, выделившийся осадок отделили и обработали перекисью водорода. К полученному веществу добавили избыток раствора едкого кали и бром; в результате протекания реакции окраска брома исчезла. Напишите уравнения описанных реакций.
13. Нерастворимое вещество, образующееся при добавлении в раствор хлористого железа едкого натра, отделили и растворили в разбавленной серной кислоте. В полученный раствор добавили цинковую пыль, выделившийся осадок отфильтровали и растворили в концентрированной соляной кислоте. Напишите уравнения описанных реакций.
14. Железный порошок растворили в большом количестве разбавленной серной кислоты и через полученный раствор пропустили воздух, а затем газ с запахом тухлых яиц. Образовавшуюся нерастворимую соль отделили и растворили в горячем растворе концентрированной азотной кислоты. Напишите уравнения описанных реакций.
15. Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щелочью образуется объемный осадок белого (светло-зеленого) цвета. При обжиге вещества А образуются два оксида. Один из них – газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
Неизвестное вещество А растворяется в концентрированной соляной кислоте, процесс растворения сопровождается выделением газа с запахом тухлых яиц; после нейтрализации раствора щелочью образуется объемный осадок белого (светло-зеленого) цвета. При обжиге вещества А образуются два оксида. Один из них – газ, имеющий характерный резкий запах и обесцвечивающий бромную воду с образованием в растворе двух сильных кислот. Напишите уравнения описанных реакций.
16. Серебристо-серый металл, который притягивается магнитом, внесли в горячую концентрированную серную кислоту и нагрели. Раствор охладили и добавили едкий натр до прекращения образования аморфного осадка бурого цвета. Осадок отделили, прокалили и растворили в концентрированной соляной кислоте при нагревании. Напишите уравнения описанных реакций.
17. Вещество, полученное при нагревании железной окалины в атмосфере водорода, внесли в горячую концентрированную кислоту и нагрели.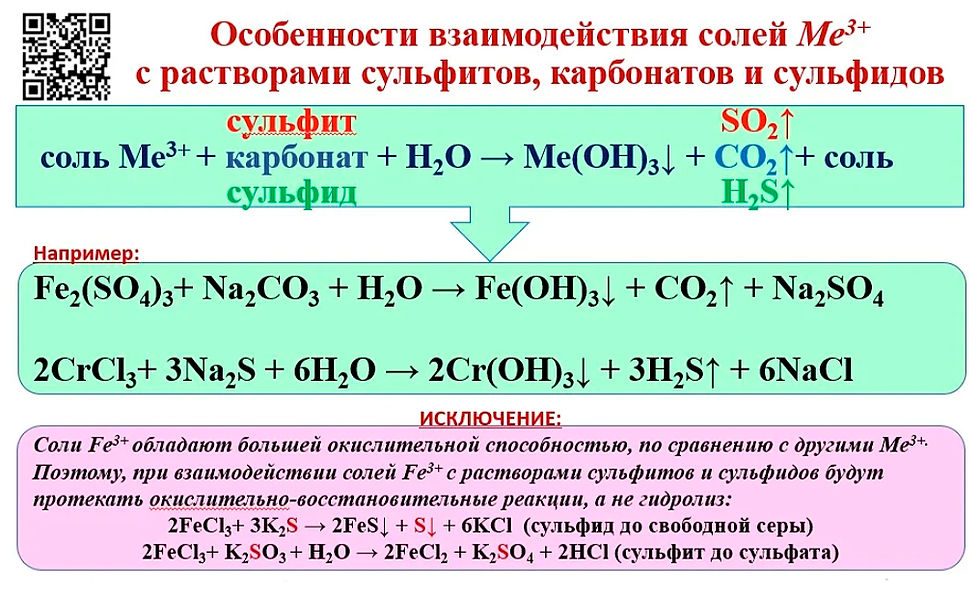 Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
Полученный раствор выпарили, остаток растворили в воде и обработали раствором хлорида бария. Раствор профильтровали и в фильтрат внесли медную пластинку, которая через некоторое время растворилась. Напишите уравнения описанных реакций.
18. Раствор хлорида железа (III) смешали с раствором карбоната калия. Осадок бурого цвета, образовавшийся при этом, отфильтровали, и сплавили с гидроксидом натрия. Полученное вещество обработали избытком раствора серной кислоты, которое необходимо для образования прозрачного раствора. Затем в полученный раствор добавили избыток сульфида калия. Напишите уравнения описанных реакций.
19. Железо сожгли в хлоре. Продукт реакции растворили в воде и в раствор внесли железные опилки. Через некоторое время раствор профильтровали и в фильтрат добавили сульфид натрия. Выделившийся осадок отделили и обработали 20%-ной серной кислотой, получив почти бесцветный раствор. Напишите уравнения описанных реакций.
20. Смесь железного порошка и твердого продукта, полученного при взаимодействии сернистого газа и сероводорода, нагрели без доступа воздуха. Полученный продукт подвергли обжигу на воздухе. Образовавшееся твердое вещество реагирует с алюминием с выделением большого количества тепла. Напишите уравнения описанных реакций.
21. Оксид железа (III) сплавили с содой. Полученный продукт внесли в воду. Выпавший осадок растворили в иодоводородной кислоте. Выделившийся галоген связали тиосульфатом натрия. Напишите уравнения описанных реакций.
22. Хлор прореагировал с горячим раствором гидроксида калия. При охлаждении раствора выпали кристаллы бертолетовой соли. Полученные кристаллы внесли в раствор соляной кислоты. образовавшееся простое вещество прореагировало с металлическим железом. Продукт реакции нагрели с новой навеской железа. Напишите уравнения описанных реакций.
23. Пирит подвергли обжигу, полученный газ с резким запахом пропустили через сероводородную кислоту. Образовавшийся желтоватый осадок отфильтровали, просушили, смешали с концентрированной азотной кислотой и нагрели. Полученный раствор дает осадок с нитратом бария. Напишите уравнения описанных реакций.
Пирит подвергли обжигу, полученный газ с резким запахом пропустили через сероводородную кислоту. Образовавшийся желтоватый осадок отфильтровали, просушили, смешали с концентрированной азотной кислотой и нагрели. Полученный раствор дает осадок с нитратом бария. Напишите уравнения описанных реакций.
24. Железные опилки растворили в разбавленной серной кислоте, полученный раствор обработали избытком раствора гидроксида натрия. Образовавшийся осадок профильтровали и оставили на воздухе до тех пор, пока он не приобрел бурую окраску. Бурое вещество прокалили до постоянной массы. Напишите уравнения описанных реакций.
25. Провели электролиз раствора хлорида натрия. К полученному раствору добавили хлорид железа (III). Выпавший осадок отфильтровали и прокалили. Твердый остаток растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.
26. Хлорат калия нагрели в присутствии катализатора, при этом выделился бесцветный газ.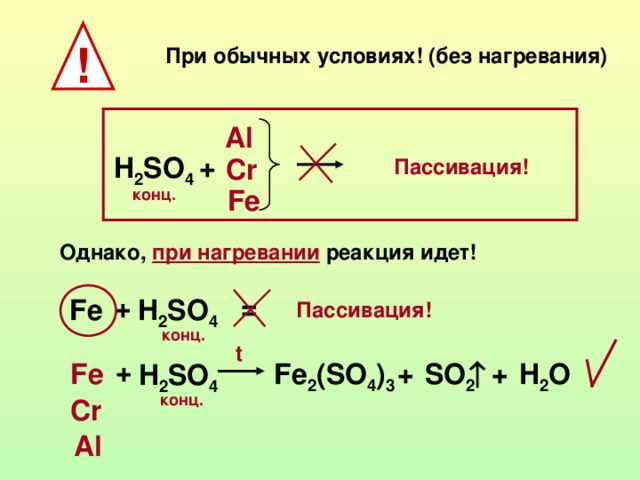 Сжиганием железа в атмосфере этого газа была получена железная окалина. Ее растворили в разбавленной соляной кислоте. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту. Напишите уравнения описанных реакций.
Сжиганием железа в атмосфере этого газа была получена железная окалина. Ее растворили в разбавленной соляной кислоте. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту. Напишите уравнения описанных реакций.
27. Железо сожгли в хлоре. Полученную соль добавили к раствору карбоната натрия, при этом выпал бурый осадок. Этот осадок отфильтровали и прокалили. Полученное вещество растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.
28. Серу сплавили с железом. Продукт реакции обработали соляной кислотой. Выделившийся при этом газ сожгли в избытке кислорода. Продукты горения поглотили водным раствором сульфата железа (III). Напишите уравнения описанных реакций.
29. В результате неполного сгорания угля получили газ, в токе которого нагрели оксид железа (III). Полученное вещество растворили в горячей концентрированной серной кислоте. Образовавшийся раствор соли обработали избытком раствора сульфида калия. Напишите уравнения описанных реакций.
Образовавшийся раствор соли обработали избытком раствора сульфида калия. Напишите уравнения описанных реакций.
30. Железо сожгли в атмосфере хлора. Полученное вещество обработали избытком раствора гидроксида натрия. Образовавшийся бурый осадок, который отфильтровали и прокалили. Остаток после прокаливания растворили в иодоводородной кислоте. Напишите уравнения описанных реакций.
31. Железо растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора карбоната натрия. Выделившийся осадок отфильтровали и прокалили. Полученное вещество растерли в мелкий порошок вместе с алюминием и смесь подожгли. Она сгорела с выделением большого количества теплоты. Напишите уравнения описанных реакций.
32. Порошок железа нагрели с порошком серы. Продукт реакции растворили в соляной кислоте, и к раствору добавили избыток щелочи. Выпавший осадок прокалили в атмосфере азота. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
33. Железо сожгли в атмосфере хлора. Полученную соль растворили в воде и добавили к ней раствор йодида калия. Выпавший осадок простого вещества отделили и разделили на две части. Первую обработали разбавленной азотной кислотой, а вторую нагрели в атмосфере водорода. Напишите уравнения описанных реакций.
34. Железо растворили в соляной кислоте, к полученному раствору добавили гидроксид натрия до прекращения выпадения осадка. В полученную реакционную массу вначале пропустили кислород, а затем добавили иодоводородной кислоты до прекращения выпадения осадка. Напишите уравнения описанных реакций.
35. Осадок, полученный при взаимодействии растворов сульфата железа (III) и нитрата бария, отфильтровали. Фильтрат обработали избытком едкого натрия. Выпавший осадок отделили и прокалили. Полученное вещество обработали избытком раствора соляной кислоты. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
Понравилось это:
Нравится Загрузка…
Микрореакции металлов с кислотами | Эксперимент
Попробуйте этот практический урок, чтобы изучить ряды реакционной способности различных металлов, когда они реагируют с кислотами в микромасштабе
В этом микромасштабном эксперименте учащиеся наблюдают реакции различных металлов с соляной, азотной и серной кислотами. Они записывают свои выводы и пытаются их объяснить. Затем учащихся могут попросить написать словесные и символьные уравнения для вовлеченных реакций.
Практика займет около 20 минут.
Оборудование
Аппаратура
- Защита глаз
- Рабочий лист для учащихся
- Лист из прозрачного пластика (например, лист OHP)
- Увеличительное стекло
- Чашка Петри и крышка
Химикаты
- Кислота соляная, 1 моль дм –3
- Кислота азотная разбавленная, 1 моль дм –3
- Кислота азотная концентрированная, 5 моль дм –3
- Кислота серная, 1 моль дм –3
- Магниевая лента
- Цинк металлический – мелкие гранулы
- Железные опилки
- Оловянные гранулы
- Медная стружка
Примечания по охране труда и технике безопасности
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда используйте защитные очки (брызгозащитные очки в соответствии с BS EN166 3).
- НЕ увеличивайте указанные количества и работайте в хорошо проветриваемой лаборатории. Образуются оксиды азота, газы КОРРОЗИОННЫ и очень ТОКСИЧНЫ (смертельны при вдыхании) — см. карточку опасности CLEAPS HC068B.
- Соляная кислота, HCl(водн.), 1 моль дм –3 малоопасна – см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043.
- Разбавленная азотная кислота, HNO 3 (водн.), 1 моль дм –3 является КОРРОЗИОННЫМ – см. карточку опасности CLEAPSS HC067 и книгу рецептов CLEAPSS RB061.
- Концентрированная азотная кислота, HNO 3 (водн.), 5 моль дм –3 ОКИСЛЯЕТ, КОРРОЗИРУЕТ и выделяет ТОКСИЧНЫЕ пары – см. карточку опасности CLEAPSS HC067 и книгу рецептов CLEAPSS RB061.
- Серная кислота, H 2 SO 4 (водн.), 1 моль дм –3 является КОРРОЗИОННЫМ – см.
 карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098.
карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098. - Магниевая лента ВОСПЛАМЕНЯЕТСЯ – см. карточку опасности CLEAPSS HC059A.
- Цинковый порошок, Zn(s), ВОСПЛАМЕНЯЕТСЯ и опасен для водной среды – см. карточку опасности CLEAPSS HC107.
Процедура
Примечание
Во время проведения этих экспериментов внимательно наблюдайте и записывайте результаты.
- Накройте стол на рабочем листе прозрачным пластиковым листом.
- Поместите несколько медных стружек в каждую коробку медного ряда.
- Поместите по одному маленькому кусочку магниевой ленты в каждую коробку магниевого ряда.
- Поместите несколько гранул цинка в каждую коробку цинкового ряда.
- Поместите несколько железных опилок в каждую коробку железного ряда.
- Наконец, поместите несколько гранул олова в каждую коробку в ряду олова.
Когда все металлические детали на месте:
- Добавьте по две капли разбавленной соляной кислоты к каждому металлу в колонне соляной кислоты.

- Добавьте по две капли разбавленной азотной кислоты к каждому металлу в колонке с азотной кислотой.
- Добавьте по две капли разбавленной серной кислоты к каждому металлу в колонке с серной кислотой.
- Наконец, поместите один кусок меди в чашку Петри. Добавьте две капли концентрированной азотной кислоты и сразу накройте крышкой.
Вопрос для учащихся
Что вы наблюдали? Дайте пояснения к своим наблюдениям.
Учебные заметки и ожидаемые наблюдения
Лента магния энергично реагирует с каждой кислотой. Цинк и железо также реагируют, но менее энергично. В каждом случае образуется газообразный водород, а также соль металла. Реакция между железом и азотной кислотой в конечном итоге приводит к красно-коричневому цвету ржавчины (оксид железа (III)). Студенты могли связать это с коррозией и кислотными дождями. Олово и медь не реагируют с соляной и серной кислотами, но можно увидеть несколько пузырьков (с помощью увеличительного стекла) с азотной кислотой.
В результате реакции между медью и концентрированной азотной кислотой образуется синий раствор и пузырьки (коричневого диоксида азота). Учащиеся ДОЛЖНЫ закрыть чашку Петри крышкой, как только они добавят кислоту. Двуокись азота очень токсична.
Учащиеся могут написать словесные и символьные уравнения для рассматриваемых реакций.
Дополнительная информация
Этот ресурс является частью нашей коллекции «Микромасштабная химия», в которой собраны эксперименты меньшего масштаба, чтобы заинтересовать ваших учащихся и изучить ключевые химические идеи. Ресурсы первоначально появились в книге Микрохимия: эксперименты в миниатюре , опубликовано Королевским химическим обществом в 1998 г. так…
Последние каналы
- Общая химия
Химия
- Общая химия
- Органическая химия 9015m3 Аналитическая химия 9015m0153 GOB Chemistry
- Biochemistry
Biology
- General Biology
- Microbiology
- Anatomy & Physiology
- Genetics
- Cell Biology
Math
- College Algebra
- Trigonometry
- Precalculus
Physics
- Физика
Бизнес
- Микроэкономика
- Макроэкономика
- Финансовый учет
Социальные науки
- Психология
Начните печатать, затем используйте стрелки вверх и вниз, чтобы выбрать вариант из списка.
- 3. Химические реакции
- Уравновешивание химических уравнений
Задача
Соответствующее решение
1 м
Воспроизвести видео:
Привет всем сегодня. У нас есть вопрос, который говорит нам, когда твердая медь реагирует с газообразным кислородом. Продукт представляет собой твердую медь, один оксид, и нам нужно написать сбалансированное химическое уравнение. Таким образом, у нас есть твердая медь, реагирующая с кислородом, газом и кислородом всегда в двух. И тогда это формирует один оксид меди. Так что нам нужно посмотреть на наши обвинения и посмотреть, что это будет. Итак, у нас есть медь с зарядом плюс один и кислород с зарядом -2. И нам нужно пересечь их. Так что это дало бы нам медь и кислород. Итак, это наш продукт. И теперь нам нужно сбалансировать это. Итак, давайте напишем, что у нас есть. У нас есть одна медь на стороне реагента И у нас есть два кислорода И на стороне продукта у нас есть две меди и один кислород. Таким образом, нашим самым простым шагом здесь будет поставить двойку перед нашим оксидом меди, и это даст нам четыре меди и два кислорода. Так что с нашим кислородом все в порядке. Теперь нам просто нужно исправить нашу медь, чтобы мы могли поставить четыре перед нашей медью на стороне реагента, и это даст нам четыре меди. А вот и наше сбалансированное химическое уравнение. Спасибо за просмотр. Пока
Так что с нашим кислородом все в порядке. Теперь нам просто нужно исправить нашу медь, чтобы мы могли поставить четыре перед нашей медью на стороне реагента, и это даст нам четыре меди. А вот и наше сбалансированное химическое уравнение. Спасибо за просмотр. Пока
Связанные видео
Связанная практика
Балансирующие химические уравнения
от профессора Дейва объясняют
236views
Как сбалансировать химические уравнения
Уравнение по органическому химии
317views
Балансировать химические уравнения. DeWitt
251просмотров
Балансировка химических уравнений
Жюля Бруно
1218просмотров
Как сбалансировать химическое уравнение EASY
by The Science Classroom
160views
Уравновешивание химических уравнений Шаг за шагом Практические задачи | Как пройти химию
от Melissa Maribel
235Views
Как сбалансировать химические уравнения в 5 простых шагах: уравнение балансировки
от Уэйна Бреслин
565Views
Балансировать химические уравнения 1
на Jules Bruno
9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2 9000 2.



 карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098.
карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098.
Leave A Comment