Азотная кислота, HNO3, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Азотная кислота. Большая российская энциклопедия
Химические соединения
- Области знаний:
- Неорганическая химия, Неорганические соединения
- Брутто-формула:
- HNO₃
- Молярная масса:
- 63,012 г/моль
- Температура плавления:
- -41,59 °C
- Температура кипения:
- 82,6 °C
- Плотность при н. у.:
- 1,1513 г/см³
- Агрегатное состояние:
- Жидкое
Азо́тная кислота́, HNO3, сильная одноосновная неорганическая кислота; многотоннажный продукт химической промышленности.
Свойства
Бесцветная жидкость; плотность безводной HNO3 1513 кг/м3; tпл –41,59 °C, tкип 82,6 °C (с разложением). С водой азотная кислота смешивается в любых соотношениях, образует азеотропную смесь (68,4 % по массе HNO3, tкип 120,7 °C). Азотная кислота ограниченно растворима в эфире. Концентрированная кислота неустойчива, при нагревании или под действием света разлагается: 4HNO3=4NO2+2h3O+O24HNO_3 = 4NO_2+2H_2O+O_24HNO3=4NO2+2h3O+O2Образующийся NO2 окрашивает кислоту в жёлтый (при высоких концентрациях NO2 – в красный) цвет и придаёт ей специфический запах. Азотная кислота – сильный окислитель. Под действием азотной кислоты металлы (за исключением Zr, Nb, Rh, Ta, Ir, Pt, Au) превращаются в нитраты или оксиды, сера окисляется до H2SO4, фосфор – до H3PO4, органические соединения окисляются и нитруются. Многие органические вещества (бумага, масло, древесина, уголь и др.) при воздействии концентрированной HNO3 воспламеняются. Некоторые металлы (например, Al, Fe), легко растворяющиеся в разбавленной HNO3, устойчивы к действию концентрированной HNO3, которая их «пассивирует» в результате образования малорастворимой оксидной плёнки.
Азотная кислота ограниченно растворима в эфире. Концентрированная кислота неустойчива, при нагревании или под действием света разлагается: 4HNO3=4NO2+2h3O+O24HNO_3 = 4NO_2+2H_2O+O_24HNO3=4NO2+2h3O+O2Образующийся NO2 окрашивает кислоту в жёлтый (при высоких концентрациях NO2 – в красный) цвет и придаёт ей специфический запах. Азотная кислота – сильный окислитель. Под действием азотной кислоты металлы (за исключением Zr, Nb, Rh, Ta, Ir, Pt, Au) превращаются в нитраты или оксиды, сера окисляется до H2SO4, фосфор – до H3PO4, органические соединения окисляются и нитруются. Многие органические вещества (бумага, масло, древесина, уголь и др.) при воздействии концентрированной HNO3 воспламеняются. Некоторые металлы (например, Al, Fe), легко растворяющиеся в разбавленной HNO3, устойчивы к действию концентрированной HNO3, которая их «пассивирует» в результате образования малорастворимой оксидной плёнки.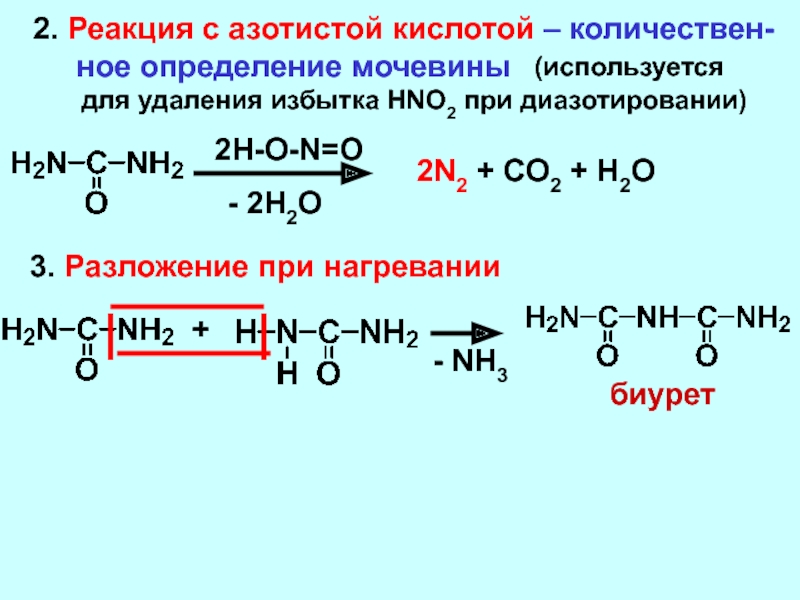 Смесь концентрированной азотной и соляной кислот (соотношение по объёму 1:3) – т. н. царская водка – растворяет золото и платиновые металлы. Смесь 100%-ной HNO3 и 96%-ной H2SO4 (соотношение по объёму 9:1) называется меланжем. Соли азотной кислоты – нитраты.
Смесь концентрированной азотной и соляной кислот (соотношение по объёму 1:3) – т. н. царская водка – растворяет золото и платиновые металлы. Смесь 100%-ной HNO3 и 96%-ной H2SO4 (соотношение по объёму 9:1) называется меланжем. Соли азотной кислоты – нитраты.
Получение
В середине 17 в. И. Глаубер предложил получать азотную кислоту при нагревании до 150 °C калиевой селитры с концентрированной серной кислотой: KNO3+h3SO4=HNO3+KHSOKNO_3 + H_2SO_4 = HNO_3 + KHSOKNO3+h3SO4=HNO3+KHSO4. До начала 20 в. этот способ применяли в промышленности, заменяя калиевую селитру более дешёвой природной чилийской селитрой NaNO3. Современный способ получения 55–58%-ной HNO3 основан на каталитическом окислении аммиака NH3 кислородом воздуха. Производство включает: получение NO, окисление его до NO2, абсорбцию NO2 водой, очистку отходящих газов от оксидов азота. NO получают окислением аммиака: 4Nh4+5O2=4NO+6h3O4NH_3 + 5O_2 = 4NO + 6H_2O4Nh4+5O2=4NO+6h3O; в качестве катализатора используют сетку из сплавов Pt (80–95 %) с металлами платиновой группы в сочетании с оксидным неплатиновым катализатором. Окисление NO (по реакции 2NO+O2=2NO22NO + O_2 = 2NO_22NO+O2=2NO2) протекает в газовой фазе при охлаждении нитрозных газов (смесь NO и NO2), полученных на стадии окисления NH3, при температуре до 160–250 °C. Абсорбцию NO2 водой (3NO2+h3O=2HNO3+NO3NO_2 + H_2O = 2HNO_3 + NO3NO2+h3O=2HNO3+NO) осуществляют в тарельчатых колоннах. Очищают отходящие газы путём каталитического восстановления оксидов азота до N2 аммиаком или природным горючим газом.
Окисление NO (по реакции 2NO+O2=2NO22NO + O_2 = 2NO_22NO+O2=2NO2) протекает в газовой фазе при охлаждении нитрозных газов (смесь NO и NO2), полученных на стадии окисления NH3, при температуре до 160–250 °C. Абсорбцию NO2 водой (3NO2+h3O=2HNO3+NO3NO_2 + H_2O = 2HNO_3 + NO3NO2+h3O=2HNO3+NO) осуществляют в тарельчатых колоннах. Очищают отходящие газы путём каталитического восстановления оксидов азота до N2 аммиаком или природным горючим газом.
Концентрированную азотную кислоту получают двумя способами. Первый способ основан на ректификации тройных смесей, содержащих HNO3, H2O и водоотнимающий агент – H2SO4 или Mg(NO3)2; при этом конденсируются пары 100%-ной HNO3. Второй способ основан на реакции 2N2O4+2h3O+O2=4HNO32N_2O_4 + 2H_2O + O_2 = 4HNO_32N2O4+2h3O+O2=4HNO3; при использовании чистого кислорода и давлении около 5 МПа образуется 97–99%-ная HNO3; при использовании воздуха и при давлении 0,7–1,0 МПа образуется 80–85%-ная HNO3 и азеотропная смесь HNO3 с водой. HNO3 с содержанием примесей менее 1·10–6 % по массе получают ректификацией 97–98%-ной HNO3 в аппаратах из силикатного или кварцевого стекла.
HNO3 с содержанием примесей менее 1·10–6 % по массе получают ректификацией 97–98%-ной HNO3 в аппаратах из силикатного или кварцевого стекла.
Применение
Разбавленная HNO3 в основном используется в производстве нитрата аммония и комплексных минеральных удобрений, нитратов Na, K, Ca и др., в гидрометаллургии; концентрированная HNO3 – при получении взрывчатых веществ (ВВ), серной и фосфорной кислот, ароматических нитросоединений, красителей, как компонент ракетного топлива, для травления металлов и др.
Концентрированная HNO3 при соприкосновении с органическими веществами вызывает пожары и взрывы. Вдыхание паров азотной кислоты приводит к отравлению, попадание концентрированной HNO3 на кожу вызывает ожоги.
Мировое производство азотной кислоты (в пересчёте на 100%-ную HNO3) около 750 млн т/год (2020), в том числе 13,8 млн т/год (2020) в РФ.
Михайличенко Анатолий Игнатьевич, Алексеев А. М. Дата публикации: 8 июня 2022 г. в 17:20 (GMT+3)
М. Дата публикации: 8 июня 2022 г. в 17:20 (GMT+3)неорганическая химия. Разложение азотной кислоты
спросил
Изменено 5 лет, 10 месяцев назад
Просмотрено 4к раз
$\begingroup$У меня проблема с реакцией разложения азотной кислоты ($\ce{HNO3}$) на свету. Моя проблема: эта реакция является окислительно-восстановительной реакцией? Если это так, пожалуйста, скажите мне отдельно реакции окисления и восстановления (сбалансированные).
- неорганическая химия
Обычно азотная кислота является сильным окислителем, который восстанавливается до оксидов азота при взаимодействии с металлами, действующими как восстановитель, что приводит к окислительно-восстановительной реакции. Но в данном случае задействована только азотная кислота, которая при реакции с воздухом/светом восстанавливается до оксидов азота. Таким образом, это можно назвать реакцией окисления, при которой азотная кислота окисляется. Из статьи в Википедии о азотной кислоте: 9{IV}O2 + O2}$ 90 005 долл. США
Но в данном случае задействована только азотная кислота, которая при реакции с воздухом/светом восстанавливается до оксидов азота. Таким образом, это можно назвать реакцией окисления, при которой азотная кислота окисляется. Из статьи в Википедии о азотной кислоте: 9{IV}O2 + O2}$ 90 005 долл. США
Эта реакция может привести к некоторым существенным изменениям в давление пара над жидкостью, так как образуются оксиды азота. частично или полностью растворяются в кислоте.
Диоксид азота ($\ce{NO2}$) остается растворенным в азотной кислоте
окрашивая его в желтый или даже красный цвет при более высоких температурах. в то время как чистый
кислота имеет тенденцию выделять белый дым при контакте с воздухом, кислота с
растворенный диоксид азота выделяет красновато-коричневые пары, что приводит к
общее название «красная дымящая кислота» или «дымящая азотная кислота» – наиболее
концентрированная форма азотной кислоты при стандартной температуре и
Давление (СТП). Оксиды азота ($\ce{NO_x}$) растворимы в азотной
кислота.
Оксиды азота ($\ce{NO_x}$) растворимы в азотной
кислота.
Есть несколько старых статей (здесь и здесь), в которых обсуждается механизм разложения азотной кислоты. Быстро прочитайте бумаги, и вы поймете механизм реакции.
$\endgroup$ 0Зарегистрируйтесь или войдите
Зарегистрироваться через Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя электронную почту и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
Азотная кислота | Свойства, формула, использование и факты
- Ключевые люди:
- Георг Брандт Иоганн Рудольф Глаубер
- Похожие темы:
- водород азот кислород царская водка биогенный газ
Просмотреть весь соответствующий контент →
Самые популярные вопросы
Что такое азотная кислота?
Азотная кислота представляет собой бесцветную, дымящуюся и сильно коррозионную жидкость, которая является обычным лабораторным реагентом и важным промышленным химикатом для производства удобрений и взрывчатых веществ.
Является ли азотная кислота сильной или слабой кислотой?
Азотная кислота – сильная кислота, полностью ионизированная до гидроксония (H 3 O+) и нитрата (N O 3 -) ионы в водном растворе и сильный окислитель.
Вредна ли азотная кислота?
Азотная кислота (HNO 3 ) представляет собой сильно коррозионную жидкость, которая является токсичной и может вызвать сильные ожоги.
Для чего используется азотная кислота?
Азотная кислота используется для производства аммиачной селитры, основного компонента удобрений. Он также используется для производства взрывчатых веществ, таких как нитроглицерин и тринитротолуол (ТНТ), а также для окисления металлов.
азотная кислота , (HNO 3 ), бесцветная, дымящая и сильно коррозионная жидкость (температура замерзания –42 °C [–44 °F], точка кипения 83 °C [181 °F]), представляющая собой обычный лабораторный реагент и важный промышленный химикат для производства удобрений и взрывчатых веществ. Он ядовит и может вызвать сильные ожоги.
Приготовление и использование азотной кислоты были известны еще древним алхимикам. Обычный лабораторный процесс, использовавшийся в течение многих лет и приписываемый немецкому химику Иоганну Рудольфу Глауберу (1648 г.), заключался в нагревании нитрата калия с концентрированной серной кислотой. В 1776 году Антуан-Лоран Лавуазье показал, что он содержит кислород, а в 1816 году Жозеф-Луи Гей-Люссак и Клод-Луи Бертолле установили его химический состав.
More From Britannica
оксикислота: азотная кислота и нитратные соли
Основным методом производства азотной кислоты является каталитическое окисление аммиака. В методе, разработанном немецким химиком Вильгельмом Оствальдом в 1901 году, газообразный аммиак последовательно окисляется до оксида азота и диоксида азота воздухом или кислородом в присутствии катализатора из платиновой сетки. Диоксид азота поглощается водой с образованием азотной кислоты. Полученный раствор кислоты в воде (около 50–70 процентов по весу кислоты) можно обезвожить путем перегонки с серной кислотой.
Азотная кислота разлагается на воду, диоксид азота и кислород с образованием коричневато-желтого раствора. Это сильная кислота, полностью ионизированная до ионов гидроксония (H 3 O + ) и нитрата (NO 3 — ) в водном растворе, а также сильный окислитель (тот, который действует как акцептор электронов при окислении).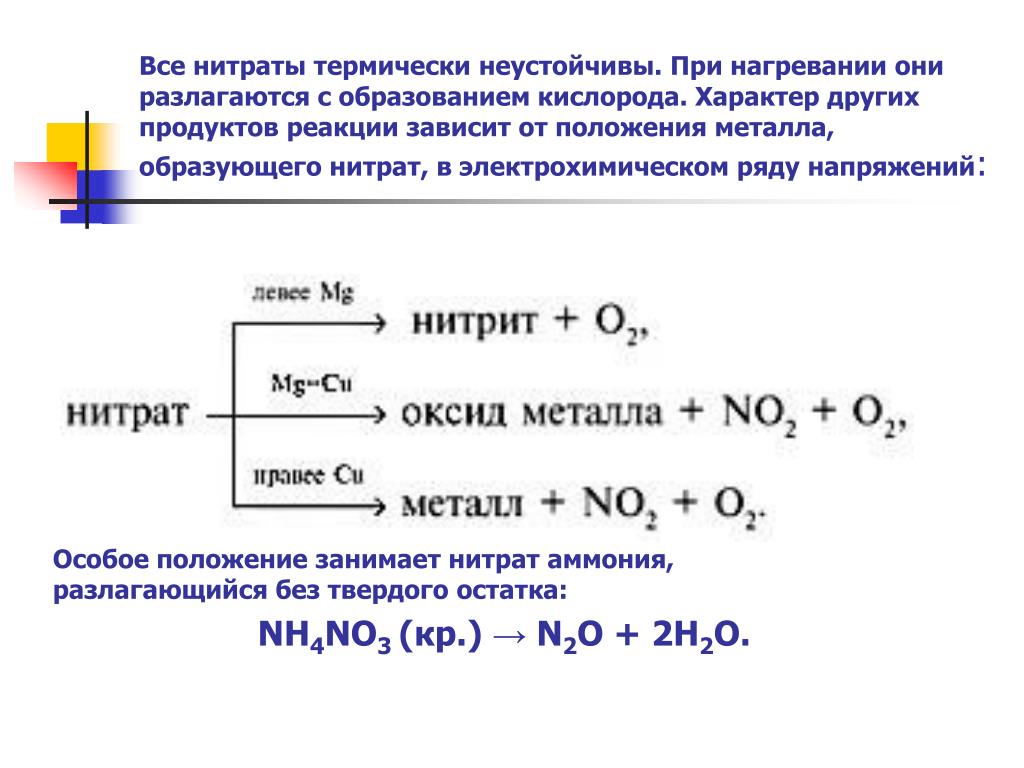

Leave A Comment