Гидроксид натрия — хим. свойства и получение
Гидроксид натрия (едкий натр) NaOH — белый, гигроскопичный, плавится и кипит без разложения. Хорошо растворяется в воде.
Относительная молекулярная масса Mr = 40; относительная плотность для тв. и ж. состояния d = 2,130; tпл = 321º C; tкип = 1390º C;
1. Гидроксид натрия получают электролизом раствора хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии натрия, оксида натрия, гидрида натрия и пероксида натрия с водой также образуется гидроксид натрия:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
Na2O2 + H2O → 2NaOH + H2O2
3. Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Карбонат натрия при взаимодействии с гидроксидом кальция образует гидроксид натрия:
Na2CO3 + Ca(OH)2 → CaCO3↓ + 2NaOH
Качественная реакция на гидроксид натрия — окрашивание фенолфталеина в малиновый цвет.
1. Гидроксид натрия реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
3NaOH + H3PO4 → Na3PO4 + H2O
2NaOH + H3PO4 → Na2HPO4 + 2H2O
NaOH + H3PO4 → NaH2PO4 + H2O
2. Гидроксид натрия реагирует с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
При этом образуются средние или кислые соли, в зависимости от соотношения реагентов:
2NaOH(избыток) + CO2 → Na2CO3 + H2O
NaOH + CO2 (избыток) → NaHCO3
3. Гидроксид натрия реагирует с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли:
2NaOH + Al2O3 → 2NaAlO2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
2NaOH + Al2O3 + 3H2O → 2Na[Al(OH)4]
4. С кислыми солями гидроксид натрия также может взаимодействовать. При этом образуются средние соли, или менее кислые соли:
При этом образуются средние соли, или менее кислые соли:
NaOH + NaHCO3 → Na2CO3 + H2O
5. Гидроксид натрия взаимодействует с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется до силиката и водорода:
2NaOH + Si + H2O → Na2SiO3 + H2
Фтор окисляет щелочь. При этом выделяется молекулярный кислород:
4NaOH + 2F2 → 4NaF + O2 (OF2) + 2H2O
Другие галогены, сера и фосфор — диспропорционируют в растворе гидроксида натрия:
3NaOH + P4 + 3H2O = 3NaH2PO2 + PH3↑
2NaOH(холодный) + Cl2 = NaClO + NaCl + H2O
6NaOH(горячий) + 3Cl2 = NaClO3 + 5NaCl + 3H2O
Сера взаимодействует с гидроксидом натрия только при нагревании:
6NaOH + 3S = 2Na2S + Na2SO3 + 3H2O
6. Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Гидроксид натрия взаимодействует с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
2NaOH + Zn → Na2ZnO2 + H2
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксид натрия вступает в обменные реакции с растворимыми солями.
Хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с гидроксидом натрия взаимодействуют соли аммония.
Например, при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
Гидроксид натрия проявляет свойства сильного основания. В воде практически полностью диссоциирует, образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na+ + OH—
9. Гидроксид натрия в расплаве подвергается электролизу. При этом на катоде восстанавливается натрий, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Понравилось это:
Нравится Загрузка…
Гидроксид натрия, NaOH, химические свойства, получение, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
кислотно-щелочное — Почему гидроксид натрия реагирует с оксидом алюминия?
спросил
Изменено 5 лет, 10 месяцев назад
Просмотрено 5к раз
$\begingroup$Я видел все химические формулы реакции между гидроксидом натрия, водой и алюминием. Я понимаю, что газообразный водород возникает из-за реакции алюминия с водой, а гидроксид натрия просто разрушает оксид алюминия. Но почему гидроксид натрия разрушает его? Кроме того, поскольку оксид алюминия является амфотерным, можно ли провести эту реакцию с сильной кислотой вместо сильного основания?
- кислотно-щелочной
Если вы используете «сильную кислоту» для разрушения пассивного оксида, вам нужно быть осторожным при выборе кислоты. Серная или азотная кислота являются окислителями и, таким образом, могут поддерживать оксид. Соляная кислота среди обычных минеральных кислот лучше всего подходит для того, чтобы добраться до металла, и при этом с ней относительно легко обращаться.
Серная или азотная кислота являются окислителями и, таким образом, могут поддерживать оксид. Соляная кислота среди обычных минеральных кислот лучше всего подходит для того, чтобы добраться до металла, и при этом с ней относительно легко обращаться.
C 2 H 6 O 2 — химическая формула.
HOCH 2 -CH 2 OH — это химическая формула.
CH 4 + 2O 2 → CO 2 + 2H 2 O представляет собой химическое уравнение . Вы должны узнать разницу.
Продукты реакции обычно имеют меньшую свободную энергию, чем реагенты. Если будет полезно, то ответ на ваш вопрос, почему NaOH реагирует с Al 2 O 3 : потому что продукты имеют меньшую свободную энергию, чем реагенты. На мой более опытный взгляд, это круговой ответ: конечно, продукты имеют более отрицательную дельту G, но это не ответ на вопрос «почему?». Наука гораздо лучше отвечает на вопрос «как?» чем «почему?». Но на вашем уровне понимания вы должны знать, что говорить об оксидном покрытии алюминия и его реакциях с кислотами и основаниями (возможно) категорически иначе, чем говорить об Al° и его реакциях. Вы спрашивали об оксиде. Аль +3 существует в водном растворе как [Al +3 ].6H 2 O со своим противоионом (в HCl (водн.) это будет анион Cl — ) и как [Al(OH) 4 ] — с противоионом (в вашем случае это будет Na + ). ОБА из них стабильны, один в кислоте, другой в щелочи (очевидно, что есть что, верно?). Итак, вопрос: самопроизвольно ли растворяется Al2O3 в кислоте (в щелочи)? Ответ таков: «при достаточно низком (достаточно высоком) рН так и есть». Сильное основание воздействует на кожу, как и сильная кислота. Реакции разные, они НЕ противоположны. Я не вижу ничего необычного в том, что материал реагирует с сильными кислотами и сильными основаниями. Я предполагаю, что одна из причин, по которой вы можете увидеть дихотомию между кислотами и основаниями, заключается в том, что в водных растворах обычно не бывает и того, и другого одновременно.
Наука гораздо лучше отвечает на вопрос «как?» чем «почему?». Но на вашем уровне понимания вы должны знать, что говорить об оксидном покрытии алюминия и его реакциях с кислотами и основаниями (возможно) категорически иначе, чем говорить об Al° и его реакциях. Вы спрашивали об оксиде. Аль +3 существует в водном растворе как [Al +3 ].6H 2 O со своим противоионом (в HCl (водн.) это будет анион Cl — ) и как [Al(OH) 4 ] — с противоионом (в вашем случае это будет Na + ). ОБА из них стабильны, один в кислоте, другой в щелочи (очевидно, что есть что, верно?). Итак, вопрос: самопроизвольно ли растворяется Al2O3 в кислоте (в щелочи)? Ответ таков: «при достаточно низком (достаточно высоком) рН так и есть». Сильное основание воздействует на кожу, как и сильная кислота. Реакции разные, они НЕ противоположны. Я не вижу ничего необычного в том, что материал реагирует с сильными кислотами и сильными основаниями. Я предполагаю, что одна из причин, по которой вы можете увидеть дихотомию между кислотами и основаниями, заключается в том, что в водных растворах обычно не бывает и того, и другого одновременно. (по крайней мере, так как константа равновесия воды 1Е-14, в большинстве растворов химический интерес (в отличие от интересных биологических ситуаций), либо кислота, либо основание присутствуют в преобладающих концентрациях…). Имея дело с кислотами/основаниями Бренстеда, иногда удобно рассматривать кислоты как противоположности основаниям, у этого подхода есть пределы, за которыми более полезны другие определения кислотности или основности. ХТХ
(по крайней мере, так как константа равновесия воды 1Е-14, в большинстве растворов химический интерес (в отличие от интересных биологических ситуаций), либо кислота, либо основание присутствуют в преобладающих концентрациях…). Имея дело с кислотами/основаниями Бренстеда, иногда удобно рассматривать кислоты как противоположности основаниям, у этого подхода есть пределы, за которыми более полезны другие определения кислотности или основности. ХТХ
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя адрес электронной почты и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания и подтверждаете, что прочитали и поняли нашу политику конфиденциальности и кодекс поведения.
домашний эксперимент — Реакция натрий+вода, ядовитые пары?
спросил
Изменено 3 года, 8 месяцев назад
Просмотрено 680 раз
$\begingroup$Я смешивал чистый натрий и водопроводную воду , и в какой-то момент я добавил немного разбрызганного натрия обратно в воду. Я заметил пары, которые вступали в реакцию с моей дыхательной системой, вызывая жжение.
Я читал, что можно получить пары оксида натрия из гидроксида натрия при высоких температурах (в конце концов натрий сгорел, образовав оранжевое пламя).
Мой вопрос каков может быть химический состав этих паров?
- домашний эксперимент
- безопасность
- щелочные металлы
Согласен. Это опасная реакция, и ее нельзя проводить без надлежащего оборудования, включая лабораторный колпак и оборудование для пожаротушения.
Это опасная реакция, и ее нельзя проводить без надлежащего оборудования, включая лабораторный колпак и оборудование для пожаротушения.
Дым может быть «всего лишь» каплями раствора гидроксида натрия. Я видел подобные пары, связанные с соляной кислотой, просто добавляя воду, чтобы смыть следы концентрированной кислоты (конечно, в вытяжном шкафу). Они могут переноситься повышенным испарением даже без кипячения и без необходимости дальнейшей «химической реакции».
$\endgroup$ $\begingroup$Ну гидроксид натрия (NaOH) твердый при комнатной температуре, но при высоких температурах может превращаться в газы. Это происходит из-за того, что молекулы NaOH приобретают столько энергии, что межмолекулярные связи (диполь-дипольные) между 2 молекулы гидроксида натрия разрушаются. Реакция натрия с водой является экзотермической и выделяет много тепла, и гидроксид натрия, возможно, поглотил часть тепла.
То, что вы сделали, было очень опасно, и я бы никому не рекомендовал делать это дома без лабораторного оборудования.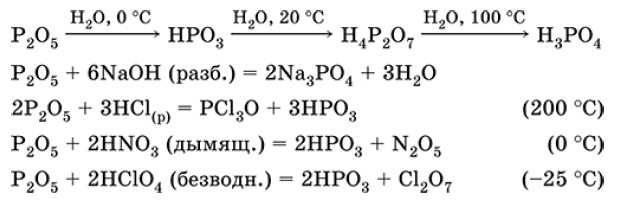
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google Зарегистрироваться через Facebook Зарегистрируйтесь, используя адрес электронной почты и парольОпубликовать как гость
Электронная почтаТребуется, но никогда не отображается
Опубликовать как гость
Электронная почтаТребуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания и подтверждаете, что прочитали и поняли нашу политику конфиденциальности и кодекс поведения.

Leave A Comment