Решение задач для подготовки к ЕГЭ по химии (11 класс)
Решение задач для подготовки к ЕГЭ по химии.
ТИП I. НЕРАСТВОРИМОСТЬ ОТДЕЛЬНЫХ КОМПОНЕНТОВ.
Задача 1. Смесь алюминия и железа обработали избытком соляной кислоты, при этом выделилось 8,96 л газа (н.у.). Это же количество смеси обработали избытком раствора гидроксида натрия, выделилось 6,72 л газа (н.у.). Найти массовую долю железа в исходной смеси.
Решение
1) Составим уравнения реакций взаимодействия металлов с
кислотой и щелочью, при этом нужно учесть, что железо не реагирует с раствором щелочи:
2Al + 6HCl = 2AlCl3+ 3h3 ↑ (1)
2моль 3моль
Fe + 2HCl = FeCl2 +h3↑ (2)
1моль 1моль
2Al + 2NaOH + 6h3O == 2Na[Al(OH)4] + 3h3↑ (3)
2моль 3моль
2) Поскольку со щелочью реагирует только алюминий, то мож-
но найти его количество вещества:
ν(Н2) = V/VM = 6,72 (л) / 22,4 (л/моль) = 0,3 моль,
следовательно,
ν(Al) = 0,2 моль.
3) Поскольку для обеих реакций были взяты одинаковые количества смеси, то в реакцию с
соляной кислотой вступило такое же количество алюминия, как и в реакцию со щелочью,
– 0,2 моль.
По уравнению (1) находим:
ν(Н2) = 0,3 моль.
4) Найдем количество вещества водорода, выделившегося в результате реакции металлов с кислотой:
νобщ(Н2) = V / VМ = 8,96 (л) / 22,4 (л/моль) = 0,4 моль.
5) Найдем количество вещества водорода, выделившегося при взаимодействии железа с кислотой, и затем количество вещества железа:
ν(Н2) = νобщ(Н2) – ν(Н2) = 0,4 – 0,3 = 0,1 моль,
ν(Fe) = 0,1 моль.
6) Найдем массы Al, Fe, массу смеси и массовую долю железа в смеси:
m(Al) = 27 (г/моль) * 0,2 (моль) = 5,4 г,
m(Fe) = 56 (г/моль) * 0,1 (моль) = 5,6 г,
mсмеси(Al, Fe) = 5,4 + 5,6 = 11 г,
ω(Fe) = mв-ва / mсм = 5,6 / 11 = 0,5091 (50,91 %).
Ответ. ω(Fe) = 50,91 %.
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Речь идет об
одновременно происходящих реакциях, с реагентом (реагентами) взаимодействуют
все компоненты смеси. Для определения порций отдельных компонентов придется использовать
алгебраический алгоритм. Поскольку в дальнейшем предстоят расчеты по уравнениям
реакций, в качестве неизвестной величины лучше всего выбрать количество
вещества.
Для определения порций отдельных компонентов придется использовать
алгебраический алгоритм. Поскольку в дальнейшем предстоят расчеты по уравнениям
реакций, в качестве неизвестной величины лучше всего выбрать количество
вещества.
Алгоритм 1. Решение через систему уравнений с двумя неизвестными
(подходит для любой задачи такого типа)
1. Составить уравнения реакций.
2. Количества веществ (ν) в исходной смеси обозначить через х, у моль и, согласно молярным соотношениям по уравнениям реакций, выразить через х, у моль количества веществ в
образовавшейся смеси.
3. Составить математические уравнения. Для этого следует выразить массу (или объем)
веществ через х, у и молярную массу (молярный объем) по формулам:
m = ν*M; V = ν*VМ.
4. Составить систему уравнений и решить ее.
5. Далее решать согласно условиям задачи
Задача 1. Пластинку из магниево-алюминиевого сплава массой 3,9 г поместили
в раствор соляной
кислоты. Пластинка растворилась, и выделилось 4,48 л газа. Найти массовые доли
металлов в сплаве.
Пластинка растворилась, и выделилось 4,48 л газа. Найти массовые доли
металлов в сплаве.
Решение
1) Запишем уравнения реакции:
Mg + 2HCl = MgCl2 +h3↑
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑
2моль 3моль
2) Обозначим количества веществ:
ν(Mg) = x моль; ν(Н2) = х моль;
ν(Al) = y моль; ν(Н2) = 1,5 у моль.
3) Составим математические уравнения: найдем массы магния, алюминия и их смеси, а также ко-
личество вещества выделившегося водорода:
m(Mg) = 24x,
m(Al) = 27y,
m(смеси) = 24х + 27y;
ν(Н2) = V/VM = 4,48 (л) / 22,4 (л/моль) = 0,2 моль.
4) Составим систему уравнений и решим ее:
24x+ 27y=3,9
x + 1,5y = 0, 2 .
х = 0,2 – 1,5у,
24(0,2 – 1,5у) + 27у = 3,9,
у = 0,1;
х = 0,2 – 1,5*0,1 = 0,05.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) /
m(см. ) = 1,2 (г) / 3,9 (г) = 0,3077,
) = 1,2 (г) / 3,9 (г) = 0,3077,
ω(Al) = m(Al) / m(см.) = 2,7 / 3,9 = 0,6923.
Ответ. ω(Mg) = 30,77 %; ω(Al) = 69,23 %.
Задача 2. К раствору, содержащему 5,48 г смеси сульфата и силиката натрия, прибавили избыток хлорида бария, в результате образовалось 9,12 г осадка. Найти массы солей в исходной смеси.
Решение
1) Составим уравнения реакций:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl,
1моль 1моль
Na2SiO3 + BaCl2 =BaSiO3↓+ 2NaCl.
1моль 1моль
2) Обозначим количества веществ:
ν(Na2SO4) = x моль,
ν(BaSO4) = х моль;
ν(Na2SiO3) = у моль,
ν(BaSiO3) = у моль.
3) Составим формулы для массы веществ:
m(Na2SO4) = 142x,
m(BaSO4) = 233x,
m(Na2SiO3) = 122y,
m(BaSiO3) = 213y;
m(исх. см.) = m(Na2SO4) + m(Na2SiO3),
m(обр. см.) = m(BaSO4) + m(BaSiO3).
4) Составим систему уравнений и решим ее:
142x+ 122y =5,48
233x+ 213y =9,12 .
х = 0,03, y = 0,01.
m(Na2SO4) = 0,03 (моль)æ142 (г/моль) = 4,26 г,
m(Na2SiO3) = 5,48 – 4,26 = 1,22 г.
Ответ. m(Na2SO4) = 4,26 г; m(Na2SiO3) = 1,22 г.
Алгоритм 2. Решение через уравнение с одним неизвестным
(подходит только для задач, в которых можно найти общее количество продукта, образующегося во всех параллельных реакциях)
1. Составить уравнения реакций.
2. Найти количество образовавшегося вещества.
3. Обозначить количество вещества, получившегося в результате одной реакции, через
х моль, тогда количество вещества, получившегося в результате второй реакции, будет равно:
(ν – х). Выразить, согласно уравнениям реакций, количества веществ в исходной смеси.
4. Выразить массы веществ, составить и решить уравнение с одним неизвестным.
Из двух задач, решенных по алгоритму 1, этим способом можно решить только задачу 1. (в разделе
ТИП II. ПАРАЛЛЕЛЬНЫЕ РЕАКЦИИ
Решение задачи 1
1) Составим уравнения реакций:
Mg+ 2HCl = MgCl2 + h3 ↑ (1)
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑ (2)
2моль 3моль
2) Найдем количество вещества образовавшегося водорода:
ν(Н2) = V / VМ =
4,48 (л) / 22,4 (л/моль) = 0,2 моль.
3) Обозначим количество вещества водорода, получившегося по реакции (2),
ν(Н2) = х моль, тогда количество вещества водорода, получившегося по реакции (1),
равно: ν(Н2) = 0,2 – х.
Согласно уравнениям реакций в исходной смеси было:
ν(Mg) = 0,2 – x; ν(Al) = 2x / 3.
4) Выразим массы:
m(Mg) = 24(0,2 – x) = 4,8 – 24x,
m(Al) = 27æ2x /3 = 18х.
Составим уравнение с одним неизвестным:
4,8 – 24х + 18х = 3,9;
х = 0,15.
ν(Mg) = 0,2 – 0,15 = 0,05 моль;
ν(Al) = 2/3 * 0,15 = 0,1 моль.
5) Найдем массы магния и алюминия и их массовые доли в смеси:
m(Mg) = 0,05 (моль) * 24 (г /моль) = 1,2 г,
m(Al) = 0,1 (моль) * 27 (г /моль) = 2,7 г,
ω(Mg) = m(Mg) / m(см.) = 1,2 (г) / 3,9 (г) = 0,3077,
ω(Al) = m(Al) / m(см.) = 2,7 / 3,9 = 0,6923.
Ответ. ω(Mg) = 30,77 %; ω(Al) = 69,23 %.
ТИП III. КОМБИНИРОВАННЫЕ ЗАДАЧИ
Задача 1. При обработке 17,4 г смеси алюминия, железа и меди избытком соляной кисло-
ты выделилось 8,96
л (н. у.) . Не растворившийся в соляной кислоте остаток растворился
у.) . Не растворившийся в соляной кислоте остаток растворился
в концентрированной азотной кислоте с выделением 4,48 л газа (н.у.). Определить состав
исходной смеси (в %).
Решение
1) Составим уравнения реакций:
Fe+ 2HCl = FeCl2 + h3↑
1моль 1моль
2Al+ 6HCl = 2AlCl3 +3h3↑
2моль 3моль
Cu+ 4HNO3 == Сu(NO3)2 + 2NO2↑+ 2h3O.
1моль 2моль
2) Найдем количество вещества оксида азота(IV) и количество
вещества и массу меди:
ν(NO2) = V / VМ = 4,48 л / 22,4 (л/моль) = 0,2 моль,
ν(Сu) = 0,1 моль;
m(Cu) = M * ν == 64 (г/моль) * 0,1 (моль) = 6,4 г.
3) Найдем массу смеси железа и алюминия:
m(Fe, Al) = 17,4 (г) – 6,4 (г) = 11 г.
4) Обозначим количества веществ:
ν(Fe) = x моль, ν(Н2) = х моль;
ν(Al) = y моль, ν(Н2) = 1,5 у моль.
5) Выразим массы Fe и Al через x и y; найдем количество вещества водорода:
m(Fe) = 56x; m(Al) = 27y;
ν(Н2) = V / VМ =
8,96 (л) / 22,4 (л/моль) = 0,4 моль.
6) Составим систему уравнений и решим ее:
56x + 27y = 11
X + 1,5y =0,4 .
х = 0,4 – 1,5у;
56(0,4 – 1,5у) + 27у = 11,
у = 0,2;
х = 0,4 – 1,5*0,2 = 0,1.
7) Найдем массы железа и алюминия, затем массовые доли веществ в смеси:
m(Fe) = 0,1 (моль) * 56 (г/моль) = 5,6 г,
m(Al) = 0,2 (моль) * 27 (г/моль) = 5,4 г;
ω(Cu) = m(Cu) / m(см.) = 6,4 (г) / 17,4 (г) = 0,368,
ω(Fe) = m(Fe) / m(см.) = 5,6 (г) / 17,4 (г) = 0,322,
ω(Al) = m(Al) / m(см.) = 5,4 (г) / 17,4 (г) = 0,31.
Ответ. ω(Сu) = 36,8 %; ω(Fe) = 32,2 %; ω(Al) = 31 %.
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| |||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Соляная кислота – Полное руководство
Определение
Соляная кислота представляет собой коррозионную кислоту, образующуюся при растворении хлороводорода (HCl) в воде, и поэтому представляет собой водный раствор галогеноводорода. Соляная кислота используется в различных отраслях промышленности в качестве очищающего, травильного или регулирующего рН раствора, а также содержится в разбавленной форме в желудочном соке. Хлористый водород иногда называют соляной кислотой, хлоридом гидроксония, хлораном, солевым спиртом или кислотным солевым раствором.
Применение соляной кислоты
Использование соляной кислоты варьируется от физиологических до промышленных. В промышленности сильные коррозионные свойства HCl и то, что она является простейшей кислотой на основе хлора, делают ее дешевым и эффективным, хотя и опасным и разрушительным соединением. Водный раствор должен находиться под давлением или охлаждаться , иначе он превратится в ядовитый газ, если водные компоненты испарятся и составят менее 60% всего раствора. Хотя полный список использования соляной кислоты занял бы много страниц, наиболее распространенные области применения более подробно обсуждаются ниже.
В промышленности
Промышленное использование соляной кислоты охватывает самые разные отрасли. Это важный ингредиент готовых промышленных товаров, таких как поливинилкарбонат (ПВХ), бисфенол А (БФА) и этилендихлорид (ЭДХ). BPA используется в производстве поликарбонатных пластиков и эпоксидных смол, но он опасен для здоровья из-за канцерогенного воздействия. По этой причине многие пластмассы в настоящее время производятся и рекламируются как продукты, не содержащие BPA. Все эти органические соединения используются в производстве пластмасс и в качестве лабораторных растворителей, но могут быть очень канцерогенными.
По этой причине многие пластмассы в настоящее время производятся и рекламируются как продукты, не содержащие BPA. Все эти органические соединения используются в производстве пластмасс и в качестве лабораторных растворителей, но могут быть очень канцерогенными.
Подготовка металла к дальнейшему производству включает один из двух аналогичных процессов: травление и пассивирование. В то время как пассивация обеспечивает более легкий эффект за счет использования слабокоррозионных кислот для удаления примесей, оставшихся во время производства металла, защиты металла от загрязняющих веществ, сглаживания поверхности и повышения долговечности, травление приводит к более сильному эффекту за счет использования сильной кислоты. Эта кислота обычно представляет собой хлористый водород. Металлы, обработанные в ваннах с хлористым водородом, называются металлами, протравленными HCl.
Соляная кислота часто используется на одной стадии обработки кожи на кожевенных заводах. Дубление шкур включает в себя введение соли хрома, чтобы изменить коллагеновую сеть внутри и избежать окрашивания в будущем. Во время этого процесса в ванну добавляют соли хрома при pH от 2,5 до 3 вместе с хлоридом натрия. Это этап травления. Затем хром закрепляется на шкуре, что повышает рН и является так называемой стадией подщелачивания. Для достижения низкого pH на стадии травления необходим хлористый водород.
Во время этого процесса в ванну добавляют соли хрома при pH от 2,5 до 3 вместе с хлоридом натрия. Это этап травления. Затем хром закрепляется на шкуре, что повышает рН и является так называемой стадией подщелачивания. Для достижения низкого pH на стадии травления необходим хлористый водород.
Другим применением хлористого водорода в промышленности является производство неорганических соединений, таких как хлорид полиалюминия (PAC), хлорид железа (III) (трихлорид железа) и хлоргидрат алюминия. Использование хлористого водорода необходимо в начале процессов производства этих соединений, например, при добавлении 20% HCl и серной кислоты к бокситу для производства ПАУ. Соли алюминия используются в косметической промышленности (например, в дезодорантах-антиперспирантах) или на этапах химической коагуляции и флокуляции при очистке питьевой воды и сточных вод, где добавленные катионы алюминия (или железа) нейтрализуют заряд коллоидных частиц загрязняющих веществ и позволяют им соединяться с образованием хлопья (флокуляция) их можно откачать.
HCl также используется для «очистки» соли, используемой в производстве продуктов питания и на наших столах. В насыщенном растворе NaCl существует постоянное равновесие между отдельными положительными ионами натрия и отрицательными ионами хлорида и неионизированным NaCl. При пропускании газообразного HCl через этот раствор он диссоциирует с образованием ионов H+ и Cl-. Поскольку ион хлорида является общим как для хлорида натрия, так и для хлороводорода, его концентрация увеличивается и создает сдвиг в соответствии с принципом Ле Шателье. Это означает, что доступные ионы натрия с большей вероятностью связываются с свободно доступным хлоридом с повышенным отложением NaCl в результате . Этот процесс называется очисткой соли. В качестве альтернативы вы можете добавить соляную кислоту к гидроксиду натрия (NaOH) или карбонату натрия (Na 2 Co 3 ), и обе реакции приведут к образованию соли хлорида натрия.
Естественно, сильная кислота, такая как хлористый водород, также используется для регулирования кислотности широкого спектра растворов, используемых в фармацевтических продуктах, в пищевых добавках, включая фруктозу, лимонную кислоту и гидролизованный растительный белок, в щелочных отходах и в наша питьевая вода.
Соляная кислота также используется для увеличения добычи нефти в нефтяных скважинах. При закачке в основную породу он образует более крупные поры, способные транспортировать больше нефти в скважину. Это лишь некоторые из наиболее распространенных применений соляной кислоты в промышленности.
В быту
Использование соляной кислоты в быту ограничено более низкими концентрациями, которые менее агрессивны, но при этом демонстрируют замечательные очищающие и регулирующие pH характеристики. Те, у кого есть плавательные бассейны, могут попробовать смешать раствор десяти частей воды и одной части HCl для удаления пятен затирки для плитки.
Этот же раствор удаляет пятна с металлов и поэтому используется в продуктах для очистки железа, меди, латуни и других металлов. Эффекты аналогичны травлению стали, окисляя поверхностные слои для удаления пятен и загрязнений. Большинство кислот, включая хлористый водород, также удаляют отложения известкового налета, но следует обращать внимание на используемую концентрацию. Большинство мощных чистящих средств, которые мы используем дома, содержат HCl. Если вы пролили соляную кислоту на деликатную поверхность, добавьте пасту из двууглекислой соды и воды, чтобы нейтрализовать ее; подготовьте его и держите под рукой, чтобы избежать максимального повреждения.
Большинство мощных чистящих средств, которые мы используем дома, содержат HCl. Если вы пролили соляную кислоту на деликатную поверхность, добавьте пасту из двууглекислой соды и воды, чтобы нейтрализовать ее; подготовьте его и держите под рукой, чтобы избежать максимального повреждения.
Кислотно-основные реакции часто используются для создания реакции шипения, которая, как говорят, увеличивает мощность кислотного чистящего средства; тем не менее, вы только ускоряете реакцию, добавляя щелочь, тогда как в идеале добавленная кислота должна работать, чтобы нейтрализовать щелочи на грязной поверхности. Соляная кислота реагирует с большинством карбонатов и металлов, например, с карбонатом кальция с образованием хлорида кальция, двуокиси углерода и воды или с магнием с образованием хлорида магния, двуокиси углерода и воды.
В человеческом организме
Желудок является местом ранних стадий пищеварения, но играет не менее важную роль, поскольку потенциальные патогенные микроорганизмы, которые могли быть проглочены, удаляются из-за очень кислой среды между 1,5-3,5 рН. Такой уровень кислотности является результатом выработки желудочным соком хлористого водорода.
Такой уровень кислотности является результатом выработки желудочным соком хлористого водорода.
В организме человека HCl вырабатывается париетальными клетками слизистой оболочки желудка. Цитоплазма париетальных клеток соединяется с водой и углекислым газом с образованием угольной кислоты. Фермент карбоангидраза превращает один ион угольной кислоты в один ион водорода (H + ) и один ион бикарбоната (HCO3 – ). Ион водорода транспортируется в желудок через H + – K + АТФазный канал, обменивая положительные внеклеточные ионы калия на положительные внутриклеточные ионы водорода. В то же время ионы бикарбоната транспортируются из клетки в кровь через анионообменник, который обменивает ионы бикарбоната на отрицательные ионы хлора. Париетальные клетки также имеют хлоридные каналы в своих мембранах. Отрицательные ионы хлора транспортируются в желудок при повышении внутриклеточной концентрации.
Париетальная клетка В результате этого процесса в желудке появляются ионы водорода и хлора. Как отрицательные и противоположные ионы, они притягиваются и образуют соляную кислоту. Соляная кислота является важным компонентом желудочного сока, необходимым для устранения широкого спектра потенциально патогенных бактерий до того, как содержимое желудка попадет в высокоабсорбирующую среду кишечника.
Как отрицательные и противоположные ионы, они притягиваются и образуют соляную кислоту. Соляная кислота является важным компонентом желудочного сока, необходимым для устранения широкого спектра потенциально патогенных бактерий до того, как содержимое желудка попадет в высокоабсорбирующую среду кишечника.
Организм человека может регулировать выработку соляной кислоты за счет непроизвольной стимуляции нейронов, в первую очередь во время стимуляции блуждающего нерва, когда пища видна или пережевывается. По мере того, как пища достигает желудка и желудок растягивается, возбуждение нервов также стимулирует блуждающий нерв к выработке большего количества ацетилхолина, который увеличивает секрецию, такую как слюна и желудочный сок, и усиливает перистальтику кишечника. Третьим и основным методом является секреция гастрина G-клетками слизистой оболочки желудка, активируемая аналогичным образом блуждающим нервом, а также пептидами, продуцируемыми желудком, такими как родственный гастрину пептид. Гастрин — это гормон, который через кровь попадает в париетальные клетки, где они связываются с гормонами холецистокинином (CKK) посредством CKK 9.0068 B и является частью связи между кишечником и мозгом, которая контролирует чувство сытости и аппетит.
Гастрин — это гормон, который через кровь попадает в париетальные клетки, где они связываются с гормонами холецистокинином (CKK) посредством CKK 9.0068 B и является частью связи между кишечником и мозгом, которая контролирует чувство сытости и аппетит.
При повышенной продукции гастрина и ацетилхолина происходит еще одна реакция в виде высвобождения гистамина из энтерохромаффиноподобных клеток (ECL-клеток), которые располагаются вблизи париетальных клеток в слизистой оболочке желудка. Этот гистамин связывается с рецепторами париетальных клеток, побуждая их вырабатывать больше желудочной кислоты.
Слизистая оболочка желудка Противоположный эффект – снижение выработки соляной кислоты – возникает в периоды голодания, когда в желудке нет пищи и повышается кислотность. Высокая кислотность останавливает выделение водорода и ионов хлора париетальной клеткой . Он также стимулирует D-клетки к выработке соматостатина, который снижает выработку гормона гастрина. Попадание пищи в двенадцатиперстную кишку также вызывает рефлекс, известный как энтерогастральный рефлекс, нервный путь кишечной нервной системы, который снижает стимуляцию блуждающего нерва. Пища в кишечнике также снижает доступность (и, следовательно, действие) холецистокинина, а также секретина, который снижает продукцию кислых компонентов желудочного сока и повышает продукцию щелочных компонентов. Поэтому можно с уверенностью сказать, что секреция соляной кислоты в пищеварительной системе регулируется гормональными и нервными путями, включающими гастрин, гистамин, соматостатин, ряд полипептидов и блуждающий нерв.
Попадание пищи в двенадцатиперстную кишку также вызывает рефлекс, известный как энтерогастральный рефлекс, нервный путь кишечной нервной системы, который снижает стимуляцию блуждающего нерва. Пища в кишечнике также снижает доступность (и, следовательно, действие) холецистокинина, а также секретина, который снижает продукцию кислых компонентов желудочного сока и повышает продукцию щелочных компонентов. Поэтому можно с уверенностью сказать, что секреция соляной кислоты в пищеварительной системе регулируется гормональными и нервными путями, включающими гастрин, гистамин, соматостатин, ряд полипептидов и блуждающий нерв.
В боевых действиях
Использование соляной кислоты в боевых действиях чаще всего связано с производством и воздействием горчичного газа или сернистого иприта, использовавшихся в траншейных войнах во время Первой мировой войны, , но недавно она использовалась в гражданской войне в Сирии , несмотря на то, что Конвенция о химическом оружии запретила его использование в 1993 году. Обычно не смертельно, если воздействие не происходит в высоких концентрациях через равные промежутки времени, это вещество, образующее волдыри, поражает кожу и слизистые оболочки дыхательных путей и пищеварительного тракта, вызывая ожоги, отек, раздражение и гнойные пузыри. Горчичный газ также вызывает мутации в ДНК и является известным канцерогеном. Противоядия нет.
Обычно не смертельно, если воздействие не происходит в высоких концентрациях через равные промежутки времени, это вещество, образующее волдыри, поражает кожу и слизистые оболочки дыхательных путей и пищеварительного тракта, вызывая ожоги, отек, раздражение и гнойные пузыри. Горчичный газ также вызывает мутации в ДНК и является известным канцерогеном. Противоядия нет.
Используются различные методы производства горчичного газа, но только один из них – метод Мейера-Кларка – использует концентрированную соляную кислоту.
Другим газом, используемым в войне, является фосген, имеющий формулу COCl 2 . В отличие от горчичного газа, имеющего слегка зеленовато-желтый оттенок, фосген бесцветен и пахнет свежескошенным сеном. Это результат угарного газа, активированного угля и газообразного хлора. Соляная кислота не используется в производстве фосгена, но создается в присутствии воды . Вода содержится в большом количестве в слизистых оболочках. Это означает, что при вдыхании или проглатывании фосген превращается в угольную и соляную кислоту. В то время как горчичный газ привел к ряду смертельных случаев, говорят, что по крайней мере 80 000 смертельных случаев во время Первой мировой войны были вызваны более резкими и более непосредственными эффектами фосгена. Это примерно 85% от общего числа смертей, связанных с химическим оружием, за этот период.
В то время как горчичный газ привел к ряду смертельных случаев, говорят, что по крайней мере 80 000 смертельных случаев во время Первой мировой войны были вызваны более резкими и более непосредственными эффектами фосгена. Это примерно 85% от общего числа смертей, связанных с химическим оружием, за этот период.
Соляная кислота Факты
Хлороводород представляет собой соединение, состоящее из водорода и хлора в соотношении один к одному . Без присутствия молекул воды хлористый водород представляет собой бесцветный, но ядовитый газ. При добавлении воды водород высвобождает многие из своих молекул водорода, образуя очень кислый раствор. Чуть более 97% молекулярной массы HCl приходится на один хлорид-ион. Этот ион хлорида имеет атомную массу 35,543, а ион водорода — атомную массу 1,00794. Поскольку у каждого есть только один атом, молярная масса HCl рассчитывается путем сложения этих двух цифр — 36,46094 г / моль. Как уже было сказано, формула хлористого водорода – HCl.
В случае молекулярной массы результаты зависят от количества молей HCl. Например, в растворе, где имеется большое количество атомов растворенного газа хлорида (Cl 2 ) для числа атомов молекулярного водорода (H 2 ), мы можем с уверенностью сказать, что 4 моля HCl дадут 4,00 моля HCl. .
Используя уравнение Масса HCl = Моли HCl x Молярная масса HCl, мы можем определить, что 4,00 моль x 36,46 г моль -1 составляет 146 г.
Плотность соляной кислоты, pH, температура плавления и температура кипения зависят от концентрации. Например, 10%-й раствор HCl имеет плотность 1048 кг/л, рН -0,5, температуру плавления -18°С и точку кипения 103°С. 30% раствор HCl имеет плотность 1,149.кг/л, рН -1, температуры плавления и кипения -52°С и 90°С соответственно.
Обращение с соляной кислотой – рекомендации по паспорту безопасности материала
Соляная кислота является опасной жидкостью и имеет собственный паспорт безопасности материала (MSDS). Это информация, в которой перечислены факторы безопасности и гигиены труда, связанные с ее использованием, и она должна быть доступна и легкодоступна там, где находятся потенциально опасные материалы.
Это информация, в которой перечислены факторы безопасности и гигиены труда, связанные с ее использованием, и она должна быть доступна и легкодоступна там, где находятся потенциально опасные материалы.
Соляная кислота вызывает коррозию; концентрированные формы также выделяют токсичный кислотный туман. При попадании кислоты или тумана на кожу, глаза или внутренние органы любое повреждение может быть необратимым или даже смертельным. Хотя HCl не классифицируется как канцероген, для его промышленного использования требуются средства индивидуальной защиты , такие как респиратор, резиновые перчатки и сапоги, а также лицевой щиток. Кроме того, любые помещения, где используется соляная кислота, должны иметь доступ к системе промывки глаз. Даже при уборке в домашних условиях разведенными средствами попадание брызг в глаза или на кожу может вызвать ожоги.
Рекомендация MSDS при контакте соляной кислоты с кожей состоит в том, чтобы промыть пораженный участок в течение не менее 15 минут и снять все предметы одежды, на которые попал раствор. При видимых ожогах рекомендуется мытье с антибактериальным мылом или использование антибактериального крема, а также посещение медицинского центра. При контакте с глазами требуется система промывки, которая промывает пораженный глаз в течение не менее 15 минут и требует медицинской помощи.
При видимых ожогах рекомендуется мытье с антибактериальным мылом или использование антибактериального крема, а также посещение медицинского центра. При контакте с глазами требуется система промывки, которая промывает пораженный глаз в течение не менее 15 минут и требует медицинской помощи.
Проглатывание соляной кислоты любой концентрации может вызвать ожоги внутренней части рта, горла и пищевода. Несмотря на то, что желудочный сок очень кислый, он остается в резервуаре желудка. Нарушение пищеварения, вызванное попаданием желудочного сока в нижний отдел пищевода, может вызвать эзофагит Барретта и увеличить риск рака пищевода. Распространенным заболеванием желудочно-кишечного тракта является гастроэзофагеальная рефлюксная болезнь или ГЭРБ . На изображении ниже показаны признаки и симптомы этой часто болезненной патологии. При проглатывании HCl важно не вызвать рвоту, а вместо этого немедленно обратиться за медицинской помощью. Вдыхание тумана HCl также требует посещения отделения неотложной помощи.
Информация о хранении в паспорте безопасности указывает на то, что соляная кислота должна храниться в закрытом и подходящем контейнере в прохладном, сухом и хорошо проветриваемом помещении. Его также следует держать вдали от органических материалов, окислителей, металлов и щелочей, поскольку он может вступать с ними в реакцию и повышать концентрацию горючего газообразного водорода.
Тест
1. Какие из следующих органических соединений выводятся из производства пластмасс?
A. Фосген
B. BPA
C. Серная кислота
D. HCl
Ответ на вопрос №1
B правильно. BPA или бисфенол А является канцерогеном, используемым в производстве пластмасс и смол. Многие пластмассы в настоящее время не содержат BPA, и эта тенденция, несомненно, сохранится.
2. Что нужно сделать в первую очередь, если вы проглотили хлористый водород?
A. Пейте много воды
Пейте много воды
B. Рвота
C. Выпить раствор бикарбоната
D. Обратиться за медицинской помощью
Ответ на вопрос № 2
D верно. Питьевая вода содержит дополнительные молекулы водорода и может повышать уровень кислотности, но, что более важно, кислота только дальше попадает в пищевод и увеличивает площадь поврежденной поверхности. Рвота повышает кислотность из-за присутствия желудочного сока. Бикарбонаты или щелочные продукты вызовут летучую реакцию, возможно перфорацию желудочно-кишечного тракта. Медицинское лечение имеет важное значение с вмешательствами, начиная от промывания желудка до интубации и перевода в отделение интенсивной терапии.
3. Где происходят коагуляция и флокуляция в пересчете на HCl?
A. Травление металлов
B. Водоподготовка
C. Лечение ожогов
D. Очистка солей
Очистка солей
Ответ на вопрос # 3
B правильно. Коагуляция и флокуляция загрязняющих веществ в воде позволяют легче их удалять, обеспечивая менее загрязненную воду.
4. Какие клетки продуцируют гастрин?
A. Париетальные клетки
B. Т-клетки
C. G-клетки
D. ECL-клетки
Ответ на вопрос №4 90 014
C правильно. ECL-клетки продуцируют гистамин, Т-клетки участвуют в иммунитете, париетальные клетки выделяют ионы водорода и хлора, внутренний фактор. Буква G указывает нам правильное направление — G-клетки производят гастрин.
5. Какой черепной нерв принимает наибольшее участие в регуляции продукции желудочного сока?
A. Блуждающий нерв
B. Отводящий нерв
C. Подъязычный нерв
D.

 Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна __________ г.
Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна __________ г. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2 равна __________ г. (Запишите число с точностью до целых.)
Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2 равна __________ г. (Запишите число с точностью до целых.) )
) 32,15 г алюминия растворили в избытке водного раствора едкого натра. Рассчитайте объём (н.у.) выделившегося в результате этой реакции газа. (Ответ запишите с точностью до целых.)
32,15 г алюминия растворили в избытке водного раствора едкого натра. Рассчитайте объём (н.у.) выделившегося в результате этой реакции газа. (Ответ запишите с точностью до целых.) )
) Рассчитайте массу осадка, образующегося при взаимодействии избытка раствора нитрата бария с раствором, содержащим 7,84 г серной кислоты. (Запишите число с точностью до десятых.)
Рассчитайте массу осадка, образующегося при взаимодействии избытка раствора нитрата бария с раствором, содержащим 7,84 г серной кислоты. (Запишите число с точностью до десятых.) (Запишите число с точностью до десятых.)
(Запишите число с точностью до десятых.) При взаимодействии кальция с водой образовался гидроксид кальция количеством 0,3 моль. Какой объём (н.у.) водорода при этом выделился? (Запишите число с точностью до сотых.)
При взаимодействии кальция с водой образовался гидроксид кальция количеством 0,3 моль. Какой объём (н.у.) водорода при этом выделился? (Запишите число с точностью до сотых.) (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.) Объем (н.у.) оксида углерода (IV), который необходимо пропустить через раствор гидроксида кальция для получения 8,1 г гидрокарбоната кальция, равен _____л. (Ответ запишите с точностью до сотых.)
Объем (н.у.) оксида углерода (IV), который необходимо пропустить через раствор гидроксида кальция для получения 8,1 г гидрокарбоната кальция, равен _____л. (Ответ запишите с точностью до сотых.) (Запишите число с точностью до целых.)
(Запишите число с точностью до целых.) При растворении сульфида железа (II) в избытке соляной кислоты выделилось 11,2 л(н.у.) газа. Масса сульфида железа (II) равна _______г. (Запишите число с точностью до целых.)
При растворении сульфида железа (II) в избытке соляной кислоты выделилось 11,2 л(н.у.) газа. Масса сульфида железа (II) равна _______г. (Запишите число с точностью до целых.)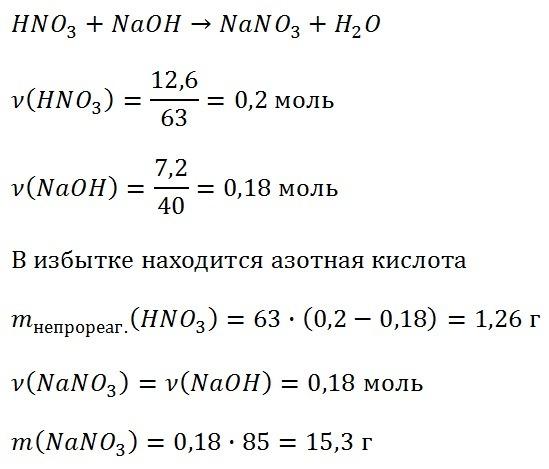 )
) Масса соли, образовавшейся при растворении оксида железа (III) массой 40 г в избытке азотной кислоты, равна________г. (Запишите число с точностью до целых.)
Масса соли, образовавшейся при растворении оксида железа (III) массой 40 г в избытке азотной кислоты, равна________г. (Запишите число с точностью до целых.)
 Твердый оксидный остаток
полностью реагирует с некоторым количеством соляной кислоты. Что
масса гидроксида натрия также будет реагировать точно с этим количеством
соляной кислоты?
Твердый оксидный остаток
полностью реагирует с некоторым количеством соляной кислоты. Что
масса гидроксида натрия также будет реагировать точно с этим количеством
соляной кислоты?  Элемент X имеет
атомный вес 75. Если 0,0333 моль X соединить с Y (1,60
г), рассчитать:
Элемент X имеет
атомный вес 75. Если 0,0333 моль X соединить с Y (1,60
г), рассчитать:  Определение молекулярной массы дало значение 198.
Какова молекулярная формула твердого вещества? Напишите уравнение для
реакция между фтором и сульфидом олова(II).
Определение молекулярной массы дало значение 198.
Какова молекулярная формула твердого вещества? Напишите уравнение для
реакция между фтором и сульфидом олова(II).  Что такое эмпирический
формула соединения?
Что такое эмпирический
формула соединения? 



 ) Из уравнения, 1 моль C 8 H 18 требуется 12,5 моль O 2 для сжигания. Поэтому родинки
O 2 требуется для сжигания 25 молей C 8 H 18 = 25 х 12,5 моль
) Из уравнения, 1 моль C 8 H 18 требуется 12,5 моль O 2 для сжигания. Поэтому родинки
O 2 требуется для сжигания 25 молей C 8 H 18 = 25 х 12,5 моль






 (Обратите внимание, что все углеводы имеют
та же эмпирическая формула — отсюда и название «углевод».)
(Обратите внимание, что все углеводы имеют
та же эмпирическая формула — отсюда и название «углевод».)


Leave A Comment