Кислоты
3. КИСЛОТЫ
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотных остатков.
С точки зрения теории электролитической диссоциации кислоты это электролиты, диссоциирующие в водных растворах на катионы только водорода Н+ и анионы кислотных остатков.
Если кислота одноосновная, то она диссоциирует в одну ступень:
HCI H+ + CI
HNO3 H+ + NO3
Если кислота многоосновная, то она диссоциирует ступенчато:
H3PO4 H+ + H2PO4 (первая ступень),
H2PO4 H+ + HPO42 (вторая ступень),
HPO42 H+ + PO43 (третья ступень).
Ступенчатой
диссоциацией
многоосновных
кислот
объясняется
образование
кислых солей.
Номенклатура кислот.
1. Бескислородные кислоты
В бескислородных кислотах называется кислотообразующий элемент и добавляется окончание водородная:
HCl хлороводородная кислота
H2S сероводородная кислота
2. Кислородосодержащие кислоты.
Составление названий кислородосодержащих кислот рассмотрим на следующих примерах:
H2SO4 серная кислота,
H3AsO4 мышьяковая кислота.
Называется кислотообразующий элемент с суффиксом н или ов (если степень окисления элементов максимальная).
Если степень окисления элемента промежуточная, то в названии используется еще и суффикс
H2SO3 сернистая кислота,
H3AsO3 мышьяковистая кислота.
Когда элемент образует много кислородсодержащих кислот (например, хлор), то, по мере убывания степени окисления кислотообразующего элемента, они имеют следующие названия:
HO4 хлорная кислота;
HO3 хлорноватая кислота;
HO2 хлористая кислота;
HO
хлорноватистая
кислота.
Иногда в молекулах кислородосодержащих кислот элемент имеет одинаковую степень окисления, тогда в названии используются приставки, которые указывают на различное содержание воды в кислоте:
мета — мало воды,
орто — много воды.
Например:
P2O5 + H2O → 2HO3 метафосфорная кислота,
P2O5 + 3H2O → 2H3O4 ортофосфорная кислота.
При составлении формул придерживаются следующих правил:
1. Бескислородные кислоты.
Зная название кислоты, записываем сначала водород, а затем кислотообразующий элемент. Степень окисления водорода в кислотах всегда +1. Степень окисления элемента отрицательная. Она равна номеру группы ПСЭ (в которой находится элемент) минус восемь.
Например:
сероводородная
кислота
элемент сера,
расположен в
шестой
группе ПСЭ. 6 — 8 = -2.
Степень
окисления серы
2. Записываем
символы
водорода и
серы Н+S-2, т. к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
к.
молекула электронейтральна,
то формула
кислоты
будет Н2S.
2. Кислородсодержащие кислоты.
По суффиксам в названии кислоты определяем степень окисления кислотообразующего элемента. Эта степень окисления сохраняется в кислотном оксиде. По приставке в названии определяем количество воды в кислоте.
Например: метафосфорная кислота кислотообразующий элемент фосфор. Суффикс н показывает, что он имеет максимальную степень окисления, фосфор в пятой группе ПСЭ, следовательно, максимальная степень окисления +5, она сохраняется и в оксиде фосфора Р2+5О5-2. Приставка мета говорит о том, что воды в кислоте минимальное количество.
В формулах кислородосодержащих кислот сначала записывается водород, затем кислотообразующий элемент и кислород. Индексами выравнивают число положительных и отрицательных зарядов. Если они четные, то их сокращают и ставят перед формулой соответствующий коэффициент.
+5 -2
P2O5 + H2O → H2P2O6 → 2HPO3 метафосфорная кислота,
+5 -2
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота,
+5 -2
P2O5 + 3H2O →
H6P2O8 →
2H3PO4
ортофосфорная
кислота.
Классификация кислот по следующим признакам:
По содержанию кислорода:
HNO3, H2SO4, H3PO4 HCl, HJ, H2S
По основности
(по числу атомов водорода в молекуле кислоты)
1. Одноосновные 2. Многоосновные
HCl, HNO3, HBr H2SO4, H3PO4, H2S
По силе (по степени диссоциации)
1. Сильные (α =100 %)
2. Слабые (α < 100 %)
Слабые (α < 100 %)
HCl, HNO3, H2SO4 H2S, HNO2, H2CO3
По растворимости
1. Растворимые 2. Нерастворимые
Получение
1. Бескислородные кислоты получают синтезом из простых веществ летучих соединений с последующим растворением их в воде. Например:
H2 + Cl2 → 2HCl хлороводород, газ. Растворяем его в воде, получаем HCl хлороводородную кислоту жидкость.
2. Растворение соответствующего оксида в воде:
P2O5 + 3H2O → 2H3PO4

3. Электролиз растворов солей:
Na2SO4 + 4H2O H2SO4 +2H2+O2+2NaОН.
4. Взаимодействие растворимой соли с сильной кислотой (получают нерастворимые, легколетучие, слабые кислоты):
Na2SiO3 + 2HCl → 2NaCI + H2SiO3
H2O
Na2CO3 + 2HCl → 2NaCI + H2 CO3
CO2
Физические свойства
Большинство
неорганических
кислот жидкости,
смешивающиеся
с водой в
любых соотношениях,
затвердевающие
при низких
температурах;
фосфорная
кислота —
кристаллическое,
похожее на
лед вещество,
хорошо
растворяется
в воде. Кремниевая
кислота
твердое
вещество,
нерастворимое
в воде.
Некоторые
кислоты
существуют
только в
растворе H2Cr2O7, HMnO4. Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Их гидратированные
анионы
окрашены в
характерные
цвета: оранжевый,
фиолетовый.
Наконец,
такие
кислоты, как хлороводородная,
бромоводородная
летучие,
поэтому
обладают
резким
запахом.
Кислоты
имеют кислый
вкус.
Химические свойства
1. Изменение цвета индикаторов:
фенолфталеин бесцветный,
лакмус розовый,
метилоранж красный.
2. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + 2NaOH → Na2SO4 + 2H2O.
3. Взаимодействие с основными оксидами:
H2SO4 + Na2O → Na2SO4 + 2H2O.
4. Взаимодействие с солями:
а) менее летучие кислоты вытесняют более летучие из их солей:
конц. тверд.
тверд.
б) более сильные кислоты вытесняют менее сильные из растворов их солей:
3HCI + Na3PO4 → 3NaCI + H3PO4.
5. Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы металл — ион металла.
Li К Ca Мg Al Ti Cr Zn Fe Ni Sn Pb H Cu Ag Au
Исходя из этого, все металлы удобно разделить на три условные группы:
Активные | Средней активности | Малоактивные |
Li К Ca Мg Al | Ti Cr Zn Fe Ni Sn Pb | Cu Ag Au |
Взаимодействие металлов с хлороводородной кислотой
.
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn +2HCI → ZnCI2 + H2
Щелочные и щелочноземельные металлы с растворами кислот взаимодействуют в две стадии:
Na + HCI NaCI + H2
1).2Na + 2H2O → 2NaОН + H2
2). NaОН + HCI→ NaCI + H2O.
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + HCl
Взаимодействие металлов с разбавленной серной кислотой
Активные | Средней
актив. | Малоактивные |
Реагируют | Реагируют (пассивируется Pb) | Не реагируют |
Например:
Zn + H2SO4 → ZnSO4 + H2
Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют:
Cu + H2SO4
Взаимодействие металлов с концентрированной серной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Al, Fe) | Реагируют Сu, Hg не реагируют Ag, Au, Pt |
В результате взаимодействия образуются сульфат металла, вода и один из продуктов окисления серной кислоты:
S , H2S, SO2 | S , H2S, SO2 | SO2 |
Например: Zn + 2H2SO4(К) → ZnSO4 + SO2 + 2H2O,
4Zn + 5H2SO4(К) → 4ZnSO4 + H2S + 4H2O,
3Zn + 4H2SO4(К) → 3ZnSO4 + S + 4H2O,
2H2SO4(к) + Сu → Сu SO4 + SO2 + 2H2O.
Холодная концентрированная серная кислота пассивирует Al, Fe; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой протекает интенсивно.
Взаимодействие металлов с разбавленной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируется Ti) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и один из продуктов окисления азотной кислоты:
NH3, NH4NO3 | N2 или N2O | NO |
Например:
10HNO3 + 4Mg → 4Mg(NO3)2 + NH4NO3 + 3H2O.
Взаимодействие металлов с концентрированной азотной кислотой
Активные | Средней активности | Малоактивные |
Реагируют | Реагируют (пассивируются Ti, Al, Cr, Fe) | Реагируют Сu, Hg Ag, не реагируют Au, Pt |
В результате взаимодействия образуются нитрат металла, вода и NO2 (газ бурого цвета). При взаимодействии с кислотой активных металлов возможно выделение N2O.
Например:
4HNO3 + Сu → Сu (NO3)2 + 2NO2 +
2H2O.
10HNO3 + 4Са → 4Са (NO3)2 + N2O + 5H2O.
При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется.
Холодная концентрированная азотная кислота пассивирует следующие металлы Fe, Cr, Al, Ti, но при нагревании взаимодействие этих металлов с кислотой протекает энергично.
6. Взаимодействие с неметаллами азотной и концентрированной серной кислот:
3P + 5HNO3 + 2H2O → 3H3PO4 + 5NO,
C + 2H2SO4(к) → CO2 + 2SO2 + 2H2O.
7. При нагревании некоторые кислоты разлагаются:
H2SiO3 H2O + SiO2.
Ход работы:
Опыт
№ 1.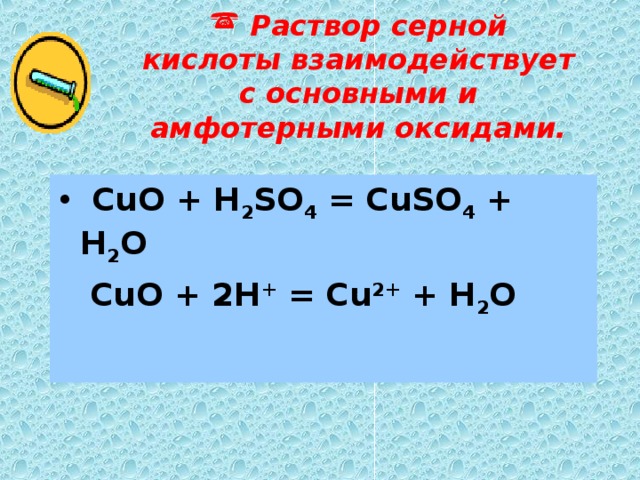 Взаимодействие
кислотного
оксида
Взаимодействие
кислотного
оксида
с водой
Стеклянной палочкой взять кусочек оксида фосфора (V) и смешать его с небольшим количеством воды. В полученный раствор добавить 23 капли лакмуса. Написать уравнение реакции.
Опыт № 2. Взаимодействие соли с кислотой
Положить в пробирку немного сухого ацетата натрия
CH3COONa или другой соли уксусной кислоты и добавить небольшое количество разбавленной серной кислоты. Образовавшаяся кислота может быть обнаружена по запаху. При выяснении запаха нельзя нюхать вещество прямо из пробирки, так как вдыхание газов и паров может вызвать сильное раздражение дыхательных путей. Необходимо ладонью руки сделать легкие движения от пробирки к носу. В этом случае в нос будет попадать смесь газа с воздухом и сильного раздражения не произойдет.
В
пробирку
внести 56
капель
концентрированного
раствора
силиката
натрия Na2SiO3 и постепенно
добавить 56
капель
соляной кислоты,
непрерывно
встряхивая
пробирку. Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Образуется
студнеобразный
осадок.
Подействовать
на
полученный
осадок
раствором
щелочи и
серной
кислоты. Отметить
изменения в
пробирках и
написать
уравнения
реакций.
Опыт № 3. Взаимодействие основного оксида с кислотой
К небольшому количеству оксида магния в пробирке прилить небольшое количество соляной кислоты. Отметить растворение осадка. Написать уравнения реакции. Какая соль образовалась?
Опыт № 4. Взаимодействие основания с кислотой
(реакция нейтрализации)
Налить в фарфоровую чашку 10 см3 2 моль/дм3 раствора гидроксида натрия. Добавить 12 капли фенолфталеина, чтобы окраска стала малиновой, что подтверждает наличие щелочи в растворе. Затем в пробирку по каплям добавлять раствор соляной кислоты, до обесцвечивания раствора. Выпарить содержимое чашки и убедиться, что образовалась соль. Написать уравнение реакции.
ОГЭ по химии | Задание 11
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22
Разбор сложных заданий в тг-канале:
Посмотреть
Задача 1
С разбавленной серной кислотой реагирует каждое из двух веществ:
- Cu и KNO3
- NaCl и Ag
- CaO и Au
- Zn и MgO
Задача 2
Вода будет образовываться при нагревании каждого из двух веществ:
- NaOH и Cu(OH)2
- Cu(OH)2 и H2SiO3
- NaOH и H2SO4
- NaHCO3 и KOH
Задача 3
С раствором гидроксида бария реагирует каждое из двух веществ:
- оксид меди(II) и гидроксид натрия
- оксид углерода(IV) и соляная кислота
- сероводород и серебро
- кремниевая кислота и во…
Задача 4
С соляной кислотой взаимодействует каждое из двух веществ в ряду:
- NaOH и Cu
- Ba(OH)2 и CO
- CuO и SO3
- Cu(OH)2 и Mg
Задача 5
Для гидроксида железа(II) характерно
- горение в кислороде
- взаимодействие с оксидом цинка
- взаимодействие с раствором хлорида калия
- термическое разложение
Задача 6
Разбавленная серная кислота не взаимодействует с каждым из двух веществ:
- гидроксидом натрия и нитратом кальция
- оксидом углерода(IV) и медью
- цинком и гидроксидом калия
- оксидом меди…
Задача 7
Раствор гидроксида калия вступает в реакцию с
- железом
- водородом
- оксидом серы(IV)
- хлоридом натрия
Задача 8
Среди продуктов реакции присутствуют газообразное вещество и вода при взаимодействии при обычных условиях
- алюминия и концентрированной азотной кислоты
- цинка и разбавленной серной …
Задача 9
С каждым из веществ: кальцием, карбонатом магния, серебром — может взаимодействовать кислота
- серная разбавленная
- соляная концентрированная
- азотная концентрированная
- фосфорная разб…
Задача 10
Гидроксид меди(II) вступает в реакцию
- соединения
- замещения
- разложения
- горения
Задача 11
Для растворения гидроксида железа(II) можно использовать разбавленный раствор
- гидроксида калия
- серной кислоты
- нитрата алюминия
- хлорида цинка
Задача 12
Раствор соляной кислоты реагирует с каждым из двух веществ:
- AgNO3 и Cu(OH)2
- Ag и CO2
- CuO и HBr
- BaBr2 и SO3
Задача 13
Ортофосфорная кислота может взаимодействовать с
- HCl и MgCl2
- S и Ca
- Cu и KOH
- Ca(OH)2 и MgCO3
Задача 14
Раствор соляной кислоты реагирует с каждым из двух веществ:
- Ca(NO3)2 и Ag
- Cu и H2SO3
- CO2(Р-Р) и SO3
- Na2O и Fe(OH)3
Задача 15
Раствор серной кислоты реагирует с каждым из двух веществ:
- BaCl2 и O2
- Zn(OH)2 и N2
- Fe и HCl
- Mg и Fe2O3
Задача 16
С гидроксидом кальция реагирует каждое из двух веществ:
- оксид меди(II) и гидроксид алюминия
- оксид углерода(IV) и фосфорная кислота
- йодоводород и кислород
- хлороводородная кислота и…
Задача 17
С раствором гидроксида натрия реагирует вещество, формула которого
- CuS
- NO
- H3PO4
- KNO3
Задача 18
Раствор соляной кислоты реагирует с каждым из двух веществ:
- AgNO3 и Cu(OH)2
- Cu и CO2
- MgO и HBr
- BaBr2 и SO2
Задача 19
При взаимодействии железа с концентрированной азотной кислотой при обычных условиях преимущественно образуются
- нитрат железа(III), водород
- вещества не взаимодействуют
- оксид азота(…
Задача 20
Гидроксид магния реагирует с
- гидроксидом меди(II)
- оксидом кальция
- хлоридом калия
- ортофосфорной кислотой
1 2
Популярные материалы
Как реагируют друг с другом оксид меди и серная кислота?
В этой статье мы подробно обсудим и ответим на все вопросы, связанные с реакцией оксида меди и серной кислоты.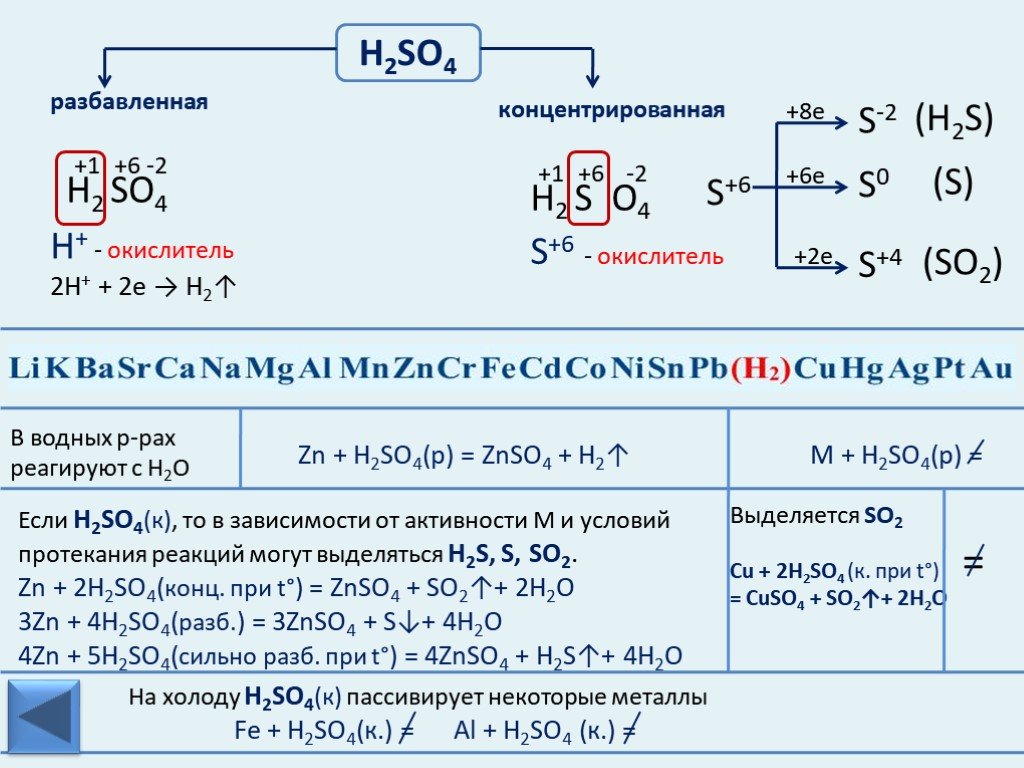 Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Реакция оксида меди с серной кислотой
Смешивание оксида меди и серной кислоты представляет собой эксперимент, включающий нерастворимый оксид металла , который реагирует с разбавленной кислотой с образованием растворимой соли . Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II.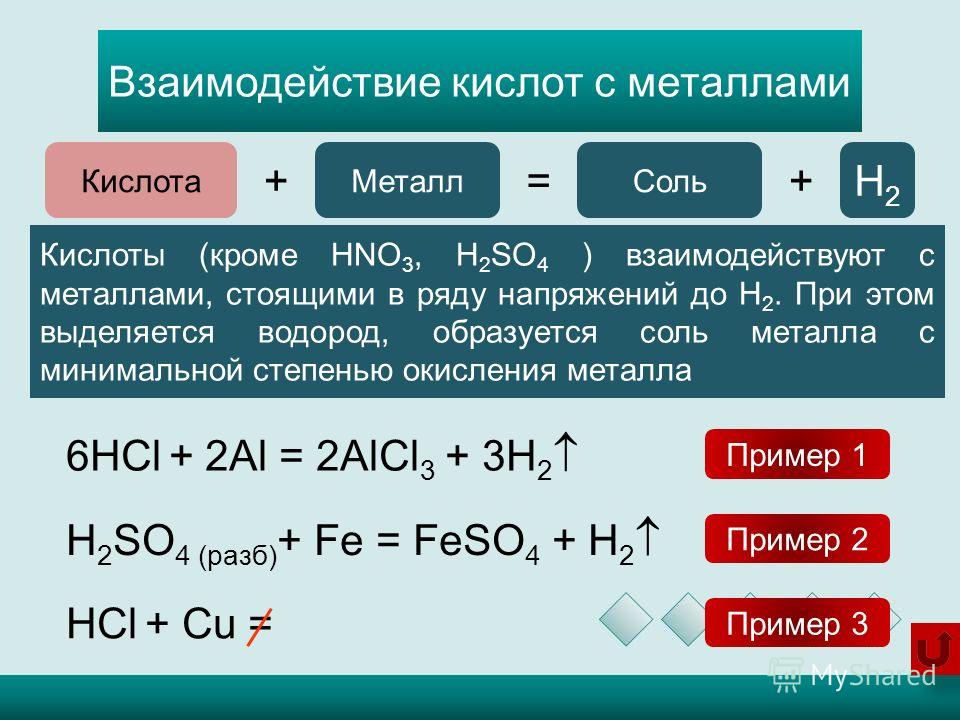 Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Написание уравнения оксида меди + серная кислота
Эту химическую реакцию можно записать следующим образом: ) Чтобы узнать, как сделать сульфат меди в домашних условиях, ознакомьтесь с этой статьей.
Что происходит, когда медь реагирует с концентрированной серной кислотой?
Восстановительный потенциал разбавленной серной кислоты выше, чем у водорода. Медь не способна вытеснять водород из неокисляющих кислот, например соляной или разбавленной серной кислоты. Другими словами, можно сказать, что медь не реагирует с разбавленной серной кислотой. Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Уравнение этой химической реакции приведено ниже:
Какое сбалансированное уравнение для оксида меди и серной кислоты?
Балансное уравнение оксида меди и серной кислоты приведено ниже:
Почему оксид меди и серная кислота окрашиваются в синий цвет?
Все мы знаем, что реакция оксида меди + серная кислота приводит к химическому веществу синего цвета. Но задумывались ли вы когда-нибудь, почему реакция оксида меди с серной кислотой приводит к химическому веществу синего цвета? Что ж, мы подробно ответим на этот вопрос здесь. Оксид меди представляет собой твердое вещество черного цвета. Когда он реагирует с серной кислотой, он производит химическое вещество голубовато-синего цвета, известное как сульфат меди. Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако природа расщепления между t2g и eg-орбиталями в этом новом комплексе такова, что он поглощает красновато-оранжевый свет.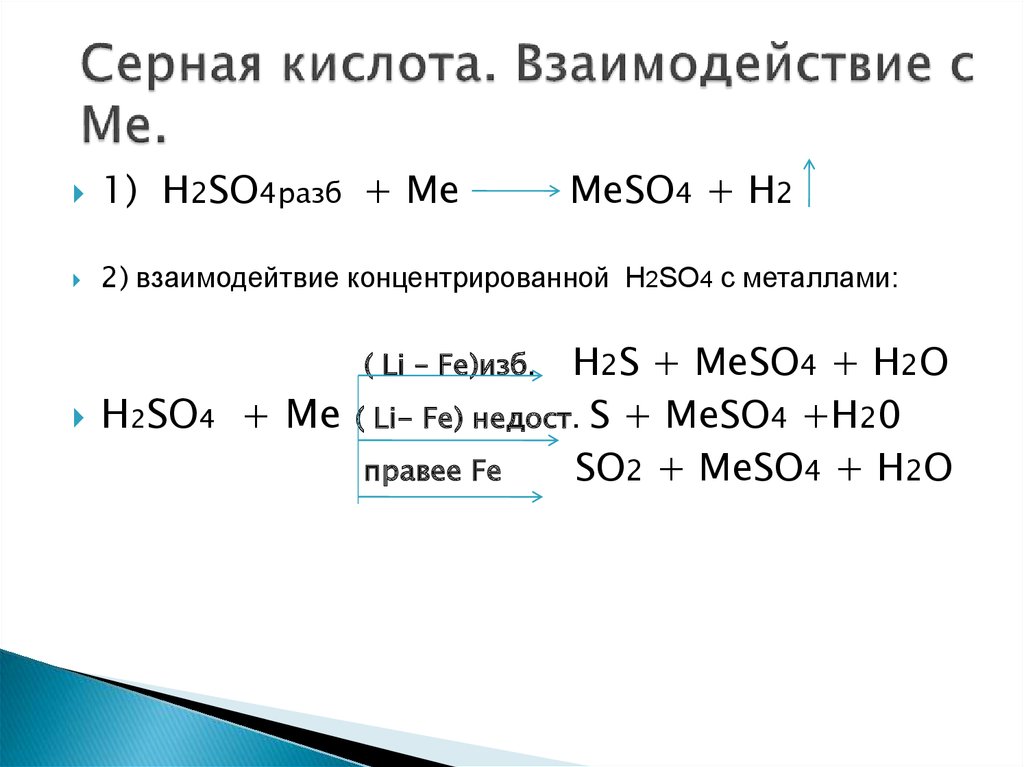 Из-за этого поглощения вы увидите раствор голубоватого цвета.
Из-за этого поглощения вы увидите раствор голубоватого цвета.
Растворяет ли серная кислота медь?
Нет, серная кислота не может растворить медь. Однако, если наблюдается растворение, это может быть вызвано одной из следующих двух причин:
- Существует вероятность того, что поверхность порошка металлической меди частично окислена до . Серная кислота может растворить окисленную поверхность меди
- Образование вихря при перемешивании. Небольшое количество воздуха (кислорода), введенное в выщелачивающий раствор, действовало как окислитель.
Какая соль образуется при взаимодействии оксида меди с соляной кислотой?
Реакция меди и соляной кислоты невозможна. Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Но оксид меди — это не металл, а оксид металла. Оксиды металлов являются основными веществами, которые могут реагировать с кислотами с образованием соли и воды. Эти кислотно-щелочные реакции также известны как нейтрализация и не являются окислительно-восстановительными по своей природе.
Будучи слабым основанием, оксид меди легко реагирует с HCl с образованием растворимого хлорида меди и воды. Уравнение этой химической реакции приведено ниже:


 Его реакции с металлами редко освещаются на уровне 14-16 лет.
Его реакции с металлами редко освещаются на уровне 14-16 лет.
 Таким образом, кислота, используемая здесь, более разбавлена, чем обычно.
Таким образом, кислота, используемая здесь, более разбавлена, чем обычно.
 Концентрированная соляная кислота 10 мол.
Концентрированная соляная кислота 10 мол.
 Включите государственные символы. Не укорачивайте это — вы должны уметь писать уравнения для простых реакций.
Включите государственные символы. Не укорачивайте это — вы должны уметь писать уравнения для простых реакций. 
Leave A Comment