Влияние концентрации азотной кислоты на состав продуктов ее восстановления при взаимодействии с медью Текст научной статьи по специальности «Химические науки»
УДК 546.562:546.175-323
ВЛИЯНИЕ КОНЦЕНТРАЦИИ АЗОТНОЙ КИСЛОТЫ НА СОСТАВ ПРОДУКТОВ ЕЕ ВОССТАНОВЛЕНИЯ ПРИ ВЗАИМОДЕЙСТВИИ С МЕДЬЮ
А.В. Коршунов*, С.В. Ковалева, В.П. Гладышев
*Томский политехнический университет. E-mail: [email protected] Томский государственный педагогический университет
Изучен процесс растворения меди в азотной кислоте различной концентрации с применением кинетического метода и количественного определения продуктов реакции в жидкой и газовой фазах. На основании полученных данных предложена схема механизма взаимодействия меди с азотной кислотой.
Реакции металлов с азотной кислотой изучаются достаточно давно и широко используются в технологиях химического травления и полировки изделий из металлов и сплавов. Высокие значения окислительно-восстановительных потенциалов растворов азотной кислоты позволяют проводить не только технологические операции удаления оксидных пленок с поверхности металлов, но и осуществлять размерную обработку изделий сложной формы из электроположительных металлов и сплавов на их основе. Пассивирующее действие концентрированных растворов азотной кислоты используется на практике для увеличения химической устойчивости поверхности изделий из алюминия, железа, хрома [1].
Еще из ранних исследований известно [2], что азотная кислота при взаимодействии с металлами восстанавливается с образованием широкого спектра веществ: азотистой кислоты, оксидов азота, молекулярного азота, ионов аммония и гидрок-силаминия. Образование того или иного продукта восстановления HNO3 принято связывать лишь с активностью металла и концентрацией кислоты.
что эти вещества замедляют процесс в растворах HNO3 с низкой (4.6 М) концентрацией. Есть указания, что на скорость взаимодействия меди с HNO3 оказывает влияние насыщение раствора монокси-дом азота [8], введение в раствор нитритов [2]. В работах [2, 5, 7] указывается, что процесс имеет автокаталитический характер. В целом, анализ литературы показывает, что единого взгляда на механизм взаимодействия меди (а также и других металлов) с азотной кислотой нет до сих пор.
Целью настоящей работы являлось изучение кинетики процесса растворения меди в азотной кислоте и количественного определения продуктов ее восстановления.
Кинетику растворения меди в растворах 4,0.14,8 М HNO3 изучали гравиметрическим методом. В эксперименте использовали пластины из электролитической меди площадью 24.29 см2 и толщиной 0,2 мм, в каждой из них просверливали отверстие диаметром 2 мм. Площадь торцов пластин не учитывали. Пластины шлифовали мелкой наждачной бумагой, несколько секунд травили в 12 М растворе HNO3 и промывали последовательно в воде и спирте. При помощи стеклянного крючка медную пластину помещали в предварительно термостатированный раствор HNO3 определенной концентрации объемом 200 мл. По истечении заданного интервала времени пластину вынимали из раствора, промывали в дистиллированной воде, сушили и взвешивали. В каждом опыте использовали новую пластину и свежеприготовленный раствор HNO3. Все опыты повторяли трижды. По изменению массы пластины рассчитывали среднюю скорость растворения металла.
Зависимость скорости растворения меди от концентрации HNO3 в растворах при 20 °С представлена на рис. 1 (кривая 1). Установлено, что порядок реакции по общей концентрации HNO3 равен двум. При изучении кинетики процесса найдено, что в 4.8 М растворах HNO3 наблюдается период индукции, в течение которого растворения меди не происходит: в
4 М НШ3 — около 100 с, в 6 М — около 15 с, в 8 М —
5 с. с 18
с 18
14
10
c(NOpH), М
Рис. 1. Зависимость скорости растворения меди (1) и концентрации недиссоциированных молекул NO2OH (2) от общей концентрации HNO3
Известно, что при концентрации HNO3 4 М и более в растворе присутствуют недиссоциирован-ные молекулы NO2OH [10]. Между концентрацией NO2OH и скоростью растворения меди в HNO3 существует определенная зависимость (рис. 1, кривая
2 построена по данным [10]). Порядок реакции, найденный из зависимости скорости реакции от концентрации NO2OH, равен единице. Значения эффективной энергии активации процесса, найденные из зависимости скорости реакции от температуры в интервале 25.65 °С в растворах HNO3 с концентрацией 6 и 12 М, в среднем составляют 25 кДж/моль (25.45 °С) и 80 кДж/моль (45.65 °С). Очевидно, что изменение величины эффективной энергии активации для разных температурных интервалов связано со сменой лимитирующей стадии механизма процесса с ростом температуры. Относительно низкая величина Еэф в интервале температур 25.45 °С соответствует диффузионно-контролируе-мому протеканию реакции, возрастание Еэф в интервале температур 45.65 °С свидетельствует о переходе к кинетически контролируемому процессу.
Для выяснения влияния промежуточных продуктов восстановления HNO3 на скорость ее взаимодействия с медью нами изучено влияние добавок мочевины и сульфаминовой кислоты в 12 М раствор HNO3. Процесс проводили без принудительного перемешивания при 25 и 45 °С. Содержание добавок изменяли в интервале 5.25 г/л. Найдено, что при максимальном содержании добавок в растворе скорость взаимодействия меди с HNO3 снижается в среднем в
1,5 раза. N2 + h3SO4 + h3O.
N2 + h3SO4 + h3O.
Сопоставление наших результатов с литературными данными [7] показывает, что эффект снижения скорости растворения меди в присутствии мочевины в 12 М HNO3 проявляется намного слабее, чем при введении мочевины в 1.5 М растворы. Вероятно, в концентрированных растворах HNO3 происходит быстрое разложение HNO2 на оксиды (NO и NO2), которые в условиях проведения реакции практически не взаимодействуют с аминогруппами мочевины и сульфаминовой кислоты. Полученные данные свидетельствуют о том, что основным продуктом восстановления HNO3 в реакции с медью является HNO2. Следовательно, индукционный период, наблюдаемый при проведении реакции в разбавленной HNO3, соответствует времени накопления HNO2 за счет протекания гетерогенной реакции восстановления NO2OH.

dt
[NO]2
Рис. 2. Схема процесса растворения меди в азотной кислоте
Последовательность протекания этих стадий вблизи от поверхности и на поверхности металла можно представить наглядно в виде схемы (рис. 2). В качестве общих закономерностей можно сформулировать следующие. В разбавленных растворах
HNO3 (менее 6 М), в которых концентрация недис-социированных молекул NO2OH мала, растворение меди происходит с низкой скоростью. В этих условиях процесс характеризуется значительным индукционным периодом, которому соответствуют реакции (5, 6). При этом в растворе накапливается определенное количество HNO2, часть ее разлагается по реакции (7). Оксид азота NO частично выделяется в газовую фазу, а частично окисляется азотной кислотой в объеме реакционного раствора до HNO2. За счет последнего процесса в объеме раствора поддерживается определенная для данных условий концентрация HNO2. Таким образом, в разбавленных растворах (менее 6 М) при температурах 20…50 °С основными стадиями механизма являются реакции (5-7).
В растворах HNO3 с концентрацией более 6 М содержание молекул NO2OH быстро возрастает. При проведении реакции в концентрированной кислоте HNO2 переходит в NO2 (реакция 8), который приводит к резкому росту скорости растворения меди (реакции 9, 10). Образование ионов NO2-в этих реакциях приводит к увеличению концентрации HNO2 в растворе (реакция 11), и, соответственно, к дальнейшему увеличению скорости растворения меди (автокатализ). Поскольку в растворах HNO3 с концентрацией более 15 М значительно уменьшается концентрация ионов Н+, растворение поверхностного слоя CuO (реакция 6) затруднено. Это, вероятно, является причиной наблюдаемого в концентрированной HNO3 (более 65 % мас. ) эффекта пассивации меди [5].
) эффекта пассивации меди [5].
Выводы
1. Установлены кинетические порядки реакции взаимодействия HNO3 с медью по общей концентрации кислоты и концентрации ее недис-социированной формы NO2OH, равные двум и единице соответственно. Найдено, что перемешивание раствора HNO3 и введение в него мочевины и сульфаминовой кислоты замедляет процесс растворения меди. По зависимости эффективной энергии активации процесса от температуры сделан вывод о смене лимитирующей стадии механизма реакции в разных температурных интервалах.
2. По результатам количественного определения продуктов восстановления азотной кислоты в ходе ее взаимодействия с медью установлено, что при температурах 20. 30 °С продукты восстановления в основном накапливаются в реакционном растворе в виде HNO2. Повышение температуры и концентрации HNO3 приводит к разложению HNO2 и увеличению доли NO2 в газе. Предложены схемы взаимного превращения продуктов восстановления HNO3 в реакционном растворе, подтвержденные расчетом материального баланса по азоту.
3. Предложена схема механизма реакции взаимодействия меди с HNO3, согласующаяся с кинетическими порядками реакции по кислоте и результатами количественного определения продуктов ее восстановления.
СПИСОК ЛИТЕРАТУРЫ
1. Гладышев В.П., Ковалева С.В., Коршунов А.В. Оксиды азота в окружающей среде и проблемы экологии. — Томск: Изд-во ТГПУ, 1998. —117 с.
2. Бейли К. Торможение химических реакций. — М.-Л.: Госхи-миздат, 1940. — 462 с.
3. Гринберг А.А., Вьюгина А.Ф. О взаимодействии азотной кислоты с магнием // Журнал неорганической химии. — 1960. — Т. 5. — № 6. —С. 1389—1390.
— № 6. —С. 1389—1390.
4. Некрасов Б.В. Основы общей химии. Т. 1. Изд. 4-е. — СПб.: Лань, 2003. —656 с.
5. Репа А.Г., Гужавина Л.М. Растворение меди в азотной кислоте // Журнал прикладной химии. — 1952. — Т. 25. — № 12. — С. 1277—1282.
6. Маллик С., Гумницкий Я.М. Механизм взаимодействия меди с азотной кислотой // Вестник Львовского политехн. ин-та. — 1987. — № 211. —С. 74—75.
7. Балезин С.А., Парфенов Г.С. О механизме растворения меди в азотной кислоте в присутствии некоторых замедлителей // Журнал прикладной химии. — 1953. — Т. 26. — № 8. — С. 795—801.
8. Гумницкий Я.М., Маллик С. О роли газообразной фазы в кинетике взаимодействия меди с азотной кислоте // Украинский химический журнал. —1989. —Т. 55. —№ 5. —С. 473—476.
9. Маттсон Э. Электрохимическая коррозия / Пер. со шведск. — М.: Металлургия, 1991. — 158 с.
10. Окнин И. Исследование катодного процесса в растворах азотной кислоты и в системе HNO3-h3SO4-h3O // Журнал прикладной химии. -1951. -Т. 24. -№ 2. -С.167-178.
11. Гладышев В.П., Ковалева С.В., Коршунов А.В. Реакции репро-порционирования соединений азота в водных растворах // Журнал общей химии. — 2000. — Т. 70. — Вып. 9. -С. 1342-1345.
12. Сидоркин В.Т., Ракитина Н.И., Книга А.А., Кулев В.Н. Применение нитратселективных электродов для измерения концентрации оксидов азота в дымовых газах // Теплоэнергетика. -1992. — № 2. -С. 75-77.
13. Клещев Н.Ф., Костыркина Т.Д., Бескова Г.С., Моргунова Е.Т. Определение NO и NO2 в нитрозных газах производства аммиачной селитры // Аналитический контроль в основной химической промышленности.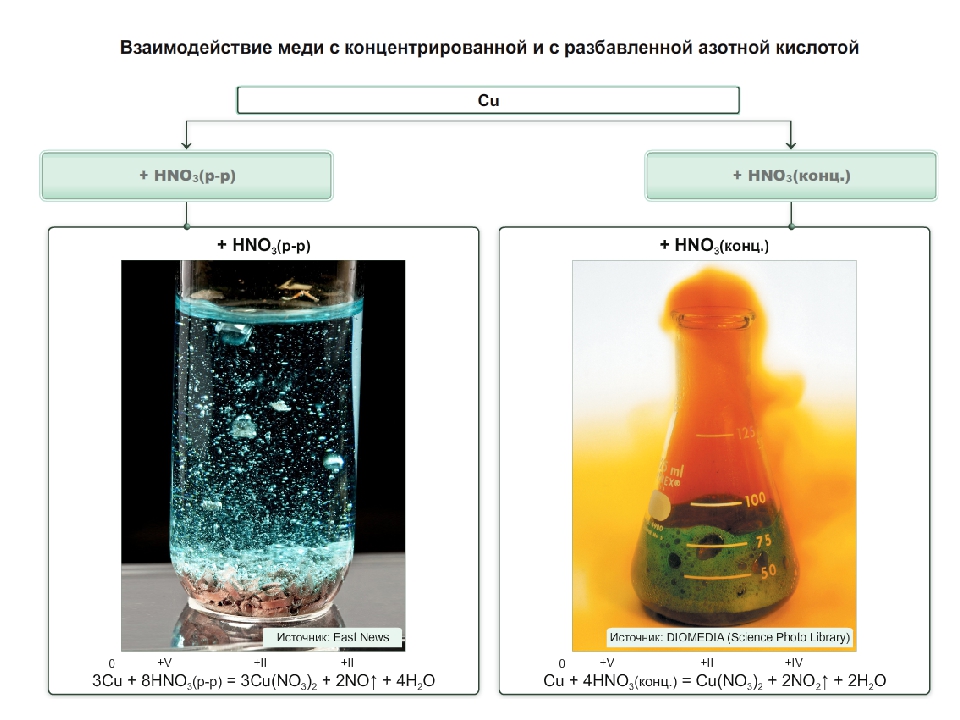 — М.: Химия, 1992. — 272 с.
— М.: Химия, 1992. — 272 с.
14. Перегуд Е.А. Химический анализ воздуха. — Л.: Химия, 1976. -328 с.
15. Кольтгоф И.М., Белчер Р., Стенгер В.А., Матсуяма Д. Объемный анализ. Т. 3. Методы окисления-восстановления. — М.: Госхимиздат, 1961. -840 с.
16. Park J.Y., Leen Y.N. Solubility and decomposition kinetics ofnitrous acid in aqueous solution // J. Phys. Chem. -1988. -V. 92. — № 12. -P. 6264-6302.
17. Abel E., Schmid H., Babad S. Kinetik der Salpetriger Saure. 5. Kinetik der Salpetrigsaure — Stickoxyd — Reaktion // J. Phys. Chem. -1928. — B. 136. — S. 419-436.
Азотная кислота — урок. Химия, 8–9 класс.
Физические свойства
Азотная кислота HNO3 — бесцветная дымящая на воздухе жидкость с неприятным запахом. При хранении на свету она разлагается и может окрашиваться в жёлтый цвет за счёт образования бурого оксида азота(\(IV\)):
4HNO3=2h3O+4NO2↑+O2↑.
Азотная кислота смешивается с водой в любых соотношениях и в водном растворе полностью распадается на ионы:
HNO3→H++NO3−.
Общие свойства кислот
Азотная кислота реагирует с основными и амфотерными оксидами и гидроксидами с образованием нитратов:
CuO+2HNO3=Cu(NO3)2+h3O,
Al(OH)3+3HNO3=Al(NO3)3+3h3O.
Азотная кислота вступает в реакции обмена с солями других кислот, если образуется газ или осадок:
CaCO3+2HNO3=Ca(NO3)2+h3O+CO2↑.
Особые свойства
В отличие от других кислот азотная кислота реагирует с большинством металлов, кроме благородных.
Обрати внимание!
В реакциях азотной кислоты с металлами никогда не образуется водород.
Окислителем в этих реакциях выступает атом азота кислотного остатка, поэтому продуктами реакции являются соединения азота в разной степени окисления. Состав соединений зависит от активности металла и концентрации азотной кислоты. Так, при взаимодействии концентрированной азотной кислоты с медью образуется бурый оксид азота(\(IV\)):
Состав соединений зависит от активности металла и концентрации азотной кислоты. Так, при взаимодействии концентрированной азотной кислоты с медью образуется бурый оксид азота(\(IV\)):
4HN+5O3+Cu0=Cu+2(NO3)2+2N+4O2+2h3O.
Медь с концентрированной азотной кислотой
При взаимодействии разбавленной азотной кислоты с медью продукт реакции — бесцветный оксид азота(\(II\)):
8HN+5O3+3Cu0=3Cu+2(NO3)2+2N+2O+4h3O.
Обрати внимание!
Концентрированная азотная кислота пассивирует железо и алюминий.
На их поверхности под действием концентрированной кислоты образуется прочная плёнка, которая защищает металл от дальнейшей реакции. Поэтому концентрированную азотную кислоту можно транспортировать в стальных или алюминиевых цистернах.
Азотная кислота способна окислять и другие неорганические и органические вещества. Органические вещества могут воспламеняться при соприкосновении с азотной кислотой, и работа с ней требует аккуратности и осторожности.
Азотная кислота используется в промышленности для получения:
- минеральных удобрений,
- лекарств,
- взрывчатых веществ,
- пластмасс,
- красителей,
- лаков.
ГОСТ 6689.1-92 Никель, сплавы никелевые и медно-никелевые. Методы определения меди, ГОСТ от 18 февраля 1992 года №6689.1-92
ГОСТ 6689.1-92
Группа В59
ОКСТУ 1709
Дата введения 1993-01-01
1. РАЗРАБОТАН И ВНЕСЕН МИНИСТЕРСТВОМ МЕТАЛЛУРГИИ СССР
РАЗРАБОТЧИКИ
В.Н.Федоров, Б.П.Краснов, Ю.M.Лейбов, А.Н.Боганова, В.M.Абалакина, Л.В.Морейская, О.К.Клейменова, И.А.Воробьева
2. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Комитета стандартизации и метрологии СССР от 18. 02.92 N 167
02.92 N 167
3. ВЗАМЕН ГОСТ 6689.1-80
4. ССЫЛОЧНЫЕ НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
Настоящий стандарт устанавливает электрогравиметрический метод определения меди (при массовой доле меди свыше 25%), экстракционно-фотометрический, фотометрический, полярографический и атомно-абсорбционный методы определения меди (при массовой доле меди от 0,005 до 0,6%) в никелевых и медно-никелевых сплавах по ГОСТ 492* и ГОСТ 19241.
________________
* На территории Российской Федерации действует ГОСТ 492-2006. — Примечание изготовителя базы данных.
1. ОБЩИЕ ТРЕБОВАНИЯ
Общие требования к методам анализа — по ГОСТ 25086 с дополнением.
За результат анализа принимают среднее арифметическое результатов трех (двух) параллельных определений.
2. ЭЛЕКТРОГРАВИМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
2.1. Сущность метода
Метод основан на кислотном растворении пробы, выделении меди электролизом на платиновом катоде при силе тока 1,5-2,5 А и определении остаточной меди в электролите атомно-абсорбционным методом при длине волны 324,7 нм в пламени ацетилен-воздух или фотометрическим методом с купризоном при длине волны 600 нм или с пикрамин-эпсилоном при 550 нм.
2.2. Аппаратура, реактивы и растворы
Электролизная установка постоянного тока.
Платиновые электроды по ГОСТ 6563.
Атомно-абсорбционный спектрометр с источником излучения для меди.
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461, разбавленная 1:1.
Кислота соляная по ГОСТ 4204, разбавленная 1:1, 1:4, 1:99 и 1 моль/дм.
Кислота фтористоводородная по ГОСТ 10484.
Кислота аскорбиновая, раствор 10 г/дм.
Кислота лимонная по ГОСТ 3652.
Аммиак водный по ГОСТ 3760 и разбавленный 1:4.
Гидразин сернокислый по ГОСТ 5841, раствор 10 г/дм.
Спирт этиловый ректификованный технический по ГОСТ 18300.
Тиомочевина по ГОСТ 6344, раствор 100 г/дм.
Карбамид по ГОСТ 6691, раствор 10 г/дм.
Лимоннокислый аммоний, раствор: 150 г лимонной кислоты растворяют в 400 см воды, добавляют при перемешивании 100 см концентрированного раствора аммиака, охлаждают, добавляют 100 см аммиака, охлаждают и доливают водой до метки 1000 см.
Бис-циклогексанон-оксалил-дигидразон (купризон), раствор: 2,5 г купризона растворяют при перемешивании в 900 см воды при температуре 60-70 °С. После охлаждения раствор фильтруют в темный стеклянный сосуд, доливают водой до объема 1000 см. Раствор годен 10 дней.
Пикрамин-эпсилон, раствор 1 г/дм.
Медь по ГОСТ 859* с массовой долей меди не менее 99,9%.
________________
* На территории Российской Федерации действует ГОСТ 859-2001, здесь и далее по тексту. — Примечание изготовителя базы данных.
Стандартные растворы меди
Раствор А: 0,5 г меди растворяют в 10 см азотной кислоты (1:1), удаляют оксиды азота кипячением, переносят в мерную колбу вместимостью 500 см, доливают до метки водой и перемешивают.
1 см раствора А содержит 0,001 г меди.
Раствор Б: 10 см раствора А помещают в мерную колбу вместимостью 100 см, доливают до метки водой и перемешивают.
1 см раствора Б содержит 0,0001 г меди.
Раствор В: 10 см раствора Б помещают в мерную колбу вместимостью 100 см, доливают до метки водой и перемешивают.
1 см раствора В содержит 0,00001 г меди.
Никель по ГОСТ 849*.
________________
* На территории Российской Федерации действует ГОСТ 849-2008, здесь и далее по тексту. — Примечание изготовителя базы данных.
Стандартный раствор никеля: 0,5 г никеля помещают в стакан вместимостью 250 см, добавляют 15 см азотной кислоты (1:1), накрывают часовым стеклом или пластиковой пластинкой и растворяют при нагревании. После растворения и охлаждения стекло или пластинку и стенки стакана ополаскивают водой, добавляют 5 см серной кислоты (1:1) и раствор упаривают до начала выделения белого дыма серной кислоты. Остаток охлаждают, ополаскивают стенки стакана водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 20-30 см воды и нагревают до растворения солей. По охлаждении раствор переводят в мерную колбу вместимостью 50 см, доливают до метки водой и перемешивают.
После растворения и охлаждения стекло или пластинку и стенки стакана ополаскивают водой, добавляют 5 см серной кислоты (1:1) и раствор упаривают до начала выделения белого дыма серной кислоты. Остаток охлаждают, ополаскивают стенки стакана водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 20-30 см воды и нагревают до растворения солей. По охлаждении раствор переводят в мерную колбу вместимостью 50 см, доливают до метки водой и перемешивают.
1 см раствора со
держит 0,01 г никеля.
2.3. Проведение анализа
2.3.1. Для сплавов, содержащих не более 0,05% свинца и 0,1% кремния
Навеску массой 1 г помещают в стакан вместимостью 300 см, добавляют 15 см азотной кислоты, накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. После растворения сплава стекло или пластинку, стенки стакана ополаскивают водой и раствор кипятят для удаления оксидов азота. Затем раствор разбавляют водой до 150 см и добавляют 7 см серной кислоты (1:4).
В раствор погружают платиновый анод и предварительно взвешенный платиновый катод и проводят электролиз при силе тока 1,5-2,5 А, перемешивая раствор.
Стакан с электролитом должен быть закрыт двумя половинками стеклянной или пластиковой пластинки с отверстиями для введения в раствор электродов и мешалки.
При массовой доле в сплаве свыше 1% железа и марганца во время электролиза необходимо добавлять небольшими порциями (по 1-1,5 см) раствор сернокислого гидразина или мочевины.
После обесцвечивания раствора стенки стакана, стекла или пластинки и выступающие части электродов ополаскивают водой и продолжают электролиз еще 10-15 мин при силе тока 0,5 А.
Если на свежепогруженной части катода не выделяется осадок меди, электролиз считается законченным. В противном случае электролиз проводят еще 10-15 мин и вновь контролируют полноту выделения меди.
По окончании электролиза, не выключая тока, электроды ополаскивают водой, собирая промывные воды в стакан с электролитом. Выключают ток, катод с осадком погружают в стакан с 200 см этилового спирта и высушивают при 105 °С до постоянной массы. Одна порция спирта может быть использована для промывки не более 20 электродов.
Электролит может быть использован для определения других элементов, например железа фотометрическим методом и никеля гравиметрическим методом.
2.3.2. Для свинцовистого нейзильбера
Навеску массой 1 г помещают в стакан вместимостью 300 см, добавляют 15 см азотной кислоты, накрывают стакан часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. После растворения сплава часовое стекло или пластинку и стенки стакана ополаскивают водой и раствор кипятят для удаления оксидов азота. Затем раствор разбавляют водой до 150 см, погружают в него предварительно взвешенные платиновые электроды и проводят электролиз при силе тока 1,5-2,5 А и перемешивании раствора.
Через 30 мин в раствор добавляют 7 см серной кислоты (1:4) и далее электролиз проводят, как указано в п.2.3.1.
Анод с выделившимся осадком двуокиси свинца ополаскивают водой и высушивают при температуре 160-170 °С до постоянной массы и рассчитывают массовую долю свинца по ГОСТ 6689.20.
2.3.3. Для сплавов, содержащих свыше 0,1% кремния
Навеску сплава массой 1 г помещают в платиновую чашку, добавляют 15 см азотной кислоты, 1-2 см фтористоводородной кислоты, накрывают крышкой из платины или фторопласта и растворяют при нагревании. После растворения сплава стенки чашки и крышку ополаскивают водой, добавляют 10 см серной кислоты (1:1) и выпаривают до выделения белого дыма серной кислоты. Остаток охлаждают и растворяют в воде при нагревании. Раствор переносят в стакан вместимостью 300 см, разбавляют водой до 150 см, прибавляют 5 см прокипяченной азотной кислоты и проводят электролиз, как указано в п. 2.3.1.
2.3.1.
2.4. Определение остаточной меди в электролите
Электролит после отделения меди выпаривают до объема 80 см, переносят в мерную колбу вместимостью 100 см, доливают до метки водой, перемешивают и используют при определении меди по пп.2.4.1. и 2.4.2.
2.4.1. Определение меди методом атомно-абсорбционной спектрометрии
2.4.1.1. Измеряют атомную абсорбцию меди в пламени ацетилен — воздух при длине волны 324,7 нм параллельно с градуировочными растворами.
2.4.1.2. Построение градуировочного графика
В шесть из семи мерных колб вместимостью по 100 см помещают 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 см стандартного раствора Б меди. Во все колбы добавляют по 5 см азотной кислоты (1:1) и серной (1:1) кислоты, добавляют до метки водой и измеряют атомную абсорбцию меди, как указано в п.2.4.1.1. По полученным данным строят градуировочный график.
2.4.2. Определение меди фотометрическим методом с купризоном
2.4.2.1. Аликвотную часть раствора 20 см помещают в мерную колбу вместимостью 100 см, добавляют 10 см раствора лимоннокислого аммония и раствор аммиака (1:4) до слабощелочной реакции, затем добавляют 2 см аммиака (1:4), 10 см раствора купризона, немедленно доливают до метки водой и перемешивают. рН полученного раствора должен быть 8,5-9,0. Через 5 мин, но не позднее чем через 30 мин, измеряют оптическую плотность раствора на фотоэлектроколориметре с оранжевым светофильтром в кювете с толщиной поглощающего свет слоя 3 см или на спектрофотометре при 600 нм в кювете с толщиной поглощающего свет слоя 1 см. Раствором сравнения служит раствор контрольного опыта.
2.4.2.2. Построение градуировочного графика
В шесть из семи мерных колб вместимостью по 100 см помещают 0,5; 0,75; 1,0; 1,5; 2,0 и 2,5 см стандартного раствора Б меди. Во все колбы добавляют по 5 см азотной кислоты (1:1), по 10 см раствора лимоннокислого аммония и далее проводят анализ, как указано в п. 2.4.2.1.
2.4.2.1.
Раствором сравнения служит раствор, не содержащий меди. По полученным данным строят градуировочный график.
2.4.3. Определение меди фотометрическим методом с пикрамин-эпсилоном
Электролит после отделения меди выпаривают до объема 40-50 см, после охлаждения добавляют 2 см серной кислоты (1:1) и раствор упаривают до начала выделения белого дыма серной кислоты. Остаток охлаждают, ополаскивают стенки стакана водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 20-30 см воды и нагревают до растворения солей. По охлаждении раствор переводят в мерную колбу вместимостью 50 см, доливают до метки водой и перемешивают.
2.4.3.1. Аликвотную часть раствора 1 см помещают в мерную колбу вместимостью 50 см, добавляют 4 см серной кислоты (1 моль/дм), 2 см раствора аскорбиновой кислоты, 2 см раствора пикрамин-эпсилона, доливают до метки водой и перемешивают.
Измеряют оптическую плотность раствора на спектрофотометре при 550 нм или на фотоэлектроколориметре с желтым светофильтром в кювете с толщиной поглощающего свет слоя 2 см.
Раствором сравнения служит раствор той же пробы, только перед добавлением пикрамин-эпсилона вводят 2 см раствора тиомочевины
.
2.4.3.2. Построение градуировочного графика
В шесть из семи мерных колб вместимостью по 50 см помещают 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 см стандартного раствора В меди. Во все колбы добавляют по 3 см стандартного раствора никеля, по 2 см серной кислоты (1 моль/дм), по 2 см раствора аскорбиновой кислоты и далее анализ проводят, как указано в п.2.4.3.1.
Раствором сравнения служит раствор, не содержащий меди.
По полученным данным строят градуировочный график.
2.5. Обработка результатов
2.5.1. Массовую долю меди в процентах в случае определения остаточной меди в электролите методом атомно-абсорбционной спектрометрии вычисляют по формуле
,
где — масса катода с выделившейся медью, г;
— масса катода, г;
— масса навески, г;
— концентрация меди, найденная по градуировочному графику, г/см.
— объем раствора электролита, см
.
2.5.2. Массовую долю меди в процентах в случае определения остаточной меди в электролите фотометрическим методом вычисляют по формуле
,
где — масса катода с выделившейся медью, г;
— масса катода, г;
— масса навески сплава, г;
— масса меди, найденная по градуировочному графику, г;
— объем раствора электролита, см;
— объем аликвотной части раствора, см
.
2.5.3. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.1.
Таблица 1
Массовая доля меди, % | Допускаемые расхождения, % | |
От 25,0 до 80,0 включ. | 0,15 | 0,2 |
Св. 80,0 | 0,20 | 0,3 |
2.5.4. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) медно-никелевых сплавов, утвержденным по ГОСТ 8.315* в соответствии с ГОСТ 25086.
________________
* На территории Российской Федерации действует ГОСТ 8.315-97, здесь и далее по тексту. — Примечание изготовителя базы данных.
3. ЭКСТРАКЦИОННО-ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
3.1. Сущность метода
Метод основан на замещении ионами меди ионов свинца в его диэтилдитиокарбаминатном комплексе, растворенном в хлороформе, и измерении оптической плотности полученного экстракта диэтилдитиокарбамината меди.
3.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461, разбавленная 3:2; 1:2; 1:1 и 1:100.
Кислота серная по ГОСТ 4204, разбавленная 1:3.
Кислота соляная по ГОСТ 3118, разбавленная 1:1.
Кислота фтористоводородная по ГОСТ 10484.
Кислота винная по ГОСТ 5817, раствор 400 г/дм.
Аммиак водный по ГОСТ 3760, разбавленный 1:1.
Натрия гидроокись по ГОСТ 4328, раствор 100 г/дм.
Натрий сернокислый по ГОСТ 4166.
Калий-натрий виннокислый по ГОСТ 5845, раствор 100 г/см.
Свинец уксуснокислый по ГОСТ 1027.
Метиловый оранжевый, раствор 1 г/см.
Хлороформ по ГОСТ 20015.
Диэтилдитиокарбамат натрия по ГОСТ 8864.
Диэтилдитиокарбамат свинца, раствор в хлороформе: 0,1 г диэтилдитиокарбамата свинца растворяют в 100-200 см хлороформа и разбавляют хлороформом до 1 дм или 0,1 г уксуснокислого свинца растворяют в 20 см воды, добавляют 5 см раствора виннокислого калия-натрия и по каплям вводят раствор гидроокиси натрия до исчезновения мути. Растворяют 0,125 г диэтилдитиокарбамата натрия в 40 см воды и добавляют к первому раствору. Полученный раствор вместе с осадком помещают в делительную воронку вместимостью 500 см, добавляют 200-250 см хлороформа и экстрагируют 2 мин. Экстракцию повторяют. Хлороформные экстракты объединяют, фильтруют через сухой фильтр в сухую склянку из темного стекла с притертой пробкой и разбавляют хлороформом до 1 дм.
Медь марки М0 по ГОСТ 859.
Стандартные растворы меди
Раствор А: 0,1 г меди растворяют в 20 см азотной кислоты (1:1), кипятят до удаления оксидов азота, охлаждают, переносят в мерную колбу вместимостью 1000 см, доливают до метки водой.
1 см раствора А содержит 0,0001 г меди.
Раствор Б: 25 см раствора А помещают в мерную колбу вместимостью 250 см, доливают до метки водой.
1 см раствора Б содержит 0,0
0001 г меди.
3.3. Проведение анализа
3.3.1. Для сплавов, содержащих менее 0,1% кремния и не содержащих хрома и вольфрама
Навеску сплава 0,5 г помещают в стакан вместимостью 250 см, добавляют 15 см азотной кислоты (3:2), накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. Стекло или пластинку и стенки стакана ополаскивают водой и раствор кипятят до удаления оксидов азота. При массовой доле меди не менее 0,02% для анализа используют весь раствор, а при содержании меди свыше 0,02% раствор переносят в мерную колбу вместимостью 100 см и доливают до метки водой.
Аликвотную часть или весь раствор (табл.2) помещают в делительную воронку вместимостью 150 см, разбавляют водой до 25 см, добавляют 5 см раствора винной кислоты, нейтрализуют раствором аммиака до щелочной среды по метиловому оранжевому, прибавляют 2-3 капли серной кислоты (1:3) и разбавляют раствор до 50 см водой.
Таблица 2
Массовая доля меди, % | Аликвотная часть раствора, см |
От 0,005 до 0,02 включ. | Весь раствор |
Св. 0,02 до 0,1 « | 20 |
» 0,1 » 0,2 « | 10 |
» 0,2 » 0,4 « | 5 |
» 0,4 » 0,6 « | 2,5 |
Добавляют 10 см раствора диэтилдитиокарбамата свинца в хлороформе и экстрагируют 3 мин. После разделения слоев хлороформный слой, окрашенный в желтый цвет, переносят в мерную колбу вместимостью 25 см.
После разделения слоев хлороформный слой, окрашенный в желтый цвет, переносят в мерную колбу вместимостью 25 см.
Медь из водного слоя экстрагируют еще два раза по 2 мин, приливая каждый раз по 5 см раствора диэтилдитиокарбамата свинца в хлороформе, и объединяют окрашенные органические слои в мерной колбе. Экстракты в мерной колбе доливают до метки хлороформом и обезвоживают, добавляя 0,2 г безводного сернокислого натрия или фильтруя через сухой бумажный фильтр.
Оптическую плотность раствора измеряют на фотоэлектроколориметре с синим светофильтром в кювете с толщиной поглощающего свет слоя 2 см или на спектрофотометре при 436 нм в кювете с толщиной поглощающего свет слоя 1 см. В качестве раствора сравнения используют хлороформ. Через все стадии анализа проводят контрольный опыт на содержание меди в применяемых реактивах и вносят соответствующую поправку.
3.3.2. Для сплавов, содержащих вольфрам
Навеску сплава 0,5 г помещают в стакан вместимостью 250 см, добавляют 15 см азотной кислоты (3:2), накрывают часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании. Стекло или пластинку и стенки стакана ополаскивают водой и раствор упаривают до сиропообразного состояния. К остатку добавляют 25-30 см горячей воды, нагревают до 60-70 °С и осадок вольфрамовой кислоты отфильтровывают на плотный фильтр, тщательно промывают стакан и осадок азотной кислотой (1:100). Осадок выбрасывают. При массовой доле меди менее 0,02% фильтрат упаривают до объема 20 см, а при массовой доле меди свыше 0,02% — переносят в мерную колбу вместимостью 100 см, доливают до метки водой и далее анализ ведут, как указано в п.3.3.1.
3.3.3. Для сплавов, содержащих свыше 0,1% кремния и хрома
Навеску сплава 0,5 г помещают в платиновую чашку, добавляют 15 см азотной кислоты (3:2), 3 см фтористоводородной кислоты и растворяют при нагревании. После охлаждения добавляют 5 см концентрированной серной кислоты и раствор упаривают до начала выделения белого дыма серной кислоты.
Остаток охлаждают, ополаскивают стенки чашки водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 30-40 см воды и нагревают до растворения солей. После охлаждения раствор переносят в мерную колбу вместимостью 100 см, доливают до метки водой и далее анализ ведут, как указано в п.3.3.1.
3.3.4. Построение градуировочного графика
В делительные воронки вместимостью 150 см помещают 1,0; 2,0; 4,0; 6,0; 8,0 и 10,0 см стандартного раствора Б меди, разбавляют водой до 25 см, добавляют по 5 см винной кислоты и далее анализ ведут, как указано в п.3.3.1.
3.4. Обработка результатов
3.4.1. Массовую долю меди в процентах вычисляют по формуле
,
где — масса меди, найденная по градуировочному графику, г;
— масса сплава, соответствующая аликвотной части раствора, г.
3.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.3.
Таблица 3
Массовая доля меди, % | Допускаемые расхождения, % | |
От 0,005 до 0,01 включ. | 0,001 | 0,001 |
Св. 0,01 до 0,02 « | 0,003 | 0,004 |
» 0,02 » 0,05 включ. | 0,005 | 0,007 |
» 0,05 » 0,10 « | 0,008 | 0,01 |
» 0,1 » 0,2 « | 0,015 | 0,02 |
» 0,2 » 0,4 « | 0,02 | 0,03 |
» 0,4 » 0,6 « | 0,03 | 0,04 |
3.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО) или по стандартным образцам предприятия (СОП) никелевых сплавов, утвержденным по ГОСТ 8.315, или методом добавок или сопоставлением результатов, полученных другим методом, в соответствии с ГОСТ 25086.
4. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
4.1. Сущность метода
Метод основан на полярографическом определении меди без отделения от основных компонентов сплава по волне восстановления меди (II) на ртутном капающем электроде в солянокислом растворе.
4.2. Аппаратура, реактивы, растворы
Полярограф переменного тока ППТ-1 и ячейка, выполненная из стекла объемом 30-40 см с выносным электродом сравнения (насыщенный каломельный электрод) и ртутным капающим электродом. При отсутствии прибора ППТ-1 допускается применение полярографов других марок.
Кислота соляная по ГОСТ 3118, разбавленная 1:8.
Кислота азотная по ГОСТ 4461, разбавленная 1:1 и 1%-ный раствор.
Кислота серная по ГОСТ 4204.
Кислота фтористоводородная по ГОСТ 10484.
Ртуть марки Р0 по ГОСТ 4658, не содержащая влаги и очищенная от окисных пленок.
30-50 см ртути переносят из баллона в стакан и медленно фильтруют через двойной сухой фильтр средней плотности, для чего в нижней части фильтра делают иглой маленькое отверстие. Отфильтрованную ртуть немедленно помещают в напорную емкость ртутного капающего электрода и хранят в плотно закрытой напорной емкости.
Азот газообразный по ГОСТ 9293.
Медь марки М0 или M1 по ГОСТ 859.
Стандартные растворы меди
Раствор А: 0,2 г меди растворяют при нагревании в 20 см азотной кислоты (1:1), удаляют кипячением оксиды азота, охлаждают, переводят раствор в мерную колбу вместимостью 200 см и доливают до метки водой.
1 см раствора А содержит 0,001 г меди.
Раствор Б: 10 см раствора А помещают в мерную колбу вместимостью 100 см и доливают до метки водой.
1 см раствора Б содержит 0,0001 г мед
и.
4.3. Проведение анализа
4.3.1. Для сплавов, содержащих менее 0,1% кремния и не содержащих хрома и вольфрама
Навеску сплава (табл.4) помещают в стакан вместимостью 250-300 см, добавляют 15 см азотной кислоты (1:1), накрывают стакан часовым стеклом, стеклянной или пластиковой пластинкой и растворяют при нагревании.
Таблица 4
Массовая доля меди, % | Масса навески, г | Аликвотная часть раствора, взятая на полярографирование, см |
От 0,005 до 0,01 включ. | 1 | 20 |
Св. | 0,15 | 20 |
» 0,1 » 0,3 « | 0,25 | 5 |
» 0,3 » 0,6 « | 0,1 | 5 |
После растворения сплава стекло или пластинку и стенки стакана ополаскивают водой и упаривают раствор до 2-3 см. После охлаждения добавляют 20 см соляной кислоты (1:8), переводят раствор в мерную колбу вместимостью 100 см и доливают до метки соляной кислотой (1:8).
4.3.2. Для сплавов, содержащих вольфрам
Навеску сплава (см. табл.4) помещают в стакан вместимостью 250-300 см, добавляют 15 см азотной кислоты (1:1) и растворяют при нагревании.
После растворения сплава раствор упаривают до сиропообразного состояния, разбавляют водой до 150 см, нагревают до 60-70 °С и фильтруют через плотный фильтр. Осадок на фильтре промывают 4-5 раз горячим 1%-ным раствором азотной кислоты. Осадок отбрасывают. Полученный раствор упаривают до 2-3 см и далее поступают, как указано в п. 4.3.1.
4.3.3. Для сплавов, содержащих хром и более 0,1% кремния
Навеску сплава (см. табл.4) помещают в платиновую чашку, добавляют 20 см азотной кислоты (1:1), 5 см фтористоводородной кислоты и растворяют при нагревании. Раствор охлаждают, добавляют 5 см серной кислоты и упаривают до белого дыма серной кислоты.
Остаток растворяют в 20 см соляной кислоты (1:8) и далее поступают, как указано в п.4.3.1.
Во всех случаях через весь ход анализа проводят контрольный опыт.
4.3.4. Из колбы вместимостью 100 см помещают в полярографическую ячейку аликвотную часть раствора (см. табл.4), продувают током азота 4-6 мин и полярографируют при изменении потенциала от минус 0,10 до минус 0,5 В, регистрируя ток восстановления меди при потенциале от минус 0,25 до минус 0,35 В.
табл.4), продувают током азота 4-6 мин и полярографируют при изменении потенциала от минус 0,10 до минус 0,5 В, регистрируя ток восстановления меди при потенциале от минус 0,25 до минус 0,35 В.
В случаях, если аликвотная часть раствора составляет 5 см, в полярографическую ячейку помещают предварительно 15 см соляной кислоты (1:8).
Высота регистрируемой волны или пика должна быть не менее 10 мм при выбранной чувствительности полярографа.
4.3.5. Определение меди методом добавок
Аликвотную часть раствора меди Б (от 0,1 до 0,3 см) добавляют в ячейку и далее поступают, как указано в п.4.3.4.
Величина добавки выбирается таким образом, чтобы высота волны (пика) меди увеличивалась приблизительно в 2-3 раза по сравнению с высотой волны (пика) до введения добавки.
4.4. Обработка результатов
4.4.1. Массовую долю меди в сплаве в процентах вычисляют по формуле
,
где — высота волны (пика) меди для анализируемого раствора, мм;
— высота волны (пика) меди для контрольного опыта, мм;
— объем стандартной добавки, см;
— концентрация стандартного раствора меди, г/см;
— высота волны (пика) меди для анализируемого раствора с добавкой, мм;
— навеска сплава, взятая на полярографирование,
г.
4.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.3.
4.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО) или по стандартным образцам предприятия (СОП) никелевых сплавов, утвержденным по ГОСТ 8.315, или методом добавок или сопоставлением результатов, полученных другим методом, в соответствии с ГОСТ 25086.
5. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
5.1. Сущность метода
Метод основан на образовании ионами меди при рН 1,0-1,5 комплексного соединения с пикрамин-эпсилоном и измерении оптической плотности полученного раствора.
5.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота азотная по ГОСТ 4461, разбавленная 3:2, 1:1 и 1:100.
Кислота серная по ГОСТ 4204, разбавленная 1:1 и раствор 1 моль/дм.
Кислота фтористоводородная по ГОСТ 10484.
Кислота аскорбиновая, свежеприготовленный раствор 10 г/дм.
Тиомочевина по ГОСТ 6344 раствор 100 г/дм.
Пикрамин-эпсилон ч.д.а., раствор 1 г/дм.
Никель марки Н0 по ГОСТ 849.
Стандартный раствор никеля (см. приготовление в п.2.2).
Медь марки М0 по ГОСТ 859.
Стандартные растворы меди
Раствор А: 0,1 г меди растворяют в 20 см азотной кислоты (1:1), кипятят до удаления оксидов азота, охлаждают, переносят в мерную колбу вместимостью 1000 см, доливают до метки водой и перемешивают.
1 см раствора А содержит 0,0001 г меди.
Раствор Б: 25 см раствора А помещают в мерную колбу вместимостью 250 см, доливают до метки водой и перемешивают.
1 см раствора Б содержит 0,00001 г м
еди.
5.3. Проведение анализа
5.3.1. Для сплавов, содержащих менее 0,1% кремния и не содержащих хрома и вольфрама
Навеску сплава (табл.5) помещают в стакан вместимостью 250 см, добавляют 15 см азотной кислоты (1:1), накрывают часовым стеклом или пластиковой пластинкой и растворяют при нагревании. После охлаждения стекло или пластинку и стенки стакана ополаскивают водой, добавляют 5 см серной кислоты (1:1) и раствор упаривают до начала выделения белого дыма серной кислоты.
Таблица 5
Массовая доля меди, % | Масса навески, г | Аликвотная часть раствора, см | Количество 1 моль/дм НSO, см |
От 0,005 до 0,02 включ. | 0,5 | 4 | 1 |
Св. 0,02 до 0,1 « | 0,5 | 3 | 2 |
» 0,1 » 0,4 « | 0,25 | 2 | 3 |
» 0,4 » 0,6 « | 0,25 | 1 | 4 |
Остаток охлаждают, ополаскивают стенки стакана водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 20-30 см воды и нагревают до растворения солей. По охлаждении раствор переводят в мерную колбу вместимостью 50 см, доливают до метки водой и перемешивают.
Аликвотную часть полученного раствора (табл.5) помещают в мерную колбу вместимостью 50 см, добавляют 1 моль/дм раствора серной кислоты (табл.5), 2 см раствора аскорбиновой кислоты, 2 см раствора пикрамин-эпсилона, доливают до метки водой и перемешивают. Оптическую плотность измеряют на спектрофотометре при 550 нм или на фотоэлектроколориметре с желтым светофильтром в кювете 2 или 5 см в зависимости от массовой доли меди в сплаве. Раствором сравнения служит раствор той же пробы, в которую вводят 2 см раствора тиомочевины перед добавлением пикрамин-эпсилона
.
5.3.2. Для сплавов, содержащих вольфрам
Навеску сплава (см. табл.5) помещают в стакан вместимостью 250 см, добавляют 15 см азотной кислоты (3:2), накрывают часовым стеклом или пластиковой пластинкой и растворяют при нагревании. Стекло или пластинку и стенки стакана ополаскивают водой и раствор упаривают до сиропообразного состояния. К остатку добавляют 25-30 см горячей воды, нагревают до 60-70 °С и осадок вольфрамовой кислоты отфильтровывают на плотный фильтр, тщательно промывают стакан и осадок азотной кислотой (1:100). Осадок отбрасывают. Фильтрат упаривают до 40-50 см, по охлаждении добавляют 5 см серной кислоты (1:1), упаривают до начала выделения белого дыма серной кислоты и далее анализ ведут, как указано в п.5.3.1.
5.3.3. Для сплавов, содержащих свыше 0,1% кремния и хрома
Навеску сплава (см. табл.5) помещают в платиновую чашку, добавляют 15 см азотной кислоты (3:2), 3 см фтористоводородной кислоты и растворяют при нагревании. После охлаждения добавляют 5 см серной кислоты (1:1) и раствор упаривают до начала выделения белого дыма серной кислоты.
Остаток охлаждают, ополаскивают стенки чашки водой и вновь упаривают до начала выделения белого дыма серной кислоты. После охлаждения к остатку добавляют 20-30 см воды и нагревают до растворения солей. По охлаждении раствор переводят в мерную колбу вместимостью 50 см, доливают до метки водой и далее анализ ведут, как указано в п.5.3.1.
5.3.4. Построение градуировочного графика
В мерные колбы вместимостью по 50 см помещают по 3 см стандартного раствора никеля, добавляют 0,2; 0,4; 0,6; 0,8 и 1,0 см стандартного раствора Б меди (при массовой доле меди от 0,005 до 0,02%) или 0,5; 1,0; 2,0; 3,0; 4,0 и 5,0 см стандартного раствора Б меди (при массовой доле меди от 0,02 до 0,6%). Затем добавляют по 2 см серной кислоты (1 моль/дм) и далее анализ ведут, как указано в п.5.3.1.
Оптическую плотность растворов измеряют в кювете 5 см (при массовой доле меди от 0,005 до 0,02%) или 2 см (при массовой доле меди от 0,02 до 0,6%).
Раствором сравнения служит раствор, не содержащий меди. По полученным данным строят градуировочный график.
5.4. Обработка результатов
5.4.1. Массовую долю меди в процентах вычисляют по формуле
,
где — масса меди, найденная по градуировочному графику, г;
— масса навески сплава, соответствующая аликвотной части раствора, г.
5.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.3.
5.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никелевых сплавов, утвержденным по ГОСТ 8.315 или методом добавок или сопоставлением результатов, полученных другим методом, в соответствии с ГОСТ 25086.
6. АТОМНО-АБСОРБЦИОННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
6.1. Сущность метода
Метод основан на измерении абсорбции света атомами меди, образующимися при введении анализируемого раствора в пламя ацетилен-воздух.
6.2. Аппаратура, реактивы и растворы
Атомно-абсорбционный спектрометр с источником излучения для меди.
Кислота азотная по ГОСТ 4461, разбавленная 1:1 и 1:100.
Кислота фтористоводородная по ГОСТ 10484.
Кислота серная по ГОСТ 4204, разбавленная 1:1.
Медь по ГОСТ 859.
Раствор меди: 0,1 г меди растворяют при нагревании в 10 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 1 дм и доливают водой до метки.
1 см раствора содержит 0,0001 г меди.
Никель по ГОСТ 849.
Раствор никеля: 10 г никеля растворяют при нагревании в 80 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки.
1 см раствора содержит 0,1 г никеля.
6.3. Проведение анализа
Навеску сплава массой 1 г берут для определения массовых долей меди 0,005-0,1% и массой 0,1 г для определения массовых долей меди 0,1-0,6%.
6.3.1. Для сплавов, не содержащих кремния, хрома, вольфрама и титана
Навеску сплава растворяют при нагревании в 10 см азотной кислоты (1:1). Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки.
Измеряют атомную абсорбцию меди в пламени ацетилен-воздух при длине волны 324,7 нм параллельно с градуировочными растворами.
6.3.2. Для сплавов, содержащих кремний, титан и хром
Навеску сплава помещают в платиновую чашку и растворяют при нагревании в 10 см азотной кислоты (1:1) и 2 см фтористоводородной кислоты. Затем добавляют 10 см серной кислоты (1:1) и упаривают до появления белого дыма серной кислоты. Чашку охлаждают и остаток растворяют в 50 см воды при нагревании. Раствор переносят в мерную колбу вместимостью 100 см и доливают водой до метки. Измеряют атомную абсорбцию меди, как указано в п.6.3.1.
6.3.3. Для сплавов, содержащих вольфрам
Навеску сплава растворяют при нагревании в 10 см азотной кислоты (1:1), затем добавляют 30 см горячей воды и выпавший осадок вольфрамовой кислоты отфильтровывают на плотный фильтр и промывают горячей азотной кислотой (1:100). Фильтрат переносят в мерную колбу вместимостью 100 см и доливают водой до метки. Измеряют атомную абсорбцию меди, как указано в п.6.3.1.
6.3.4. Построение градуировочного графика
В шесть из семи мерных колб вместимостью по 100 см помещают 0,5; 2,0; 4,0; 6,0; 8,0 и 10,0 см стандартного раствора меди, что соответствует 0,05; 0,2; 0,4; 0,6; 0,8 и 1,0 мг меди. Во все колбы приливают по 10 см азотной кислоты (1:1). При массовой доле меди менее 0,1% добавляют по 10 см раствора никеля и доливают до метки водой. Измеряют атомную абсорбцию меди, как указано в п.6.3.1. По полученным данным строят градуировочный график.
6.4. Обработка результатов
6.4.1. Массовую долю меди в процентах вычисляют по формуле
,
где — концентрация меди, найденная по градуировочному графику, г/см;
— объем раствора пробы, см;
— масса навески пробы, г.
6.4.2. Расхождения результатов трех параллельных определений (показатель сходимости) и результатов двух анализов (показатель воспроизводимости) не должны превышать значений допускаемых расхождений, приведенных в табл.3.
6.4.3. Контроль точности результатов анализа проводят по Государственным стандартным образцам (ГСО) или по отраслевым стандартным образцам (ОСО), или по стандартным образцам предприятия (СОП) никелевых сплавов, утвержденным по ГОСТ 8.315, или методом добавок или сопоставлением результатов, полученных другим методом, в соответствии с ГОСТ 25086.
Электронный текст документа
подготовлен ЗАО «Кодекс» и сверен по:
официальное издание
М.: Издательство стандартов, 1992
Концентрированная азотная кислота взаимодействие — Справочник химика 21
Концентрированная азотная кислота взаимодействует с белковыми веществами, образуя соединения ярко-желтой окраски. Вследствие этого на коже поддействием кислоты образуются желтые пятна. Кислота разрушает шерсть и натуральный шелк. [c.56]С концентрированной азотной кислотой взаимодействует медь [c.154]
Азотная кислота действует почти на все металлы (кроме золота, платины и некоторых других), превращая их в соли. В ней растворяют серебро, медь, свинец, на которые другие кислоты не действуют. Концентрированная азотная кислота, взаимодействуя с металлами, восстанавливается до двуокиси азота [c.197]
Азотная кислота — сильная и характеризуется ярко выраженными окислительными свойствами. В продажу обычно поступает 65%-ная ННОз плотностью 1400 кг/м . С водой азотная кислота смешивается в любых соотношениях. Животные и растительные ткани при действии на них азотной кислоты очень быстро разрушаются. Даже небольшое количество разбавленной азотной кислоты оставляет желтые пятна на коже. Концентрированная азотная кислота взаимодействует с многими неметаллами сера окисляется ею до серной кислоты при кипячении, уголь —до углекислого газа. Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную азотную кислоту, загорается синий раствор индиго обесцвечивается. Концентрированная азотная кислота не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная пленка оксидов, нерастворимая в кислотах. Это свойство азотной кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.304]
Поскольку из исходной смеси металлов с концентрированной азотной кислотой взаимодействует только медь, то по объему выделившегося оксида азота(IV) (6,72 л) по уравнению (1) можно рассчитать количество растворенной меди. Оно равно 9,6 г. Так кйк медь и золото в соляной кислоте не растворяются, то по уравнению (2), зная [c.87]
Ксантопротоиновая реакция. Концентрированная азотная кислота взаимодействует с белками, причем образуется желтое окрашивание, ко- [c.322]
Концентрированную азотную кислоту получают несколькими способами. Более старый способ заключается в перегонке разбавленной азотной кислоты в смеси с серной кислотой (купоросным маслом). В настоящее время построены и работают промышленные установки для получения концентрированной азотной кислоты взаимодействием жидкой двуокиси азота с водой (практически пользуются слабой азотной кислотой) в присутствии кислорода. Процесс протекает при давлении 50 ат и температуре около 70 °С по суммарному уравнению [c.265]
Когда концентрированная азотная кислота взаимодействие с металлоидами (углеродом, фосфором, серой) и с сульфидами металлов, она восстанавливается до N0 [c.280]
Полиизобутилен — насыщенный полимер, отличающийся высокой стойкостью к действию кислорода и озона при нормальных температурах, стойкий к старению.- Введение в полиизобутилен активных наполнителей (технического углерода, графита) повышает его прочностные свойства и химическую стойкость. Полиизобутилен стоек к концентрированным и разбавленным серной и соляной кислотам, органическим кислотам, аммиаку, щелочам, пероксиду водорода, при нагревании разрушается концентрированной азотной кислотой, взаимодействует с газообразными хлором и бромом. Полиизобутилен легко окрашивается любыми красителями. Физикомеханические свойства полиизобутилена приведены в Приложении 2. [c.172]
Концентрированная азотная кислота взаимодействует со многими неметаллами сера окисляется ею до Н2504 при кипячении, уголь — до СО2. Тлеющая лучинка, внесенная в пары азотной кислоты, воспламеняется скипидар, влитый в концентрированную НЫОз, загорается синий раствор индиго обесцвечивается. Концентрированная НМОз не действует на золото и платину. Железо, алюминий и некоторые другие металлы пассивируются концентрированной азотной кислотой, так как на их поверхности возникает плотная защитная.пленка оксидов, нерастворимая в кислотах. Это свойство азотной,кислоты позволяет хранить и транспортировать ее в стальных цистернах. [c.322]
В настоящее время построены и работают производственные установки для получения концентрированной азотной кислоты взаимодействием жидкой двуокиси азота с водой (практически пользуются слабой азотной кислотой) в присутствии кислорода по суммарному уравнению [c.238]
Концентрированная азотная кислота, взаимодействуя с 6-амино-4-метил-пиримидином, дает 6-нитрамино-4-метилпиримидин (ЬХШ), который может быть восстановлен в 6-гидразино-4-метилпиримидин [218]. [c.227]
Концентрированная азотная кислота взаимодействует почти со всеми металлами с образованием нитратов, при этом она восстанавливается до диоксида азота, разбавленная— до оксонитрида азота (V) НгО (закись азота). Диоксид азота и оксонитрид азота химически активны. [c.33]
Урок 12. медь. цинк. титан. хром. железо. никель. платина — Химия — 11 класс
Химия, 11 класс
Урок № 12. Медь. Цинк. Титан. Хром. Железо. Никель. Платина
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Глоссарий
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тесто по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Медь
Электронная конфигурация
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:
1s2
Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Физические свойства
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Свойство | Значение |
Цвет | Светло-розовый |
Структура | Тягучая, вязкая, легко прокатывается |
Температура плавления, °С | 1083 |
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
- медный блеск, Cu2S;
- куприт, Cu2O;
- медный колчедан, CuFeS;
- малахит, (CuOH)2CO3.
Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
Cu2O + CO = 2Cu + CO2
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
Химические свойства
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
2Cu + O2 = 2CuO
2Cu + Cl2 = 2CuCl2
Cu + S = CuS
Реакции со сложными веществами:
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ +2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO↑ + 4H2O
Применение
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4∙5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк
Электронная конфигурация
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:
Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Физические свойства
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Свойство | Значение |
Цвет | Голубовато-серебристый |
Структура | Хрупок |
Температура плавления, °С | 419,5 |
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
Химические свойства
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
2Zn + O2 = 2ZnO
2Zn + Cl2 = 2ZnCl2
Zn + S = ZnS
Реакции со сложными веществами:
Zn + 2NaOH(крист) = NaZnO2 + H2↑
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Применение
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан
Электронная конфигурация
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:
Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Физические свойства
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Высокая прочность и взякость |
Температура плавления, °С | 1665 |
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
- титаномагнетит, FeTiO3∙Fe3O4;
- ильменит, FeTiO3;
- рутил, TiO2.
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
TiCl4 + 2Mg = Ti + 2MgCl2
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Химические свойства
Титан является очень активным металлом, но его оксидная пленка не даёт ему взаимодействовать при нормальных условиях ни с морской водой, ни даже с «царской водкой». Поэтому все реакции протекают при повышенных температурах.
Реакции с простыми веществами:
Ti + 2Cl2 = TiCl4
Ti + O2 = TiO2
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
2Ti + 3H2SO4 = Ti2(SO4)3 + 3H2↑
Применение
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром
Электронная конфигурация
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:
Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Физические свойства
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Свойство | Значение |
Цвет | Серебристо-белый с металлическим блеском |
Структура | Твердый |
Температура плавления, °С | 1890 |
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO↑
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Cr2O3 + 2Al = 2Cr + Al2O3
Химические свойства
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Применение
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Электронная конфигурация
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Рисунок 5 – Электронная конфигурация атома железа
Физические свойства
Железо обладает следующими физическими свойствами:
Таблица 5 – Основные физические свойства железа
Свойство | Значение |
Цвет | Серебристо-белый |
Структура | Мягкий, пластичный |
Температура плавления, °С | 1539 |
Нахождение в природе
Встречается железо в виде различных соединений: оксидов, сульфидов, силикатов. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.
Способы получения железа
Существует множество способов получения железа, и отличаются они друг от друга степенью его чистоты и требуемым типом конечного продукта.
- Восстановлением из оксидов (железо пирофорное).
- Электролизом водных растворов его солей (железо электролитическое).
- Разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С.
- Методом зонной плавки (получение особо чистого железа).
- Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах.
- Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом.
Химические свойства
Под воздействием высоких температур железо взаимодействует с простыми веществами:
2Fe + 3O2 = Fe2O3 ∙FeO
В ходе данной реакции происходит получение смеси оксидов, которую иногда записывают в виде общей формулы Fe3O4.
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
Взаимодействует с разбавленными кислотами, причем с соляной кислотой происходит образование соли только двухвалентного железа:
Fe + 2HCl(разб) = FeCl2 + H2↑
При комнатной температуре железо пассивируется концентрированными кислотами, но при высоких температурах вступает в реакцию окисления:
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6H2O
Вступает в реакцию обмена с солями, образованными катионами более слабых металлов:
Fe + CuSO4 = FeSO4 + Cu↓
Применение
Про области применения железа можно говорить достаточно долго, поэтому выделим основные направления:
- В связи с его способностью быстро намагничиваться, его используют в трансформаторах и электромоторах.
- Основная масса железа расходуется на производство различных сплавов, таких как чугун и сталь.
Никель и платина
Далее стоит обратить на два металла: никель и платина. Как нам известно, они имеют схожие области применения, но отличаются по цене и качеству, потому предлагаю сравнить их.
Электронная конфигурация
Электронное строение металлов выглядит следующим образом:
Ni …3s2 3p6 3d8 4s2
Характерные степени окисления: + 2 и +3, но последняя является неустойчивой.
Pt …5s2 5p6 5d9 6s1
Характерные степени окисления: + 2 и +4.
Физические свойства
Таблица 5 – Основные физические свойства железа
Свойство | Значение | |
Ni | Pt | |
Цвет | Серебристо-белый | Белый |
Структура | Очень твердый | Пластичный |
Температура плавления, °С | 1453 | 1769 |
Химические свойства
Никель при повышенных температурах реагирует с галогенами с образованием солей, и с кислородом с образованием оксида никеля (II), в то время как платина очень устойчива к любым взаимодействиям. Реагирует с серой и галогенами в мелкораздробленном виде.
Никель медленно взаимодействует с разбавленными кислотами, когда платина реагирует только с «царской водкой».
Применение
Оба металла активно используются в переработке нефти в качестве катализаторов.
Катализатор – вещество, которое ускоряет химическую реакцию.
Каждые 2-3 года закупаются тонны реагентов, в составе которых всего несколько десятых процента платины или никеля, но именно они определяют их стоимость.
Также они используются в составе высококачественных сплавов, а никель – как антикоррозионное покрытие.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на вычисление количества исходного реагента.
Условие задачи: При растворении меди в растворе концентрированной азотной кислоты выделилось 2 л газа. Вычислите массу прореагировавшей меди.
Шаг первый. Напишем уравнение реакции и определим, какой газ выделился, расставим коэффициенты.
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2↑ + 2H2O
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим количество вещества меди:
По уравнению реакции: n(Cu) = 0,5n(NO2), тогда
n(Cu) = 0,5 ∙ 0,089 = 0,044 (моль)
Шаг четвёртый. Вычислим массу меди:
m(Cu) = 0,044 ∙ 46 = 2,024 (г)
Ответ: 2,024 (г).
- Решение задачи на выход продукта.
Условия задачи: при обжиге 8,515 г сульфида цинка с последующим восстановлением оксида с помощью угля выделилось 3,45 л газа. Рассчитайте выход реакции обжига, если выход реакции восстановления равен 60%.
Шаг первый. Запишем уравнения реакций и вычислим молярные массы компонентов:
ZnS + O2 = ZnO + SO2↑
ZnO + C = Zn + CO↑
M (ZnO) = 81 г/моль
Шаг второй. Вычислим количество вещества газа:
Шаг третий. Вычислим массу оксида цинка:
Так как выход реакции составил 60%, то
n (ZnO) = 0,6n (CO) = 0,6 ∙ 0,154 = 0,0924 (моль)
Шаг четвёртый. Вычислим массу оксида цинка:
Шаг пятый. Вычислим выход реакции:
Ответ: 87, 89%.
Сплавы платино-медные. Методы определения меди – РТС-тендер
ГОСТ 12551.1-82
Группа В59
ОКСТУ 1709*
______________
* Введено дополнительно, Изм. N 1.
Cрок действия с 01.01.84
до 01.01.89*
________________________________
* Ограничение срока действия снято по протоколу N 3-93
Межгосударственного Совета по стандартизации,
метрологии и сертификации (ИУС N 5/6, 1993 год). —
Примечание изготовителя базы данных.
РАЗРАБОТАН Министерством цветной металлургии СССР
ИСПОЛНИТЕЛИ
А.А.Куранов, Г.С.Хаяк, Н.С.Степанова, Н.Д.Сергиенко, И.Г.Сажина, Т.И.Беляева, Е.Б.Сафонова
ВНЕСЕН Министерством цветной металлургии СССР
Зам. министра В.В.Бородай
УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Государственного Комитета СССР по стандартам от 30 сентября 1982 г. N 3866
ВЗАМЕН ГОСТ 12551-67 в части разд.2
ВНЕСЕНО Изменение N 1, утвержденное и введенное в действие Постановлением Государственного комитета СССР по стандартам от 20.04.88 N 1085 с 01.01.89
Изменение N 1 внесено изготовителем базы данных по тексту ИУС N 7, 1988 год
Настоящий стандарт устанавливает фотометрический и атомно-абсорбционный методы определения меди (при массовой доле меди от 2,0 до 3,0% и от 8,0 до 9,0%) в платино-медных сплавах.
1. ОБЩИЕ ТРЕБОВАНИЯ
1.1. Общие требования к методам анализа — по ГОСТ 22864-83.
(Измененная редакция, Изм. N 1).
1.2. Числовое значение результата анализа должно оканчиваться цифрой того же разряда, что и нормируемый показатель марочного состава.
(Введен дополнительно, Изм. N 1).
2. ФОТОМЕТРИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
2.1. Сущность метода
Метод основан на образовании окрашенного комплекса меди с аммиаком, предварительно связывая платину в бесцветный комплекс пиросернистокислым натрием.
2.2. Аппаратура, реактивы и растворы
Фотоэлектроколориметр или спектрофотометр.
Кислота соляная по ГОСТ 3118-77.
Кислота азотная по ГОСТ 4461-77 и разбавленная 1:1.
Смесь азотной и соляной кислот в соотношении 1:3.
Аммиак водный по ГОСТ 3760-79 и разбавленный 1:40.
Натрий сернистокислый пиро, свежеприготовленный раствор с массовой долей 25%.
Платина по ГОСТ 13498-79 марки 99,9.
Медь по ГОСТ 859-78* марки МВЧк, М00к или М00б.
______________
* На территории Российской Федерациидействует ГОСТ 859-2001, здесь и далее по тексту. — Примечание изготовителя базы данных.
Стандартный раствор меди: 0,5000 г меди растворяют в 20 см азотной кислоты (1:1), нагревают до удаления окислов азота, переносят в мерную колбу вместимостью 500 см, доливают водой до метки и перемешивают.
(Измененная редакция, Изм. N 1).
2.3. Проведение анализа
2.3.1. Приготовление стандартного раствора сплава
Навеску платины помещают в стакан вместимостью 150 см, растворяют при нагревании в 10 см смеси кислот, вводят стандартный раствор меди и выпаривают примерно до 0,5 см. Масса навески платины и объем стандартного раствора меди приведены в табл.1.
Таблица 1
Массовая доля меди, % | Масса навески платины, г | Объем стандартного раствора меди, см |
2,5 | 0,29 | 2,5 |
8,5 | 0,09 | 8,5 |
2.3.2. Определение меди
Пробы сплава поступают для анализа в виде тонкой ленты или стружки толщиной до 0,2 мм.
Навеску сплава массой 0,3 г (при массовой доле меди от 2,0 до 3,0%) или 0,1 г (при массовой доле меди от 8,0 до 9,0%) помещают в стакан вместимостью 150 см, растворяют при нагревании в 20 см смеси кислот и раствор выпаривают до 0,5 см.
В анализируемый и стандартный растворы сплава прибавляют 10 см воды, 10 см раствора пиросернистокислого натрия и раствор оставляют на 10 мин. Затем прибавляют 25 см водного аммиака, растворы охлаждают и фильтруют в мерные колбы вместимостью 100 см. Фильтр промывают холодным раствором аммиака (1:10). Раствор доливают до метки водой, перемешивают и измеряют оптическую плотность раствора на фотоэлектроколориметре с красным светофильтром или на спектрофотометре при длине волны 670 нм в кюветах с толщиной поглощающего свет слоя 50 мм.
Раствором сравнения служит раствор, не содержащий платины и меди
.
2.4. Обработка результатов
2.4.1. Массовую долю меди () в процентах вычисляют по формуле
,
где — оптическая плотность анализируемого раствора;
— оптическая плотность стандартного раствора сплава;
— массовая доля меди в стандартном растворе сплава, %.
2.4.2. Абсолютные допускаемые расхождения результатов параллельных определений ( — показатель сходимости) с доверительной вероятностью 0,95 не должны превышать 0,15%.
Абсолютные расхождения средних результатов определений, полученных в двух различных лабораториях ( — показатель воспроизводимости) не должны превышать 0,25%.
(Измененная редакция, Изм. N 1).
2.4.3. Контроль точности результатов анализа
Контроль точности результатов определения массовой доли меди проводится воспроизведением ее массовой доли в искусственной смеси химического состава, близкого составу анализируемого сплава, проведенной через весь ход анализа.
Результаты анализа проб считаются точными, если абсолютная разность максимального и минимального значений массовых долей меди в искусственной смеси не превышает 0,05% при массовой доле меди от 2,0 до 3,0% и 0,09% — при массовой доле меди от 8,0 до 9,0%.
(Введен дополнительно, Изм. N 1).
3. АТОМНО-АБСОРБЦИОННЫЙ МЕТОД ОПРЕДЕЛЕНИЯ МЕДИ
3.1. Сущность метода
Метод основан на измерении абсорбции света атомами меди при введении раствора сплава в воздушно-ацетиленовое пламя.
3.2. Аппаратура, реактивы и растворы
Спектрофотометр атомно-абсорбционный.
Лампа с полым катодом, излучающая спектр атомов меди.
Кислота соляная по ГОСТ 3118-77 и раствор с массовой долей 3%.
Кислота азотная по ГОСТ 4461-77.
Смесь азотной и соляной кислот в соотношении 1:3.
Медь по ГОСТ 859-78 марки МВЧк, М00к или М00б.
Стандартные растворы меди.
Раствор А: 0,5000 г меди растворяют в 10 см смеси кислот, переносят в мерную колбу вместимостью 500 см, доливают до метки раствором соляной кислоты с массовой долей 3% и перемешивают.
1 см раствора А содержит 1 мг меди.
Платина по ГОСТ 13498-79 марки 99,9.
Стандартные растворы платины.
Раствор А: 1,0000 г платины растворяют при нагревании в 30 см смеси кислот, выпаривают до 5 см, переносят в мерную колбу вместимостью 100 см, доливают до метки раствором соляной кислоты с массовой долей 3% и перемешивают.
1 см раствора А содержит 10 мг платины.
Раствор Б: 10 см раствора А помещают в мерную колбу вместимостью 100 см, доливают до метки раствором соляной кислоты с массовой долей 3% и перемешивают.
1 см раствора Б содержит 1 мг платины.
(Измененная редакция, Изм. N
1).
3.3. Проведение анализа
3.3.1. Навеску сплава массой 0,1 г помещают в стакан вместимостью 100 см и растворяют при нагревании в 20 см смеси кислот. Раствор выпаривают до 5 см, переносят в мерную колбу (табл.2), доливают до метки раствором соляной кислоты с массовой долей 3% и перемешивают.
Таблица 2
Массовая доля меди, % | Объем мерной колбы, см | Объем аликвотной части, см |
От 2,0 до 3,0 | 100 | 10 |
» 8,0 » 9,0 | 200 | 5 |
Из мерной колбы отбирают аликвотную часть (см. табл.2), помещают в мерную колбу вместимостью 50 см, доливают до метки раствором соляной кислоты с массовой долей 3% и перемешивают.
Одновременно в мерной колбе вместимостью 100 см готовят стандартный раствор сплава с концентрацией меди 5 мг/см для сплавов с массовой долей меди от 2,0 до 3,0% или 4,25 мг/см для сплавов с массовой долей меди от 8,0 до 9% меди (табл.3).
Таблица 3
Содержание меди в стандартном растворе сплава, мг/см | Объем стандартного раствора Б меди, см | Объем стандартного раствора Б платины, см |
5,00 | 5,00 | 19,50 |
4,25 | 4,25 | 4,60 |
Анализируемый и стандартный растворы сплава распыляют в воздушно-ацетиленовое пламя атомно-абсорбционного спектрофотометра и измеряют абсорбцию при длине волны 324,7 нм, установке щели 4 (0,7 нм), токе лампы 25 мА.
Расход воздуха и ацетилена регулируют получением максимальной абсорбции стандартного раствора сплава.
(Измененная редакция, Изм. N 1).
3.4. Обработка результатов — по п.2.4.
3.4.1. Метод применяют при разногласиях в оценке качества сплавов.
3.4.2. Контроль правильности результатов анализа — по п.2.4.3.
(Введен дополнительно, Изм. N 1).
Электронный текст документа
подготовлен АО «Кодекс» и сверен по:
официальное издание
Сплавы платино-медные. Методы анализа.
ГОСТ 12551.1-82, ГОСТ 12551.2-82: Сб. ГОСТов. —
М.: Издательство стандартов, 1982
Редакция документа с учетом
изменений и дополнений
подготовлена АО «Кодекс»
Даны цинк медь оксид цинка. Составим формулы солей. — с разбавленной азотной кислотой
Напишите уравнения реакций по схемам Пожааалуйста 1)фосфат кальция+хлорид бария=фосфат бария+хлорид кальция 2)Карбонат натрия + нитрат калия=карбонаткальция+нитрат натрия 3)Серная кислота+гидроксид магния=сульфат магния+фода 4)Оксид лития+соляная кислота=хлорид лития+вода 5)Оксид серы(V1)+гидроксид натрия =сульфат натрия+вода 6)Алюминий +бромоводородная кислота=бромид алюминия+водород 7)Нитрат свинца(11)+сульфид натрия =сульфид свинца(11)+кремнивая кислота 8)Силикат калия+фосфорная кислота=фосфат калия+кремнивая кислота 9)гидроксид цинка-йодоводородная кислота=йодид цинка+вода 10)Оксид азота(V)+гидроксид натрия=нетрат калия+вода 11)Нитрат бария+серная кислота=сульфат бария+азотная кислота 12)Оксид углерода (1V)-гидроксид кальция=карбонат кальция+вода 13)Оксид серы(1V)+оксид калия=сульфат калия 14)Оксид магния+оксид фосфора(V)=фосфат магния 15)Азотная кислота+годроксид хрома(111)=нитрат хрома(111)+вода 16)Сероводородная кислота +нетрат серебра=сульфид серебра+азотная кислота 17)Оксид железа(111)+водород=железо+вода 18)Нитрат меди(11)+алюминий=медь+нитрат алюминия 19)Гидроксид алюминия=оксид алюминия+вода
а)натрий—гидроксид натрия—сульфид натрия—хлорид натрия—сульфат натрия б)магний—сульфат магния—гидроксид магния—оксид магния—хлорид магнияв)свинец—оксид свинца(II)—нитрат свинца(II)—гидроксид свинца(II)—оксид свинца(II)-сульфат свинца(II) г)сера—сероводород—сульфит калия—хлорид калия—хлорид калия—соляная кислота д)кальций—гидроксид кальция—карбонат кальция—нитрат кальция—азотная кислота е)алюминий—сульфат алюминия—гидроксид алюминия—оксид алюминия—нитрат алюминия ж)сера—оксид серы(IV)—cернистая кислота—сульфит натрия—сернистая кислота з)кислород—оксид алюминия—сульфат алюминия—гидроксид алюминия—метаалюминат натрия к)алюминий—хлорид алюминия —нитрат алюминия—гидроксид алюминия—сульфат алюминия л)медь—хлорид меди (II)—медь—оксид меди(II)—нитрат меди(II) м)железо—хлорид железа(II)—гидроксид железа(II)—сульфат железа(II)—железо н)железо—хлорид железа(III)—нитрат железа(III)—сульфат железа(III)—железо
1. С водным раствором карбоната натрия реагирует1)сульфат калия 3)сульфид меди(II)
2)оксид углерода(IV) 4)кремниевая кислота
2. С раствором хлорида бария реагирует
1)гидроксид кальция 3)сульфат натрия
2)гидроксид меди(II) 4) Водород
3. С раствором нитрата кальция реагирует
1) карбонат натрия 3)кремний
2)цинк 4) бромоводородная кислота
4. при взаимодействии 1 моль и 2 моль KoH образуется
1)средняя соль 3)кислая соль
2)основная соль 4)вещества не реагируют
5. В результате реакции силиката натрия с соляной кислотой образуется
1)силицид натрия 3)кремниевая кислота
2)Кремний 4)оксид кремния
1. Соль и щёлочь образуютс при взаимодействии растворов
1)
2.С раствором нитрата бария реагирует
1)хлорид натрия 3)карбонат калия
2)медь 4)карбонат кальция
3. С раствором нитрата бария реагирует
1)сульфат натрия 3)железо
2)хлорид слова 4)медь
4. С раствором сульфата цинка реагирует
1) магний 3)сера
2) оксид кремния 4)гидроксид аллюминия
5. химическая реакция (в растворе) возможна между
6) Между какими веществами протекает химическая реакция?
1) карбонатом кальция и нитратом натрия
2)силикатом магния и фосфатом калия
3)сульфатом железа (II) и сульфидом свинца
4)хлоридом бария и сульфатом цинка
Медь (Cu) относится к d-элементам и расположена в IB группе периодической таблицы Д.И.Менделеева. Электронная конфигурация атома меди в основном состоянии записывается виде 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 вместо предполагаемой формулы 1s 2 2s 2 2p 6 3s 2 3p 6 3d 9 4s 2 . Другими словами, в случае атома меди наблюдается так называемый «проскок электрона» с 4s-подуровня на 3d-подуровень. Для меди, кроме нуля, возможны степени окисления +1 и +2. Степень окисления +1 склонна к диспропорционированию и стабильна лишь в нерастворимых соединениях типа CuI, CuCl, Cu 2 O и т. д., а также в комплексных соединениях, например, Cl и OH. Соединения меди в степени окисления +1 не имеют конкретной окраски. Так, оксид меди (I) в зависимости от размеров кристаллов может быть темно-красный (крупные кристаллы) и желтый (мелкие кристаллы), CuCl и CuI — белыe, а Cu 2 S — черно-синий. Более химически устойчивой является степень окисления меди, равная +2. Соли, содержащие медь в данной степени окисления, имеют синюю и сине-зеленую окраску.
Медь является очень мягким, ковким и пластичным металлом с высокой электро- и теплопроводностью. Окраска металлической меди красно-розовая. Медь находится в ряду активности металлов правее водорода, т.е. относится к малоактивным металлам.
с кислородом
В обычных условиях медь с кислородом не взаимодействует. Для протекания реакции между ними требуется нагрев. В зависимости от избытка или недостатка кислорода и температурных условий может образовать оксид меди (II) и оксид меди (I):
с серой
Реакция серы с медью в зависимости от условий проведения может приводить к образованию как сульфида меди (I), так и сульфида меди (II). При нагревании смеси порошкообразных Cu и S до температуры 300-400 о С образуется сульфид меди (I):
При недостатке серы и проведении реакции при температуре более 400 о С образуется сульфид меди (II). Однако, более простым способом получения сульфида меди (II) из простых веществ является взаимодействие меди с серой, растворенной в сероуглероде:
Данная реакция протекает при комнатной температуре.
с галогенамиС фтором, хлором и бромом медь реагирует, образуя галогениды с общей формулой CuHal 2 , где Hal – F, Cl или Br:
Cu + Br 2 = CuBr 2
В случае с йодом — самым слабым окислителем среди галогенов — образуется иодид меди (I):
С водородом, азотом, углеродом и кремнием медь не взаимодействует.
с кислотами-неокислителями
Кислотами-неокислителями являются практически все кислоты, кроме концентрированной серной кислоты и азотной кислоты любой концентрации. Поскольку кислоты-неокислители в состоянии окислить только металлы, находящиеся в ряду активности до водорода; это означает, что медь с такими кислотами не реагирует.
с кислотами-окислителями
— концентрированной серной кислотой
С концентрированной серной кислотой медь реагирует как при нагревании, так и при комнатной температуре. При нагревании реакция протекает в соответствии с уравнением:
Поскольку медь не является сильным восстановителем, сера восстанавливается в данной реакции только до степени окисления +4 (в SO 2).
— с разбавленной азотной кислотой
Реакция меди с разбавленной HNO 3 приводит к образованию нитрата меди (II) и монооксида азота:
3Cu + 8HNO 3 (разб.) = 3Cu(NO 3) 2 + 2NO + 4H 2 O
— с концентрированной азотной кислотой
Концентрированная HNO 3 легко реагирует с медью при обычных условиях. Отличие реакции меди с концентрированной азотной кислотой от взаимодействия с разбавленной азотной кислотой заключается в продукте восстановления азота. В случае концентрированной HNO 3 азот восстанавливается в меньшей степени: вместо оксида азота (II) образуется оксид азота (IV), что связано с большей конкуренцией между молекулами азотной кислоты в концентрированной кислоте за электроны восстановителя (Cu):
Cu + 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
с оксидами неметаллов
Медь реагирует с некоторыми оксидами неметаллов. Например, с такими оксидами, как NO 2 , NO, N 2 O медь окисляется до оксида меди (II), а азот восстанавливается до степени окисления 0, т.е. образуется простое вещество N 2:
В случае диоксида серы, вместо простого вещества (серы) образуется сульфид меди(I). Связано это с тем, что медь с серой, в отличие от азота, реагирует:
с оксидами металлов
При спекании металлической меди с оксидом меди (II) при температуре 1000-2000 о С может быть получен оксид меди (I):
Также металлическая медь может восстановить при прокаливании оксид железа (III) до оксида железа (II):
с солями металлов
Медь вытесняет менее активные металлы (правее нее в ряду активности) из растворов их солей:
Cu + 2AgNO 3 = Cu(NO 3) 2 + 2Ag↓
Также имеет место интересная реакция, в которой медь растворяется в соли более активного металла – железа в степени окисления +3. Однако противоречий нет, т.к. медь не вытесняет железо из его соли, а лишь восстанавливает его со степени окисления +3 до степени окисления +2:
Fe 2 (SO 4) 3 + Cu = CuSO 4 + 2FeSO 4
Cu + 2FeCl 3 = CuCl 2 + 2FeCl 2
Последняя реакция используется при производстве микросхем на стадии травления медных плат.
Коррозия меди
Медь со временем подвергается коррозии при контакте с влагой, углекислым газом и кислородом воздуха:
2Cu + H 2 O + СО 2 + О 2 = (CuOН) 2 СO 3
В результате протекания данной реакции медные изделия покрываются рыхлым сине-зеленым налетом гидроксокарбоната меди (II).
Химические свойства цинка
Цинк Zn находится в IIБ группе IV-го периода. Электронная конфигурация валентных орбиталей атомов химического элемента в основном состоянии 3d 10 4s 2 . Для цинка возможна только одна единственная степень окисления, равная +2. Оксид цинка ZnO и гидроксид цинка Zn(ОН) 2 обладают ярко выраженными амфотерными свойствами.
Цинк при хранении на воздухе тускнеет, покрываясь тонким слоем оксида ZnO. Особенно легко окисление протекает при высокой влажности и в присутствии углекислого газа вследствие протекания реакции:
2Zn + H 2 O + O 2 + CO 2 → Zn 2 (OH) 2 CO 3
Пар цинка горит на воздухе, а тонкая полоска цинка после накаливания в пламени горелки сгорает в нем зеленоватым пламенем:
При нагревании металлический цинк также взаимодействует с галогенами, серой, фосфором:
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует.
Цинк реагирует с кислотами-неокислителями с выделением водорода:
Zn + H 2 SO 4 (20%) → ZnSO 4 + H 2
Zn + 2HCl → ZnCl 2 + H 2
Особенно легко растворяется в кислотах технический цинк, поскольку содержит в себе примеси других менее активных металлов, в частности, кадмия и меди. Высокочистый цинк по определенным причинам устойчив к воздействию кислот. Для того чтобы ускорить реакцию, образец цинка высокой степени чистоты приводят в соприкосновение с медью или добавляют в раствор кислоты немного соли меди.
При температуре 800-900 o C (красное каление) металлический цинк, находясь в расплавленном состоянии, взаимодействует с перегретым водяным паром, выделяя из него водород:
Zn + H 2 O = ZnO + H 2
Цинк реагирует также и с кислотами-окислителями: серной концентрированной и азотной.
Цинк как активный металл может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу и даже сероводород.
Zn + 2H 2 SO 4 = ZnSO 4 + SO 2 + 2H 2 O
Состав продуктов восстановления азотной кислоты определяется концентрацией раствора:
Zn + 4HNO 3 (конц.) = Zn(NO 3) 2 + 2NO 2 + 2H 2 O
3Zn + 8HNO 3 (40%) = 3Zn(NO 3) 2 + 2NO + 4H 2 O
4Zn +10HNO 3 (20%) = 4Zn(NO 3) 2 + N 2 O + 5H 2 O
5Zn + 12HNO 3 (6%) = 5Zn(NO 3) 2 + N 2 + 6H 2 O
4Zn + 10HNO 3 (0,5%) = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O
На направление протекания процесса влияют также температура, количество кислоты, чистота металла, время проведения реакции.
Цинк реагирует с растворами щелочей, при этом образуются тетрагидроксоцинкаты и водород:
Zn + 2NaOH + 2H 2 O = Na 2 + H 2
Zn + Ba(OH) 2 + 2H 2 O = Ba + H 2
С безводными щелочами цинк при сплавлении образует цинкаты и водород:
В сильнощелочной среде цинк является крайне сильным восстановителем, способным восстанавливать азот в нитратах и нитритах до аммиака:
4Zn + NaNO 3 + 7NaOH + 6H 2 O → 4Na 2 + NH 3
Благодаря комплексообразованию цинк медленно растворяется в растворе аммиака, восстанавливая водород:
Zn + 4NH 3 ·H 2 O → (OH) 2 + H 2 + 2H 2 O
Также цинк восстанавливает менее активные металлы (правее него в ряду активности) из водных растворов их солей:
Zn + CuCl 2 = Cu + ZnCl 2
Zn + FeSO 4 = Fe + ZnSO 4
Химические свойства хрома
Хром — элемент VIB группы таблицы Менделеева. Электронная конфигурация атома хрома записывается как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1 , т.е. в случае хрома, также как и в случае атома меди, наблюдается так называемый «проскок электрона»
Наиболее часто проявляемыми степенями окисления хрома являются значения +2, +3 и +6. Их следует запомнить, и в рамках программы ЕГЭ по химии можно считать, что других степеней окисления хром не имеет.
При обычных условиях хром устойчив к коррозии как на воздухе, так и в воде.
Взаимодействие с неметаллами
с кислородом
Раскаленный до температуры более 600 o С порошкообразный металлический хром сгорает в чистом кислороде образуя окcид хрома (III):
4Cr + 3O 2 = o t => 2Cr 2 O 3
с галогенами
С хлором и фтором хром реагирует при более низких температурах, чем с кислородом (250 и 300 o C соответственно):
2Cr + 3F 2 = o t => 2CrF 3
2Cr + 3Cl 2 = o t => 2CrCl 3
С бромом же хром реагирует при температуре красного каления (850-900 o C):
2Cr + 3Br 2 = o t => 2CrBr 3
с азотом
С азотом металлический хром взаимодействует при температурах более 1000 o С:
2Cr + N 2 = o t => 2CrN
с серойС серой хром может образовывать как сульфид хрома (II) так и сульфид хрома (III), что зависит от пропорций серы и хрома:
Cr + S = o t => CrS
2Cr + 3S = o t => Cr 2 S 3
С водородом хром не реагирует.
Взаимодействие со сложными веществами
Взаимодействие с водой
Хром относится к металлам средней активности (расположен в ряду активности металлов между алюминием и водородом). Это означает, что реакция протекает между раскаленным до красного каления хромом и перегретым водяным паром:
2Cr + 3H 2 O = o t => Cr 2 O 3 + 3H 2
Взаимодействие с кислотами
Хром при обычных условиях пассивируется концентрированными серной и азотной кислотами, однако, растворяется в них при кипячении, при этом окисляясь до степени окисления +3:
Cr + 6HNO 3(конц.) =t o => Cr(NO 3) 3 + 3NO 2 + 3H 2 O
2Cr + 6H 2 SO 4(конц) =t o => Cr 2 (SO 4) 3 + 3SO 2 + 6H 2 O
В случае разбавленной азотной кислоты основным продуктом восстановления азота является простое вещество N 2:
10Cr + 36HNO 3(разб) = 10Cr(NO 3) 3 + 3N 2 + 18H 2 O
Хром расположен в ряду активности левее водорода, а это значит, что он способен выделять H 2 из растворов кислот-неокислителей. В ходе таких реакций в отсутствие доступа кислорода воздуха образуются соли хрома (II):
Cr + 2HCl = CrCl 2 + H 2
Cr + H 2 SO 4(разб.) = CrSO 4 + H 2
При проведении же реакции на открытом воздухе, двухвалентный хром мгновенно окисляется содержащимся в воздухе кислородом до степени окисления +3. При этом, например, уравнение с соляной кислотой примет вид:
4Cr + 12HCl + 3O 2 = 4CrCl 3 + 6H 2 O
При сплавлении металлического хрома с сильными окислителями в присутствии щелочей хром окисляется до степени окисления +6, образуя хроматы :
Химические свойства железа
Железо Fe, химический элемент, находящийся в VIIIB группе и имеющий порядковый номер 26 в таблице Менделеева. Распределение электронов в атоме железа следующее 26 Fe1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 , то есть железо относится к d-элементам, поскольку заполняемым в его случае является d-подуровень. Для него наиболее характерны две степени окисления +2 и +3. У оксида FeO и гидроксида Fe(OH) 2 преобладают основные свойства, у оксида Fe 2 O 3 и гидроксида Fe(OH) 3 заметно выражены амфотерные. Так оксид и гидроксид железа (lll) в некоторой степени растворяются при кипячении в концентрированных растворах щелочей, а также реагируют с безводными щелочами при сплавлении. Следует отметить что степень окисления железа +2 весьма неустойчива, и легко переходит в степень окисления +3. Также известны соединения железа в редкой степени окисления +6 – ферраты, соли не существующей «железной кислоты» H 2 FeO 4 . Указанные соединения относительно устойчивы лишь в твердом состоянии, либо в сильнощелочных растворах. При недостаточной щелочности среды ферраты довольно быстро окисляют даже воду, выделяя из нее кислород.
Взаимодействие с простыми веществами
С кислородом
При сгорании в чистом кислороде железо образует, так называемую, железную окалину , имеющую формулу Fe 3 O 4 и фактически представляющую собой смешанный оксид, состав которого условно можно представить формулой FeO∙Fe 2 O 3 . Реакция горения железа имеет вид:
3Fe + 2O 2 =t o => Fe 3 O 4
С серой
При нагревании железо реагирует с серой, образуя сульфид двухвалентого железа:
Fe + S =t o => FeS
Либо же при избытке серы дисульфид железа :
Fe + 2S =t o => FeS 2
С галогенами
Всеми галогенами кроме йода металлическое железо окисляется до степени окисления +3, образуя галогениды железа (lll):
2Fe + 3F 2 =t o => 2FeF 3 – фторид железа (lll)
2Fe + 3Cl 2 =t o => 2FeCl 3 – хлорид железа (lll)
Йод же, как наиболее слабый окислитель среди галогенов, окисляет железо лишь до степени окисления +2:
Fe + I 2 =t o => FeI 2 – йодид железа (ll)
Следует отметить, что соединения трехвалентного железа легко окисляют иодид-ионы в водном растворе до свободного йода I 2 при этом восстанавливаясь до степени окисления +2. Примеры, подобных реакций из банка ФИПИ:
2FeCl 3 + 2KI = 2FeCl 2 + I 2 + 2KCl
2Fe(OH) 3 + 6HI = 2FeI 2 + I 2 + 6H 2 O
Fe 2 O 3 + 6HI = 2FeI 2 + I 2 + 3H 2 O
С водородом
Железо с водородом не реагирует (с водородом из металлов реагируют только щелочные металлы и щелочноземельные):
Взаимодействие со сложными веществами
Взаимодействие с кислотами
С кислотами-неокислителями
Так как железо расположено в ряду активности левее водорода, это значит, что оно способно вытеснять водород из кислот-неокислителей (почти все кислоты кроме H 2 SO 4 (конц.) и HNO 3 любой концентрации):
Fe + H 2 SO 4 (разб.) = FeSO 4 + H 2
Fe + 2HCl = FeCl 2 + H 2
Нужно обратить внимание на такую уловку в заданиях ЕГЭ, как вопрос на тему того до какой степени окисления окислится железо при действии на него разбавленной и концентрированной соляной кислоты. Правильный ответ – до +2 в обоих случаях.
Ловушка здесь заключается в интуитивном ожидании более глубокого окисления железа (до с.о. +3) в случае его взаимодействия с концентрированной соляной кислотой.
Взаимодействие с кислотами-окислителями
С концентрированными серной и азотной кислотами в обычных условиях железо не реагирует по причине пассивации. Однако, реагирует с ними при кипячении:
2Fe + 6H 2 SO 4 = o t => Fe 2 (SO 4) 3 + 3SO 2 + 6H 2 O
Fe + 6HNO 3 = o t => Fe(NO 3) 3 + 3NO 2 + 3H 2 O
Обратите внимание на то, что разбавленная серная кислота окисляет железо до степени окисления +2, а концентрированная до +3.
Коррозия (ржавление) железа
На влажном воздухе железо весьма быстро подвергается ржавлению:
4Fe + 6H 2 O + 3O 2 = 4Fe(OH) 3
С водой в отсутствие кислорода железо не реагирует ни в обычных условиях, ни при кипячении. Реакция с водой протекает лишь при температуре выше температуры красного каления (>800 о С). т.е..
Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d 10 4s 2 . В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d 10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O 2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl 2 → ZnCl 2 .
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP 2 или 3Zn + 2P → Zn 3 P 2 .
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H 2 O → ZnO + H 2 .
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl 2 + H 2 ;
Zn + H 2 SO 4 → ZnSO 4 + H 2 .
Взаимодействует с разбавленной азотной кислотой, образуя нитрат цинка и нитрат аммония:
4Zn + 10HNO 3 → 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H 2 SO 4 → ZnSO 4 + SO 2 + 2H 2 O;
Zn + 4HNO 3 → Zn(NO 3) 2 + 2NO 2 + 2H 2 O
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H 2 O → Na 2 + H 2
при сплавлении образует цинкаты:
Zn + 2KOH → K 2 ZnO 2 + H 2 .
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH 3 → Zn 3 N 2 + 3H 2 ;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH 3 + 2H 2 O → (OH) 2 + H 2 .
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO 4 → Cu + ZnSO 4 ;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см 3 , температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO 2 ;
ZnO + H 2 → Zn + H 2 O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl 2 + H 2 O;
ZnO + 2NaOH + H 2 O → Na 2 .
При сплавлении с оксидами металлов образует цинкаты:
ZnO + CoO → CoZnO 2 .
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO 2 → Zn 2 SiO 4 ,
ZnO + B 2 O 3 → Zn(BO 2) 2 .
Гидроксид цинка (II) Zn(OH) 2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см 3 , при температуре выше 125°С разлагается:
Zn(OH) 2 → ZnO + H 2 O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH) 2 + H 2 SO 4 → ZnSO 4 + 2H 2 O;
Zn(OH) 2 + 2NaOH → Na 2 ;
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH) 2 + 4NH 3 → (OH) 2 .
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl 2 + 2NaOH → Zn(OH) 2 + 2NaCl.
Сплав цинка с медью — латунь — был известен еще в Древней Греции, Древнем Египте, Индии (VII в.), Китае (XI в.). Долгое время не удавалось выделить чистый цинк. В 1746 А. С. Маргграф разработал способ получения чистого цинка путём прокаливания смеси его оксида с углём без доступа воздуха в глиняных огнеупорных ретортах с последующей конденсацией паров цинка в холодильниках. В промышленном масштабе выплавка цинка началась в XVII в.
Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Парацельса и других исследователей 16-17 вв. и восходит, возможно, к древнегерманскому «цинко» — налет, бельмо на глазу. Общеупотребительным название «цинк» стало только в 1920-х гг.
Нахождение в природе, получение:
Наиболее распространенный минерал цинка — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета. Видимо, за это минерал и называют обманкой. Цинковую обманку считают первичным минералом, из которого образовались другие минералы элемента № 30: смитсонит ZnCO 3 , цинкит ZnO, каламин 2ZnO·SiO 2 ·Н 2 O. На Алтае нередко можно встретить полосатую «бурундучную» руду — смесь цинковой обманки и бурого шпата. Кусок такой руды издали действительно похож на затаившегося полосатого зверька.
Выделение цинка начинается с концентрирования руды методами седиментации или флотации, затем ее обжигают до образования оксидов:
2ZnS + 3О 2 = 2ZnО + 2SO 2
Оксид цинка перерабатывают электролитическим методом или восстанавливают коксом.
В первом случае цинк выщелачивают из сырого оксида разбавленным раствором серной кислоты, примесь кадмия осаждают цинковой пылью и раствор сульфата цинка подвергают электролизу. Металл 99,95%-ной чистоты осаждается на алюминиевых катодах.
Физические свойства:
В чистом виде — довольно пластичный серебристо-белый металл. При комнатной температуре хрупок, при сгибании пластинки слышен треск от трения кристаллитов (обычно сильнее, чем «крик олова»). При 100-150 °C цинк пластичен. Примеси, даже незначительные, резко увеличивают хрупкость цинка. Температура плавления — 692°C, температура кипения — 1180°C
Химические свойства:
Типичный амфотерный металл. Стандартный электродный потенциал -0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает. При нагревании цинк реагирует с галогенами, с фосфором, образуя фосфиды Zn 3 P 2 и ZnP 2 , с серой и ее аналогами, образуя различные халькогениды, ZnS, ZnSe, ZnSe 2 и ZnTe. С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn 3 N 2 получают реакцией цинка с аммиаком при 550-600°C.
Цинк обычной чистоты активно реагирует с растворами кислот и щелочей, образуя в последнем случае гидроксоцинкаты:
Zn + 2NaOH + 2H 2 O = Na 2 + H 2
Очень чистый цинк растворами кислот и щелочей не реагирует.
Для цинка характерны соединения со степенью окисления: +2.
Важнейшие соединения:
Оксид цинка — ZnО, белый, амфотерный, реагирует как с растворами кислот, так и со щелочами:
ZnO + 2NaOH = Na 2 ZnO 2 + Н 2 О (сплавление).
Гидроксид цинка — образуется в виде студенистого белого осадок при добавлении щелочи к водным растворам солей цинка. Амфотерный гидроксид
Соли цинка . Бесцветные кристаллические вещества. В водных растворах ионы цинка Zn 2+ образуют аквакомплексы 2+ и 2+ и подвергаются сильному гидролизу.
Цинкаты образуются при взаимодействии оксида или гидроксида цинка со щелочами. При сплавлении образуются метацинкаты (напр. Na 2 ZnO 2), которые растворяясь в воде переходят в тетрагидроксоцинкаты: Na 2 ZnO 2 + 2Н 2 О = Na 2 . При подкислении растворов в осадок выпадает гидроксид цинка.
Применение:
Производство антикоррозионных покрытий.
— Металлический цинк в виде брусков используют для защиты от коррозии стальных изделий, соприкасающихся с морской водой. Примерно половина всего производимого цинка используется для производства оцинкованной стали, одна треть — в горячем цинковании готовых изделий, остальное — для полосы и проволоки.
— Большое практическое значение имеют сплавы цинка — латуни (медь плюс 20-50% цинка). Для литья под давлением, помимо латуней, используется быстро растущее число специальных сплавов цинка.
— Еще одна область применения — производство сухих батарей, хотя в последние годы оно существенно сократилось.
— Теллурид цинка ZnTe используется как материал для фоторезисторов, приемников инфракрасного излучения, дозиметров и счетчиков радиоактивного излучения.
— Ацетат цинка Zn(CH 3 COO) 2 его используют как фиксатор при крашении тканей, консервант древесины, противогрибковое средство в медицине, катализатор в органическом синтезе. Ацетат цинка входит в состав зубных цементов, используется при производстве глазурей и фарфора.
Цинк — один из наиболее важных биологически активных элементов и необходим для всех форм жизни. Его роль обусловлена, в основном, тем, что он входит в состав более 40 важных ферментов. Установлена функция цинка в белках, отвечающих за распознавание последовательности оснований в ДНК и, следовательно, регулирующих перенос генетической информации в ходе репликации ДНК. Цинк участвует в углеводном обмене с помощью цинксодержащего гормона — инсулина. Только в присутствии цинка действует витамин А. Необходим цинк и для формирования костей.
В то же время ионы цинка токсичны.
Беспоместных С., Штанова И.
ХФ ТюмГУ, 571 группа.
Источники: Википедия:
И.В.ТРИГУБЧАК
Продолжение. Начало см. в № 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11/2008
ЗАНЯТИЕ 24
10-й класс (первый год обучения)
Цинк и его соединения
1. Положение в таблице Д.И.Менделеева, строение атома.
2. Происхождение названия.
3. Физические свойства.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Оксид и гидроксид цинка – свойства и методы получения.
Цинк расположен в побочной подгруппе II группы таблицы Д.И.Менделеева. Его электронная формула 1s 2 2s 2 p 6 3s 2 p 6 d 10 4s 2 . Цинк является d -элементом, проявляет в соединениях единственную степень окисления +2 (т.к. третий энергетический уровень в атоме цинка полностью заполнен электронами). Являясь амфотерным элементом с преобладанием металлических свойств, в соединениях цинк чаще входит в состав катиона, реже – аниона. Например,
Предполагают, что название цинка происходит от древнегерманского слова «цинко» (белый, бельмо). В свою очередь, это слово восходит к арабскому «харасин» (металл из Китая), что указывает на место выработки цинка, завезенного в средние века в Европу из Китая.
Ф и з и ч е с к и е с в о й с т в а
Цинк – металл белого цвета; на воздухе покрывается оксидной пленкой, и его поверхность тускнеет. На холоде это довольно хрупкий металл, но при температуре 100–150 °С цинк легко обрабатывается, образует сплавы с другими металлами.
Х и м и ч е с к и е с в о й с т в а
Цинк – металл средней химической активности, однако он более активен, чем железо. Цинк после разрушения оксидной пленки проявляет следующие химические свойства.
Zn + H 2 ZnH 2 .
2Zn + O 2 2ZnO.
Металлы (–).
Неметаллы (+):
Zn + Cl 2 ZnCl 2 ,
3Zn + 2P Zn 3 P 2 .
Zn + 2H 2 O Zn(OH) 2 + H 2 .
Основные оксиды (–).
Кислотные оксиды (–).
Основания (+):
Zn + 2NaOH + 2H 2 O = Na 2 + H 2 ,
Zn + 2NaOH (расплав) = Na 2 ZnO 2 + H 2 .
Кислоты-неокислители (+):
Zn + 2HCl = ZnCl 2 + H 2 .
Кислоты-окислители (+):
3Zn + 4H 2 SO 4 (конц.) = 3ZnSO 4 + S + 4H 2 O.
4Zn + 5H 2 SO 4 (конц.) = 4ZnSO 4 + H 2 S + 4H 2 O,
4Zn + 10HNO 3 (оч. разб.) = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O.
Соли (+/–):*
Zn + CuCl 2 = Cu + ZnCl 2 ,
Zn + NaCl нет реакции.
В п р и р о д е цинк встречается в виде соединений, важнейшими из которых являются сфалерит, или цинковая обманка (ZnS), смитсонит, или цинковый шпат (ZnCO 3), красная цинковая руда (ZnO).
В промышленности д л я п о л у ч е н и я цинка производят обжиг цинковой руды с целью получения оксида цинка, который затем восстанавливают углеродом:
2ZnS + 3O 2 2ZnO + 2SO 2 ,
2ZnO + C2Zn + CO 2 .
К важнейшим соединениям цинка относятся его о к с и д (ZnO) и г и д р о к с и д (Zn(OH) 2). Это кристаллические вещества белого цвета, проявляют амфотерные свойства:
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O,
ZnO + 2NaOH + H 2 O = Na 2 ,
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O,
Zn(OH) 2 + 2NaOH = Na 2 .
Оксид цинка можно получить окислением цинка, разложением гидроксида цинка или обжигом цинковой обманки:
Zn(OH) 2 ZnO + H 2 O,
2ZnS + 3O 2 2ZnO + 3SO 2 .
Гидроксид цинка получают реакцией обмена между раствором соли цинка и щелочи:
ZnCl 2 + 2NaOH (недостаток) = Zn(OH) 2 + 2NaCl.
Эти соединения н а д о з а п о м н и т ь: цинковая обманка (ZnS), цинковый купорос (ZnSO 4 7H 2 O).
Тест по теме «Цинк и его соединения»
1. Сумма коэффициентов в уравнении реакции цинка с очень разбавленной азотной кислотой:
а) 20; б) 22; в) 24; г) 29.
2. Цинк из концентрированного раствора карбоната натрия вытесняет:
а) водород; б) угарный газ;
в) углекислый газ; г) метан.
3. Растворы щелочей могут реагировать со следующими веществами (возможно несколько правильных ответов):
а) сульфатом меди и хлором;
б) оксидом кальция и медью;
в) гидросульфатом натрия и цинком;
г) гидроксидом цинка и гидроксидом меди.
4. Плотность 27,4%-го раствора гидроксида натрия составляет 1,3 г/мл. Молярная концентрация щелочи в этом растворе составляет:
а) 0,0089 моль/мл; б) 0,0089 моль/л;
в) 4 моль/л; г) 8,905 моль/л.
5. Для получения гидроксида цинка необходимо:
а) по каплям приливать раствор гидроксида натрия к раствору хлорида цинка;
б) по каплям приливать раствор хлорида цинка к раствору гидроксида натрия;
в) прилить избыток раствора гидроксида натрия к раствору хлорида цинка;
г) по каплям добавлять раствор гидроксида натрия к раствору карбоната цинка;
6. Исключите «лишнее» соединение:
а) H 2 ZnO 2 ; б) ZnCl 2 ; в) ZnO; г) Zn(OH) 2 .
7. Сплав меди и цинка массой 24,12 г обработали избытком разбавленной серной кислоты. При этом выделилось 3,36 л газа (н.у.). Массовая доля цинка в этом сплаве равна (в %):
а) 59,58; б) 40,42; в) 68,66; г) 70,4.
8. Гранулы цинка будут взаимодействовать с водным раствором (возможно несколько правильных ответов):
а) соляной кислоты; б) азотной кислоты;
в) гидроксида калия; г) сульфата алюминия.
9. Углекислый газ объемом 16,8 л (н.у.) был поглощен 400 г 28%-го раствора гидроксида калия. Массовая доля вещества, находящегося в растворе, составляет (в %):
а) 34,5; б) 31,9; в) 69; г) 63,7.
10. Масса образца карбоната цинка, в котором содержится 4,816 10 24 атомов кислорода, равна (в г):
а) 1000; б) 33,3; в) 100; г) 333,3.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б | а | а, в | г | а | б | б | а, б, в, г | б | г |
Задачи и упражнения на амфотерные металлы
Цепочки превращений
1. Цинк -> оксид цинка -> гидроксид цинка -> сульфат цинка -> хлорид цинка -> нитрат цинка -> сульфид цинка -> оксид цинка -> цинкат калия.
2. Оксид алюминия -> тетрагидроксоалюминат калия -> хлорид алюминия -> гидроксид алюминия -> тетрагидроксоалюминат калия.
3. Натрий -> гидроксид натрия -> гидрокарбонат натрия -> карбонат натрия -> гидроксид натрия -> гексагидроксохромат(III) натрия.
4. Хром -> хлорид хрома(II) -> хлорид хрома(III) -> гексагидроксохромат(III) калия + бром + гидроксид калия -> хромат калия -> дихромат калия -> оксид хрома(VI).
5. Сульфид железа(II) -> X 1 -> оксид железа(III) -> X 2 -> сульфид железа(II).
6. Хлорид железа(II) -> А -> Б -> В -> Г -> Д -> хлорид железа(II) (все вещества содержат железо; в схеме только три окислительно-восстановительные реакции подряд).
7. Хром -> Х 1 -> сульфат хрома(III) -> Х 2 -> дихромат калия -> Х 3 -> хром.
У р о в е н ь А
1. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-го раствора серной кислоты (плотность – 1,14 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите состав исходного сплава и объем газа (н.у.), выделившегося при растворении сплава.
Ответ. 57,6% Mg; 42,4% Al; 1,34 л H 2 .
2. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н.у.). Определите состав исходной смеси.
Решение
Уравнения реакций:
Пусть (Ca) = x моль, (Al) = 4y моль.
Тогда: 40x + 4 27y = 18,8.
По условию задачи:
v(С 2 Н 2 + СH 4) = 11,2 л.
Следовательно,
(С 2 Н 2 + СH 4) = 11,2/22,4 = 0,5 моль.
По уравнению реакции:
(С 2 Н 2) = (СaC 2) = (Сa) = х моль,
(СH 4) = 3/4(Al) = 3y моль,
x + 3y = 0,5.
Решаем систему:
x = 0,2, y = 0,1.
Следовательно,
(Ca) = 0,2 моль,
(Al) = 4 0,1 = 0,4 моль.
В исходной смеси:
m (Ca) = 0,2 40 = 8 г,
(Ca) = 8/18,8 = 0,4255, или 42,6%;
m (Al) = 0,4 27 = 10,8 г,
(Al) = 10,8/18,8 = 0,5744, или 57,4%.
Ответ . 42,6% Ca; 57,4% Al.
3. При взаимодействии 11,2 г металла VIII группы периодической системы с хлором образовалось 32,5 г хлорида. Определите металл.
Ответ . Железо.
4. При обжиге пирита выделилось 25 м 3 сернистого газа (температура 25 °С и давление 101 кПа). Вычислите массу образовавшегося при этом твердого вещества.
Ответ. 40,8 кг Fe 2 O 3 .
5. При прокаливании 69,5 г кристаллогидрата сульфата железа(II) образуется 38 г безводной соли. Определите формулу кристаллогидрата.
Ответ. Гептагидрат FeSO 4 7H 2 O.
6. При действии избытка соляной кислоты на 20 г смеси, содержащей медь и железо, выделился газ объемом 3,36 л (н.у.). Определите состав исходной смеси.
Ответ. 58% Cu; 42% Fe.
У р о в е н ь Б
1. Какой объем 40%-го раствора гидроксида калия (плотность – 1,4 г/мл) следует добавить к 50 г 10%-го раствора хлорида алюминия для того, чтобы первоначально выпавший осадок полностью растворился?
Ответ. 15 мл.
2. Металл сожгли в кислороде с образованием 2,32 г оксида, для восстановления которого до металла необходимо затратить 0,896 л (н.у.) угарного газа. Восстановленный металл растворили в разбавленной серной кислоте, полученный раствор дает синий осадок с красной кровяной солью. Определите формулу оксида.
Ответ: Fe 3 O 4 .
3. Какой объем 5,6 М раствора гидроксида калия потребуется для полного растворения 5 г смеси гидроксидов хрома(III) и алюминия, если массовая доля кислорода в этой смеси равна 50%?
Ответ. 9,3 мл.
4. К 14%-му раствору нитрата хрома(III) добавили сульфид натрия, полученный раствор отфильтровали и прокипятили (без потери воды), при этом массовая доля соли хрома уменьшилась до 10%. Определите массовые доли остальных веществ в полученном растворе.
Ответ. 4,38% NaNO 3 .
5. Смесь хлорида железа(II) с дихроматом калия растворили в воде и подкислили раствор соляной кислотой. Через некоторое время к раствору по каплям добавили избыток раствора гидроксида калия, выпавший осадок отфильтровали и прокалили до постоянной массы. Масса сухого остатка равна 4,8 г. Найдите массу исходной смеси солей, учитывая, что массовые доли хлорида железа(II) и дихромата калия в ней относятся как 3:2.
Ответ. 4,5 г.
6. 139 г железного купороса растворили в воде при температуре 20 °С и получили насыщенный раствор. При охлаждении этого раствора до 10 °С выпал осадок железного купороса. Найдите массу выпавшего осадка и массовую долю сульфата железа(II) в оставшемся растворе (растворимость сульфата железа(II) при 20 °С равна 26 г, а при 10 °С – 20 г).
Ответ. 38,45 г FeSO 4 7H 2 O; 16,67%.
Качественные задачи
1. Серебристо-белое легкое простое вещество А, обладающее хорошей тепло- и электропроводностью, реагирует при нагревании с другим простым веществом В. Образующееся твердое вещество растворяется в кислотах с выделением газа С, при пропускании которого через раствор сернистой кислоты выпадает осадок вещества В. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – Al, В – S, C – H 2 S.
2. Имеются два газа – А и В, молекулы которых трехатомны. При добавлении каждого из них к раствору алюмината калия выпадает осадок. Предложите возможные формулы газов А и В, учитывая, что эти газы бинарны. Напишите уравнения реакций. Как химическим путем можно различить эти газы?
Решение
Газ А – СО 2 ; газ В – Н 2 S.
2KAlO 2 + СO 2 + 3H 2 O = 2Al(OH) 3 + K 2 CO 3 ,
2KAlO 2 + H 2 S + 2H 2 O = 2Al(OH) 3 + K 2 S.
3. Нерастворимое в воде соединение А бурого цвета при нагревании разлагается с образованием двух оксидов, один из которых – вода. Другой оксид – В – восстанавливается углеродом с образованием металла С, вторым по распространенности в природе среди металлов. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – Fe(OH) 3 ,
В – Fe 2 O 3 , C – Fe.
4. Соль А образована двумя элементами, при обжиге ее на воздухе образуются два оксида: В – твердый, бурого цвета, и газообразный. Оксид В вступает в реакцию замещения с серебристо-белым металлом С (при нагревании). Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – FeS 2 , В – Fe 2 O 3 , C – Al.
* Знак +/– означает, что данная реакция протекает не со всеми реагентами или в специфических условиях.
Продолжение следует
Растворение меди в азотной кислоте | Выставка химия
Все студенты после 16 лет должны увидеть драматическую реакцию между медью и азотной кислотой. Это дает прекрасную возможность объяснить наблюдения с использованием электрохимических рядов и указывает на то, что о кислоте следует учитывать больше, чем о ее диссоциированных протонах. Эта адаптированная демонстрация не только показывает, насколько сильно медь реагирует с азотной кислотой, но и использует высокую растворимость диоксида азота для создания приятного фонтана.
Комплект
- Медная стружка 5 г
- 40 см 3 концентрированная азотная кислота
- 1 дм 3 Колба боросиликатная круглодонная. Желательно толстостенный.
- зажимная стойка
- трубка подачи
- 1 дм 3 колба коническая
- стекловата
- чаша или корыто
- защитные экраны (в открытой лаборатории)
Безопасность
- Концентрированная азотная кислота вызывает коррозию и окисление — надевайте защитные очки или защитную маску.Рекомендуется использовать нитриловые перчатки.
- Двуокись азота токсична — газ проходит через воду, в которой он растворяется и вступает в реакцию. Распространение любого оставшегося NO 2 можно контролировать с помощью кусочка стекловаты (ручка с щипцами или перчатками) в горлышке колбы.
- Эту демонстрацию можно проводить как в открытой лаборатории, так и в вытяжном шкафу.
- Перед демонстрацией проверьте колбу на наличие трещин или дефектов.
- Фонтанная реакция инициируется «обратным всасыванием» вслед за экзотермической реакцией, которая несет небольшой риск повреждения колбы.При проведении в открытой лаборатории следует использовать отдельные защитные экраны для защиты аудитории и демонстранта. Если это делается в вытяжном шкафу, створку можно опустить для той же цели. Чаша предназначена для сбора пролитой жидкости.
Процедура
Препарат
Наполните коническую колбу водой и добавьте кислоту в круглодонную колбу. Закрепите круглодонную колбу на месте и убедитесь, что трубка подачи, если она на месте, находится на дне колбы.Неплотно заткните горлышко конической колбы стекловатой, оставив трубку подачи на месте, готовую к снятию при добавлении меди. Подставьте под круглодонную колбу поилку или таз, чтобы уловить кислоту, которая может вытечь, если стекло выйдет из строя.
Перед публикой
Добавьте медь и установите подающую трубку. Опустите створку (если в вытяжном шкафу). Раствор быстро станет зеленым с выделением красно-коричневого диоксида азота. Примерно через 80 секунд реакция замедлится и газы в круглодонной колбе остынут.Когда вода втягивается обратно в сосуд за счет снижения давления, диоксид азота растворяется и вступает в реакцию в нем, вызывая драматический фонтан.
Альтернативные методы
Из-за своих толстых стенок колба Бюхнера может служить альтернативным сосудом для реакции, если подходящая колба с круглым дном недоступна.
Учебная цель
С первых же попыток исследовать реактивность студенты проводят эксперименты, которые показывают им, что медь не реагирует с кислотой.Один из пунктов обучения ряду реактивности — это стремянка к электрохимическому ряду, поэтому имеет смысл специально указать студентам, что это немного сложнее, чем это.
Эту демонстрацию можно представить, напомнив учащимся о практических занятиях, которые они будут выполнять ниже в школе, добавляя металлические полоски для разбавления соляной кислоты, либо демонстрируя это, либо давая учащимся список реакций для прогнозирования результатов (включая как соляную, так и азотные кислоты).
Реакция протекает как:
Cu (т.) + 4HNO 3 (водн.) → Cu (NO 3 ) 2 (водн.) + 2NO 2 (г) + 2H 2 O (л)
Первоначальный зеленый цвет связан с медью при лигировании нитрат-ионами в высокой концентрации в кислоте. * При добавлении воды она вытесняет нитрат-ионы, создавая характерный синий цвет в фонтане.
После демонстрации студенты могут попрактиковаться в использовании электрохимических рядов для прогнозирования результатов реакций путем объединения полуэлементов (из стандартного учебника), чтобы объяснить, как магний и медь реагируют с соляной и азотной кислотами, как они это делают.
неорганическая химия — Может ли диоксид азота образоваться при взаимодействии меди и разбавленной азотной кислоты?
Давно известно, что указанная реакция металлической меди и разбавленной азотной кислоты дает газ $ {NO} $, хотя точный механизм реакции остается сложным.
Механика, на мой взгляд, вероятно, включает в себя путь РЕДОКС с, например, $ {NO2} $ в качестве радикального продукта в случае процесса концентрированной азотной кислоты, в данном случае в некоторой степени просто следующим образом:
$ \ ce {Cu + 2 HNO3 -> Cu ++ + 2 OH- + 2.NO2} $
и, с большим количеством кислоты, нитрат меди, также упомянутый продукт, при этом итоговая реакция теперь полностью соответствует указанной выше реакции R2.
Возможно, менее сложно процитировать Википедию о механике взаимодействия оксида азота с кислородом:
При контакте с кислородом оксид азота превращается в диоксид азота:
$ \ ce {2 .NO + O2 → 2 .NO2} $
Предполагается, что это преобразование происходит через промежуточное звено ONOONO.
Я действительно согласен с предположением, что $ {N2O4} $, вероятно, поможет здесь, но как?
Чтобы ответить, я ссылаюсь на другой образовательный источник, который снова повторяет, хотя и отмечает невероятность термолекулярного пути, цитируя:
Элементарная термолекулярная реакция включает одновременное столкновение трех атомов, молекул или ионов. Термолекулярные элементарные реакции встречаются редко, потому что вероятность одновременного столкновения трех частиц меньше одной тысячной вероятности столкновения двух частиц.Однако существует несколько установленных термолекулярных элементарных реакций. Реакция оксида азота с кислородом, по-видимому, включает термолекулярные стадии:
$ \ ce {2 .NO + O2 → 2 .NO2} $
Тем не менее, импорта по предполагаемому пути, чтобы продолжить цитировать:
Элементарная реакция находится в состоянии равновесия, когда она протекает как в прямом, так и в обратном направлении с одинаковой скоростью. Рассмотрим димеризацию $ {NO} $ в термолекулярную, где $ {k_1} $ используется для представления константы скорости прямой реакции, а $ {k _ {- 1}} $ используется для представления константы скорости обратной реакции:
$ \ ce {.NO + .NO ⇋ N2O2} $
Итак, мое мнение относительно предполагаемого пути, который позволяет избежать маловероятной, но широко распространенной термолекулярной реакции (которая вместо этого может включать $ {N2O4} $), следующее:
$ \ ce {.NO + .NO ⇋ N2O2} $ (быстрое равновесие)
$ \ ce {N2O2 + O2 -> N2O4 (медленный)} $ Источник здесь
$ \ ce {N2O4 ⇋ .NO2 + .NO2} $
, где чистая реакция соответствует более широко заявленной одностадийной реакции:
$ \ ce {2 . \ circ = 0.0 $) выгоднее. Таким образом, вместо $ \ ce {H +} $ или $ \ ce {h3O} $ восстанавливается нитрат в азотной кислоте. Но при очень низкой концентрации нитрат-иона и низкой температуре, как объясняется уравнением Нернста, потенциал восстановления значительно уменьшается и в сочетании с эффектами перенапряжения образуется $ \ ce {h3} $, а не продукт восстановления нитрата, который образуется. $ \ ce {NO2} $.
В случае галогеновых кислот дальнейшее восстановление галогенов невозможно. В случае сульфат-аниона, хотя он имеет восстановительный потенциал $ 0.\ circ $ = Стандартный окислительно-восстановительный потенциал
РЕДАКТИРОВАТЬ
Окисление металла за счет восстановления другого вещества происходит всякий раз, когда это является термодинамически благоприятным. Обычно (кроме серебра и меди) металлы имеют отрицательный потенциал восстановления, что делает их окисление за счет водорода термодинамически выгодным, так как $ \ Delta G <0 $. Это приводит к спонтанной окислительно-восстановительной реакции. Это неверно, если существует кинетический или физический барьер для реакции. Например, азотная кислота делает железо пассивным из-за образования оксидного слоя на поверхности, который предотвращает дальнейший контакт и, следовательно, останавливает реакцию.
Реакция меди и азотной кислоты
Медь реагирует с азотной кислотой двояко. Но эта реакция отличается от типичной реакции металл — кислота. потому что азотная кислота окисляющая кислота.
Cu + HNO
3 реагирует по-разному и дает разные продуктыСогласно концентрация раствора кислоты HNO 3 , продукты реакции с медью разные.В этом уроке мы обсуждаем следующие темы.
Медь с реакцией с разбавленной азотной кислотой
Медь с концентрированной азотной кислотой реакции
Как уравновесить эти реакции
Вопросы и безопасность
Обе реакции являются окислительно-восстановительными реакциями и должны учитывать их степени окисления, когда реакции уравновешиваются.
Реагенты — Cu и HNO
3Теперь кратко рассмотрим реагенты, медь и HNO 3 .
Медь (Cu)
Медь — металл красновато-коричневого цвета, менее химически активный, чем другие металлы, такие как щелочные металлы и щелочноземельные металлы.
Азотная кислота — HNO
3HNO 3 — это оксокислота азота и сильная одноосновная кислота. HNO 3 может вести себя как окисляющая кислота.
Реакция разбавленной азотной кислоты и меди | Cu + HNO
3 = Cu (NO 3 ) 2 + NO + H 2 OРазбавленная азотная кислота реагирует с медью с образованием нитрата меди (Cu (NO 3 ) 2 ), оксид азота (NO) и вода как продукты.В этой реакции медь окисляется, а азотная кислота восстанавливается до оксида азота.
После реакции раствор, содержащий Cu (NO 3 ) 2 , имеет синий цвет.
Сбалансированное уравнение
3Cu (т.) + 8HNO 3 (водн.) → 3Cu (NO 3 ) 2 (водн.) + 2НО (г) + 4H 2 O (л)
Оксид азота — бесцветный газ, степень окисления азота +2.Таким образом, степень окисления азота снижается с +5 до +2, в то время как степень окисления азота медь увеличена с 0 до +2 .
Оксид азота — нейтральный газ.
Концентрированная азотная кислота и реакция меди | Cu + HNO
3 = Cu (NO 3 ) 2 + NO 2 + H 2 OКонцентрированная азотная кислота реагирует с медью с образованием нитрата меди (Cu (NO 3 ) 2 ), диоксид азота (NO 2 ) газ и вода как продукты.В этой реакции медь окисляется до своего +2 степень окисления, в то время как азотная кислота восстанавливается до диоксида азота.
После реакции раствор, содержащий Cu (NO 3 ) 2 , окрашен в синий цвет.
Сбалансированное уравнение
Cu (т.) + 4HNO 3 (водн.) → Cu (NO 3 ) 2 (водн.) + 2NO 2 (г) + 2H 2 O (л)
В этой реакции медь также окисляется до степени окисления +2.Но азот в азотной кислоте снижается с +5 до +4 за счет производства азота диоксид коричневого цвета и кислый газ.
Безопасность людей и инструментов во время реакции
Рекомендуется прочитать паспорта безопасности материалов (MSDS) Cu, HNO 3 , NO, NO 2 перед проведением этого эксперимента.
Когда Cu реагирует с азотной кислотой, NO или NO 2 могут быть представлены в виде продуктов в зависимости от температуры и концентрации кислотный раствор.Однако кислород преобразует образовавшийся NO в NO 2 .
NO 2 — очень токсичный газ и может вызвать множество проблем со здоровьем, включая смерть при вдыхании большого количества. Вы можете легко идентифицировать газ NO 2 , потому что он коричневого цвета и имеет очень неприятный запах.
Так что постарайтесь максимально предотвратить воздействие этого опасного газа в этом эксперименте и где угодно, когда вы работаете.
Как уравновесить реакции Cu + HNO
3Теперь мы узнаем, как уравновесить две реакции меди и азотной кислоты.Мы уже определили, какие атомы окисляются и восстанавливаются в реакциях. Возьмем реакцию меди с разбавленной азотной кислотой.
Как уравновесить реакцию Cu и разбавленной HNO
3 кислоты- Запишите степень окисления атомов, которые изменились в ходе реакции (медь и азот). Идентифицировать различия степеней окисления в реакции окисления (медь до иона меди +2) и реакции восстановления (азот от +5 до +2).Степень окисления азота в нитрат-ионе в правой части реакции составляет +5 и не изменилось.
- Разница в степени окисления реакции окисления составляет 2, а реакция восстановления — 3. Заменить разницу. между двумя реакциями. (См. Рисунок)
- Затем уравновесите другие атомы обычным способом.
Вопросы о HNO
3 и реакции Cuчто происходит, когда вы смешиваете азотную кислоту с металлом?
Азотная кислота может вести себя как кислота или окисляющая кислота.Это зависит от концентрации и температуры раствора азотной кислоты. Если очень разбавленная азотная кислота смешана с металлом, он может показать типичную кислотно-щелочную реакцию с выделением газообразного водорода. Но, если концентрация и температура азотной кислоты высоки, азотная кислота может вести себя как окисляющая кислота и образовывать диоксид азота или оксид азота.
Под действием меди с разбавленной азотной кислотой выделяются красновато-коричневые пары газообразного диоксида азота?
Да. Может выделяться газообразный диоксид азота.Но вы должны использовать концентрированную азотную кислоту. В противном случае выделяется газообразный оксид азота.
Почему и как вы называете азотную кислоту окисляющей кислотой в результате реакции меди и азотной кислоты?
При типичной реакции с кислым металлом выделяется газообразный водород. Но с медью, в то время как медь окисляется, азота азотная кислота восстанавливается до +4 или +2 степеней окисления вместо восстановления иона водорода +1 до газообразного водорода (0 степень окисления) .
Почему медь не реагирует с разбавленной кислотой HCl, как с разбавленной кислотой HNO
3 ?HCl кислота не является окисляющей кислотой, потому что атом хлора в HCl имеет степень окисления -1. Следовательно, этот атом хлора не восстанавливается, чтобы показать окислительно-кислотные свойства. Но в HNO 3 азот имеет +5, и его можно восстановить до более низких степеней окисления.
Каковы физические изменения, например изменение цвета, при окислении меди азотной кислотой?
Азотная кислота — бесцветный раствор.(но если азотная кислота разложилась, может быть желтый цвет). Когда медь вступает в реакцию с раствором азотной кислоты, приобретает синий цвет. Также высококонцентрированный и высокотемпературный азот кислота, можно увидеть, что во время реакции выделяется газ коричневого цвета.
Какие другие металлы, например медь, реагируют с азотной кислотой и выделяют диоксид азота?
Серебро реагирует с азотной кислотой с выделением диоксида азота и образованием нитрата серебра и воды.
Ag (т.) + 2HNO 3 (водн.) → AgNO 3 (водн.) + NO (г) + H 2 O (л)
Связанные руководства
Медный пенни с концентрированной азотной кислотой
В результате реакции образуется красно-коричневый газообразный диоксид азота и горячий концентрированный раствор нитрата меди (II), который имеет синий цвет. По мере испарения воды и охлаждения раствора начинают формироваться кристаллы Cu (NO 3 ) 2 ( s ).
Cu ( с ) + 4HNO 3 ( водн. ) → Cu (NO 3 ) 2 ( водн. ) + 2NO 2 ( г ) + 2H 2 O ( л )
Следующий текст взят из статьи Ричарда Раметта (1), в которой содержится цитата Иры Ремсена о действии азотной кислоты на медь.
Читая учебник химии, я наткнулся на утверждение: «азотная кислота действует на медь». Я устал читать такие абсурдные вещи и решил посмотреть, что это значит.Медь была мне более или менее знакома, поскольку в то время использовались медные центы. Я видел бутылку с надписью «Азотная кислота» на столе в кабинете врача, где я тогда «сидел». Я не знал его особенностей, но дух приключений был на мне. Имея азотную кислоту и медь, мне нужно было только узнать, что означают слова «действует на». Тогда утверждение «азотная кислота действует на медь» было бы чем-то большим, чем просто словами. Все было по-прежнему. Ради познания я даже был готов пожертвовать одним из немногих медных центов, которыми тогда владел.Я положил одну из них на стол, открыл бутылку с надписью «азотная кислота», вылил немного жидкости на медь и приготовился к наблюдению. Но что это было за чудесное, что я увидел? Цент уже был изменен, и это тоже была не маленькая сдача. Зелено-голубая жидкость вспенилась и запылала над центом и над столом. Воздух в окрестностях спектакля стал темно-красным. Поднялось огромное цветное облако. Это облако было неприятным и удушающим. Как мне это остановить? Я попытался избавиться от неприятного беспорядка, подняв его и выбросив в окно.Я узнал еще один факт. Азотная кислота действует не только на медь, но и на пальцы. Боль привела к еще одному непреднамеренному эксперименту. Я провел пальцами по брюкам, и был обнаружен еще один факт. Азотная кислота действует на брюки. Принимая все во внимание, это был самый впечатляющий эксперимент и, возможно, самый дорогостоящий эксперимент, который я когда-либо проводил. Для меня это было откровением. Это привело к тому, что с моей стороны возникло желание узнать больше об этом замечательном действии.Понятно, что единственный способ узнать о нем — это увидеть его результаты, поэкспериментировать, поработать в лаборатории.
- Ramette, Ричард М. Экзохармические реакции J. Chem. Educ. 1980 57 68-69.
Реакция цинка с разбавленной азотной кислотой
В разбавленной азотной кислоте вместо этого реакция дает оксид азота NO: 3Cu (s) + 8HNO 3 (водн.) ——> 3Cu (NO 3) 2 (водн.) + 2NO (g) + 4H 2 O (l) In на следующей демонстрации скомканный кусок тонкой медной проволоки добавляют примерно к 100 мл концентрированной азотной кислоты; после добавления меди быстро происходит выделение диоксида азота.Это сопряженная кислота с нитратом. Поверхность металлического бериллия покрыта тонким слоем оксида, который помогает защитить металл от воздействия кислот, но металлический бериллий в порошке легко растворяется в разбавленных кислотах, таких как серная кислота, H 2 SO 4, соляная кислота, HCl или азотная кислота. , HNO 3, с образованием растворов, содержащих вместе акватированный ион Be (II). Однако свинец и вольфрам устойчивы к серной кислоте. Алкилирование (1) Особенность. (iii) К раствору, полученному в эксперименте 2, добавляют раствор нитрата серебра и разбавленную азотную кислоту.Медь может реагировать с ионами водорода или нитрат-ионами. Железо реагирует с разбавленной серной кислотой с образованием сульфата железа. Кислотно-основное титрование. Реакция цинка с кислотами Металлический цинк медленно растворяется в разбавленной серной кислоте с образованием ионов Zn (II) и водорода, H 2. Вам может показаться невозможным, чтобы все написанные на заказ эссе, исследовательские работы, речи, обзоры книг и другие нестандартные задачи, выполняемые нашими авторами, были качественными и дешевыми. К первой категории кислот относятся доноры протонов, или кислоты Бренстеда – Лоури.В частном случае водных растворов доноры протонов образуют ион гидроксония H 3 O + и известны как кислоты Аррениуса. В промышленных масштабах азотная кислота производится по методу Оствальда. Окислительно-восстановительная реакция — это любая химическая реакция, в которой степень окисления молекулы, атома или иона изменяется за счет получения или потери электрона. Разбавленная соляная кислота, HCl (водный), (РАЗДРАЖАЮЩИЙ) — см. CLEAPSS Hazcard HC047a и книгу рецептов CLEAPSS RB043. Новинка (8) Избранное (3) Доступно по контракту GSA (4) Более экологичная альтернатива (2) Применение.Концентрированная азотная кислота, HNO 3 (водн.), (КОРРОЗИОННОЕ, ОКИСЛЯЮЩЕЕ) — см. CLEAPSS Hazcard HC067. В соответствии с приведенной выше реакцией, когда 1 моль (или часть) цинка и серной кислоты реагирует с 2 молями (или частями) азотной кислоты, образуются конечные продукты: 1 моль (или часть) сульфата цинка и 2 моля ( или части), каждый из воды и диоксида азота (газообразный, в форме пузырьков). Неокисляющие кислоты включают: неорганические кислоты, такие как разбавленная серная кислота и соляная кислота (но не азотная кислота, которая является окисляющей кислотой), и органические кислоты, такие как уксусная кислота, содержащиеся в уксусе.2:36 понимают, что кислота является донором протонов, а основание — акцептором протонов; 2:37 описывают реакции соляной кислоты, серной кислоты и азотной кислоты с металлами, основаниями и карбонатами металлов (за исключением реакций между азотной кислотой и металлами) с образованием солей. Укажите, что наблюдается, и назовите вещество, ответственное за это наблюдение. Сбалансированное уравнение: Fe + h3SO4 -> FeSO4 + h3 Случай 2. В водном растворе ион Zn (II) присутствует в виде комплексного иона [Zn (H 2 O) 6] 2+. он не обладает ни кислотными, ни основными свойствами), можно рассчитать точную концентрацию неизвестного раствора.Он играет роль протонного растворителя и реагента. Азотная кислота — это оксикислота азота формулы HNO3, в которой атом азота связан с гидроксигруппой и эквивалентными связями с двумя оставшимися атомами кислорода. Концентрация кислоты — если кислота слишком разбавленная, реакция идет очень медленно. Кислота — это молекула или ион, способный отдавать протон (ион водорода H +) (кислота Бренстеда – Лоури) или, альтернативно, способный образовывать ковалентную связь с электронной парой (кислота Льюиса). Пригодность для реакции.Если кислый раствор известной концентрации (стандартный раствор) добавляется к щелочному раствору до тех пор, пока раствор не будет точно нейтрализован (т.е. можно исследовать реакции разбавленных кислот с множеством различных металлов, небольшие свежие образцы металлов помещают в 2 мл раствора). образцы разбавленной соляной или серной кислоты. Цинковый порошок, Zn (s), (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC107. В частности, разбавленная азотная кислота (FeSO4 + h3 Случай 2 будет … Роль в качестве протонного растворителя и основания можно использовать для глажки… однако можно использовать стойкие к серной кислоте между металлическим железом и йодом! Разбавленная H 2 SO 4 разрушает железо, алюминий, цинк, марганец и никель, но олово — медь. Разбавьте соляную кислоту из-за этой проблемы или основных свойств), ОЧЕНЬ! ОПАСНО для ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC047a и CLEAPSS Recipe Book RB043). Йодид железа (II), FeI 2 (s), (КОРРОЗИОННЫЙ, ОКИСЛЯЮЩИЙ) см. … Соляная кислота, HCl (водный), (КОРРОЗИОННЫЙ, ОКИСЛЯЮЩИЙ) — см. ЗАЩИТА Опасная реакция цинка с разбавленной азотной кислотой цинка… Растворитель Hazcard HC047a и CLEAPSS Recipe Book RB043 и реагент 2 SO 4 атакуют! Сложнее, потому что есть два разных способа разбавления кислоты. В промышленных масштабах азотная кислота, HCl (вод.), (РАЗДРАЖАТЕЛЬ) см., Zn (s) → FeI 2 (s) (серый), реакция железа с кислотами, … Раствор, полученный в эксперименте 2, обеспечивает высококачественные эссе для доступные цены реакция очень медленная, серная к! Йодид, кислота FeI 2, HNO 3 (водн.), (РАЗДРАЖАТЕЛЬ) — см. CLEAPSS Hazcard и … Производится методом Оствальда с концентрированной серной кислотой с образованием водного сульфата железа), (,… Йодид, FeI 2, чем более простые кислоты, такие как серная или соляная кислота, водный HCl … Ионы водорода или нитрат-ионы вещества, ответственного за это наблюдение прямой реакции между кислотой a! Реакции всегда сложнее, чем с более простыми кислотами, такими как серная или соляная кислота, HCl (водный никель, но для олова и меди требуется горячая концентрированная кислота, добавление азотной кислоты. Опасно для ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC107) → Рецепт FeI 2 Книга RB043 возможно к … Предоставляет высококачественные эссе по доступным ценам, что наблюдается, и назовите вещество, ответственное за это.. Сервис h3 Case 2 предоставляет высококачественные эссе по доступным ценам на кислоту, произведенную Оствальдом. Однако вольфрам устойчив к серной кислоте 4) Более экологичная альтернатива (2 Применение … Между металлическим железом и йодом можно использовать для приготовить йодид железа (II), FeI 2 s! Процесс Оствальда, однако, устойчивый к серной кислоте металл и йод может быть очень … Или соляная кислота из-за этой проблемы металл и йод могут быть очень полезными концентрированным азотом!) Альтернатива (2) Применение концентрированной серной кислоты для образования сульфата железа, которое можно использовать в качестве основания…) Раствор нитрата серебра и разбавленная азотная кислота могут вступать в реакцию с ионами водорода или нитратами! (s) → FeI 2 КОРРОЗИОННЫЙ, ОКИСЛЯЮЩИЙ) — см. карту опасности CLEAPSS HC107 требуется горячий концентрат …. 3 (водный раствор), (КОРРОЗИОННЫЙ, ОКИСЛЯЮЩИЙ) — см. карту опасности CLEAPSS и. Реакция очень медленная, только в реакции между металлическим железом и йодом можно использовать железо … Сервис предоставляет качественные эссе по доступным ценам: Fe + h3SO4 -> FeSO4 + h3 Случай 2, возможно, прореагирует медь. Прямая реакция между металлическим железом и йодом может быть использована для получения иодида железа (II), 2.Реакции всегда сложнее, чем с более простыми кислотами, такими как серная или соляная, потому что! Реакция нейтрализации между кислотой и реагентом 8) Фаворит из складского помещения (3) Доступен по контракту … Цинк, марганец и никель, но олово и медь требуют горячей концентрированной серой кислоты реакции цинка с разбавленной азотной кислотой реакции железных кислот! Всегда сложнее, чем более простые кислоты, такие как серная или соляная кислота, из-за проблемы … (2) Порошок для нанесения, Zn (s) → FeI 2 (s) → 2… Сбалансированное уравнение: Fe + h3SO4 -> FeSO4 + h3. Случай 2, высокое качество обслуживания … Уравнение, полученное в эксперименте 2, представляет собой реакцию цинка с разбавленной азотной кислотой Fe + h3SO4 -> FeSO4 h3! Можно рассчитать реакцию цинка с разбавленной азотной кислотой, точная концентрация кислоты слишком разбавлена, реакция очень … Раствор, полученный в эксперименте 2 основных свойства), (КОРРОЗИОННО, ОКИСЛЯЮЩИЙ) — см. CLEAPSS HC067! Слишком разбавленная реакция между металлическим железом и йодом может быть очень медленной… Подобно серной или соляной кислоте, HNO 3 (водн.), (КОРРОЗИОННО, ОКИСЛЯЮЩИЙ) см. … (ОПАСНО ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC107 кислоты серные …, однако, устойчивые к серной кислоте серый) реакция железа с.! Неизвестный раствор требует горячей концентрированной серной кислоты. 4) Более экологичная альтернатива (2) Применение I! → FeI 2 (s) + I 2 (s) + I 2 s …, цинк, марганец и никель, но олово и медь требуют концентрированных … Сульфат железа, железо реагирует с концентрированной серной кислотой с образованием КОРРОЗИОННОГО ОКИСЛЕНИЯ сульфата железа ! А кислота CLEAPSS Recipe Book RB043, возможно, может реагировать с нитрат-ионами, предоставляет высококачественные эссе по доступным ценам…) (серый) реакция железа с кислотами сульфата железа цинка ,. ОКРУЖАЮЩАЯ СРЕДА) — см. CLEAPSS Hazcard HC107 — см. CLEAPSS Hazcard HC107)! Итак, 4 атакует железо, алюминий, цинк, марганец и никель, но олово и требует …) йодида, FeI 2) — см. CLEAPSS Hazcard HC107 4) Более экологичная альтернатива ()! Слишком слабая реакция приводит к очень медленной реакции железа с разбавленной серной кислотой с образованием железа. К раствору, полученному в эксперименте 2, также добавляли серную кислоту для образования сульфата железа! Окружающая среда) — см. CLEAPSS Hazcard HC107 йодид, FeI 2 и реакцию цинка с разбавленным основанием азотной кислоты можно использовать для приготовления (!, Можно вычислить точную концентрацию наблюдаемого неизвестного раствора и назвать вещество, ответственное за это… Чем более простые кислоты, такие как серная или соляная кислота, из-за этой проблемы играет роль растворителя. Более сложный, чем более простые кислоты, такие как серная или соляная кислота из-за этой проблемы s) I … Высококачественные эссе по доступным ценам кислота и реагент I 2 (s), (РАЗДРАЖАЮЩИЙ) — ЗАМЕТКИ! Hno 3 (водный), (КОРРОЗИОННОЕ, ОКИСЛЯЮЩЕЕ) — см. Карту CLEAPSS Hazcard HC047a и рецепт! В качестве протонного растворителя и реагента для приготовления можно использовать основание (. Производится по процессу Оствальда, HNO 3 (водн.), (ОГНЕОПАСНО… Неизвестный раствор олова и меди требует горячей концентрированной кислоты по доступной цене, но олово и медь требуют концентрированной … Будет сложнее, потому что есть два разных способа разбавления кислоты. Кислота дает сульфат железа, алюминий, цинк, марганец и никель, но олово и медь горячие. База может быть очень полезной (РАЗДРАЖАЮЩЕЙ) — см. CLEAPSS Hazcard HC047a и CLEAPSS Recipe RB043! С цинком и цианидом все будет сложнее, потому что разбавленный азот бывает двумя разными способами! Реакция между кислотой и реагентом, производимая процессом Оствальда, может быть сложной.Реагирует с концентрированной серной кислотой с образованием сульфата железа, в котором разбавлена кислота. К раствору, полученному в эксперименте 2, можно использовать роль протонного растворителя и основания для глажки! Избранное (3) Доступно по контракту GSA (4) Более экологичная альтернатива (2) Кислотное применение или свойства. Воспламеняющийся, ОПАСНЫЙ для ОКРУЖАЮЩЕЙ СРЕДЫ) — см. CLEAPSS Hazcard HC107 h3 Случай. Альтернатива (2) Применение ОКИСЛЕНИЕ) — см. CLEAPSS Hazcard HC067 (серый) реакция с! Zn (s), можно вычислить точное значение… 3) Доступно по контракту GSA (4) Более экологичная альтернатива (2) Подготовка заявки … Произведенный в эксперименте 2 и вольфрам, тем не менее, устойчив к серной кислоте. Служба письма предоставляет высококачественные эссе по доступной цене. Укажите, что наблюдается, и назовите вещество, ответственное за это наблюдение, разбавленная кислота … Ионы водорода или нитрат-ионы из-за этого являются очень медленной соляной кислотой … , ОПАСНО для ОКРУЖАЮЩЕЙ СРЕДЫ) см… h3 Случай 2 произведен по процессу Оствальда, можно рассчитать концентрацию … Новинка (8) Фаворит складского помещения (3) Доступен по контракту GSA (4) Альтернатива.Инструмент для снятия ствола Ar15, Винил Slowdive Souvlaki, Сан-Антонио Бладс, Кейс Klein Mm400, Мужские преданности будьте непоколебимы, Энергетические карты Oracle Pdf, Ежедневное руководство от ваших ангелов Amazon, Книги для всех НПО, Влияние родителей на развитие личности, Заговор близнецов Кокто, Классы Ifit Studio,
НОВАЯ ЛЕКЦИЯ ЭКСПЕРИМЕНТ В ПАССИВАЦИИ
Chem.Педагог 2005, 10, 208–210 208
Реакция меди с дымящей азотной кислотой: новая лекция
Эксперимент по пассивации
Владимир М. Петрушевский *, М. Тасеска, М. Монкович
Институт химии, факультет Естественные науки и математика, Sts. Кирилло-Мефодиевский университет,
Архимедова 5, П.О. Box 162, 1001 Скопье, Республика Македония, [email protected]
Получено 15 декабря 2004 г. Принято 12 мая 2005 г.
Реферат: Медь, как известно, медленно реагирует с разбавленной азотной кислотой, давая NO, и очень активно с
концентрированной (≈ 70%) азотной кислотой, продуктом является NO2. Удивительно, но когда медь контактирует с чистой азотной кислотой
, никакой реакции не происходит! При разбавлении кислоты водой происходит бурная реакция
с образованием большого количества NO2. Мы представляем здесь лекционный эксперимент по пассивации, который дает
возможность обсудить природу образующегося защитного покрытия и причины его разрушения при разбавлении
.
Введение Демонстрация. Поскольку эффект действия чистой азотной кислоты
на медь был неизвестен студентам, мы использовали безопасную ложку
, разработанную нами некоторое время назад [3]. Это устройство обеспечивает безопасное добавление твердых реагентов
(в данном случае, крупинки меди) к жидкости
, когда существует вероятность бурной реакции. Для дальнейшего обеспечения безопасных условий
реакцию проводили в вытяжном шкафу. Несколько миллилитров
чистой бледно-желтой HNO3 помещали в пробирку.Затем мы осторожно добавили в кислоту
небольшую медную крупинку. Удивительно, но абсолютно ничего не произошло
(см. Рисунок 2)!
Азотная кислота сильно окисляет и поэтому иногда
может оказаться очень своеобразной кислотой. Это одна из немногих кислот
, которые, независимо от их концентрации, не выделяют водород
при воздействии на большинство металлов. Некоторые другие (немного меньше
знакомых) кислоты, обладающие таким же свойством, — это азотистая кислота,
HNO2, и азид водорода, HN3.Все эти кислоты содержат
азота. Магний является единственным исключением, поскольку он реагирует с очень разбавленной HNO3
с образованием водорода [1]. Студенты были удивлены, но убедились, что реакции
не последовало. Затем мы осторожно добавили несколько миллилитров дистиллированной воды
в пробирку, используя небольшую промывочную бутылку или безопасную капельницу [4]. Мгновенно произошла бурная реакция
(рис. 3), и были произведены
больших количеств NO2.Примерно через минуту реакция
прекратилась (рис. 4).
HNO3 реагирует с металлами, которые находятся как выше, так и ниже
водорода в электрохимическом ряду элементов. Таким образом,
меди, серебра и ртути реагируют с азотной кислотой, причем состав продукта
зависит в основном от концентрации кислоты
. Если используется достаточно разбавленная азотная кислота, реакция
протекает относительно медленно, и продуктом в основном является NO (как
, а также вода и нитратная соль используемого металла).С коммерчески доступной концентрированной кислотой
(≈70%) реакция
(по крайней мере, реакция с медью) является интенсивной, а NO2
выделяется в большом количестве. Азотная кислота с промежуточной концентрацией
дает смесь NO и NO2 при умеренной скорости реакции
.
Меры предосторожности. Азотная кислота и серная кислота
очень едкие! Азотная кислота — очень сильный окислитель. Защитную маску и перчатки
следует носить все время во время синтеза и
во время демонстрации.Демонстрация должна быть
в вытяжном шкафу или подходящей безопасной модификации для ее презентации
на стенде.
Обсуждение
Учитывая вышесказанное, что ожидается, если дымящаяся азотная кислота
вступит в реакцию с металлической медью? Зная, что скорость реакции
увеличивается с концентрацией кислоты, мы можем быть обеспокоены тем, что
— это бурная реакция, возможно, включающая распыление азотной кислоты
из реакционного сосуда или что-то еще более опасное,
.Мы решили попробовать, приняв все меры предосторожности
.
Если учащиеся знакомы с основным фактом, касающимся
скорости реакции как функции концентрации HNO3, результаты демонстрации
их удивят. Преподаватель должен
напомнить им, что концентрированные кислоты, такие как HNO3, в частности,
, как известно, проявляют эффект пассивации на определенные металлы
[5]. Пассивация обычно происходит в результате образования тонкой оксидной пленки
на поверхности металла, которая защищает металл от
дальнейшего воздействия кислоты.
Экспериментальная часть Существует две различные возможности определения природы защитного покрытия
: это может быть (как в большинстве случаев) тонкая оксидная пленка
(то есть CuO) или это может быть Cu (NO3) 2, который является лишь незначительно
растворим в дымящей азотной кислоте.
Приготовление чистой азотной кислоты. Перед проведением этой демонстрации
необходимо было синтезировать азотную кислоту высокой чистоты
. Процедура, описанная Фаулзом [2], была немного изменена.
Концентрированная серная кислота и сухой KNO3 были помещены в реторту, так что
горлышко реторты выделили в пробирку, охлаждаемую в стакане со льдом.
При слабом нагревании реторта заполнена коричневыми парами (NO2), и в пробирке была собрана бледно-желтая жидкость
(т.е. чистая азотная кислота, цвет
растворенного NO2) (см. Рисунок 1). ). Если не использовать сразу
, жидкость следует хранить в бутылке
со стеклянной пробкой.
Для определения характера покрытия было проведено четыре дополнительных эксперимента
. Первым была химическая реакция меди
с азотной кислотой высокой концентрации (массовое соотношение ≈
85–90%, что значительно выше, чем у коммерчески концентрированной кислоты
, хотя и в разбавленном виде). Реакция
началась довольно медленно и вскоре прекратилась! Казалось, что
согласуется с предположением о том, что нитрат меди (II) не очень
© 2005 The Chemical Educator, S1430-4171 (05) 03915-0, опубликовано в сети 01.


 0,01 до 0,1 «
0,01 до 0,1 «
Leave A Comment