Образовательный портал «РЕШУ ЕГЭ» (
Задание 31 ЕГЭ по химии
Верное решение задания 31 должно содержать уравнения четырёх За верную запись каждого уравнения реакции можно получить 1 балл. Максимально за выполнение этого задания можно получить 4 балла. Каждое верное
ПодробнееОбразовательный портал «РЕШУ ЕГЭ» (
За да ния для подготовки 1. Оксид меди (II) нагревали в токе угарного газа. Полученное простое вещество сожгли в атмосфере хлора. Продукт реакции растворили в воде. Полученный раствор разделили на две
Подробнее Образовательный портал «РЕШУ ЕГЭ» (
Экзаменационные задания 1. Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили.
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили.
Задания 1. Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты реакции разложения полностью поглощены водой, а над твёрдым
ПодробнееЭлементы IА и IIА подгруппы 1. 8. 9. 2. 10. 11. 3. 4. 12. 5. 13. 14. 6. 7. 15. 16. 1 17. 26. 18. 27. 19. 28. 20. 21. 29. 22. 23. 30. 24. 31. 25. 32. 2 33. 39. Взаимодействие оксида кальция с водой относится
ПодробнееЗадания С2 по химии
Задания С2 по химии 1. Даны вещества: фосфор, хлор, водные растворы серной кислоты и гидроксида калия. 1. 2. 3. 4. 2. Даны: бромоводородная кислота, перманганат натрия, гидроксид натрия и бром. Записаны
1. 2. 3. 4. 2. Даны: бромоводородная кислота, перманганат натрия, гидроксид натрия и бром. Записаны
1/6. Образовательный портал «РЕШУ ЕГЭ» (
Вариант 2978652 1. Определите, атомы каких двух из указанных в ряду элементов имеют на внеш нем энер ге ти че ском уров не шесть элек тро нов. За пи ши те в поле от ве та но ме ра вы бран ных эле мен тов.
Подробнее1. Дана схема превращений:
Задание 22 1. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение
Химические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
1/6. Образовательный портал «РЕШУ ЕГЭ» (
Вариант 2968970 1. Определите, какие из указанных элементов образуют устойчивый положительный ион, содержащий 10 электронов. Запишите в поле ответа номера выбранных элементов. 2. Выберите три элемента,
Банк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Подробнеехарактеризующие металл:
Расчетные задачи в неорганической химии 1. Массовая доля металла в оксиде состава характеризующие металл: равна 71,4 %.
1/6. Образовательный портал «РЕШУ ЕГЭ» (
Вариант 2968967 1. Определите элементы, атомы которых в основном состоянии содержат два неспаренных электрона. Запишите в поле ответа номера выбранных элементов. 2. Из указанных в ряду химических элементов
Подробнее1/6. Образовательный портал «РЕШУ ЕГЭ» (
Вариант 2968974 1. Определите, атомы каких из указанных элементов образуют устойчивый положительный ион, содержащий 18 электронов. Запишите в поле ответа номера выбранных элементов. 2. Выберите три элемента,
11 класс. Авторы задач Скрипкин М.Ю. ( 1, 2), Ростовский Н.В. ( 3, 6), Ванин А.А. ( 4), Пошехонов И.С. ( 5), Байгозин Д.В. ( 7)
11 класс Авторы задач Скрипкин М.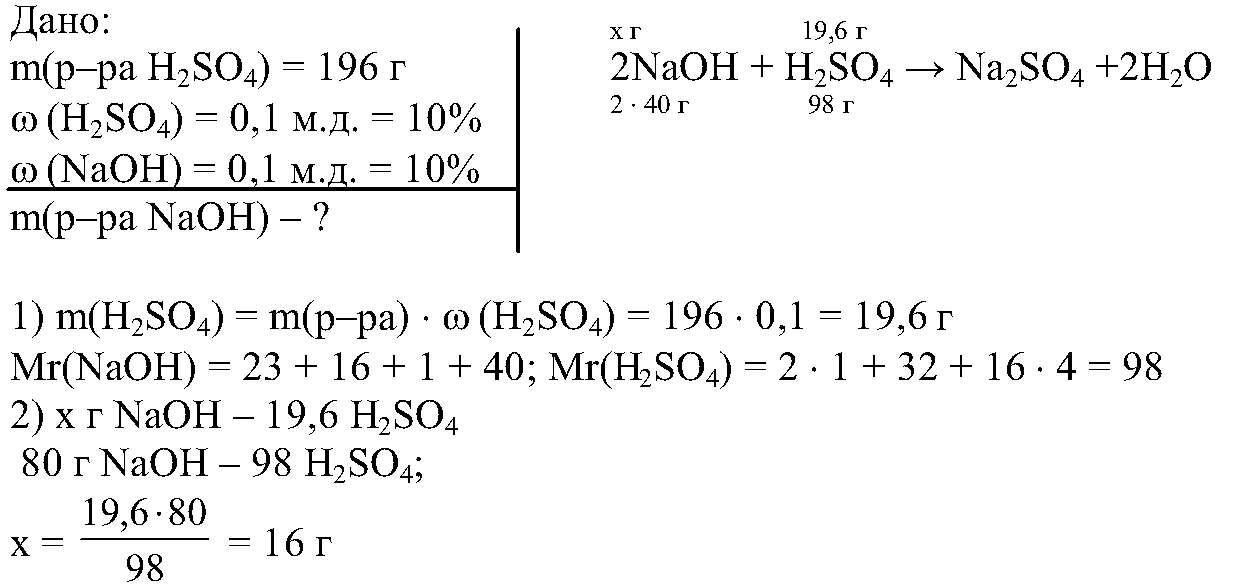 Ю. ( 1, 2), Ростовский Н.В. ( 3, 6), Ванин А.А. ( 4), Пошехонов И.С. ( 5), Байгозин Д.В. ( 7) 1-1. Юный Химик, разбирая реактивы, обнаружил на одной из полок четыре банки
Ю. ( 1, 2), Ростовский Н.В. ( 3, 6), Ванин А.А. ( 4), Пошехонов И.С. ( 5), Байгозин Д.В. ( 7) 1-1. Юный Химик, разбирая реактивы, обнаружил на одной из полок четыре банки
ИНТЕЛЛЕКТУАЛЬНЫЙ МАРАФОН 10 КЛАСС 1 тур
ИНТЕЛЛЕКТУАЛЬНЫЙ МАРАФОН 10 КЛАСС 1 тур 1. В водном растворе иодида бария массовая доля электронов равна 2,852*10-4. Определите массовые долю соли в растворе. 2 балла 2. Имеется смесь кислорода и озона,
ПодробнееЗадания С4 по химии
Задания С4 по химии 1. К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na
ПодробнееГалогены. Теория и подборка заданий №32 ЕГЭ. | Материал для подготовки к ЕГЭ (ГИА) по химии (11 класс):
Галогены.
Хлор. Соединения хлора.
- Хлор — простое вещество
Получение.
- В промышленности хлор получают электролизом расплава или раствора хлорида натрия:
2NaCl 2Na + Cl2↑
2NaCl + 2h3O h3↑ + 2NaOH + Cl2↑
- В лаборатории хлор получают взаимодействием соляной кислоты с сильными окислителями, например:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2h3O
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2↑ + 8h3O
KClO3 + 6HCl = KCl + 3Cl2↑ + 3h3O
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2↑ + 7h3O
Химические свойства. Свободный хлор реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Хлор проявляет сильные окислительные свойства в реакциях как с простыми веществами – неметаллами и металлами, так и со сложными веществами:
- С неметаллами
Cl2 + h3 = 2HCl 3Cl2+ 2P = 2PCl3 5Cl2 + 2P = 2PCl5
2Cl2 + Si = SiCl4 2Cl2 + C (кокс) + 2h3O (пар)= CO2 + 4HCl
Cl2 + 2Na = 2NaCl Cl2 + Mg = MgCl2 3Cl2 + 2Fe = 2FeCl3
- Со сложными веществами
Cl2 + h3O↔ HCl + HClO (хлорная вода)
2Cl2 + 2h3O = 4HCl + O2 (на свету или кип. )
)
Сl2 + 2NaOH(хол.) = NaCl + NaClO + h3O
3Cl2 + 6NaOH(гор.) = 5NaCl + NaClO3 + 3h3O
2Сl2 + 2Са(OH)2 (хол.) = СaCl2 + Сa(ClO)2 + 2h3O хлорная известь
Cl2 + 2NaI = 2NaCl + I2 Cl2 + h3S = S + 2HCl
Cl2 + 3h3O2 = 2HCl + 2h3O + O2
Cl2 + h3O + Na2SO3 = 2HCl + Na2SO4
- Соединения хлора.
- Хлороводород. Хлороводород получают действием концентрированной соляной кислоты на твердый хлорид натрия:
h3SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
Хлороводород получают также прямым взаимодействием простых веществ: Cl2 + h3 2HCl
- Кислоты.
Соляная кислота. В химических реакциях соляная кислота проявляет все свойства сильных кислот: взаимодействует с металлами, стоящими в ряду напряжений левее водорода, с оксидами (основными, амфотерными), основаниями, амфотерными гидроксидами и солями:
2HCl + Fe = FeCl2 + h3
2HCl + CaO = CaCl2 + h3O
6HCl + Al2O3 = 2AlCl3 + 3h3O
HCl + NaOH = NaCl + h3O
2HCl + Cu(OH)2 = CuCl2 + 2h3O
2HCl + Zn(OH)2 = ZnCl2 + 2h3O
HCl + NaHCO3 = NaCl + CO2↑ + h3O
HCl + AgNO3 = AgCl↓ + HNO3 (качественная реакция на галогенид-ионы)
6HCl(конц. ) + 2HNO3(конц.) = 3Cl2 + 2NO + 4h3O
) + 2HNO3(конц.) = 3Cl2 + 2NO + 4h3O
Кислородсодержащие кислоты:
HClO HClO2 HClO3 HClO4
Хлорноватистая хлористая хлорноватая хлорная
усиление кислотных свойств
2HClO 2HCl + O2 HClO + 2HI = HCl + I2 + h3O
HClO + h3O2 = HCl + h3O + O2
- Соли.
Соли соляной кислоты – хлориды.
AgCl + 2(Nh4∙ h3O) = [Ag(Nh4)2]Cl + 2h3O
2AgCl 2Ag + Cl2
Соли кислородсодержащих кислот.
Кислота | название солей |
HClO | гипохлориты |
HClO2 | хлориты |
HClO3 | Хлораты |
HClO4 | перхлораты |
NaClO + 2HCl = NaCl + Cl2 + h3O
Ca(ClO)2 + h3SO4 = CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + h3O = CaCO3 + 2HCl + 2O2
Ca(ClO)2 + Na2CO3 = CaCO3 + 2NaClO
Ca(ClO)2 CaCl2 + O2
4KClO3 3KClO4 + KCl
Бертолетова соль
2KClO3 2KCl + 3O2↑
KClO4 2O2 + KCl
III. Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Бром. Соединения брома. По химической активности бром занимает промежуточное положение между хлором и иодом.
Br2 + h3 = 2HBr 3Br2 + 2Fe = 2FeBr3
Br2 + h3O = НBr + НBrO – бромная вода
3Br2 + 6NaOH(конц.) = 5NaBr + NaBrO3 + 3h3O при нагревании
Br2 + 2NaOH(конц.) = NaBr + NаBrO + h3O без нагревания
3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2
3Br2 + S + 4h3O = 6HBr + h3SO4
Br2 + SO2 + 2h3O = 2HBr + h3SO4
Br2 + 2NaI = 2NaBr + I2 Br2 + h3S = S + 2HBr
4Br2 + Na2S2O3 + 10NaOH = 2Na2SO4 + 8NaBr + 5h3O
14HBr + K2Cr2O7 = 2KBr + 2CrBr3 + 3Br2 + 7h3O
4HBr + MnO2 = MnBr2 + Br2 + 2h3O
2HBr + h3O2 = Br2 + 2h3O
2KBr + 2h3SO4 (конц.) = 4K2SO4 + 4Br2 + SO2 + 2h3O
2KBrO3 3O2 + 2KBr
2KBrO4O2 + 2KBrO3 (до 275°С)
KBrO4 2O2 + KBr (выше 390°С)
IV. Йод. Соединения йода.
Йод. Соединения йода.
Йод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании.
3I2 + 3P = 2PI3 I2 + h3 = 2HI I2 + Fe = FeI2
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
3I2 + 6NaOH(гор.) = 5NaI + NaIO3 + 3h3O
I2 + 2NaOH(хол) =NaI + NaIO + h3O
3I2 + 10HNO3(разб) = 6HIO3 + 10NO + 2h3O
I2 + 10HNO3(конц.)= 2HIO3 + 10NO2 + 4h3O
I2 + 5NaClO + 2NaOH = 5NaCl + 2NaIO3 + h3O
I2 + 5Cl2 + 6h3O = 10HCl + 2HIO3
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + h3O
2HI + 2FeCl3 = I2 + 2FeCl2 + 2HCl
2HI + Fe2(SO4)3 = 2FeSO4 + I2 + h3SO4
2HI + NO2 = I2 + NO + h3O
2HI + S = I2 + h3S
8KI + 5h3SO4 (конц. ) = 4K2SO4 + 4I2 + h3S + 4h3Oили
) = 4K2SO4 + 4I2 + h3S + 4h3Oили
8KI + 9h3SO4(конц.) = 4I2↓ + h3S↑ + 8KHSO4 + 4h3O
KI + 3h3O + 3Cl2 = HIO3 + KCl + 5HCl
10KI + 8h3SO4 + 2KMnO4 = 5I2 + 2MnSO4 + 6K2SO4 + 8h3O
6KI + 7h3SO4 + K2Cr2O7 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7h3O
2KI + h3SO4 + h3O2 = I2 + K2SO4 + 2h3O
2KI + Fe2(SO4)3 = I2 + 2FeSO4 + K2SO4
2KI + 2CuSO4 + K2SO3 + h3O = 2CuI + 2K2SO4 + h3SO4
2HIO3 I2O5 + h3O
2HIO3 + 10HCl = I2 + 5Cl2 + 6h3O
2HIO3 + 5Na2SO3 = 5Na2SO4 + I2 + h3O
2HIO3 + 5h3SO4 + 10FeSO4 = Fe2(SO4)3 + I2 + 6h3O
I2O5 + 5CO I2 + 5CO2
2KIO3 3O2 + 2KI
2KIO3 + 12HCl(конц.) = I2 + 5Cl2 + 2KCl + 6h3O
KIO3+ 3h3SO4 + 5KI = 3I2 + 3K2SO4 + 3h3O
KIO3 + 3h3O2 = KI + 3O2 + 3h3O
2KIO4 O2 + 2KIO3
5KIO4+ 3h3O + 2MnSO4 = 2HMnO4 + 5KIO3 + 2h3SO4
Галогены.
1. Вещество, полученное на аноде при электролизе расплава иодида натрия с инертными электродами, выделили и ввели во взаимодействие с сероводородом. Газообразный продукт последней реакции растворили в воде и к полученному раствору добавили хлорное железо. Образовавшийся осадок отфильтровали и обработали горячим раствором гидроксида натрия. Напишите уравнения описанных реакций.
2. Вещество, полученное на аноде при электролизе раствора иодида натрия с инертными электродами, ввели в реакцию с калием. Продукт реакции нагрели с концентрированной серной кислотой и выделившийся газ пропустили через горячий раствор хромата калия.Напишите уравнения описанных реакций.
3. Хлорная вода имеет запах хлора. При подщелачивании запах исчезает, а при добавлении соляной кислоты – становится более сильным, чем был ранее. Напишите уравнения описанных реакций.
4. Бесцветные газы выделяются при выдерживании концентрированной кислоты, как с хлоридом натрия, так и с иодидом натрия. При пропускании этих газов через водный раствор аммиака образуются соли. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
5. При термическом разложении соли А в присутствии диоксида марганца образовались бинарная соль Б и газ, поддерживающий горение и входящий в состав воздуха, при нагревании этой соли без катализатора образуются соль Б и соль кислородсодержащей кислоты. При взаимодействии соли А с соляной кислотой выделяется жёлто-зелёный газ (простое вещество) и образуется соль Б. соль Б окрашивает пламя в фиолетовый цвет, при её взаимодействии с раствором нитрата серебра выпадает осадок белого цвета.Напишите уравнения описанных реакций.
6) При добавлении раствора кислоты А к диоксиду марганца происходит выделение ядовитого газа жёлто-зелёного газа. Пропустив выделившийся газ через горячий раствор едкого кали, получают вещество, которое используется при изготовлении спичек и некоторых других зажигательных составов. При термическом разложении последнего в присутствии диоксида марганца образуется соль, из которой при взаимодействии с концентрированной серной кислотой можно получить исходную кислоту А, и бесцветный газ , входящий в состав атмосферного воздуха. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
7) Йод нагрели с избытком фосфора, и продукт реакции обработали небольшим количеством воды. Газообразный продукт реакции полностью нейтрализовали раствором едкого натра и добавили в полученный раствор нитрат серебра. Напишите уравнения описанных реакций.
8) Газ, выделившийся при нагревании твердой поваренной соли с концентрированной серной кислотой, пропустили через раствор перманганата калия. Газообразный продукт реакции поглотили холодным раствором едкого натра. После добавления в полученный раствор йодоводородной кислоты появляется резкий запах и раствор приобретает тёмную окраску.Напишите уравнения описанных реакций.
9) Через раствор бромида натрия пропустили газ, выделяющийся при взаимодействии соляной кислоты с перманганатом калия. После окончания реакции раствор выпарили, остаток растворили в воде и подвергли электролизу с графитовыми электродами. Газообразные продукты реакции смешали друг с другом и осветили. В результате произошел взрыв. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
10) К пиролюзиту осторожно прибавили раствор соляной кислоты, и выделившийся газ пропустили в химический стакан, наполненный холодным раствором едкого кали. После окончания реакции стакан накрыли картонкой и оставили, при этом стакан освещали солнечные лучи; через некоторое время в стакан внесли тлеющую лучинку, которая ярко вспыхнула. Напишите уравнения описанных реакций.
11) Вещество, выделяющееся на катоде и аноде при электролизе раствора йодида натрия с графитовыми электродами, реагируют друг с другом. Продукт реакции взаимодействуют с концентрированной серной кислотой с выделением газа, который пропустили через раствор гидроксида калия.Напишите уравнения описанных реакций.
12) К оксиду свинца (IV) при нагревании добавили концентрированную соляную кислоту. Выделяющийся газ пропустили через нагретый раствор едкого кали. Раствор охладили, соль кислородсодержащей кислоты отфильтровали и высушили. При нагревании полученной соли с соляной кислотой выделяется ядовитый газ, а при нагревании её в присутствии диоксида марганца – газ, входящий в состав атмосферы. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
13)Йод обработали концентрированной азотной кислотой при нагревании. Продукт реакции осторожно нагрели. Образовавшийся при оксид вступил в реакцию с угарным газом. Выделившееся простое вещество растворили в теплом растворе гидроксида калия. Напишите уравнения описанных реакций.
14) Раствор иодида калия обработали избытком хлорной воды, при этом сначала наблюдали образование осадка, а затем – его полное растворение. Образовавшуюся при этом йодсодержащую кислоту выделили из раствора, высушили и осторожно нагрели. полученный оксид прореагировал с угарным газом. Напишите уравнения описанных реакций.
15) Йод обработали хлорноватой кислотой. Продукт реакции осторожно нагрели. продукт реакции осторожно нагрели. Образующийся оксид реагирует с угарным газом с образованием двух веществ – простого и сложного. Простое вещество растворяется в теплом щелочном растворе сульфита натрия. Напишите уравнения описанных реакций.
16) Перманганат калия обработали избытком раствора соляной кислоты, образовался раствор и выделился газ. Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
Раствор разделили на две части: к первой добавили гидроксид калия, а ко второй – нитрат серебра. Выделившийся газ прореагировал газ прореагировал с гидроксидом калия при охлаждении. Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль. Напишите уравнения описанных реакций.
Напишите уравнения описанных реакций.
17) Расплав хлорида натрия подвергли электролизу. Газ, выделившийся на аноде, прореагировал с водородом с образованием нового газообразного вещества с характерным запахом. Его растворили в воде и обработали расчетным количеством перманганата калия, при этом образовался газ желто-зеленого цвета. Это вещество вступает при охлаждении с гидроксидом натрия.Напишите уравнения описанных реакций.
18) Перманганат калия обработали концентрированной соляной кислотой. Выделившийся при этом газ собрали, а к реакционной массе по каплям прибавили раствор гидроксида калия до прекращения выделения осадка. Собранный газ пропустили через горячий раствор гидроксида калия, при этом образовалась смесь двух солей. Раствор выпарили, твердый остаток прокалили в присутствии катализатора, после чего в твердом остатке осталась одна соль.Напишите уравнения описанных реакций.
Галогены.
1) 2NaI 2Na + I2
на катоде на аноде
I2 + h3S = 2HI↑ + S↓
2HI + 2FeCl3 = I2 + 2FeCl2+ 2HCl
I2 + 6NaOH (гор. ) = NaIO3 + 5NaI + 3h3O
) = NaIO3 + 5NaI + 3h3O
2) 2NaI + 2h3O 2h3 + 2NaOH + I2
на катоде на аноде
I2 + 2K = 2KI
8KI + 8h3SO4(конц.) = 4I2↓ + h3S↑ + 4K2SO4 + 4h3Oили
8KI + 9h3SO4(конц.) = 4I2↓ + h3S↑ + 8KHSO4 + 4h3O
3h3S + 2K2CrO4 + 2h3O = 2Cr(OH)3 + 3S + 4KOH
3) Cl2 + h3O ↔HCl + HClO
HCl + NaOH = NaCl+ h3O
HClO + NaOH = NaClO+ h3O
NaClO + 2HCl = NaCl + Cl2 + h3O
4) h3SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
9h3SO4(конц.) + 8NaI(тверд.) = 8NaHSO4 + 4I2↓ + h3S + 4h3O
Nh5OH + HCl = Nh5Cl + h3O
Nh5OH + h3S = Nh5HS + h3O
5) 2KClO3 2KCl + 3O2↑
4KClO3KCl + 3KClO4
KClO3 + 6HCl = KCl + 3Cl2↑+ 3h3O
KCl + AgNO3 = AgCl↓ + KNO3
6) 4HCl + MnO2 = MnCl2 + Cl2↑ + 2h3O
3Cl2 + 6KOH(гор. ) = 5KCl + KClO3 + 3h3O
) = 5KCl + KClO3 + 3h3O
2KClO3 2KCl + 3O2↑
h3SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
7) 3I2 + 2P = 2PI3
PI3 + 3h3O = h4PO3 + 3HI
HI + NaOH = NaI + h3O
NaI + AgNO3 = AgI↓ + NaNO3
8) h3SO4(конц.) + NaCl(тверд.) = NaHSO4 + HCl↑
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8h3O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + h3O
NaClO + 2HI = NaCl + I2 + h3O
9) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8h3O
2NaBr + Cl2 = 2NaCl + Br2
2NaCl + 2h3O 2h3 + 2NaOH + Cl2
на катоде на аноде
h3 + Cl2 = 2HCl
10) 4HCl+ MnO2 = MnCl2 + Cl2↑ + 2h3O
Cl2 + 2KOH(хол.) = KCl + KClO + h3O
2KClO3 2KCl + 3O2↑
C + O2 = CO2
11) 2NaI + 2h3O 2h3 + 2NaOH + I2
на катоде на аноде
I2 + h3 = 2HI
8HI + h3SO4(конц. ) = 4I2↓ + h3S↑ + 4h3Oили
) = 4I2↓ + h3S↑ + 4h3Oили
2HI + h3SO4(конц.) = I2↓ + SO2↑ + 2h3O
а) h3S + 2KOH = K2S + 2h3O
h3S + K2S = 2KHSили
б) SO2 + 2KOH = K2SO3 + 2h3O
K2SO3 + SO2 + h3O = 2KHSO3
12) 4HCl+ PbO2 = PbCl2 + Cl2↑ + 2h3O
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3h3O
KClO3 + 6HCl = KCl + 3Cl2 + 3h3O
2KClO3 2KCl + 3O2↑
13) I2 + 10HNO32HIO3 + 10NO2 + 4h3O
2HIO3 I2O5 + h3O
I2O5 + 5CO I2 + 5CO2
3I2 + 6KOH(гор.) = 5KI + KIO3 + 3h3O
14) 2KI + Cl2 = 2KCl + I2
I2 + 5Cl2 + 6h3O = 10HCl + 2HIO3
2HIO3 I2O5 + h3O
I2O5 + 5CO = I2 + 5CO2
15) I2+ 2HClO3 = 2HIO3 + Cl2
2HIO3 I2O5 + h3O
I2O5 + 5CO I2 + 5CO2
I2 + Na2SO3 + 2NaOH = 2NaI + Na2SO4 + h3O
16) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8h3O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
KCl + AgNO3 = AgCl↓ + KNO3
Cl2 + 2KOH(хол. ) = KCl + KClO + h3O
) = KCl + KClO + h3O
17) 2NaCl 2Na + CL2
на катоде на аноде
Cl2 + h3 = 2HCl
16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8h3O
Cl2 + 2NaOH(хол.) = NaCl + NaClO + h3O
18) 16HCl + 2KMnO4 = 5Cl2 + 2KCl + 2MnCl2 + 8h3O
MnCl2 + 2KOH = Mn(OH)2↓ + 2KCl
3Cl2 + 6KOH(гор.) = 5KCl + KClO3 + 3h3O
2KClO3 2KCl + 3O2↑
Взаимосвязь различных классов неорганических веществ — Студопедия
Задания с комментариями и решениями
Пример 25. В схеме превращений
веществами «X» и «Y» являются:
Ответ:
Проанализируем указанные превращения веществ. Первое превращение можно осуществить в результате реакции обмена между растворимыми соединениями, которая согласно сокращённому ионному уравнению идет с образованием осадка. Значит, веществом «X» может быть хлорид кальция — СаСl2 (ответ 4). Второе превращение — образование гидрокарбоната кальция — Са(НСO3)2 из нерастворимого карбоната СаСO3 возможно только под действием раствора оксида углерода (IV):
Значит, реагентом «Y» будет СO2
Ответ:
Пример 26. В схеме превращений
веществами «X» и «Y» являются:
Ответ:
Анализ схемы превращений веществ, указанной в задании, свидетельствует о том, что в результате реакции ионного обмена со щёлочью из соли двухвалентного железа получится гидроксид железа(II). Далее по схеме происходит реакция окисления гидроксида железа(II) кислородом в присутствии воды, что приводит к образованию гидроксида железа(IIi).
Ответ:
Пример 27. Смесь оксида азота(IV) и кислорода пропустили через раствор гидроксида калия. Полученную при этом соль высушили и прокалили. Остаток, полученный после прокаливания соли, растворили в воде и смешали с раствором иодида калия и серной кислотой. Образовавшееся в ходе этой реакции простое вещество прореагировало с алюминием.
Напишите уравнения четырёх описанных реакций.
Прежде всего, следует освежить в памяти информацию об основных классах неорганических соединений, их важнейших представителях и химических свойствах.
Проанализируем условие задания. Оксид азота(IV) в щелочной среде в присутствии кислорода легко окисляется до производного азота(V), т.е. до нитрат-ионов:
Нитраты термически неустойчивы и легко разлагаются при нагревании. При нагревании нитратов самых активных металлов (щелочных и щелочноземельных) образуется нитрит и выделяется кислород:
Следовательно, остаток после прокаливания нитрата калия представляет собой нитрит калия — соль с явно выраженными окислительными свойствами. Иодид-ионы в кислой среде легко окисляются нитрит-ионами до свободного иода:
Свободный иод легко взаимодействует с металлами, например с алюминием, с образованием соли — иодида алюминия:
Итак, ответ включает в себя четыре уравнения возможных реакций, соответствующих описанным превращениям:
Пример 28. В раствор сульфата меди(II) поместили железную пластинку. По окончании реакции пластинку вынули, а к образовавшемуся зеленоватому раствору добавляли по каплям раствор нитрата бария до тех пор, пока не прекратилось образование осадка. Осадок отфильтровали, раствор выпарили, оставшуюся сухую соль прокалили на воздухе. При этом образовался красно-коричневый порошок, который обработали концентрированной иодоводородной кислотой. Напишите уравнения четырёх описанных реакций.
Первое превращение — это реакция замещения: атомы железа вытесняют медь из сульфата меди(II):
Образовавшийся при этом зеленоватый раствор содержит сульфат железа(II), который с нитратом бария образует белый осадок сульфата бария (качественная реакция на сульфаты), а в растворе образуется новая соль — нитрат железа(II):
Процесс термического разложения нитрата железа(II) сопровождается окислением железа:
Красно-коричневый порошок представляет собой оксид железа(III), который, растворяясь в иодоводородной кислоте, восстанавливается вновь до железа(+2), а иодид-ионы окисляются при этом до элементарного иода:
Таким образом, вы должны записать уравнения четырех реакций:
Пример 29. Твёрдый хлорид лития нагрели с концентрированной серной кислотой, выделившийся при этом газ растворили в воде. При взаимодействии полученного раствора с перманганатом калия образовалось простое газообразное вещество жёлто-зелёного цвета. При горении железной проволоки в этом веществе получили соль. Соль растворили в воде и смешали с раствором карбоната натрия.
Напишите уравнения четырёх описанных реакций.
В данном задании есть и простые уравнения реакций, есть и сложные. Так, при взаимодействии твёрдого хлорида лития с концентрированной серной кислотой выделяется газообразный хлороводород. Наряду с НСl образуется гидросульфат лития (сульфат практически не образуется в указанных условиях).
Хлороводород, растворяясь в воде, образует соляную кислоту, которая вступает с перманганатом калия в окислительно-восстановительную реакцию (лабораторный способ получения хлора — газообразного вещества желто-зелёного цвета).
Железо взаимодействует с хлором, окисляясь до степени окисления +3.
Хлорид железа(III), взаимодействуя с водным раствором карбоната натрия, вступает с ним в реакцию совместного гидролиза, в результате чего выпадает осадок гидроксида железа(III) и выделяется углекислый газ (напомним, что карбонат железа(III) не существует).
Вы должны записать следующие уравнения химических реакций:
Пример 30. При сливании водных растворов сульфита калия и перманганата калия выпал осадок. Осадок при нагревании обработали концентрированной соляной кислотой, при этом наблюдалось образование газа. Полученный газ прореагировал с алюминием. Продукт данной реакции растворили в избытке раствора гидроксида натрия.
Напишите уравнения четырёх описанных реакций.
Первая из описанных реакций относится к окислительно-восстановительным процессам: сульфит-ион окисляется до сульфат-иона, перманганат-ион восстанавливается в слабощелочной среде до диоксида марганца.
Вторая реакция также относится к окислительно-восстановительным и может рассматриваться как лабораторный способ получения хлора.
При взаимодействии алюминия с хлором образуется хлорид алюминия, которьщ с избытком гидроксида натрия образует гидроксокомплекс (тетрагидроксо- или гексагидроксоалюминат натрия).
Требуемые уравнения реакций:
Пример 31. Порошок сульфида хрома(III) обработали водой. Выпавший при этом серо-зелёный осадок обработали хлорной водой в присутствии гидроксида калия. К полученному жёлтому раствору прилили раствор сульфита калия, при этом вновь выпал серо-зелёный осадок, который прокалили до постоянства массы.
Запишите уравнения четырёх описанных реакций.
Проанализируем текст задания.
1) Сульфид хрома(III) имеет формулу Cr2S3 и относится к солям, образованным слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу и по катиону, и по аниону. Особенностью взаимодействия сульфида хрома с водой является то, что гидролиз протекает практически полностью, «до конца»:
Это связано с образованием осадка нерастворимого гидроксида хрома и выделением газообразного сероводорода (оба эти фактора смещают равновесие гидролиза вправо и делает реакцию практически необратимой).
2) Выпавший серо-зелёный осадок представляет собой гидроксид хрома(III). Под действием сильного окислителя — хлора, хром(III) окисляется до хрома(VI). В щелочной среде образуется жёлтый хромат калия — соль хромовой кислоты:
3) Сульфит калия является хорошим восстановителем, а хроматы(VI) проявляют окислительные свойства. Поэтому возможна окислительно-восстановительная реакция, в ходе которой хром восстанавливается до устойчивой степени окисления +3:
4) Выпавший осадок гидроксида хрома(III), являясь термически неустойчивым, при нагревании легко распадается с образованием оксида и воды:
Пример 32. Железную окалину (минерал магнетит) растворили при нагревании в концентрированной азотной кислоте. В раствор полученной при этом соли внесли избыток порошка железа. После завершения реакции раствор отфильтровали и к фильтрату добавили гидроксид калия до прекращения выпадения осадка. Выпавший осадок отфильтровали и оставили на воздухе до полного изменения его цвета.
Запишите уравнения четырёх описанных реакций.
1) Железная окалина Fe3O4является смешанным оксидом железа(II,III): FeO∙Fe2O3. Концентрированной азотной кислотой, особенно при нагревании, железо(II) окисляется до железа(III):
2) В присутствии металлического железа возможна реакция сопропорционирования железа, в ходе которой происходит «усреднение» степени окисления железа:
3) При действии щелочи на раствор получившегося нитрата железа(II) выпадает осадок гидроксида железа(II):
4) Под действием воздуха гидроксид железа(II) быстро буреет — окисляется кислородом до гидроксида железа(III):
Пример 33. Красный фосфор сожгли в избытке газообразного хлора. Продукт реакции нагрели ещё с одной навеской фосфора. Получившееся вещество внесли в воду. Образовавшуюся при этом фосфорсодержащую кислоту обработали подкисленным раствором перманганата калия. Запишите уравнения четырёх описанных реакций.
В результате горения фосфора в избытке хлора образуется хлорид фосфора(V). На втором этапе фосфор выступает в роли восстановителя и происходит восстановление хлорида фосфора(V) до хлорида фосфора(III). В результате гидролиза хлорида фосфора(III) образуется фосфористая кислота, степень окисления фосфора в которой соответствует степени окисления фосфора в хлориде, т.е. +3.
А при действии перманганата калия в кислой среде на образовавшуюся кислоту Н3РO3 происходит её окисления фосфора фосфорной кислоты Н3РO4 восстановления марганца до +2 (MnSO4). Составим уравнения описанных реакций:
Задания для самостоятельной работы
111. В цепочке превращений
веществами «X» и «Y» являются:
Ответ:
112. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
113. В схеме превращений
веществами «Х1» и «Х2» являются:
Ответ:
114. В схеме превращений
веществами «Х1» и «Х2» являются:
1) FeO
2) НСl
3) FeCl3
4) FeCl2
5) Fe2O3
Ответ:
115.В схеме превращений
веществами «Х1» и «Х2» являются:
1) сульфат железа(III)
2) сульфат железа(II)
3) сульфид железа(III)
4) гидроксид железа(II)
5) гидроксид железа(III)
Ответ:
116. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
117. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
118. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
119. В схеме превращений
веществами «X1» и «Х2» являются:
120. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
121. В схеме превращений
веществами «X1» и «Х2» являются:
Ответ:
122. В схеме превращений
веществами «X1» и «Х2» являются соответственно
Ответ:
123. В схеме превращений
веществами «X1» и «Х2» являются соответственно
Ответ:
124. Железо растворили в разбавленном растворе серной кислоты, образовавшуюся соль выделили. При взаимодействии полученной соли со щелочным раствором перманганата калия наблюдается выпадение осадка и изменение цвета раствора на зелёный. Осадок отделили и растворили в соляной кислоте. Полученный раствор нагрели и поместили в него порошок меди, при этом наблюдали изменение цвета раствора.
Напишите уравнения четырёх описанных реакций.
125. Нитрат серебра прокалили. К образовавшемуся твёрдому остатку добавили концентрированную азотную кислоту и наблюдали интенсивное выделение бурого газа. Газ собрали и полностью поглотили раствором гидроксида калия при охлаждении. К образовавшемуся раствору прилили раствор дихромата калия, подкисленный серной кислотой.
Напишите уравнения четырёх описанных реакций.
126. Железо растворили в соляной кислоте. Через образовавшийся раствор пропустили аммиак. Образовавшийся при этом осадок отделили и обработали пероксидом водорода без нагревания, при этом наблюдали изменение цвета осадка. Полученное бурое вещество сплавили с твёрдым гидроксидом натрия.
Напишите уравнения четырёх описанных реакций.
127. На перманганат калия подействовали концентрированной соляной кислотой. Образовавшийся жёлто-зелёный газ пропустили над нагретым порошком меди. Полученное вещество растворили в воде и смешали с раствором нитрата серебра(I), выпавший при этом осадок отделили. К оставшемуся раствору добавили раствор иодида калия.
Напишите уравнения четырёх описанных реакций.
128. Фосфат кальция прокалили с углём в присутствии речного песка. Образовавшееся простое вещество прореагировало с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой.
Напишите уравнения описанных реакций.
129. Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили и полученный продукт сплавили с карбонатом натрия.
Напишите уравнения описанных реакций.
130. Металлическую медь обработали при нагревании иодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали гидроксидом калия. Выпавший осадок прокалили.
Напишите уравнения описанных реакций.
131. К раствору хлорида меди(II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте.
Напишите уравнения описанных реакций.
132. Оксид алюминия сплавили с содой. Полученный продукт растворили в соляной кислоте и обработали избытком аммиачной воды. Выпавший осадок растворился в растворе гидроксида натрия с образованием тетрагидроксоалюмината натрия.
Напишите уравнения описанных реакций.
133. Провели электролиз раствора хлорида натрия. К полученному раствору добавили хлорид железами). Выпавший осадок отфильтровали и прокалили. Твёрдый остаток растворили в иодово-дородной кислоте.
Напишите уравнения четырёх описанных реакций.
134. Алюминий прореагировал с раствором гидроксида натрия. Выделившийся газ пропустили над нагретым порошком оксида меди(II). Образовавшееся простое вещество растворили при нагревании в концентрированной серной кислоте. Полученную соль выделили и добавили к раствору иодида калия.
Напишите уравнения четырёх описанных реакций.
135. Хлорат калия нагрели в присутствии катализатора, при этом выделился бесцветный газ. Сжиганием железа в атмосфере этого газа была получена железная окалина. Её растворили в избытке соляной кислоты. К полученному при этом раствору добавили раствор, содержащий дихромат натрия и соляную кислоту.
Напишите уравнения четырёх описанных реакций.
136. Порошок магния нагрели в атмосфере азота. При взаимодействии полученного вещества с водой выделился газ. Газ пропустили через водный раствор сульфата хрома(III), в результате чего образовался серый осадок. Осадок отделили и обработали при нагревании раствором, содержащим пероксид водорода и гидроксид калия.
Напишите уравнения четырёх описанных реакций.
137. Оксид хрома(VI) прореагировал с гидроксидом калия. Полученное вещество обработали серной кислотой, из образовавшегося раствора выделили соль оранжевого цвета. Эту соль обработали бромоводородной кислотой. Полученное простое вещество вступило в реакцию с сероводородом.
Напишите уравнения четырёх описанных реакций.
138. Твёрдый хлорид лития нагрели с концентрированной серной кислотой, выделившийся при этом газ растворили в воде. При взаимодействии полученного раствора с перманганатом калия образовалось простое газообразное вещество жёлто-зелёного цвета. При горении железной проволоки в этом веществе получили соль. Соль растворили в воде и смешали с раствором карбоната натрия.
Напишите уравнения четырёх описанных реакций.
ОРГАНИЧЕСКАЯ ХИМИЯ
Представление об элементах содержания, проверяемых заданиями этого блока, дает таблица 3.
Таблица 3
| Проверяемые элементы содержания | Уровень сложности задания проверяющего усвоение элемента содержания |
| Классификация органических соединений. Номенклатура органических веществ (тривиальная и международная). | Б |
| Теория строения органических соединений: гомология и изомерия (структурная и пространственная). Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбита- лей углерода. Радикал. Функциональная группа | Б |
| Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и толуола). Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии. | Б, П |
| Характерные химические свойства предельных одноатомных и многоатомных спиртов; фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды). | Б, П |
| Основные способы получения углеводородов (в лаборатории). Основные способы получения кислородсодержащих соединений (в лаборатории) | Б |
| Характерные химические свойства азотсодержащих органических соединений: аминов и аминокислот. Белки. | Б |
| Взаимосвязь органических соединений | Б, В |
Сложные задания на превращения неорганических веществ из ЕГЭ 2017.
Задание №1
Оксид алюминия растворили в водном растворе гидроксида натрия. К образовавшемуся раствору прилили избыток азотной кислоты. Продукт, являющимся соединением алюминия, выделили, высушили и прокалили. Выделившуюся смесь газов пропустили через раствор гидроксида кальция. Напишите уравнения четырёх описанных реакций.
Решение1) Оксид алюминия относится к амфотерным оксидам. При действии на амфотерные оксиды и гидроксиды водными растворами щелочей образуются комплексные соли:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
2) Комплексные соли, полученные взаимодействием щелочей с амфотерными металлами/оксидами/гидроксидами, при действии на них избытка сильной кислоты разрушаются, превращаясь в соли, образованные этой кислотой, и воду:
Na[Al(OH)4] + 4HNO3 → NaNO3 + Al(NO3)3 + 4H2O
3) Все нитраты термически нестойки, т.е. разлагаются при нагревании. Нитраты металлов, расположенных в ряду активности от Mg до Cu (включительно), при разложении образуют оксид металла, оксид азота (IV) и кислород. В случае нитрата алюминия реакция разложения будет описываться уравнением:
4Al(NO3)3 2Al2O3 + 12NO2↑ + 3O2↑
4) При поглощении диоксида азота щелочью в присутствии кислорода образуется нитрат активного металла и вода:
2Ca(OH)2 + 4NO2 + O2 → 2Ca(NO3)2 + 2H2O
Задание №2
Гидроксид алюминия прокалили. Образовавшийся твердый остаток при нагревании растворили в растворе гидроксида калия. Через полученный прозрачный раствор пропустили избыток газа с резким запахом, образовавшийся при взаимодействии твердого бромида натрия с концентрированной серной кислотой. Напишите уравнения четырёх описанных реакций.
Решение1) Нерастворимые основания, а также амфотерные гидроксиды при нагревании разлагаются до соответствующего оксида и воды:
2Al(OH)3 Al2O3 + 3H2O
* Щелочи, в отличие от нерастворимых оснований и амфотерных гидроксидов, при нагревании не разлагаются и способны плавиться и даже кипеть без разложения.
2) Амфотерные оксиды и гидроксиды реагируют как с твердыми щелочами при сплавлении, так и с водными растворами щелочей. При взаимодействии амфотерных оксидов и гидроксидов с водными растворами щелочей образуются комплексные соли (гидроксокомплексы). В случае с оксидом и гидроксидом алюминия образуются тетрагидроксоалюминат щелочного или щелочноземельного металла (в зависимости от используемой щелочи):
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4]
3) При взаимодействии кристаллических бромидов с концентрированной серной кислотой протекает окислительно-восстановительная реакция, в результате которой бромид-ион окисляется до брома, а сера в концентрированной серной кислоте понижает свою степень окисления +6 до +4, превращаясь в диоксид серы SO2:
2NaBr(тв.) + 3H2SO4(конц.) → 2NaHSO4 + Br2 + SO2↑ + 2H2O
Вместо NaHSO4 в качестве продукта также можно записать Na2SO4.
* Отношение остальных галогенидов к концентрированной серной кислоте
Кристаллические йодиды, являясь намного более сильными восстановителями, чем бромиды, восстанавливают концентрированную серную кислоту до сероводорода, сами при этом как и бром окисляясь до простого вещества (I2).
Кристаллические фториды и хлориды под действием концентрированной серной кислоты не окисляются, а переходят соответственно в газообразные HF и HCl.
4) Комплексные соли, являющиеся продуктами взаимодействия щелочей и амфотерных гидроксидов, разлагаются при действии на них кислот и кислотных оксидов. В данном случае сернистый газ, образующий слабую сернистую кислоту, разрушает комплексную соль с образованием калиевой соли и нерастворимого амфотерного основания — гидроксида алюминия:
K[Al(OH)4] + SO2 → KHSO3 + Al(OH)3↓
*Кислотные оксиды SO2 и CO2 не способны реагировать с гидроксидами вида Me(OH)3.
Задание №3
Фосфат кальция сплавили с оксидом кремния (IV) и углеродом. Образовавшееся в результате этой реакции простое вещество сожгли в избытке хлора. К образовавшемуся веществу добавили избыток раствора гидроксида калия, а после завершения реакции — известковую воду. Напишите уравнения четырёх описанных реакций.
Решение1) Данная реакция лежит в основе промышленного получения фосфора. Фосфор восстанавливается коксом при нагревании, а оксид кремния связывает соединения кальция в тугоплавкий силикат. Реакция протекает при температуре около 1600oC:
Ca3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 2P + 5CO
2) Фосфор в качестве восстановителя взаимодействует со многими неметаллами. В недостатке хлора фосфор сгорает до трихлорида фосфора PCl3, а в избытке хлора фосфор окисляется до пятивалентного состояния с образованием пентахлорида фосфора:
2P + 5Cl2(изб.) 2PCl5
3) Являясь кислотным соединением, пентахлорид фосфора способен взаимодействовать с растворами щелочей с образованием соответствующих хлоридов и фосфатов:
8KOH + PCl5 → K3PO4 + 5KCl + 4H2O
4) Обменные реакции солей с щелочами, кислотами и другими солями протекают при условии образования осадка или выделения газа:
2K3PO4 + 3Ca(OH)2 → Ca3(PO4)2↓ + 6KOH
Задание №4
Калий растворили в воде. Через полученный раствор пропустили газ, выделившийся при взаимодействии серебра с концентрированной азотной кислотой. После этого к данному раствору прилили раствор перманганата калия, в результате чего наблюдали выпадение темно-коричневого осадка. Напишите уравнения четырёх описанных реакций.
Решение1) Щелочные и щелочно-земельные металлы бурно взаимодействуют с водой с образованием щелочи и водорода:
2K + 2H2O → 2KOH + H2↑
2) Азотная и концентрированная серная кислоты являются кислотами-окислителями. В отличие от кислот-неокислителей, взаимодействующих с металлами, расположенными в электрохимическом ряду напряжений до водорода, с выделением водорода, кислоты-окислители способны реагировать с металлами, стоящими в этом ряду напряжение как до, так и после водорода (кроме платины и золота). Однако вместо водорода выделяются продукты восстановления азота и серы, причем состав продуктов зависит от температуры реакции, активности металла и концентрации кислоты. При взаимодействии концентрированной азотной кислоты с железом и любым металлом правее него продуктом восстановления является диоксид азота (бурый газ):
Ag + 2HNO3(конц.) → AgNO3 + NO2↑ + H2O
3) Диоксид азота, как и другие кислотные оксиды, способен взаимодействовать с основными оксидами и основаниями с образованием солей. Однако диоксид азота, в отличие от других кислотных оксидов, при взаимодействии с основаниями образует сразу две соли – нитрат и нитрит:
2NO2 + 2KOH → KNO3 + KNO2 + H2O
4) Перманганат способен окислять нитриты до нитратов. В кислой среде перманганат восстанавливается до Mn2+, в нейтральной – до MnO2, в щелочной – до манганата MnO42-. В нашем случае среда нейтральная, поэтому уравнение реакции будет иметь вид:
3KNO2 + 2KMnO4 + H2O → 3KNO3 + 2MnO2↓ + 2KOH
Задание №5
В раствор бромоводорода добавили карбонат калия. Образовавшуюся при этом соль выделили, высушили, добавили к концентрированной серной кислоте и нагрели. Полученное простое вещество разделили на две части. Одну часть вещества поместили в горячий концентрированный раствор гидроксида калия, а другую часть – в раствор, содержащий сульфит калия и гидроксид натрия. Напишите уравнения четырёх описанных реакций.
Решение1) Все соли, образованные слабыми кислотами, реагируют с другими существенно более сильными кислотами:
K2CO3 + 2HBr → 2KBr + CO2↑ + H2O
2) При взаимодействии кристаллических бромидов с концентрированной серной кислотой протекает окислительно-восстановительная реакция, в результате которой бромид-ион окисляется до брома, а сера в концентрированной серной кислоте понижает свою степень окисления +6 до +4, превращаясь в диоксид серы SO2:
2KBr(тв) + 2H2SO4(конц., гор.) → K2SO4 + Br2 + SO2↑ + 2H2O
Также возможен вариант с образованием кислой соли KHSO4 вместо K2SO4.
* Отношение остальных галогенидов к концентрированной серной кислоте:
Кристаллические йодиды, являясь намного более сильными восстановителями, чем бромиды, восстанавливают концентрированную серную кислоту до сероводорода, сами при этом как и бром окисляясь до простого вещества (I2).
Кристаллические фториды и хлориды под действием концентрированной серной кислоты не окисляются, а переходят соответственно в газообразные HF и HCl.
3) При взаимодействии галогенов – хлора, брома и йода – с щелочами протекает реакция диспропорционирования. Реакция брома (хлора, йода) с горячим раствором щелочи приводит к образованию бромида (хлорида, йодида) и бромата (хлората, йодата):
3Br2 + 6KOH → 5KBr + KBrO3 + 3H2O (нагрев)
4) Сера является кислотообразующим элементом, для которого присущи разные степени окисления. При использовании подходящего окислителя или восстановителя можно перейти от соли одной кислоты к соли другой кислоты, в которой кислотообразующий элемент имеет другую степень окисления. В данном случае соль сернистой кислоты при действии окислителя – брома — переходит в соль серной кислоты:
Br2 + K2SO3 + 2NaOH → 2NaBr + K2SO4 + H2O
Задание №6
Оксид железа (III) поместили в раствор азотной кислоты. Образовавшуюся соль выделили, высушили и прокалили. Твердый остаток, полученный при прокаливании соли, растворили в иодоводородной кислоте. Один из продуктов этой реакции, являющийся простым веществом, вступило в реакцию с концентрированным раствором гидроксида натрия при нагревании. Напишите уравнения четырёх описанных реакций.
Решение1) Оксид железа (III) является амфотерным оксидом. Как и другие амфотерные оксиды, Fe2O3 в зависимости от свойств второго реагента способен проявлять как кислотные, так и основные свойства. При взаимодействии с кислотами амфотерный оксид проявляется основные свойства, в результате чего образуется соль:
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
2) Все нитраты подвержены термическому разложению. Глубина разложения зависит от положения металла в ряду активности. Нитраты металлов от Mg до Cu включительно разлагаются с образованием оксида металла, бурого газа NO2 и кислорода:
4Fe(NO3)3 2Fe2O3 + 12NO2↑ + 3O2↑
3) При взаимодействии оксида железа (III) с иодоводородной кислотой, проявляющей восстановительные свойства, происходит изменение степени окисления йода, при этом железо (III) восстанавливается до железа (II):
Fe2O3 + 6HI → 2FeI2 + I2 + 3H2O
4) Йод, как и галогены бром и хлор, проявляет как окислительные, так и восстановительные свойства, поэтому способен вступать в реакции диспропорционирования. В горячем концентрированном раствором щелочи йод диспропорционирует с образованием иодида и иодата:
3I2 + 6NaOH(конц.) 5NaI + NaIO3 + 3H2O
Задание №7
Карбид алюминия сожгли на воздухе. Выделившийся газ пропустили через избыток раствора гидроксида калия. К раствору образовавшейся в результате этой реакции соли добавили сульфат хрома (III). Выделившийся осадок поместили в концентрированный раствор пероксида водорода и гидроксида натрия. Напишите уравнения четырёх описанных реакций.
Решение1) Бинарное соединение карбид алюминия сгорает на воздухе до двух оксидов: нелетучего оксида алюминия и углекислого газа:
Al4C3 + 6O2 → 2Al2O3 + 3CO2↑
2) Реакция кислотного оксида с основными оксидами и основаниями приводит к образованию солей:
2KOH + CO2 → K2CO3 + H2O
3) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции помимо солей принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
3K2CO3 + Сr2(SO4)3 + 3H2O → 2Cr(OH)3↓ + 3K2SO4 + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
4) Соединения хрома (III) при действии на них сильных окислителей в щелочной среде превращаются в хроматы — соли ярко-желтого цвета, содержащие в своем составе хромат-ион CrO42-:
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
Задание №8
Алюминий сожгли в токе хлора. Полученное вещество добавили к раствору карбоната натрия. Выпавший в результате этой реакции осадок выделили и поместили в раствор гидроксида натрия. К продукту реакции прилили избыток раствора серной кислоты. Напишите уравнения четырёх описанных реакций.
Решение1) При взаимодействии алюминия с хлором образуется бескислородная соль:
2Al + 3Cl2 → 2AlCl3
2) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2AlCl3 + 3Na2CO3 + 3H2O → 6NaCl + 2Al(OH)3↓ + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
3) Амфотерные гидроксиды проявляют как кислотные, так и основные свойства. При взаимодействии амфотерных оксидов/гидроксидов с щелочами образуются комплексные соли:
Al(OH)3 + NaOH(р-р) → Na[Al(OH)4]
4) При действии избытка сильных кислот на гидроксокомплексы последние полностью разрушаются, образуя соли активного и амфотерного металлов:
2Na[Al(OH)4] + 4H2SO4 → Na2SO4 + Al2(SO4)3 + 8H2O
Задание №9
Оксид железа (III) сплавили с твердым гидроксидом натрия. Полученное твердое вещество добавили к избытку раствора вещества, полученного при пропускании смеси оксида азота(IV) с кислородом через воду. Соединение железа выделили и поместили в раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Решение1) Оксид железа (III) является амфотерным оксидом, обладающим и кислотными, и основными свойствами. При сплавлении оксида железа (III) со щелочью образуется диоксоферрат (III) натрия:
Fe2O3 + 2NaOH(тв.) → 2NaFeO2 + H2O (сплавление)
2) При пропускании смеси диоксида азота с кислородом через воду образуется азотная кислота:
4NO2 + O2 + 2H2O → 4HNO3
* при пропускании чистого NO2 (без кислорода) через воду образуются две кислоты — азотная и азотистая.
3) При действии сильных кислот на NaFeO2 образуется две соли и вода:
NaFeO2 + 4HNO3(изб.) → NaNO3 + Fe(NO3)3 + 2H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 6KNO3 + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
Задание №10
Сульфат железа (II) добавили к раствору гидроксида натрия. Осадок выделили и добавили к концентрированному раствору перекиси водорода. Полученное вещество бурого цвета добавили к раствору иодоводородной кислоты. Простое вещество, образовавшееся в результате этой реакции, поместили к горячий концентрированный раствор гидроксида калия. Напишите уравнения четырёх описанных реакций.
Решение1) Реакция сульфата железа (II) и гидроксида натрия является типичным примером реакции обмена между растворимой солью и щелочью. Ее протекание возможно, поскольку образуется осадок (гидроксид железа (II)):
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
2) Гидроксид железа (II) легко окисляется. Под действием кислорода или перекиси водорода бледно-зеленый осадок гидроксида железа окисляется, превращаясь также в нерастворимый гидроксид железа (III) бурого цвета:
2Fe(OH)2 + H2O2 → 2Fe(OH)3
3) Иодид-ион является довольно сильным восстановителем вследствие чего способен окисляться даже ионами Cu2+ и Fe3+, восстанавливая их соответственно до соединений Cu+1 и Fe+2. Так, в случае гидроксида железа (III) его взаимодействие с йодоводородной кислотой выглядит следующим образом:
2Fe(OH)3 + 6HI → 2FeI2 + I2 + 6H2O
4) Все галогены (кроме фтора) диспропорционируют при взаимодействии с щелочами, т.е. одновременно и повышают, и понижают свою степень окисления. В горячем растворе щелочи йод окисляется до I+5 и восстанавливается до I-1:
3I2 + 6KOH(горяч.) → 5KI + KIO3 + 3H2O
* аналогично реагируют с щелочью при нагревании хлор и бром.
Задание №11
Хлорат калия нагрели в присутствии оксида марганца (IV). Выделившийся газ прореагировал с горячим металлическим железом. Железную окалину растворили в концентрированной азотной кислоте. Образовавшаяся в результате этой реакции соль внесли в раствор карбоната калия. Напишите уравнения четырёх описанных реакций.
Решение1) Хлорат калия (бертолетова соль) разлагается в присутствии диоксида марганца до хлорида калия и кислорода:
2KClO3 → 2KCl + 3O2↑ (кат. MnO2)
2) Реакция горения железа в кислороде приводит к образованию железной окалины Fe3O4, представляющей собой смешанный оксид FeO∙Fe2O3:
3Fe + 2O2 → Fe3O4
3) Железная окалина Fe3O4 формально может рассматриваться как смесь FeO и Fe2O3 в мольном соотношении 1:1. При взаимодействии оксида Fe2O3 с концентрированной азотной кислотой протекает реакция обмена без изменения степени окисления железа в образовавшейся соли – нитрата железа (III). А при взаимодействии оксида FeO, в котором железо проявляет степень окисления +2, происходит его окисление, в результате чего также образуется соль нитрата железа (III), а концентрированная азотная кислота восстанавливается до диоксида азота:
Fe3O4 + 10HNO3(конц.) → 3Fe(NO3)3 + NO2 + 5H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 6KNO3 + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
Задание №12
Гидрид калия растворили в воде. Через полученный раствор пропустили газ с неприятным запахом, выделившийся при взаимодействии твердого иодида калия с нагретой концентрированной серной кислотой. К раствору образовавшейся соли калия добавили сульфат алюминия. Напишите уравнения четырёх описанных реакций.
Решение1) Гидриды активных металлов содержат водород в редкой для него степени окисления, равной -1. По этой причине гидриды активных металлов являются чрезвычайно сильными восстановителям, в частности, восстанавливают водород из воды:
KH + H2O → KOH + H2↑
2) В ряду ионов F—-Cl—-Br—-I— возрастают восстановительные свойства галогенидов. Так, например, фториды и хлориды не вступают в окислительно-восстановительную реакцию с концентрированной серной кислотой. При их взаимодействии с H2SO4 выделяются газообразные HF и HCl соответственно. Бромиды восстанавливают концентрированную H2SO4 до SO2, а йодиды – до H2S:
8KI(тв.) + 9H2SO4(конц.) → 4I2↓ + H2S↑ + 4H2O + 8KHSO4
3) При взаимодействии сероводородной кислоты с избытком щелочи протекает реакция обмена с образованием сульфида калия и воды:
H2S + 2KOH → K2S + 2H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции помимо солей принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
3K2S + Al2(SO4)3 + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 3K2SO4
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
Задание №13
Пероксид водорода разложили в присутствии оксида марганца (IV). Выделившийся в результате этой реакции бесцветный газ прореагировал с железом с образованием железной окалины, которую затем смешали с концентрированной азотной кислотой. Далее к полученному раствору добавили раствор карбонат калия, в результате чего выделился газ и образовался бурый осадок. Напишите уравнения четырёх описанных реакций.
Решение1) Пероксид водорода – неустойчивое, легко разлагающееся соединение. Разложение пероксида водорода катализируется ионами переходных металлов:
2H2O2 → 2H2O + O2↑ (кат. MnO2)
2) Железная окалина, имеющая формулу Fe3O4, образуется при сжигании железа в кислороде:
3Fe + 2O2 Fe3O4
3) Железная окалина – Fe3O4 может условно рассматриваться как смесь оксидов FeO и Fe2O3 в молярном соотношении 1:1.Таким образом, между оксидом железа (III) и концентрированной азотной кислотой протекает обычная обменная реакция с образованием нитрата железа (III) и воды, а между оксидом железа (II) – окислительно-восстановительная реакция, в результате которой также образуется нитрат железа (III), а азот в азотной кислоте восстанавливается до бурого газа (NO2):
Fe3O4 + 10HNO3(конц.) → 3Fe(NO3)3 + NO2 + 5H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 6KNO3 + 3CO2↑
Задание №14
Оксид азота (II) окислили кислородом. Выделившийся в результате этой реакции газ бурого цвета смешали с кислородом и пропустили через воду, при этом образовалась кислота. В горячий концентрированный раствор этой кислоты поместили оксид железа (II). В раствор образовавшийся соли добавили карбонат калия. Напишите уравнения четырёх описанных реакций.
Решение1) NO легко окисляется кислородом воздуха при комнатной температуре и атмосферном давлении с образованием «бурого газа» NO2:
2NO + O2 → 2NO2
2) При пропускании смеси диоксида азота с кислородом через воду образуется азотная кислота::
4NO2 + O2 + 2H2O → 4HNO3
* при пропускании чистого NO2 через воду образуются сразу две кислоты — азотная и азотистая.
3) При взаимодействии оксида железа (II) с кислотами-неокислителями образуются соли двухвалентного железа, при взаимодействии оксида железа (II) с кислотами-окислителями образуются соли трехвалентного железа. В случае использования в качестве окислителя азотной кислоты продуктом восстановления является газ NO2:
FeO + 4HNO3(конц.) → Fe(NO3)3 + NO2↑ + 2H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2Fe(NO3)3 + 3K2CO3 + 3H2O → 2Fe(OH)3↓ + 6KNO3 + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
Задание №15
Силицид кальция обработали горячей водой. Выделившийся в результате этой реакции газ сожгли в кислороде. Твердый продукт смешали с фосфатом кальция и углем и данную смесь прокалили. Образовавшееся простое вещество растворили в концентрированной азотной кислоте. Напишите уравнения четырёх описанных реакций.
Решение1) Бинарное соединение силицид кальция легко гидролизуется водой и водными растворами кислот-неокислителей. В обоих случаях одним из продуктов является силан SiH4:
Ca2Si + 4H2O → 2Ca(OH)2 + SiH4↑
2) Силан может самопроизвольно загораться при контакте с кислородом воздуха. При это образуется диоксид кремния, вода, а также выделяется большое количество теплоты:
SiH4 + 2O2 → SiO2 + 2H2O
3) В промышленности фосфор получают прокаливанием фосфата кальция с углем (коксом) и песком в электрических печах при температуре около 1500 – 1600oC. Выделяющиеся пары белого фосфора конденсируются в приемнике под слоем воды:
2Ca3(PO4)2 + 6SiO2 + 10C → 6CaSiO3 + P4 + 10CO
* вместо формулы белого фосфора P4 можно записывать просто P.
4) Фосфор, сера и углерод способны окисляться азотной кислотой и концентрированной серной кислотой. Данные простые вещества окисляются до высших степеней окисления элементов, образуя соответствующие кислородсодержащие кислоты:
P + 5HNO3 → H3PO4 + 5NO2↑ + H2O
* При действии концентрированной серной кислоты на серу, очевидно, невозможно окисление серы S0 до высшей степени окисления +6. В этом случае протекает реакция сопропорционирования:
2H2SO4(конц.) + S = 3SO2 + 2H2O
Задание №16
Натрий осторожно поместили в воду. Через полученный раствор пропустили недостаток сернистого газа. Образовавшуюся соль добавили в подкисленный серной кислотой раствор бихромата натрия. Соль хрома выделили и добавили к раствору карбоната натрия. Напишите уравнения четырёх описанных реакций.
Решение1) Щелочные и щелочно-земельные металлы взаимодействуют с водой в обычных условиях. При этом образуется щелочь и выделяется водород:
2Na + 2H2O → 2NaOH + H2↑
2) При пропускании недостатка сернистого газа через водный раствор щелочи образуется нормальная (средняя) соль:
2NaOH + SO2 → Na2SO3 + H2O
3) Сульфит натрия содержит серу в промежуточной степени окисления, т.е. в реакциях может быть как окислителем, так и восстановителем (чаще последнее). При действии различных окислителей (кислорода, перманганатов, бихроматов , кислот-окислителей, галогенов) сульфит натрия окисляется до сульфата:
3Na2SO3 + Na2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 4Na2SO4 + 4H2O
4) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
Cr2(SO4)3 + 3Na2CO3 + 3H2O → 2Cr(OH)3↓ + 3Na2SO4 + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
Задание №17
К раствору хлорида железа (III) добавили карбонат натрия, в результате чего выпал осадок бурого цвета. Осадок выделили, высушили и прокалили. Оксид железа (III) полностью восстановили угарным газом, в результате чего выделился бесцветный газ. Этот газ пропустили через водный раствор силиката натрия. Напишите уравнения четырёх описанных реакций.
Решение1) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaCl + 3CO2↑
2) Нерастворимые гидроксиды подвержены термическому разложению с образованием соответствующих оксидов и воды. Данные реакции протекают без изменения степеней окисления:
2Fe(OH)3 → Fe2O3 + 3H2O (нагрев)
3) При восстановлении высших оксидов образуются низшие оксиды. Так, при действии на оксид железа (III) избытком угарным газа, водорода или углерода при нагревании образуется железо:
Fe2O3 + 3CO → 2Fe + 3CO2
4) Соли способны взаимодействовать с кислотами при условии признака реакции. Осадок в подобных типах реакции образуют только соли кремниевой кислоты. При пропускании через соль кремниевой кислоты кислотного оксида (или другой кислоты) образуется соль и в осадок выпадает кремниевая кислота:
Na2SiO3 + CO2 + H2O → Na2CO3 + H2SiO3↓
Задание №18
Оксид меди (II) растворили в серной кислоте. Через образовавшийся раствор пропустили газ с резким запахом, выделившийся при взаимодействии магния с концентрированной серной кислотой, в результате чего в осадок выпало вещество черного цвета. Это вещество выделили и добавили к концентрированной азотной кислоте. Напишите уравнения четырёх описанных реакций.
Решение1) Оксид меди (II) относится к основным оксидам, в связи с чем реагирует с кислотами, образуя соответствующие соли:
CuO + H2SO4 → CuSO4 + H2O
2) Концентрированная серная кислота проявляет сильные окислительные свойства. Связано это с тем, что окислительные свойства в кислотах-окислителях обеспечиваются не за счет катионов водорода H+, а за счет кислотообразующего элемента в высшей степени окисления, в нашем случае серы.
Магний является активным металлом, поэтому сера в концентрированной серной кислоте восстанавливается им до низшей степени окисления -2, т.е. до сероводорода:
4Mg + 5H2SO4(конц.) → 4MgSO4 + H2S↑ + 4H2O
3) Обычно реакция слабой кислоты с солью, образованной другой существенно более сильной кислотой не протекает. Однако это правило нарушается, если образуется соль с крайне низкой растворимостью. Например, к таким «крайне нерастворимым» солям относятся сульфиды меди, свинца и ртути. При пропускании сероводорода через растворы солей этих металлов наблюдается выпадение осадка нерастворимого сульфида:
CuSO4 + H2S → CuS↓ + H2SO4
* следует отметить, что нерастворимый в воде сульфид железа (II) в аналогичных условиях в осадок не выпадает из-за недостаточно низкой растворимости.
4) Кислота-окислитель переводит серу из минимальной степени окисления (-2) в максимальную (+6), при этом концентрированная азотная кислота восстанавливается до диоксида азота:
CuS + 8HNO3(конц.) → CuSO4 + 8NO2↑ + 4H2O
Задание №19
Нитрид кальция растворили в воде, в результате чего выделился газ с резким запахом. Этот газ при нагревании пропустили через трубку, заполненную оксидом меди (II). Образовавшееся в результате этой реакции простое вещество красного цвета поместили в разбавленный раствор азотной кислоты. Водный раствор полученной соли подвергли электролизу. Напишите уравнения четырёх описанных реакций.
Решение1) Нитриды щелочных и щелочноземельных металлов легко разлагаются водой, образуя щелочь и аммиак:
Ca3N2 + 6H2O → 3Ca(OH)2 + 2NH3↑
2) Оксид меди восстанавливается аммиаком до свободного металла:
2NH3+ 3CuO → 3Cu + N2↑ + 3H2O (нагрев)
3) Азотная кислота является сильным окислителем и способна реагировать со всеми металлами в ряду активности, кроме платины и золота. Медь, будучи малоактивным металлом, восстанавливает концентрированную азотную кислоту до NO2, а разбавленную до NO:
3Cu + 8HNO3(разб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
4) Нитрат меди — соль, образованная катионом металла,расположенного правее водорода в ряду активности, и кислородсодержащим кислотным остатком. В случае растворов солей таких металлов на катоде протекает процесс восстановления катиона металла. В нашем случае его можно записать так:
катод: Cu2+ + 2e— => Cu0
Кислородсодержащие кислотные остатки (кроме остатков карбоновых кислот) не могут разрядиться на аноде, поскольку энергетически более выгодным является процесс окисления молекул воды:
анод: 2H2O — 4e- => O2 + 4H+
Количество электронов, которые отдает катод, равно количеству электронов, которые принимает анод. Подведем в связи с этим электронный баланс:
катод: Cu2+ + 2e— => Cu0 | ∙ 2
анод: 2H2O — 4e- => O2 + 4H+ | ∙ 1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+ — ионное уравнение электролиза. Добавив по 4 нитрат-иона в левую и правую часть уравнения и объединив их с противоионами, получаем полное уравнение электролиза:
2Cu(NO3)2 + 2H2O → 2Cu↓ + O2↑ + 4HNO3 (электролиз)
Задание №20
Водный раствор нитрата меди (II) подвергли электролизу, в результате чего на катоде выделилось простое вещество красного цвета. Это вещество нагрели с оксидом меди (II). Образовавшееся соединение меди растворили в концентрированной серной кислоте. Далее к этому раствору добавили раствор сульфида натрия. Напишите уравнения четырёх описанных реакций.
Решение1) Нитрат меди — соль, образованная катионом металла, расположенного правее водорода в ряду активности, и кислородсодержащим кислотным остатком. В случае растворов солей таких металлов на катоде протекает процесс восстановления катиона металла. В нашем случае его можно записать так:
катод: Cu2+ + 2e— => Cu0
Кислородсодержащие кислотные остатки (кроме остатков карбоновых кислот) не могут разрядиться на аноде, поскольку энергетически более выгодным является процесс окисления молекул воды:
анод: 2H2O — 4e- => O2 + 4H+
Количество электронов, которые отдает катод, равно количеству электронов, которые принимает анод. Подведем в связи с этим электронный баланс:
катод: Cu2+ + 2e— => Cu0 | ∙ 2
анод: 2H2O — 4e- => O2 + 4H+ | ∙ 1
2Cu2+ + 2H2O = 2Cu0 + O2 + 4H+ — ионное уравнение электролиза.
Добавив по 4 нитрат-иона в левую и правую часть уравнения и объединив их с противоионами, получаем полное уравнение электролиза:
2Cu(NO3)2 + 2H2O → 2Cu↓ + O2↑ + 4HNO3 (электролиз)
2) Высшие оксиды меди, железа, углерода могут реагировать соответственно с медью, железом, углеродом при нагревании. При этом образуется оксид с промежуточной степенью окисления элемента. В случае меди и оксида меди (II) реакция приводит к образованию оксида меди (I):
Cu + CuO → Cu2O (нагрев)
3) Cu+1 окисляется концентрированными серной и азотной кислотами до Cu+2:
Cu2O + 3H2SO4(конц.) → 2CuSO4 + SO2↑ + 3H2O
4) Две соли реагируют друг с другом в случае, если одновременно выполняются два требования:
* исходные соли растворимы
* в продуктах есть осадок или газ
Таким образом, реакция между растворимыми солями CuSO4 и Na2S возможна поскольку образуется осадок (CuS):
CuSO4 + Na2S → CuS↓ + Na2SO4
* среди редких случаев образования газа при взаимодействии солей обязательно следует помнить реакцию между растворами солей аммония и нитритов при нагревании, например:
NH4Cl + KNO2 = N2↑ + 2H2O + KCl
Задание №21
Карбид алюминия поместили в раствор бромоводородной кислоты. К раствору соли добавили сульфит калия, в результате чего выпал осадок и выделился газ с резким запахом. Этот газ пропустили через подкисленный серной кислотой раствор бихромата калия. Соль хрома выделили и добавили к раствору хлорида бария. Напишите уравнения четырёх описанных реакций.
Решение1) Карбид алюминия легко гидролизуется водой, а также растворами кислот и щелочей. При взаимодействии с водой и кислотами протекает обычная реакция обмена:
Al4C3 + 12HBr → 4AlBr3 + 3CH4↑
2) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции, помимо солей, принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2AlBr3 + 3K2SO3 + 3H2O → 2Al(OH)3↓ + 3SO2↑ + 6KBr
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
3) Дихроматы и перманганаты являются сильными окислителями. Сернистый газ содержит серу в степени окисления +4, т.е. в промежуточной степени окисления, в связи с чем может быть как окислителем, так и восстановителем. Дихромат-ион при восстановлении в нейтральной среде превращается в Cr(OH)3, в щелочной среде — в [Cr(OH)6]3+, в случае кислой среды — в соль трехвалентного хрома:
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
4) Две соли реагируют друг с другом в случае, если одновременно выполняются два требования:
* исходные соли растворимы
* в продуктах есть осадок или газ
Таким образом, реакция между растворимыми солями Cr2(SO4)3 и BaCl2 возможна, поскольку образуется осадок (BaSO4):
Cr2(SO4)3 + 3BaCl2 → 3BaSO4↓ + 2CrCl3
* среди редких случаев образования газа при взаимодействии солей обязательно следует помнить реакцию между растворами солей аммония и нитритов при нагревании, например:
NH4Cl + KNO2 = N2↑ + 2H2O + KCl
Задание №22
Нитрат натрия прокалили. Образовавшуюся при этом соль смешали с йодидом аммония и нагрели. Продукт реакции поместили в щелочной раствор перманганата натрия. Осадок выделили и добавили к концентрированному раствору едкого калия. Напишите уравнения четырёх описанных реакций.
Решение1) Степень разложения нитратов определяется расположением металлов в ряду активностей.
Разложение нитратов металлов, расположенных в ряду активностей левее магния, происходит до нитритов и кислорода. Разложение нитратов металлов, расположенных в ряду активностей от Mg до Cu (включительно), протекает до оксидов металлов, диоксида азота и кислорода. Разложение нитратов металлов, расположенных правее меди, происходит до металла, диоксида азота и кислорода. Натрий расположен до магния в ряду активности, поэтому уравнение разложения его нитрата записывается следующим образом:
2NaNO3 → 2NaNO2 + O2 (нагрев)
2) При нагревании смеси, состоящей из нитрита металла и соли аммония, протекает окислительно-восстановительная реакция с образованием молекулярного азота, соли и воды:
NaNO2 + NH4I → NaI + N2↑ + 2H2O (нагрев)
3) Йодид-ион обладает сильными восстановительными свойствами, легко превращаясь под действием даже не очень сильных окислителей в простое вещество I2. Перманганат-ион в щелочной среде восстанавливается в наименьшей степени: марганец понижает свою степень окисления с +7 лишь до +6:
2NaI + 2NaMnO4 → I2↓ + 2Na2MnO4
4) Все галогены реагируют с растворами щелочей. Хлор, бром и йод при взаимодействии с щелочами при нагревании образуют воду и две соли — галогенид (MeHal) и галогенат (MeHalO3) активного металла:
3I2 + 6KOH → 5KI + KIO3 + 3H2O
* в случае щелочей, образованных щелочно-земельными металлами, формулы галогенида и галогената имеют вид MeHal2 и Me(HalO3)2 соответственно.
Задание №23
К раствору хлорида бария добавили сульфат натрия. Выпавший осадок отделили, а оставшийся раствор досуха упарили. Бесцветное кристаллическое вещество поместили в концентрированный раствор серной кислоты, в результате чего выделился газ с резким запахом. Газ собрали, растворили в воде и избыток получившегося раствора прилили к железной окалине. После окончания реакции к данному кислому раствору добавили перманганат калия. Напишите уравнения четырёх описанных реакций.
Решение1) Обменные реакции между солями сопровождаются, как правило, выпадением осадков. Сульфат бария – не растворимое в воде, в растворах щелочей и большинства кислот вещество белого цвета:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
2) При действии концентрированной серной кислоты на хлориды выделяется газообразный хлороводород. Реакция протекает благодаря тому, что в серной кислоте, в отличие от воды, хлороводород плохо растворяется:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl↑
* Фториды реагируют с концентрированной серной кислотой аналогично хлоридам, а бромиды и йоды окисляются ею до свободных галогенов Br2 и I2 соответственно.
3) Железная окалина формально может рассматриваться как смесь оксидов FeO и Fe2O3 в мольном соотношении 1:1. По этой причине при взаимодействии железной окалины с растворами кислот-неокислителей образуются соли железа (II) и железа (III):
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
4) Перманганаты и дихроматы – типичные окислители, соли железа (II) – типичные восстановители. Их взаимодействие приводит к окислению железа до степени окисления +3, а перманганат-ион в кислой среде восстанавливается до Mn2+:
5FeCl2 + KMnO4 + 8HCl → 5FeCl3 + MnCl2 + KCl + 4H2O
Задание №24
Бромид железа (III) добавили к раствору карбоната натрия. Образовавшийся осадок бурого цвета выделили, высушили и прокалили. Твердый остаток сплавили с гидроксидом калия. Продукт данной реакции растворили в избытке соляной кислоты. Напишите уравнения четырёх описанных реакций.
Решение1) При смешении растворов солей трехвалентных металлов с растворами сульфитов/сульфидов/карбонатов в реакции помимо солей принимает участие также вода. Связано это с тем, что предполагаемый в качестве продукта сульфит/сульфид/карбонат трехвалентного металла необратимо гидролизуется водой:
2FeBr3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6NaBr + 3CO2↑
* Исключение: взаимодействие солей трехвалентного железа с растворами сульфидов и сульфитов не подчиняются описанному выше правилу, поскольку протекают окислительно-восстановительные реакции — железо (III) восстанавливается до железа (II). При этом сульфид-ион окисляется до свободной серы, а сульфит-ион окисляется до сульфат-иона. Например:
2FeCl3 + 3Na2S = 2FeS + S + 6NaCl
2FeCl3 + Na2SO3 + H2O= 2FeCl2 + 2HCl + Na2SO4
2) Нерастворимые гидроксиды при прокаливании разлагаются до соответствующего оксида и воды:
2Fe(OH)3 → Fe2O3 + 3H2O (нагрев)
3) Оксид железа (III), будучи амфотерным оксидом, при сплавлении с щелочами образует среднюю соль:
Fe2O3 + 2KOH → 2KFeO2 + H2O (нагрев)
4) Феррат (III) калия при обработке его раствором сильной кислоты образует две соли и воду:
KFeO2 + 4HCl → FeCl3 + KCl + 2H2O
Кэролайн Имрейбе
Реакция торнадо
Научная концепция: Произойдет реакция, подобная торнадо при использовании раствора хлорида ртути и йода калия решение. Используя магнитную мешалку и мешалку, химикаты вызовет в колбе реакцию, подобную торнадо.
Материалы: Колба Эрленмейера 1 литр, заполненная 1000 мл воды
10 мл 0,01 М раствора хлорида ртути (II) (или вы можете использовать нитрат ртути)
20 мл 2 М раствора йодида калия
Магнитная мешалка
Магнитная штанга
К начальному набору колбы реакции торнадо.Начать с 800 мл дистиллированной воды и добавить 10 мл 0,1 М хлорида ртути (II) решение. Медленно добавляйте по несколько мл 2 М йодида калия за раз. решение. (Раствор должен стать оранжевым и дать оранжевый осадок … если вы добавите много KI слишком быстро, вы можете пропустить оранжевый осадок.) Продолжайте добавлять KI до тех пор, пока не появится оранжевый осадок. исчезает. Теперь вы готовы перейти к шагу 4 ниже.
Направление:
1.) Осторожно опустите магнитный стержень в колбу с водой.
2.) Подключите магнитную мешалку и поместите колбу на мешалку.
3.) Если бутылка торнадо уже установлена, просто продолжайте со следующими шагами.
4.) Затем добавьте примерно 1-2 мл хлорида ртути (II) в колба. Должен иметь место эффект оранжевого торнадо. Этот шаг может повторяться несколько раз.
** Примечание: если в растворе остался оранжевый осадок, то добавьте еще раствора KI в колбу, чтобы вернуть ее в исходное состояние состояние бесцветного раствора.
# Мы храним колбу для многих демонстраций и циклов. Этот облегчает многократную утилизацию.
Введение: Кто-нибудь проверял прогнозы погоды сегодня? Ну, я слышал, что он должен был штурмовать и быть на следите за смерчем !!!
Пояснение: Магнитный стержень внутри колбы и магнитная мешалка под колбой создает вихрь. В магнитная мешалка работает, потому что двигатель внутри вращается электромагнит.Сила достаточно сильна, чтобы вращать магнит на внутренней стороне стеклянной колбы. Быстрое движение решения создает эффект вихря.
Когда хлорид ртути (II) смешивают с калием йодид. Происходит реакция двойного замещения. Йодид ртути образует оранжевый осадок внутри вихря, создавая торнадо подобный эффект. Затем осадок исчезает, потому что он смешивается. обратно с избытком йодида калия.
См. Ссылку ниже для более полного обсуждения принципы реакции и равновесия, задействованные в этой демонстрации.
HgCl 2 + KI —> HgI 2 + KCl
Безопасность: Обращайтесь со стеклянной посудой осторожно.
Удаление отходов: См. Примечание выше #. контейнер для ртутных отходов и дайте воде испариться. Затем следуйте надлежащие методы окончательной утилизации опасных отходов.
Ссылка: Шахашари, Б., Химические демонстрации , Vol. 1, U. Wisconsin Press, 1983, стр. 271.
WebElements Периодическая таблица элементов »Йод» реакции элементов
Реакция йода с воздухом
Йод, I 2 не реагирует с кислородом, O 2 , или азотом, N 2 .Однако йод реагирует с озоном, O 3 , вторым аллотропом кислорода, с образованием нестабильного желтого цвета I 4 O 9 , природа которого, возможно, является I (IO 3 ) 3 .
Реакция йода с водой
Йод, I 2 , реагирует с водой с образованием гипойодита, OI — . Положение равновесия очень сильно зависит от pH раствора.
I 2 (л) + H 2 O (л) ⇌ OI — (водн.) + 2H + (водн.) + I — (водн.)
Реакция йода с галогенами
Йод, I 2 , реагирует с фтором, F 2 , при комнатной температуре с образованием фторида пентафторида иода (V).При 250 ° C та же реакция дает фторид гептафторида иода (VII). При тщательном контроле условий реакции (-45 ° C, суспензия в CFCl 3 ) возможно выделить фторид трифторида иода (III).
I 2 (s) + 5F 2 (g) → 2IF 5 (l) [бесцветный]
I 2 (г) + 7F 2 (г) → 2IF 7 (г) [бесцветный]
I 2 (s) + 3F 2 (g) → 2IF 3 (s) [желтый]
Йод, I 2 , реагирует с бромом, Br 2 , образует очень нестабильный, легкоплавкий твердый межгалогенный бромид йода (I).
I 2 (т) + Br 2 (л) → 2IBr (т)
Йод реагирует с хлором при -80 ° C с избытком жидкого хлора с образованием «трихлорида йода», хлорида йода (III), фактически I 2 Cl 6 . Йод реагирует с хлором в присутствии воды с образованием йодной кислоты.
I 2 (s) + 3Cl 2 (l) + I 2 Cl 6 (s) [желтый]
I 2 (с) + 6H 2 O (л) + 5Cl 2 (г) → 2HIO 3 (с) + 10HCl (г)
Реакция йода с кислотами
Йод реагирует с горячей концентрированной азотной кислотой с образованием йодной кислоты.Йодная кислота выкристаллизовывается при охлаждении
3I 2 (с) + 10HNO 3 (вод.) → 6HIO 3 (с) + 10NO (г) + 2H 2 O (л)
Реакция йода с основаниями
Йод, I 2 , реагирует с горячей водной щелочью с образованием йодата, IO 3 —. В этой реакции преобразуется только шестая часть всего йода.
3I 2 (г) + 6OH — (водн.) → IO 3 — (водн.) + 5I — (водн.) + 3H 2 O
вопросов и ответов о йодиде калия (KI) Американская ассоциация щитовидной железы
Почему щитовидная железа нуждается в специальной защите после выброса радиоактивного материала?
Йод необходим щитовидной железе для выработки гормонов, регулирующих энергию и обмен веществ в организме.Щитовидная железа поглощает йод из кровотока. Железа не может отличить стабильный (обычный) йод от радиоактивного йода и будет поглощать все, что может. У младенцев и детей щитовидная железа является одной из наиболее чувствительных к радиации частей тела. Большинство ядерных взрывов выделяют радиоактивный йод. Когда клетки щитовидной железы поглощают слишком много радиоактивного йода, это может вызвать рак щитовидной железы. Младенцы и маленькие дети подвергаются наибольшему риску. Риск намного ниже для людей старше 40 лет.Рак щитовидной железы кажется единственным раком, заболеваемость которым повышается после выброса радиоактивного йода. KI защищает только щитовидную железу, но это орган, который больше всего нуждается в защите.
Что такое КИ?
Йодид калия (KI) — это та же форма йода, которая используется для йодирования поваренной соли. KI наполняет щитовидную железу йодом, предотвращая поглощение радиоактивного йода. При своевременном приеме KI защищает щитовидную железу от радиоактивного йода из всех источников — воздуха, пищи, молока и воды.KI — это лекарство, отпускаемое без рецепта, которое можно купить в Интернете и в некоторых аптеках. КИ выпускается в таблетированной и жидкой формах. Две одобренные FDA марки таблеток KI с полной дозой 130 мг для взрослых — это IOSAT® (Anbex, Inc.) и Thyro-Block® (Medpointe, Inc.). Утвержденная FDA марка таблеток с KI на 65 мг — ThyroSafe® (Recip US). При правильной упаковке срок годности KI составляет не менее 5 лет, а возможно, и 11 лет. Если вы случайно примете очень старую таблетку, она может не подействовать в полной мере, но вам не повредит.
Какое доказательство того, что KI работает?
После Чернобыльской ядерной аварии 1986 года (ранее называвшейся «Чернобыль») меняющиеся ветры подняли радиоактивное облако по всей Европе.У 3000 человек, подвергшихся воздействию этого излучения, уже развился рак щитовидной железы. Большинство жертв были младенцами или маленькими детьми, проживавшими в Украине, Беларуси или России на момент аварии. Согласно отчету ООН, опубликованному в феврале 2002 года, еще от 8 000 до 10 000 подвергшихся воздействию людей могут заболеть раком щитовидной железы в течение следующих 10 лет. Польша, непосредственно граничащая с Беларусью и Украиной, распространила KI среди своего населения, и, похоже, не было случаев рака щитовидной железы.
Когда следует принимать КИ?
Принимаемый за 6-12 часов до воздействия радиоактивного йода, KI заполняет клетки щитовидной железы и препятствует поглощению железой радиоактивного йода.KI также является защитным, если его принимать в течение первых нескольких часов после воздействия радиоактивного йода. Людям следует принимать одну дозу в день только во время воздействия радиоактивного йода и через день после этого. KI следует использовать только по указанию местных органов здравоохранения. Не каждый радиоактивный выброс включает радиоактивный йод, который может вызвать рак щитовидной железы. Например, «грязная бомба» вряд ли будет содержать радиоактивный йод, потому что у нее короткий период полураспада. («Грязная бомба» — это обычная бомба, смешанная с радиоактивным материалом и предназначенная для взрыва с выбросом радиоактивных изотопов и заражением обширной территории.) Только органы здравоохранения могут определить, какие радиоактивные изотопы высвобождаются во время ядерной аварии, и, если высвобождается радиоактивный йод, когда принимать KI и как долго продолжать его принимать.
Какие рекомендуемые дозы KI?
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) опубликовало общие рекомендации по минимальным дозам KI: полная таблетка 130 мг для взрослых, 65 мг для детей от 3 до 18 лет, 32 мг для детей от 1 месяца до 3 лет, и 16 мг для новорожденных до 1 месяца.В США таблетки KI сейчас продаются в дозах 130 и 65 мг. Таблетки имеют отметки, чтобы их было легче разрезать для получения детских доз. В заявлении FDA от апреля 2002 г. говорится, что «абсолютная точность дозирования обычно не критична для безопасности или эффективности» и «общие преимущества KI намного превышают риски передозировки, особенно у детей». Согласно FDA, детям старше 1 месяца можно безопасно давать полную дозу 130-мг пилюли каждый из 2 дней подряд. Однако новорожденным следует давать только дозу 16 мг.Самый простой способ приготовить дозу 16 мг — растворить таблетку 130 мг в 8 унциях прозрачной жидкости и дать новорожденному 1 унцию жидкости. Другой альтернативой является введение новорожденному 16 мг жидкой формы KI (насыщенный раствор йодида калия [SSKI]), для чего требуется рецепт врача. Для предложений FDA по приготовлению доз KI для детей см. Http://www.fda.gov/Drugs/EmergencyPreparedness/BioterrorismandDrugPreparedness/ucm072254
Кому нельзя принимать КИ?
Миллионы людей принимали KI, но о серьезных побочных эффектах не сообщалось.Единственные люди, которым не следует принимать KI, — это те, у кого была серьезная аллергическая реакция на йод. В количествах, рекомендованных FDA, и в течение нескольких дней, когда представители общественного здравоохранения ожидают, что людям понадобится KI, пациенты с заболеваниями щитовидной железы могут безопасно принимать таблетки в регулярно рекомендуемых дозах. Во время ядерной аварии выгода KI намного превышает любой потенциальный риск. Взрослые старше 40 лет вообще не нуждаются в KI, если они не подвергаются воздействию чрезвычайно высоких уровней радиоактивного йода.
При длительном приеме KI может вызвать временный гипотиреоз (недостаточная активность щитовидной железы).«Достаточно долго» у каждого человека разное. Длительное лечение может стать серьезной проблемой для совсем маленьких детей. Такие дети должны быть впоследствии осмотрены медицинским работником. Также следует обследовать пациентов с гипертиреозом Грейвса или с автономно функционирующими узлами щитовидной железы.
Зачем так беспокоиться о раке щитовидной железы, если большинство людей выживают?
В целом, 90% пациентов выживают после рака щитовидной железы. Постчернобыльские раковые заболевания носили агрессивный характер и редко поражали детей в возрасте до 10 лет.Люди, пережившие рак щитовидной железы, всегда подвергаются риску рецидива и нуждаются в пожизненной медицинской помощи. Точно так же люди, которые подверглись воздействию радиоактивного йода в результате Чернобыльской аварии, но не заболели раком щитовидной железы, остаются в группе риска для жизни и должны продолжать проходить тестирование. Требования регулярного тестирования и ухода за этой большой группой населения ложатся тяжелым бременем как на пациентов, так и на системы здравоохранения.
Как следует включить KI в общий план действий в чрезвычайных ситуациях?
KI является дополнением к эвакуации, укрытию (пребыванию в непроветриваемом помещении с закрытыми дверями и окнами) и избеганию зараженной пищи, молока и воды.KI не должен заменять любую другую защитную меру.
Разве таблетки KI не внушают людям ложное чувство безопасности?
Вряд ли. Местные власти рекомендуют людям как можно быстрее покинуть зону ядерной аварии. Людей учат, что КИ — всего лишь дополнение к эвакуации.
Зачем тратить время на прием таблеток, если вам велят эвакуироваться?
Поскольку ядерные выбросы непредсказуемы, но заторы на дорогах могут задержать быструю эвакуацию, люди должны забрать свои KI перед эвакуацией, следуя инструкциям местных органов здравоохранения.
Зачем предлагать KI людям в пределах 10-20 миль от завода? Неужели дальше радиация не может быть вредной?
Распределение KI не должно ограничиваться 10 или 20 милями. Никто не может предсказать, как далеко может распространиться облако радиоактивного йода. После Чернобыля, более чем в 200 милях от атомной станции был обнаружен более высокий, чем ожидалось, уровень заболеваемости раком щитовидной железы. Таким образом, никто не может предсказать, как далеко от атомной станции США должны распространять KI, если это необходимо для защиты каждого человека, который может подвергнуться воздействию радиоактивного йода.Поскольку нет правильного ответа, Американская тироидная ассоциация рекомендует три уровня охвата, определяемые расстоянием от атомной станции:
| Кольцо | Расстояние от АЭС | Действие |
| 1 | 0-50 миль | Распределить KI заранее («предварительно распределить») среди отдельных домохозяйств, с дополнительными запасами, хранящимися в центрах приема экстренной помощи |
| 2 | 50-200 миль | Запас KI в местных общественных учреждениях, таких как школы, больницы, клиники, почтовые отделения, полицейские и пожарные депо, для распределения после уведомления местными органами здравоохранения |
| 3 | > 200 миль | Сделать KI доступным на национальном фармацевтическом складе Министерства здравоохранения и социальных служб |
Что делают U.С. госорганы рекомендуют?
KI одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для защиты от радиации. Министерство здравоохранения и социальных служб включило KI в Национальный фармацевтический запас для использования в чрезвычайных ситуациях в области здравоохранения. В декабре 2001 года Комиссия по ядерному регулированию направила письмо 34 штатам, которые либо имеют действующую атомную электростанцию, либо находятся в пределах 10 миль от станции другого государства; в письме предлагались две бесплатные таблетки KI для каждого жителя в пределах 10-мильной «аварийной зоны», окружающей действующие предприятия, а также дополнительный запас для временного персонала.С 13 сентября 2002 года Алабама, Аризона, Калифорния, Коннектикут, Делавэр, Флорида, Мэриленд, Массачусетс, Нью-Гэмпшир, Нью-Джерси, Нью-Йорк, Северная Каролина, Огайо, Пенсильвания, Вермонт и Вирджиния приняли предложение NRC. . Вместо того, чтобы принять предложение NRC, Иллинойс решил распространять таблетки KI, предоставленные оператором большинства атомных станций штата. В Теннесси с 1981 года действует собственная программа KI. Мэн прекратил реализацию своей государственной программы.
Закон 2002 года о безопасности общественного здравоохранения и готовности к биотерроризму и ответных мерах, принятый Конгрессом в мае 2002 года, создает механизм для расширения радиуса распространения KI на общины в пределах 20 миль от атомных станций и поручает президенту решить, какое агентство или агентства будет контролировать накопление и распространение KI.Распространение по новому закону может начаться уже в июне 2003 года.
Разве распространение и общественное образование не будут дорогими и требуют много времени?
Возможно, хотя потенциальная выгода от KI намного превышает стоимость. Закон о биотерроризме предписывает Национальной академии наук изучить «наиболее эффективный и безопасный способ массового распространения и применения таблеток йодида калия». Комиссия Национальной академии наук должна рассмотреть многие решения, которые еще предстоит принять, например: Кто должен нести ответственность за распространение? Как лучше всего распределять таблетки среди семей в пределах 50 миль от атомной электростанции, чтобы они могли хранить их дома до того, как возникнет необходимость? Следует ли хранить таблетки в пределах 50 миль от завода в местных школах, клиниках, почтовых отделениях, полицейских и пожарных частях для распространения во время чрезвычайной ситуации? Как следует относиться к детям в школе? Как следует поддерживать запасы? Также необходимо обеспечить информирование общественности о том, почему KI важен, что он может и не может делать, и как и когда его использовать.Штаты, которые хотят KI, разрабатывают индивидуальные планы распределения и обучения как часть своих общих планов действий в чрезвычайных ситуациях. Проект плана штата Вермонт размещен на его веб-сайте (http://healthvermont.gov). Примечательно, что предложение KI побудило некоторые штаты пересмотреть свои общие планы реагирования на чрезвычайные ситуации.
Чем занимаются другие страны?
Всемирная организация здравоохранения одобряет KI. Франция, Ирландия, Швеция и Швейцария не только накапливают KI, но и распределяют его среди своего населения.
Что рекомендует Американская тироидная ассоциация?
Американская тиреоидная ассоциация (ATA) призывает к созданию запасов КИ с 1984 года. Члены ATA изучают аварию на Чернобыльской АЭС и заботятся о ее жертвах. Рекомендации ассоциации изложены в заявлении об общественном здравоохранении. Американская тироидная ассоциация рекомендует йодид калия для лечения радиационных чрезвычайных ситуаций. Этот план одобрен Американской ассоциацией клинических эндокринологов, Детским эндокринным обществом Лоусона Уилкинса и Американским фондом щитовидной железы.
Йодид калия (KI) Информация на сайте ATA
Американская тироидная ассоциация одобряет применение йодида калия для лечения радиационных чрезвычайных ситуаций
От редакции: «Скажи« да »йодиду калия» Питера Дж. Крейна, перепечатано из Seattle Post-Intelligencer,
, 14 февраля 2002 г.
Интернет-ссылки на важные документы о йодиде калия
Веб-ссылки для государственной информации о йодиде калия
Реакции замещения галогенов — Группа 7 — галогены — GCSE Chemistry (Single Science) Revision — Other
Реакционная способность галогенов — элементов группы 7 — уменьшается по мере продвижения вниз по группе.Это можно показать, посмотрев на реакции смещения .
Пример
Когда хлор (в виде газа или растворенный в воде) добавляют к раствору бромида натрия, хлор заменяет бром. Поскольку хлор более активен, чем бром, он вытесняет бром из бромида натрия.
Раствор становится коричневым. Этот коричневый цвет представляет собой вытесненный бром. Хлор превратился в хлорид натрия.
В этом уравнении Cl и Br поменялись местами:
хлор + бромид натрия → хлорид натрия + бром
Cl 2 (водн.) + 2NaBr (водн.) → 2NaCl (водн.) + Br 2 ( водн.)
Этот тип реакции происходит со всеми галогенами.Более реактивный галоген вытесняет менее реактивный галоген из раствора одной из его солей.
Ряд реактивности
Если вы протестируете различные комбинации галогенов и их солей, вы можете разработать ряд реактивностей для Группы 7:
- самый реактивный галоген вытесняет все других галогенов из их растворов. солей, и сам по себе не замещается ни одним из остальных
- наименее реактивный галоген не замещает ни один из других, и сам замещается всеми остальными
Неважно, используете ли вы соли натрия или соли калия — действует одинаково для обоих типов.
На слайд-шоу показано, что происходит, когда хлор, бром и йод добавляются к различным солям галогенов:
Добавление хлора, брома и йода к солям галогенов
Хлорная вода добавляется к трем растворам
Результат добавления хлора к трем растворам растворов
Бромная вода добавляется к трем растворам
Результат добавления брома к трем растворам
Йодная вода добавляется к трем растворам
Результат добавления йода к трем растворам
Окислительно-восстановительные реакции включают оба окисления (потеря электронов) и уменьшение (усиление электронов).Вы могли запомнить это как: OIL RIG — O xidation I s L oss of электронов, R eduction I s G ain of электронов.
Реакции замещения галогенов — это окислительно-восстановительные реакции , потому что галогены приобретают электроны, а ионы галогенов теряют электроны.
Когда мы рассматриваем одну из реакций замещения, мы можем видеть, какой элемент окисляется на , а какой на восстанавливается .
бром + йодид калия → йод + бромид калия
Br 2 + 2KI → I 2 + 2KBr
В виде ионного уравнения (без учета «наблюдающих» ионов калия):
Br 2 + 2I — → I 2 + 2Br —
Мы видим, что бром получил электроны, поэтому он был восстановлен.Иодид-ионы потеряли электроны, поэтому они окислились.
неорганическая химия — Что происходит, когда йодид калия добавляется к соли меди (II)?
При написании реакции вы должны позаботиться о том, чтобы заряды и атомы были сбалансированы. Итак, самая первая реакция, которую вы постулировали, хороша (в ней сбалансированы заряды и атомы), но затем она идет на юг.
Если вас интересует только окислительно-восстановительный процесс, то имеет смысл думать только о тех реакциях, которые являются частью окислительно-восстановительного процесса. 2 + + 5 KI & -> 2 CuI v + KI3 + 4 K +} \ tag {полный, полуионный} \\ \ ce {2 CuSO4 + 5 KI & -> 2 CuI v + KI3 + 2 K2SO4} \ tag {полный, сбалансированный} \ end {align} $$
Поскольку щелочные галогениды обычно очень похожи друг на друга, я думаю, что реакция должна протекать примерно одинаково, если калий заменить натрием или литием.Лично у меня не было возможности выполнить это, так как в моих студенческих лабораториях по неорганическим веществам были только предварительно смешанные растворы йодида калия.
OA Руководство по очистке воды
OA Руководство по очистке водычасть
Полевое руководство туриста
Рик Кертис
первое издание опубликовано Random House, март 1998 г.
Купи сейчас на Amazon.com
Этот материал взят из главы 4 — Гигиена и очистка воды из Полевое руководство для туристов, , Рик Кертис.Чтобы узнать больше об этой захватывающей книжной проверке из страницы полевого руководства туриста.
Этот материал предоставлен автором в учебных целях. только для использования и не заменяет специальную подготовку или опыт. Университет Принстона и автор не несет ответственности за использование или использование кем-либо каких-либо материалы, содержащиеся или упомянутые в данном документе. Когда выходишь на улицу, это твой ответственность за наличие необходимых знаний, опыта и оборудования для безопасного путешествия. Этот материал не может быть воспроизведен ни в какой форме для коммерческих или Интернет-публикаций. без письменного разрешения автора.Copyright 1999, все права защищены, Издательство Random House и Рик Кертис, Программа действий на открытом воздухе, Принстонский университет.
Очистка воды
Окунуться в холодный горный ручей и долго пить освежающий напиток — опыт, который в основном исчез из дикой природы Америки. С увеличилось использование дикой природы, также увеличилось количество бактериологическое заражение загородных водопроводов. U.S. Экологические Агентство по охране сообщает, что 90 процентов воды в мире загрязнено каким-то образом. Существует множество микроскопических организмов, которые могут загрязнять источники воды. и вызывают потенциально серьезные, даже смертельные, болезни среди путешественников по дикой природе. Главная Опасность этих инфекций в отдаленных районах — потеря жидкости из-за диареи и рвота, которая может привести к гиповолемическому шоку и, возможно, к смерти (см. Диарея или Рвота, стр. 315; Замена жидкого электролита, стр. 286; Шок, стр. 238).
Чтобы пить воду, нужно подготовиться к ее обработке. Есть множество методы очистки воды, описанные ниже в порядке эффективности. Помните, однако эти инфекции также могут передаваться из-за несоблюдения правил личной гигиены, что очистка воды не помешает.
Биологически загрязненная и токсичная вода
Биологически загрязненная вода — это вода, содержащая такие микроорганизмы, как Giardia (распространенный микроорганизм, который, если его не убить, приводит к кишечным расстройствам), бактерии или вирусы, которые могут привести к инфекциям (см. Желудочно-кишечные инфекции, стр. 316). Токсичная вода источники содержат химическое загрязнение от стоков пестицидов, хвостов шахт и т. д. Кипячение, фильтрация или химическая обработка воды могут удалить или убить микроорганизмы, но это , а не , удалит химические токсины. То же самое и при использовании солнечного перезаряжателя. (см. страницу 223).
Кипячение
Кипячение — самый верный способ убить все микроорганизмы. Согласно Медицинское общество дикой природы, температура воды выше 160 F (70 C) убивает все патогены в течение 30 минут и выше 185 F (85 C) в течение нескольких минут.Так что за время чтобы вода достигла точки кипения (212 F или 100 C) от 160 F (70 C), все патогены будут убиты даже на большой высоте. Для большей безопасности дайте воде закипеть быстро в течение одной минуты, особенно на больших высотах, так как вода закипает на более низких температура (см. стр. 68.)
Химическая очистка
Существует два типа химической обработки: с использованием йода и с использованием хлора. На рынке представлено множество продуктов, поэтому следуйте указаниям на бутылке.Быть сообщил, что у многих таблеток есть срок годности, и они становятся неэффективными после этого точка. Кроме того, после того, как бутылка была открыта, таблетки необходимо использовать в течение определенного срока. период. Если сомневаетесь, купите новую бутылку. Помните, что методы химической очистки могут только частично, в зависимости от температуры воды.
Общие процедуры химической обработки
- Эффективность любой химической обработки воды зависит от температуры, pH. уровень и чистота воды.Мутная вода часто требует более высоких концентраций химическая дезинфекция.
- Если вода мутная или наполнена крупными частицами, процедите ее тканью, перед лечение. При проглатывании крупные частицы можно очистить только «снаружи».
- Добавьте химическое вещество в воду и размахните им, чтобы способствовать растворению. Брызги некоторые из воду с химикатом на крышку и резьбу бутылки с водой, чтобы все обработаны акватории.
- Вода должна оставаться на не менее через 30 минут после добавления химиката, чтобы очищение должно произойти. При использовании таблеток дайте воде постоять 30 минут после таблетка растворилась.
- Чем холоднее вода, тем менее эффективно очищающее средство. Исследование показал, что при 50 F (10 C) только 90 процентов цист Giardia были инактивируется после 30 минут воздействия. Если температура воды ниже 40 F (4 C), удвойте время обработки перед употреблением.Лучше всего, если температура воды не менее 60 F (16 C) перед лечением. Вы можете поставить воду на солнце, чтобы нагреть ее перед обработкой.
- Химически очищенную воду можно улучшить по вкусу, проливая ее взад и вперед. между контейнерами после соответствующей обработки. Другие методы включают добавление щепотка соли на литр или добавление ароматизаторов (например, смеси лимонада и т. д.) после химиката период лечения.
Лечение йодом
Йод чувствителен к свету и должен всегда храниться в темной бутылке.Лучше всего работает, если температура воды выше 68 F (21 C). Было показано, что йод более эффективен, чем хлорсодержащие препараты для инактивации цист Giardia . Имейте в виду, что некоторые люди страдают аллергией на йод и не могут использовать его для очистки воды. человек при проблемах с щитовидной железой или на литуме женщинам старше пятидесяти и беременным женщинам следует проконсультироваться их врач перед использованием йода для очистки. Кроме того, некоторые люди, страдающие аллергией к моллюскам также аллергия на йод.Если кто-то не может использовать йод, используйте либо продукт на основе хлора или не содержащий йода фильтр, такой как PUR Hiker Microfilter, MSR WaterWorks или фильтр для воды Katadyn.
Обычно процедура следующая:
- Жидкая 2% настойка йода Добавить 5 капель на кварту, когда вода станет прозрачной. Если вода мутная, добавьте 10 капель на литр.
- Кристаллы полярного чистого йода заполняют чистое полярное сияние бутылку с водой и встряхнуть. Раствор будет готов к употреблению через час.Добавить количество крышек (на литр обработанной воды), указанное на бутылке, в зависимости от температура раствора йода. Ловушка для частиц предотвращает попадание кристаллов внутрь очищаемую воду. Важно отметить, что вы используете раствор йода . для обработки воды, а не кристаллов йода. Концентрация йода в кристалле ядовит и может вызвать ожог тканей или глаз. Дайте обработанной воде постоять 30 минут. перед употреблением.Для уничтожения цисты Giardia питьевая вода должна быть не менее 68 F (20 C). Воду можно согреть на солнце перед обработкой или можно нагреть горячую воду. быть добавленным. После использования наполните лечебный флакон, чтобы раствор был готов. час спустя. Кристаллов в бутылке достаточно, чтобы обработать около 2000 литров. Выбросьте пустую бутылку.
- Питьевая вода Это таблетированный продукт с йодом. Следуйте инструкциям производителя по применению.
Обработка хлором
Хлор можно использовать для людей с аллергией на йод или с ограничениями.Помни это температура воды, уровень отложений и время контакта — все это элементы убийства микроорганизмы в воде. Галазон является примером таблетированного продукта, содержащего хлор. Использовать, следуйте инструкциям производителя.
Уловки следа |
|
Фильтрация
На рынке имеется ряд устройств, фильтрующих микроорганизмы.Вода Фильтр прокачивает воду через микроскопический фильтр, рассчитанный на организм определенного размера. Стандартный размер — микрон (точка в конце этого предложения примерно 600 мкм). В зависимости от микронного рейтинга фильтра, более мелкие организмы (например, вирусы). Будьте осторожны при выборе фильтра. Ты должен знать что потенциальных организмов, от которых необходимо лечить. Вы не хотите идти в район, где вирус, подобный гепатиту А, присутствует в воде (проблема в некоторых развивающихся странах) с фильтром, который справится только с более крупными организмами, такими как Giardia.
Общие микроорганизмы и необходимый размер фильтра:
| Организм | Примеры | Общий размер | Тип фильтра | Размер частиц |
| Простейшие | Giardia, Cryptosporidium | 5 микрон или больше | Фильтр для воды | 1,0–4,0 мкм |
| Бактерии | Холера, E.coli, сальмонелла | 0,2–0,5 мкм | Микрофильтр | 0,2–1,0 мкм |
| Вирусы | Гепатит А, ротавирус, вирус Норуолк | 0,004 мкм | Очиститель воды | до 0,004 мкм |
Существует два основных типа фильтров (описания некоторых популярных моделей начинаются на лицевую страницу).
- Мембранные фильтры используют тонкие листы с точно размер пор, которые препятствуют прохождению предметов, размер которых превышает размер поры.Плюсы: относительно легко чистить. Против: засоряются быстрее, чем глубинные фильтры. Пример: PUR-Hiker. Глубинные фильтры
- используют толстые пористые материалы, такие как углерод или керамика для улавливания частиц при прохождении воды через материал. Плюсы: Частично очищается обратной промывкой. Активирован угольные фильтры также удаляют ряд органических химикатов и тяжелых металлов. Минус: грубая обработка может привести к потере фильтра и его потере бесполезный. Примеры: MSR WaterWorks II, Katadyn.
Примечание: Существует разница между фильтром для воды и очистителем для воды . Фильтры не отфильтровывают вирусы, но есть очистители воды, такие как PUR Scout, которые пропустите воду через фильтр и соединение йода, которое убивает все мелкие организмы, прошедшие через фильтр. Эти очистители убивают все микроорганизмы до 0,004 мкм; однако фильтр не должен использоваться люди, страдающие аллергией на йод.
Общие методы использования фильтра для воды
- Отфильтруйте самую чистую воду, которую только сможете найти. Грязная вода или вода с большой взвесью частицы быстрее забивают ваш фильтр.
- Предварительно отфильтруйте воду либо через фильтр предварительной очистки на насосе, либо процедите ее через бандана.
- Если вам необходимо отфильтровать грязную воду, дайте ей постоять на ночь, чтобы частицы осели.
Уловки следа |
| Некоторые фильтры для воды поставляются в виде герметичных картриджей, что делает их невозможно осмотреть сам фильтрующий патрон. Если фильтр сильно упадет, он может треснуть внутри. Если фильтр внутри треснет, нефильтрованная вода может протечь через трескаться.Обращайтесь с фильтром осторожно, и если он сильно ударит, выбросьте его. Помните, что всасывающий шланг от водяного фильтра был погружен в нефильтрованную воду. Считайте этот шланг «загрязненным» и храните его в отдельном пластиковом пакете. |
Материал предоставлен автором в учебных целях. только для использования и не заменяет специальную подготовку или опыт. Университет Принстона и автор не несет ответственности за использование или использование кем-либо каких-либо материалы, содержащиеся или упомянутые в данном документе.Когда выходишь на улицу, это твой ответственность за наличие необходимых знаний, опыта и оборудования для безопасного путешествия. Этот материал не может быть воспроизведен ни в какой форме для коммерческих или Интернет-публикаций. без письменного разрешения автора. Copyright 1999, все права защищены, Издательство Random House и Рик Кертис, Программа действий на открытом воздухе, Принстонский университет.
Проверка на содержание хлора в питьевой воде
Сегодня вода становится еще более ценным товаром, чем когда-либо прежде, поэтому чрезвычайно важно, чтобы ваши клиенты пили воду высочайшего качества.Использование хлора — это один из способов защиты воды от бактерий и вредных организмов в водоочистных сооружениях, но слишком много хлора в водопроводной воде также может быть опасным, если его не уменьшить до того, как он выйдет из крана ваших клиентов.
Знайте свои остатки
Ответственные дилеры по очистке воды предпринимают несколько шагов перед обработкой воды значительным количеством хлора. Во-первых, дилеры должны знать об остатках хлора. «Есть разные виды остаточного хлора», — говорит Иварс Яунакайс, химик-аналитик, лектор и преподаватель, а также президент Industrial Test Systems.«У вас может быть свободный хлор, а также могут быть хлорамины».
Свободный хлор — это остаток, состоящий из растворенного газообразного хлора, хлорноватистой кислоты и ионов гипохлорита; хлорамины представляют собой комбинацию хлора и аммиака.
«Различные формы возникают, поскольку многие муниципальные очистные сооружения будут хлорировать, но из-за правил EPA для тригалометанов (THM) они нейтрализуют хлор, добавляя аммиак для образования хлораминов», — объясняет Яунакайс.
Питание ПО и тестирование
Хотя хлор и хлорамины являются отличными инструментами для дезинфекции воды, в конечном итоге их необходимо отфильтровать, и здесь есть возможность для дилера по очистке воды.Зная об использовании муниципалитетом химических веществ, в том числе хлора, дилеры могут предоставить эффективное решение и выиграть сделку с учетом осведомленности общественности.
«[Клиентам] нужен хлор, потому что, когда вода поступает с завода в [их] дома, вы хотите, чтобы вода оставалась нетронутой», — говорит Яунакайс. «Вот почему POU — прекрасное устройство, которое очищает воду от химикатов, добавленных на муниципальных очистных сооружениях».
Кроме того, есть два способа проверки на хлор: тест-полоски и тест-наборы.Некоторые тесты будут искать как свободный хлор, так и общий хлор.
«Если вы хотите узнать, есть ли у вас хлор или соединение хлорамина, существуют довольно простые тесты, позволяющие отличить одно от другого и количественно определить, сколько свободного хлора и хлораминов содержится в вашей воде», — говорит Яунакайс. «Как правило, вы можете использовать систему DPD, где DPD мгновенно реагирует с соединениями свободного хлора с образованием красного цвета. Затем, когда вы добавляете йодид калия в DPD, он вступает в реакцию как с хлорамином, так и с хлором.Разница между реакцией свободного хлора и реакцией общего хлора дает вам реакцию хлорамина ».
Контрольная точка хлорирования
Хлорирование по точке останова — это процесс, в котором хлор добавляется до тех пор, пока все соединения, требующиеся в хлоре, не будут удалены. То, что у вас осталось, называется остаточным свободным хлором. Очистные сооружения используют этот процесс в течение многих лет для устранения соединений, требующихся хлора, на полировочной и полномасштабной основе.
Во время этого процесса вода вступает в реакцию с содержащимися в ней восстанавливающими соединениями, которые впитывают хлор.Затем хлор вступает в реакцию с аммиаком и органическими соединениями, содержащимися в неочищенной воде. Затем вода достигает точки останова, когда потребность в хлоре полностью удовлетворяется.
«После определения контрольной точки хлорирования очистная установка добавит хлор в большой резервуар с водой и дозирует его на определенном уровне в частях на миллион в зависимости от того, что они обнаружили», — говорит Яунакайс. «Который нейтрализует все загрязнения в воде».
Воздействие хлора на здоровье
По словам Яунакайса, водоочистные сооружения отлично справляются с задачей обеспечить всем американским гражданам здоровую и чистую воду, но ваши клиенты должны помнить о трех факторах, связанных с водой: фторид, металлы, коррозирующие из-за водопровода, и другие добавки. хлор.
«Мудрый, ты не хочешь пить эту чушь, когда она попадает к тебе в кран. Вы хотите отфильтровать это », — говорит Яунакайс. «Хотя хлорамины вредны, [их] не так много, когда вы их пьете, но каждый должен знать о проблемах, связанных с вдыханием. Когда вы вдыхаете хлорамины, они проходят через легкие и быстро повышают содержание хлораминов в крови ».
Хлор используется в качестве дезинфицирующего средства для питьевой воды и в плавательных бассейнах, чтобы помочь устранить бактерии и запахи.В воде хлор реагирует с образованием хлорноватистой кислоты и гипохлоритов и потенциально может нанести вред при потреблении.
Основным последствием употребления слишком большого количества хлорированной воды для здоровья является рак мочевого пузыря.
«Если вы пьете хлорированную воду в течение 20 или более лет, это может увеличить ваши шансы на рак мочевого пузыря», — объясняет Яунакайс. «Возможность рака мочевого пузыря у людей, которые пьют нехлорированную воду из колодцев, по сравнению с городскими жителями, которые пьют хлорированную воду, была очень тщательно задокументирована [на протяжении многих лет].Существуют реальные и четкие статистические данные, которые показывают, что хлорированная вода увеличивает вероятность рака мочевого пузыря ».
Питье хлорированной воды в течение длительного периода времени также может вызвать у человека астматическое состояние.
Тригалометаны — один из наиболее опасных побочных продуктов хлора, которые, как было доказано, оказывают негативное воздействие при контакте с людьми. Вдыхание ТГМ может повлиять на центральную нервную систему организма и вызвать нарушения в работе печени и почек.
Для защиты ваших клиентов жизненно важно, чтобы вы удостоверились, что вода проверена правильно и что в их воде нет краткосрочных или долгосрочных рисков, прежде чем предлагать очистку или предварительную обработку.
«Наше общество озабочено тем, чтобы жить вечно, и вы не будете жить вечно, если потребляете токсичные химические вещества», — говорит Яунакайс. «Вот на чем основаны POU [устройства] и вся водная промышленность… как сделать нашу питьевую воду более безопасной».

Leave A Comment