Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии / Справочник :: Бингоскул
Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химиидобавить в закладки удалить из закладок
Содержание:
Органическая химия вызывает страх при виде формул из этого раздела, но давайте перестанем бояться и углубимся в изучение взаимодействия веществ.
Что же из себя представляют механизмы реакций?
Это детальное разъяснение процесса перехода субстрата в продукт. В органике выделяются два типа механизмов химических реакций, ионный и радикальный.
Ионный механизм
Происходит разрыв связи, во время которого, общая пара электронов остается у одного атома, что приводит к возникновению заряженных частиц — ионов (катионов и анионов). Будучи гетероциклическим, этот разрыв возможен при ковалентной связи.
В ходе получаются:
- Нуклеофил – обладающая парой электронов на своем внешнем энергетическом уровне частица, которая образует новые ковалентные связи.
 Примерами могут послужить: SCN—,Br—, CN—,Cl—,I—, OH— и другие анионы и соединения с неподеленной электронной парой.
Примерами могут послужить: SCN—,Br—, CN—,Cl—,I—, OH— и другие анионы и соединения с неподеленной электронной парой. - Электрофил – обладающая незаполненной на внешнем энергетическом уровне электронную орбиталь частица, являющаяся электронным акцептором. Например: H3O+, CH3CO+, AlCl3,BF3, катионы, карбокатионы, электронодефицитные нейтральные молекулы, а так же молекулы с сильнополяризованной связью.
Типичными представителями ионных реакций отмечают взаимодействия электролитов в растворах, которые знакомы нам с первых шагов познания неорганической химии, реакции присоединения к непредельным углеводородам, дегидрирование спиртов и замещение гидроксильной группы в спиртах.
Правило Владимира Васильевича Марковникова
Формулировка гласит следующим образом: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам, атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена:
Проще говоря, атом водорода присоединяется к тому атому углерода, у которого наименьшее количество связей с водородом, рассмотрим это заключение на примере гидрогалогенирования пропена:
Но также существуют и исключения из этого правила, когда заместитель при двойной связи оттягивает электронную плотность на себя,
или при присоединении в присутствии пероксидов
Радикальный механизм
Происходит деление общей пары электронов между атомами, приводя к образованию нейтрально заряженных частиц (радикалов), которые имеют неспаренные электроны. Будучи гомолитическим, такой разрыв возможен при малополярной ковалентной связи.
Реакции, проходящие по этому механизму, происходят в газовой фазе с огромной скоростью, зачастую сопровождаясь взрывом. Сами радикальные взаимодействия возникают между образовавшимися в ходе взаимодействия нейтрально заряженными частицами и молекулами.
Весьма немалое количество органических реакций протекают по радикальному механизму, например: галогенирование алканов, полимеризация этилена и синтез аммиака.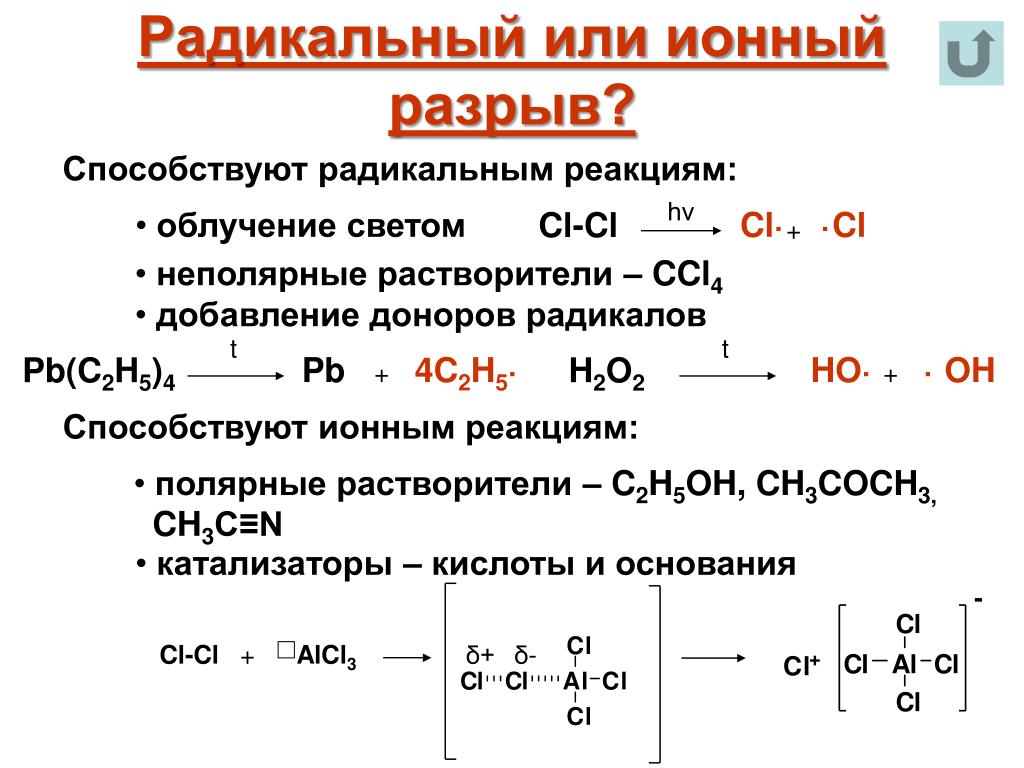
Смотри также:
- Классификация химических реакций в неорганической и органической химии
- Тепловой эффект химической реакции. Термохимические уравнения
- Скорость химической реакции, ее зависимость от различных факторов
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Реакции ионного обмена
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
Поделитесь в социальных сетях:
18 сентября 2020, 14:56
Could not load xLike class!
Механизмы химических реакций | Дистанционные уроки
29-Янв-2014 | Нет комментариев | Лолита Окольнова
Ионный механизм химической реакции
Судя по названию, ионный механизм реакции — это механизм, приводящий к образованию ионов. Соответственно, образуются органические катионы и анионы — карбокатионы или карбоанионы.
Соответственно, образуются органические катионы и анионы — карбокатионы или карбоанионы.
Такие ионы образуются при разрыве полярных ковалентных связей в органическом веществе.
Гетеролитический разрыв связей:
Дальше:
- карбокатионы будут взаимодействовать с нуклеофильными частицами,
- анионы – с электрофильными частицами (катионы металлов, галогены и др.)
- карбоанионы ( у них «избыток» электронов) будут взаимодействовать с электрофильными частицами.
Пример ионного механизма химической органической реакции:
СH3-Cl + NaOH → CH3OH + NaCl
Нуклеофильные частицы:
- азотсодержащие: NH3, NH2-, NH2R, NR2;
- кислородсодержащие: H2O, R-OH, R-O-R, RCOO-, OH-;
- кратные связи С-С: двойные и тройные связи;
- частицы галогенов, например, Cl—
Электрофильные частицы:
- кислородсодержащие: альдегиды и кетоны, карбоновые кислоты, сложные эфиры;
- галогеналканы;
- H+, различные катионы.

Электрофильные и нуклеофильные реакции
Нуклеофильные реакции — органическое вещество реагирует с нуклеофильным реагентом.
Нуклеофильное замещение SN — substitution nucleophile | Нуклеофильное присоединение AdN — addition nucleophile |
СH3Cl + NaOH ->СH3OH + NaCl Нуклеофил — OH— У аренов: нуклеофильное замещение протекает в тяжелых условиях ( t,p), но если в бензольном кольце будут электроноакцепторные заместители, то реакции пойдут намного легче, электронодонорные — наоборот — затрудняют реакцию | H2C=O + HCN -> H2C(CN)(OH) реакция Кучерова: HС≡CH + h3O -> ( Hg2+)-> СH3CHO |
Электрофильные реакции — органическое вещество реагирует с электрофильным реагентом
Электрофильное замещение SEAr — substitution electrophilic reaction | Электрофильное присоединение AdE — addition electrophilic reaction |
| У аренов: C6H6 + HNO3 -> C6H5NO2 + H2O ( образуется промежуточная частица NO2+) C6H6 + Cl2 ->C6H5Cl + HCl C6H6 + CH3Cl -> C6H5CH3 + HCl |
бромирование кратной связи гидрогалогенирование кратной связи гидратация двойной связи присоединение аминов или Nh4 |
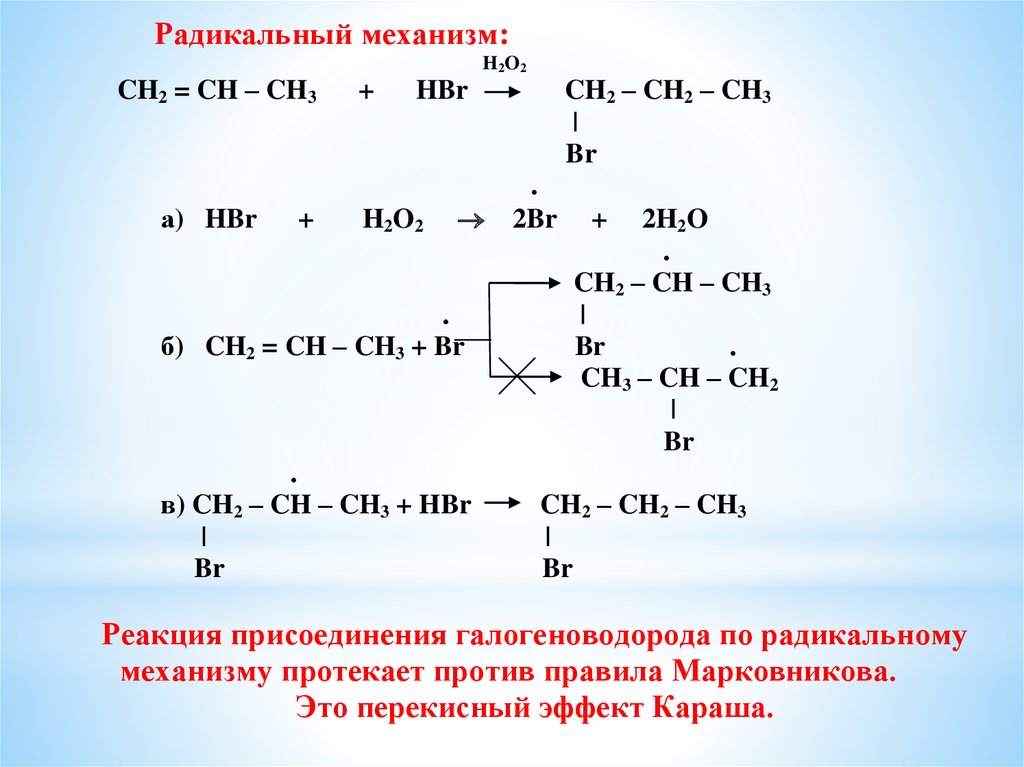
Присоединение по правилу Марковникова — типичный пример ионного типа механизма химической реакции:
CH2=CH-CH3 + HCl → CH3-CHCl-CH3
водород присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
В основном, это реакции присоединения к кратным связям или обменные реакции.
Присоединение против правила Марковникова:
- заместитель при двойной связи оттягивает электронную плотность на себя
- если реакция присоединения идет не по электрофильному, а по радикальному механизму,
Ионные реакции проводят:
- при невысокой температуре;
- в полярных растворителях (в воде, например)
Радикальный механизм химической реакции
— механизм, приводящий к образованию радикалов.
Соответственно, образуются органические частицы — радикалы — имеющие неспаренный электрон.
Такие частицы образуются при разрыве неполярных \ слабо полярных

Гомолитический разрыв связей:
Образовавшиеся радикалы могут взаимодействовать друг с другом.
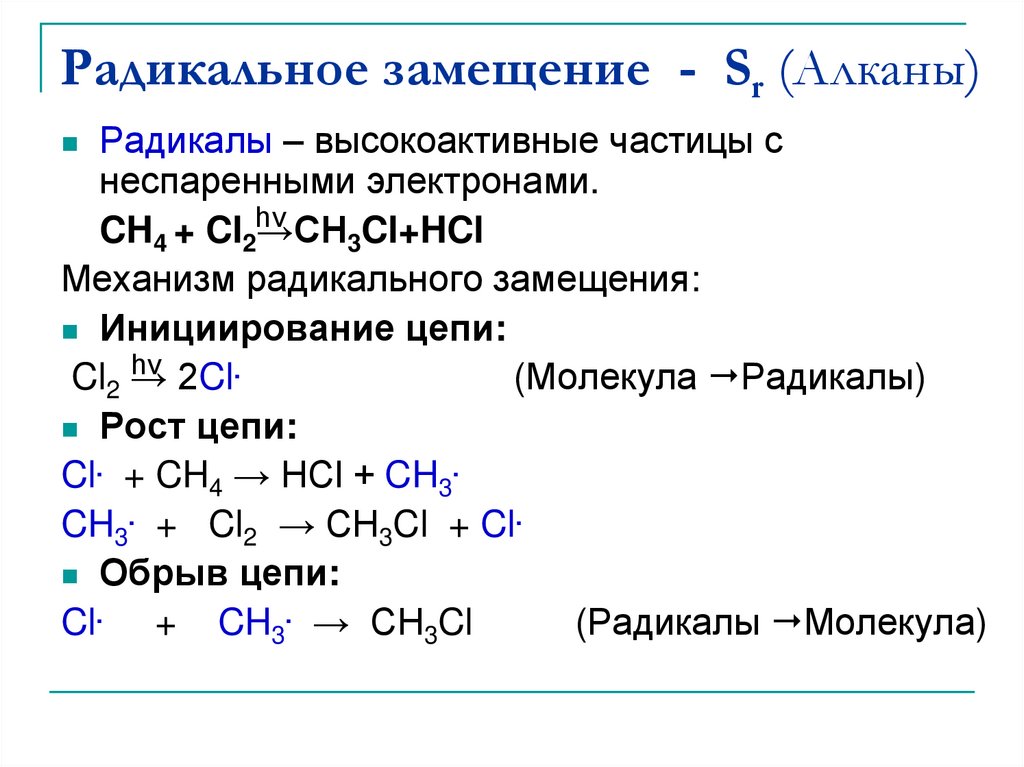
Классическая реакция, идущая по радикальному механизму — хлорирование метана (обязательно на свету):
CH4 + Cl2 → CH3Cl + HCl:
Cl2 → Cl• + •Cl
Cl• + CH4 → CH3• + HCl
CH3• + Cl• → CH3Cl
Радикальные реакции проводят:
- при высокой температуре,
- под действием света или радиоактивном облучении.
- примеры ЕГЭ — вопросов по механизмам органических реакций
- Подписка на рассылку
(Правила комментирования)
6.3: Радикальные реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31438
Цели
После завершения этого раздела вы сможете
- приведите пример реакции радикального замещения.

- идентифицируют три стадии (инициирование, распространение и прекращение), которые происходят в типичной реакции радикального замещения.
- запишите этапы простой реакции радикального замещения, такой как хлорирование метана.
- объясняют, почему галогенирование алкана не является особенно полезным методом получения определенных алкилгалогенидов.
Основные термины
Убедитесь, что вы можете определить и использовать в контексте приведенные ниже ключевые термины.
- цепная реакция
- начальный шаг
- шаг распространения
- радикальная замена
- шаг завершения
Примечания к исследованию
Реакция радикального замещения представляет собой реакцию, протекающую по свободнорадикальному механизму и приводящую к замещению одного или нескольких атомов или групп, присутствующих в субстрате, другими атомами или группами.
Стадия инициирования в радикальной цепной реакции — это стадия, на которой сначала образуется свободный радикал. Стадия обрыва радикальной цепной реакции представляет собой стадию, в которой два радикала каким-то образом взаимодействуют друг с другом, так что цепь больше не может распространяться.
Стадия обрыва радикальной цепной реакции представляет собой стадию, в которой два радикала каким-то образом взаимодействуют друг с другом, так что цепь больше не может распространяться.
В то время как радикальное галогенирование очень простых алканов может быть эффективной стратегией синтеза, его нельзя использовать для более крупных и сложных алканов для получения определенных алкилгалогенидов, поскольку реакционная природа радикалов всегда приводит к смесям одно- и многократно галогенированных продуктов.
Три фазы радикальных цепных реакций
Из-за своей высокой реакционной способности свободные радикалы могут быть как чрезвычайно мощными химическими инструментами, так и чрезвычайно вредными загрязнителями. Большая часть силы видов свободных радикалов проистекает из естественной тенденции радикальных процессов происходить в виде цепной реакции. Радикальные цепные реакции имеют три отдельные фазы: инициирование, распространение и прекращение.
Начальная фаза описывает этап, который первоначально создает радикальные виды. В большинстве случаев это гомолитическое расщепление, которое происходит очень редко из-за высоких энергетических барьеров. Часто для преодоления энергетического барьера необходимо воздействие тепла, УФ-излучения или металлсодержащего катализатора.
Молекулярный хлор и бром подвергаются гомолитическому расщеплению с образованием радикалов при воздействии тепла или света. Другими функциональными группами, которые также имеют тенденцию образовывать радикалы при воздействии тепла или света, являются хлорфторуглероды, пероксиды и галогенированный амид N-бромсукцинимид (NBS).
Фаза распространения описывает «цепную» часть цепных реакций. После образования реактивного свободного радикала он может реагировать со стабильными молекулами с образованием новых свободных радикалов. Эти новые свободные радикалы продолжают генерировать еще больше свободных радикалов и так далее. Стадии распространения часто включают отщепление водорода или присоединение радикала к двойным связям.
Стадии распространения часто включают отщепление водорода или присоединение радикала к двойным связям.
Обрыв цепи происходит, когда два вида свободных радикалов реагируют друг с другом с образованием стабильного нерадикального аддукта. Хотя это очень термодинамически нисходящее событие, оно также очень редко из-за низкой концентрации радикалов и малой вероятности столкновения двух радикалов друг с другом. Другими словами, барьер свободной энергии Гиббса для этой реакции очень высок, в основном из-за энтропийных, а не энтальпийных соображений. Активные центры ферментов, конечно, могут эволюционировать, чтобы преодолеть этот энтропийный барьер, располагая два радикальных интермедиата рядом друг с другом.
Упражнения
6.3: Radical Reactions распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем, Тим Содерберг и Тим Содерберг.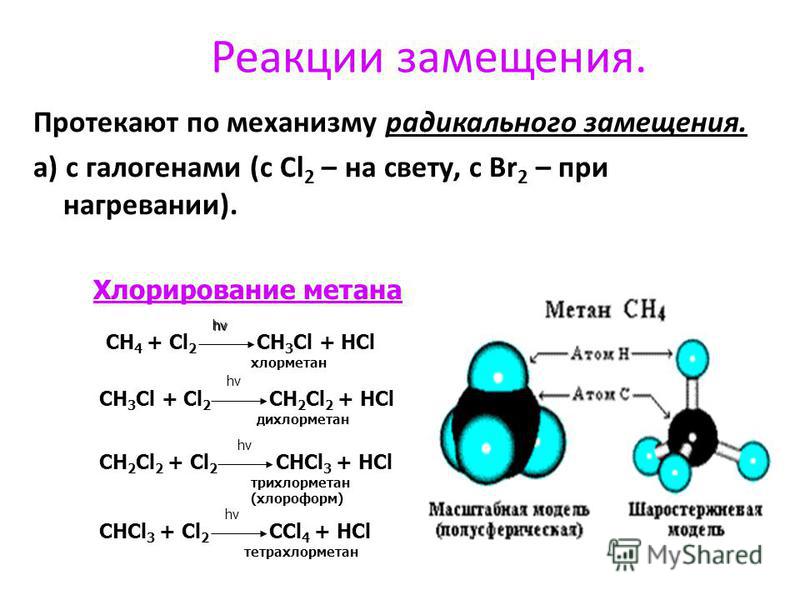
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- автор@Дитмар Кеннеполь
- автор@Криста Каннингем
- автор@Стивен Фармер
- автор @ Тим Содерберг
- цепная реакция
- начальный этап
- шаг распространения
- радикальная замена
- шаг завершения
5.
 5. Свободнорадикальная цепная реакция — Химия LibreTexts
5. Свободнорадикальная цепная реакция — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15883
Решения к упражнениям
17.2A: Три фазы радикальных цепных реакций
Из-за своей высокой реакционной способности свободные радикалы могут быть как чрезвычайно мощными химическими инструментами, так и чрезвычайно вредными загрязнителями. Большая часть силы видов свободных радикалов проистекает из естественной тенденции радикальных процессов происходить в виде цепной реакции. Радикальные цепные реакции имеют три отдельные фазы: инициирование, распространение и прекращение.
Фаза инициации описывает этап, который первоначально создает радикальные виды. В большинстве случаев это гомолитическое расщепление, которое происходит очень редко из-за высоких энергетических барьеров. Часто для преодоления энергетического барьера необходимо воздействие тепла, УФ-излучения или металлсодержащего катализатора.
В большинстве случаев это гомолитическое расщепление, которое происходит очень редко из-за высоких энергетических барьеров. Часто для преодоления энергетического барьера необходимо воздействие тепла, УФ-излучения или металлсодержащего катализатора.
Молекулярный хлор и бром подвергаются гомолитическому расщеплению с образованием радикалов при воздействии тепла или света. Другими функциональными группами, которые также имеют тенденцию образовывать радикалы при воздействии тепла или света, являются хлорфторуглероды, пероксиды и галогенированный амид N-бромсукцинимид (NBS).
Фаза распространения описывает «цепную» часть цепных реакций. После образования реактивного свободного радикала он может реагировать со стабильными молекулами с образованием новых свободных радикалов. Эти новые свободные радикалы продолжают генерировать еще больше свободных радикалов и так далее. Стадии распространения часто включают отщепление водорода или присоединение радикала к двойным связям.
Обрыв цепи происходит, когда два вида свободных радикалов реагируют друг с другом с образованием стабильного нерадикального аддукта. Хотя это очень термодинамически нисходящее событие, оно также очень редко из-за низкой концентрации радикалов и малой вероятности столкновения двух радикалов друг с другом. Другими словами, барьер свободной энергии Гиббса для этой реакции очень высок, в основном из-за энтропийных, а не энтальпийных соображений. Активные центры ферментов, конечно, могут эволюционировать, чтобы преодолеть этот энтропийный барьер, располагая два радикальных интермедиата рядом друг с другом.
17.2B: Радикальное галогенирование в лаборатории
Хлорирование алкана представляет собой простой пример свободнорадикальной цепной реакции. На этапе инициации молекула хлора подвергается гомолитическому расщеплению после поглощения энергии света:
Радикал хлора затем отщепляет водород, приводя к алкильному радикалу (этап 2), который реагирует со второй молекулой хлора (этап 3) с образованием продукта хлоралкана плюс радикал хлора, который затем возвращается к повторению шага 2.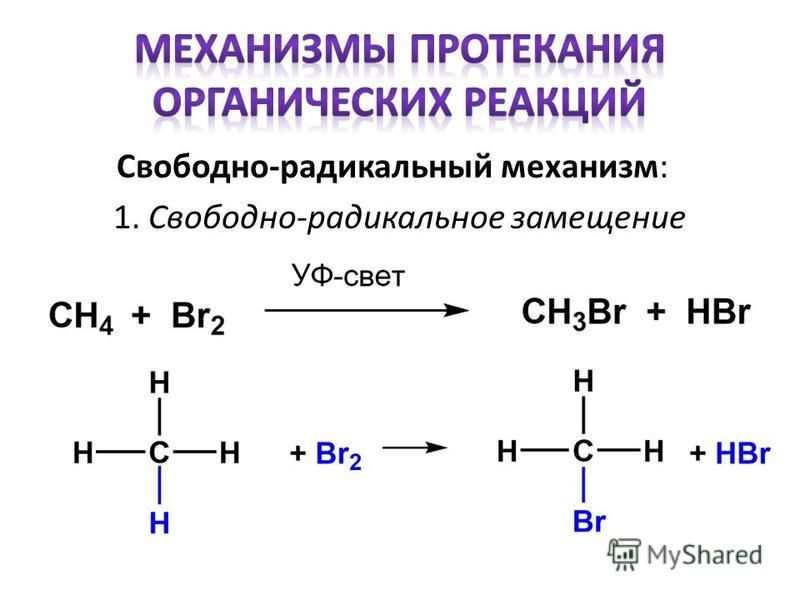
Вероятными стадиями обрыва цепи являются конденсация двух промежуточных алкильных радикалов или конденсация алканового радикала с радикалом хлора.
Реакции галогенирования алканов проявляют определенную степень региоспецифичности: например, если 2-метилбутан подвергается воздействию ограниченного количества хлора, хлорирование происходит быстрее всего на третичном углероде.
Это связано с тем, что третичное радикальное промежуточное соединение более стабильно, чем вторичное радикальное промежуточное соединение, возникающее в результате отрыва протона от углерода №3, и, конечно, оба они более стабильны, чем первичные радикальные промежуточные соединения. Напомним, что постулат Хаммонда (раздел 6.2, раздел 15.2B) говорит нам, что промежуточное соединение с более низкой энергией подразумевает переходное состояние с более низкой энергией и, следовательно, более быструю реакцию.
К сожалению, хлоралканы легко подвергаются дальнейшему хлорированию, что приводит к полихлорированным продуктам, так что эта реакция, как правило, не очень полезна с синтетической точки зрения.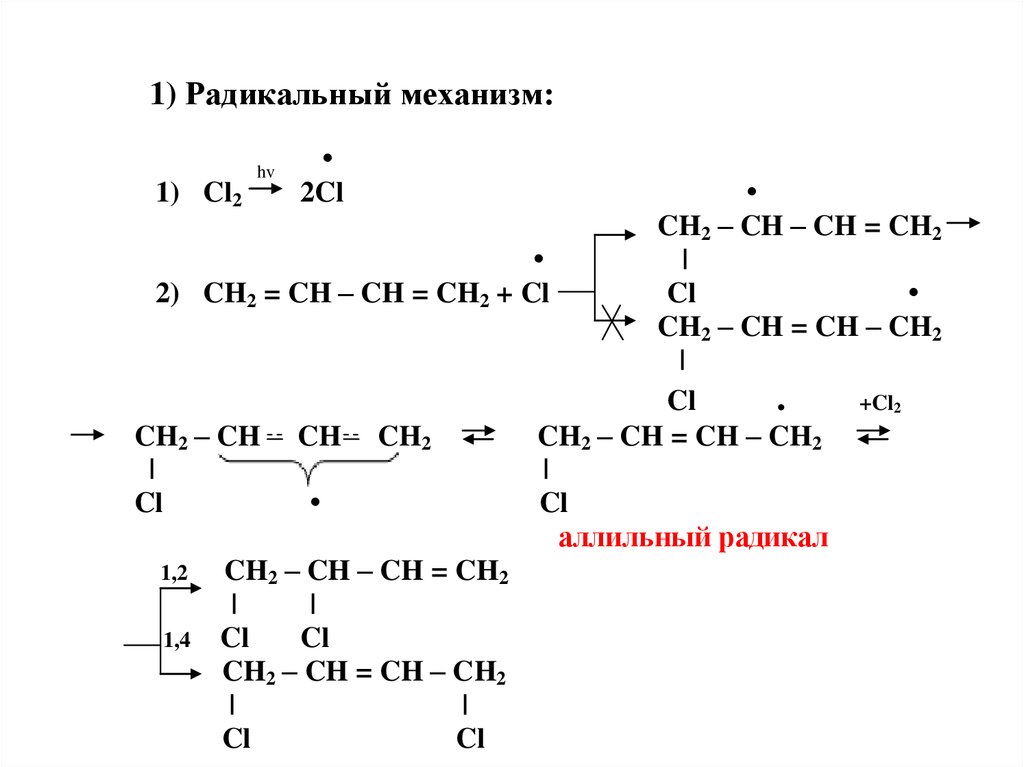
Алканы можно бромировать аналогичной реакцией. Региохимические тренды такие же, как и для хлорирования, но значительно более выраженные (другими словами, бромирование более региоселективно). Это связано с тем, что отщепление водорода радикалом брома гораздо менее экзэргонично, чем радикалом хлора, а это, в свою очередь, означает, что переходное состояние для отщепления бромом больше похоже на полученное промежуточное соединение, чем переходное состояние для отщепления хлором напоминает его промежуточное соединение.
Другой способ сказать то же самое состоит в том, что переходное состояние бромирования имеет более «радикальный характер», чем переходное состояние хлорирования. Таким образом, тенденции радикальной стабильности оказывают большее влияние на скорость выделения водорода.
Алкены и алкилбензол можно галогенировать с высокой региоспецифичностью с использованием N-бромсукцинимида (NBS) в присутствии света или радикального инициатора, такого как перекись бензоила. Бромирование происходит конкретно в аллильном положении алкенов и в бензильном положении алкилбензола (напомним из раздела 17.1А, что аллильные и бензильные радикалы стабилизируются резонансом).
Бромирование происходит конкретно в аллильном положении алкенов и в бензильном положении алкилбензола (напомним из раздела 17.1А, что аллильные и бензильные радикалы стабилизируются резонансом).
Механизм аллильного бромирования с помощью NBS показан ниже:
Br 2 в этом процессе образуется в результате побочной реакции между HBr и NBS (не показано).
17.2C: Полезные полимеры, образованные неферментативными радикальными цепными реакциями
Многие бытовые полимерные материалы, с которыми вы, вероятно, знакомы, производятся с использованием процесса радикальной цепной реакции. Полиэтилен (ПЭТ), пластиковый материал, используемый для изготовления бутылок для безалкогольных напитков и многих других видов упаковки, производится путем радикальной полимеризации этилена (этена по номенклатуре ИЮПАК). Радикальный инициатор, такой как пероксид бензоила, подвергается гомолитическому расщеплению при воздействии высоких температур.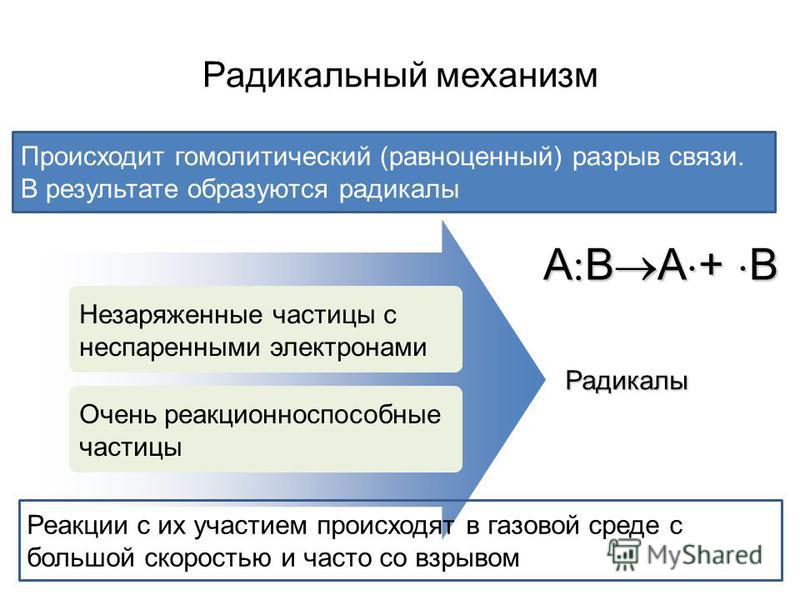
В фазе роста бензоильный радикал (X• на рисунке ниже) присоединяется к двойной связи этилена, образуя новый органический радикал. Последовательные молекулы этилена присоединяются к растущему полимеру до тех пор, пока не произойдет обрыв при столкновении двух радикалов. На рисунке ниже растущий ПЭТ-полимер обрывается бензоильным радикалом, но на альтернативной стадии обрыва два растущих ПЭТ-радикала могут конденсироваться.
Другие небольшие замещенные алкеновые мономеры полимеризуются аналогичным образом с образованием знакомых полимерных материалов. Два примера приведены ниже.
Дополнительная литература
MasterOrganicChemistry
Радикальные реакции – зачем нужны «тепло» или «свет»?
Инициация, распространение, завершение
Carey 4 TH Edition Online Activity
Механизм реакции
Веб-страницы
. Действительно gice Summary of Radical Реакция
.
Механизм свободных радикалов
Страница механизма свободных радикалов
Часто задаваемые вопросы о механизме свободных радикалов
Глоссарий, охватывающий механизмы роста цепи
Механизм свободнорадикального галогенирования
Видео
Механизм свободной радикальной цепи
Лекция свободного радикала. Видео о радикальном галогенировании
Видео о свободнорадикальном галогенировании
Free radical mechanism video
Free radical halogenation video
Radical Halogenation video
Intro video on free radical halogenation
Free radical substution video
Tutorial
How to draw free radical chain mechanisms
Free radical учебник по реакции
5.5. Free-Radical Chain Reaction распространяется под лицензией CC BY-NC-SA 4.0, автор, ремикс и/или куратор LibreTexts.

 Примерами могут послужить: SCN—,Br—, CN—,Cl—,I—, OH— и другие анионы и соединения с неподеленной электронной парой.
Примерами могут послужить: SCN—,Br—, CN—,Cl—,I—, OH— и другие анионы и соединения с неподеленной электронной парой.


Leave A Comment