ЕГЭ по химии 2023 задание 12: номер 147 | xlrin
Все для самостоятельной подготовки к ЕГЭ
Зарегистрироваться
Русский язык Математика (профильная) Математика (базовая) Обществознание Физика История Биология Химия Английский язык Литература Информатика География
Задания Варианты Теория
Задание 1 Задание 2 Задание 3 Задание 4 Задание 5 Задание 6 Задание 7 Задание 8 Задание 9 Задание 10 Задание 11 Задание 12 Задание 13 Задание 14 Задание 15 Задание 16 Задание 17 Задание 18 Задание 19 Задание 20 Задание 21 Задание 22 Задание 23 Задание 24 Задание 25 Задание 26 Задание 27 Задание 28 Задание 29 Задание 30 Задание 31 Задание 32 Задание 33 Задание 34
Разбор сложных заданий в тг-канале:
Пропин будет реагировать с каждым из веществ, указанных в рядах:
- Na, H2O, HBr
- KMnO4, H2, Br2
- [Ag(NH3)2]OH, HCl, Br2
- CaO, HCl, O2
- CO2, H2O, HCl
- Na2SO4, O2, Br2
Объект авторского права ООО «Легион»
Посмотреть решение
Предыдущая задача
Следующая задача
Из предложенного перечня выберите два вещества, которые могут образоваться при нагревании смеси хлорметана и хлорэтана с металлическим натрием.
- метан
- пропан
- этан
- 1,2-дибромпропан …
Бутен-1 (преимущественно) образуется при взаимодействии
- бутанола-1 и концентрированной H2SO4 (при t > 140°C)
- 2-хлорбутана со спиртовым раствором KOH
- 1-хлорбутана и водного раствор…
Из предложенного перечня выберите два вещества, с которыми одноатомные спирты не взаимодействуют.
- уксусная кислота
- метан
- металлический натрий
- кислород
- фенол
Запишите в поле ответ…
Из предложенного перечня выберите две реакции, в которые, в отличие от других альдегидов, вступает метаналь.
- окисление гидроксидом меди(II)
- восстановление водородом
- поликонденсаци…
Популярные материалы
Составим твой персональный план подготовки к ЕГЭ
Углеводороды
Характерные химические свойства углеводородов: алканов, алкенов, диенов, алкинов. Механизмы реакций замещения и присоединения в органической химии. Правило В.В. Марковникова.
Механизмы реакций замещения и присоединения в органической химии. Правило В.В. Марковникова.
1. Как для бензола, так и для стирола характерны
1) наличие в молекуле сопряженной электронной системы
2) sp3-гибридизация атомов углерода
3) взаимодействие с водородом в присутствии катализатора
4) обесцвечивание бромной воды
5) горючесть
6) хорошая растворимость в воде
2. И толуол, и бензол реагируют с
1) бромом
2) хлорметаном
3) бромной водой
4) бромоводородом
5) азотной кислотой
6) гидроксидом меди(II)
3. Раствор перманганата калия обесцвечивают
1) пентан
2) бензол
3) бутин-1
4) толуол
5) пентен-2
6) полиэтилен
4. Бромную воду обесцвечивают
1) пентан
2) бензол
3) бутин-1
4) толуол
5) бутен-2
6) бутадиен-1,3
5. И для толуола, и для бутадиена-1,3 характерны
1) наличие в молекуле сопряжённой электронной системы
2) sp2-гибридизация всех атомов углерода
3) реакции замещения
4) обесцвечивание раствора КМnO4
5) горючесть
6) хорошая растворимость в воде
6.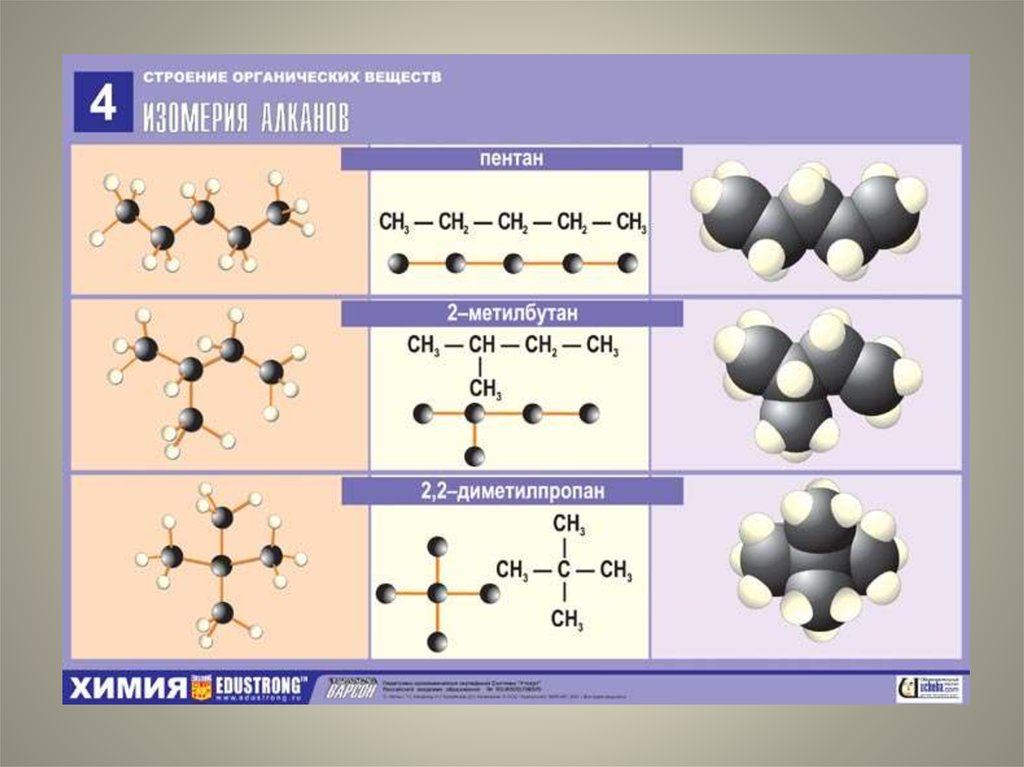 Толуол вступает в реакцию с
Толуол вступает в реакцию с
1) аммиаком
2) хлороводородом
3) хлором при освещении
4) аммиачным раствором оксида серебра
5) хлором в присутствии катализатора AICI3
6) хлорэтаном в присутствии катализатора AICI3
7. Пропин взаимодействует с
1) натрием
2) бромной водой
3) метаном
4) азотом
5) гидроксидом натрия
6) водой в присутствии катализатора
8. Пропен взаимодействует с
1) натрием
2) бромной водой
3) метаном
4) бромоводородом
5) гидроксидом натрия
6) водой в присутствии катализатора
9. Бутан вступает в реакцию
1) гидратации
2) гидрирования
3) бромирования
4) дегидратации
5) изомеризации
6) дегидрирования
10. По ионному механизму протекают реакции, уравнения которых:
1) СН4+О2 —> СO2 + 2H2O
2) СН2=СН2 + НС1 —> СН3-СН2С1
4) C2H6 + Cl2 —> C2H5Cl + HCl
5) СН3-СН=СН2 + НВr —> СН3-СНВг-СН3
6) CH3-CH=CH2 + H2 —> CH3-CH2-CH3
11. К способам получения алкенов относят:
К способам получения алкенов относят:
1) дегидрирование алканов
2) гидрирование бензола
3) дегидратацию спиртов
4) отщепление галогеноводородов от галогеналканов
5) ароматизацию предельных углеродов
6) гидратацию альдегидов
12. И для метана, и для пропена характерны:
1) реакции бромирования
2) sp3-гибридизация атомов углерода в молекуле
3) наличие p-связи в молекулах
4) реакции гидрирования
5) горение на воздухе
6) хорошая растворимость в воде
13. Пропин будет реагировать с каждым из веществ, указанных в ряду:
1) [Cu(NH3)2]OH, H2O, Н2
2) CuSO4, С, Вг2
3) Na2O, HCI, O2
4) [Ag(NH3)2|OH, НВr, O2
5) СO2, Н2O, HCI
6) КМnO4, Н2, Вг2
14. Алкены взаимодействуют с:
Алкены взаимодействуют с:
1) [Ag(NH3)2]OH
2) Вг2 (р-р)
3) Сu(ОН)2
4) КМnO4 (раствор)
5) Н2O (Н+)
6) Са(ОН)2
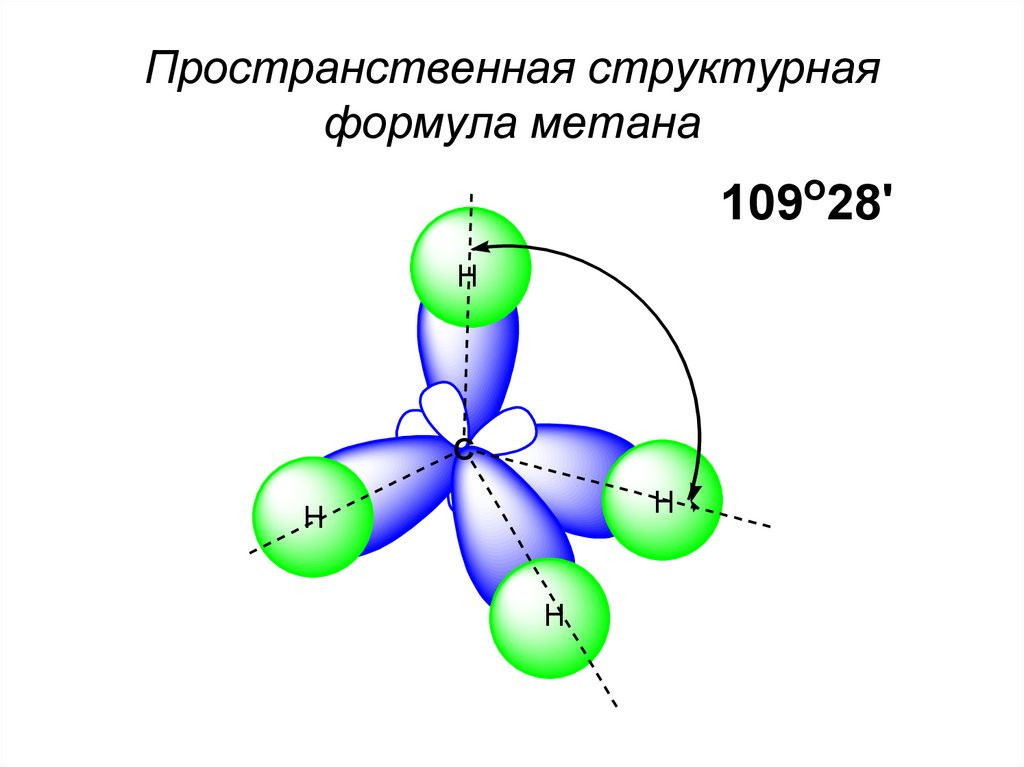
15. Для метана характерны:
1) реакция гидрирования
2) тетраэдрическая форма молекулы
3) наличие p-связи в молекуле
4) sp3-гибридизация орбиталей атома углерода в молекуле
5) реакции с галогеноводородами
6) горение на воздухе
16. Из перечисленных ниже соединений с хлороводородом взаимодействуют
1) этан
2) этилен
3) бензол
4) глицин
5) муравьиная кислота
6) a-аминопропионовая кислота
17. Углеводороды ряда этилена будут реагировать с каждым из веществ, указанных в ряду:
1) Br2, HCI, С3Н8
2) КМnO4, Н2, Н2О
3) HСl, C6H6, Br2
4) НСНО, СН4, НВг
5) Н2, О2, Nа
6) Н2O, HCI, Br2
18.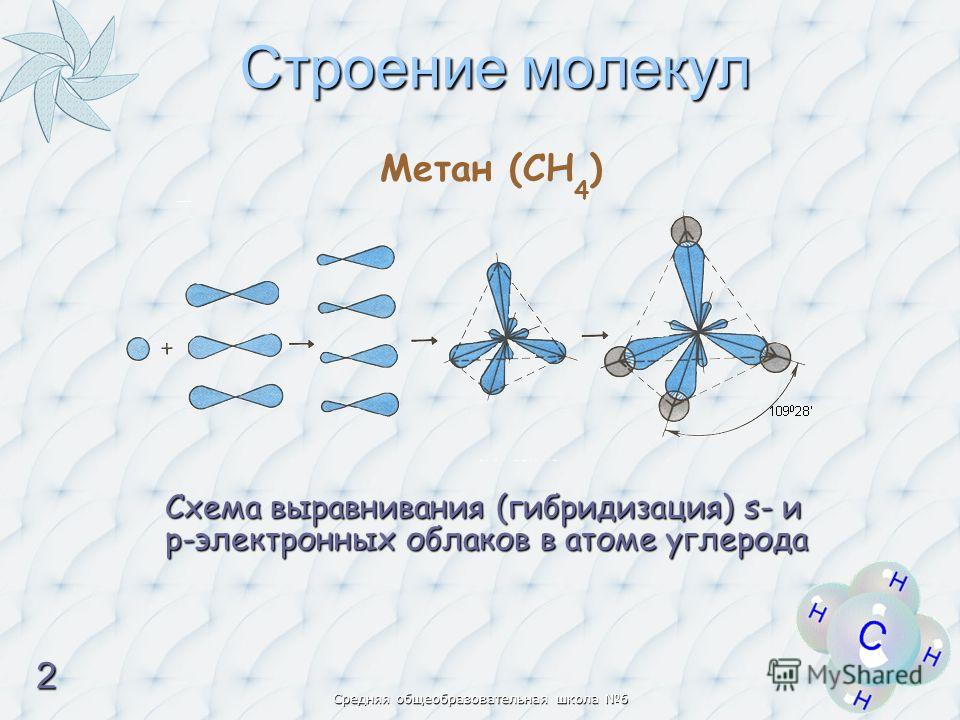 С водородом взаимодействует каждое из двух веществ:
С водородом взаимодействует каждое из двух веществ:
1) бензол, пропан
2) бутен, этан
3) дивинил, этен
4) стирол, бутадиен-1,3
5) дихлорэтан, бутан
6) этин, бутин-1
19. Ацетилен можно получить в результате реакции
1) гидрирования углерода
2) гидролиза карбида алюминия
3) гидролиза карбида кальция
4) взаимодействия Na2C2 с кислотой
5) пиролиза метана
6) дегидратации этанола
20. Промежуточное образование карбокатиона СН3 — СН+ — СН3 происходит при взаимодействии
1) пропана и хлора
2) пропена и хлора
3) пропена и хлороводорода
4) пропена и воды в присутствии катализатора
5) пропина и хлороводорода
6) пропена и бромоводорода
21. По радикальному механизму протекают реакции
1) СН4 + С12 —> СН3С1 + НС1
2) С2Н4 + Н2O —> С2Н5ОН
3) С2Н6 + HNO3 —> C2H5N02 + Н20
4) С2Н2 + Н2O —> СНзСНО
5) C2H6 + Br2 —>C2H5Br + HBr
6) С2Н5ОН + НВг —> С2Н5Вг + Н20
22.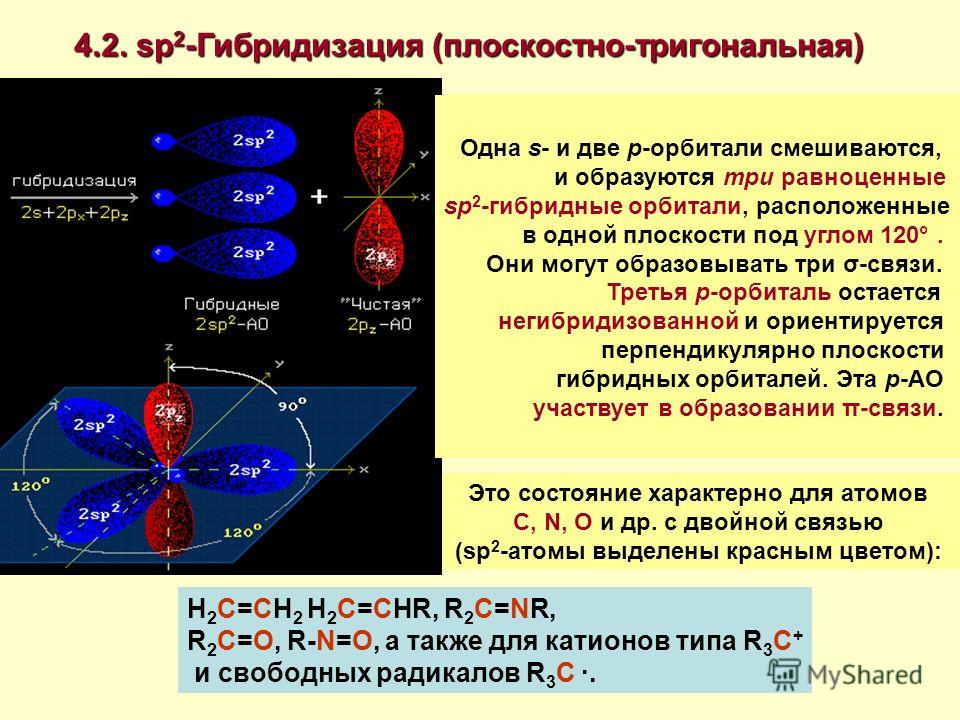 Промежуточное образование карбокатиона СН3 — СН+ — СН2 — СН3 происходит при взаимодействии
Промежуточное образование карбокатиона СН3 — СН+ — СН2 — СН3 происходит при взаимодействии
1) бутана и брома
2) бутена-2 и брома
3) бутена-1 и хлороводорода
4) бутена-2 и хлороводорода
5) бутена-1 и воды
6) бутена-2 и водорода
23. Реакция бромирования пропана протекает
1) по радикальному механизму
2) в несколько стадий
3) с разрывом связи в молекуле брома в начале реакции
4) в соответствии с правилом В.В. Марковникова
5) в присутствии катализатора
6) с преимущественным образованием 1-бромпропана
24. Этилен получают в результате реакций
1) дегидратации этанола
2) восстановления этанола
3) гидрирования этина
4) термического разложения ацетилена
5) дегидрирования этана
6) гидролиза этилбензола
25. Для бутана характерны:
1) наличие структурных изомеров
2) геометрическая изомерия
3) sp3-гибридизация атомов углерода
4) наличие s- и p-связей в молекулах
5) реакции с галогенами
6) окисление перманганатом калия
26. Реакция полимеризации характерна для
Реакция полимеризации характерна для
1) стирола
2) 2-метилбутадиена-1,3
3) 2-метилпропана
4) тетрафторэтена
5) 2-метилбутана
6) 3-метилпентана
27. Бромная вода обесцвечивается при действии
1) ацетилена
2) пропана
3) бутадиена-1,3
4) бензола
5) стирола
6) 2,2-диметилпропана
28. Для пропана характерны
1) горение
2) структурная изомерия
3) sp3 -гибридизация атомов углерода в молекуле
4) геометрическая изомерия
5) реакции замещения
6) взаимодействие с бромной водой
29. По правилу В.В. Марковникова происходит взаимодействие
1) бутена-1 и хлороводорода
2) пропена и воды
3) бутена-1 и хлора
4) бутена-1 и водорода
5) бутена-2 и брома
6) пропена и хлороводорода
30. Атомы углерода в состоянии sp3-гибридизации имеются в молекулах
1) 2-хлорбутана
2) дивинила
3) изобутана
4) этина
5) пропина
6) винилбензола
31.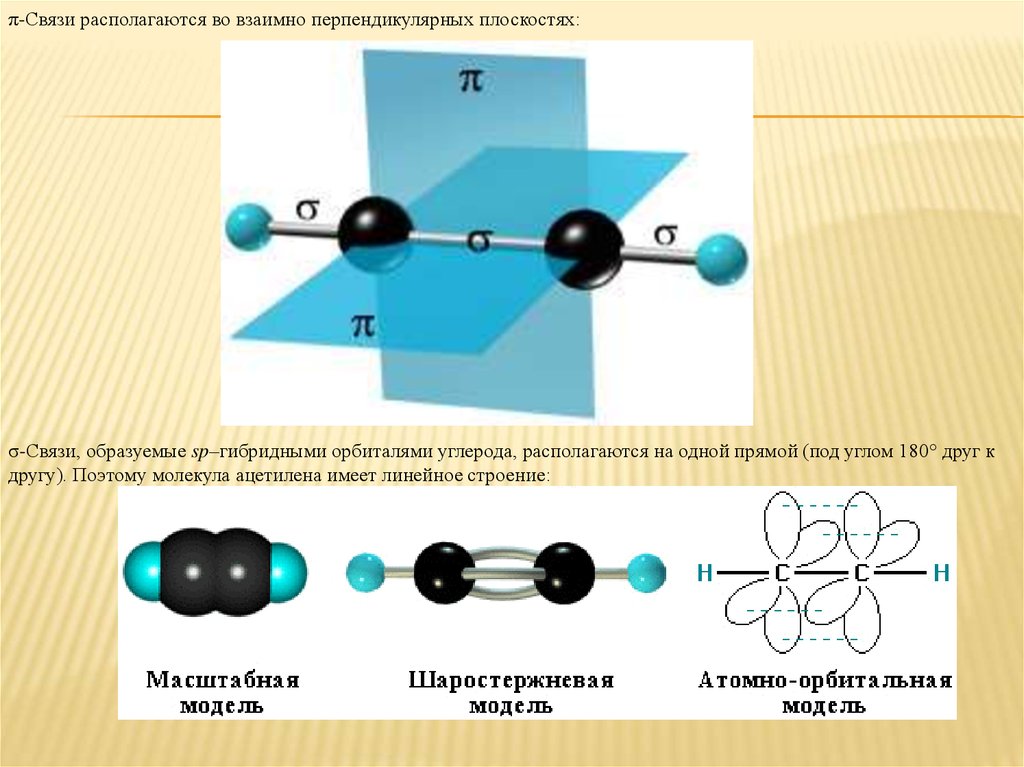 Атомы углерода в состоянии sp2-гибридизации находятся в молекулах
Атомы углерода в состоянии sp2-гибридизации находятся в молекулах
1) бутана
2) цис-бутена-2
3) транс-бутена-2
4) метанола
5) ацетилена
6) толуола
ОТВЕТЫ: 1-135; 2-125; 3-345; 4-356; 5-145; 6-356; 7-126; 8-246; 9-356; 10-235; 11-134; 12-125; 13-146; 14-245; 15-246; 16-246; 17-236; 18-346; 19-345; 20-346; 21-135; 22-345; 23-123; 24-135; 25-135; 26-124; 27-135; 28-135, 29-126, 30-135, 31-236.
1.9: sp-гибридные орбитали и структура ацетилена
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31376
Цели
После завершения этого раздела вы сможете
- используют концепцию гибридизации

- перечислены приблизительные длины связей, связанных с типичными одинарными, двойными и тройными связями углерод-углерод. [Возможно, вам придется просмотреть разделы 1.7 и 1.8.]
- список приблизительных валентных углов, связанных с sp 3 -, sp 2 — и sp ‑гибридизировали атомы углерода и предсказывают ожидаемые валентные углы в данных органических соединениях. [При необходимости просмотрите разделы 1.6, 1.7 и 1.8.]
- учитывают различия в длине связи, прочности связи и валентных углах, обнаруженные в соединениях, содержащих sp 3 -, sp 2 — и sp-гибридизированные атомы углерода, такие как этан, этилен и ацетилен.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- sp гибридный орбитальный
Study Notes
Валентные углы, связанные с sp 3 -, sp 2 — и sp ‑гибридизированными атомами углерода, составляют приблизительно 109,5° и 1800° соответственно.
Связывание в ацетилене
Наконец, концепция гибридных орбит хорошо применима к группам с тройными связями, таким как алкины и нитрилы. Рассмотрим, например, строение этина (другое распространенное название — ацетилен), простейшего алкина.
этин
Эта молекула линейна: все четыре атома лежат на одной прямой. Тройная связь углерод-углерод имеет длину всего 1,20Å. В картине гибридной орбиты ацетилена оба атома углерода являются sp -гибридизированными . В гибридном углероде sp орбиталь 2 s объединяется с орбиталью 2 p x , образуя две гибридные орбитали sp , ориентированные под углом 180° друг к другу (например, , вдоль оси х). 2 9Орбитали 0029 p y и 2 p z остаются негибридизированными и ориентированы перпендикулярно оси y и z соответственно.
С-С сигма-связь образуется путем перекрывания одной 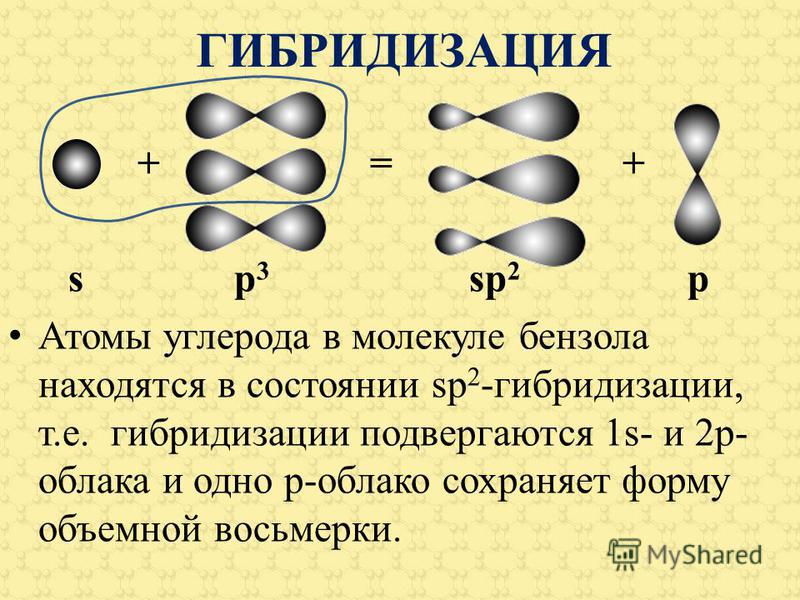 У каждого атома углерода еще есть два наполовину заполненных 2 p y и 2 p z орбитали, которые перпендикулярны как друг другу, так и линии, образованной сигма-связями. Эти две перпендикулярные пары орбиталей p образуют две пи-связи между атомами углерода, что в целом дает тройную связь (одна сигма-связь плюс две пи-связи).
У каждого атома углерода еще есть два наполовину заполненных 2 p y и 2 p z орбитали, которые перпендикулярны как друг другу, так и линии, образованной сигма-связями. Эти две перпендикулярные пары орбиталей p образуют две пи-связи между атомами углерода, что в целом дает тройную связь (одна сигма-связь плюс две пи-связи).
| сигма-соединение в этилене | связывание пи в этилене |
Ацетилен имеет три сигма-связи и две пи-связи. Тройная связь углерод-углерод в ацетилене является самой короткой (120 пм) и самой прочной (965 кДж/моль) из всех типов связи углерод-углерод. Поскольку каждый углерод в ацетилене имеет две электронные группы, VSEPR предсказывает линейную геометрию и валентный угол H-C-C, равный 180 o .
| Молекула | Прочность связи (кДж/моль) | Длина соединения (пм) | |
|---|---|---|---|
| Этан, CH 3 CH 3 | ( сп 3 ) К-К ( сп 3 ) | 376 | 154 |
| Этилен, H 2 C=CH 2 | ( сп 2 ) С=С ( сп 2 ) | 728 | |
| Ацетилен, HC≡CH | ( сп ) К≡К ( сп ) | 965 | 120 |
Обратите внимание, что по мере увеличения порядка связи длина связи уменьшается, а прочность связи увеличивается.
Концепция гибридных орбиталей прекрасно объясняет другое экспериментальное наблюдение: одинарные связи, соседствующие с двойными и тройными связями, становятся все короче и прочнее, чем «нормальные» одинарные связи, такие как в простом алкане. Связь углерод-углерод в этане (структура A ниже) возникает в результате перекрывания двух sp
Однако в пропене (B) одинарная связь углерод-углерод является результатом перекрытия между орбиталью sp 2 и орбиталью sp 3 , тогда как в пропине (C) одинарная связь углерод-углерод является результат перекрытия между sp-орбиталью и sp-орбиталью 3 . Все это одинарные связи, но одинарная связь в молекуле C короче и прочнее, чем в молекуле B, которая, в свою очередь, короче и прочнее, чем в A.
Объяснение здесь относительно простое. sp-орбиталь состоит из одной  Для сравнения, орбитали sp 2 имеют 33% s признаков и 67 % p признаков, в то время как sp 3 орбиталей имеют 25 % s признаков и 75 % p признаков. Из-за своей сферической формы орбитали 2 s меньше и удерживают электроны ближе и «плотнее» к ядру по сравнению с 2 p орбиталей. Следовательно, связи с перекрытием sp + sp 3 (как в алкине C) короче и прочнее, чем связи с перекрытием sp 2 + sp 3 (как в алкене B). Связи, включающие перекрывание sp 3 — sp 3 (как в алкане А), являются самыми длинными и слабыми в группе из-за 75-процентного « p » характера гибридов.
Для сравнения, орбитали sp 2 имеют 33% s признаков и 67 % p признаков, в то время как sp 3 орбиталей имеют 25 % s признаков и 75 % p признаков. Из-за своей сферической формы орбитали 2 s меньше и удерживают электроны ближе и «плотнее» к ядру по сравнению с 2 p орбиталей. Следовательно, связи с перекрытием sp + sp 3 (как в алкине C) короче и прочнее, чем связи с перекрытием sp 2 + sp 3 (как в алкене B). Связи, включающие перекрывание sp 3 — sp 3 (как в алкане А), являются самыми длинными и слабыми в группе из-за 75-процентного « p » характера гибридов.
Сводка по гибридизации
- Одинарная связь является сигма-связью.
- Двойная связь состоит из сигма-связи и пи-связи.
- Тройная связь состоит из сигма-связи и двух пи-связей.
- Сигма-связи образованы перекрытием двух гибридных орбиталей или перекрытием гибридной орбитали и s-орбитали водорода.
 Связи
Связи - Pi образованы перекрыванием двух негибридных p-орбиталей.
- Электроны неподеленной пары обычно содержатся на гибридных орбиталях.
Используемые гибридные орбитали (и, следовательно, гибридизация) зависят от того, сколько электронных групп окружает рассматриваемый атом. Электронная группа может означать либо связанный атом, либо неподеленную пару. Молекулярная геометрия также определяется количеством электронных групп, поэтому она напрямую связана с гибридизацией.
| Количество электронных групп | Гибридный орбитальный Бывший в употреблении | Пример | Базовая геометрия | Базовый соединительный уголок |
|---|---|---|---|---|
| 2 | сп | Линейный | 180 или | |
| 3 | сп 2 | Тригональная планарная | 120 или | |
| 4 | сп 3 | Тетраэдрический | 109,5 или |
Упражнения
1) Для молекулы ацетонитрила:
а) Сколько в ней сигма- и пи-связей?
б) Какие орбитали перекрываются, образуя сигма-связи C-H?
в) Какие орбитали перекрываются, образуя сигма-связь С-С?
г) Какие орбитали перекрываются, образуя сигма-связь C-N?
д) Какие орбитали перекрываются, образуя пи-связи C-N?
е) Какая орбиталь содержит неподеленную пару электронов азота?
Растворы
1)
a) 5 сигма и 2 пи
b) An sp 3 гибридная орбиталь из углерода и a s-орбиталь из водорода.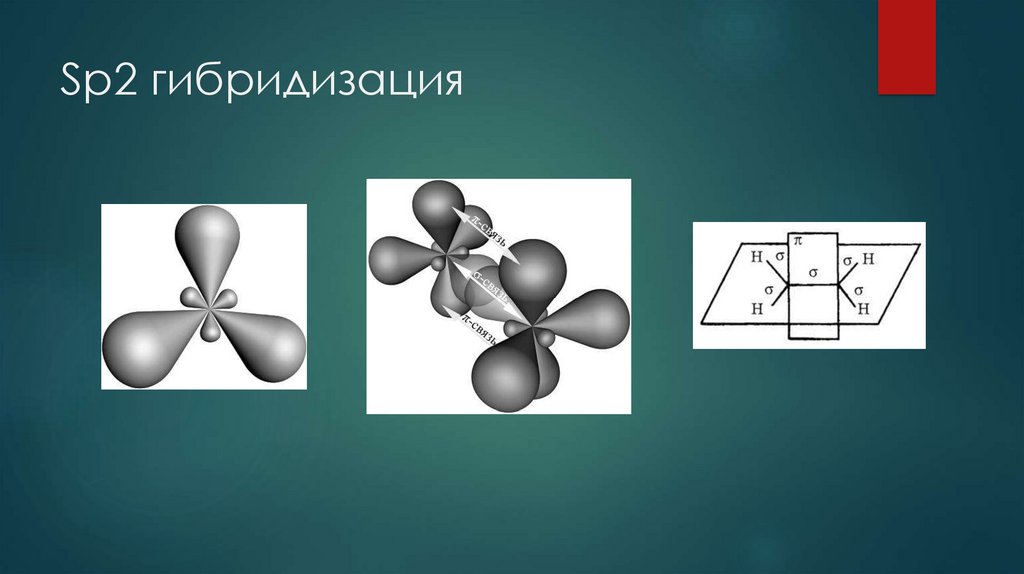
c) An sp 3 Гибридная орбиталь из одного углерода и a sp 3 орбиталь от другого углерода.
d) Гибридная sp-орбиталь из углерода и a-орбиталь из азота.
e) Орбитали An p y и p z из углерода и орбитали p y и p z из азота.
f) Гибридная sp-орбиталь.
1.9: sp Hybrid Orbitals and the Structure of Acetylene распространяется по лицензии CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Стивен Фармер, Дитмар Кеннеполь, Криста Каннингем, Тим Содерберг, Уильям Рейш и Уильям. Реуш.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- автор@Дитмар Кеннеполь
- автор @ Криста Каннингем
- автор@Стивен Фармер
- автор @ Тим Содерберг
- автор@William Reusch
- sp гибридный орбитальный
Реакционная способность алкинов
Реакции алкинов |
|---|
Тройная углерод-углеродная связь может располагаться в любом неразветвленном участке углеродной цепи или на конце цепи, и в этом случае она называется концевой . Из-за своей линейной конфигурации (угол связи sp-гибридизованного углерода составляет 180º) десятичленное углеродное кольцо является наименьшим, которое может выполнять эту функцию без чрезмерного напряжения.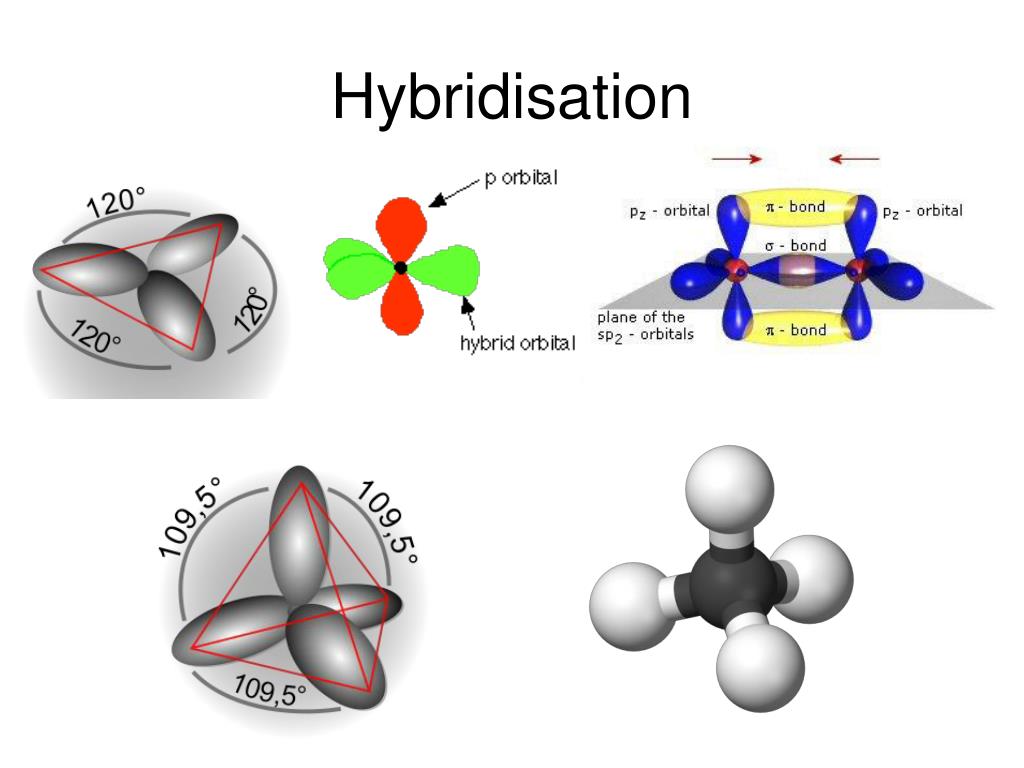 Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
Поскольку наиболее распространенным химическим превращением двойной углерод-углеродной связи является реакция присоединения, можно ожидать, что то же самое верно и для тройных углерод-углеродных связей. Действительно, большинство реакций присоединения алкенов, обсуждавшихся ранее, также протекают с алкинами и с аналогичной регио- и стереоселективностью.
1. Каталитическое гидрирование
Каталитическое присоединение водорода к 2-бутину не только служит примером такой реакции присоединения, но также предоставляет данные о теплоте реакции, которые отражают относительную термодинамическую стабильность этих углеводородов, как показано на диаграмме справа. Из теплоты гидрирования, показанной синим цветом в единицах ккал/моль, видно, что алкины термодинамически менее стабильны, чем алкены, в большей степени, чем алкены менее стабильны, чем алканы. Стандартные энергии связи для углерод-углеродных связей подтверждают этот вывод. Таким образом, двойная связь прочнее одинарной связи, но не в два раза прочнее. Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 — 28,3 = 8,4).
Разность (63 ккал/моль) можно рассматривать как силу компонента π-связи. Точно так же тройная связь прочнее двойной связи, но не на 50% прочнее. Здесь разницу (54 ккал/моль) можно принять за силу второй π-связи. 9ккал/моль Ослабление этой второй π-связи отражается в числах теплоты гидрирования (36,7 — 28,3 = 8,4).
Поскольку алкины термодинамически менее стабильны, чем алкены, можно ожидать, что реакции присоединения первых будут более экзотермическими и относительно более быстрыми, чем эквивалентные реакции последних. В случае каталитического гидрирования обычные катализаторы гидрирования Pt и Pd настолько эффективны в промотировании присоединения водорода как к двойным, так и к тройным углерод-углеродным связям, что алкеновое промежуточное соединение, образованное присоединением водорода к алкину, не может быть выделено. Менее эффективный катализатор, Катализатор Линдлара , приготовленный дезактивацией (или отравлением) обычного палладиевого катализатора путем обработки его ацетатом свинца и хинолином, позволяет превращать алкины в алкены без дальнейшего восстановления в алкан.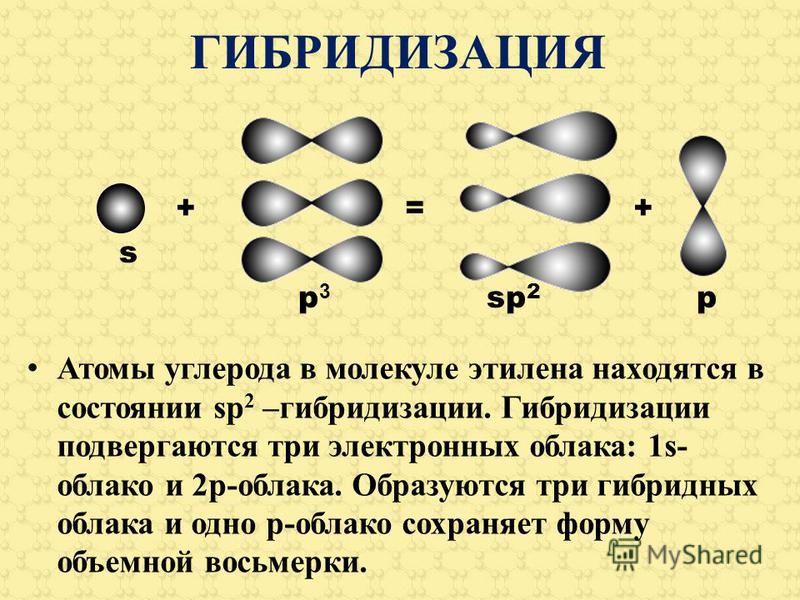 Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
Добавление водорода является стереоселективным сином (например, 2-бутин дает цис-2-бутен). Дополнительное стереоселективное восстановление в антимоде может быть осуществлено раствором натрия в жидком аммиаке. Эта реакция будет обсуждаться далее в этом разделе.
| r-c≡C-r + H 2 & Lindlar Catalyst-> CIS R-CH = CH-R | |||
R-C≡C-R + 2 NA в NH 3| r-C≡C-R + 2 NA в NH 1102 (LIQ)- | r-C≡C-R + 2 Na в NH 1102 (Liq)- | r-C≡C-R + 2 Na. > транс R-CH=CH-R + 2 NaNH 2 | |
Алкены и алкины обнаруживают любопытную разницу в поведении при каталитическом гидрировании. Независимые исследования скорости гидрирования для каждого класса показывают, что алкены реагируют быстрее, чем алкины. Однако осторожное гидрирование алкина происходит исключительно до алкена до тех пор, пока первый не будет израсходован, после чего алкен продукта очень быстро гидрируется до алкана.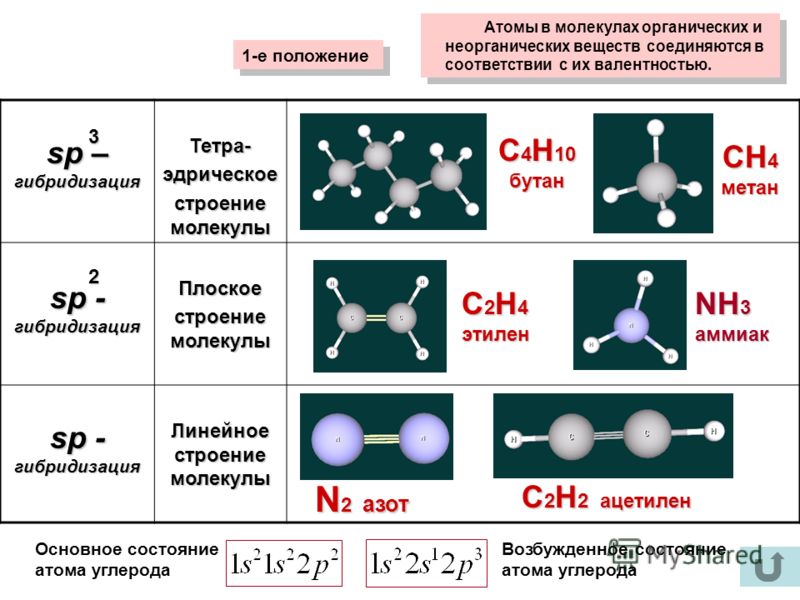 Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.
Такое поведение хорошо объясняется различиями в стадиях реакции гидрирования. Прежде чем водород сможет присоединиться к кратной связи, алкен или алкин должны быть адсорбированы на поверхности катализатора. В связи с этим ранее было описано образование устойчивых комплексов платины (и палладия) с алкенами. Поскольку алкины сильнее адсорбируются на таких каталитических поверхностях, чем алкены, они предпочтительно занимают реакционные центры на катализаторе. Последующий перенос водорода к адсорбированному алкину протекает медленно по сравнению с соответствующим переносом водорода к адсорбированной молекуле алкена. Следовательно, восстановление тройных связей происходит избирательно с умеренной скоростью с последующим быстрым присоединением водорода к алкеновому продукту. Катализатор Линдлара позволяет адсорбировать и восстанавливать алкины, но не адсорбирует алкены в достаточной степени для их восстановления.
2. Добавление электрофильных реагентов
При изучении реакций присоединения электрофильных реагентов, таких как сильные кислоты Бренстеда и галогены, к алкинам обнаруживается любопытный парадокс.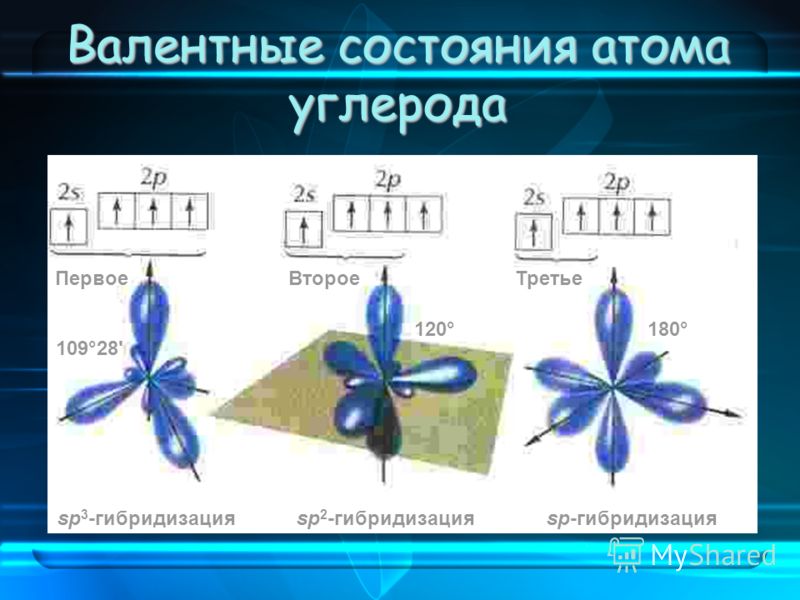 Реакции даже более экзотермичны, чем присоединения к алкенам, и все же скорость присоединения к алкинам в 100–1000 раз медленнее, чем присоединение к эквивалентно замещенным алкенам. Реакция одного эквивалента брома с 1-пентен-4-ином, например, дает в качестве основного продукта 4,5-дибром-1-пентин.
Реакции даже более экзотермичны, чем присоединения к алкенам, и все же скорость присоединения к алкинам в 100–1000 раз медленнее, чем присоединение к эквивалентно замещенным алкенам. Реакция одного эквивалента брома с 1-пентен-4-ином, например, дает в качестве основного продукта 4,5-дибром-1-пентин.
Хотя эти электрофильные присоединения к алкинам медленны, они происходят и обычно проявляют региоселективность по правилу Марковникова и антистереоселективность. Одной из проблем, конечно, является то, что продукты этих присоединений сами по себе являются замещенными алкенами и поэтому могут подвергаться дальнейшему присоединению. Из-за своей высокой электроотрицательности галогеновые заместители на двойной связи снижают ее нуклеофильность и тем самым снижают скорость реакций электрофильного присоединения. Следовательно, существует тонкий баланс относительно того, будет ли продукт первоначального присоединения к алкину подвергаться дальнейшему присоединению к насыщенному продукту.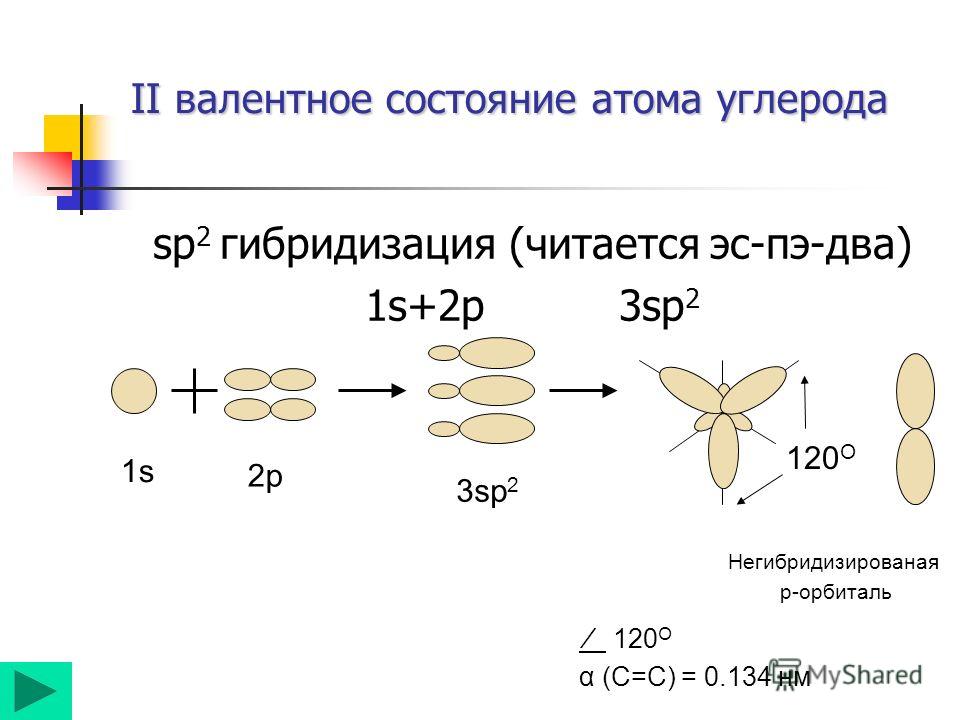 Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Хотя исходные алкеновые продукты часто можно выделить и идентифицировать, они обычно присутствуют в смесях продуктов и не могут быть получены с высоким выходом. Следующие реакции иллюстрируют многие из этих особенностей. В последнем примере 1,2-диодэтен не подвергается дальнейшему присоединению, поскольку вицинальные дийодалканы относительно нестабильны.
Реакции электрофильного присоединения к алкенам и алкинам, как правило, протекают с начальным образованием пи-комплекса , в котором электрофил принимает электроны от кратной связи и слабо связывается с ней. Такие комплексы образуются обратимо и затем могут реорганизоваться в реакционноспособный промежуточный продукт на более медленной, определяющей скорость стадии. Реакции с алкинами более чувствительны к смене растворителя и каталитическим воздействиям, чем реакции с эквивалентными алкенами. Для примеров и обсуждения механизмов нажмите здесь.
Почему реакции алкинов с электрофильными реагентами протекают более вяло, чем соответствующие реакции алкенов? В конце концов, реакции присоединения к алкинам, как правило, более экзотермичны, чем присоединения к алкенам, и кажется, что плотность π-электронов вокруг тройной связи выше (две π-связи против одной).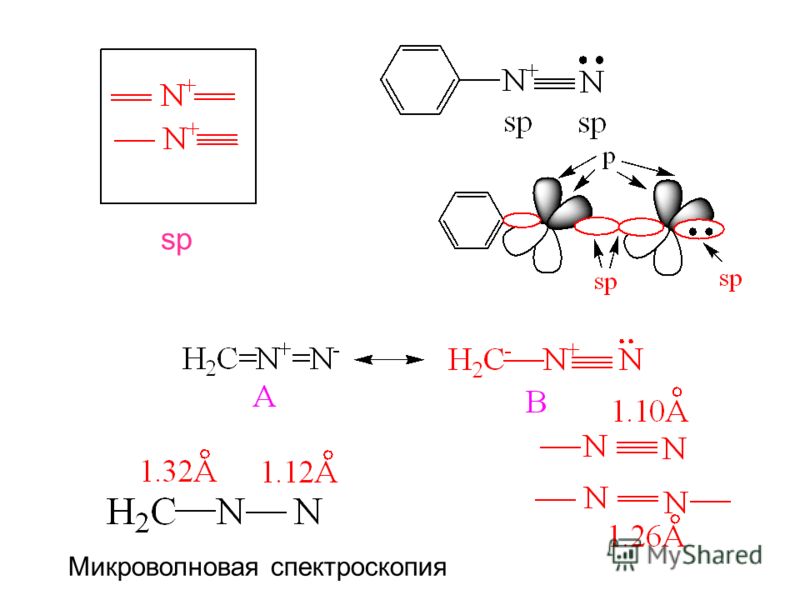 Два фактора важны для объяснения этого кажущегося парадокса. Во-первых, хотя с тройной связью связано больше π-электронов, sp-гибридизованные атомы углерода оказывают сильное притяжение к этим π-электронам, которые, следовательно, более прочно связаны с функциональной группой, чем π-электроны двойной связи. . Это видно по потенциалам ионизации этилена и ацетилена.
Два фактора важны для объяснения этого кажущегося парадокса. Во-первых, хотя с тройной связью связано больше π-электронов, sp-гибридизованные атомы углерода оказывают сильное притяжение к этим π-электронам, которые, следовательно, более прочно связаны с функциональной группой, чем π-электроны двойной связи. . Это видно по потенциалам ионизации этилена и ацетилена.
| Ацетилен | Hc≡CH + энергия —— > [hc≡CH • ( +) + E ( -) | ΔH = +264 KCAL/MOLE | |
|---|---|---|---|
| 66666664 | |||
| ΔH = +244 ккал/моль | |||
| Этан | H 3 C–CH 3 + Энергия —— > [H 3 C–CH 3 ] • (+) + e (–)| ΔH = +296 ккал/моль | |
Как определено предыдущими уравнениями, потенциал ионизации — это минимальная энергия, необходимая для отрыва электрона от молекулы соединения.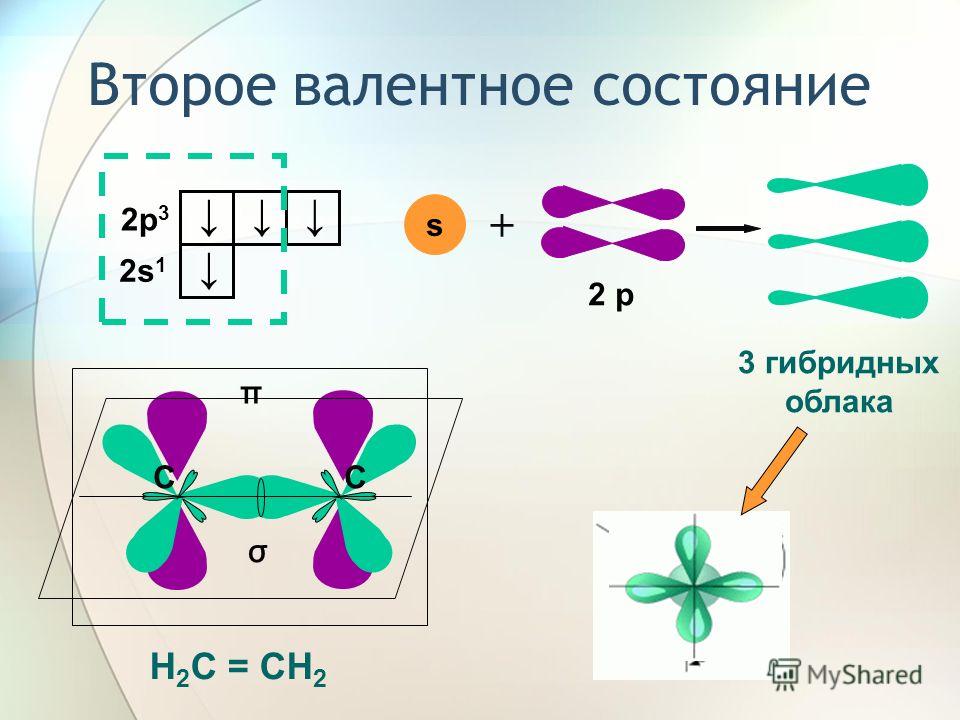 Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Поскольку пи-электроны удерживаются менее прочно, чем сигма-электроны, мы ожидаем, что потенциалы ионизации этилена и ацетилена будут ниже, чем у этана, как и в случае. Сродство к протону в газовой фазе имеет тот же порядок: этилен более основный, чем ацетилен, а этан менее основный, чем любой из них. Поскольку начальным взаимодействием между электрофилом и алкеном или алкином является образование пи-комплекса, в котором электрофил принимает электроны от кратной связи и становится слабо связанным с кратной связью, становится понятным относительно более медленные реакции алкинов.
Предполагается, что вторым фактором является стабильность промежуточного карбокатиона, образованного сигма-связью протона или другого электрофила с одним из атомов углерода тройной связи. Этот промежуточный продукт имеет положительный заряд, локализованный на ненасыщенном углероде, и такие винильные катионы менее стабильны, чем их насыщенные аналоги. Действительно, мы можем модифицировать наш предыдущий порядок устойчивости карбокатионов, включив в него эти виниловые катионы, как показано ниже.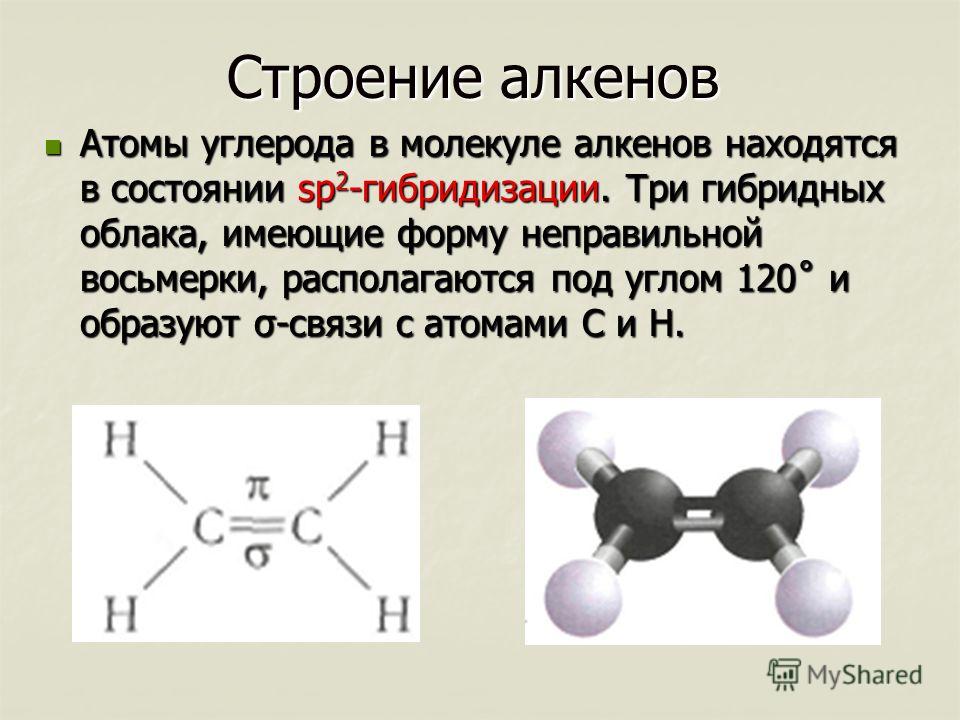 Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
Возможно, что виниловые катионы, стабилизированные сопряжением с арильным заместителем, являются интермедиатами присоединения НХ к алкинам типа Ar-C≡C-R, но такие интермедиаты образуются не во всех реакциях присоединения алкинов.
|
Применение постулата Хаммонда указывает на то, что энергия активации для образования промежуточного соединения винилового катиона будет выше, чем для промежуточного соединения с более низкой энергией. Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Это показано для алкенов по сравнению с алкинами на следующих энергетических диаграммах.
Несмотря на эти различия, электрофильные присоединения к алкинам оказались исключительно полезными синтетическими трансформациями. Например, добавление HCl, уксусной кислоты и синильной кислоты к ацетилену дает соответственно полезные мономеры винилхлорид, винилацетат и акрилонитрил, как показано в следующих уравнениях. Обратите внимание, что в этих и многих других подобных реакциях переходные металлы, такие как соли меди и ртути, являются эффективными катализаторами.
| HC≡CH + HCL + HGCL 2 (на углероде) — > H 2 C = CHCL VINYLCHLIDE |
| HCAT —— > H 2 C = CCLCH 2 CL 2,3-дихлорпропен |
HC≡CH + CH 3 CO 1139 HC≡CH + CH 3 CO 11139 HC≡CH + CH 3 CO 11101139 HC≡CH + CH 3 CO 110111011011101110111011101101111139 HC≡CH + CH 3 .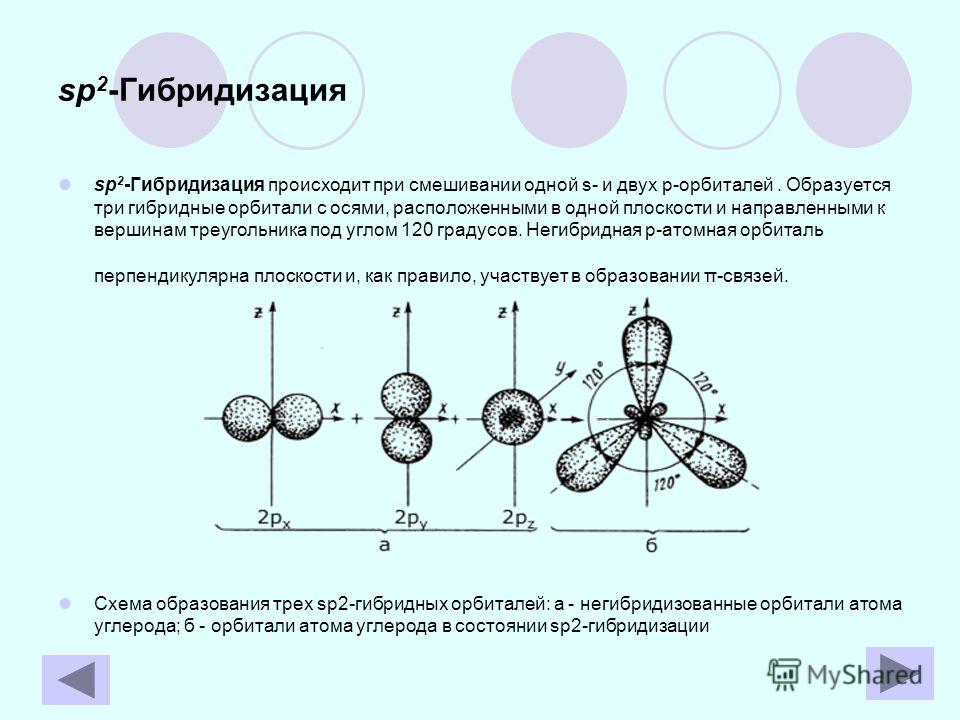 H 2 C=CHOCOCH 3 vinyl acetate H 2 C=CHOCOCH 3 vinyl acetate |
| HC≡CH + HCN + Cu 2 Cl 2 —— > H 2 C=CHCN acryonitrile |
Complexes formed by alkenes and alkynes with transition металлы отличаются от простых пи-комплексов, отмеченных выше. Здесь синергетический процесс, включающий донорство электронов с заполненной π-орбитали органического лиганда на пустую d-орбиталь металла вместе с обратным донорством электронов с другой d-орбитали металла на пустую π*-разрыхляющую орбиталь лиганда. Модель комплекса Pt(II) с ацетиленом можно посмотреть, нажав здесь
3. Гидратация алкинов и таутомерия
Как и в случае с алкенами, для присоединения воды к алкинам требуется сильная кислота, обычно серная кислота, и этому способствует сульфат ртути. Однако, в отличие от присоединения к двойным связям, которое дает спиртовые продукты, присоединение воды к алкинам дает кетоновые продукты (за исключением ацетилена, который дает ацетальдегид).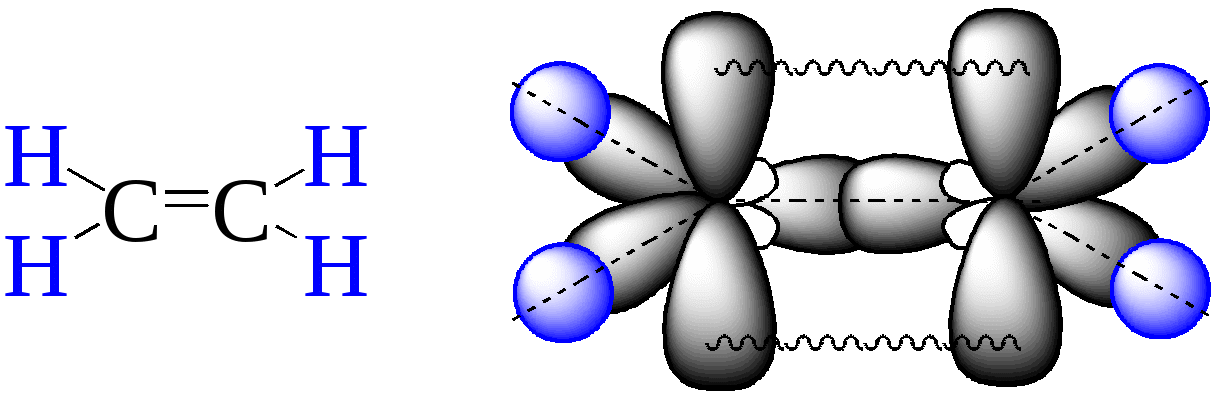 Объяснение этого отклонения лежит в енол-кето-таутомеризации , иллюстрируемой следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), который немедленно перегруппировывается в более стабильный кето-таутомер.
Объяснение этого отклонения лежит в енол-кето-таутомеризации , иллюстрируемой следующим уравнением. Исходным продуктом присоединения воды к алкину является енол (соединение, имеющее гидроксильный заместитель, присоединенный к двойной связи), который немедленно перегруппировывается в более стабильный кето-таутомер.
Таутомеры определяются как быстро взаимопревращающиеся конституциональные изомеры, обычно отличающиеся другим расположением связи для лабильного атома водорода (здесь окрашены красным) и другим расположением двойной связи. Равновесие между таутомерами не только быстрое в нормальных условиях, но часто сильно благоприятствует одному из изомеров (например, ацетон на 99,999% состоит из кето-таутомера). Даже в таких односторонних равновесиях свидетельство присутствия второстепенного таутомера исходит из химического поведения соединения. Таутомерные равновесия катализируются следами кислот или оснований, которые обычно присутствуют в большинстве химических образцов.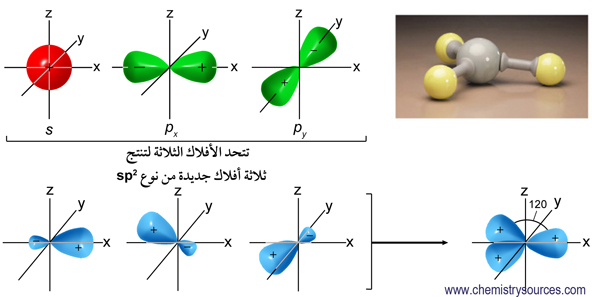 Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
Три приведенных ниже примера иллюстрируют эти реакции для различных замещений тройной связи. Стадия таутомеризации указана красной стрелкой. Для терминальных алкинов добавление воды следует правилу Марковникова, как и во втором примере ниже, и конечным продуктом является метилкетон (за исключением ацетилена, показанного в первом примере). Для внутренних алкинов (тройная связь находится внутри более длинной цепи) добавление воды не является региоселективным. Если тройная связь расположена несимметрично (т. е. если R и R’ в третьем уравнении не совпадают), будут образованы два изомерных кетона.
| HC≡CH + H 2 O + HGSO 4 & H 2 SO 4 —> [H 2 C = Choh]-> H 3 2 CH = —— —-> H 3 CH =-> H 3 CH =-> H О |
Rc≡CH + H 2 O + HGSO 4 & H 2 SO 4 — > [RC (OH) = CH 2 ] — > RC (= O) CH. 3 3 |
| RC≡CR’ + H 2 O + HgSO 4 & H 2 SO 4 —— > [ RHC=C(OH)R’ + 9 RC(OH)=CHR’ 4 0 ] > RCH 2 -C(=O)R’ + RC(=O)-CH 2 R’ |
Два фактора оказывают важное влияние на описанную здесь енол-кето-таутомеризацию. Во-первых, это разность потенциальных энергий между таутомерными изомерами. Этот фактор определяет положение равновесного состояния . Второй фактор — это энергия активации взаимного превращения одного таутомера в другой. Этот фактор определяет скорость перегруппировки . Поскольку потенциальная энергия или стабильность соединения в значительной степени зависит от энергии его ковалентной связи, мы можем оценить относительную энергию кето- и енольных таутомеров, рассматривая связи, которые изменяются при перегруппировке. Из следующей диаграммы мы видим, что происходят только три значительных изменения, и стандартные энергии связи для этих изменений приведены справа от уравнения.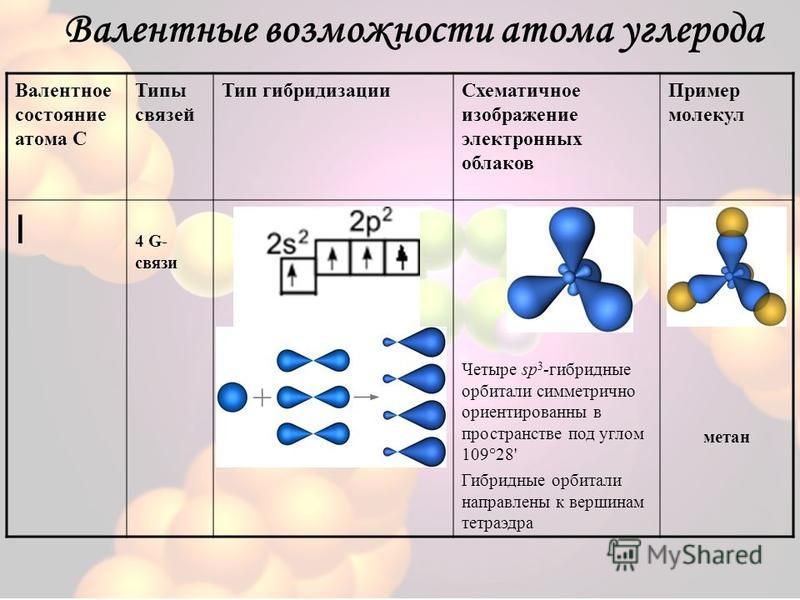 Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии.
Кето-таутомер имеет преимущество в энергии связи на 17,5 ккал/моль, поэтому ожидается его преобладание в равновесии.
Скорость, с которой происходит енол-кето-таутомеризация, свидетельствует о низкой энергии активации этого процесса. Мы отметили, что перегруппировка катализируется кислотой и основанием, и очень тщательные эксперименты показали, что взаимное превращение таутомеров происходит намного медленнее, если такие катализаторы отсутствуют. Ярким примером влияния энергии активации на такие превращения может служить следующая гипотетическая перегруппировка. Здесь мы заменили метильную группу (окрашенную темно-бордовым цветом) на протон обычной таутомерии, и метил переходит от кислорода к углероду точно так же, как протон переходит от енола к кетону.
H 2 C=CH-O-CH 3 –X– > CH 3 -CH 2 -CH=O
Изменение потенциальной энергии для этой перегруппировки даже более выгодно, чем для енол-кето-таутомерии, и оценивается более чем в 25 ккал/моль от изменения энергии связи.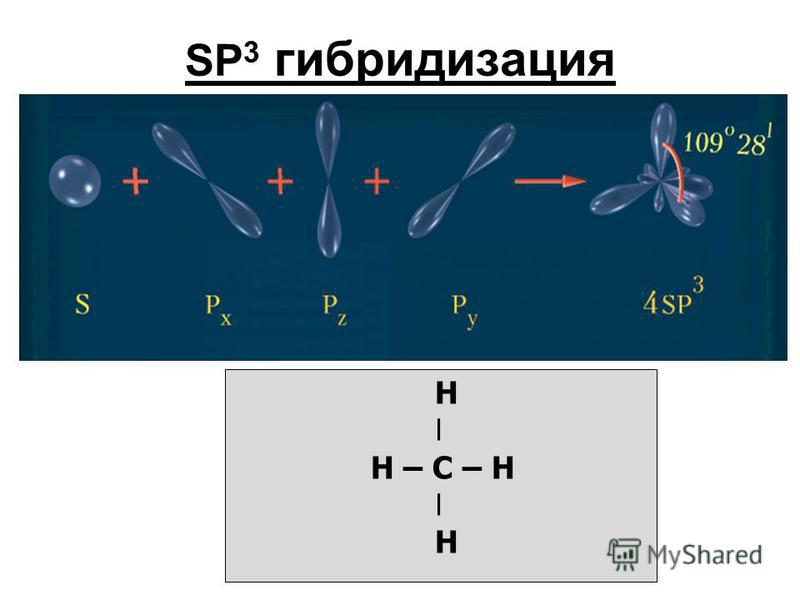 Несмотря на эту термодинамическую движущую силу, описанный выше эфир енола полностью устойчив к обработке основанием и подвергается быстрому кислотно-катализируемому гидролизу с потерей метанола, а не перегруппировке. Определяющим отличием в этом случае должна быть непозволительно высокая энергия активации для описанной перегруппировки в сочетании с альтернативными путями реакции с более низкой энергией.
Несмотря на эту термодинамическую движущую силу, описанный выше эфир енола полностью устойчив к обработке основанием и подвергается быстрому кислотно-катализируемому гидролизу с потерей метанола, а не перегруппировке. Определяющим отличием в этом случае должна быть непозволительно высокая энергия активации для описанной перегруппировки в сочетании с альтернативными путями реакции с более низкой энергией.
4. Реакции гидроборирования
Диборан легко реагирует с алкинами, но образование замещенных алкеновых продуктов оставляет открытой возможность второй реакции присоединения. Умный метод предотвращения этого события использует тот факт, что алкины обычно не страдают от стерических затруднений вблизи тройной связи (конфигурация этой функциональной группы линейна). Следовательно, большие или объемные электрофильные реагенты легко присоединяются к тройной связи, но получающийся в результате алкен обязательно более скучен или стерически затруднен и сопротивляется дальнейшему присоединению.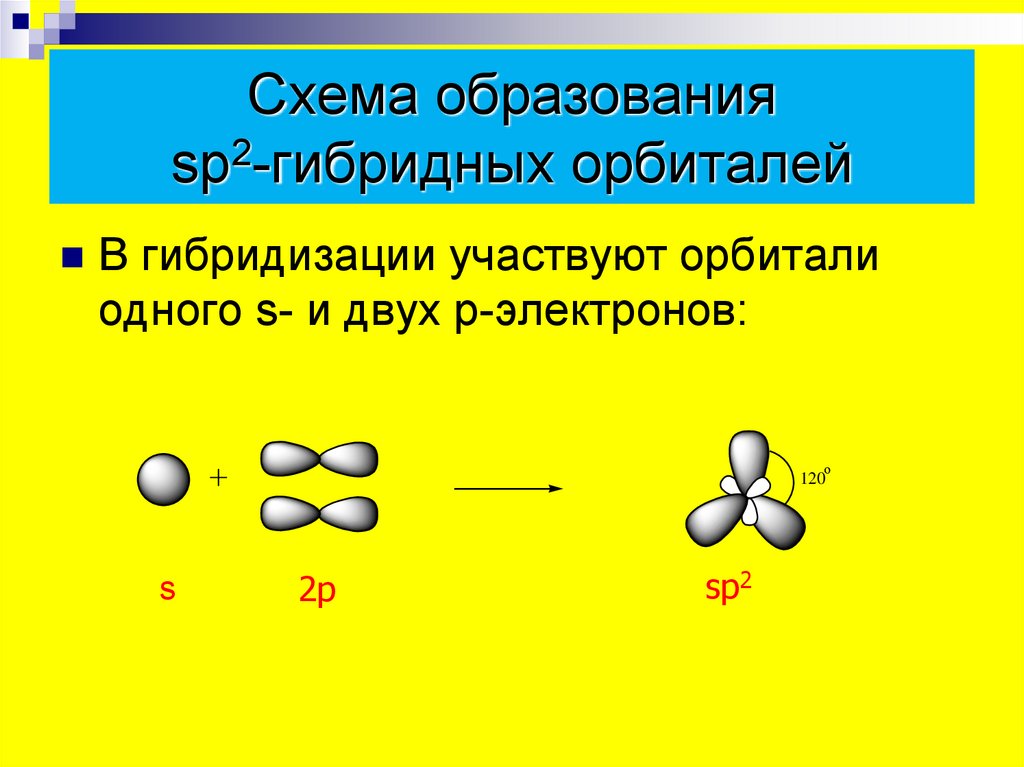 Объемный реагент гидроборирования, необходимый для этой стратегии, получают реакцией диборана с 2-метил-2-бутеном, сильно разветвленным алкеном. Из-за алкильного разветвления только два алкена присоединяются к BH 3 фрагмент (снова стерические затруднения), оставляя одну ковалентную связь BH доступной для реакции с алкином, как показано ниже. Полученный диалкилборан называется дисиамилбораном, сокращением от ди-вторичного изоамилборана (амил — это старое название пентила).
Объемный реагент гидроборирования, необходимый для этой стратегии, получают реакцией диборана с 2-метил-2-бутеном, сильно разветвленным алкеном. Из-за алкильного разветвления только два алкена присоединяются к BH 3 фрагмент (снова стерические затруднения), оставляя одну ковалентную связь BH доступной для реакции с алкином, как показано ниже. Полученный диалкилборан называется дисиамилбораном, сокращением от ди-вторичного изоамилборана (амил — это старое название пентила).
Важным применением дисиамилборана является его реакция присоединения к концевым алкинам. Как и в случае с алкенами, группа реагентов BH добавляется явно антимарковниковским образом из-за того, что электрофилом является бор, а не водород. Дальнейшее присоединение к образующемуся борзамещенному алкену не происходит, и обычное окислительное удаление бора щелочной перекисью водорода дает енол, который быстро перегруппировывается в альдегидный таутомер. Таким образом, при правильном выборе реагентов терминальные алкины могут быть превращены либо в метилкетоны (гидратация, катализируемая ионами ртути), либо в альдегиды (гидроборирование с последующим окислением).
Таким образом, при правильном выборе реагентов терминальные алкины могут быть превращены либо в метилкетоны (гидратация, катализируемая ионами ртути), либо в альдегиды (гидроборирование с последующим окислением).
Гидроборирование внутренних алкинов не является особенно полезной процедурой, поскольку часто будет получена смесь продуктов, если только тройная связь не замещена симметрично. Аналогичные результаты дает гидратация, катализируемая ионами ртути.
5. Окисления
Реакции алкинов с окислителями, такими как перманганат калия и озон, обычно приводят к разрыву тройной связи с образованием продуктов карбоновой кислоты.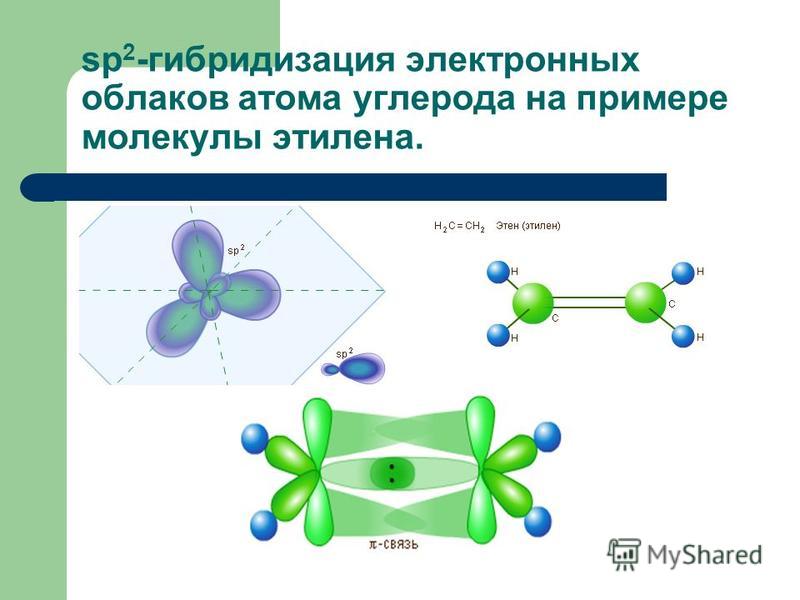 Общее уравнение для такого рода преобразования следует. Символ [O] часто используется в общем для обозначения окисления.
Общее уравнение для такого рода преобразования следует. Символ [O] часто используется в общем для обозначения окисления.
Реакции нуклеофильного присоединения и восстановление |
|---|
Реакции нуклеофильного присоединения и восстановление
Sp-гибридные атомы углерода тройной связи делают алкины более электрофильными, чем алкены с аналогичным замещением. В результате алкины иногда вступают в реакции присоединения, инициированные связыванием с нуклеофилом. Этот способ реакции, показанный ниже, обычно не проявляется для алкенов, если только двойная связь не активируется электроотрицательными заместителями, напр. F 2 C=CF 2 или путем сопряжения с электроноакцепторной группой.
 CH + HCN + NaCN (каталитический) —— > H 2 C=CH-CN
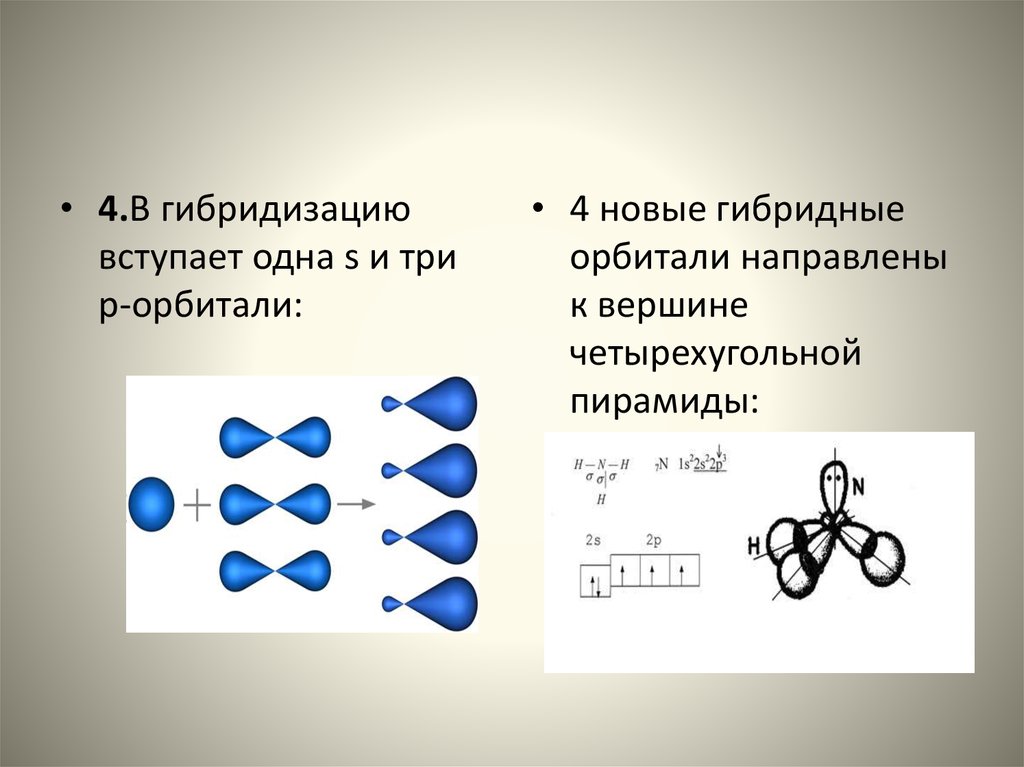
CH + HCN + NaCN (каталитический) —— > H 2 C=CH-CN Самым маленьким и наиболее реакционноспособным нуклеофильным веществом, вероятно, является электрон. Присоединение электрона к функциональной группе по определению является восстановлением, и мы отмечали ранее, что алкины восстанавливаются растворами натрия в жидком аммиаке до транс-алкенов. Чтобы понять, как происходит это восстановление, нам сначала нужно идентифицировать две различные реакции натрия с жидким аммиаком (температура кипения -78 ºC). В первом случае натрий растворяется в чистой жидкости с образованием темно-синего раствора, состоящего из очень подвижных и слабо связанных электронов вместе с сольватированными катионами натрия (первое уравнение ниже). В практических целях мы можем рассматривать такие растворы как источник «свободных электронов», которые можно использовать в качестве мощных восстановителей. Во втором случае соли трехвалентного железа катализируют реакцию натрия с аммиаком с выделением водорода и образованием бесцветной соли амида натрия (второе уравнение).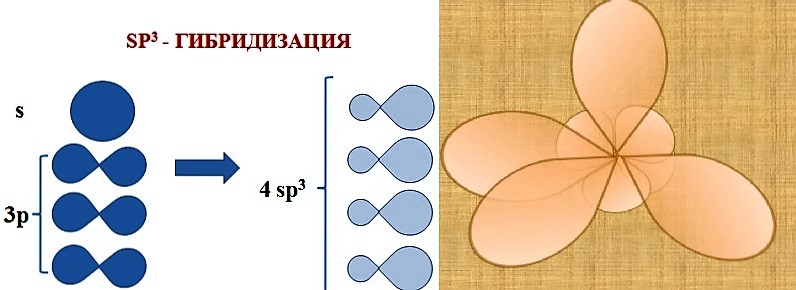 Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания.
Это аналогично реакции натрия с водой с образованием гидроксида натрия, но поскольку аммиак 10 18 раз слабее кислоты, чем вода, реакция менее бурная. Полезность этой реакции заключается в том, что амид натрия, NaNH 2 , является чрезвычайно сильным основанием (на 18 порядков сильнее, чем гидроксид натрия), которое можно использовать для превращения очень слабых кислот в сопряженные с ними основания.
| Na + NH 3 (жидкость, –78 ºC) —— > Na (+) + e (–) (синий раствор) | ||||
| Na + NH 3 (жидкость, –78 ºC) + Fe — —— > H 2 + NaNH 2 (бесцветный раствор) |
Кислотность терминальных алкинов |
|---|
Кислотность терминальных алкинов
Алканы, несомненно, являются самыми слабыми кислотами Бренстеда, обычно встречающимися в органической химии. Трудно измерить такие слабые кислоты, но по оценкам pK a этана составляет около 48. Гибридизация углерода с целью увеличения s-характера C-H увеличивает кислотность, при этом наибольшее изменение происходит для sp- Группы C-H обнаружены в терминальных алкинах. Таким образом, рК a этена оценивается в 44, а pK a этина (ацетилена) равно 25, что делает его кислотой в 10 23 раз более сильной, чем этан. Это увеличение кислотности позволяет выделить нерастворимые соли серебра и меди таких соединений.
Несмотря на резкое увеличение кислотности терминальных алкинов по сравнению с другими углеводородами, они все еще являются очень слабыми кислотами, особенно по сравнению с водой, которая примерно в миллиард раз более кислая.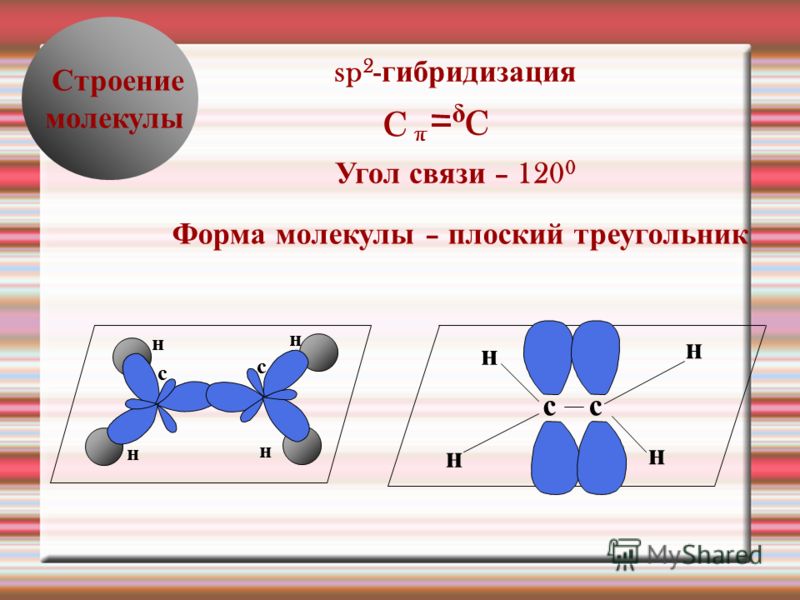 Если мы хотим получить нуклеофильные соли терминальных алкинов для использования в синтезе, поэтому необходимо будет использовать гораздо более сильное основание, чем гидроксидный (или этоксидный) анион. Таким основанием является амид натрия (NaNH 2 ), обсуждавшийся выше, и его реакции с концевыми алкинами можно проводить в жидком аммиаке или эфире в качестве растворителей. Продуктами этой кислотно-щелочной реакции являются аммиак и соль ацетилида натрия. Поскольку ацетилид-анион является мощным нуклеофилом, он может вытеснять ионы галогенидов из 1º-алкилгалогенидов с образованием более сильно замещенного алкина в качестве продукта (S N 2 реакции). Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
Если мы хотим получить нуклеофильные соли терминальных алкинов для использования в синтезе, поэтому необходимо будет использовать гораздо более сильное основание, чем гидроксидный (или этоксидный) анион. Таким основанием является амид натрия (NaNH 2 ), обсуждавшийся выше, и его реакции с концевыми алкинами можно проводить в жидком аммиаке или эфире в качестве растворителей. Продуктами этой кислотно-щелочной реакции являются аммиак и соль ацетилида натрия. Поскольку ацетилид-анион является мощным нуклеофилом, он может вытеснять ионы галогенидов из 1º-алкилгалогенидов с образованием более сильно замещенного алкина в качестве продукта (S N 2 реакции). Это приложение синтеза описано в следующих уравнениях. Первые два уравнения показывают, как ацетилен можно превратить в пропин; последние два уравнения представляют собой синтез 2-пентина из пропина.
| H-C≡C-H + NANH 2 (в аммиаке или эфире)-> H-C≡C-NA (ацетилид натрия) + NH 3 |
| H-C≡C-NA + CH 38-I -и-I -и -и -и -и -и- — > H-C≡C-CH 3 + NaI |
CH 3 -Cспеют -H + NANH 2 (в аммиаке или эфире) —> CH 3 -Cспеющих. -C титк -НА + C 2 H 5 -BR —— > CH 3 -C тит C 2 H 5 + NABR -C титк -НА + C 2 H 5 -BR —— > CH 3 -C тит C 2 H 5 + NABR |
Поскольку RC≡C: (–) Na (+) — очень сильное основание (примерно в миллиард раз сильнее, чем NaOH), его использование в качестве нуклеофила в реакциях S N 2 ограничено 1º-алкилгалогенидами; 2º и 3º-алкилгалогениды отщепляются по механизму Е2.
Повышенная кислотность терминальных алкинов по сравнению с алканами также приводит к реакциям металлообмена при обработке этих соединений литийорганическими реактивами или реактивами Гриньяра. Этот обмен, показанный ниже в уравнении 1, можно интерпретировать как кислотно-основную реакцию, которая, как и ожидалось, протекает в направлении более слабой кислоты и более слабого основания. Этот фактор явно ограничивает применимость реагентов Гриньяра или литиевых реагентов, когда присутствует концевая тройная связь, как в уравнении 2.
| 1) RC≡C-H + C 2 H 5 MgBr (in ether) —— > RC≡C-MgBr + C 2 H 6 |
| 2) HC≡C-CH 2 CH 2 BR+MG (в эфире)-> [HC≡C-CH 2 CH 2 MGBR]-> BRMGC®C-CH 2 CH 2 H |
Кислотность терминальных алкинов также играет роль в определении продукта, когда вицинальные (или геминальные) дигалогениды подвергаются реакциям бис-элиминирования, индуцированным основанием. Следующий пример иллюстрирует отщепление такого типа, исходя из 1,2-дибромпентана, полученного из 1-пентена добавлением брома. Первоначальное отщепление предположительно приводит к образованию 1-бром-1-пентена, поскольку следует отдавать предпочтение атаке основания на более кислый и менее затрудненный 1º-углерод. Затем второе удаление дает 1-пентин. Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.
Если используется очень сильное основание амид натрия, концевой алкин улавливается в виде его натриевой соли, из которой он может быть высвобожден при обработке слабой кислотой. Однако, если для элиминации используется более слабое основание KOH, концевая алкиновая соль не образуется или образуется обратимо, а первоначально образовавшийся 1-пентин перегруппировывается в более стабильный 2-пентин через промежуточное соединение аллена.


Leave A Comment