Пропандиол-1,2-ят натрия двузамещенный, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Спирты и фенолы | CHEMEGE.RU
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.
Строение, изомерия и гомологический ряд спиртов
Химические свойства спиртов
Способы получения спиртов
| Спирты – это гидроксисоединения, в которых группа ОН соединена с алифатическим углеводородным радикалом R-OH. Если гидроксогруппа ОН соединена с бензольным кольцом, то вещество относится к фенолам. |
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
По числу гидроксильных групп:
- одноатомные спирты — содержат одну группу -ОН. Общая формула CnH2n+1OH или CnH2n+2O.
- двухатомные — содержат две группы ОН. Общая формула CnH2n(OH)2 или CnH2n+2O2.
- трехатомные спирты — содержат три группы ОН. Общая формула CnH2n-1(OH)3 или CnH2n+2O3.
Двухатомные спирты с двумя и тремя гидроксогруппами у одного атома углерода R‒CH(OH)2 или R-C(OH)3 неустойчивы, от них легко отрывается вода и образуется карбонильное соединение.
Классификация по числу углеводородных радикалов у атома углерода при гидроксильной группе
- Первичные спирты – группа ОН соединена с первичным атомом углерода.
 Например, этанол СН3–СН2–ОН.
Например, этанол СН3–СН2–ОН. - Вторичные спирты – группа ОН соединена с вторичным атомом углерода. Например, пропанол-2: СН3–СН(СН3)–ОН.
- Третичные спирты – группа ОН соединена с третичным атомом углерода. Например, 2-метилпропанол-2: (СН3)3С–ОН.
- Метанол не относится ни к первичным, ни к вторичным, ни к третичным спиртам.
Классификация по строению углеводородного радикала
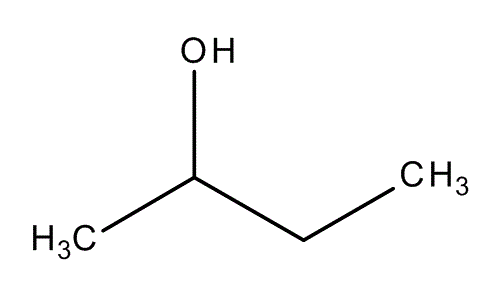
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.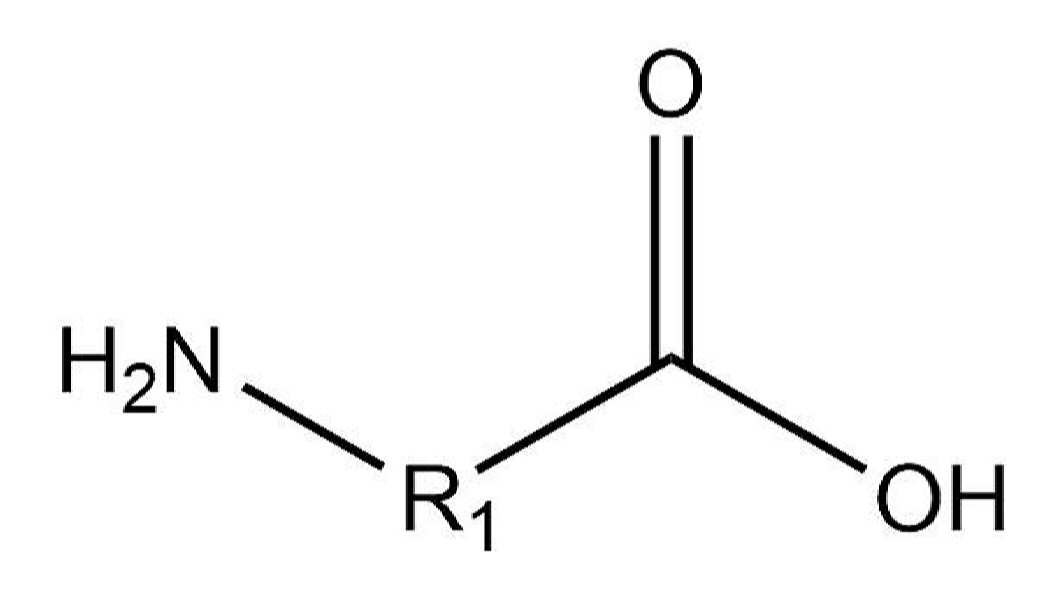
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
- По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
- По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т. д.
д.
- В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.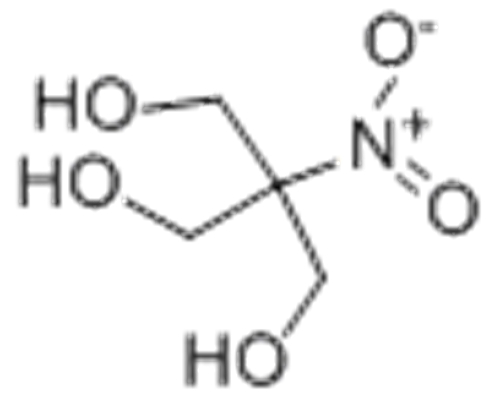
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства
Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
Например, этанол взаимодействует с калием с образованием этилата калия и водорода. |
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
| Кислотные свойства одноатомных спиртов уменьшаются в ряду: CH3OH > первичные спирты > вторичные спирты > третичные спирты |
Многоатомные спирты также реагируют с активными металлами:
Видеоопыт взаимодействия глицерина с натрием можно посмотреть здесь.
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).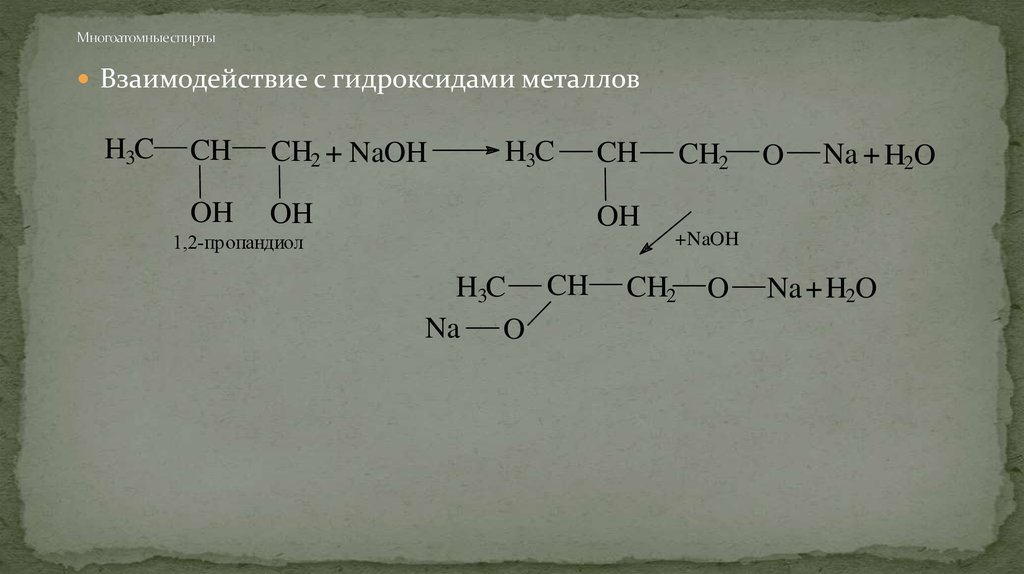
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
Видеоопыт взаимодействия этиленгликоля с гидроксидом меди (II) можно посмотреть здесь.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |
Видеоопыт взаимодействия этилового спирта с бромоводородом можно посмотреть здесь.
| Реакционная способность одноатомных спиртов в реакциях с галогеноводородами уменьшается в ряду: третичные > вторичные > первичные > CH3OH. |
Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.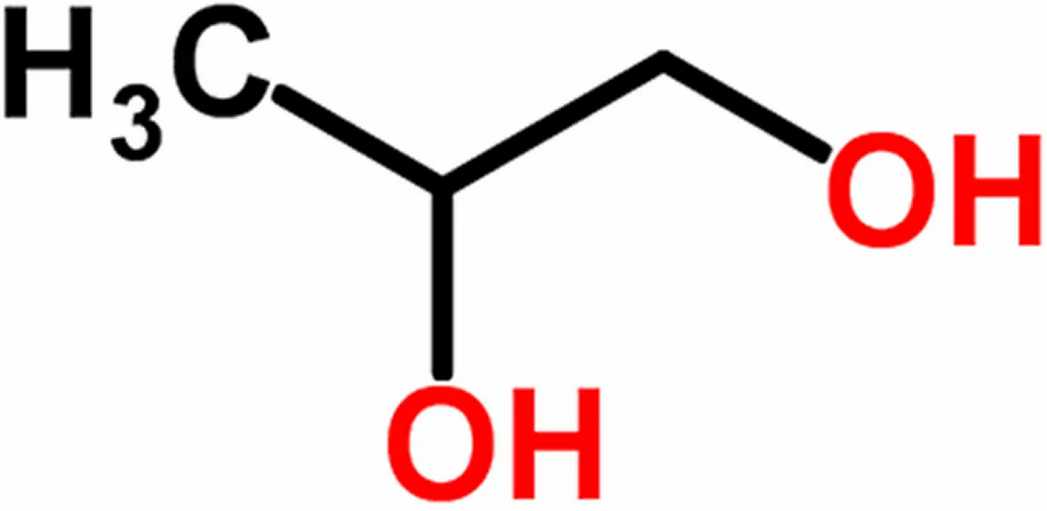
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат: |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.
 1. Внутримолекулярная дегидратация
1. Внутримолекулярная дегидратацияПри высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140оС из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140оС образуется диэтиловый эфир: |
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| При окислении первичных спиртов они последовательно превращаются сначала в альдегиды, а потом в карбоновые кислоты. Глубина окисления зависит от окислителя. Первичный спирт → альдегид → карбоновая кислота |
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
| Вторичные спирты окисляются в кетоны: вторичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол < первичные спирты < вторичные спирты < третичные спирты
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
Видеоопыт окисления этанола оксидом меди (II) можно посмотреть здесь.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |
Видеоопыт каталитического окисления этанола кислородом можно посмотреть здесь.
| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.
 4. Горение спиртов
4. Горение спиртовОбразуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2n+1ОН + 3n/2O2 → nCO2 + (n+1)H2O + Q
| Например, уравнение сгорания метанола: |
2CH3OH + 3O2 = 2CO2 + 4H2O
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
| Например, при дегидрировании этанола образуется этаналь |
| Например, при дегидрировании этиленгликоля образуется диальдегид (глиоксаль) |
1.
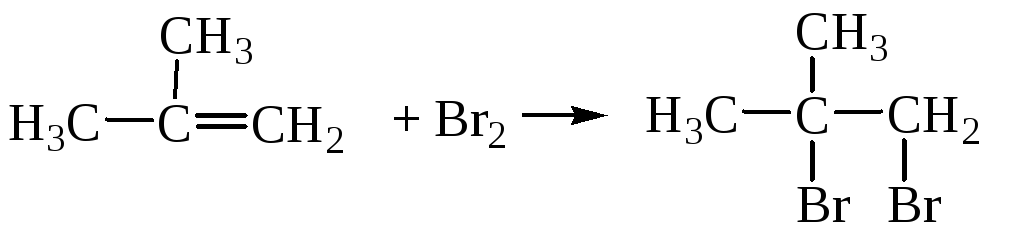 Щелочной гидролиз галогеналканов
Щелочной гидролиз галогеналкановПри взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
| Например, глицерин можно получить щелочным гидролизом 1,2,3-трихлорпропана: |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
| Например, при взаимодействии этилена с водой образуется этиловый спирт. |
Гидратация алкенов также протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
| Например, при взаимодействии пропилена с водой образуется преимущественно пропанол-2. |
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании этаналя образуется этанол |
| Например: при гидрировании ацетона образуется изопропанол |
| Например, гидрирование диальдегида – один из способов получения этиленгликоля |
4. Окисление алкенов холодным водным раствором перманганата калия
Алкены реагируют с водным раствором перманганата калия без нагревания. При этом образуются двухатомные спирты (гликоли).
При этом образуются двухатомные спирты (гликоли).
5. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
CO + 2H2 ⇄ CH3OH
6. Получение этанола спиртовым брожением глюкозы
Для глюкозы характерно ферментативное брожение, то есть распад молекул на части под действием ферментов. Один из вариантов — спиртовое брожение.
7. Гидролиз жиров – способ получения многоатомных спиртов
Под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например: при гидролизе тристеарата глицерина образуется глицерин и стеариновая кислота |
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.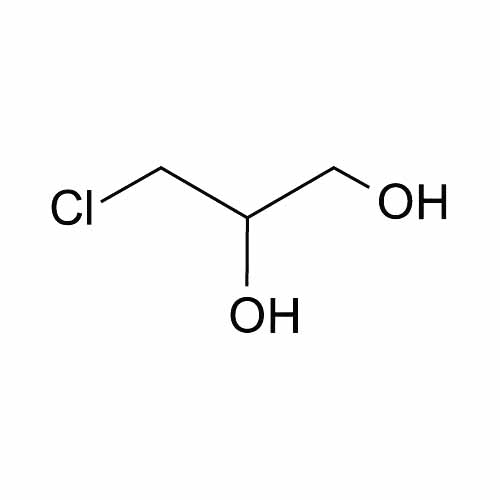
| Например: при щелочном гидролизе тристеарата глицерина образуется глицерин и соль стеариновой кислоты (стеарат) |
Понравилось это:
Нравится Загрузка…
1,2-пропандиол
1,2-пропандиол —
Наименования и идентификаторы| Name | 1,2-Propanediol |
| Synonyms | 1,2-Propanediol Propylene Glycol Propane-1,2-diol Propyledne glycol Propylene glycol 57-55-6 PROPYLENEGLYCOLTECHGRADE Propylene Гликоль, Реагент Пропиленгликоль Производитель ПРОПИЛЕНГЛИКОЛЬ, РЕАГЕНТ (ACS)ПРОПИЛЕНГЛИКОЛЬ, РЕАГЕНТ (ACS)ПРОПИЛЕНГЛИКОЛЬ, РЕАГЕНТ (ACS) |
| CAS | 57-55-6 123120-98-9 |
| EINECS | 200-338-0 |
| дюймов | Дюйм: 1S/C3H8O | дюймов | Dinhi: 1S/C3H8O |
| дюймов | Dinhi: 1S/C3H8O |
| дюйм | /CHORITIS/C3H8O |
| дюймов | .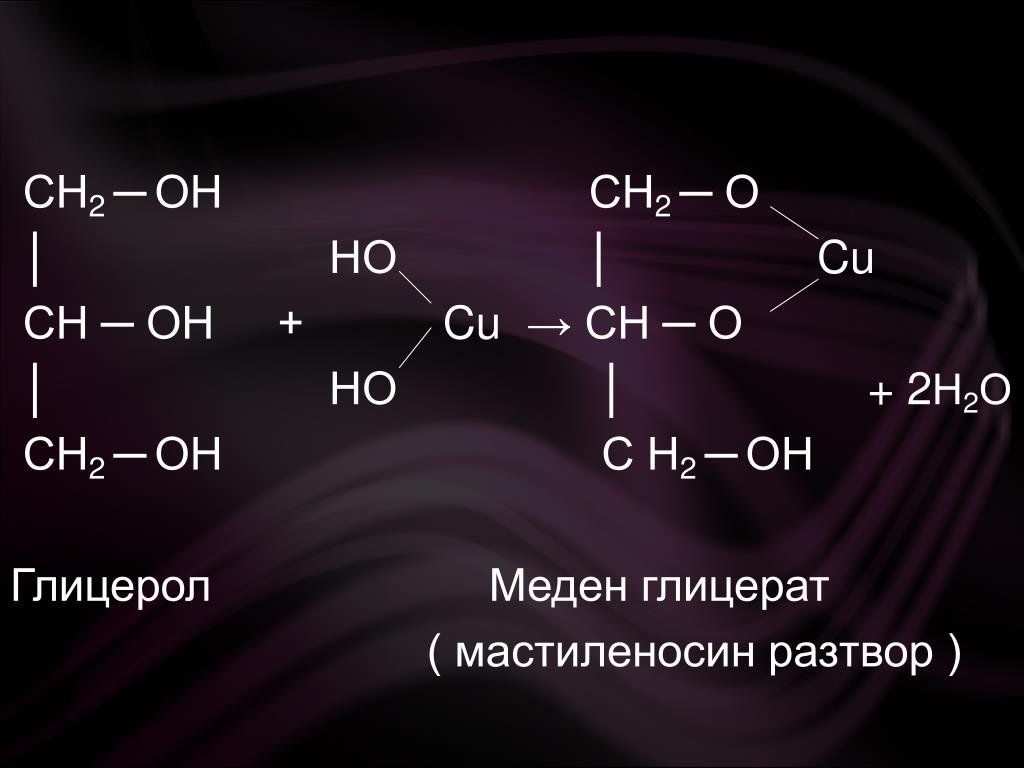 )2-4/х4-5Н,2х3,1х4 )2-4/х4-5Н,2х3,1х4 |
| ИнЧИКей | ДНИАПМСППВПВГФ-УХФФФАОЙСА-Н |
1,2-пропандиол — 90 000093 Физико-химические свойства
| Молекулярная формула | C3H8O2 | |
| Molar Mass | 76.09 | |
| Density | 1.036 g/mL at 25 °C (lit.) | |
| Melting Point | -60 °C (lit.) | |
| Boling Point | 187 °C (lit.) | |
| Specific Rotation(α) | n20/D 1.432 (lit.) | |
| Flash Point | 225°F | |
| JECFA Number | 925 | |
| Растворимость в воде | смешивается | |
| Растворимость | Смешивается с водой, ацетоном, этилацетатом и хлороформом, растворим в эфире. Он может растворяться во многих эфирных маслах, но не смешивается с петролейным эфиром, парафином и жиром. | |
| Парная препарата | 0,08 мм рт.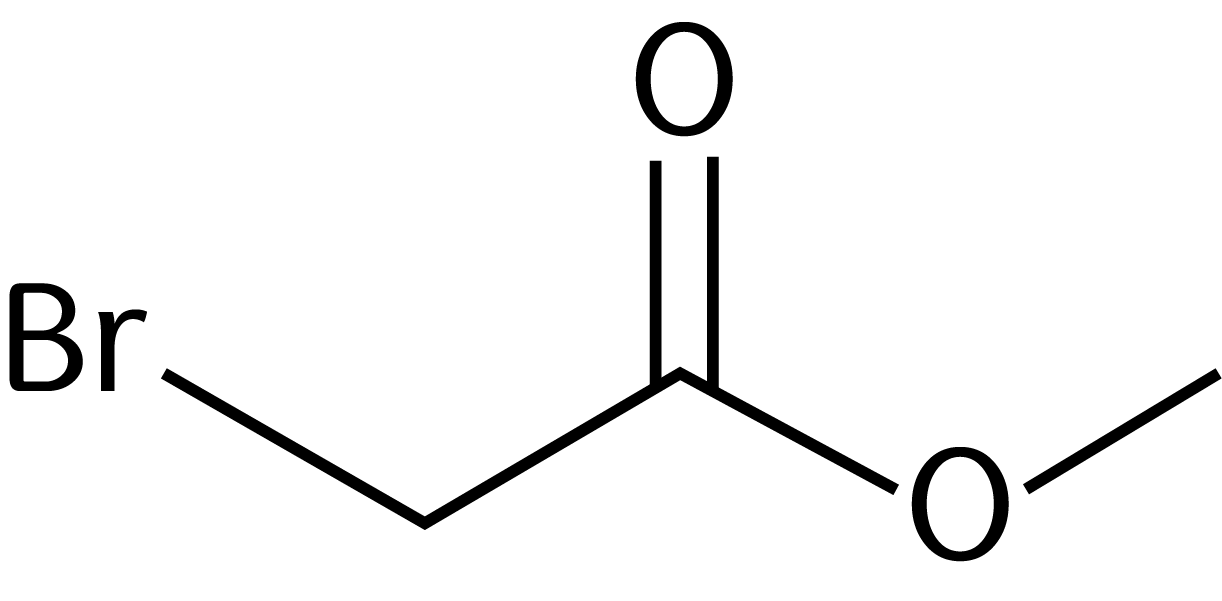 0010 0010 | 1.038 (20/20℃)1.036~1.040 |
| Color | APHA: ≤10 | |
| Merck | 14,7855 | |
| BRN | 1340498 | |
| pKa | 14.49± 0,20 (прогноз) | |
| PH | 6-8 (100 г/л, водяной столб, 20℃) | |
| Условия хранения | Хранить при температуре от +5°C до +30°C. | |
| Чувствительный | Гигроскопичный | |
| Взрывной лимит | 2,4-17,4%(v) | |
| Индекс преломления | N20/D 1,432 (горит.) | |
| MDL | MFCD00064272 | |
| Применение | Используется в качестве смолы, пластификатора, ПАВ, эмульгатора и деэмульгатора сырья, также может использоваться как антифриз и теплоноситель |
1,2-пропандиол —
| Описание безопасности | 24/25 — Избегайте контакта с кожей и глазами. | |
| WGK Германия | 1 | |
| RTECS | TY2000000 | |
| TSCA | Yes | |
| HS Code | 2 | 00 |
| Toxicity | LD50 orally in Rabbit: 19400 — 36000 mg/kg LD50 dermal Rabbit 20800 mg/kg |
1 ,2-пропандиол —
Upstream Downstream Industry| Сырье | Пропиленоксид Метиловый спирт Пропиленкарбонат |
| Продукты вниз по течению | 1,2-пропанедиол |
1,2-пропанедиол-
Справочник| Ссылка Показывает больше | 1.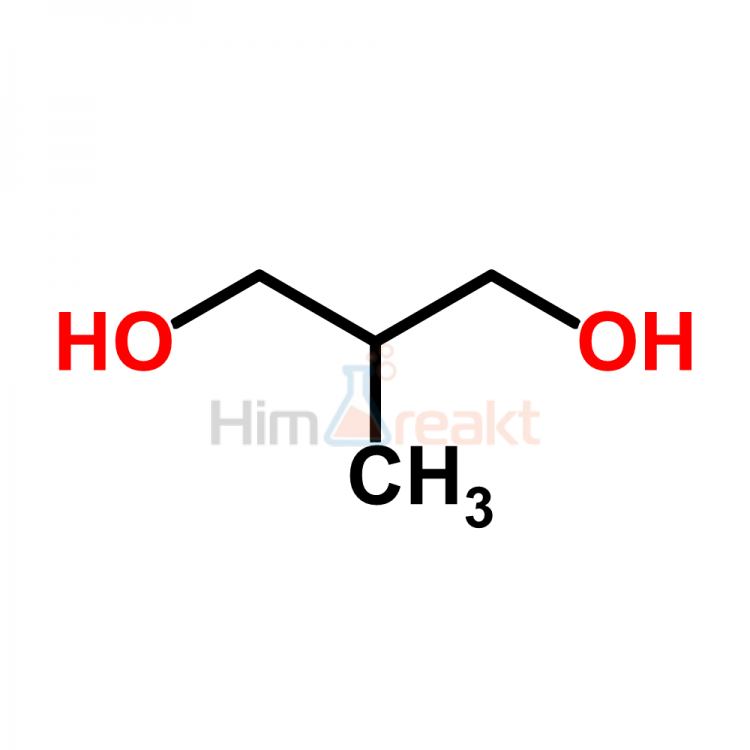 yang, Qing. «Разработка наноэмульсий, содержащих сулконазол, для усиления трансдермального проникновения и противогрибковой активности». Международный журнал наномедицины 14 (2019): 3955. https://dx.doi.org/10.2147%2FIJN.S206657 yang, Qing. «Разработка наноэмульсий, содержащих сулконазол, для усиления трансдермального проникновения и противогрибковой активности». Международный журнал наномедицины 14 (2019): 3955. https://dx.doi.org/10.2147%2FIJN.S206657 2. Cheng, Qi-Bin, and Li-Wei Zhang. «Высокоэффективный ферментативный препарат даидзеина в глубоких эвтектических растворителях». Молекулы 22.1 (2017 г.): 186. https://doi.org/10.3390/molecules22010186 3. [IF=4,411] Qi-Bin Cheng et al. «Высокоэффективное ферментативное получение даидзеина в растворителях глубокой эвтектики». Molecules. 2017 Jan;22(1):186 4. [IF=6,953] Xi Yang et al. «Структурирование эмульсии масло-в-воде путем образования комплексов яичного желтка/альгината: их потенциальное применение при изготовлении майонезоподобной эмульсии с низким содержанием жира» гели и редиспергируемые твердые эмульсии». Int J Biol Macromol. 2020 Mar;147:595 5. [IF=6,321] Chuanqi Wang et al. «Наноэмульсия и нанокристаллы дазатиниба для улучшенной пероральной доставки лекарств».  Фармацевтика. 2022 янв;14(1):197 Фармацевтика. 2022 янв;14(1):197 6. [IF = 5,875] Yutong Wang et al. «Фосфолипидный комплекс/собственно-микроэмульсия на основе оливкового масла первого отжима усиливает пероральное всасывание сальвианоловой кислоты B за счет ингибирования метаболизма, опосредованного катехол-O-метилтрансферазой». Int J Pharmaceut . 2022 Jan;611:121330 |
1,2-пропандиол —
Nature бесцветная вязкая стабильная абсорбирующая жидкость, почти без вкуса, без запаха, легковоспламеняющаяся, малотоксичная. Смешивается с водой, этанолом и различными органическими растворителями. Температура кипения 187,3°С. Температура плавления -60°С. Относительная плотность составила 1,0381. Показатель преломления 4326. Поверхностное натяжение (20 градусов С) 38мНм. Вязкость (20 ℃) 60. 5мПа-с. Удельная теплоемкость (20°С) 2,49содержание (:3 давление 0 2 не менее 99,5%). Метод некаталитического гидролиза под давлением.Из пропиленоксида и воды при температуре 150 N160 ℃, давлении 0,78~0,98 МПа, прямая гидратация продукта реакции выпариванием, перегонкой для получения готового продукта.
Последнее обновление:2022-01-01 10:34:37
1,2-пропандиол —
Характеристика- Этот продукт представляет собой бесцветную прозрачную вязкую жидкость; без запаха; С гигроскопичностью.
- Этот продукт свободно смешивается с водой, этанолом или метаном.
относительная плотность
Относительная плотность этого продукта (общее правило 0601) должна быть 1,035~1,037 при 25°C.
показатель преломления
Показатель преломления данного продукта (Общие правила 0 6 2 2 ) должен составлять 1,431~1,433.
Последнее обновление:2022-01-01 11:21:36
1,2-пропандиол —
Введение Слегка пряный.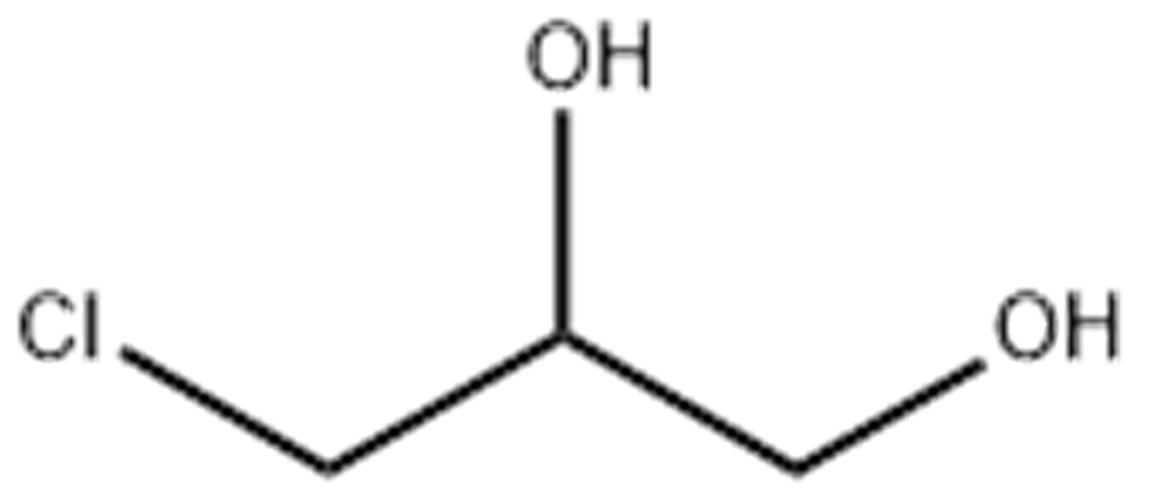 Он легко впитывает влагу и стабилен при нормальных условиях, но легко производит пропионовый альдегид, молочную кислоту, пируват и уксусную кислоту при высоких температурах. Смешивается с водой, ацетоном и хлороформом, растворим в эфире. Средняя смертельная доза (для крыс, перорально) составляет 25 мл/кг.
Он легко впитывает влагу и стабилен при нормальных условиях, но легко производит пропионовый альдегид, молочную кислоту, пируват и уксусную кислоту при высоких температурах. Смешивается с водой, ацетоном и хлороформом, растворим в эфире. Средняя смертельная доза (для крыс, перорально) составляет 25 мл/кг.
Последнее обновление:2022-10-16 17:26:29
1,2-пропандиол —
Использованиеявляется сырьем для ненасыщенной полиэфирной смолы, эпоксидной смолы, полиуретановой смолы, а также сырьем для пластификатора. , ПАВ, эмульгатор и деэмульгатор. В пищевой промышленности и т.п. он используется в качестве растворителя ароматизатора, пищевого пигмента, смачивателя табака, фунгицида и консерванта для созревания фруктов, фармацевтического эксципиента и т.п. Может также использоваться в качестве антифриза, теплоносителя и смазки для пищевого оборудования.
Последнее обновление:2022-01-01 10:34:36
1,2-пропандиол —
Дифференциальный диагноз- в хроматограмме, записанной под пунктом определения содержания, время удерживания основного пика теста раствора должно соответствовать времени удерживания основного пика эталонного раствора.

- Спектр инфракрасного поглощения этого продукта должен соответствовать спектру контроля (набор спектров 706) (общий номер 0402).
Последнее обновление:2022-01-01 11:21:36
1,2-пропандиол —
Безопасность- токсичность и раздражение очень малы, жертв пока не обнаружено. Крысам вводили внутривенно и внутрибрюшинно LD50 7000 ~ 8000 мг/кг и перорально LD502800 мг/кг. Однако также сообщалось, что при добавлении его в пищу и напитки в слишком высоких дозах существует риск вызвать смертельный сон и расстройство почек.
- , хотя этот продукт не самовозгорается, он горюч. При длительном хранении не испортится, но проем впитает влагу. Емкости для хранения и транспортировки должны быть изготовлены из бочек из оцинкованного железа, алюминия или нержавеющей стали. Согласно общим положениям о хранении и транспортировке малотоксичных химических веществ.
Последнее обновление:2022-01-01 10:34:37
1,2-пропандиол —
Экзаменкислотность
принимать этот продукт 10.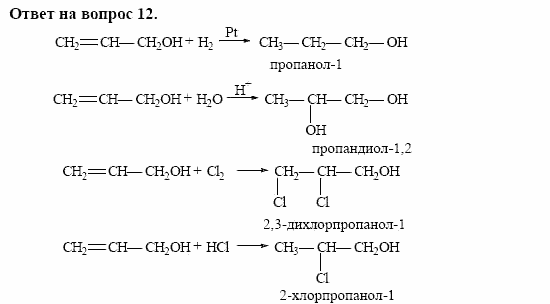 0мл, после добавления 50мл свежей кипяченой холодной воды для растворения, добавить 3 капли индикаторного раствора бромтимолового синего, титруйте титровальным раствором гидроксида натрия (0,01 моль/л) до тех пор, пока раствор не станет синим, расход титрового раствора гидроксида натрия (0,01 моль/л) не должен превышать объем 0,5 мл.
0мл, после добавления 50мл свежей кипяченой холодной воды для растворения, добавить 3 капли индикаторного раствора бромтимолового синего, титруйте титровальным раствором гидроксида натрия (0,01 моль/л) до тех пор, пока раствор не станет синим, расход титрового раствора гидроксида натрия (0,01 моль/л) не должен превышать объем 0,5 мл.
оксид
взять 1.0 этого товара и проверить его по закону (общее правило 0801). По сравнению с контрольным раствором, приготовленным из стандартного раствора оксида натрия 7,0 мл, он не должен быть глубже (0-0,007%).
сульфат
взять этот продукт 5. 0 мл, проверить по закону (общее правило 0802), и стандартный раствор сульфата калия 3. По сравнению с контрольным раствором, приготовленным из 0 М л, он не должен быть глубже (0, 006% )
окисляющее вещество
Возьмите 5,0 этого продукта, поместите его в бутылку с йодом, добавьте 1,5 М раствора йодистого калия и разбавленную серную кислоту 2 мл, закройте, поместите в темное место на 15 минут, добавьте 2 мл раствором индикатора крахмала, если синий, титруйте раствором для титрования тиосульфата натрия (0,005 моль/л) до исчезновения синевы, расход раствора для титрования тиосульфата натрия (0,0,005 моль/л) не должен превышать объем 0,2 мл.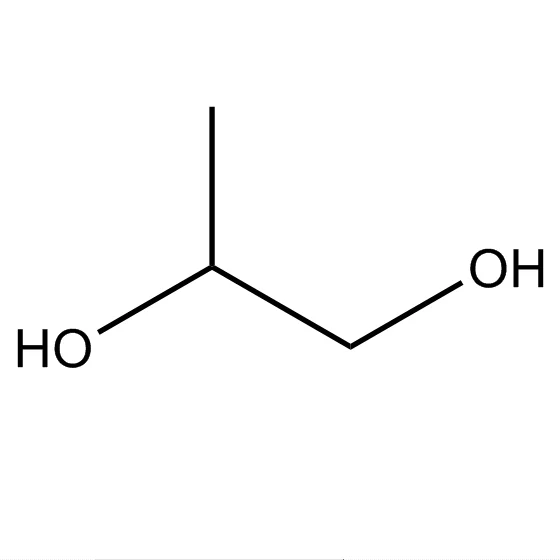
восстанавливающее вещество
взять этот продукт 1. Om↑, добавить тестовый раствор аммиака, 1 мл л, нагревать в бане с температурой 60fC в течение 5 минут, раствор не должен быть желтым; Быстро добавить тестовый раствор нитрата серебра 0,15 мл, встряхнуть, оставить на 5 минут, раствор не должен измениться.
Сопутствующие вещества
берут нужное количество этого продукта, точно взвешивают, разбавляют абсолютным этанолом, чтобы сделать каждую л ч л раствора, содержащего 0,5 г пропиленгликоля, в качестве испытуемого раствора; В качестве эталонного раствора готовили еще одну прецизионную взвешивание диэтиленгликоля (диэтиленгликоля), дипропиленгликоля, трипропиленгликоля и эталона оксида пропилена, разбавленного абсолютным этанолом, смешанный раствор, содержащий 5 тонн, 5 0, 10 и 5 мг на 1 мл л. Испытание по газовой хроматографии (Общее правило 0 5 2 1). В качестве стационарной жидкости использовали полиэтиленгликоль 20 М, начальную температуру 80°С, температуру поддерживали в течение 3 минут и повышали до 2 20 со скоростью 15°С в минуту. 0, выдерживают 4 минуты, температура на входе пробы 230°С, температура детектора 25°С*0, разделение пиков каждого компонента должно соответствовать требованиям. В газовый хроматограф вводят Б л испытуемого раствора и эталонного раствора и рассчитывают площадь пика по методу внешнего стандарта. Содержание диэтиленгликоля (диэтиленгликоля) не должно превышать 0,001’» — содержание дипропиленгликоля не должно превышать 0,1 %; Содержание трипропиленгликоля не должно превышать 0,03%, содержание оксида пропилена не должно превышать 0,001%.
0, выдерживают 4 минуты, температура на входе пробы 230°С, температура детектора 25°С*0, разделение пиков каждого компонента должно соответствовать требованиям. В газовый хроматограф вводят Б л испытуемого раствора и эталонного раствора и рассчитывают площадь пика по методу внешнего стандарта. Содержание диэтиленгликоля (диэтиленгликоля) не должно превышать 0,001’» — содержание дипропиленгликоля не должно превышать 0,1 %; Содержание трипропиленгликоля не должно превышать 0,03%, содержание оксида пропилена не должно превышать 0,001%.
влажность
берут соответствующее количество этого продукта, в соответствии с методом определения влажности (общее правило 0832 первый метод 1), содержание воды не должно превышать 0,2%.
остаток воспламенения
взять 50г этого продукта, нагреть до сгорания, то есть остановить нагрев, произвести естественное сгорание до тысячи, сжечь до постоянного веса при 700~800aC, а остаток не должен пройти 2.5мг.
Тяжелые металлы
взять 4,0 М л этого продукта, добавить воду 1 9 М л и ацетатный буфер (p H 3,5) 2 М л, смешать, проверить в соответствии с законом (Общие принципы 0821 первый закон), содержание тяжелых металлов не должно превышать 5 частей за миллион.
мышьяковая соль
взять этот продукт л .0 г, добавить 5М хлористоводородной кислоты л и воды 23мл, встряхнуть, проверить в соответствии с законом (общее правило 0822), должны соблюдаться положения (0,0002%).
Последнее обновление:2022-01-01 11:21:37
1,2-пропандиол —
Определение содержанияизмерено с помощью газовой хроматографии (общие 0521).
хроматографические условия и тест на пригодность системы
с полиэтиленгликолем 20m в качестве стационарной фазы; Начальная температура 1 3 0°С, 1 мин, скорость нагрева 1(ТС до 240°С, 1 мин, температура на входе 230°С, температура детектора 250°С. Число теоретических тарелок не указано. менее 10 000 в пересчете на пик 1,2-пропандиола
анализ
взять этот продукт, точно взвесить, разбавить безводным брожением, чтобы сделать раствор, содержащий около 1 мг г на 1 мл л, взять точность л пл и ввести его в человеческий газовый хроматограф, записать хроматограмму; другое эталонное вещество 1,2-пропандиола определяли тем же методом и рассчитывали по площади пика в соответствии с методом внешнего стандарта.
Последнее обновление:2022-01-01 11:21:38
1,2-пропандиол —
Справочная информация| Дата обновления: | 12.11.2022 10:05:38 | ||||
| FEMA | 2940 | ПРОПИЛЕНГЛИКОЛЬ | ||||
| Химическая информация NIST | информация предоставлена: webbook.nist.gov (внешняя ссылка) | ||||
| Информация о химическом веществе EPA | информация предоставлена: ofmpeb.epa.epa.gov 8010 | Свойства и применение | пропиленгликоль обладает хорошей растворимостью, меньшей токсичностью и раздражением и широко используется в качестве инъекций (таких как внутримышечные инъекции, растворители, растворители для экстракции и консерванты для неинъекционных фармацевтических препаратов (например, пероральные жидкости, Офтальмологические препараты, ушные препараты, стоматологические препараты, ректовагинальные препараты, трансдермальные препараты и т. д.), является лучшим растворителем, чем глицерин, может растворять многие вещества, такие как кортикостероиды (половые гормоны), хлорамфеникол, сульфаниламиды, барбитураты, резерпин, хинидин, дегидрокортикостерона ацетат , сульфат тетрагидропальматина, гидрохлорид хлорамбуцила, витамин А, витамин D, многие эфирные масла, большинство алкалоидов и многие местные анестетики. пропиленгликоль подобен этанолу в качестве бактериостатического агента, а эффективность ингибирования плесени аналогична эффективности глицерина, которая немного ниже, чем у этанола. Пропиленгликоль обычно используется в качестве пластификатора для водных материалов пленочных покрытий. Такое же количество жидкости, смешанной с водой, может задержать гидролиз некоторых лекарств и повысить стабильность продукта препарата. 15% ~ 30% раствор пропиленгликоля, полутвердые препараты можно использовать в качестве антибактериальных консервантов, около 15% препаратов для местного применения на основе пропиленгликоля можно использовать в качестве увлажнителей, 10% ~ 30% аэрозольный растворитель пропиленгликоля, от 10% до 25% пропилена пероральный раствор гликоля, от 10% до 60% препарата для инъекций и от 5% до 80% препарата для местного применения используются в качестве растворителей и сорастворителей. [стабильность и условия хранения] очень стабилен при комнатной температуре, но при высокой температуре (выше 280°C) в открытом виде подвергается окислению; Смешанный с 95% этанолом или водой, с химической стабильностью; Можно автоклавировать или фильтровать стерилизации.  Пропиленгликоль, обладающий гигроскопичностью, следует хранить в прохладном и сухом месте, в закрытой темной таре. Пропиленгликоль, обладающий гигроскопичностью, следует хранить в прохладном и сухом месте, в закрытой темной таре. [несовместимость] Несовместимость с некоторыми окислителями (такими как перманганат калия). Эта информация была отредактирована Тонгом (2015-10-17). | ||
| анализ содержания | образец объемом 10 мкл вводили в газовый хроматограф с детектором по теплопроводности. Колонка представляла собой колонку из нержавеющей стали размером 1 м x 6,35 мм, набивка представляла собой полиэтиленгликоль 20 м (соединение Carbowax 20 м), 4%, а носитель представлял собой политетрафторэтилен с ситом 40/60 (Chromosorb T) или аналогичный материал. В качестве газа-носителя использовался гелий, скорость потока составляла 75 мл/мин. Температура отбора проб 240 ℃; Температура колонки 120~200 ℃, повышение температуры 5 ℃/мин; Конечная температура составляет 250 ℃. В указанных условиях время удерживания пропиленгликоля составляет около 5,7 мин, а время удерживания трех изомеров дипропиленгликоля составляет 8,2, 9 мин. 0,0 и 10,2 мин соответственно. Площади всех пиков определяли любым подходящим способом, рассчитывали процент площади пропиленгликоля и переводили в массовый процент. 0,0 и 10,2 мин соответственно. Площади всех пиков определяли любым подходящим способом, рассчитывали процент площади пропиленгликоля и переводили в массовый процент. | ||||
| токсичность | .ФАО/ВОЗ (2000): ДСП 0~25 мг/кг. LD5022 ~ 23,9 мг/кг (мыши, внутрь). GRAS (FDA, § 184.1666, 2000). | ||||
| предел использования | ФАО/ВОЗ (1984): Сыр Шеннон, 5 г/кг (отдельно или в сочетании с другими носителями и стабилизаторами) сливочной смеси. Япония (1998): сырая лапша, сырые начинки, копчености из каракатиц меньше или равно 2%; Кожура цзяоцзы, жареной пшеницы, блинчиков с начинкой, сыромятной кожи и т. д. меньше или равна 1,2%; Другая пища меньше или равна 0,6%. GB 2760~96: пирожные 3,0 г/кг, жевательная резинка FDA, § 184.1666 (2000): Алкогольные напитки 5%; Кондитерские изделия и глазурь 24%; Замороженные молочные продукты 2,5%; Ароматизаторы, ароматизаторы, 97%; Фрукты и орехи 5%; Другая еда 2,0%. | ||||
| Использование | в качестве сырья для смол, пластификаторов, поверхностно-активных веществ, эмульгаторов и деэмульгаторов, также может использоваться в качестве антифриза и теплоносителя используется в качестве стационарной жидкости для ГХ, растворителя, антифриза, пластификатора и дегидратирующего агента.  растворитель-носитель; Смачивающий агент; Увлажнитель; агент против слеживания; антиоксидант; Улучшитель тканей; поверхностно-активные вещества; стабилизаторы; загустители; кондиционеры для теста; Эмульгаторы; Ароматизаторы; вспомогательные вещества; Средства обработки. GB 2760~96 классифицируется как пищевая добавка. В основном используется в различных специях, пигментах, консервантах, растворителях, ванильных бобах, жареных кофейных зернах, растворителе для экстракции натурального аромата. Конфеты, хлеб, упаковка мяса, сыра и другие увлажняющие, смягчающие средства. Может также использоваться в качестве лапши, начинки сердцевины добавок против плесени. В молоко добавить 0,006%, можно сделать нагревание того же вкуса, из белого и блестящего упаковки тофу, жареного расширения объема. пропиленгликоль является промежуточным продуктом фунгицида дифеноконазола. в качестве растворителя, консерванты, пигменты, антиоксиданты и другие пищевые добавки, нерастворимые в воде, могут быть растворены в нем, а затем добавлены в пищу, он оказывает увлажняющее и антифризное действие на пищу.  Правила Китая могут быть использованы для тортов, максимальное использование 3,0 г/кг. Пропиленгликоль Правила Китая могут быть использованы для тортов, максимальное использование 3,0 г/кг. Пропиленгликоль является важным сырьем для ненасыщенного полиэфира, эпоксидной смолы и полиуретановой смолы, и дозировка в этой области составляет около 45% от общего потребления пропиленгликоля. Этот ненасыщенный полиэфир широко используется в поверхностных покрытиях и армированных пластмассах. Пропиленгликоль обладает хорошей вязкостью и гигроскопичностью, нетоксичен, поэтому широко используется в качестве гигроскопического агента, антифриза, смазки и растворителя в пищевой, фармацевтической и косметической промышленности. В пищевой промышленности пропиленгликоль реагирует с жирными кислотами с образованием сложных эфиров пропиленгликоля и жирных кислот, которые в основном используются в качестве пищевых эмульгаторов. Пропиленгликоль — отличный растворитель для приправ и пигментов. Пропиленгликоль в фармацевтической промышленности часто используется для производства всех видов мазей, растворителей мазей, смягчителей и наполнителей, благодаря тому, что пропиленгликоль и все виды специй обладают хорошей взаимной растворимостью, поэтому также используются в качестве растворителей и смягчителей косметики и т.  д. Пропилен Гликоль также используется в качестве растворителя для увлажнителей табака, средств защиты от плесени, смазочных материалов для оборудования пищевой промышленности и чернил для маркировки пищевых продуктов. Водный раствор пропиленгликоля является эффективным антифризом. д. Пропилен Гликоль также используется в качестве растворителя для увлажнителей табака, средств защиты от плесени, смазочных материалов для оборудования пищевой промышленности и чернил для маркировки пищевых продуктов. Водный раствор пропиленгликоля является эффективным антифризом. в качестве носителя лекарственного средства, гранулированного лекарственного средства. Его можно использовать в качестве увлажнителя, смягчителя, растворителя и т. д. в косметике. Табачная промышленность может использоваться в качестве ароматизатора табака, увлажняющих агентов для табака, консервантов и т. д. В пищевой промышленности он используется в качестве растворителя для ароматизатора, пищевого пигмента, смягчителя упаковки пищевых продуктов, антиадгезивного агента и т. д. Также может использоваться для производства ненасыщенной полиэфирной смолы, пластификатора пластика, дегидратирующего агента, поверхностно-активного вещества, отвердителя, связующего сырья. Может также использоваться в красках, пестицидах, покрытиях и других отраслях промышленности авиационные противообледенительные жидкости, хладагенты и антифризы, пищевые продукты и специи, ароматизаторы, косметика и средства личной гигиены, теплоносители, гидравлические и тормозные жидкости, краски и покрытия, корма для животных, фармацевтические препараты, полиуретан, ненасыщенный полиэстер смола и др.  Растворители органического синтеза, антифризы, пластификаторы, бактерициды. Стандарт для газохроматографического анализа. Газовая хроматография стационарная жидкостная (наивысшая температура 150 град С, растворитель хлороформ), разделение и анализ спиртов, эфиров и кетонов. | ||||
| метод производства | 1. Метод прямой гидратации оксида пропилена представляет собой метод некаталитического гидролиза под давлением. Из окиси пропилена и воды при температуре 150-160 ℃, давлении 0,78-0,98 МПа проводят непосредственную гидратацию продукта реакции выпариванием, перегонкой до получения готового продукта. 2. Косвенная гидратация оксида пропилена получается путем косвенной гидратации оксида пропилена и воды с серной кислотой в качестве катализатора. 3. Прямое каталитическое окисление пропилена. можно получить гидролизом окиси пропилена: Ch4CHCh3 + h3O[H +]→ Ch4CH(OH)Ch3OH прямой гидратацией окиси пропилена и воды при мольном соотношении ингредиентов 1:15, реакцию проводили при 150~200 ℃ и 1,2 ~ 1,4 МПа в течение 30 мин с получением водного раствора, содержащего 16% пропиленгликоля, и продукт был получен путем испарительной перегонки.  Реакцию каталитического гидролиза проводят при катализе серной кислотой или соляной кислотой. 10% ~ 15% разбавленной серной кислоты добавляют к 0,5% ~ 1,0% водному раствору пропиленоксида, гидролиз проводят при 50~70 ℃; Гидролизат нейтрализуют, концентрируют при пониженном давлении и очищают до получения готового продукта. Реакцию каталитического гидролиза проводят при катализе серной кислотой или соляной кислотой. 10% ~ 15% разбавленной серной кислоты добавляют к 0,5% ~ 1,0% водному раствору пропиленоксида, гидролиз проводят при 50~70 ℃; Гидролизат нейтрализуют, концентрируют при пониженном давлении и очищают до получения готового продукта. Способ получения – гидролиз оксида пропилена до пропиленгликоля, который можно проводить в жидкой фазе. В промышленности существуют каталитические и некаталитические методы. Каталитический метод представляет собой гидролиз в присутствии 0,5% ~ 1% серной кислоты при 50~70°С. Нет каталитического метода при высокотемпературном давлении (150 ~ 300 ℃, 980 ~ 2940 кПа), отечественное производство этого метода. 1-хлор-2-пропанол получают реакцией пропилена с хлорной водой, которую получают гидролизом раствором карбоната натрия. В результате окисления пропана до оксида пропилена, а затем гидролиза соляной кислоты. | ||||
| категория | легковоспламеняющаяся жидкость | ||||
| степень токсичности | низкая токсичность | ||||
| Острая токсичность | : орально-крыса 2 LD 050; Орально-мышь LD50: 32000 мг/кг | ||||
| данные стимуляции | глаз-кролик 100 мг слабый | ||||
| характеристики взрывоопасности | взрывоопасность при смешивании с воздухом | характеристики опасностивоспламеняемость; Стимул для сжигания дым | |||
| Характеристики хранения и транспорта | Вентиляция склада и низкотемпературная сушка | ||||
| Ednatingwoversing Agent | Сухой порошок, пенопласта, песок | ||||
| ТЕМПЛАТНА СПОНТА | 9009|||||
| Спонтная температура сгорания | 9009 100010|||||
| ТЕМПЛЕКТА СПОНТА | 9009 100010 100010 100010 100010 100010|||||
Спонтная температура. | |||||
| данные о токсичных веществах | информация предоставлена: pubchem.ncbi.nlm.nih.gov (внешняя ссылка) |
Последнее обновление:2022-12-14 18:28:39
1,2-пропандиол —
Категорияфармацевтические вспомогательные вещества, растворители и пластификаторы.
Последнее обновление:2022-01-01 11:21:38
1,2-пропандиол —
Хранениезапечатан и хранится в сухом месте в темном месте.
Последнее обновление:2022-01-01 11:21:39
1,2-пропандиол, 1-фенил- | S598594 | смолекула
1,2-пропандиол, 1-фенил- | S598594 | дым- Этот продукт не предназначен для использования людьми или ветеринарами. Только для исследовательских целей.
№ по каталогу:
S598594Номер CAS:
1855-09-0Молекулярная формула:
C9h22O2Молекулярный вес:
152,19 г/мольНаличие:
Обычно в наличии- Пожалуйста, Запросите
- ОПИСАНИЕ
1,2-Пропандиол, 1-фенил-это натуральный продукт, найденный в Peniophora polygonia, по которому имеются данные.
| Количество CAS | 1855-09-0 |
| наименование товара | 1,2-пропандиол, 1-фенил- |
| Название ИЮПАК | 1-фенилпропан-1,2-диол |
| Молекулярная формула | C9h22O2 |
| Молекулярная масса | 152,19 г/моль |
| ИнЧИ | InChI=1S/C9h22O2/c1-7(10)9(11)8-5-3-2-4-6-8/h3-7,9-11H,1h4 |
| Ключ ИнЧИ | MZQZXSHFWDHNOW-UHFFFAOYSA-N |
| УЛЫБКИ | СС(С(С1=СС=СС=С1)О)О |
| Синонимы | 1,2-дигидрокси-1-фенилпропан, 1,2-дигидрокси-1-фенилпропан, (R*,R*)-изомер, 1,2-дигидрокси-1-фенилпропан, (R*,S*)-изомер, 1-фенокси-2-пропанол |
| Канонические Улыбки | СС(С(С1=СС=СС=С1)О)О |
- ТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
| Молекулярная масса | 152,19 г/моль |
| XLogP3 | 1. 1 1 |
- ДРУГИЕ
| Другой CAS | 1855-09-0 |
| Википедия | Эритро-1-фенилпропан-1,2-диол |
| Общая информация о производстве | 1,2-пропандиол, 1-фенил-: НЕАКТИВНЫЙ |
| Даты | Изменить: 2022-04-08 |
- Ссылка
Айер, Уильям А .; Трифонов, Лачезар С.; Метаболиты Peniophora polygonia, часть 2. Некоторые ароматические соединения, Journal of Natural Products, 561, 85-89. DOI: 10.1021/np50091a012
- Онлайн-запрос
* Этот продукт предназначен только для исследовательских или производственных целей. Использование человеком строго запрещено.
* Обратите внимание, что мы будем отправлять предложения только на действительные профессиональные адреса электронной почты.

 Например, этанол СН3–СН2–ОН.
Например, этанол СН3–СН2–ОН.
Leave A Comment