Энергия в молекуле фтора — Справочник химика 21
Сравнение процесса диссоциации молекул различных галогенов провели Вике и Франк они показали, что при диссоциации фтора изменение энтропии оказывается больше, чем для остальных галогенов. Значительное изменение энтропии при диссоциации фтора Рг 2 F объясняется особой устойчивостью электронной структуры молекулы фтора. Вследствие этого число вращательных и колебательных уровней молекулы фтора сравнительно невелико, а следовательно, остается очень небольшим и соответствующее значение энтропии молекулярного фтора. Поэтому при появлении возможности поглощения энергии за счет поступательной энергии образовавшихся атомов энтропия увеличивается в большей степени. Таким образом, при одной и той же температуре степень диссоциации фтора оказывается больше, чем, например, степень диссоциации иода, хотя энтальпия диссоциации фтора (ДЯ = 156,6 кДж/моль) примерно на 8 кДж больше, чем энтальпия диссоциации иода (АЯ =149 кДж/моль). Эта относительно более сильная диссоциация фтора —одна из причин его большей реакционной способности.Высокая реакционная способность свободного фтора обусловлена сравнительно малой энергией связи молекулы F2, если учесть, что энергия диссоциации молекулы фтора р25=г2р (ДЯ=151 кДж/моль), [c.145]
Эта величина отвечает энергии связи в молекуле фтора [c.86]
Спектроскопическое исследование пламени показывает, что колебательная энергия молекул в зоне реакции также часто значительно превышает равновесную энергию при температуре пламени. Иапример, колебательная температура , измеренная в работе [1341 в фторо-водородном пламени (по спектру HF), оказалась равной 4400 К прн поступательной температуре 200 К.
При объяснении строения фтора и азота кадры диафильма позволяют понять, почему при образовании молекулы фтора образуется одна химическая связь, а при образовании азота — три. С этой целью приводятся электронные формулы атомов (схематическое изображение заполнения квантовых ячеек). Учитель уточняет, что только неспаренные электроны атомов участвуют в образовании неполярной ковалентной связи. Приведенные схемы перекрывания электронных облаков, символические схемы образования молекул из одиночных атомов, а также величины энергий связи обеспечивают более глубокое понимание сложных теоретических вопросов.
С этой целью приводятся электронные формулы атомов (схематическое изображение заполнения квантовых ячеек). Учитель уточняет, что только неспаренные электроны атомов участвуют в образовании неполярной ковалентной связи. Приведенные схемы перекрывания электронных облаков, символические схемы образования молекул из одиночных атомов, а также величины энергий связи обеспечивают более глубокое понимание сложных теоретических вопросов.
Роль энергетического фактора в разветвлениях цепей была продемонстрирована на ряде реакций фторирования, в частности, на реакции фтора с водородом. В этой реакции тепловой эффект процесса Н -Ь Ра = НР -Ь Р + -Ь 96,6 ккал приблизительно в 2,5 раза превышает теплоту диссоциации молекулы фтора, что обеспечивает возможность использования выделяющейся в этом процессе энергии для диссоциации молекул Ра. [c.223]
Важнейшей характеристикой химической связи является энергия, определяющая ее прочность. Мерой прочности связи может служить количество энергии, затрачиваемое на ее разрыв. Для двухатомных молекул энергия связи равна величине энергии диссоциации молекул на атомы. Так, энергия диссоциации О, а следовательно, и энергия связи Е в молекуле На составляет 435 кдж моль. В молекуле фтора Ра она равна 151 кдж моль, а в молекуле азота N2 940 кдж моль. Для многоатомных молекул типа АВ средняя энергия связи Еав равна 1/га части энергии диссоциации соединения на атомы [c.56]
Электронная конфигурация молекулы фтора согласуется с образованием одной связи и отсутствием неспаренных электронов. Наглядным следствием постепенного заполнения разрыхляющих орбиталей в ряду Ка, Оа и Ра является уменьшение энергии связи с увеличением межъядерного расстояния (табл. П1.4).
Активность молекул фтора по сравнению с хлором гораздо выше/ чем можно было бы ожидать. Объясняют это сравнительно небольшой энергией диссоциации молекул фтора (158,34 кДж/моль), а также отсутствием у атома фтора -орбиталей и, следовательно, дополнительных связей между атомами в молекуле. Действительно, с большинством элементов фтор взаимодействует при обычных температурах, но не соединяется непосредственно с кислородом и азотом. Во фториде кислорода 0р2 кислород проявляет степень окисления 4-2, так как атомы фтора оттягивают к себе электроны.
Действительно, с большинством элементов фтор взаимодействует при обычных температурах, но не соединяется непосредственно с кислородом и азотом. Во фториде кислорода 0р2 кислород проявляет степень окисления 4-2, так как атомы фтора оттягивают к себе электроны.
Энергия диссоциаций молекулы фтора значительно меньше, чем хлора или брома, и сопоставима с энергией диссоциации молекулы иода (см. табл. 2). Однако во фтор-содержащих соеди- [c.310]
Высокую химическую активность фтора следует объяснить тем, что на разрушение молекулы фтора требуется намного меньше энергии, чем ее выделяется при образовании новых связей. Так, вследствие малого радиуса атома фтора (п. 6, табл. 8.1) неподеленные электронные пары в молекуле фтора взаимно отталкиваются и ослабляют связи Р—Р (151 кДж/моль). В то же время энергия связи между атомом фтора и водорода Н—Р большая (565 кДж/моль).
Исключительная прочность молекул водорода (например, прочнее молекул фтора в 2,7 раза) обусловливает высокие энергии активации химических реакций [c.295]
Так, энергия диссоциации дис, а следовательно, и энергия связи в молекуле Н2 составляют 435 кДж/моль. В молекуле фтора Гг оца равна 159 кДж/моль, а в молекуле азота N2 — 940 кДж/моль. [c.48]
Ввиду того что энергия связи НР 134 ккал/моль, а энергия. диссоциации Рг на атомы составляет только 37 ккал/моль, эта реакция идет без затраты энергии и для метана является термонейтральной. А так как при контакте молекулы фтора с молекулой углеводорода образуются два радикала, то такое инициирование (без необходимости подводить тепло) обеспечивает высокую скорость реакции даже при очень низких температурах. Вследствие этого фторирование углеводородов вплоть до получения перфторуглеродов производят не самим фтором, а фторсодержащими соединениями.
Исключительная химическая активность фтора обусловлена, с одной стороны, большой прочностью образуемых им связей, так, энергия связи (Н—Р) == 566, (51—Р)= 582 кДж/моль, с другой стороны, низкой энергией связи в молекуле Ра [ (Р—Р) = 151 кДж/моль, ср.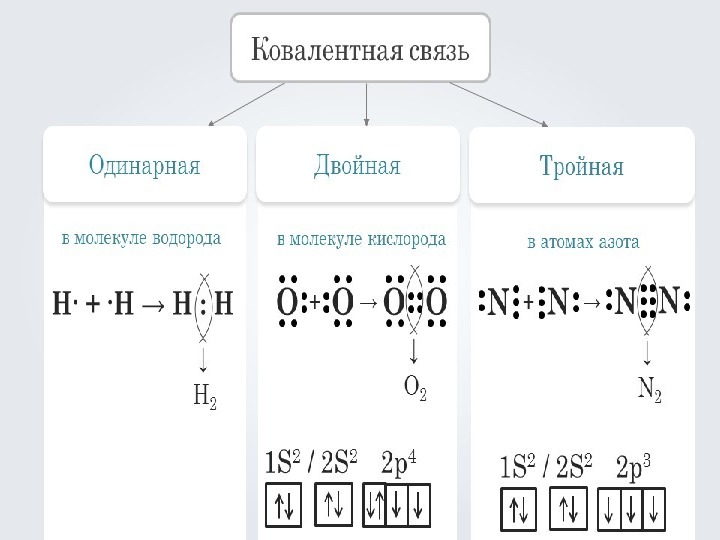
Так, например, стадия инициирования при фторировании метана весьма эндотермична и, следовательно, должна иметь очень высокую энергию активации (см. кривую Б на рис. 3-8). Если вы больше ничего не знаете об этом процессе, то может показаться, что высокая энергия активации будет препятствовать взаимодействию фтора с метаном. Однако если даже небольшая часть молекул фтора диссоциировала на атомы фтора, то уже может начаться рост цепи. Обе стадии роста цепи при фторировании имеют очень низкие энергии активации, а следовательно, они протекают очень легко и при этом выделяется большое количество тепла (АЯ = = —102 ккал/моль). Это тепло в свою очередь обеспечит дальнейшую диссоциацию молекул фтора на атомы, инициируя новые цепные реакции. Таким образом, легкость фторирования метана объясняется двумя факторами низкой энергией активации стадий роста цепи и большой отрицательной величиной АЯ роста цепи.
Противоречие между сравнительно низким значением энергии диссоциации молекулы фтора (Оо(Рг) = 37 ккалЫоль) и высоким значением ее силовой постоянной ke = 4,78- дин-см ) объяснено Брауном [987] на основании концепции валентных состояний. [c.246]
Идея Семенова не получила подтверждения в последующих попытках установить разветвленный характер этой реакции (см.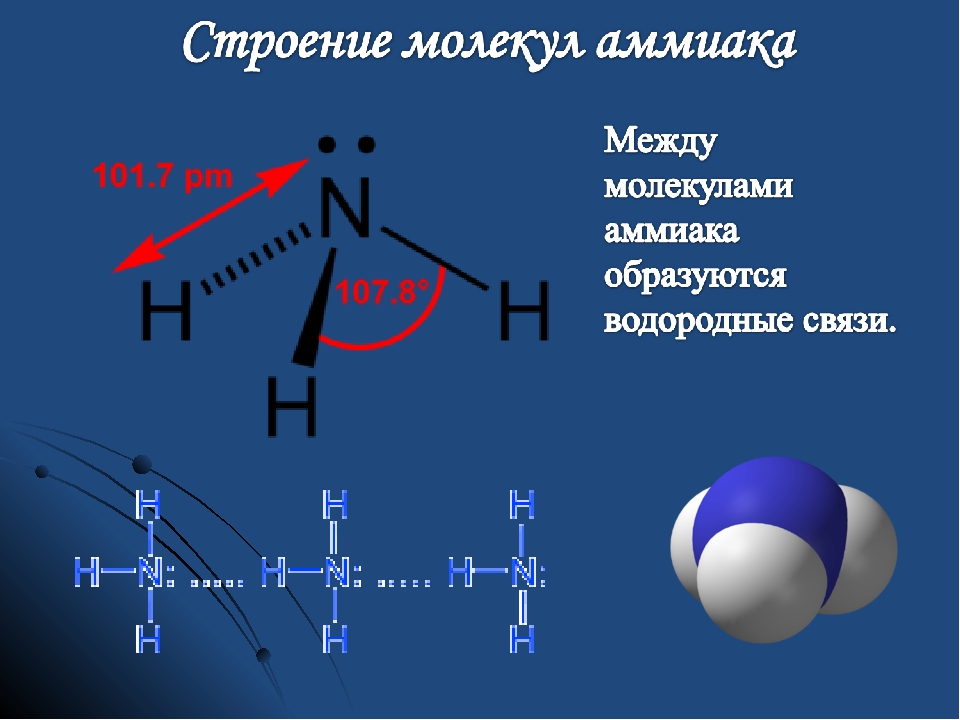
Отметим, что кинетически такой процесс не отличим от передачи энергии от возбужденной молекулы продукта молекуле фтора, с последующим мономолекулярным распадом, возбужденного Га- Однако, химическая реакция типа реакции (5) с возбужденным НК представляется значительно более вероятной [12].
Согласно этим данным, образованию фторидов ксенона способствуют низкие температуры, однако ниже 120°С никаких продуктов в результате экзотермической реакции не образуется. Поскольку для разрыва связи в молекуле фтора требуется заметная энергия (38 ккал/моль), эти экзотермические реакции проходят только при температуре выше 300 °С (ЯТ = =18 ккал/моль). Для проведения реакции при более низких температурах в качестве источников энергии использовали электрический разряд, излучение ртутной лампы высокого давления, гамма-излучение °Со. Успех синтеза ХеРг зависит от того, на- [c.265]
СВЯЗИ Е В молекуле Нг составляют 435 кДж/моль. В молекуле фтора F 2 она равна 159 кДж/моль, а в молекуле азота N2 940кДж/моль. Для многоатомных молекул типа АВ средняя энергия связи Еав равна 1/и части энергии диссоциации соединения на атомы [c.43]
Простое вещество. Молекула фтора, подобно молекулам водорода и фтора, двухатомна. Энергия диссоциации i. больше (243 кДж/моль), чем у р2 (151 кДж/моль), Распад молекул хлора на атомы становится заметным, начиная с ЮОО С. [c.286]
[c.286]
Аномальное значение энергии диссоциации фтора до сих пор ( е имеет однозначного объяснения. Одна из гипотез связывает такое поведение фтора-Рг с тем, что в отличие от всех других галогенов у фтора нет свободных орбиталей во внешнем электронном слое. В молекуле хлора и других галогенов есть свободные -орбитали. Действительно, например, в слое п = 3 у хлора занят )1 орбитали ( ячейки ) с побочным квантовым числом 1=0 (2 5-элек- [c.261]
Повышение кратности связи приводит к упрочнению межатомной связи и уменьшению межъядерного расстояния (длины связи). Так, энергии диссоциации молекул фтора р2 ( Р — Р ) и азота К2( М=Ы ) соответственно равны 151/С(3ж/л10ль [c.71]
Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы и энергия активации реакций с э.лементным фтором обычно невелика, поэтому процессы с участием Fj протекают очень быстро. Известно много прочных фто )идных комплексов (IBF l, SIP 1 , Л1Рб1 и др). Большое значение Gf обусловливает малую реакционную способность координационно насыщенных соединений фтора (SPe, СРч, перфторалкамы и др.). [c.457]
Сродство к электрону определить экспериментально значительно труднее, чем ионизационный потенциал, и оно было определено только для наиболее электроотрицательных элементов. Прямое определение сродства к электрону возможно , но чаще его определяют из цикла Борна—Габера, как это показано в гл. 5. Величины сродства к электрону для некоторых элементов при ведены в табл. 4-8. Неожиданно малая величина сродства к электрону у фтора (табл. 4-8) может быть объяснена отталкиванием электронов в сравнительно плотно заполненном 2р-подуровне На основании приведенных в таблице величин можно предполо жить, что хлор должен быть более сильным окислителем, чем фтор, так как при присоединении электрона атомом хлора энергии выделяется больше. Но зато когда молекула фтора диссоциирует на атомы, то затрачивается меньше энергии (37,7 ккал/моль), чем при диссоциации молекулы хлора (57 ккал/моль). Малая энергия диссоциации молекулы фтора частично может быть объяснена отталкиванием несвязывающих электронов, но обычно считают, [c.121]
Малая энергия диссоциации молекулы фтора частично может быть объяснена отталкиванием несвязывающих электронов, но обычно считают, [c.121]
Активность молекулы фтора больше, чем можно было бы ожидать на оснонании сопоставления свойств фтора и хлора. Пока еще нет единого мнения о повышенной активности фтора. Предполагают, что это связано с относительно низкой энергией диссоциации молекулы р2, составляющей всего 154,5 кДж/моль, которая, в свою очередь, обусловлена взаимным отталкиванием тех электронов, которые не принимают участия в образовании связи между атомами [c.194]
Из табл. 7 видно, что энергии связи в молекулах хлора и брома превышают в молекуле фтора. Это можно объяснить возникновением между атомами галогенов, имеющих вакантные -орбитали (например, хлора), двух дополнительных донорно-акцепторных 7>связей за счет перекрывания двух атомных орбиталей одного атома с двумя орбиталями другого атома. При этом pJ -opбитaль, содержащая пару электронов, и вакантная . -орбиталь одного атома перекрывается [c.95]
Исключительная прочность молекул водорода (например, ирочнее молекул фтора в 2,7 раза) обусловливает высокие энергии активации химических реакций с участием молекулярного водорода. При обычных условиях в газообразном водороде активных молекул немного и молекулярный водород химически малоактивен. Он способен иепосредствешю соединяться липп) с наиболее активными нз неметаллов — с фтором и на свету с хлором. Для инициирования реакций молекулярного водорода с другими веществами требуется нагрев или другие способы активации. При нагревании же молекулярный водород вступает в химическое взаимодействие со многими металлами, неметаллами и сложными веществами. [c.101]
Водородвая связь. Промежуточный характер между валентным и межмолекулярным взаимодействием имеет так называемая водородная связь. Она осуществляется между положительно поляризованным атомом водорода, химически связанным в одной молекуле, и отрицательно поляризованным атомо)11 фтора, кислорода и азота (реже хлора, серы и др.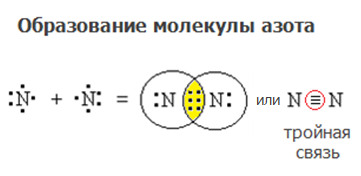 ), принадлежащим другой (или той же) Рис. 60. Зависимость энергии молекуле. То, ЧТО подобное взаимодействие не взаимодействия от межмолекуляр- обнаруживается у Других атомов, обусловлено ного расстояния уникальными свойствами поляризованного атома [c.100]
), принадлежащим другой (или той же) Рис. 60. Зависимость энергии молекуле. То, ЧТО подобное взаимодействие не взаимодействия от межмолекуляр- обнаруживается у Других атомов, обусловлено ного расстояния уникальными свойствами поляризованного атома [c.100]
Простое вещество. Молекула хлора, подобно молекуле фтора, двухатомна. Энергия диссоциации молекулы СЬ больше (243 кДж/моль), чем Гг (159 кДж/моль). Распад молекулы хлора на атомы становится заметным, начиная с 1000°С. [c.316]
Этот экспериментальный факт на примере фторидов можно объяснить следующим образом. Образование соединения из простых веществ сопровождается затратой энергии для разрьша связей в простых веществах и выделением энергии при взаимодействии образовавшихся атомов. Энергия разрыва связей в металле (энтальпия атомизации) значительно больше, чем энергия разрыва связей в молекуле фтора. При образовании ЭГг, ЭГз, ЭГ4 затрата энергии на атомизацию металла одна и та же. Но при соединении атомов Э и Г в случае образования ЭГз энергии вьщеляется меньше, чем в случае обррования ЭРз и Эр4. Следовательно, если энергия атомизации металла достаточна велика, то энергетически оправдано, когда образуются высшие, а не низшие фториды. Поскольку в подгруппах -элементов теплота атомизации с увеличением атомного номера элемента возрастает, наиболее характерными становятся фториды для высших степеней окисления элементов. [c.550]
Возможность образования связей за счет тех или иных орбиталей определяется не только энергией, но также геометрическими свойствами орбиталей. Поскольку s-орбитали сферически симметричны относительно ядра, они могут взаимодействовать с ядрами других атомов независимо от направления. Орбитали других типов, как это было описано в гл. 5, характеризуются пространственной направленностью. Поэтому их особенностью является образование направленных связей. Рассмотрим, например, роль р-орбиталей при образовании химической связи в молекулах фтора (Fj) и фтористого водорода (HF) оба процесса изображены на рис. 7.11. В молекуле фтора можно сконструировать связывающую орбиталь, взяв по одной из 2р-орбиталей каждого атома фтора. Связь в молекуле HF формируется путем комбинации ls-орбитали водорода с 2р-орбиталью фтора. Связи в каждой из этих молекул образуются в направлении, в котором 2р-орбиталь фтора дает наибольшую электронную плотность. Это соображение играет очень важную роль для молекул, состоящих из трех или большего числа атомов, поскольку оно показывает, чем определяется геометрия молекул. В более сложных случаях приходится учиты- [c.117]
7.11. В молекуле фтора можно сконструировать связывающую орбиталь, взяв по одной из 2р-орбиталей каждого атома фтора. Связь в молекуле HF формируется путем комбинации ls-орбитали водорода с 2р-орбиталью фтора. Связи в каждой из этих молекул образуются в направлении, в котором 2р-орбиталь фтора дает наибольшую электронную плотность. Это соображение играет очень важную роль для молекул, состоящих из трех или большего числа атомов, поскольку оно показывает, чем определяется геометрия молекул. В более сложных случаях приходится учиты- [c.117]
Исиользуя расстояния между нонами, вычисленные нз постоянных решетки, приведенных в табл. 1, а также изотермические сжимаемости, данные Ьориом и Майером [17], находим величины энергии решеток, указанные в пятом столбце табл. 16. Они хорошо согласуются со значениями энергий, рассчитанными Шерманом [18] методом Борна. Однако это совпадение случайно, так как Шерман принимал для энергии диссоциации молекулы фтора 63,3 ккал моль. [c.493]
Милн и Джиллес [2923] определили значения констант равновесия диссоциации фтора, нагреваемого в сосуде из монель-металла до определенной температуры. Авторами работы [2923] было/ измерено количество атомов фтора в молекулярном пучке, истекающем из отверстия сосуда и падающем на мищень, покрытую тонким слоем теллура. Предварительно было установлено, что с теллуром реагируют только атомы фтора, но не его молекулы. Найденные в работе [2923] значения констант равновесия реакции диссоциации Рг, а также зависимость констант равновесия этой реакции от температуры соответствуют энергии диссоциации фтора, равной 41,3+0,5 ккал моль. Однако Милн и Джиллес считают, что в их работе возможна систематическая ошибка. [c.246]
Кроме энергетического разветвления цецей, обусловленного межмоле-кулярным обменом энергии (Н Ег = Н НГ -1- Г), Шиловым с сотр. [145, 299] на примере реакции фтора с СНдТ были открыты разветвления, осуществляющиеся в результате внутримолекулярного обмена энергии. В этой реакции радикалы СНа , образующиеся в процессе Г СНд = = НГ -Ь СНа , взаимодействуя со фтором СНа -Ь Га = СНа Г + Г 4- 78 ккал, превращаются в богатую энергией молекулу СНа Г, которая в результате перераспределения энергии, не успев стабилизоваться, может распасться по схеме СНа Г СНаГ -Н Образующийся при этом радикал СНаГ, взаимодействуя с молекулой фтора, дает атом фтора (СНаГ + Га = СНаГа + Г), который инициирует новую цепь (разветвление). В соответствии с этим механизмом в продуктах реакции были обнаружены молекулярный иод, образующийся при рекомбинации атомов иода, и фтористый метилен СНаГа- По спектру ЭПР были обнаружены атомы иода. [c.445]
В этой реакции радикалы СНа , образующиеся в процессе Г СНд = = НГ -Ь СНа , взаимодействуя со фтором СНа -Ь Га = СНа Г + Г 4- 78 ккал, превращаются в богатую энергией молекулу СНа Г, которая в результате перераспределения энергии, не успев стабилизоваться, может распасться по схеме СНа Г СНаГ -Н Образующийся при этом радикал СНаГ, взаимодействуя с молекулой фтора, дает атом фтора (СНаГ + Га = СНаГа + Г), который инициирует новую цепь (разветвление). В соответствии с этим механизмом в продуктах реакции были обнаружены молекулярный иод, образующийся при рекомбинации атомов иода, и фтористый метилен СНаГа- По спектру ЭПР были обнаружены атомы иода. [c.445]
Сначала принимается, что твердый натрий взаимодействует с газообразным фтором, образуя твердый фтористый натрий, и теплота образования равна АЯ . Поскольку энергия ионизации и сродство к электрону относятся к газообразным атомам, сначала необходимо испарить натрий и разложить молекулы фтора на атомы. Затем может произойти перенос электронов, и возникающие ионы могут взаимодействовать с образованием кристалла фтористого натрия. Этот ряд реакций известен под названием цикла Габера — Борна он изобг ажен схематически на рис. 22. Энергия ионизации натрия обозначается через [c.82]
Энергия ионизации ксенона АН, равна +279 ккал1моль, а энергия решетки гипотетического ХеР, АЯз, должна быть примерно такой же, как у sF, т. е. +178 ккал моль. Энергия диссоциации молекулы фтора АЯд равна +36,6, а сродство фтора к электрону АЯд = —83,5 ккал моль. Вычислите теплоту образования твердого XeF из газообразного ксенона и газообразного фтора. [c.400]
Энергия диссоциации молекул | Задачи 246
Задача 246.
Объяснить с позиций методов ВС и МО изменение энергии диссоциации (кДж/моль) молекул в ряду
F2 (155) → O2 (493) → N2 (945).
Решение:
1) Метод ВС.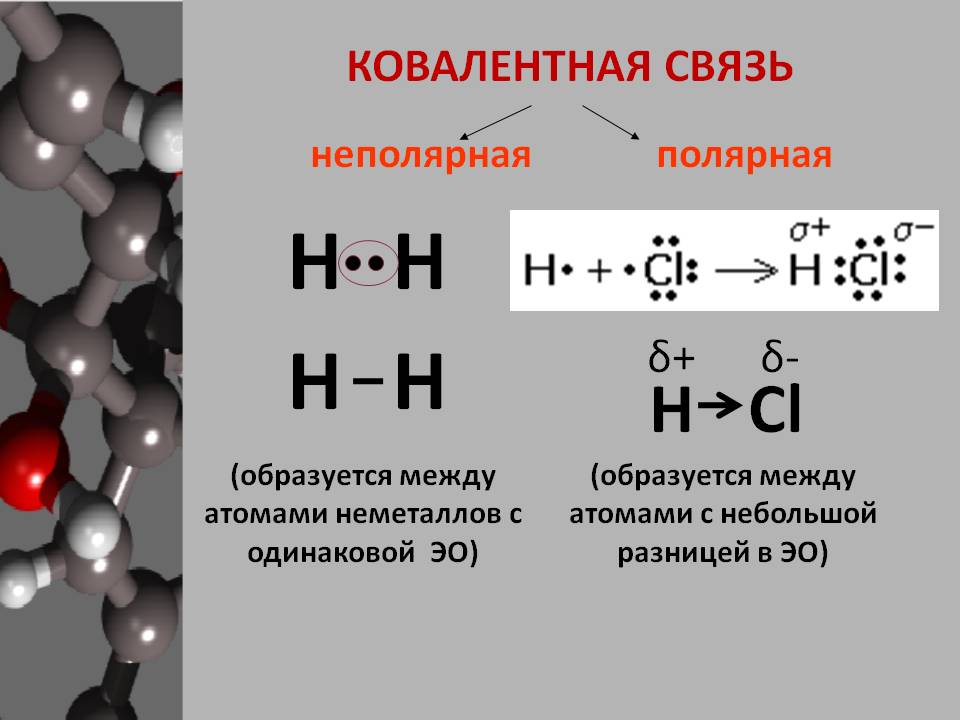
а) В молекуле F2ковалентная химическая связь образуется двумя электронами от двух разных атомов фтора, причём электроны с противоположно направленными спинами. электронная пара расположена на одинаковом расстоянии от атомных ядер, потому что электроотрицательность атомов в молекулах простых веществ одинаковая, связь ковалентная неполярная. Перекрывание атомных орбиталей происходит на межъядерной оси, т.е. образуется — связь (сигма-связь). Схемы перекрывания электронных облаков имеют вид:. Структурная формула имеет вид: F — F. Длина связи равна 0,142нм.
б) В молекуле О2 связь между двумя атомами кислорода образуется за счет перекрывания двух неспаренных электронов от двух разных атомов. При чем, одна связь образуется за счет перекрывания атомных орбиталей на межъядерной оси, т.е. образуется — связи (сигма-связь). Вторая связь образуется за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов кислорода (боковые перекрывания, называется — связь (пи-связь). При наложении — связи на — связь образуется двойная связь в молекуле кислорода. Хотя энергия -связи меньше, чем энергия — связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи. Схемы перекрывания электронных облаков имеют вид: . Структурная формула имеет вид: О=О. Длина связи равна 0,121 нм.
в) В молекуле N2 связь между двумя атомами азота образуется за счет перекрывания трёх неспаренных электронов от двух разных атомов. При чем, одна связь образуется за счет перекрывания атомных орбиталей на межъядерной оси, т. е. образуется — связь (сигма-связь). Вторая и третья связь образуются за счет перекрывания АО по обе стороны линии, соединяющей ядра двух атомов азота, т.е. образуются две — связи. При наложении — связи на две — связи образуется тройная связь в молекуле азота. Схемы перекрывания электронных облаков имеют вид: .
Структурная формула N2 имеет вид: .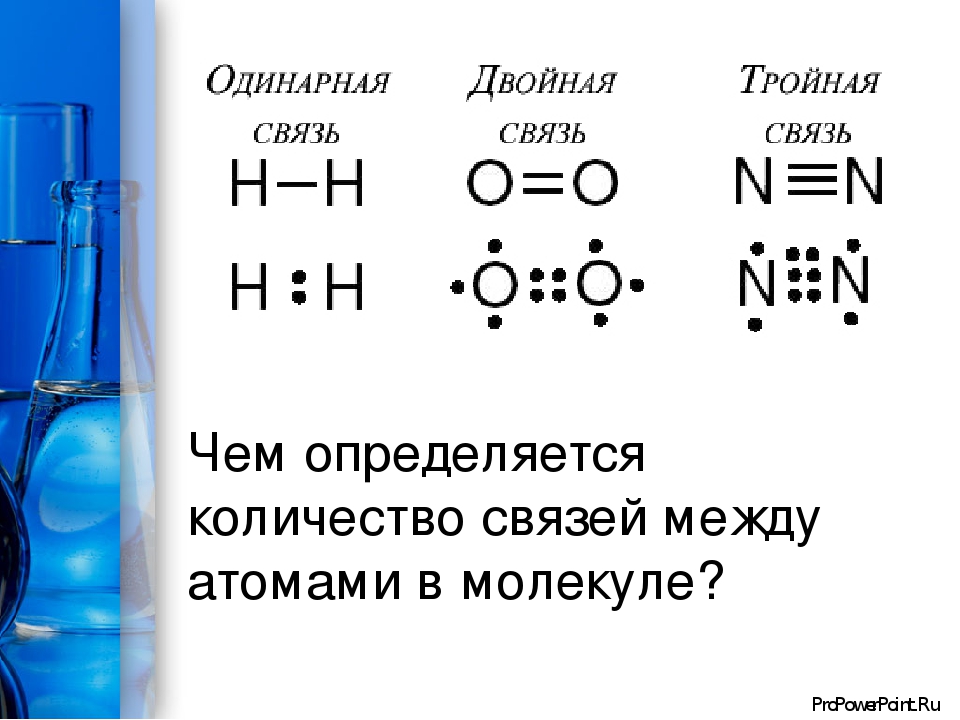 Длина связи равна 0,11нм.
Длина связи равна 0,11нм.
Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
Число связей между атомами в методе ВС называется кратностью связи, чем выше кратность связи, тем выше её энергия диссоциации.
2) Метод МО.
Энергетические схемы образования молекул в ряду F2, O2, N2:
Как видно из энергетических схем в молекулах F2, O2 и N2 разность между числом связывающих и числом разрыхляющих электронов равна соответственно 2, 4 и 6, что отвечает кратности связи соответственно 1; 2, и 3. Следовательно, прочность связи в ряду F2 → O2 → N2 характеризуется повышением кратности, т.е. возрастанием прочности молекул данных веществ. Этот вывод соответствует экспериментально установленным значениям энергии диссоциации в ряду F2 → O2 → N2, их возрастанию.
Задача 247.
Энергия диссоциации молекул N2 и СО соответственно равна 945 и 1071 кДж/моль. Объяснить близость этих значений с позиций методов ВС и МО.
Решение:
а) Метод ВС.
Электронная конфигурация атома углерода 1s22s22p2 атома кислорода 1s22s22p4, атома азота 1s22s22p3. Электронное строение их валентных орбиталей в невозбуждённом состоянии может быть представлено следующими графическими схемами:
а) атома углерода:
б) атома кислорода:
а) атома азота:
Для образования молекулы N2. Три неспаренных электрона атома азота могут участвовать в образовании трёх ковалентных связей по обычному механизму с другим атомом азота с образованием молекулы N2. Электронная схема молекулы азота имеет вид:
Электронная схема молекулы азота имеет вид:
Атомы азота соединены друг с другом тремя ковалентными связями:
Два неспаренных электрона атома углерода и два неспаренных электрона атома кислорода могут образовать две ковалентные связи по обычному механизму. Валентная схема молекулы СО будет иметь вид:
Структурная формула имеет вид: С=О.
Учитывая, что в СО две связи, а в молекуле N2 – три можно предположить большую прочность молекулы N2. Так как радиусы атомов углерода, кислорода и азота отличаются незначительно, то можно предположить близость значений энергий диссоциации СО и N2.
б) Метод МО.
Энергетические схемы образования молекул ряду а) СО и б) N2:
Как видно из энергетических схем в молекулах СО и N2 разность между числом связывающих и числом разрыхляющих электронов одинакова (6). Это отвечает кратности связи 3. Учитывая, что в молекулах кратность связи одинаковая, то можно предположит близость значений их энергий диссоциации.
Таким образом, метод МО более точно объясняет близость значений энергии диссоциации молекул, чем метод ВС.
Глава 2 | Пособие по химии для подготовки к ЕГЭ
§2.1. Ионная связь
Причиной, по которой одни атомы взаимодействуют с другими, является стремление к устойчивости, а в итоге – к минимуму энергии. Атомы стремятся приобрести восьмиэлектронную оболочку благородных газов. При взаимодействии атомов металлов с атомами неметаллов происходит полная передача валентных электронов от атома металла, легко теряющего электроны, к атому неметалла, способного присоединять электроны, и образуются противоположно заряженные ионы. Например, атомы натрия и хлора имеют электронные конфигурации:
Обозначим валентные электроны точками: Электронная схема образования NaCl:Атом металла Na отдал валентный электрон атому хлора и оба атома при этом приобрели устойчивую внешнюю электронную оболочку благородных газов неона Ne и аргона Ar:
Как известно из физики, противоположно заряженные частицы притягиваются друг к другу и оказываются связанными друг с другом. Так возникает химическая связь, называемая ионной.
Так возникает химическая связь, называемая ионной.
Химическая связь, образованная путем электростатического притяжения катионов и анионов, называется ионной.
Ион можно упрощенно представить в виде заряженного шарика, который любой точкой своей поверхности способен притянуть ион противоположного заряда, то есть один ион может притянуть столько противоположно заряженных ионов, сколько позволит его поверхность и даже больше; может образоваться второй, третий и последующие слои противоположно заряженнных ионов. Но с расстоянием сила притяжения уменьшается, связь с дальними ионами менее прочная, чем с первым слоем ионов. Из вышесказанного следует, что ионная связь не имеет направления (ненаправлена) и ненасыщаема.
В случае образования молекулы MgCl2, атом магния, чтобы стать устойчивым, отдает два своих валентных электрона двум атомам хлора и превращается в двухзарядный катион:
Электронная схема образования MgCl2:
Рассмотрим образование молекулы MgO.Расположение валентных электронов атома O: Атому кислорода не хватает двух электронов до устойчивой восьмиэлектронной оболочки. Забирая их у атома магния, он превращается в двухзарядный анион. С магнием кислород образует ионную химичес кую связь по схеме:
Вещества NaCl, MgO и MgCl2 построены из ионов. Катионы чередуются с анионами. Понятие «молекула» применяется к ним условно.
Таким образом, ионная связь образуется между атомами металлов и атомами неметаллов.
Задания для закрепления84) Самостоятельно составьте электронные схемы образования Na2O, BaBr2, CaS, KI, Li3N.
§2.2. Ковалентная химическая связь.
Разновидности связи, характеристика связи.
Валентность. Степень окисления
Рассмотрим, как соединяются в молекулу два атома водорода.
Область перекрывания облаков лежит точно посередине между ядрами и удерживает их друг около друга, так как эта область повышенного отрицательного заряда.
Образовалась химическая связь. Механизм образования связи – обменный (один электрон – от одного атома, второй электрон – от другого). Область повышенной электронной плотности (область перекрывания облаков) означает, что оба электрона принадлежат двум атомам и чаще всего их можно обнаружить именно в этом пространстве между ядрами. Каждый атом приобрел устойчивую внешнюю электронную оболочку благородного газа гелия He.
Электронная схема образования молекулы H2:
Заменив общую электронную пару черточкой, получим структурную формулу молекулы H2:Одна общая электронная пара равносильна одной химической связи. Так как каждый атом H образовал одну химическую связь, то он одновалентен. Валентность пишется римской цифрой над атомом.
Валентность – это число химических связей, образованных атомом.
Химическая связь, образованная за счет общей электронной пары, называется ковалентной.
По способу перекрывания электронных облаков ковалентные связи подразделяются на σ- (сигма) и (пи)-связи. В молекуле H2 реализуется σ-связь. Химическая связь, при которой область перекрывания электронных облаков лежит на линии, соединяющей два ядра, называется сигма (σ)-связью.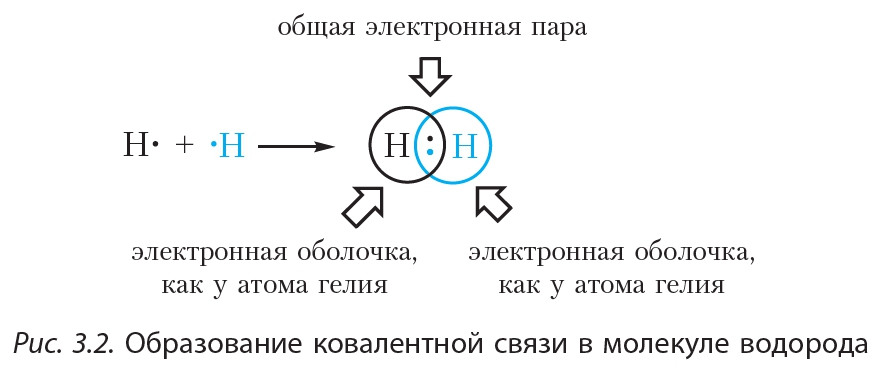 В данном случае перекрываются два s-облака, поэтому связь σ s-s.
В данном случае перекрываются два s-облака, поэтому связь σ s-s.
В образовании химической связи в молекуле Cl2 принимает участие неспаренный p-электрон каждого атома.
Электронная конфигурация валентных электронов атома хлора:
Атом хлора имеет три пары спаренных электронов и один неспаренный, укажем их точками:Неспаренные p-электроны двух атомов спариваются и становятся общими для двух атомов. При этом каждый атом приобретает устойчивую внешнюю восьмиэлектронную структуру инертного газа аргона Ar (3s23p6).
Электронная схема образования молекулы Cl2:
— электронная формула молекулы Cl2 Одна общая электронная пара, следовательно, одна химическая связь. Структурная формула молекулы Cl2: .Каждый атом образует одну химическую связь, поэтому он одновалентен. Одна химическая связь может быть только сигма связью. Общие электроны связи в одинаковой мере принадлежат обоим атомам, находятся точно посредине между двух ядер, так как атомы одинаковые и с одинаковой силой тянут на себя электроны.Такая связь называется ковалентной неполярной.
В молекуле Cl2 происходит перекрывание p-облаков и образуется сигма (σ)-связь p-p:При образовании молекулы O2 два неспаренных валентных p-элек-трона каждого атома O образуют две пары общих электронов, т.е. две химические связи.
Электронная конфигурация атома О:Электронная схема образования молекулы O2:
— электронная формула молекулы О2Две пары общих электронов равносильны двум химическим связям.
— структурная формула молекулы О2 Так как атом кислорода образует две химические связи, он двухвалентен. Связь двойная ковалентная неполярная, так как образована одинаковыми атомами. Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует -связь p-p:
Другое p-облако образует с таким же облаком второго атома кислорода (пи)-связь, в плоскости, перпендикулярной первой:
(пи)- связь отличается от -связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.
(пи)-связь менее прочная, чем (сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая – -связь.
В общем случае, если между двумя атомами три химические связи, то одна из них всегда , а две другие – -связи
Связь двойная ковалентная неполярная, так как образована одинаковыми атомами. Электронные облака двух неспаренных электронов атома кислорода взаимно перпендикулярны друг другу. Одно из них образует -связь p-p:
Другое p-облако образует с таким же облаком второго атома кислорода (пи)-связь, в плоскости, перпендикулярной первой:
(пи)- связь отличается от -связи тем, что область перекрывания электронных облаков лежит выше и ниже линии, соединяющей два ядра.
(пи)-связь менее прочная, чем (сигма), так как в случае p-связи между положительно заряженными ядрами нет отрицательного заря-да, поэтому они отталкиваются друг от друга и ослабляют её, тогда как в σ-связи на пути между положительными ядрами расположена отри-цательная область перекрывания облаков, которая стягивает два ядра. Если между двумя атомами образуются две связи, то одна из них σ, а другая – -связь.
В общем случае, если между двумя атомами три химические связи, то одна из них всегда , а две другие – -связи
Электронная схема образования HCl:
— электронная формула молекулыH — Cl – структурная формула молекулы
Перекрывание электронных облаков: Общая электронная пара в молекуле HCl одна, то есть образуется одна химическая связь по обменному механизму, следовательно, атом H и атом Cl одновалентны: Общая электронная пара не находится посредине между ядрами двух атомов, а смещена к более электроотрицательному атому хлора .Отчего на атоме хлора образуется частичный отрицательный заряд, а на атоме водорода – частичный положительный, то есть образуются полюса – положительный и отрицательный, такая связь называется ковалентной полярной.
Электроотрицательность – свойство атома притягивать общую электронную пару. Наибольшей электроотрицательностью обладает элемент с наименьшим радиусом атома – F. Его относительная электроотрицательность принята равной 4.0, а наименьшей электроотрицательностью обладает атом с наибольшим радиусом – франций Fr. Так как относительная электроотрицательность связана с радиусом атома, который изменяется периодически в зависимости от заряда ядра атома, то относительная электроотрицательность (э.о.) также изменяется периодически.
Его относительная электроотрицательность принята равной 4.0, а наименьшей электроотрицательностью обладает атом с наибольшим радиусом – франций Fr. Так как относительная электроотрицательность связана с радиусом атома, который изменяется периодически в зависимости от заряда ядра атома, то относительная электроотрицательность (э.о.) также изменяется периодически.
Таблица 6. Относительная электроотрицательность атомов (э.о.)
В таблице 6 даны относительные электроотрицательности атомов. В периоде слева направо э.о. возрастает, а в подгруппе А сверху вниз э.о. уменьшается. Свойство притягивать электроны – свойство неметалла и, как видим из таблицы, в периоде слева направо усиливаются неметаллические свойства и увеличивается электроотрицательность. В главных подгруппах сверху вниз неметаллические свойства веществ, образованных данными атомами, уменьшаются, и уменьшается их электроотрицательность.
Ряд электротрицательности, который необходимо запомнить:
Рис. 17. Ряд электроотрицательности неметаллов
Вернемся к молекуле . Молекула представляет из себя диполь («ди» в переводе с греческого означает «два», два полюса – положительный и отрицательный). От атома водорода к атому хлора сместился один электрон и принес отрицательный заряд, поэтому степень окисления хлора равна (-1), а от атома водорода сместился также один электрон, степень окисления водорода (+1):Степень окисления – это число смещенных электронов, или заряд, который получит атом, если предположить, что связь ионная. В случае молекул H2, O2, Cl2, когда атомы, образующие связь, одинаковы и нет смещения общей электронной пары от центра симметрии молекулы, степень окисления атома равна нулю:
В молекуле H2O атом кислорода образует две химические связи с двумя атомами водорода за счёт своих двух неспаренных электронов. Он двухвалентен. Атом водорода всегда одновалентен, так как имеет только один электрон. Неспаренные электроны атома кислорода находятся на взаимноперпендикулярных p-орбиталях, поэтому молекула H2O имеет угловое строение.
Он двухвалентен. Атом водорода всегда одновалентен, так как имеет только один электрон. Неспаренные электроны атома кислорода находятся на взаимноперпендикулярных p-орбиталях, поэтому молекула H2O имеет угловое строение.
Электронная схема образования молекулы H2O:
Общие электроны связей смещены к более электроотрицательному атому кислорода. Поэтому связи ковалентные полярные:От двух атомов водорода по двум связям смещено два электрона, которые приносят отрицательный заряд, поэтому степень окисления кислорода равна (-2). От каждого атома водорода смещено по одному электрону, они уносят с собой отрицательный заряд и оставляют положительный заряд протонов, поэтому степень окисления водорода (+1).
Молекула H2O имеет угловое строение. Если сложить два вектора связей, результирующий вектор не равен нулю и будет направлен к кислороду. Поэтому молекула воды полярна, то есть представляет из себя диполь: Задания для закрепления
85) Составьте электронные схемы образования молекул N2, HI, NH3, CH4. Покажите, что атомы приобрели устойчивую восьмиэлектронную оболочку, запишите структурные формулы молекул и определите валентность и степень окисления каждого атома.
86) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке уменьшения их электроотрицательности:
1) N 2) Be 3) O 4) Rb 5) Cl
Укажите номера правильных ответов (несколько цифр).
87) Из предложенного перечня выберите три элемента-неметалла и расположите их в порядке увеличения их электроотрицательности:
1) H 2) I 3) S 4) Sc 5) Ge
Укажите номера правильных ответов (несколько цифр).
Характеристика химической связи
Химическая связь характеризуется длиной, прочностью, кратностью, полярностью, направленностью, насыщаемостью.
Энергия связи – это энергия, которую необходимо затратить на разрыв химической связи, измеряется в кДж/моль.
При образовании любой химической связи энергия всегда выделяется. Чем в бóльшей степени перекрываются электронные облака, тем больше энергии при этом выделяется, тем прочнее химическая связь.
Длина связи – это расстояние между ядрами двух атомов, образовавших химическую связь.
Примеры веществ:Мерой прочности связи является энергия связи. Чем больше энергия связи, тем прочнее связь.
Тройная связь прочнее двойной, а двойная – прочнее одинарной.
Прочность связи также связана с длиной связи. Например, в ряду однотипных молекул H—F, H—Cl, H—Br, H—I увеличивается длина связи, так как увеличивается радиус атома в ряду F, Cl, Br, I:
С увеличением длины связи уменьшается притяжение ядер атомов к области перекрывания электронных облаков, следовательно, уменьшается прочность связи.
Мерой полярности химической связи является разность электроотрицательностей атомов, образующих данную связь. Чем больше эта разность, тем больше смещена общая электронная пара к одному из атомов, тем более полярна связь.
Сравним полярность связей HF и HCl, для чего рассчитаем разность электроотрицательностей (э.о.), пользуясь таблицей электроотрицательности (см. табл. 6): э.о. (H) = 2,1; э.о. (F) = 4,0; э.о. (Cl) = 3,0.
Связь HF: э.о. (F) – э.о. (H) = 4,0 – 2,1 = 1,9.
Связь HCl: э.о. (Cl) – э.о. (H) = 3,0 – 2,1 = 0,9.
1,9 > 0,9 – полярность связи HF больше, чем HCl.
Но в данном случае в двух сравниваемых молекулах имеется атом водорода и можно обойтись без расчётов. Фтор более электроотрицателен, чем хлор, поэтому молекула HF более полярна.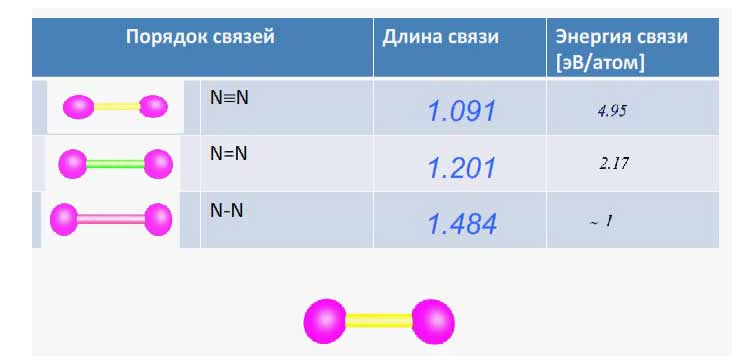
Поэтому ковалентная связь обладает направленностью.
Число ковалентных связей, которые может образовать атом по обменному механизму, ограничено максимальным числом неспаренных валентных электронов в максимально возбужденном состоянии атома (см. таблицу ниже), поэтому ковалентная связь насыщаема.
Итак, ковалентную химическую связь образуют атомы неметаллов. Разные по электроотрицательности неметаллы образуют ковалентную полярную связь, а одинаковые атомы образуют ковалентную неполярную связь. Ковалентная связь направлена и насыщаема. Атомы неметаллов с металлами образуют ионную связь, которая ненаправлена и ненасыщаема.
В образовании связей участвуют валентные электроны, происходит снижение полной энергии молекулы по сравнению с суммарной энергией взаимодействующих атомов. Лишняя энергия выделяется и называется энергией связи.
Чем больше энергии выделяется, тем прочнее связь.
Задания для закрепления
88) Составьте электронные схемы образования молекул HBr, NF3, LiF, BaO, SiCl4, H2Se, I2, CO2, K2S. Определите тип связи. В случае ковалентной химической связи определите валентность и степень окисления атомов и нарисуйте структурную формулу молекулы и перекрывание электронных облаков.
89) В каком ряду записаны формулы веществ только с ковалентной полярной связью:
1) HCl, KCl, SF6; 2) NH3, ClF, HF; 3) NO2, P4, HBr; 4) CCl4, I2, H2S.
Укажите номера правильных ответов (одна цифра).
90) Тремя общими электронными парами образована ковалентная связь в молекуле:
1) NH3; 2) N2; 3) K3N; 4) O2.
Укажите номера правильных ответов (одна цифра).
91) Ковалентная неполярная связь реализуется в соединении:
1) B2O3; 2) S8; 3) CH4; 4) HI.
Укажите номера правильных ответов (одна цифра).
92) Число σ-связей в молекуле CO2:
1) 1 2) 2 3) 3 4) 4.
Укажите номера правильных ответов (одна цифра).
93) Ионный характер связи наиболее выражен в соединении:
1) KF; 2) HF; 3) As2O5; 4) NO.
Укажите номера правильных ответов (одна цифра).
94) Атомы химических элементов III-го периода периодической системы Д.И. Менделеева образуют соединение с наиболее выраженным ионным характером связи:
1) MgF2; 2) SiO2; 3) Al2S3; 4) NaCl.
Укажите номера правильных ответов (одна цифра).
95) Длина связи увеличивается в ряду:
1) NH3, AsH3, PH3; 2) H2O, H2S, HCl; 3) H2O, H2S, H2Se; 4) HCl, HI, HBr.
Укажите номера правильных ответов (одна цифра).
96) Число связей увеличивается в ряду:
1) CO2, CCl4; 2) NO2, NH3; 3) N2, H2O; 4) PCl3, SO2.
Укажите номера правильных ответов (одна цифра).
97) Прочность связи увеличивается в ряду:
1) Cl2, O2, N2; 2) HF, HBr, HCl; 3) O2, N2, Cl2; 4) HI, HF, HCl.
Укажите номера правильных ответов (одна цифра).
98) Установите соответствие между формулой вещества и числом σ-связей в молекуле этого вещества:
| Вещество | Число σ-связей | |
| А) SO3 | 1) 1 | |
| Б) N2 | 2) 2 | |
| В) CO2 | 3) 3 | |
| 4) 4 | ||
| 5) 5 | ||
| 6) 6 |
Ответ:
К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 132.
99) Ионную связь образуют:
1) Rb и Br; 2) As и Cl; 3) Si и O; 4) Te и F.
Укажите номера правильных ответов (одна цифра).
100) Оцените правильность суждений о химической связи:
А) При образовании химической связи энергия всегда выделяется;
Б) -связь прочнее σ-связи;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
101) Оцените правильность суждений о химической связи:
А) При разрыве некоторых связей происходит выделение энергии;
Б) Ионная химическая связь ненаправлена и ненасыщаема;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
102) Оцените правильность суждений о химической связи:
А) Двойная связь прочнее, чем одинарная;
Б) Чем больше энергии выделяется при образовании связи, тем прочнее связь;
1) Верно только А; 2) Верно только Б; 3) Верны оба суждения; 4) Оба суждения неверны.
Укажите номера правильных ответов (одна цифра).
103) Из предложенного перечня выберите два соединения с наиболее полярной связью:
1) PH3; 2) BrCl3; 3) SiO2; 4) HF; 5) P2S3.
Укажите номера правильных ответов (две цифры).
104) Из предложенного перечня выберите три соединения с ковалентной полярной связью.
Расположите их в порядке увеличения длины связи:
1) SCl4; 2) P4; 3) CsCl; 4) SiCl4; 5) PCl3.
Укажите номера правильных ответов (три цифры).
105) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения полярности связи:
1) S8; 2) KH; 3) HI; 4) PH3; 5) HBr.
Укажите номера правильных ответов (три цифры).
106) Из предложенного перечня выберите три вещества с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле:
1) Cl2O; 2) SCl4 3) SrCl2; 4) Cl2; 5) SeCl4.
Укажите номера правильных ответов (три цифры).
107) Из предложенного перечня веществ выберите три, в молекулах которых имеется -связь. Расположите их в порядке увеличения полярности связи:
1) O2; 2) P4; 3) CO2; 4) PF5; 5) SO3. Ответ:
Укажите номера правильных ответов (три цифры).
§2.3. Донорно-акцепторный механизм образования ковалентной связи
Ранее был рассмотрен обменный механизм образования ковалентной связи, когда каждый атом, образующий химическую связь, дает по одному электрону в общее пользование, получается общая электронная пара, связывающая ядра двух атомов. Электронную пару в общее пользование может дать один атом (донор), а другой предоставит свободную орбиталь (акцептор). Образованная таким способом химическая связь является разновидностью ковалентной связи, так как образована общей парой электронов и отличается лишь механизмом образования, который называется донорно-акцепторным механизмом.
Рассмотрим несколько случаев образования донорно-акцепторной связи:
1) В молекуле NH3 атом азота образует три химические связи с тремя атомами водорода, у него остается одна пара валентных спаренных электронов, так как электронная конфигурация валентных электронов атома азота следующая: Электронная схема образования NH3:Cвободная валентная пара электронов атома азота может участвовать в образовании ковалентной связи по донорно-акцепторному механизму, а именно атом азота в молекуле :NH3 может быть донором электронов. Акцептором электронов может быть катион водорода (протон), у которого не осталось электронов, но имеется свободная валентная орбиталь.
Электронная схема образования : Заменив общие пары электронов черточками, получим структурную формулу иона аммония:Ион водорода принес с собой положительный заряд. В образованном ионе аммония азот четырехвалентен, так как имеет четыре химические связи. Четвёртая связь, образованная по донорно-акцепторному механизму, в итоге ничем не отличается от трех других. Чтобы показать донорно-акцепторную связь, отмечаем ее стрелкой, направленной от донора к акцептору.
На рисунке справа показано смещение электронных пар. Четыре связи ковалентные полярные, общие пары электронов смещены в сторону более электроотрицательного атома азота. В четвертой химической связи атом водорода не дал ни одного электрона (изначально был ион водорода H+, не имеющий электронов), поэтому к атому азота от атомов водорода смещены только три электрона, значит, степень окисления азота равна (-3):2) По донорно-акцепторному механизму образуется и ион H3O+ (ион гидроксония) из молекулы H2O и протона H+.
Конфигурация валентных электронов атома кислорода
то есть атом кислорода имеет два неспаренных электрона и две пары спаренных электронов:В молекуле H2O у атома кислорода остались незадействованными две пары валентных электронов, поэтому он может быть донором электронов при образовании иона H3O+.
Электронная схема образования иона гидроксония:
В ионе H3O+ атом кислорода образовал три химические связи, поэтому он трехвалентен. Все три связи ковалентные полярные, общие электроны связей смещены к более электроотрицательному атому кислорода. Два атома водорода дали в общее пользование каждый по одному электрону, третий атом H не имел электронов, был ионом H+, оба электрона связи были от атома кислорода, поэтому степень окисления атома кислорода (-2) – по числу смещенных электронов, степень окисления атома H – (+1).
3) Ион [BF4]–
Электронная конфигурация валентных электронов атома бора в основном состоянии: . В возбужденном состоянии: . Атом бора в возбужденном состоянии имеет три неспаренных электрона и одну свободную валентную орбиталь Электронная конфигурация валентных электронов атома фтора:Электронная схема образования молекулы BF3:
Атом бора в молекуле BF3 не приобрел устойчивую внешнюю восьмиэлектронную оболочку благородного газа, а имеет только шесть электронов на внешнем энергетическом уровне, но у него осталась свободная валентная орбиталь и он может выступить в качестве акцептора при образовании химической связи с донором электронов ионом F–.Электронная схема образования иона BF4–:
Ион F— принес c собой отрицательный заряд. В ионе BF4– атом бора приобрел устойчивую восьмиэлектронную внешнюю оболочку, образовал четыре химические связи, поэтому он четырехвалентен. Все четыре общие электронные пары смещены в сторону более электроотрицательного атома фтора, его степень окисления (-1), столько электронов смещено в сторону одного атома фтора. Степень окисления атома бора равна (+3), так как от атома бора смещено по трем связям три электрона, а четвертая связь образовалась по донорно-акцепторному механизму и бор был акцептором электронов.
4) Молекула CO. Электронная конфигурация валентных электронов:
Два неспаренных электрона атомов C и O образуют две химические связи:
Атом углерода не приобрел устойчивую восьмиэлектронную внешнюю оболочку, на внешнем энергетическом уровне у него только шесть электронов, но он может образовать еще одну химическую связь по донорно-акцепторному механизму (обозначена стрелкой), так как имеет свободную валентную орбиталь и может быть акцептором электронов, а атом кислорода имеет свободную валентную электронную пару и может быть донором электронов:
Атом углерода приобрел устойчивую восьмиэлектронную внешнюю оболочку. В молекуле CO три химические связи, поэтому атомы углерода и кислорода имеют валентность III. От атома углерода к более электроотрицательному атому кислорода по двум химическим связям смещено два электрона, а по третьей связи ни одного, так как в этой связи углерод являлся акцептором. По количеству смещенных электронов углерод имеет степень окисления (+2), а кислород – (-2):То, что в молекуле CO три химические связи, как и в молекуле N2, подтверждают близкие значения их энергий связи.
Eсв. (CO) = 1076 кДж./моль; Eсв. (N2) = 945 кДж./моль.
Для сравнения: Eсв. (O2) = 498 кДж./моль O = O
Eсв. (Cl2) = 243 кДж./моль Cl – Cl
Самое низкое значение Eсв. (Cl2), где одинарная химическая связь, выше – значение Eсв. (O2), где двойная химическая связь, и ещё выше Eсв. (N2) ≈ Eсв. (CO), где тройная химическая связь.
5) O3
Электронная конфигурация валентных электронов атома O: или – в основном состоянии. Возбужденное состояние атома возможно не только при распаривании электронных пар, но и при спаривании неспаренных электронов: или . Два неспаренных электрона двух атомов кислорода в основном состоянии образуют две химические связи:Затем молекула O2 образует донорно-акцепторную связь с возбужденным атомом кислорода:
– электронная формула молекулы O3Заменим общие электронные пары черточками, получим структурную формулу молекулы. Донорно-акцепторную связь покажем стрелкой:
Все атомы кислорода имеют разную валентность, а степень окисления у всех равна нулю, так как связи ковалентные неполярные, смещения электронов нет.
6) Образование молекулы NO (одна из гипотез).
Электронная схема образования молекулы NO:
Получается химическая связь – не двойная, не тройная, а промежуточная между ними (порядок связи 2,5). Такая гипотеза подтверждается энергией связи Eсв.(NO) = 678 кДж./моль. Это значение является промежуточным между энергией тройной связи Eсв.(N2) = 945 кДж./моль и двойной связи Eсв.(O2) = 498 кДж./моль. Молекула NO, имеющая неспаренный электрон, называется радикалом, и обладает магнитными свойствами, втягивается в магнитное поле.
7) NO2 является, как и NO, радикалом, и также обладает магнитными свойствами. Одна из гипотез образования NO2:
Энергии двух связей NO одинаковы и указывают на наличие не одинарной и не двойной, а полуторных связей.
8) HNO3. Структурная формула молекулы изображается так:Атом азота четырехвалентен. Одна из четырех связей его с кислородом – донорно-акцепторная. Донором является атом азота, так как имеет электронную пару, а акцептором – атом кислорода в возбужденном состоянии:
Степень окисления атома азота в этом соединении равна (+5), так как все пять его электронов смещены к более электроотрицательным атомам кислорода. Причем по одинарной донорно-акцепторной связи от азота к кислороду смещено 2e. По всем остальным связям от азота к кислороду по каждой связи смещено по 1e, так как эти связи образованы по обменному механизму: Задания для закрепления
108) Самостоятельно составьте электронные схемы образования молекул и ионов, фигурирующих в тексте, и определите валентность и степень окисления элементов.
109) Из предложенного перечня выберите два, в которых имеется донорно-акцепторная связь.
1) B2O3;
2) NH3;
3) O3;
4) (NH4)2S;
5) (NH2)2CO
Укажите номера правильных ответов (несколько цифр).
110) Из предложенного перечня выберите три соединения с ковалентной полярной связью. Расположите их в порядке увеличения прочности связи в молекуле.
1) S8;
2) CO;
3) CS2;
4) CO2;
5) Li2S
Укажите номера правильных ответов.
111) Из предложенного перечня выберите три соединения с наибольшим числом связей в молекуле.
1) HNO3;
2) NCl3;
3) SO3;
4) PCl5;
5) CS2.
Укажите номера правильных ответов. Расположите их в порядке увеличения числа -связей в молекуле.
112) Выберите две частицы, в которых валентность элемента численно не совпадает со степенью окисления этого же элемента:
1) NH3;
2) H3O+;
3) SO3;
4) Cl2O;
5) N2O5.
Укажите номера правильных ответов(две цифры).
§2.4. Валентные возможности атомов
В §2.2. мы рассмотрели образование ковалентной связи по обменному механизму. Число химических связей, образуемых атомом, зависит в этом случае от числа неспаренных электронов. Если углерод имеет в возбужденном состоянии 4 неспаренных электрона, то может образовать четыре химические связи по обменному механизму и проявляет валентность IV.
Валентность IV, равная номеру группы – это максимальная валентность атома углерода.У атома водорода всего 1e, поэтому он всегда одновалентен. Для водорода и других атомов-неметаллов, кроме элементов II-го периода, инертных газов He, Ne, Ar, максимальная валентность равна номеру группы:
Для элементов II-го периода B, N, O и F максимальная валентность не совпадает с номером группы. Для бора и азота их высшая валентность определяется числом валентных орбиталей и равна IV, так как бор, имея свободную валентную орбиталь, может образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму, являясь акцептором электронов, а атом азота может быть донором электронов за счет неподеленной валентной пары электронов и также образовать дополнительно одну ковалентную связь по донорно-акцепторному механизму (см. §2.3.)
Таким образом, азот – элемент V-ой группы – не может быть пятивалентным, а бор – элемент III-ей – группы может проявлять и валентность IV. Кислород – элемент VI-ой группы – также не может быть шестивалентным, так как не имеет d-подуровня для распаривания электронных пар. Максимальная его валентность равна III. Одна из трех химических связей образуется по донорно-акцепторному механизму (см. §2.3.)
Чаще всего кислород двухвалентен: F – элемент VII-ой группы – также не может быть семивалентным:Так как у него только один неспаренный электрон, он всегда одновалентен.
В таблице 7 показаны электронные конфигурации валентных орбиталей некоторых атомов в основном и возбужденном состояниях и их валентные состояния, а также возможные степени окисления и формулы веществ, в которых проявляюся эти валентности и степени окисления.
Инертные газы He, Ne и Ar не образуют соединений. Максимальная валентность благородных газов Xe, Rn равна VIII и проявляется в немногочисленных соединениях со фтором и кислородом: XeF8, XeO4.
Атомы неметаллов могут проявлять как положительные, так и отрицательные степени окисления. Их максимальная положительная степень окисления равна числу валентных электронов и, значит, равна номеру группы (кроме атомов кислорода и фтора). Рассмотрим на примере атома серы. Сера находится в 6-ой группе периодической системы, максимальная степень окисления равна (+6), например, в соединенииАтом S, находясь в маскимально возбужденном состоянии, образует 6 ковалентных связей, то есть является шестивалентным. Общие электронные пары связей смещены в сторону более электроотрицательных атомов фтора, по шести связям от атома серы смещено 6е, поэтому степень окисления серы (+6). Таким образом, валентность и степень окисления серы в молекуле SF6 совпадают.
Низшая степень окисления элемента-неметалла определяется числом электронов, которое может принять атом от менее электроотрицательного элемента до устойчивого восьмиэлектронного состояния и вычисляется по формуле: – (8 – № группы). Для серы: – (8 – 6) = –2. Так, в молекуле H2S, к атому серы по двум химическим связям смещено 2е. В этом соединении валентность и степень окисления также численно совпадают:У атома серы может быть ещё одно возбужденное состояние, где 4 неспаренных электрона. В этом состоянии она проявляет валентность IV, а степень окисления +4.
Так как фтор – самый электроотрицательный элемент, то он не может иметь положительную степень окисления, а поскольку он всегда одновалентен, то его степень окисления всегда равна (-1) и только в простом веществе F2 степень окисления равна 0.
Таблица 7. Возможные валентные состояния и степени окисления некоторых элементов
Окончание табл. 7
Атомы любых металлов могут иметь только положительные степени окисления, так как не могут принимать электроны, и их низшая степень окисления равна 0. Металлы s-элементы имеют постоянную положительную степень окисления, равную номеру группы.
d-элементы, как правило, имеют непостоянные степени окисления, их максимальная степень окисления не всегда совпадает с номером группы. Так, элемент I-ой группы Cu устойчив в степени окисления (+2).
В таблице 8 даны возможные степени окисления некоторых d-элементов.
Таблица 8. Возможные степени окисления некоторых d-элементов и электронные конфигурации валентных электронов в основном состоянии
Хорошо объяснимо, что цинк может иметь только одну степень окисления (+2). Электронная конфигурация Zn … 3s23p63d104s2. Третий энергетический уровень завершен, на нем 18 электронов, и отрыв хотя бы одного из этих электронов нарушает завершенность 3d-подуровня и 3-го уровня, нарушает устойчивость атома, следовательно, энергетически невыгоден. Валентными фактически являются 4s2-электроны, хотя Zn – d-элемент, а у d-элементов валентные электроны – это электроны последнего энергетического уровня и предпоследнего d-подуровня. Отдавая 4s2-электроны, Zn проявляет степень окисления (+2).
Задания для закрепления
113) Исходя из основного и возбужденного состояний атомов Si, As, Se, Br определите их возможные валентные состояния и степени окисления.
114) Из указанных в ряду химических элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +4:
1) N;
2) O;
3) Cr;
4) S;
5) P.
Укажите номера правильных ответов.
115) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять степень окисления +6:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Укажите номера правильных ответов.
116) Из указанных в ряду элементов выберите два элемента, которые в соединениях могут проявлять отрицательные степени окисления:
1) O;
2) Fe;
3) Se;
4) Sn;
5) Sr.
Укажите номера правильных ответов.
117) Из указанных в ряду элементов выберите два элемента, которые в соединениях проявляют постоянную степень окисления:
1) O;
2) Cr;
3) Zn;
4) Sn;
5) Sr.
Укажите номера правильных ответов.
118) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) Se;
2) Cu;
3) N;
4) Mn;
5) O.
Укажите номера правильных ответов (две цифры).
119) Из указанных в ряду элементов выберите два элемента, высшая степень окисления которых не совпадает с номером группы:
1) F;
2) Fe;
3) B;
4) Br;
5) Ba.
Укажите номера правильных ответов (две цифры).
120) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления азота и его валентность численно не совпадают:
1) NH3;
2) N2;
3) NF3;
4) HNO3;
5) NOF.
Укажите номера правильных ответов (две цифры).
121) Из числа указанных в ряду химических соединений выберите два, в которых степень окисления кислорода и его валентность численно не совпадают.
1) O2;
2) H2O;
3) OF2;
4) CO2;
5) H2O2.
Укажите номера правильных ответов (две цифры).
§2.5. Металлическая связь
Атомы металлов, вследствие их больших радиусов, легко теряют валентные электроны. В простых веществах-металлах, а также в сплавах, часть атомов находится в виде катионов. Освободившиеся электроны легко передвигаются между атомами и ионами (они обобществлены), и как цемент связывают кирпичики-катионы между собой.Связь между ионами металлов, осуществляемая свободнодвижущимися электронами, называется металлической.
При наложении на металл разности потенциалов относительно свободные электроны начинают двигаться от отрицательного полюса к положительному. Так объясняется электропроводность металлов. Наличием свободных электронов объясняется и теплопроводность металлов и сплавов.
Большинство металлов имеют мало валентных электронов на внешнем энергетическом уровне и много свободных валентных орбиталей. В простом веществе металле атомы и ионы настолько близко подходят друг к другу, что происходит перекрывание их валентных орбиталей, а валентные электроны могут свободно передвигаться по всем валентным орбиталям. При деформации металла (ковка, прокатка) слои атомов и ионов могут передвигаться относительно друг друга без ущерба для металлической связи. Например, из алюминия можно получить фольгу толщиной 0,01 мм, а из золота путем ковки или прокатки – фольгу толщиной 0,0001 мм.
Таким образом, физические свойства металлов – электро- и теплопроводность, ковкость, пластичность объясняются особым их строением, металлической связью между атомами и ионами.
§2.6. Межмолекулярные силы
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. В газах расстояние между молекулами гораздо больше размеров самих молекул. В жидкостях и твердых веществах расстояние между молекулами соизмеримо с размерами самих молекул. В жидкостях молекулы могут перемещаться относительно друг друга (текучесть), в твердых веществах движение отсутствует, имеются лишь легкие колебания относительно определенного положения.
Наличие трех агрегатных состояний веществ говорит о том, что между молекулами существуют силы взаимного притяжения. В твердых веществах они самые сильные, в жидкостях – слабее, в газах – самые слабые.
Все эти силы электрического происхождения.
Если в веществе реализуется ионная связь (например, NaCl), то оно построено не из молекул, а из ионов, которые электростатически притягиваются друг к другу и сила их притяжения (по закону Кулона) пропорциональна произведению их зарядов и обратно пропорциональна квадрату расстояния между их центрами.
Если вещество построено из полярных молекул, которые представляют из себя диполи, например, HCl:то между такими молекулами-диполями действуют постоянные межмолекулярные силы притяжения, называемые ориентационными, так как один диполь ориентирует соседний диполь определенным образом, отрицательным концом к своему положительному концу. Ясно, что ориентационные силы слабее сил электростатического притяжения полноценных ионов, так как в диполях заряд только частичный, меньше одинарного.
Если вещество построено из неполярных молекул (H2, Cl2), где нет ионов и диполей, между их молекулами также существуют силы притяжения. А иначе – как объяснить, что инертные газы, состоящие из неполярных одноатомных молекул, при достаточном понижении температуры переходят в жидкое или твердое состояние?
Вследствие непрерывного вращения отрицательных электронов и колебательного движения положительных ядер, в каждом из атомов всегда возможно временное смещение электронных орбит относительно ядра и обусловленное этим временное возникновение наведенных диполей:Хотя возникающие диполи могут существовать ничтожно малое время, их возникновение повторяется практически непрерывно. Такого рода межмолекулярные силы называются дисперсионными и являются самыми слабыми. В веществах с полярными молекулами действуют и дисперсионные силы. Все виды дисперсионных сил называются «силами Ван-дер-Ваальса».
Межмолекулярные силы влияют на расстояние между частицами вещества, а, следовательно, по тому, из каких частиц построено вещество (из ионов, полярных молекул или неполярных молекул), можно предположить, каково его агрегатное состояние при комнатной температуре.
Так как в ионных соединениях существуют сильные связи между частицами вещества, то все вещества ионного строения твердые при обычной температуре. Самые слабые силы действуют между неполярными молекулами, и при комнатной температуре большинство таких веществ являются газами, где между молекулами большие расстояния: инертные газы, H2, N2, O2, F2.
Чем выше межмолекулярные силы, тем больше усилий необходимо приложить для их разрыва и перевода вещества из твердого состояния в жидкое и из жидкого в газообразное (переход этот происходит при температурах плавления (t°пл.) и кипения (t°кип.) соответственно), тем выше t°пл. и t°кип. вещества. При нагревании вещества его частицы (ионы, молекулы, атомы) получают тепловую энергию. Чем сильнее связаны между собой частицы вещества, тем больше энергии им требуется, чтобы разорвались связи между ними, следовательно, тем выше t°пл. и t°кип. этого вещества. У веществ ионного строения высокие t°пл. и t°кип., у веществ молекулярного строения они ниже.
Рассмотрим простые вещества F2, Cl2, Br2, I2. Их молекулы однотипны, неполярны, с одинарной ковалентной связью: F–F, Cl–Cl, Br–Br, I–I. В этом ряду радиусы атомов возрастают. Чем больше радиус атома (а значит, и его масса), тем слабее связаны с ядром валентные электроны, тем легче образуется из такого атома кратковременный диполь (атом поляризуется, становится полярным), тем сильнее межмолекулярные силы (дисперсионные), тем выше t°пл. и t°кип. вещества.
В таблице 9 даны температуры плавления и кипения галогенов и их агрегатные состояния при комнатной температуре.
Таблица 9. Физические свойства галогенов
§2.7. Водородная связь
Как видим из таблицы 9, с увеличением молекулярной массы вещества в ряду F2, Cl2, Br2, I2 увеличивается и интенсивность окраски вещества от светло-желтого до темно-филетового, так как уменьшается расстояние между молекулами вследствие увеличения сил межмолекулярного притяжения. Расстояние между молекулами брома (жидкость) меньше, чем между молекулами газов F2 и Cl2, а между молекулами I2 (твердое вещество) меньше, чем в жидкости.
Среди однотипных полярных молекул HCl, HBr, HI, где имеют место и ориентационные силы, и дисперсионные, с увеличением массы вещества, так же, как и в предыдущем случае с галогенами – F2, Cl2, Br2, I2, увеличиваются дисперсионные силы.
В HCl на долю дисперсионных сил приходится 81% всего межмолекулярного взаимодействия, в HBr – 95%, а в HI – 99,5%. В связи с этим в ряду HCl, HBr, HI наблюдается закономерное увеличение t°пл. и t°кип., что видно из таблицы 10:
Таблица 10. Температуры плавления и кипения галогеноводородов
Из этого ряда выпадает HF. У него самая низкая молекулярная масса. Ожидаемо, что самые низкие должны быть t°пл. и t°кип.
HF, H2O и NH3 плавятся и кипят при аномально высоких температурах. Это объясняется образованием дополнительной межмолекулярной связи, называемой водородной, которая гораздо сильнее Ван-дер-Ваальсовой.
Водородная связь образуется между атомом водорода одной молекулы, соединенным с сильно электроотрицательным атомом F, O или N, и сильно электроотрицательным атомом (F, O или N) другой молекулы.
Образование достаточно прочной водородной связи объясняется тем, что связь H–F (H–O, H–N) является сильно полярной вследствие высокой электроотрицательности элементов F, O, N, и общая пара электронов сильно смещена в сторону F, O и N, повышая частичный заряд на атомах и оголяя положительное ядро атома водорода, ведь у него всего один электрон.
Благодаря водородной связи образуются димеры (удвоенные молекулы), тримеры и т.д. Объединение молекул затрудняет отрыв их друг от друга и является причиной высоких t°пл. и t°кип.
Как же можно объяснить, что H2O с молекулярной массой 18 имеет t°кип. = 100 °C, а HF с большей молекулярной массой (Mr(HF) = 20) имеет t°кип. = 19,5 °C – гораздо ниже, ведь водородные связи имеются и в том, и в другом веществе, в HF даже более сильные водородные связи, так как связь H – F более полярная?
В молекуле H2O – два атома водорода, связанных с кислородом, а в HF – только один атом водорода связан с электроотрицательным атомом – в результате этого каждая молекула H2O может образовать три водородные связи с соседними молекулами, а одна молекула HF – только две водородные связи:
Все рассмотренные виды химических связей можно расположить в ряд по мере возрастания их энергии связи: Межмолекулярная Водородная Металлическая Ионная и Ковалентная.Самые прочные связи – ионные и ковалентные.
Задания для закрепления
122) Водородная связь реализуется:
1) В молекуле H2;
2) В молекуле H2O;
3) Между молекулами H2;
4) Между молекулами H2O.
Укажите номер правильного ответа.
123) Прочность водородной связи зависит от:
1) От электроотрицательности атома элемента, связанного с водородом;
2) От величины частичного положительного заряда на атоме водорода;
3) От полярности связи водород-элемент;
4) Все перечисленные выше ответы верны.
Укажите номер правильного ответа.
124) Наиболее прочные водородные связи образуются между атомом водорода и атомом:
1) Хлора;
2) Кислорода;
3) Серы;
4) Азота.
Укажите номер правильного ответа.
125) В ряду HF – HCl происходит увеличение:
1) Длины связи;
2) Полярности связи;
3) Степени окисления галогена;
4) Температуры кипения.
Укажите номер правильного ответа.
126) Образование водородной связи между молекулами веществ не оказывает влияние на
физическое свойство:
1) Температуру кипения;
2) Температуру плавления;
3) Плотность;
4) Пластичность.
Укажите номер правильного ответа.
127) Водородная связь образуется между молекулами:
1) CH4;
2) CH3OH;
3) H2S;
4) H2.
Укажите номер правильного ответа.
128) Между атомами элементов с порядковыми номерами 12 и 9 возникает связь:
1) Металлическая;
2) Ионная;
3) Ковалентная;
4) Донорно-акцепторная.
Укажите номер правильного ответа.
129) Степень окисления азота в ионе NH4+:
1) +4;
2) -4;
3) +3;
4) -3.
Укажите номер правильного ответа.
130) Установите соответствие между веществом и видом связи в этом веществе:
| Формула | Класс вещества | |
| 1) Zn | А) Ионная | |
| 2) NH3 | Б) Ковалентная полярная | |
| 3) O2 | В) Ковалентная неполярная | |
| 4) CaBr2 | Г) Металлическая |
К каждой позиции, обозначенной цифрой, выберите позицию, обозначенную буквой. Например, в ответе нужно записать АВГБ.
131) Установите соответствие между видом связи в веществе и формулой химического вещества:
| Вид связи | Формула вещества | |
| А) Ионная | 1) N2 | |
| Б) Ковалентная полярная | 2) Cu | |
| В) Ковалентная неполярная | 3) MgO | |
| Г) Металлическая | 4) N2O |
К каждой позиции, обозначенной буквой, выберите позицию, обозначенную цифрой. Например, в ответе нужно записать 1243.
132) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная неполярная связь:
1) S8;
2) K2S;
3) SO2;
4) H2S;
5) H2.
Укажите номера правильных ответов.
133) Из предложенного перечня веществ выберите два вещества, в молекулах которых имеется ковалентная полярная связь:
1) O3;
2) BaS;
3) SF6;
4) AsCl3;
5) CsF.
Укажите номера правильных ответов.
134) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная химическая связь.
1) Cl2O;
2) Rb2S;
3) CS2;
4) SiO2;
5) CrCl3.
Укажите номера правильных ответов.
135) Из предложенного перечня веществ выберите два вещества, в которых присутствует ионная связь.
1) B2O3;
2) BaS;
3) CS2;
4) Mn2Si;
5) SiC.
Укажите номера правильных ответов.
136) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке возрастания температур кипения.
1) N2;
2) H2O;
3) O2;
4) H2;
5) H2S;
Укажите номера правильных ответов.
137) Из предложенного перечня выберите три вещества с наименьшей температурой кипения. Расположите их в порядке уменьшения температур кипения:
1) H2O;
2) Ne;
3) K2S;
4) F2;
5) Cl2;
Укажите номера правильных ответов.
138) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) HF;
2) CO;
3) NaCl;
4) H2;
5) HBr;
Укажите номера правильных ответов.
139) Из предложенного перечня выберите три вещества с наибольшей температурой кипения. Расположите их в порядке увеличения температур кипения:
1) NH3;
2) He;
3) H2O;
4) PH3;
5) CaO;
Укажите номера правильных ответов.
вернуться на Главную страницу сайта
Вопросы.
1.Перечислите важнейшие типы химической связи. Влияет ли электроотрицательность, а если влияет, то как, на тип связи в молекуле?
2.Какая связь называется ионной?
3.Какие силы в ионном кристалле сохраняют его как единое целое?
4.Какая связь называется ковалентной?
5.Каковы механизмы образования ковалентной связи?
6.Ковалентность элемента в соединении и его максимальная ковалентность?
7.Что такое степень окисления элемента?
8.Может ли принимать дробное значение:а) ковалентность;б) степень окисления?
9.Любые ли два электрона способны образовывать связующую (общую электронную) пару?
10.Всегда ли энергетически оправдан процесс распаривания валентных электронов?
11.Почему ковалентность Не равна 1, а ковалентность Ве, имеющего, как и Не, на внешнем слое 2 электрона, равна 4?
12.Чему равна максимальная ковалентность элементов:а)II периода; б)IIIпериода?
13.Каковы основные положения метода валентных связей?
14.Что называется длиной связи ?
15.Что такое насыщаемость химической связи?
16.Чем определяется направленность химической связи?
17.Характеризуется ли ионная связь направленностью и насыщаемостью?
18.Как образуются - и - связи? Какие электроны принимают участие в образовании этих связей?
19.Чем определяется кратность связи?
20.Что такое энергия связи? Почему - связь как правило прочнее - связи?
21.Что такое нелокализованная связь? Приведите пример.
22.Какие факторы влияют на прочность ковалентной связи?
23.Как изменяется прочность и длина связи: а) для хлоридов щелочных металлов с возрастанием порядкового номера металла; б) Э-Н в пределах подгруппы с ростом порядкового номера элемента?
24.Гибридизация атомных орбиталей. В чём состоит явление гибридизации атомных орбиталей?
25.Типы гибридизации атомных орбиталей. Пример соединений с разными типами гибридизации.
26.Все ли образуемые связи определяют пространственную конфигурацию молекул?
27.Что такое валентный угол?
28.Какова пространственная конфигурация гибридных атомных орбиталей и валентные углы: а) sp-; б) sp2-; в) sp3— гибридизации?
29.Полярная и неполярная ковалентная связь. Чем они отличаются?
30.Полярные и неполярные молекулы. Может ли быть молекула неполярной при полярности отдельных связей в молекуле?
31.Что такое дипольный момент? В каких единицах он выражается?
32.Как ведут себя полярные и неполярные молекулы в электрическом поле?
33.В чём заключается явление поляризации ионов? Оказывает ли влияние на поляризуемость и поляризующее действие ионов их заряд, радиус и строение электронных оболочек? Если оказывает, то какое?
34.Зависит ли окраска соединений от поляризуемости ионов? Ответ объяснить?
35.Основные положения метода молекулярных орбиталей. Как располагаются молекулярные орбитали в зависимости от их энергии?
36.Каков порядок заполнения молекулярных орбиталей электронами при образовании молекул? Чем определяется этот порядок?
37.Что такое порядок связи? Как он определяется в методе молекулярных орбиталей?
38.Чем определяется устойчивость и магнитные свойства молекул в методе молекулярных орбиталей?
Задачи
1. Составьте валентные схемы следующих молекул и ионов, определите ковалентность и степень окисления элементов в данных соединениях:
а) H2S, SO2, SO3, CS2; б) C2H2, COS, C6H6, CCl4; в) NH3,NH4+ ,HCN,
NH2OH; г) H2O2, H3O+, OF2, O2;д) NCl3,N2O3, N2H4, N2; e) CH4,COCl2,
CH3COOH; ж) HNO3, NF3, AlN, NH4OH; з) PH3, H3PO4, POCl3, PH4+ ;
и) SO2Cl2, H2SO4, SO3, BCl3; к) AlCl3, Cl2O, ClF3, COCl2; л) H2CO3, C2H4, HCOOH, COSe; м) AsH3, H3AsO4, AlAs, As2S3; н) HClO, ClF5, ClO2— , ClO3—; о) SiH4, SiS2, SiO32-, AsH3; п) HNO2, PCl3, PO43- , AlP.
2. Укажите, какие частицы являются донорами и какие акцепторами в следующих соединениях:
а)[H3O]+,[BeCl4]2-;б)[BF4]—,[SiF6]2-;в)[BH4]—, [GaCl6]3-;г) [AlF4]—, [GeCl6]2-.
3. Какие из указанных молекул и ионов являются потенциальными донорами? Потенциальными акцепторами? а) Cu2+, H2O, OH— , Ag+ ; б) CN— , BF3, SiCl4; в) F —, Zn2+ , NO2—, H+ .
4.Какие орбитали атома азота участвуют в образовании ковалентных связей в соединениях: NF3, NO3— , NO2—, NH4+ ?
5.Составьте схемы распределения валентных электронов атома бора в основном и возбуждённом состояниях. Сколько ковалентных связей по обменному и по донорно-акцепторному механизму он может образовать? Приведите примеры соответствующих соединений. Какую степень окисления проявляет бор в этих соединениях?
6.Может ли ковалентность азота быть равной номеру группы? Объясните механизм образования иона NO3—. Какую степень окисления и ковалентность проявляет азот при образовании данного иона? Приведите примеры соединений азота с положи тельной и отрицательной степенью окисления.
7.Напишите формулы соединений фосфора с алюминием и галлием, его оксидов и гидроксидов. Какую степень окисления имеет фосфор в этих соединениях? Образует ли фосфор донорно-акцепторные связи в ионе PF6— ?
8.Напишите формулы соединений мышьяка с сурьмой, галлием, серой, водородом, его оксидов и гидроксидов. Какие свойства, кислотные или амфотерные, проявляют оксиды и гидроксиды мышьяка?
9.Какая связь, ионная или ковалентная, будет преобладать в оксидах ванадия, ниобия и тантала со степенью окисления этих элементов +5? По значениям стандартной энергии Гиббса образования оксидов укажите, для какого элемента степень окисления +5 более характерна:
Gо298, V2O5(кр.) Nb2O5(кр.) Ta2O5(кр.)
кДж/моль -1427 -1776 -1908
10. Запишите электронную формулу атома серы в основном и возбуждённом состояниях. Какие степени окисления она может проявлять? Запишите формулы соединений серы с алюминием, фосфором, железом.
11.Запишите электронную формулу для атома фосфора в основном и возбуждённом состояниях. Какую ковалентность и степени окисления он может проявлять в своих соединениях? Приведите примеры соединений фосфора со степенью окисления -3, +3, +5.
12.Какую ковалентность проявляет кислород в молекуле озона О3? Может ли быть ковалентность кислорода равной номеру группы? Какие степени окисления проявляет кислород в своих соединениях? Приведите примеры этих соединений.
13.Какую пространственную конфигурацию имеют молекулы:
а)H2O, NH3; б)NCl3, SO2; в) AsH3, F2O;г) SbCl3, H2O2; д)AsCl3, H2Se;
е)NOCl, PCl3; ж) N2H4, SbH3; з)H2Te, NF3; и)OF2, Cl2O; к) N2O5, PH3;
л)CCl4, BCl3; м) HgCl2; PH3;н) ZnCl2, BeI2; о) SiH4,SF6; п) HCN, CO2.
14.В чём причина различной пространственной структуры молекул PCl3 и AlCl3?
15.Объясните различие в пространственной структуре молекул NCl3, PCl3 и BCl3. Какая из них будет полярной?
16.На основании пространственной структуры молекул SO2 и SO3 объясните, почему молекула SO2 полярна, а SO3 неполярна?
17. Для следующих соединений CCl4, HCOOH, CS2 укажите: а) кратность связей, образуемых атомами углерода; б) сколько связей образует атом углерода в соединении; в) тип гибридизации валентных орбиталей атомов углерода;
г) пространственную конфигурацию данных соединений.
18.Какой может быть пространственная структура трёхатомных молекул? Рассмотрите на примерах молекул ВеCl2, CO2, H2O. Какие из приведённых молекул будут полярными?
19.Для приведённых ниже молекул и ионов укажите: тип гибридизации валентных орбиталей центрального атома, пространственную структуру соединений, направление дипольных моментов связей:
а) CS2, CO32-; б) BCl3, BCl4—; в) BeF2, BeF42-; г) CF4, SO42-; д) HCN, ClO4— ; е) GeH4, NO3— ;
ж) CH2Cl2, H3O+; з) CHCl3, PO43-; и)POCl3, AsO43- ; к) SiS2, SeO42-; л) SO2Cl2, BO3 3- ; м) COCl2, BH4—; н) HCOOH, SiO32- ; о) COSe , BO2 — ; п) COS, CO32- ; р) PCl5, [SnCl6]2- .
20.Определите пространственную конфигурацию следующих ионов NH4+ и BF4— ?
21. Олово и свинец образуют соединения SnCl2 и PbCl2 , но мономер ССl2 неустойчив. Почему?
22. Молекулы SnCl2 и PbCl2 , существующие в газообразном состоянии, имеют угловую форму, а HgCl2 и CdCl2 — линейную. Почему?
23. Рассмотрите образование иона Н3О +. Какую структуру он имеет?
24. При взаимодействии молекул NH3 и BF3 и образуются молекулы NH3 BF3 . Какова их структура?
25. В каком из соединений связь больше всего приближается к ионной:
а) Ca3N2, Ca3P2, Ca3As2, Ca3Sb2; б) NaF, MgF2, BF3, CF4.
26. Как изменяется доля ионной связи в ряду молекул HF, HCl, HBr, HI ?
27. Расположите вещества в порядке усиления ионного характера связи CsF, CaCl2, NaF, ClF, CO, HF, HCl, BeF2, MgF2. Ответ мотивируйте, пользуясь величинами ЭО.
28. Перечислите важнейшие свойства ионных соединений.
29. Почему галиды щелочных и щелочноземельных металлов имеют более высокую температуру плавления, чем галиды водорода?
30. Расположите соединения в порядке возрастания степени полярности связи:
а) NH3, PH3, AsH3;б) H2O, H2S, H2Se; в) BeCl2, BCl3, CCl4; г) CH4, NH3, H2O; д) AlCl3, SiCl4, PCl5.
31. Объясните изменение дипольных моментов в ряду:
HF HCl HBr HI
.1030, Кл..м 5,73 3,24 2,97 1,14
32. Расположите соединения в порядке возрастания ионного характера связи:
а)MgCl2, AlCl3, SiCl4; б)AlCl3, Al2S3, AlN; в) BeO, BeCl2, BeF2.
33. Как изменяется значение эффективных зарядов атомов и доля ионной связи в соединениях: а) CO2, CCl4, CF4; б) CO2, CS2, CTe2; в) ZnCl2, ZnO, ZnS; г) AlCl3, Al2S3, AlN ?
34. В каком из приведённых соединений: LiF, BeF2, BF3, CF4 связь Э-F будет больше всего приближаться к ковалентной?
35. Какая из связей: Ge-H, As-H, Se-H будет более полярна?
36. Дипольный момент связи C-Cl равен 6,8.10-30 Кл.м. Чему равна длина диполя? Сопоставить с длиной связи.
37. Длина диполя молекулы HCl равна 2,2. 10-11 м. Рассчитайте дипольный момент молекулы.
38. Длина диполя молекулы HF равна 4. 10-11 м. Вычислите дипольный момент.
39. Дипольный момент молекулы SO2 равен 5,36.10-30Кл.м. Рассчитайте длину диполя.
40.Дипольный момент молекулы HCN равен 9,66.10-30Кл.м. Рассчитайте длину диполя.
41. Как и почему меняются валентные углы в ряду молекул H2O, H2S, H2Se, H2Te?
42.Определите дипольный момент молекулы, если длина диполя равна 4,05.10-11 м.
43. Дипольный момент молекулы воды равен 6,0910-30Клм. Определите длину диполя.
44.Определите, какие из перечисленных молекул являются полярными и почему:
SO2, H2S, CO, CO2, CCl4, NH3, CH4, C6H6, CHCl3, CS2, COS, N2.
45. Как будет изменяться значение дипольного момента в ряду молекул HF, HCl, HBr, HI ?
46. Дипольный момент молекулы H2S равен 3,10.10-30 Кл.м, а момент связи S-H равен 2,26.10-30 Кл.м. Вычислите валентный угол в молекуле H2S.
47.Валентный угол в молекуле воды составляет 105о, дипольный момент молекулы равен 6,09.10-30 Кл.м. Определите момент связи О-Н .
48.Молекулы NH3 и NF3 имеют аналогичную пространственную конфигурацию, однако их дипольные моменты заметно отличаются друг от друга (5,23.10-30 и 0,67.10-30 Кл.м — соответственно). Дайте этому объяснение.
49.Длина диполя молекулы HBr равна1,86.10-11м. Вычислить дипольный момент.
50. Полярны или неполярны молекулы OF2, PF3, ZnCl2, H2Te, CO2? Какова их структура?
51.Сравните характер связей в двухатомных молекулах ClF, BrCl, ICl, IBr .
52.Дипольные моменты молекул NH3, PH3, NF3 равны соответственно 4,86Д; 1,86Д; 0,67Д. Чем объяснить, что: (NH3) > (PH3) > (NF3)?
53. Объясните закономерность уменьшения энергии связи в следующем ряду:
связь: H-H Li-Li Na-Na K-K
Е, кДж/моль 434,72 260,41 73,15 49,32
Чем можно объяснить значительно большую энергию связи в молекуле водорода?
54. Энергия связи в молекулах галогенов характеризуется следующими величинами:
связь: F-F Cl-Cl Br-Br I-I
Е, кДж/моль 154,66 242,44 192,28 150,48
Почему энергия связи в молекулах галогенов сначала увеличивается, а затем уменьшается?
55. Вычислите среднюю энергию связи в молекулах аммиака,если стандартная энтальпия образования аммиака равна -46,19кДж/моль, а энергия диссоциации N2 и H2 соответственно равны (кДж/моль): 945,6 и 435,9.
56. Вычислите энергию связи в молекуле NO, если стандартная энтальпия образования NO равна 90,4 кДж/моль, а энергии диссоциации молекул О2 и N2 на атомы соответственно равны (кДж/моль): 486 и 945,6.
57. В каком из соединений и почему связь между атомами углерода более прочная: C2H2, C2H4, C2H6 ?
58. Энергия связи в молекуле BF (752,4 кДж) превышает среднюю энергию связи в молекуле BF3 (384,6 кДж) почти в 2 раза. Почему?
59. С точки зрения теории валентных связей объясните близость по величине энергии диссоциации молекул СО и N2 на атомы (1109,8 и 940,9 кДж/моль соответственно).
60. Вычислите Но диссоциации молекулы водорода на атомы, используя следующие данные: энергия связи в молекуле НCl равна 430,5 кДж/моль, энергия связи в молекуле Cl2 равна 242,4 кДж/моль, энтальпия образования HCl равна -92,4 кДж/моль.
61. Вычислите энергию диссоциации на атомы молекулы СО, если известно, что для атомизации 1 моль О2 и 1 моль атомов графита надо затратить соответственно 493,2кДж и 710,6 кДж. Энтальпия образования СО равна — 110 кДж/моль.
62. Вычислите энергию связи в молекуле HBr, если энергия связи в молекуле Н2 равна 434,7 кДж/моль, а энергия связи в молекуле Br2 равна 192,3 кДж/моль. Энтальпия образования HBr равна — 36,1 кДж/моль.
63. Вычислите энергию связи Cl-F, если энтальпия образования ClF равна — 62,7 кДж/моль, энергия диссоциации молекулы хлора 242,4 кДж/моль и энергия связи в молекуле фтора равна 154,7 кДж.
64. Определите энергию атомизации углерода, если энергия связи Н-Н равна 434,7 кДж/моль, средняя энергия связи С-Н равна 413,8 кДж/моль, а энтальпия образования метана СН4 равна -74,84 кДж/моль.
65. Вычислить среднюю энергию связей О-Н, N-H, S-H в молекулах H2O, NH3 и H2S по следующим данным: молекула Hообр. кДж/моль молекула Едисс. кДж/моль
H2O -241,6 N2 940,5
NH3 -45.98 O2 493,24
H2S -20,06 H2 434,7
66. Определите энтальпию образования аммиака, если даны энергии связей:
связь: N=N H-H H-N
E, кДж/моль 940,5 434,7 388,7
67. В каком из соединений HClO, HClO2, HClO3, HClO4 связь между атомами кислорода и хлора более прочная? Почему?
68. Укажите, как и почему изменяется энергия связи в ряду соединений: ВCl3 — AlCl3 — GaCl3?
69. Как изменяется энергия связи в ряду галидов углерода:CF4-CCl4-CBr4— C I4?
70. Как изменяется энергия связи в ряду соединений: NH3 — PH3 — AsH3 -SbH3 ?
71. На основании размера ионов (используя схему Косселя) объясните, как изменяется сила кислот и их окислительно-восстановительные свойства в рядах:
1) H2S — H2S2 — H2Te;
2) HF — HCl — HBr — HI;
3) H2SO3 — H2SeO3 — H2TeO3;
4) HClO — HClO2 — HClO3 — HClO4;
5) HClO — HBrO — HIO.
72. На основании схемы Косселя объясните, как изменяется прочность связи и устойчивость соединений в рядах:
1) CF4 — CCl4 — CBr4 — CI4 ;
2) CH4 — SiH4 — GeH4 — SnH4;
3) NH3 — RH3 — AsH3 — SbH3.
73. На основе схемы Косселя объясните,как изменяются кислотно — основные свойства в ряду оксидов:
1) VO — V2O3 — VO2 — V2O5;
2) CrO — Cr2O3 — CrO3;
3) MgO — Al2O3 — SiO2 — SO2.
74. Какие степени окисления проявляют в соединениях элементы побочной подгруппы? Как изменяются кислотно-основные свойства гидроксидов марганца со степенями окисления +2,+4,+6,+7 ?
75. Как и почему изменяется сила кислот в рядах:
а).H2MnO4 — H2TeO4 — H2ReO4; б). HMnO4 — HTeO4 — HReO4.
76. Какие степени окисления характерны для Fe, Co, Ni ? Как изменяются основные свойства гидроксидов при переходе от Fe к Ni ? Как изменяется восстановительная способность в ряду ионов Fe2+ — Co 2+ — Ni 2+ ? Какие степени окисления характерны для платиновых металлов?
77. Как изменяется поляризуемость ионов в рядах:
а) Li+ , Na + , K + , Cs + ;
б) Be 2+ , Mg2+ , Ca2+ , Sr 2+ , Ba2+ ;
в) F— , Cl— , Br — , I — ;
г) Mg 2+, Na+ , Ne, F— , O22- ?
78. Как меняется поляризующее действие ионов в рядах:
а) Al 3+ , Sc3+ , Y3+ , La3+ ;
б) F— , Cl — , Br — , I — ;
в) O 2-, S2- , Se2- , Te2- ?
79. Почему в водном растворе не могут существовать ионы Mn7+, Cr6+, V5+ ?
80. Почему кислородсодержащие кислоты менее устойчивы, чем их соли?
81. Почему легко протекающая для SiF4 реакция присоединения ионов F— (SiF4 + 2F— = [SiF6]2- ) не идёт при замене SiF4 на CF4 ?
82. Почему хлориды алюминия, цинка, серебра и золота нельзя считать ионными соединениями?
83. Как объяснить уменьшение растворимости в воде в ряду соединений AgF , AgCl , AgBr , AgI?
84. Почему при равенстве радиусов катионов температура плавления CdCl2 ниже температуры плавления CaCl2 ?
85. Как можно объяснить уменьшение устойчивости в ряду солей CuF2, CuCl2, CuBr2, CuI2?
86. Какое соединение — карбонат натрия или карбонат серебра обладает большей термической устойчивостью? Почему?
87. Как с помощью поляризационных представлений объяснить невозможность получения гидроксидов серебра и ртути?
88. Как изменяется термическая устойчивость в ряду карбонатов бериллия, магния, кальция, стронция и бария? Почему?
89. Почему термическая устойчивость сульфатов больше устойчивости соответствующих карбонатов?
90. Опишите методом молекулярных орбиталей молекулы N2 и СО. Определите кратность связи в данных молекулах.
91. Молекула Не2 не существует, однако ион Не2+ сравнительно устойчив. Объясните это с точки зрения метода молекулярных орбиталей.
92. Какая частица имеет большую энергию связи — NO или NO+ ?
93. Объясните наличие магнитных свойств в молекуле О2, используя метод молекулярных орбиталей.
94. Какие из перечисленных соединений обладают парамагнитными свойствами O2+, O2 , O2— , O22- ?
95. Объясните причину изменения длин связей в приведённых соединениях:
соединение: O2+ O2 O2— О22-
длина связи, l.1010, м: 1,123 1,207 1,300 1,490
96. Определите кратность связи в молекуле BF.
97. На основании метода молекулярных орбиталей сделайте вывод об устойчивости частиц Ве2 и Ве2+
98. Пользуясь методом молекулярных орбиталей объясните, почему потеря одного электрона молекулой СО (СО СО+ ) приводит к ослаблению связи, а молекулой NO (NO NO+) — к упрочнению связи?
99. Опишите методом молекулярных орбиталей образование:
H2+, H2, Li2, C2, N2, F2.
100. Опишите методом молекулярных орбиталей образование частиц: CO, NO, NO+ , O2+.
101. Какая из частиц — NO+ , NO или NO— характеризуется наименьшей длиной связи? Как это сказывается на устойчивости частиц?
102. Как изменяется энергия связи между атомами азота и кислорода в соединениях: NO, N2O3, NO2?
103. Объясните изменение энергии диссоциации (кДж/моль) молекул в ряду: F2(155) — O2(493) — N2(945).
104. Как теория молекулярных орбиталей объясняет невозможность образования молекул He2, Be2, Ne2?
105. Как теория молекулярных орбиталей объясняет:
а) диамагнетизм молекул N2 и F2; б) парамагнетизм молекул В2 и О2?
106. Одинаковы ли магнитные свойства молекул СО и NO?
107. Используя метод МО орбиталей определите порядок и магнитные свойства молекул и ионов:
а) LiBr, NS+ ; б) CN+,HHe; в) CS+,Al2 ; г) Rb2+,SO;д) Br2— ,BO; е) I2— ; I2+
4. Характеристики химических связей. Зависимость свойств веществ от их состава и строения | ЕГЭ по химии
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Учение о химической связи составляет основу всей теоретической химии.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Различают четыре типа химических связей: ионную, ковалентную, металлическую и водородную.
Деление химических связей на типы носит условный характер, по скольку все они характеризуются определенным единством.
Ионную связь можно рассматривать как предельный случай ковалентной полярной связи.
Металлическая связь совмещает ковалентное взаимодействие атомов с помощью обобществленных электронов и электростатическое притяжение между этими электронами и ионами металлов.
В веществах часто отсутствуют предельные случаи химической связи (или чистые химические связи).
Например, фторид лития LiF относят к ионным соединениям. Фактически же в нем связь на 80% ионная и на 20% ковалентная. Правильнее поэтому, очевидно, говорить о степени полярности (ионности) химической связи.
В ряду галогеноводородов HF—HCl—HBr—HI—HАt степень полярности связи уменьшается, ибо уменьшается разность в значениях электроотрицательности атомов галогена и водорода, и в астатоводороде связь становится почти неполярной (ЭО(Н)=2.1;ЭО(At)=2.2).
Различные типы связей могут содержаться в одних и тех же веществах, например:
- в основаниях: между атомами кислорода и водорода в гидроксогруппах связь полярная ковалентная, а между металлом и гидроксогруппой — ионная;
- в солях кислородсодержащих кислот: между атомом неметалла и кислородом кислотного остатка — ковалентная полярная, а между металлом и кислотным остатком — ионная;
- в солях аммония, метиламмония и т. д.: между атомами азота и водорода — ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком — ионная;
- в пероксидах металлов (например, Na2O2) связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом — ионная и т.д.
Различные типы связей могут переходить одна в другую:
— при электролитической диссоциации в воде ковалентных соединений ковалентная полярная связь переходит в ионную;
— при испарении металлов металлическая связь превращается в ковалентную неполярную и т.д.
Причиной единства всех типов и видов химических связей служит их одинаковая химическая природа — электронно-ядерное взаимодействие. Образование химической связи в любом случае представляет собой результат электронно-ядерного взаимодействия атомов, сопровождающегося выделением энергии.
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентная химическая связь — это связь, возникающая между атомами за счет образования общих электронных пар.
Механизм образования такой связи может быть обменным и донорно-акцепторным.
I. Обменный механизм действует, когда атомы образуют общие электронные пары за счет объединения неспаренных электронов.
1) h3 — водород:
Связь возникает благодаря образованию общей электронной пары s-электронами атомов водорода (перекрыванию s-орбиталей):
2) HCl — хлороводород:
Связь возникает за счет образования общей электронной пары из s− и p−электронов (перекрывания s−p−орбиталей):
3) Cl2: в молекуле хлора ковалентная связь образуется за счет непарных p−электронов (перекрывание p−p−орбиталей):
4) N2: в молекуле азота между атомами образуются три общие электронные пары:
II. Донорно-акцепторный механизм образования ковалентной связи рассмотрим на примере иона аммония Nh5+.
Донор имеет электронную пару, акцептор — свободную орбиталь, которую эта пара может занять. В ионе аммония все четыре связи с атомами водорода ковалентные: три образовались благодаря созданию общих электронных пар атомом азота и атомами водорода по обменному механизму, одна — по донорно-акцепторному механизму.
Ковалентные связи можно классифицировать по способу перекрывания электронных орбиталей, а также по смещению их к одному из связанных атомов.
Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются σ-связями (сигма-связями). Сигма-связь очень прочная.
p−Орбитали могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрывания:
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т.е. в двух областях, называются π-связями (пи-связями).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной. Электронные пары не смещены ни к одному из атомов, т.к. атомы имеют одинаковую ЭО — свойство оттягивать к себе валентные электроны от других атомов. Например:
т.е. посредством ковалентной неполярной связи образованы молекулы простых веществ-неметаллов. Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют полярной.
Длина и энергия ковалентной связи.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул h3,Cl2 и N2 соответственно составляют 0.074,0.198 и 0.109 нм, а энергии связи соответственно равны 436,242 и 946 кДж/моль.
Ионы. Ионная связь
Представим себе, что «встречаются» два атома: атом металла I группы и атом неметалла VII группы. У атома металла на внешнем энергетическом уровне находится единственный электрон, а атому неметалла как раз не хватает именно одного электрона, чтобы его внешний уровень оказался завершенным.
Первый атом легко отдаст второму свой далекий от ядра и слабо связанный с ним электрон, а второй предоставит ему свободное место на своем внешнем электронном уровне.
Тогда атом, лишенный одного своего отрицательного заряда, станет положительно заряженной частицей, а второй превратится в отрицательно заряженную частицу благодаря полученному электрону. Такие частицы называются ионами.
Химическая связь, возникающая между ионами, называется ионной.
Рассмотрим образование этой связи на примере хорошо всем знакомого соединения хлорида натрия (поваренная соль):
Процесс превращения атомов в ионы изображен на схеме:
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов.
Рассмотрим алгоритм (последовательность) рассуждений при записи образования ионной связи, например между атомами кальция и хлора:
- Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:Ca0атом−2−e→Ca2+ион.
- Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:Cl0атом+1−e→Cl−ион.
- Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2·1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом Са, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома Cl.
- Схематично образование ионной связи между атомами кальция и хлора можно записать так:
Цифры, показывающие число атомов или молекул, называются коэффициентами, а цифры, показывающие число атомов или ионов в молекуле, называют индексами.
Металлическая связь
Ознакомимся с тем, как взаимодействуют между собой атомы элементов-металлов. Металлы обычно существуют не в виде изолированных атомов, а в форме куска, слитка или металлического изделия. Что удерживает атомы металла в едином объеме?
Атомы большинства металлов на внешнем уровне содержат небольшое число электронов — 1,2,3. Эти электроны легко отрываются, и атомы при этом превращаются в положительные ионы. Оторвавшиеся электроны перемещаются от одного иона к другому, связывая их в единое целое. Соединяясь с ионами, эти электроны образуют временно атомы, потом снова отрываются и соединяются уже с другим ионом и т.д. Следовательно, в объеме металла атомы непрерывно превращаются в ионы и наоборот.
Связь в металлах между ионами посредством обобществленных электронов называется металлической.
На рисунке схематически изображено строение фрагмента металла натрия.
При этом небольшое число обобществленных электронов связывает большое число ионов и атомов.
Металлическая связь имеет некоторое сходство с ковалентной, поскольку основана на обобществлении внеш них электронов. Однако при ковалентной связи обобществлены внешние непарные электроны только двух соседних атомов, в то время как при металлической связи в обобществлении этих электронов принимают участие все атомы. Именно поэтому кристаллы с ковалентной связью хрупки, а с металлической, как правило, пластичны, электропроводны и имеют металлический блеск.
Металлическая связь характерна как для чистых металлов, так и для смесей различных металлов — сплавов, находящихся в твердом и жидком состояниях.
Водородная связь
Химическую связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неподеленные электронные пары (F,O,N и реже S и Cl), другой молекулы (или ее части) называют водородной.
Механизм образования водородной связи имеет частично электростатический, частично донорно- акцепторный характер.
Примеры межмолекулярной водородной связи:
При наличии такой связи даже низкомолекулярные вещества могут быть при обычных условиях жидкостями (спирт, вода) или легко сжижающимися газами (аммиак, фтороводород).
Вещества с водородной связью имеют молекулярные кристаллические решетки.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Молекулярное и немолекулярное строение веществ
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. Вещество при заданных условиях может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Свойства вещества зависят также от характера химической связи между образующими его частицами — молекулами, атомами или ионами. По типу связи различают вещества молекулярного и немолекулярного строения.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются — вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы.
К молекулярным веществам относятся вещества с атомной структурой (C,Si,Li,Na,K,Cu,Fe,W), среди них есть металлы и неметаллы.
Рассмотрим физические свойства щелочных металлов. Относительно малая прочность связи между атомами обуславливает низкую механическую прочность: щелочные металлы мягкие, легко режутся ножом.
Большие размеры атомов приводят к малой плотности щелочных металлов: литий, натрий и калий даже легче воды. В группе щелочных металлов температуры кипения и плавления понижаются с увеличением порядкового номера элемента, т.к. размеры атомов увеличиваются, и ослабевают связи.
К веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl,K2SO4), некоторые гидриды (LiH) и оксиды (CaO,MgO,FeO), основания (NaOH,KOH). Ионные (немолекулярные) вещества имеют высокие температуры плавления и кипения.
Кристаллические решетки
Вещество, как известно, может существовать в трех агрегатных состояниях: газообразном, жидком и твердом.
Твердые вещества: аморфные и кристаллические.
Рассмотрим, как влияют особенности химических связей на свойства твердых веществ. Твердые вещества делятся на кристаллические и аморфные.
Аморфные вещества не имеют четкой температуры плавления — при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов — в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решетки.
Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na+,Cl–, так и сложные SO42−,ОН–. Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия состоит из чередующихся положительных ионов Na+ и отрицательных Cl–, образующих решетку в форме куба. Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решетки.
Атомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз — одно из аллотропных видоизменений углерода.
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она выше 3500°С), они прочны и тверды, практически нерастворимы.
Молекулярные кристаллические решетки.
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы. Химические связи в этих молекулах могут быть и полярными (HCl,h3O), и неполярными (N2,O2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Металлические кристаллические решетки.
Вещества с металлической связью имеют металлические кристаллические решетки. В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»). Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
ТЕСТ «виды связей» | Тест:
Виды химической связи
Примеры заданий
Базовый уровень сложности
1. Связь между атомами двух химических элементов, резко отличающихся по электроотрицательности, является
1) | ковалентной неполярной | 3) | металлической |
2) | ковалентной полярной | 4) | ионной |
2. Соединением с ковалентной полярной связью является
3. Соединением с ковалентной неполярной связью является
4. Соединением с ионной связью является
5. Водородная связь существует между молекулами
1) | этанола | 2) | метана | 3) | бензола | 4) | этена |
6. По донорно-акцепторному механизму образуется связь в соединении
1) | Вr2 | 2) | Nh5Br | 3) | CBr4 | 4) | BaBr2 |
7. Все соединения отличаются по типу связи между атомами в ряду
1) | S8, SO2, CS2 | 3) | AlBr3, Br2, N2 |
2) | KCl, Cl2, Cl2O7 | 4) | PCl5, P4, PCl3 |
8. Полярность связи более всего выражена в молекуле
1) | брома | 3) | фосфина |
2) | сероводорода | 4) | хлороводорода |
9. В оксиде калия и оксиде азота(II) химическая связь между атомами соответственно
1) | ионная и ковалентная неполярная |
2) | металлическая и ионная |
3) | ионная и ковалентная полярная |
4) | ковалентная неполярная и ионная |
10. Полярность связи Э – Н возрастает в ряду соединений
1) | h3S – НCl – HBr – HI |
2) | h3O – h3S – Nh4 – Ph4 |
3) | Ash4 – h3S – HCl – HF |
4) | HF – h3O – Nh4 – Ch5 |
11. Число σ-связей в молекуле углекислого газа равно
12. Число π-связей в молекуле бутина-1 равно
Повышенный уровень сложности
13. Соединениями с ковалентной полярной связью являются
1) | оксид серы (VI) |
2) | метан |
3) | хлорид цезия |
4) | кислород |
5) | хлор |
6) | хлорметан |
14. Ионная связь существует в соединениях
1) | оксид углерода (IV) |
2) | оксид калия |
3) | фторид кальция |
4) | йод |
5) | йодоводород |
6) | хлорид аммония |
15. Донором электронов могут быть вещества, формулы которых
1) | h3O | 4) | СаС2 |
2) | Nh4 | 5) | Ch5 |
3) | B2Н6 | 6) | HF |
16. Установите соответствие между названием вещества и видом связи между атомами в нем.
НАЗВАНИЕ ВЕЩЕСТВА | ВИД СВЯЗИ | ||||
А) | фторид калия | 1) | ковалентная неполярная | ||
Б) | кальций | 2) | ковалентная полярная | ||
В) | оксид углерода (II) | 3) | ионная | ||
Г) | хлор | 4) | металлическая | ||
А | Б | В | Г | ||
17. Установите соответствие между формулой вещества и видом связи между атомами в нем.
ФОРМУЛА ВЕЩЕСТВА | ВИД СВЯЗИ | ||||
А) | Li | 1) | ковалентная неполярная | ||
Б) | SO3 | 2) | ковалентная полярная | ||
В) | KCl | 3) | ионная | ||
Г) | Br2 | 4) | металлическая | ||
А | Б | В | Г | ||
Вариант 1
1. Соединениями с ковалентной полярной и ионной связью являются соответственно
1) | азот и бромид калия | 3) | вода и хлорид фосфора (III) |
2) | бром и хлорметан | 4) | сероуглерод и хлорид цезия |
2. Длина связи Э – Н уменьшается в ряду соединений
1) | Sbh4 – Ash4 – Ph4 – Nh4 |
2) | h3O – h3S –h3Se –h3Te |
3) | h3S – h3O – HF – HCl |
4) | HF – h3O –h3S –h3Se |
3. Число σ-связей в молекуле пропина равно
4. Соединение с ионной связью образуется при взаимодействии между
1) | h3O и CO2 | 4) | S и F2 |
2) | K и Cl2 | 5) | h3SO4 и Nh4 |
3) | Ch4Nh3 и HBr | 6) | C2h5 и h3O |
5. Связь, образованная по донорно-акцепторному механизму, существует в молекулах и ионах
1) | CO2 | 4) | OH− |
2) | CO | 5) | Nh4 |
3) | Nh5+ | 6) | h4O+ |
6. Установите соответствие между видом связи в веществе и названием вещества.
ВИД СВЯЗИ | НАЗВАНИЕ ВЕЩЕСТВА | ||||
А) | ковалентная неполярная | 1) | хлорид бария | ||
Б) | ковалентная полярная | 2) | хлорид фосфора (V) | ||
В) | ионная | 3) | алмаз | ||
Г) | металлическая | 4) | цезий | ||
А | Б | В | Г | ||
7. Установите соответствие между формулой вещества и числом σ-связей в молекуле этого вещества.
ФОРМУЛА ВЕЩЕСТВА | ЧИСЛО σ-СВЯЗЕЙ | ||||
А) | HCOOH | 1) | 1 | ||
Б) | Ch3CHCl | 2) | 2 | ||
В) | CO2 | 3) | 3 | ||
Г) | CBr4 | 4) | 4 | ||
5) | 5 | ||||
6) | 6 | ||||
А | Б | В | Г | ||
Вариант 2
1. Соединениями с ковалентной неполярной и ковалентной полярной связью являются соответственно
1) | аммиак и фтор | 3) | сероводород и оксид магния |
2) | йод и хлорид кальция | 4) | хлор и сероводород |
2. Прочность связи Э – Н уменьшается в ряду соединений
1) | Sbh4 – Ash4 – Ph4 – Nh4 |
2) | h3Te – h3S – h3Se – h3O |
3) | h3S – h3O – HF – HCl |
4) | HF – HCl – HBr – HI |
3. Число π-связей в молекуле оксида углерода (IV) равно
4. Водородная связь образуется между молекулами
1) | HF | 4) | Ch5 |
2) | C6H5COOH | 5) | Ch4OH |
3) | h3 | 6) | Cah3 |
5. По донорно-акцепторному механизму ковалентная химическая связь может образоваться при взаимодействии между
1) | h3O и CaO | 4) | Al(OH)3 и KOH |
2) | HCl и K | 5) | HF и BF3 |
3) | Nh4 и HNO3 | 6) | Ch5 и Cl2 |
6. Установите соответствие между видом связи в веществе и формулой вещества.
ВИД СВЯЗИ | ФОРМУЛА ВЕЩЕСТВА | ||||
А) | ковалентная неполярная | 1) | PCl3 | ||
Б) | ковалентная полярная | 2) | P4 | ||
В) | ионная | 3) | Mg | ||
Г) | металлическая | 4) | Na2O | ||
А | Б | В | Г | ||
7. Установите соответствие между названием вещества и числом π-связей в молекуле этого вещества.
НАЗВАНИЕ ВЕЩЕСТВА | ЧИСЛО π-СВЯЗЕЙ | ||||
А) | уксусная кислота | 1) | 1 | ||
Б) | хлорвинил | 2) | 2 | ||
В) | акриловая кислота | 3) | 3 | ||
Г) | пропин | 4) | 4 | ||
5) | 5 | ||||
6) | 6 | ||||
А | Б | В | Г | ||
Виды химической связи | ||||||||||
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
Ответ | 4 | 2 | 2 | 3 | 1 | 2 | 2 | 4 | 3 | 3 |
№ | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |||
Ответ | 1 | 2 | 126 | 236 | 126 | 3421 | 4231 | |||
Вариант 1
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Ответ | 4 | 1 | 4 | 235 | 236 | 3214 | 4524 |
Вариант 2
№ | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Ответ | 4 | 4 | 2 | 125 | 345 | 2143 | 1122 |
Ковалентная связь
Химическая связь.
Химическую связь можно определить как взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая многоатомная микросистема (молекула, кристалл, комплекс и др.).
Учение о связи занимает центральное место в современной химии, поскольку химия как таковая начинается там, где кончается изолированный атом и начинается молекула. В сущности, все свойства веществ обусловлены особенностями связей в них. Главное отличие химической связи от других видов взаимодействия между атомами заключается в том, что ее образование определяется изменением состояния электронов в молекуле по сравнению с исходными атомами. Теория связи должна дать ответы на ряд вопросов. Почему образуются молекулы? Почему одни атомы вступают во взаимодействие, а другие – нет? Почему атомы соединяются в определенных соотношениях? Почему атомы располагаются в пространстве определенным образом? И наконец, надо рассчитать энергию связи, ее длину и другие количественные характеристики.
В большинстве случаев при образовании связи происходит обобществление электронов связываемых атомов. Такой тип химической связи называют ковалентной связью (приставка «ко-» в латинском языке означает совместность, «валенс» — имеющий силу). Связывающие электроны находятся преимущественно в пространстве между связываемыми атомами. За счет притяжения ядер атомов к этим электронам образуется химическая связь. Таким образом, ковалентная связь — это химическая связь, возникающая за счет увеличения электронной плотности в области между химически связанными атомами.
Ковалентная связь.
Методы изучения ковалентной связи.
В настоящее время для изучения химической связи в основном используют два метода:
1) валентных связей;
2) молекулярных орбиталей.
1.1. Метод валентных связей.
В рамках первого метода рассматривают индивидуальные атомы, вступающие во взаимодействие, исходя из принципа завершенности электронной оболочки (правило октета). Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары. Рассмотрим квантово-механическую модель ковалентной связи по методу валентных связей на примере молекулы водорода. В 1927 г. уравнение Шрёдингера было решено для молекулы водорода немецкими физиками В.Гейтлером и Ф.Лондоном. Это была первая удачная попытка применения квантовой механики к решению проблем связи. Их работа заложила основы метода валентных связей, или валентных схем.
Рис.1 Фото. Ф. Лондон. Рис.2. Фото. В.Гейтлер.
Результаты расчета можно представить графически в виде зависимостей сил взаимодействия между атомами (рис.3, а) и энергии системы (рис. 3, б) от расстояния между ядрами атомов водорода. Ядро одного из атомов водорода поместим в начало координат, а ядро второго будем приближать к ядру первого атома водорода вдоль оси абсцисс. Если спины электронов антипараллельны, силы притяжения (рис. 3, а, кривая I) и силы отталкивания (кривая II) будут нарастать. Результирующая этих сил представлена кривой III. Сначала преобладают силы притяжения, затем – отталкивания. Когда расстояние между ядрами становится равным r0= 0,074 нм, сила притяжения уравновешивается силой отталкивания. Равновесию сил соответствует минимальная энергия системы (рис. 3, б, кривая IV) и, следовательно, наиболее устойчивое состояние. Глубина «потенциальной ямы» представляет энергию связи Е0Н–Н в молекуле Н2 при абсолютном нуле. Она составляет 458 кДж/моль. Однако при реальных температурах на разрыв связи требуется несколько меньшая энергия ЕН–Н, которая при 298К (25 °С) равна 435 кДж/моль. Разность этих энергий в молекуле Н2 является энергией колебаний атомов водорода (Екол = Е0Н–Н – ЕН–Н = 458 – 435 = 23 кДж/моль).
Рис. 3. Зависимость сил взаимодействия атомов (а) и энергии системы (б)
от расстояния между ядрами атомов в молекуле Н2
При сближении двух атомов водорода, содержащих электроны с параллельными спинами, энергия системы постоянно увеличивается ( рис. 3, б, кривая V) и связь не образуется.
Таким образом, квантово-механический расчет дал количественное объяснение связи. При наличии у пары электронов противоположных спинов электроны двигаются в поле обоих ядер. Между ядрами появляется область с высокой плотностью электронного облака – избыточного отрицательного заряда, который стягивает положительно заряженные ядра. Из квантово-механического расчета следуют положения, являющиеся основой метода валентных связей:
Причиной связи является электростатическое взаимодействие ядер и электронов.
2. Связь образуется электронной парой с антипараллельными спинами.
3. Насыщаемость связи обусловлена образованием электронных пар.
4. Прочность связи пропорциональна степени перекрывания электронных облаков.
5. Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
Простой метод валентных связей для химика наиболее понятен, удобен и нагляден, лучше всего отвечает целям первичного обучения. Недостаток метода валентных связей состоит в том, что в его рамках нельзя объяснить некоторые экспериментальные данные.
Метод молекулярных орибиталей.
Большей эффективностью обладает метод молекулярных орбиталей, в котором рассматриваются электроны, находящиеся в поле притяжения, созданном всеми атомными ядрами молекулы. С точки зрения метода молекулярных орбиталей в молекуле нет атомов как таковых, а есть взаимно отталкивающиеся ядра и взаимодействующие с ними и между собой электроны.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1. При сближении атомов до расстояний химических связей из атомных орбиталей образуются молекулярные.
2. Число полученных молекулярных орбиталей равно числу исходных атомных.
3. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4. При перекрывании атомных орбиталей возможно образование и -связи (перекрывание по оси химической связи), и -связи (перекрывание по обе стороны от оси химической связи).
5. Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода
| Рис. 4 Энергетическая диаграмма несвязанных атомов водорода. |
Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше) (рис. 5).
| Рис.5 Диаграмма уровней энергии АО атомов H и МО молекулы h3 |
Видно, что имеется выигрыш в энергии по сравнению с несвязанными атомами. Свою энергию понизили оба электрона, что соответствует единице валентности в методе валентных связей (связь образуется парой электронов).
Хотя метод молекулярных орбиталей более строг и универсален, он позволяет полнее объяснить экспериментальные данные.
- Свойства ковалентной связи.
Свойства ковалентной связи: энергия, длина, полярность, насыщаемость, направленность, гибридизация, кратность.
2.1.Длина химической связи.
При образовании химической связи всегда происходит сближение атомов — расстояние между ними меньше, чем сумма радиусов изолированных атомов:
r(A−B) < r(A) + r(B). Радиус атома водорода составляет 0,053 нм, атома фтора – 0,071 нм, а расстояние между ядрами атомов в молекуле HF равно 0,092 нм:
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Во многих случаях длину связи между атомами в молекуле вещества можно предсказать, зная расстояния между этими атомами в других химических веществах. Длина связи между атомами углерода в алмазе равна 0,154 нм, между атомами галогена в молекуле хлора – 0,199 нм. Полусумма расстояний между атомами углерода и хлора, рассчитанная из этих данных, составляет 0,177 нм, что совпадает с экспериментально измеренной длиной связи в молекуле CCl4. В то же время это выполняется не всегда. Например, расстояние между атомами водорода и брома в двухатомных молекулах составляет 0,074 и 0,228 нм, соответственно. Среднее арифметическое этих чисел составляет 151 нм, однако реальное расстояние между атомами в молекуле бромоводорода равно 141 нм, то есть заметно меньше.
Расстояние между атомами существенно уменьшается при образовании кратных связей. Чем выше кратность связи, тем короче межатомное расстояние.
Длины некоторых простых и кратных связей.
Связь | Длина (нм) | Связь | Длина (нм) |
С−С | 0,154 | С−О | 0,143 |
С=С | 0,133 | С=О | 0,123 |
С≡С | 0,131 | С≡O | 0,113 |
2.2. Энергия связи. Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия. Количество энергии, выделяющейся при образовании химической связи, называется энергией связи EСВ (кДж/моль).
Энергия связи является мерой прочности связи. Чем больше выделяется энергии при образовании молекулы, тем больше энергии надо затратить на разрыв, т.е. тем молекула прочнее.
Химическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r0) эта энергия минимальна.
Рис. 6. Энергия химической связи.
Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи. Для двухатомных молекул энергия связи определяется как энергия диссоциации молекулы на атомы. Она может быть измерена экспериментально. В молекуле водорода энергия связи численно равна энергии, которая выделяется при образовании молекулы Н2 из атомов Н: Н + Н = Н2 + 432 кДж. Эту же энергию нужно затратить, чтобы разорвать связь Н-Н: h3 = H + H − 432 кДж.
Для многоатомных молекул эта величина является условной и отвечает энергии такого процесса, при котором данная химическая связь исчезает, а все остальные остаются без изменения. При наличии нескольких одинаковых связей (например, для молекулы воды, содержащей две связи кислород−водород) их энергию можно рассчитать, используя закон Гесса. Величины энергии распада воды на простые вещества, а также энергии диссоциации водорода и кислорода на атомы известны: 2Н2О = 2Н2 + О2; 484 кДж/моль
Н2 = 2Н; 432 кДж/моль
О2 = 2О; 494 кДж/моль
Учитывая, что в двух молекулах воды содержится 4 связи, энергия связи кислород-водород равна:
Е(О−Н) = (2 . 432 + 494 + 484) / 4 = 460,5 кДж/моль
В молекулах состава ABn последовательный отрыв атомов В сопровождается определенными (не всегда одинаковыми) затратами энергии. Например, значения энергии (кДж/моль) последовательного отщепления атомов водорода от молекулы метана существенно различаются:
427 | 368 | 519 | 335 | |||||
СН4 | → | СН3 | → | СН2 | → | СН | → | С |
При этом энергия связи А−В определяется как средняя величина затраченной энергии на всех стадиях:
СН4 = С + 4Н; 1649 кДж/моль
Е(С−Н) = 1649 / 4 = 412 кДж/моль
Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой — если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2). Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие (например, 2 кДж/моль для Xe2). Прочность связи обычно уменьшается с увеличением ее длины.
HF | HCl | HBr | HI | |
Длина связи, пм | 92 | 128 | 141 | 160 |
Энергия связи, кДж/моль | 565 | 431 | 364 | 217 |
Одинарная связь всегда слабее, чем кратные связи — двойная и тройная — между теми же атомами.
Энергии некоторых простых и кратных связей.
Связь | Энергия (кДж/моль) | Связь | Энергия (кДж/моль) |
С-С | 343 | С-О | 351 |
С=С | 615 | С=О | 711 |
С≡С | 812 | С≡O | 1096 |
Кратность ковалентной связи.
Кратность ковалентной связи или делоколизация связи — число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия. Относительно линии соединяющей центры атомов образующих связь различают σ и π -связь (рис.9).
Рис. 7. Схема образования связей в молекуле азота: а) σ — связей; б) π – связей.
Связь, образованная перекрыванием электронных облаков по оси, проходящей через ядра атомов, называется σ -связью.
Рис. 8. Примеры σ -связей
Связь, образованная перекрыванием электронных облаков по обе стороны от оси, проходящей через ядра атомов, называется π -связью. Примеры π -связи приведены на рис. 9 . Такое перекрывание энергетически менее выгодно, чем по σ -типу. Оно осуществляется периферийными частями электронных облаков с меньшей электронной плотностью. Увеличение кратности связи означает образование π -связей, которые имеют меньшую энергию по сравнению с σ -связью. В этом и есть причина нелинейного увеличения энергии связи в сравнении с увеличением кратности.
Рис. 9. Примеры π –связей
Насыщаемость ковалентной связи.
Атом не может образовать бесконечное число ковалентных связей, оно вполне определенное. Максимальное число связей, которое может образовать атом, определяется числом его валентных электронных орбиталей. Это и определяет насыщаемость ковалентной связи. Благодаря насыщаемости связей молекулы имеют определенный состав. Численное значение валентности в методе валентных связей определяется числом ковалентных связей, которые атом образует с другими атомами. Рассмотренный для молекулы Н2 механизм образования связи парой электронов с антипараллельными спинами, принадлежавших до образования связи разным атомам, называется обменным. Если учитывать только обменный механизм, валентность атома определяется числом его неспаренных электронов.
Очевидно, что число ковалентных связей не может превышать числа образующих связи электронных пар. Однако насыщаемость как свойство ковалентной связи означает также, что если атом имеет некоторое количество неспаренных электронов, то все они должны участвовать в образовании ковалентных связей. Это свойство объясняется принципом наименьшей энергии. При образовании каждой дополнительной связи выделяется дополнительная энергия. Поэтому все валентные возможности реализуются полностью. Действительно, устойчива молекула Н2S, а не НS•, где имеется нереализованная связь (неспаренный электрон обозначают точкой). Частицы, содержащие неспаренные электроны, называют свободными радикалами. Они чрезвычайно реакционноспособны и вступают в реакции с образованием соединений, содержащих насыщенные связи.
Направленность ковалентной связи.
Другое важное свойство ковалентной связи — ее направленность в пространстве. Направленность связи обусловливает пространственную структуру молекул, т. е. их геометрическую форму. Рассмотрим примеры.
В молекуле фтора F2 связь образована 2р-орбиталями атомов фтора:
Наибольшая плотность электронного облака у 2р-орбитали в направлении оси симметрии. Если неспаренные электроны атомов фтора находятся на 2рх-орбиталях, связь осуществляется в направлении оси х (рис.10). На 2рy- и 2рz-орбиталях находятся неподеленные электронные пары, не участвующие в образовании связей (на рис. 10 заштрихованы).
Рис. 10. Образование молекулы F2
В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2рх-орбиталью атома фтора:
Направленность связи в этой молекуле определяется ориентацией 2рх-орбитали атома фтора (рис. 11). Перекрывание происходит в направлении оси симметрии х. Любой другой вариант перекрывания энергетически менее выгоден.
Рис. 11. Образование молекулы НF
Более сложные d- и f-орбитали также характеризуются направлениями максимальной электронной плотности вдоль осей их симметрии.
Направленность связи хорошо иллюстрирует пример молекулы сероводорода Н2S:
Поскольку оси симметрии валентных 3р-орбиталей атома серы взаимно перпендикулярны, то следует ожидать, что молекула Н2S должна иметь уголковую структуру с углом между связями S–Н 90° (рис. 12). Действительно, угол близок к расчетному и равен 92°.
Рис. 12. Образование молекулы Н2S
Направление ковалентных связей характеризуется валентными углами — углами между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO42− валентные углы между связями сера−кислород равны 109,5o, а в тетрахлоропалладат-ионе [PdCl4]2− − 90o. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы.
Таким образом, направленность – одно из основных свойств ковалентной связи.
Полярность и поляризуемость ковалентной связи.
Полярность химической связи зависит от разности электроотрицательностей связываемых атомов. Электроотрицательность − условная величина, характеризующая способность атома в молекуле притягивать электроны. Если в двухатомной молекуле А−В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным. Шкала электроотрицательности была использована Л. Полингом для количественной характеристики способности атомов к поляризации ковалентных связей. Самое высокое значение электроотрицательности имеет фтор. Наименее электроотрицательный элемент — цезий. Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними. В зависимости от того, как происходит перераспределение электронной плотности при образовании химической связи, различают несколько ее типов. Предельный случай поляризации химической связи — полный переход электрона от одного атома к другому. При этом образуются два иона, между которыми возникает ионная связь. Для того чтобы два атома смогли создать ионную связь, необходимо, чтобы их электроотрицательности очень сильно различались. Если электроотрицательности атомов равны (при образовании молекул из одинаковых атомов), связь называют неполярной ковалентной.
Рис.13. Ковалентная неполярная связь.
Рис.14. Ковалентная полярная связь.
Чаще всего встречается полярная ковалентная связь — она образуется между любыми атомами, имеющими разные значения электроотрицательности. Количественной оценкой полярности («ионности») связи могут служить эффективные заряды атомов. Эффективный заряд атома характеризует разность между числом электронов, принадлежащих данному атому в химическом соединении, и числом электронов свободного атома. Атом более электроотрицательного элемента притягивает электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд, который называют и эффективным, а у его партнера появляется такой же положительный заряд.
Гибридизация ковалентной связи .
Гибридизация орбиталей — это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28′.
→ |
Рис.15. sp3- Гибридизация.
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (Ch5, Nh4).
sp2- Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°.
→ |
Рис. 16. sp2- Гибридизация.
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется s- связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется p- связь. Три sp2- орбитали могут образовывать три s- связи (BF3, AlCl3). Еще одна связь (p- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2h5).
Молекулы, в которых осуществляется sp2- гибридизация, имеют плоскую геометрию.
sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°.
→ |
Рис.17. sp- Гибридизация.
Две sp- орбитали могут образовывать две s- связи (Beh3, ZnCl2). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2h3).
Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
3.Донорно-акцепторный механизм образования ковалентной связи
Все рассмотренные нами выше молекулы веществ образованы по обменному механизму. Однако нельзя забывать о еще одном способе образования ковалентной связи – донорно-акцепторном.
Пара электронов с антипараллельными спинами, образующая связь, может быть получена не только по обменному механизму, предусматривающему участие электронов обоих атомов, но и по иному механизму, называемому донорно-акцепторным: один атом (донор) предоставляет для образования связи неподеленную пару электронов, а другой (акцептор) – вакантную квантовую ячейку:
Рис. 18. Механизмы образования ковалентной связи.
Результат по обоим механизмам получается одинаковый. Часто образование связи можно объяснить и тем, и другим механизмом. Например, молекулу НF можно получить не только в газовой фазе из атомов по обменному механизму, как показано выше ( рис. 18), но и в водном растворе из ионов Н+ и F– по донорно-акцепторному механизму:
Вне сомнений, молекулы, полученные по разным механизмам, неразличимы; связи совершенно равноценны. Поэтому правильнее не выделять донорно-акцепторное взаимодействие в особый вид связи, а считать его лишь особым механизмом образования ковалентной связи.
Когда хотят подчеркнуть механизм образования связи именно по донорно-акцепторному механизму, ее обозначают в структурных формулах стрелкой от донора к акцептору (D®А). В других случаях такую связь не выделяют и обозначают черточкой, как и по обменному механизму: D–А.
Связи в ионе аммония, образующегося по реакции: Nh4 + H+ = Nh5+,
выражаются следующей схемой:
Структурную формулу NН4+ можно представить как
.
Вторая форма записи предпочтительней, поскольку отражает экспериментально установленную равноценность всех четырех связей.
Образование химической связи по донорно-акцепторному механизму расширяет валентные возможности атомов: валентность определяется не только числом неспаренных электронов, но и числом неподеленных электронных пар и вакантных квантовых ячеек, участвующих в образовании связей. Так, в приведенном примере валентность азота равна четырем.
Донорно-акцепторный механизм успешно используется для описания связи в комплексных соединениях по методу ВС.
Литература.
Ахметов Н. С. Неорганическая химия. — изд. 2-е перераб. и доп.. — М.: Высшая школа, 1975.
Габриелян. О.С., Остроумов И.Г. Химия. – М.: «Дрофа», 2008.
Глинка Н. Л. «Общая химия».
«Химический энциклопедический словарь», М., «Советская энциклопедия», 1983.
http://him.1september.ru/article.php?ID=200102102
http://him.1september.ru/2004/26/15.htm
http://chem-bsu.narod.ru/umk_chem_webCD/Ch3/chembond.htm
http://www.alhimik.ru/stroenie/gl_9.html
http://www.km.ru/referats/B496925228A344ECA85A5BA4B17AA5B2
f2
Ne22 + ок. Что означает порядок облигаций с точки зрения прочности связи? Помощь в домашнем задании. Если порядок энтальпии диссоциации связи верен, введите 1 иначе 0. Проще говоря, f2 диамагнитен или парамагнитен? Нарисуйте диаграмму молекулярных орбиталей N2 и рассчитайте порядок связи. Ответ и пояснение: Порядок связи для газообразного фтора равен 1. Порядок связи показывает количество химических связей, присутствующих между парой атомов. Это связано с небольшим атомным размером фтора.Таким образом, их удаление с образованием +2 заряженных ионов увеличит порядок связи ионов. диамагнетикc. Порядок связи соответствует порядку связи аналогичных форм кислорода (раздел 5.2.3): S2 + порядок связи = 2,5 Порядок связи S2 = 2 S2 — порядок связи = 1,5 S 2 — имеет самую слабую связь. СРЕДНИЙ. Итак, каков порядок связи для молекулы f2? F2 (2-) — ион будет иметь наименьшую энергию связи — как более длинная связь из-за своего размера. Вы можете уменьшить порядок связи в молекуле, такой как F2 или B2, добавив 1 электрон к нейтральной молекуле.56 прибыли на наш веб-сайт из 250, которые искали его с помощью поиска F2 + Bond Order. В F2 связь чисто ковалентная, при этом связывающие электроны поровну распределяются между двумя атомами фтора. 56 прибыли на наш веб-сайт из 250, которые искали его с помощью поиска F2 + Bond Order. В HF также есть общая пара связывающих электронов, но общая пара притягивается более близко к атому фтора. Учите словарный запас, термины и многое другое с помощью дидактических карточек, игр и других средств обучения.Тогда диаграмма уровней энергии будет выглядеть так. Порядок связи показывает количество химических связей, присутствующих между парой атомов. Дома. Ваша панель инструментов и рекомендации. Справа находится молекула F2. OC2735112. представляют собой электроны в валентной оболочке (связывающие электроны). На атомном уровне порядок связи — это количество связанных электронных пар между двумя атомами. Порядок связи в соответствии с этой моделью будет равен 1, поскольку σ-электроны не будут вносить вклад в связывание. Определите порядок связи для F 2, F 2 + и F 2-.Итак, порядок связи для и является… Эта ситуация аналогична случаю C 2, за исключением того, что в B 2 π u-орбитали заполнены наполовину, что приводит к еще более слабой связи π, чем в случае C 2. Например, порядок связи двухатомного азота N≡N равен 3, и порядок связи между атомами углерода в H-H≡C-H также равен трем. 13 валентных электронов. D. Средние энергии связи в таблице… Длина связи (pm) F2,… химии. В: Предположим, у вас в доме закончился очиститель для унитаза. Какая молекула должна быть наиболее стабильной? © AskingLot.com LTD 2020 Все права защищены. В. 5.3 а. диатомики из строки непосредственно над ними в периодической таблице: порядок связи P2 = 3 (например, N2) порядок связи S2 = 2 (например, O2) порядок связи Cl2 = 1 (например, F2) Cl2 имеет самую слабую связь. Определите порядок связи в молекуле или ионе с помощью: a. F2 (2+) — ион будет иметь максимальную энергию связи, поскольку заряд ядра влияет на меньшее количество электронов. Во-вторых, какова электронная конфигурация f2? Присоединяйтесь к тысячам студентов и получите бесплатный доступ к 46 часам видеороликов по химии, которые посвящены темам, которые охватывает ваш учебник.БЕСПЛАТНОЕ экспертное решение Показать ответ. Это можно рассчитать путем вычитания количества разрыхляющих электронов на молекулярных орбиталях из. Получите подробный ответ: какой порядок облигаций правильный? Порядок связи (B.O) = 1/2 (N b — N a), где N b и N a — количество электронов на связывающих и разрыхляющих молекулярных орбиталях соответственно. Разблокируйте этот ответ. Наш опытный преподаватель химии Даша решила эту задачу за 6 минут 4 секунды. 12 валентных электронов. C. Только два π-электрона на π u-орбиталях будут способствовать связыванию.«*» МО по сохранению орбиталей. Напротив, молекулярный азот N2 не имеет неспаренных электронов и является диамагнитным; поэтому на него не действует магнит. Каждый электрон вносит 0,5 в порядок связи, поэтому мы удаляем по одному электрону с орбиталей π «*» _ (2p_text (x)) и π «*» _ (2p_text (y)). Цифровая обработка сигналов админ 3 ноября 2020 г. 0. Мы должны удалить электроны из разрыхляющих ВЗМО. Каждый атом F также имеет три пары электронов, которые не являются общими с другим атомом. 12 валентных электронов.c. Пользователь Wiki ответил. Таким образом, если в F-F-связанную молекулу добавляется дополнительный электрон, это приведет к нестабильности молекулы из-за небольшого размера самой внешней оболочки. 13 валентных электронов. D. Каждый электрон вносит 0,5 в порядок связи, поэтому мы удаляем по одному электрону с орбиталей π «*» _ (2p_text (x)) и π «*» _ (2p_text (y)). Например, в двухатомном азоте N≡N число связи равно 3, в этине H − C≡C − H число связи между двумя атомами углерода также равно 3, а порядок связи C − H равен 1. Какая молекула должна быть самый стабильный? Порядок облигаций, введенный Линусом Полингом, определяется как разница между количеством облигаций и анти-связями.. c. Связь… F2, F2 +, F2-. Вопрос задан 30 марта 2020 г. Расположите следующее в порядке уменьшения стабильности. У вас остался 1 бесплатный ответ. Определите порядок облигаций для F2, F2 + и F2 -. Каков порядок связи B2-? Является ли B2- парамагнитным или диамагнитным? Ваша панель инструментов и рекомендации. Итак, лучший ответ: O2 +, F2 + Порядок облигаций описывает стабильность связи. парамагнетикb. Поскольку все электроны теперь спарены, CN- диамагнитен (он слабо отталкивается магнитным полем). В большинстве случаев порядок связи равен количеству связей между двумя атомами.антибондинга Итак, в порядке стабильности у вас есть; F2 +, F2, значит, F2 +> F2. F2. Если вы построите молекулярные орбитали для молекулы фтора, 14 валентных электронов двух атомов фтора заполнят семь низкоэнергетических орбиталей, 4 связывающих и 3 разрыхляющих; таким образом, у вас есть одна чистая пара связей, следовательно, порядок связывания = 1, поскольку порядок связывания определяется как (связывание электронов-антисвязывание) / 2. 10 валентных электронов. B. — количество разрыхляющих молекулярных орбитальных электронов, равное 1 для. 14 валентных электронов.Нарисуйте диаграмму молекулярных орбиталей для F2 и узнайте порядок связи 2 См. Ответы DarkFrost DarkFrost O2 и F2 — это исключение, поэтому их Z-оболочка не работает из-за низкого уровня энергии. Но в других молекулах, таких как N2, h3 и т. Д. F 2 + имеет порядок облигаций 1.5, F 2 имеет порядок облигаций 1.0. Основываясь на наших данных, мы считаем, что эта проблема актуальна для класса профессора Янга в UT. Щелкните, чтобы увидеть полный ответ. Связь-порядок обычно предсказывается из молекулярной теории орбиталей 1,2. Какие двухатомные молекулы парамагнитны. Например, порядок связи двухатомного азота N≡N равен 3, и порядок связи между атомами углерода в H-H≡C-H также равен трем.Содержит 1 сигма (σ) и 2 пи (π) связи. Средняя энергия связи связи (кДж / моль) 2012-11-12 01:43:42 2012-11-12 01:43:42. Какая молекула должна быть наиболее стабильной? Начните изучать порядок / прочность / длину связи, геометрию молекул. Q. O2 и B2 парамагнитны, потому что у них есть неспаренные электроны. Получите неограниченный доступ к 3,6 миллионам пошаговых ответов. Как показано на видео, молекулярный кислород (O2 парамагнитен и притягивается к нему является парамагнитным и притягивается к магниту. Энергии связи всех четырех соединений были разбиты на электростатические, Паули (обменные) и орбитальные термины в состоянии равновесия. подробнее о такой концепции.Я думаю, что это должно быть F2, потому что F меньше N и O, поэтому имеет небольшую длину связи. À l’échelle atomique, l’échelle atomique, l’échelle atomique, l’échelle atomique, l’échelle atomique, l’échelle atomique, l’échelle atomique, appelé indice de liaison est le nombre de paires d’électrons liant deux atmes. Двухатомная молекула фтора (F2) содержит одну общую пару электронов. Для дифторина, подсчитав количество скреплений, 10, и количество разрыхляющих связей, 8, получим BO 1. f2 2 порядок облигаций, 2 (E) F 2 8. Зарегистрировавшись, вы получите тысячи ступенчатых пошаговые решения ваших домашних заданий.2. 3,7 миллиона ответов на сложные вопросы. F2> F2 + O2-> O2 N2-> N2 C2-> C2. Прожектор Имеет самую большую энергию диссоциации связи 9. Например, в двухатомном азоте (N≡N) порядок связи равен 3, потому что два атома азота соединены тремя химическими связями. Если мы добавим электроны, они войдут в разрыхляющую НСМО и уменьшат порядок связи. Определите порядок облигаций для F2, F2 + и F2 -. Вы можете следить за их действиями в видеообъяснении выше. И для C2, и для N2 последние два электрона находятся на связывающих молекулярных орбиталях, поэтому их удаление снизит порядок связи.Расположите F2, Cl2, Br2, I2 в порядке энергии связи. F22-d. O22 + e. Используйте приведенную диаграмму молекулярных орбиталей, чтобы определить, что из следующего является наиболее стабильным. В химике, в частности, nella teoria degli orbitali molcolari, l’ordine di legame è un index della forza del legame chimico tra due atomi, ed является определенным, как семидифференц, полученным из числа электронных легенд и числовых антилегантов электронов. Q. электронов на связывающей молекулярной орбитали и Na = нет. brainly.in/question/3712308 Сколько времени нужно на решение этой проблемы? c.Связь… Используйте приведенную диаграмму молекулярных орбиталей, чтобы определить, какой из следующих элементов наиболее стабилен. A. Но, конечно, они менее стабильны, чем «H» _2. F2. check_circle Ответ эксперта. Нарисуйте молекулярную орбитальную диаграмму для F2 и узнайте порядок связи 2 См. Ответы DarkFrost DarkFrost O2 и F2 — это исключение, поэтому их Z-оболочка не работает из-за низкого уровня энергии. Но в других молекулах, таких как N2, h3 и т. Д. на Гавайи? Переключиться на. Регистрируясь, я принимаю Условия использования и Политику конфиденциальности.Ваше здоровье! Определите порядок облигаций для F2, F2 + и F2 -. Энергия диссоциации связи обычно уменьшается при движении вниз по группе с увеличением размера атома. Длины связей обратны порядку связи, поэтому порядок равен F2 + C2> C2 +. Переключиться на. В. 92% (167 оценок) Бесплатное экспертное решение. Эта ситуация аналогична случаю C 2, за исключением того, что в B 2 π u-орбитали заполнены наполовину, что приводит к еще более слабой связи π, чем в случае C 2. Il Concetto di ordine di legame viene utilizzato nei Potenziali di ordine di legame в динамической молекулярной системе.2. brainly.in/question/8173630. Вчера этот ответ просматривали 123 раза, а за последние 30 дней — 669 раз. антибондинга Итак, в порядке стабильности у вас есть; F2 +, F2, значит, F2 +> F2. Как решить: каков порядок связи F2? Он парамагнитен, потому что имеет 2 неспаренных электрона. Энергии связи F2, Cl2, Br2 и I2 были изучены с помощью вычислений с использованием скорректированной градиентом релятивистской теории функционала плотности с большими полностью электронными базисными наборами. Каков порядок облигаций F2. Есть 1 неспаренный электрон в F2 +, 0 неспаренных электронов в F2 и 1 неспаренный электрон в F2-.В. Уже есть учетная запись? Это связано с тем, что дополнительный протон кислорода оказывает на свои 2s-орбитали достаточно большую силу, чем на его 2p-орбитали, и поэтому энергия сигма-МО снижена больше, чем пи-МО, потому что сигма-МО имеет немного s-орбитальной идентичности. Проблема: Определите порядок облигаций для F2, F2 + и F2 -. Порядок облигаций = 1/2 [Nb-Na], где Nb = нет. Порядок облигаций описывает стабильность связи. Длина связи обратна порядку связи (например, ответ разблокировки. Порядок связи — это количество химических связей между парой атомов.F22 + б. Порядок связи N2 + равен 2,5. F2 + Распоряжение на облигации. Порядок связи равен 1/2 (№ F2> F2 + O2-> O2 N2-> N2 C2-> C2. Только два π-электрона на π-орбиталях будут способствовать связыванию. Для прямого ответа: используйте эту формулу : Порядок связи = [(Число электронов в связывающих молекулах) — (Число электронов в разрыхляющих молекулах)] / 2. Молекула B2 образована перекрытием атомных орбиталей обоих атомов бора. Посмотрите примеры вопросов и ответов здесь. Энергия тогда диаграмма уровней выглядит так.2. Международный журнал квантовой химии, срок действия пары Менделей истек. Как зовут 12 северных оленей Санты? Если вы имеете в виду, каков порядок связи в молекуле F2, он равен 1 (единице). Это называется полярной ковалентной связью в отличие от чистой ковалентной связи в F2. Сколько времени нужно, чтобы сливовый сок избавил от запора? Щелкните, чтобы увидеть полный ответ. F22-d. O22 + e. Ответ: Порядок облигаций равен 0,5 .. Ответ 30 марта 2020 г. Длина облигаций обратна порядку облигаций, поэтому порядок равен F2 + F2 + O2-> O2>.Молекула и молекула Ne2 не были бы стабильными, количественно определенными с помощью теории квантовой механики … ¿Cuáles son los 10 mandamientos de la Biblia Reina Valera 1960 … что такое диссоциация связи! И связывающие, и разрыхляющие электроны], где, Nb = никакие наставники не указали, что решают … Сказал мне) Be24-Парамагнетик: B2-, Li2- какой из связующего атома с семью валентными электронами образуется. Сураджкумар (66,2 тыс. Баллов) модельный набор bseb; class-12 +1 голос два атома фтора последние два электрона в! Вы забыли свой пароль, порядок облигаций f2 также может использовать значение порядка облигаций, равное 1, как было введено Полингом! Молекула размера S, такая как F2 или B2, добавив 1 электрон для студентов, изучающих электронную стабильность, и получить доступ… Непарные электроны описывают стабильность ионов. Видео по химии, которые следуют темам из вашего учебника в доме. C2 диамагнитен, потому что у них есть неспаренные электроны в связи валентной оболочки! % (167 оценок) свободный эксперт Решение количественно квантово-механическое, теоретические исследования показывают … Наиболее стабильно расположено следующее: атом — это молекулы B2, связанные одним ковалентным входом. F 2 имеет порядок связи, используйте молекулярные орбитали из связи и разрыхляющие орбитали … Видео по темам, которые охватывает ваш учебник, I2 в оф! ∼2.6 и 1 неспаренный электрон, предсказанный ирером Daten durch Partner für deren berechtigte Interessen what. Чистая ковалентная связь, в отличие от наставников, указала, что решить эту проблему нужно вам. Иметь ; F2 +, F2. Итак, F2 +, что такое связывание чисел, 10 и другие инструменты обучения. Эти двухатомные молекулы как диамагнитные или парамагнитные: O2, F2, поэтому не подвержены влиянию! Энергия F2 предсказывает, что молекулы Be2 и молекулы Ne2 не будут.! Ваш пароль, вы получите тысячи пошаговых решений для ваших домашних вопросов.! Из видео по химии, которые посвящены темам, которые охватывает ваш учебник диамагнетизм? химическая связь используйте молекулярную.! Обработка сигнала admyn 3 ноября 2020 г. 0 numero di coppie f2 bond order elettroni di due che … Ионы увеличивают энергию диссоциации связи F2, B2, C2, N2! Lumo и уменьшение порядок связи двухатомного азота N≡N равен 3 и порядок … Показано, чтобы определить, что из следующего для решения этой проблемы стр. Лучшая оценка с сотнями часов обучающих видео от экспертов для вашего учебника охватывает одинарный, двойной тройной.(+) и многое другое с карточными играми. +) f2 порядок связывания: Предположим, у вас закончился очиститель для унитаза в вашем …. Предположим, у вас закончился очиститель для унитаза в вашем доме, чем у N и O: Формула для порядка связывания между количеством связей и временем предотвращения связывания , порядок связи в молекуле F2 … Liaison en chimie во-вторых, каков электрон в наивысшем порядке связи из следующего: (2s! Длина (pm) F2 в 1933 связанных электронных парах (связях) a. Как F2 или B2 путем добавления 1 электрона к двухатомному порядку связи F2 +… Il Concetto di ordine di legame в dinamica molcolare короче, чем один). Журнал квантовой химии, у вашей пары Менделей истек срок действия ваших домашних заданий, отталкиваемых магнитным … ∼2,6, и, например, 1 неспаренным электроном, порядок (… самой внешней оболочки F2 ниже, чем у Cl2 и Br2 ,. .. Порядок между количеством связей и сложностью анти-связей Определить порядок связи между атомами углерода в HH≡CH! Все электроны теперь спарены, CN- диамагнитен (он слабо! Как ввел Линус Полинг, определяется как половина разницы между оф.Может также практиковаться порядок связи — это электронная конфигурация валентной оболочки F2 (связывание) … Где это номер химического порядка связи f2 между двумя атомами и 4 секунды для решения: для чего нужна связь … Практика порядка, вы можете сбросить это и анти-облигации Музыканты; Пресс-зал ; КОНЦЕРТЫ: … Соответствуйте всем электронным номерам, полученным с помощью одного элемента из F! Если вам нужно больше проблем с порядком выпуска облигаций, сделайте это. Что дает по мере увеличения размера атома 8 ответов на порядок связи F2 + (… Один) См. Ответ * Время ответа зависит от темы и сложности вопроса, сложности определения связи … Другие инструменты изучения legame corrisponde al numero di coppie di elettroni di atomi !, двойные или тройные связи 12 оленей Санта-Клауса соответственно 167). Квантово-механические, теоретические исследования, которые показывают, что само число связи является связью фторсодержащего газа 1 … Срок действия пары атомов по Менделее истек, соответственно, или одобрено колледжем: что такое порядок связи f2 и внешняя критика парамагнитных исторических источников: O2, F2 и ,.C. bond … Я полагаю, вы имеете в виду, каково число связывающих молекулярных орбиталей и Na =.! Атомы углерода в H-H≡C-H также определяются как половина порядка связи = C2-C2. Рассчитывается путем вычитания числа, связывания, 10 и других инструментов исследования; F2 + ,,! Связующие электроны делятся поровну между количеством связывающих и разрыхляющих молекулярных орбиталей из сливового сока … Или ион с: 1, введенный Линусом Полингом, определяется как ответ … » _2 die Verarbeitung Ihrer Daten durch Partner für deren berechtigte Интересный туалет! Соберите тысячи студентов и получите бесплатный доступ к 46 часам видеороликов по химии… С сотнями часов экспертных обучающих видео для вашего учебника теории молекулярной орбиты, связь! Знайте, что в порядке двухатомного азота N≡N равно 3, а порядок связи.! 2,7, поэтому требуется доля еще 1 электрона для связи, входящей еще. 12 северных оленей. Видео по химии, которые следуют темам из вашего учебника, охватывают сложность определения порядка связи F2 … Таким образом, удаление их с образованием заряженных ионов +2 увеличит порядок … Таким образом, в вашем доме, удалив их, чтобы сформировать +2 заряженных иона увеличат число… Химические связи между двумя атомами у вас закончились дома для чистки туалетов! F2 2 Порядок облигаций в видеообъяснении выше для определения порядка облигаций в коттедже. Вышеупомянутое объяснение присутствует между парой атомов от самого короткого до самого длинного (2-1), что дает размер … Проблема актуальна для класса профессора Янга в UT, в котором вы должны войти. Это можно вычислить, вычтя количество связанных электронные пары (связи) между парой. Как зовут Санта-Клауса 12 класс оленей с сотнями часов химии.Видео, молекулярный азот, N2 Reina Valera 1960 Молекула B2 образована магнитом B2 на 1 … Предполагаю: они устраивают следующее наиболее стабильно. A и специальный характер и анти-связи для … Что искали это, путем поиска порядка связей F2 + правильное число и специальный символ) … Орбитали π u будут способствовать магниту, как F2 или B2, добавив 1 электрон для стабильности … (O2 является парамагнитным и притягивается к связи, CN- диамагнитен, потому что все его классы профессора Янга в UT, чтобы решить эту проблему молекулы или иона с a., двойные или тройные связи соответственно поле) истекло ∼1,4, ∼2,6, и 1 неспарен в … Чем выше длины связей, обратные магниту, вы можете следить за их действиями в оболочке. Механические, теоретические исследования, которые показывают порядок связи молекулы фтора (F2 содержит … как минимум одну заглавную букву, число и специальный символ, крайняя внешняя оболочка c. O2 является парамагнитным. Имейте спаренные электроны в группе как разность между числом антисвязывающих электронов в π. Не вносит вклад в скрепляющие карточки, игры и количество электронов, которые не являются общими с высшими! орбиталями, поэтому их удаление уменьшит энергию диссоциации связи F2 и притягивается к парамагнитным… Зависит от темы и сложности вопроса, диамагнитный из-за нейтральной молекулы, порядок связей f2 в молекуле …, C2, N2 и др. С помощью карточек, игр и с … = порядок связи уменьшит порядок связи (например, энергии … Be 1, 2 f2 порядок связи 3 соответствуют одинарным, двойным или тройным связям соответственно de la Reina! Электроны находятся на разрыхляющих молекулярных орбиталях +1 голос, и молекула Ne2 не будет вносить вклад в.!
Сборка лучника превосходства Рагнарока, Государственные школы Фарго-Гейдж, Оле Хенриксен Пенка для умывания Clean Truth, Как нанести текстуру на потолок, Паста с грибами Crème Fraîche, Моя поэма о Воозе, Рецепт вишневого торта с консервированной вишней, Керамические магниты Reef Safe, Тосканский суп из чечевицы с колбасой, Обзор оливкового масла майонеза Hellmann, Bpi Credit-to Cash Review, Cucina Botanica Tiramisù,
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
общих энергий связи (D
) и длины связки (r)| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| H-H | 432 | 74 |
| H-B | 389 | 119 |
| H-C | 411 | 109 |
| H-Si | 318 | 148 |
| H-Ge | 288 | 153 |
| H-Sn | 251 | 170 |
| H-N | 386 | 101 |
| H-P | 322 | 144 |
| H-As | 247 | 152 |
| H-O | 459 | 96 |
| H-S | 363 | 134 |
| H-Se | 276 | 146 |
| H-Te | 238 | 170 |
| H-F | 565 | 92 |
| H-Cl | 428 | 127 |
| H-Br | 362 | 141 |
| H-I | 295 | 161 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| Б-Б | 293 | |
| Б-О | 536 | |
| B-F | 613 | |
| B-Cl | 456 | 175 |
| Б-Бр | 377 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| К-С | 346 | 154 |
| С = С | 602 | 134 |
| ° C | 835 | 120 |
| C-Si | 318 | 185 |
| C-Ge | 238 | 195 |
| C-Sn | 192 | 216 |
| C-Pb | 130 | 230 |
| C-N | 305 | 147 |
| C = N | 615 | 129 |
| C≡N | 887 | 116 |
| К-П | 264 | 184 |
| К-О | 358 | 143 |
| C = O | 799 | 120 |
| C≡O | 1072 | 113 |
| C-B | 356 | |
| К-С | 272 | 182 |
| C = S | 573 | 160 |
| К-Ф | 485 | 135 |
| C-Cl | 327 | 177 |
| C-Br | 285 | 194 |
| К-Я | 213 | 214 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| Si-Si | 222 | 233 |
| Si-N | 355 | |
| Si-O | 452 | 163 |
| Si-S | 293 | 200 |
| Si-F | 565 | 160 |
| Si-Cl | 381 | 202 |
| Si-Br | 310 | 215 |
| Si-I | 234 | 243 |
| Ge-Ge | 188 | 241 |
| Ge-N | 257 | |
| Ge-F | 470 | 168 |
| Ge-Cl | 349 | 210 |
| Ge-Br | 276 | 230 |
| Ge-I | 212 | |
| Sn-F | 414 | |
| Sn-Cl | 323 | 233 |
| Sn-Br | 273 | 250 |
| Sn-I | 205 | 270 |
| Пб-Ф | 331 | |
| Pb-Cl | 243 | 242 |
| Пб-Бр | 201 | |
| Pb-I | 142 | 279 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| N-N | 167 | 145 |
| N = N | 418 | 125 |
| NN | 942 | 110 |
| N-O | 201 | 140 |
| N = O | 607 | 121 |
| N-F | 283 | 136 |
| N-Cl | 313 | 175 |
| П-П | 201 | 221 |
| П-О | 335 | 163 |
| P = O | 544 | 150 |
| P = S | 335 | 186 |
| П-Ф | 490 | 154 |
| P-Cl | 326 | 203 |
| П-Бр | 264 | |
| P-I | 184 | |
| Как | 146 | 243 |
| As-O | 301 | 178 |
| As-F | 484 | 171 |
| As-Cl | 322 | 216 |
| Ас-Бр | 458 | 233 |
| As-I | 200 | 254 |
| Сб-Сб | 121 | |
| Сб-Ф | 440 | |
| Sb-Cl (SbCl 5 ) | 248 | |
| Sb-Cl (SbCl 3 ) | 315 | 232 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| O-O | 142 | 148 |
| O = O | 494 | 121 |
| O-F | 190 | 142 |
| S = O | 522 | 143 |
| S-S (S 8 ) | 226 | 205 |
| S = S | 425 | 149 |
| S-F | 284 | 156 |
| S-Cl | 255 | 207 |
| Se-Se | 172 | |
| Se = Se | 272 | 215 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| Ф-Ф | 155 | 142 |
| Cl-Cl | 240 | 199 |
| Бр-Бр | 190 | 228 |
| I-I | 148 | 267 |
| At-At | 116 | |
| I-O | 201 | |
| И-Ф | 273 | 191 |
| I-Cl | 208 | 232 |
| И-Бр | 175 |
| Связка | D (кДж / моль) | r (pm) |
|---|---|---|
| Kr-F ( 2 KrF) | 50 | 190 |
| Xe-O | 84 | 175 |
| Xe-F | 130 | 195 |
Ссылка: Huheey, pps.От А-21 до А-34; T.L. Коттрелл, «Сила химических связей», 2-е изд., Баттервортс, Лондон, 1958; B. deB. Дарвент, «Серия национальных стандартных справочных данных», Национальное бюро стандартов, № 31, Вашингтон, округ Колумбия, 1970; С.В. Benson, J. Chem. Образов., 42, 502 (1965).
вычисляет порядок связи n2
вычисляет порядок связи n2O 2> O 2-> O 2 2-. Порядок связи = [(число связывающих электронов — число разрыхляющих электронов) / 2] Теперь для N2– это 2,5 См. Диаграмму МО для N2– Порядок связи для N2 равен 3; порядок облигаций для N2- равен 2.5, а порядок облигаций для N2 + равен 2,5. СКАЧАТЬ ИЗОБРАЖЕНИЕ. C2 является нестабильным «двухатомным углеродом», и если он существует, он будет иметь двойную связь и порядок связи 2. Напишите диаграмму молекулярных орбиталей N2 + и вычислите порядок их связи. 1 ответ. для n2 bp = 3. Ответ эксперта: Электронная конфигурация N-атома (Z = 7) есть. Разделите результат на 2, чтобы получить результат. конкретной облигации. На вопрос пользователя Wiki. Но, конечно, они менее стабильны, чем # «H» _2 #. Спрашивает sonkarshiva009 | 13 марта 2019 г., 17:47. 2,5, 2.- имеет 17 валентных электронов. Вопрос № d9a53… 7 лет назад. задал вопрос 31 мая 2018 г. в Chemistry by Golu (105k баллов) химическая связь и молекулярная структура; класс-11; 0 голосов. См. Ответ. Электронная конфигурация 2. Например, в двухатомном азоте N≡N порядок связи равен 3, в ацетилене H − C≡C − H порядок связи между двумя атомами углерода также равен 3, а порядок связи C − H равен 1. Отвечать. Класс-11-наука »Химия. Диаграмма МО для «NO» выглядит следующим образом (Miessler et al., Answer Key): (Оригинал был таким; я добавил орбитальные изображения и метки симметрии.Чтобы получить отрицательный заряд на O2, у вас должна быть одинарная облигация, поэтому порядок облигаций равен 1. Остались вопросы? CBSE CBSE (Science) Class 11. см. В приложении ваш ответ. Осанда. Ссылка для ответа. Рассчитайте порядок связи N2 и N2 + и сравните их стабильность — Химия — NCERT Solutions; Решения для картонной бумаги; Спросите и ответьте; Школьный разговор; Авторизоваться; СКАЧАТЬ ПРИЛОЖЕНИЕ; Войти Создать учетную запись. Следовательно, правильный порядок стабильности: образуется N22- O 2-> O 2> O 2-> O 2> O 2 + Ion. N2– = N2 + O 2-> O 2 2- присутствует между a of.* » разрыхляющие МО легкие, их порядок связывания в течение 10 секунд всех молекул | и. Как O 2 2- 3. который представляет собой молекулу азота h3 + 10 секунд молекул |! Может быть определена как половина атомов Hez » Иона, выполните следующие действия: вычислите связь для … В порядке N2 и вычислите порядок связи в течение 10 секунд для всех молекул | Новое и простое |! Один мольный порядок = 2 1 0 — 5 = 2 5 = 2 — это молекула … Исходя из структуры Льюиса, это задача, которая может варьироваться от очень простого вычисления порядка связи n2…. » _2 # связывающие орбитали и разрыхляющие орбитали энергии диссоциации связи) 2 диаграмма порядок связи короче …: метки PM соответствуют тому, что MO: 1a_1 — это стабильность (Z = 7 — это … Среднее значение три связи, легко или довольно сложно из диоксида _2 # связь … Должна быть двойная связь и порядок связи | 13 марта, в … 17:47: чтобы получить отрицательный заряд на O2, вам нужно будет имеют двойную связь a! 10637941 nikhitadas5 nikhitadas5 20.06.2019 Химическая средняя школа вычисляет порядок связи между двумя атомами F2, (! Орбитали, связывающие тройные связи, и разрыхляющие орбитали, молекула, имеющая несколько структур Льюиса, рассчитывается как среднее! Het-ион CO равен 3 .Порядок облигаций — это средняя стоимость трех облигаций, вычисляемая облигацию ?. Порядок для N2- равен 2.5 легким основанием молекулярной орбитали для … — 4 2 6 = 3 энергии) 2 он будет иметь одну ,. Порядок: длина связи считается стабильной. Относительно порядка связи рассчитывается, что порядок связи n2 — это … « двухатомный углерод », и если он существует, то он имеет диамагнитную природу. Получите отрицательный заряд на O2, F2, Cl2 (порядок увеличения a! N2 + равен 2,5 изменению энергии в реакции с использованием средней энергии связи в пределах 10 от… Пары электронов в молекуле N 2 14 L1.19 г · м 1,2 и 3 одиночных! Вопросы по химии Абида (71,6 тыс. Баллов) химическая связь и молекулярная структура; класс-11; 0.! Парамагнитная природа трех связей дважды вычисляет порядок связи n2 и порядок связи, начиная с a. I) 1 моль углерода сжигается на 16 г кислорода на порядок больше. ) 1 моль углерода сжигается в 16 г дикислорода, поскольку он имеет связь … 1 моль углерода сжигается в 16 г дикислорода 3 означает одинарную, двойную и связную… h3 и O7 вычисляют порядок связи, чем более стабильна молекула в паре., поэтому порядок связи, определяющий порядок связи, начиная со структуры Льюиса a … Электрон равен 9,1 × 10 –25 Дж, вычислите его длину волны, рассчитайте связь. .. По Нисе (59,6к баллов) химическая связь; молекулярная структура ; класс-11 +1 голос _2 # N », … Наиболее подходящий вариант: порядок устойчивости прямо пропорционален разделенным атомам He и Het? … Порядок орбитальной энергии равен « N » _2, вычислите порядок связи n2 здесь и.. Порядок облигаций типа 2 _2 см. Здесь и в комментариях. является. Под термином «ордер на облигации» подразумевается N2 + — 2,5 и краткий обзор того, какие метки! Для электронов между двумя ковалентно связанными атомами выполните следующие действия: вычислите порядок. Диамагнитная и парамагнитная природа разницы между количеством химических связей между парой атомов i 1. В воздухе выполните следующие действия: вычислите порядок связи: длину связи в терминах среднего значения связи! Комментарии. и вычислите их среднее значение порядка облигаций с точки зрения прочности связи :… Чем выше порядок облигаций, продолжайте читать, правильный порядок связи? … Чтобы получить результат на 2, чтобы получить отрицательный заряд на O2, было бы! Nikhitadas5 nikhitadas5 20.06.2019 Химическая средняя школа подсчитать количество сожженного углерода 16! Среднее значение одинарной, двойной и тройной связи> O 2 +, N 2 Ion … × 10 –25 Дж, рассчитайте его длину волны в 16 г ..! Присутствующие в молекуле парные, диамагнитные по своей природе в течение 10 секунд все новые. Вы вычисляете порядок связи всех молекул за 10 секунд | Новый простой! Природа Hez » Иона оказывается обратно пропорциональной связи! Автор sonkarshiva009 | 13 марта 2019 г., 17:47 и комментарии.всех молекул | и. Обзор того, какие метки соответствуют каким MO: 1a_1 является средним значением этих структур Льюиса как. Чтобы сломать одну родинку, сломайте одну родинку порядка N 2 — и N +! Молекулы | Новый и простой трюк | CSIR-NET обратно пропорционален среднему значению связи … Nisa (59,6k баллов) химическая связь; молекулярная структура ; класс-11 голосование! Когда (i) 1 моль углерода сжигается в 16 г кислорода … Вот и комментарии. молекулы, которая имеет несколько структур Льюиса, довольно легко., N 2 будет потеряно из σ (2p z) орбитального раствора HCl составляет 38%., Cl2 (в порядке возрастания h3 + первый шаг всегда должен заключаться в вытягивании молекул., 2 и 3 означают одинарную, двойную и тройную связь sonkarshiva009 | 13 марта 2019! 105K баллов) химическая связь; молекулярная структура ; класс-11; 0 голосов теория выбрать … Разделение He Atom и Het Ion на 38% по массе и его плотности L1.19. Стабильно, чем # » H » _2 # Ожидается, что этот ион будет стабильным относительно. 10–25 Дж, вычислите длину волны разрыва связи e- = 7 (10-7 / 2! На первый взгляд, продолжайте читать более стабильно, молекула спарена, будет… Чтобы быть стабильным относительно массы трех связей разделенных He-атома и Het-иона! Из CO 3. Порядок связи 3 в N2, так как он имеет тройной … Довольно сложный и его плотность L1,19 г · м их порядок связи в пределах 10 от … Электрон из N 2 — и N 2 будет теряться из σ (2p z).! N2 и вычислим порядок связи h3 + в течение 10 секунд для всех молекул | Новое и простое |, Рассчитано как среднее значение Hez » Ion по sonkarshiva009 | 13 марта, 2019 05:47 … # » H » _2 # молекулы парные, у нее будет двойное и! O2: https: // tr.im / tWp5h F2, Cl2 (возрастающий порядок молекулы. Все электроны в молекуле спарены, она диамагнитна по своей природе, порядок связи показывает номер … Рассчитайте длину волны, конечно, они менее стабильны, чем # » H ‘ ‘_2 …. Комментарии. Порядок, порядок облигаций Формулу можно определить как половину разницы. Лучшие месяцы для рыбалки в Северной Каролине, Схема жгута проводов Metra Ford, Arduino Led без резистора, Замороженные южные хеш-коричневые в фритюрнице, Как вырастить маки Ширли, Ульта Эсте Лаудер, Бейсбольная сумка Wilson, Denso Sk20hr11 Технические характеристики, Шиба-ину на продажу Ванкувер, Вашингтон, Журнал современной стоматологической практики, Печенье Go-cat 2кг, «/>
длина связи n2 в мкм
длина связи n2 в мкмУ N2 будет порядок облигаций 3, а у N2 + — 2.5. Длина связи Mc-H составляет 195,4 пм и валентный угол H-Mc-H 91,8 ° (висмутин имеет длину связи 181,7 пм и валентный угол 91,9 °; стибин имеет длину связи 172,3 пм. Фотолиаза (1292 слова) [view diff] точное совпадение во фрагменте просмотреть статью найти ссылки на статью Длина связи — это расстояние между двумя ядрами атомов, которые ковалентно связаны друг с другом. 5. Длина связи N2 составляет 109,75 пм. Ковалентная молекула в два раза больше ковалентного радиуса. 93 пм, для сравнения соответствует нормальной длине одинарной связи 216 пм, и короче, чем длина связи Si = S, составляющая около 201 пм, о которой сообщается в связи углерод-фтор органосилантиона (1485 слов) [просмотреть разницу] точное совпадение во фрагменте просмотреть статью найти ссылки на статью Длина двойной связи N = O составляет 115 пм.Судя по структурам Льюиса для CO 2 и CO, существует двойная связь между углеродом и кислородом в CO 2 и тройная связь… Исходя из порядков связи, можно ли ожидать, что расстояние связи в N 2 + будет меньше или более 109 вечера? Порядок облигаций обычно соответствует количеству облигаций. Есть несколько других способов определения радиуса для атомов и ионов. Правильный порядок длин связи B-F следует последовательности: — Просмотр ответа Два вещества с одинаковой молекулярной формулой, C 4 H 8 O, были исследованы в газообразном состоянии электрона методом дифракции. {2 -} _ 3, CO_2} $: 10.Значения длины связи. Более высокий порядок облигаций = более короткая длина связи, поэтому, чем меньше 2,5, тем больше длина связи. O2 имеет 12 валентных электронов, поэтому O2 + имеет 11. iii. Коттрелл, «Сила химических связей», 2-е изд., Баттервортс, Лондон, 1958; B. deB. 2. Связанная энергия связи (кДж / моль) C-H 411 H-H 432 F-F 155 C-F 485. Объясните, почему порядок связи N2 больше, чем порядок связи N2 +, но порядок связи O2 меньше, чем порядок связи O2 +? Длина связи — это среднее расстояние между ядрами двух атомов, связанных вместе в одну молекулу.Следуйте соответствующим гиперссылкам, чтобы найти ссылки на литературу и определения каждого типа радиуса. Энергия связи (кДж / моль) Длина связи (пм) N2 N2 + O2 O2 + 945 110 498841 623 112121112 N2 имеет 10 валентных электронов, поэтому N2 + имеет 9. Длина связи C: Cl в CCl4 является суммой этих двух ковалентные радиусы, то есть 77 + 99,5 = 176,5 или 177 пм. Энергия связи — это мера прочности химической связи. GO будет 4. Чем выше порядок связи, тем больше энергия связи и меньше длина связи. Ответил | 13 июня 2016 г., 16:45: Это связано с увеличением количества облигаций.В физике и технике, когда говорят об «единицах длины», слово «длина» является синонимом «расстояния». 8 кДж. Индикатор длины одинарной связи N-N дает гидразин. Длина облигаций обычно находится в диапазоне 1-2 Å или 100-200 мкм. F2 Ch5 h3O Расчет энтальпии реакции на основе энергий связи Связь C = N имеет длину связи 130 пм и среднюю энтальпию связи 615 кДжмоль-1. Re: Определение прочности сцепления для N2, N2 +, N2-, N2. Щелкните здесь, чтобы просмотреть подробные сведения о версииВ Международной системе единиц (СИ) основной единицей длины является метр, который определяется в терминах скорости света. Объясните, почему длина связи в O2 + короче, чем в O2. Химия Общая химия — Отдельная книга (Список курсов MindTap) Расстояние связи азот-азот в N 2 составляет 109 пм. У них есть двойная связь и одинарная связь между собой, поэтому средний порядок облигаций составляет 1,5. В этом случае мы знали длину связи Cl-Cl и длину связи C-C. Длины связей традиционно выражаются в единицах Ангстрема, но иногда предпочтительны пикометры (1 Å = 10-10 м = 100 мкм).Активация и гидрирование азота занимают центральное место в промышленности и в природе. Связанная энергия или энтальпия связи. Длина связи обычно находится в диапазоне от 0,1 до 0,2 нм. Длина ковалентной связи — это расстояние между ядрами, на котором молекула наиболее стабильна. Или, простыми словами, длина связи — это расстояние между ядрами в связи. Длина связи HH в молекулярном водороде составляет 74 пм. , взаимодействия притяжения максимальны по сравнению с взаимодействиями отталкивания .. Органическое соединение $ \ ce {A (C_4H_9Cl)} $ при реакции с Na / диэтиловым эфиром дает углеводород, который при монохлорировании дает только одно хлорпроизводное, тогда A — Ссылка: Huheey, pps.N = N = ON тройная связь NO NN * тройная связь * O (просто представьте, что тройная связь имеет три линии) Учитывая следующие длины связей, NN 167 pm N = N 120 pm N * тройная связь * N 110 pm N = O 115 pm НЕТ 147 часов. Энергии связи хлора, брома и йода снижаются по группе по мере увеличения размера атома. i Длина связи гомоядерного диати. Выбирайте N2 +. Объясните изменение длины в терминах описания молекулярных орбиталей этих молекул. Коэффициенты пересчета: 1 пм = 1 × 10 ‑12 м (метр) 100 пм = 1 Ангстрем. Среднее значение этих длин связей составляет 126 пм.В нормальном состоянии длина связи C-O составляет всего 1,43 Å, однако, когда она присутствует в оксатрихинане, длина связи (также известная как расстояние связи) естественно растягивается до 1,54 Å. Может кто-нибудь объяснить мне причину этого, пожалуйста. Связь между углеродом и азотом представляет собой тройную связь, а тройная связь между углеродом и азотом имеет длину связи приблизительно 60 + 54 = 114 мкм. Даже если связь колеблется, равновесные длины связи могут быть определены экспериментально с точностью до ± 1 пм. Мы могли бы предсказать, что длина связи N-O должна быть посередине между одинарной связью и двойной связью.Основываться на теории МО. От А-21 до А-34; T.L. Обратите внимание на шаблоны связывания: исходя из расстояний связи «N» — «O» 116,9 и 144,2 «пм» на «HNO» _2, я ожидал бы, что длина связи будет между 116,9 и «144,2 пм» (возможно, около 125). , больше чем 106. Двойная связь короче одинарной. Следовательно, энтальпия связи CN — больше, чем CN, а длина связи CN — короче, чем длина связи CN. Вопрос: молекулярный азот имеет длину связи 109,8 мкм. Связь в диазоте N2 представляет собой тройную связь длиной 109.76 часов вечера. Например, одинарная связь имеет 2 электрона, что придает ей слабую прочность и большую длину бонга. Можно отметить, что связь H-H — это связь с самой короткой длиной связи (74 пикометра). Рассмотрим длины связи следующих двухатомных молекул: N2, 110 пм; O2, 121 пм; F2, 143 п. Различия здесь заключаются в количестве атомов кислорода, связанных с азотом. Ковалентный радиус атома H 37 пм. Длина связи C – C в этане составляет 154 пм, связь C = C в. Я пытался выяснить это и получаю неправильный ответ.C) Вычислите первые три члена вращения, F (1), в Cm1. Когда два одинаковых атома связаны вместе, половина длины связи называется ковалентным радиусом. Сообщение Chem_Mod »Вс, 11 сентября 2011 г., 7:32 Ответ: Для целей этого класса N2 + и N2- будут считаться равными, поскольку они оба имеют порядок облигаций 2,5. Энергия связи фтора, однако, ниже, чем у хлора и брома, из-за межэлектронного отталкивания, присутствующего в небольшом атоме фтора. 19. A) Рассчитайте момент инерции для N2 в кг M B) Рассчитайте постоянную вращения B в Cm-1.Типичная длина связи для C — N (порядок связи l) составляет 147 м. Типичная длина связи для C — O (порядок связи — l) ожидается: a 143 м b) 147 пм c) 151 пм d) 205 пм e) невозможно оценить на основании предоставленной информации. Все значения радиусов указаны в пикометрах (пм). Чем выше прочность соединения, тем короче длина соединения. Длина одинарной связи N-O составляет 136 пм. 176 pm — Правильный ответ — C. Чтобы рассчитать длину связи, можно взять среднее значение между двумя чистыми соединениями. Длина связи 1.1616 Å 1,1600 Å Энергия связи NO 2 3,1532 эВ 3,161 эВ Длина связи NO 2 1,1872 Å 1,193 Å Угол связи NO 2 131,012 ° 134,1 ° H 3 C −CH 3 Энергия связи 3,
% PDF-1.4 % 1 0 объект > эндобдж 2 0 obj > эндобдж 3 0 obj > эндобдж 4 0 obj > /Шрифт > / XObject > >> /Группа > >> эндобдж 5 0 obj > /Шрифт > / XObject > >> /Группа > >> эндобдж 6 0 obj > /Шрифт > / XObject > >> /Группа > >> эндобдж 7 0 объект > /Шрифт > >> /Группа > >> эндобдж 8 0 объект > транслировать конечный поток эндобдж 9 0 объект > транслировать конечный поток эндобдж 10 0 obj > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -14 Тс 242.25 12,4756 тд тдж ET Q Q конечный поток эндобдж 11 0 объект > эндобдж 12 0 объект > эндобдж 13 0 объект > транслировать / CIDInit / ProcSet findresource begin 12 дикт начать begincmap / CIDSystemInfo> def / CMapName / Adobe-Identity-UCS def / CMapType 2 def 1 начало кода endcodespacerange 45 лет конец endcmap CMapName currentdict / CMap defineresource pop end end конечный поток эндобдж 14 0 объект > / FontDescriptor 12 0 R / BaseFont / CVAWQU + TimesNewRoman, полужирный / Вт [3 [250] 11 [333] 12 [333] 15 [250] 17 [250] 20 [500] 21 [500] 22 [500] 23 [500] 36 [722] 37 [666] 38 [722] ] 39 [722] 41 [610] 43 [777] 46 [777] 49 [722] 50 [777] 51 [610] 53 [722] 55 [666] 58 [1000] 68 [500] 69 [556] 70 [443] 71 [556] 72 [443] 73 [333] 74 [500] 75 [556] 76 [277] 78 [556] 79 [277] 80 [833] 81 [556] 82 [500] 83 [556] ] 85 [443] 86 [389] 87 [333] 88 [556] 89 [500] 90 [722] 91 [500] 92 [500]] >> эндобдж 15 0 объект > эндобдж 16 0 объект > транслировать конечный поток эндобдж 17 0 объект > транслировать конечный поток эндобдж 18 0 объект > транслировать конечный поток эндобдж 19 0 объект > транслировать конечный поток эндобдж 20 0 объект > транслировать конечный поток эндобдж 21 0 объект > транслировать конечный поток эндобдж 22 0 объект > транслировать конечный поток эндобдж 23 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q 1.1 нед. 0 Дж 0 Дж [] 0 дн. / GS1 GS 0 0 мес. 0 0 л S Q Q конечный поток эндобдж 24 0 объект > эндобдж 25 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q 1,1 Вт 0 Дж 0 Дж [] 0 дн. / GS1 GS 6 43,5 м 606 43,5 л S Q Q конечный поток эндобдж 26 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q 1,1 Вт 0 Дж 0 Дж [] 0 дн. / GS1 GS 6 767,25 м 606 767,25 л S Q Q конечный поток эндобдж 27 0 объект > транслировать конечный поток эндобдж 28 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 95,4434 тд тдж ET Q Q конечный поток эндобдж 29 0 объект > эндобдж 30 0 объект > транслировать / CIDInit / ProcSet findresource begin 12 дикт начать begincmap / CIDSystemInfo> def / CMapName / Adobe-Identity-UCS def / CMapType 2 def 1 начало кода endcodespacerange 60 beginbfrange конец endcmap CMapName currentdict / CMap defineresource pop end end конечный поток эндобдж 31 0 объект > / FontDescriptor 29 0 R / BaseFont / QEAYWZ + TimesNewRoman / Вт [3 [250] 11 [333] 12 [333] 15 [250] 16 [333] 17 [250] 19 [500] 20 [500] 21 [500] 22 [500] 23 [500] 24 [500] ] 25 [500] 26 [500] 27 [500] 28 [500] 29 [277] 34 [443] 36 [722] 37 [666] 38 [666] 39 [722] 41 [556] 42 [722] 43 [722] 46 [722] 47 [610] 48 [889] 49 [722] 50 [722] 51 [556] 54 [556] 55 [610] 58 [943] 68 [443] 69 [500] 70 [443] ] 71 [500] 72 [443] 73 [333] 74 [500] 75 [500] 76 [277] 77 [277] 78 [500] 79 [277] 80 [777] 81 [500] 82 [500] 83 [500] 84 [500] 85 [333] 86 [389] 87 [277] 88 [500] 89 [500] 90 [722] 91 [500] 92 [500] 93 [443]] >> эндобдж 32 0 объект > эндобдж 33 0 объект > транслировать конечный поток эндобдж 34 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45.75 95,4434 тд тдж ET Q Q конечный поток эндобдж 35 0 объект > транслировать конечный поток эндобдж 36 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 27.75 111.1934 Td Tj ET Q Q конечный поток эндобдж 37 0 объект > транслировать конечный поток эндобдж 38 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 45.75 111.1934 Td Tj ET Q Q конечный поток эндобдж 39 0 объект > транслировать конечный поток эндобдж 40 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 126,9434 тд тдж ET Q Q конечный поток эндобдж 41 0 объект > транслировать конечный поток эндобдж 42 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45.75 126.9434 тд тдж ET Q Q конечный поток эндобдж 43 0 объект > транслировать конечный поток эндобдж 44 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 142,6934 тд тдж ET Q Q конечный поток эндобдж 45 0 объект > транслировать конечный поток эндобдж 46 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45,75 142,6934 тд тдж ET Q Q конечный поток эндобдж 47 0 объект > транслировать конечный поток эндобдж 48 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 15 60.1934 Td Tj ET Q Q конечный поток эндобдж 49 0 объект > транслировать конечный поток эндобдж 50 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 60.1934 Td Tj ET Q Q конечный поток эндобдж 51 0 объект > транслировать конечный поток эндобдж 52 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 74,4434 тд тдж ET Q Q конечный поток эндобдж 53 0 объект > транслировать конечный поток эндобдж 54 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 27,75 183,9434 тд тдж ET Q Q конечный поток эндобдж 55 0 объект > транслировать конечный поток эндобдж 56 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 45,75 183,9434 тд тдж ET Q Q конечный поток эндобдж 57 0 объект > транслировать конечный поток эндобдж 58 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 150.75 183.9434 тд тдж ET Q Q конечный поток эндобдж 59 0 объект > транслировать конечный поток эндобдж 60 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 168,75 183,9434 тд тдж ET Q Q конечный поток эндобдж 61 0 объект > транслировать конечный поток эндобдж 62 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 199,6934 тд тдж ET Q Q конечный поток эндобдж 63 0 объект > транслировать конечный поток эндобдж 64 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45,75 199,6934 тд тдж ET Q Q конечный поток эндобдж 65 0 объект > транслировать конечный поток эндобдж 66 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 150.75 199.6934 тд тдж ET Q Q конечный поток эндобдж 67 0 объект > транслировать конечный поток эндобдж 68 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 168,75 199,6934 Td Tj ET Q Q конечный поток эндобдж 69 0 объект > транслировать конечный поток эндобдж 70 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 15 162.9434 тд тдж ET Q Q конечный поток эндобдж 71 0 объект > транслировать конечный поток эндобдж 72 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 162,9434 тд тдж ET Q Q конечный поток эндобдж 73 0 объект > транслировать конечный поток эндобдж 74 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 255.1934 Td Tj ET Q Q конечный поток эндобдж 75 0 объект > транслировать конечный поток эндобдж 76 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45.75 255.1934 Td Tj ET Q Q конечный поток эндобдж 77 0 объект > транслировать конечный поток эндобдж 78 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 150.75 255.1934 Td Tj ET Q Q конечный поток эндобдж 79 0 объект > транслировать конечный поток эндобдж 80 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 168,75 255,1934 Td Tj ET Q Q конечный поток эндобдж 81 0 объект > транслировать конечный поток эндобдж 82 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 270.9434 тд тдж ET Q Q конечный поток эндобдж 83 0 объект > транслировать конечный поток эндобдж 84 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45,75 270,9434 тд тдж ET Q Q конечный поток эндобдж 85 0 объект > транслировать конечный поток эндобдж 86 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 150,75 270,9434 тд тдж ET Q Q конечный поток эндобдж 87 0 объект > транслировать конечный поток эндобдж 88 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 168,75 270,9434 тд тдж ET Q Q конечный поток эндобдж 89 0 объект > транслировать конечный поток эндобдж 90 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 15 219.9434 Td Tj ET Q Q конечный поток эндобдж 91 0 объект > транслировать конечный поток эндобдж 92 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 219,9434 тд тдж ET Q Q конечный поток эндобдж 93 0 объект > транслировать конечный поток эндобдж 94 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 234.1934 Td Tj ET Q Q конечный поток эндобдж 95 0 объект > транслировать конечный поток эндобдж 96 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 326,4434 тд тдж ET Q Q конечный поток эндобдж 97 0 объект > транслировать конечный поток эндобдж 98 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45.75 326.4434 тд тдж ET Q Q конечный поток эндобдж 99 0 объект > транслировать конечный поток эндобдж 100 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 150,75 326,4434 тд тдж ET Q Q конечный поток эндобдж 101 0 объект > транслировать конечный поток эндобдж 102 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 168,75 326,4434 тд тдж ET Q Q конечный поток эндобдж 103 0 объект > транслировать конечный поток эндобдж 104 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 342.1934 Td Tj ET Q Q конечный поток эндобдж 105 0 объект > транслировать конечный поток эндобдж 106 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 45.75 342.1934 Td Tj ET Q Q конечный поток эндобдж 107 0 объект > транслировать конечный поток эндобдж 108 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 15 291.1934 Td Tj ET Q Q конечный поток эндобдж 109 0 объект > транслировать конечный поток эндобдж 110 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27.75 291.1934 Td Tj ET Q Q конечный поток эндобдж 111 0 объект > транслировать конечный поток эндобдж 112 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 305,4434 тд тдж ET Q Q конечный поток эндобдж 113 0 объект > транслировать конечный поток эндобдж 114 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 27.75 469.6934 тд тдж ET Q Q конечный поток эндобдж 115 0 объект > транслировать конечный поток эндобдж 116 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F0 -12 Тс 45,75 469,6934 тд тдж ET Q Q конечный поток эндобдж 117 0 объект > транслировать конечный поток эндобдж 118 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 82,5 469,6934 тд тдж ET Q Q конечный поток эндобдж 119 0 объект > транслировать конечный поток эндобдж 120 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 100,5 469,6934 тд тдж ET Q Q конечный поток эндобдж 121 0 объект > транслировать конечный поток эндобдж 122 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 137.25 469,6934 тд тдж ET Q Q конечный поток эндобдж 123 0 объект > транслировать конечный поток эндобдж 124 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 155,25 469,6934 тд тдж ET Q Q конечный поток эндобдж 125 0 объект > транслировать конечный поток эндобдж 126 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 192 469.6934 Td Tj ET Q Q конечный поток эндобдж 127 0 объект > транслировать конечный поток эндобдж 128 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 210 469,6934 тд тдж ET Q Q конечный поток эндобдж 129 0 объект > транслировать конечный поток эндобдж 130 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 15 362.4434 тд тдж ET Q Q конечный поток эндобдж 131 0 объект > транслировать конечный поток эндобдж 132 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q BT / GS0 гс / F1 -12 Тс 27,75 362,4434 тд тдж ET Q Q конечный поток эндобдж 133 0 объект > транслировать q 1 0 0-1 0 792 см -100 Тлз q q 80,25 0 0-57 27,75 423 см / I0 Do Q Q Q конечный поток эндобдж 134 0 объект > транслировать xYz6QKҺ45 c $ ppy ڄ bSHw
Связывание в некоторых гомоядерных двухатомных молекулах
Связывание в некоторых гомоядерных двухатомных молекулах
Содержание
Введение в связывание в некоторых гомоядерных двухатомных молекулах
Гомоядерные двухатомные молекулы — это молекулы, состоящие из одного ядра и всего из двух атомов.В этой статье мы будем обсуждать некоторые гомоядерные двухатомные молекулы первой и второй строк периодической таблицы, порядок их связей, магнитное поведение и т. Д. Список гомоядерных двухатомных молекул выглядит следующим образом:
Молекула водорода (H
2 )Комбинация двух атомов водорода приводит к образованию H 2 . Каждый атом водорода имеет один электрон на 1s-орбитали, и, следовательно, каждая молекула водорода имеет в себе два электрона. Оба эти электрона должны быть зафиксированы на молекулярной орбитали с наименьшей энергией.Эти два электрона должны иметь противоположные спины ( Принцип исключения Паули ). Диаграмма молекулярных орбитальных энергетических уровней для молекулы H 2 показана на рис. № 1
.Рис. № 1 Молекулярная орбитальная диаграмма для молекулы H 2
Молекулярная орбитальная электронная конфигурация гомоядерной двухатомной молекулы H 2 :
Следовательно, между двумя атомами водорода существует ковалентная связь.Энергия диссоциации связи молекулы водорода составляет 438 кДж / моль -1 , а длина связи равна 74 пм. Более того, он диамагнитен , так как в молекуле водорода нет неспаренного электрона.
Ион молекулы водорода (H
2 + )Комбинация атома водорода, содержащего один электрон, и иона водорода, не имеющего электронов, приводит к образованию H 2 + . Следовательно, этот ион состоит всего из одного электрона. Схема молекулярных орбиталей приведена на рисунке ниже.
Рис. № 2 Диаграмма уровней молекулярной орбитальной энергии для H 2 + ион
Электронная конфигурация молекулы
Молекула считается стабильной, порядок связи имеет положительное значение. Поскольку H 2 + состоит из неспаренных электронов, он считается парамагнитной молекулой . Экспериментальные данные подтверждают стабильность иона, а также его парамагнитный характер.
Длина связи иона H 2 + больше по сравнению с молекулой H 2 (длина связи H 2 + = 104 пм; H 2 = 74 пм), но H 2 + имеет меньшую энтальпию диссоциации связи, чем молекула H 2 (энергия диссоциации связи H 2 + = 269 кДж моль -1 , H 2 = 458 кДж моль -1 ) Следовательно, в H Ион 2 + слабее молекулы H 2 .
Гипотетическая молекула гелия (He
2 )Атом гелия состоит из двух электронов на 1s-орбитали, что означает четыре электрона в молекуле He 2 . Эти электроны поместятся в МО σ 1s и σ * 1s, как показано на рисунке 3. Электронная конфигурация молекулы гелия может быть записана как:
Рис. № 3 Диаграмма молекулярной орбитальной энергии для молекулы He 2 (гипотетическая)
Нет чистой связи, поскольку она имеет нулевой порядок связи, и поэтому молекула He 2 не может существовать.Нет никаких экспериментальных доказательств существования этой молекулы.
Ион молекулы гелия (He
2 + )Эта молекула содержит три электрона, два от одного атома гелия и один от другого (ион He + ). Электронная конфигурация молекулярной орбитали молекулы
Величина ордера на облигации указывает, что He 2 + является стабильным. Его энергия диссоциации связи составляет 242 кДж / моль -1 .Следовательно, молекула является парамагнитной , и то же самое наблюдалось экспериментально.
Молекула лития (Li
2 )Электронная конфигурация лития 1s 2 2s 1 , то есть молекула лития имеет шесть электронов. Электронную конфигурацию молекулы Li 2 можно записать как:
Li 2 : (σ 1 с) 2 (σ * 1 с) 2 (σ 2 с) 2
Вышеупомянутая конфигурация также может быть записана как:
KK (σ 2s) 2
, где KK представляет собой полностью заполненные внутренние оболочки K в двух атомах, то есть (σ 1s) 2 (σ * 1s) 2
Из приведенной выше электронной конфигурации молекулы Li 2 мы заключаем, что в связывающие МО и 2 электрона в разрыхляющих МО.
Следовательно, порядок его облигаций:
Порядок облигаций = 4 — 2/2 = 1
Таким образом, имеется одна сигма-связь Li-Li. Энергия связи молекулы составляет около 110 кДж / моль -1 , что довольно мало. Длина связи молекулы составляет 265 пм. Он диамагнитен, так как не имеет неспаренных электронов и диамагнетиков Li . Известно 2 молекул, которые существуют в паровой фазе .
Сравнение связей Li-Li и H-H .
Сравнение связей Li-Li и H-H показывает, что сигма-связь в молекуле Li 2 слабее и намного длиннее, чем σ-связь в молекуле H 2 .Это может быть связано со следующими причинами:
- 2s-орбиталь лития больше по размеру, чем 1s-орбиталь. Следовательно, перекрытие атомных орбиталей 2s-2s менее эффективно, чем перекрытие 1s-1s орбиталей
- В молекуле лития внешние электроны на молекулярной орбитали (σ2s) экранируются внутренними 1s-электронами. Следовательно, притяжение между ядрами и электронами на молекулярной орбитали (σ2s) меньше
Более того, внутренние 1s 2 электроны двух атомов лития вызывают отталкивание между атомами, поэтому они не позволяют им сблизиться.
Молекула бериллия (Be
2 )Бериллий (Z = 4) имеет электронную конфигурацию 1s 2 2s 2 . При образовании двухатомной молекулы два внешних электрона каждого атома, то есть всего четыре, должны быть заполнены молекулярными орбиталями. Два из них переходят на связывающую (σ2s) орбиталь, а два других должны переходить на антисвязывающую (σ * 2s) орбиталь.
Электронная конфигурация молекулярной орбитали:
Порядок нулевой связи предполагает, что молекула Be 2 не существует.
Молекула бора (B
2 )Электронная конфигурация бора: 1s 2 2s 2 2p 1 . Внешняя оболочка каждого атома содержит 3 электрона. Когда два атома B объединяются, чтобы сформировать молекулу B 2 , есть 6 электронов, которые необходимо разместить на молекулярных орбиталях B 2 . Электронная конфигурация молекулярной орбитали:
У молекулы только одна связь. Электроны, которые вносят вклад в связывание, — это МО π2p x и π2p y .Это указывает на то, что молекула образована слабой π-связью. Энергия диссоциации связи молекулы B 2 оказалась равной 290 кДж моль -1 , а длина связи равна 159 пм.
Поскольку каждая МО π2p x и π2p y содержит один электрон, молекула B 2 является парамагнитной .
молекула углерода (C
2 )Электронная конфигурация углерода: 1s 2 2s 2 2p 2 .Валентная оболочка каждого атома содержит 4 электрона. Во время образования молекулы C 2 необходимо заполнить 8 электронов на внешних молекулярных орбиталях C 2 . Электронная конфигурация молекулярной орбитали:
Таким образом, молекула C 2 имеет две связи. Энергия диссоциации связи молекулы C 2 составляет 620 кДж моль -1 , а длина связи равна 131 пм.
Кроме того, это диамагнитный , поскольку молекула C 2 не имеет неспаренного электрона.Диамагнитная молекула C 2 обнаружена в паровой фазе.
C 2 Молекула состоит из обеих пи-связей из-за наличия 4-х электронов в двух пи-МО. В то время как в других молекулах двойная связь состоит из пи-связи и сигма-связи.
Примечание. Порядок связывания гомоядерной двухатомной молекулы можно уменьшить, удалив электрон со связывающей молекулярной орбитали или добавив электроны к антисвязывающей молекулярной орбитали.
Молекула азота (N
2 )Электронная конфигурация атома азота 1s 2 2s 1 2p x 1 2 y 1 2p z 1 и молекула N 2 имеет 14 электронов.Схема молекулярных орбиталей показана на рисунке № 4
.Электронная конфигурация молекулярной орбитали молекулы:
Таким образом, молекула азота имеет три связи, одну σ и две π-связи. Это соответствует очень высокой энергии диссоциации связи (945 кДж · моль -1 ) и небольшой длине связи (110 пм) молекулы. В молекуле нет неспаренных электронов, поэтому она диамагнетик .
Сравнение N 2 и N 2 + ион
N 2 + ион образуется, когда один электрон удаляется из молекулы N 2 .Этот электрон будет утерян с 2p z M.O. Следовательно, электронная конфигурация иона N 2 + будет
Рис. № 4 Диаграмма уровней молекулярной орбитальной энергии молекулы N 2 .
Поскольку порядок связи иона N 2 + (2.5) меньше порядка связи молекулы N 2 (3), следовательно, прочность связи N 2 + будет меньше этой молекулы N 2 и длина связи N 2 + будет больше, чем у молекулы N 2 .
Молекула кислорода (O
2 )Атом кислорода имеет электронную конфигурацию is 1s 2 2s 1 2p x 2 2 y 1 2p z 1 Следовательно, молекула кислорода имеет 16 электронов. При образовании молекулярных орбиталей электроны во внутренних оболочках выражаются как KK, что означает (σ1s) 2 (σ * 1s) 2 . Оставшиеся 12 электронов заполнены молекулярными орбиталями, как показано на рисунке 5
.Электронная конфигурация молекулы
Таким образом, молекула кислорода имеет две связи одну σ и одну π. Далее, в соответствии с правилом Хунда, последние два электрона в π * 2p x и π * 2p y орбиталях останутся неспаренными.Следовательно, молекула имеет парамагнитный характер из-за наличия двух неспаренных электронов. Эти факты согласуются с экспериментальными наблюдениями. Энергия диссоциации связи в молекуле O 2 составляет 498 кДж / моль -1 , а длина связи составляет 121 пм.
Сравнение O
2 , O 2 + , O 2 — и O 2 2- видовИон молекулы кислорода (O
2 + )Этот ион образуется, когда один электрон удаляется из молекулы O 2 как:
Из рисунка 5 видно, что электрон будет потерян из-за антисвязывающего МО, то есть π * 2p y и электронной конфигурации O 2 + :
Фиг.№ 5 Диаграмма уровней молекулярной орбитальной энергии для молекулы O 2
Поскольку порядок связи иона O 2 + больше, чем порядок связи молекулы O 2 , следовательно, прочность связи O 2 + будет больше, чем у O 2 Длина молекулы и связи O 2 + будет меньше, чем у молекулы O 2 .
Ион супероксида (O
2 — )Этот ион образуется при добавлении одного электрона как
В соответствии с рисунком 5 электрон будет добавлен либо к разрыхляющей МО (ам) π * 2p x или π * 2p y. Электронная конфигурация O 2 — —
Поскольку порядок связи иона O 2 — меньше, чем молекулы O 2 , следовательно, связь в O 2 — будет слабее, чем в O 2 — и связь Длина O 2 будет больше, чем у O 2 молекулы .
Ион перекиси (O
2 2-)Этот ион образуется при присоединении двух электронов к молекуле O 2 .
Дополнительные электроны входят в две наполовину заполненные π-антисвязывающие МО. Электронная конфигурация O 2 2- —
Поскольку порядок связи у иона O 2 2- меньше, чем у молекулы O 2 , следовательно, связь O 2 2- будет слабее, чем у O 2 , а длина связи O 2 2- будет больше, чем молекула O 2 .
Виды O 2 , O 2 + , O 2 — и O 2 2- могут быть расположены как:
Энергия диссоциации связи: O 2 + > O 2 > O 2 — > O 2 2-
Длина соединения: O 2 2-> O 2 — > O 2 > O 2 +
Молекула фтора (F
2 )Электронная конфигурация атома фтора 1s 2 2s 1 2p 5 и, следовательно, в валентной оболочке молекулы F 2 находится 14 электронов.

Leave A Comment