ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §5 Закон Авогадро. Молярный объём газов РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §5 Закон Авогадро. Молярный объём газов РЕШЕБНИК ОТВЕТЫ
Другие задания смотри здесь…
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Сформулируйте закон Авогадро. В равных объёмах любых газов, находящихся при одних и тех же условиях (температура и давление), содержится одинаковое число молекул.
Задание 2
Какие условия называют нормальными? При температуре 0°С и давлении 760 мм рт.ст. (или 101,3 кПа).
Чему равен молярный объём газа:
а) при нормальных условиях; 22,4 л/моль
б) при 25°C и 1 атм? 24,4 л/моль
Задание 3
Какой объём занимают при н. у.:
а) 2 моль азота;
Дано: n(N2)=2 моль
Найти: V(N2)-?
Решение
1-й способ
V(N2)=n(N2)•VM=2 моль • 22,4 л/моль=44,8 л
Для нахождения объёма азота составляем пропорцию и решаем её:
1 моль азота занимает объём 22,4 л,
2 моль азота ― объём х л
х = 2 моль • 22,4 л : 1 моль=44,8 л
Ответ: 44,8 л
б) 0,5 моль кислорода;
Дано: n(O2)=0,5 моль
Найти: V(O2)-?
Решение
1-й способ
V(O2)=n(O2)•VM=0,5 моль • 22,4 л/моль=11,2 л
2-й способ
Для нахождения объёма кислорода составляем пропорцию и решаем её:
1 моль кислорода занимает объём 22,4 л,
0,5 моль кислорода ― объём х л
х = 0,5 моль • 22,4 л : 1 моль=11,2 л
Ответ: 11,2 л
в) 0,25 моль фтора?
Дано: n(F2)=0,25 моль
Решение
1-й способ
V(F2)=n(F2)•VM=0,25 моль • 22,4 л/моль=5,6 л
2-й способ
Для нахождения объёма фтора составляем пропорцию и решаем её:
1 моль фтора занимает объём 22,4 л,
0,25 моль фтора ― объём х л
х = 0,25 моль • 22,4 л : 1 моль=5,6 л
Ответ: 5,6 л
Задание 4
Сколько молекул находится внутри резинового шара объёмом 5,6 л (н. у.), заполненного водородом?
у.), заполненного водородом?
Дано: V(H2)=5,6 л
Найти: N(H2)-?
Решение
1-й способ
n(H2)=V(H2)/VM=5,6 л : 22,4 л/моль=0,25 моль
N(N2
2-й способ
Для нахождения числа молекул водорода составляем пропорцию и решаем её:
в объёме 22,4 л водорода содержится 6,02•1023 молекул N2,
в объёме 5,6 л водорода ― х молекул N2
х=N(N2)=5,6 л • 6,02•1023: 22,4 л=1,5•1023
Ответ: N(N2)=1,5•1023
Изменится ли ответ, если в условии задачи водород заменить на:
а) азот; Не изменится, т.к. закон Авогадро справедлив для любого газа,
б) неизвестный газ; Не изменится, т.к. закон Авогадро справедлив для любого газа,

Задание 5
Объясните, как с помощью закона Авогадро можно установить, что формула воды H2O, а не HO. Необходимо заполнить пробирку методом вытеснения воды смесью водорода и кислорода с объёмным соотношением 2:1. Просунуть в пробирку электроподжиг, и поджечь смесь газов, после реакции вода полностью заполнит пробирку, что подтверждает формулу воды H2O. Если смесь водорода и кислорода будет иметь объёмное соотношение 1:1, то после реакции вода не полностью заполнит пробирку, что опровергает формулу воды HO.
Задание 6
В каком объёме аммиака содержится в 3 раза больше молекул, чем в 100 л метана? Газы находятся при одинаковых температуре и давлении. В 300 л аммиака содержится в 3 раза больше молекул, чем в 100 л метана, так как в равных объёмах любых газов, находящихся при одних и тех же условиях, содержится одинаковое число молекул.
Задание 7
Имеются два газа, взятые при одинаковых условиях: 10 л метана CH4 и 20 л хлора Cl2. В каком из них содержится больше молекул, а в каком – больше атомов и во сколько раз? Поскольку объём хлора в два раза больше объёма метана, следовательно, в
20 л Cl
В каком из них содержится больше молекул, а в каком – больше атомов и во сколько раз? Поскольку объём хлора в два раза больше объёма метана, следовательно, в
20 л Cl
Задание 8
Где содержится больше молекул аммиака – в 100 г или в 100 л (н.у.)?
n1(NH3)=m(NH3):M(NH3)=100 г : 17 г/моль=5,882 моль
n2(NH3)=V(NH3)/VM=100 л : 22,4 л/моль=4,46 моль
Ответ: больше молекул NH3 содержится в 100 г аммиака.

Задание 9
Сколько молекул кислорода находится при нормальных условиях:
а) в одном кубометре;
Дано: V(O2)=1 м3 = 1000 л
Найти: N(O2)-?
Решение
1-й способ
n(O2)=V(O2)/VM=1000 л : 22,4 л/моль=44,64 моль
N(O
2-й способ
Для нахождения числа молекул кислорода составляем пропорцию и решаем её:
в объёме 22,4 л кислорода содержится 6,02•1023 молекул O2,
в объёме 1000 л кислорода ― х молекул O2
х=N(O2)=1000 л • 6,02•1023: 22,4 л=2,7•1025
Ответ: N(O2)=2,27•1025
б) в одном килограмме этого вещества?
Дано: m(O2)=1 кг = 1000 г
Найти: N(O2)-?
Решение
1-й способ
n(O2)=m(O2):M(O2
N(O2)=n(O2)•NА=31,25 моль • 6,02•1023 моль-1=1,8•1025
2-й способ
Для нахождения числа молекул кислорода составляем пропорцию и решаем её:
в 32 г кислорода содержится 6,02•1023 молекул O2,
в 1000 г кислорода ― х молекул O2
х=N(O2)=1000 г • 6,02•1023: 32 г =1,8•1025
Ответ: N(O2)=1,8•1025
Задание 10
Какой объём занимают при нормальных условиях:
а) 10 г водорода;
Дано: m(H2)=10 г
Найти: V(H2)-?
Решение
1-й способ
n(H
V(H2)=n(H2)•Vm=5 моль • 22,4 л/моль=112 л
2-й способ
Для нахождения объёма водорода составляем пропорцию и решаем её:
2 г водорода занимает объём 22,4 л,
10 г водорода ― объём х л
х = 10 г • 22,4 л : 2 г =112 л
Ответ: V(H2)=112 л
б) 10 моль водорода?
Дано: n(H2)=10 моль
Найти: V(H2)-?
Решение
1-й способ
V(H2)=n(H2)•Vm=10 моль • 22,4 л/моль=224 л
2-й способ
Для нахождения объёма водорода составляем пропорцию и решаем её:
1 моль водорода занимает объём 22,4 л,
10 моль водорода ― объём х л
Ответ: V(H2)=224 л
Задание 11
При растворении 300 л хлороводорода (н. у.) в 1 л воды образуется раствор объёмом 1,28 л. Рассчитайте массовую долю хлороводорода в полученной соляной кислоте и плотность раствора.
у.) в 1 л воды образуется раствор объёмом 1,28 л. Рассчитайте массовую долю хлороводорода в полученной соляной кислоте и плотность раствора.
Дано: V(HCl)=300 л, V(H2O)=1 л=1000 мл, V(раствора)=1,28 л=1280 мл
Найти: ω(HCl)-?, ρ(раствора)-?
Решение
1. Вычисляем количество вещества соляной кислоты.
n(HCl)=V(HCl)/Vm=300 л : 22,4 г/л=13,4 моль
2. Вычисляем массу соляной кислоты.
m(HCl)=n(HCl)•M(HCl)=13,4 моль • 36,5 г/моль=489 г
m(H2O)=ρ(H2O)•V(H2O)=1 г/мл • 1000 мл=1000 г
4. Рассчитываем массу раствора.
m(раствора)=m(H2O)+m(HCl)=1000 г + 489 г=1489 г
5. Вычисляем массовую долю соляной кислоты в растворе.
ω(HCl)=m(HCl):m(раствора)=489 г : 1489 г=0,328%, или 32,8%
6. Вычисляем плотность раствора.
ρ(раствора)=m(раствора)/(V(раствора)=1489 г : 1280 мл=1,16 г/мл
Ответ: ω(HCl)=32,8%, ρ(раствора)=1,16 г/мл
Другие задания смотри здесь…
Кристаллогидраты.
 Задачи на кристаллогидраты | CHEMEGE.RU
Задачи на кристаллогидраты | CHEMEGE.RUКристаллогидраты — это сложные вещества, которые содержат в кристаллической решетке молекулы воды.
Многие соединения (чаще всего соли) выкристаллизовываются из водных растворов в виде кристаллогидратов.
Например, медный купорос:
CuSO4·5H2O
Кристаллогидраты растворяются в воде, при этом протекают сложные физико-химические процессы, но, если говорить про конечный результат, вещество диссоциирует, а кристаллизационная вода отделяется и попадает в раствор. Условно процесс растворения можно записать в виде уравнения:
CuSO4·5H2O → CuSO4 + 5H2O
Но в ЕГЭ по химии лучше не записывать растворение кристаллогидрата, как химическую реакцию!
Названия кристаллогидратов, которые могут встретиться в ЕГЭ по химии:
CuSO4·5H2O — медный купорос, пентагидрат сульфата меди (II)
Na2CO3 × 10H2O — кристаллическая сода, декагидрат карбоната натрия
ZnSO4 × 7H2O — цинковый купорос, гептагидрат сульфата цинка
Как решать задачи на кристаллогидраты?
Рассмотрим приемы, которые можно использовать при решении задач на кристаллогидраты, на примере.
| 1. В 300 мл воды растворили 7,6 г CuSO4·5H2O (медного купороса). Определите массовую долю CuSO4 в образовавшемся растворе. |
Для определения массы соли в составе кристаллогидрата по массе кристаллогидрата можно использовать два способа.
Первый способ.
В составе кристаллогидрата медного купороса на одну частицу кристаллогидрата приходится одна частица сульфата меди (II). На две частицы кристаллогидратов тогда приходится две частицы сульфата меди и т.д. Аналогично на 1 порцию (моль) частиц кристаллогидрата приходится 1 порция (1 моль) частиц сульфата меди (II).
То есть молярное соотношение (отношение количества вещества) кристаллогидрата CuSO4·5H2O и сульфата меди (II) равно CuSO4 1:1
n(CuSO4·5H2O):n(CuSO4) = 1:1
Или:
n(CuSO4·5H2O) = n(CuSO4)
Находим молярные массы гидрата и сульфата меди (II):
М(CuSO4·5H2O) = 64 + 32 + 64 + 5·18 = 250 г/моль
М(CuSO4) = 64 + 32 + 64 = 160 г/моль
Количество вещества кристаллогидрата:
n(CuSO4·5H2O) = m/M = 7,6/250 = 0,0304 моль
n(CuSO4) = n(CuSO4·5H2O) = 0,0304 моль
Масса сульфата меди в составе кристаллогидрата:
m(CuSO4) = M·n = 160 г/моль·0,0304 моль = 4,864 г
Второй способ.
Определим массовую долю сульфата меди в составе кристаллогидрата:
ω(CuSO4) = М(CuSO4)/М(CuSO4·5H2O) = 160 г/моль/250 г/моль = 0,64 или 64%
Тогда массу сульфата меди в образце кристаллогидрата массой 7,6 г можно определить, зная массовую долю сульфата меди:
m(CuSO4) = ω(CuSO4) · m(CuSO4·5H2O) = 0,64 · 7,6 г = 4,864 г
Масса исходной воды:
m(H2O) = ρ·V = 1 г/мл · 300 мл = 300 г
Массу раствора сульфата меди (II) находим по принципу материального баланса: складываем все материальные потоки, которые пришли в систему, вычитаем уходящие материальные потоки.
mр-ра(CuSO4) = m(CuSO4·5H2O) + m(H2O) = 7,6 г + 300 г = 307,6 г
Массовая доля сульфата меди (II) в конечном растворе:
ω(CuSO4) = m(CuSO4)/mр-ра(CuSO4) = 4,864 г/307,6 г = 0,0158 или 1,58%
Ответ: ω(CuSO4) = 0,0158 или 1,58%
2. Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? Какую массу железного купороса (FeSO4•7H2O) надо взять, чтобы приготовить 1,25 л раствора сульфата железа с массовой долей 9%, если плотность этого раствора 1,086 г/мл? |
| 3. В растворе хлорида алюминия с ω(AlCl3) = 2% растворили 100 г кристаллогидрата AlCl3·6H2O. Вычислите, какой стала массовая доля AlCl3 в полученном растворе, если объём раствора 1047 мл, а его плотность 1,07 г/мл. |
4. Вычислите массы FeSO4·7H2O (железного купороса) и воды, необходимые для приготовления 500 г раствора с массовой долей FeSO4 7%.
5. Вычислите объём воды и массу кристаллогидрата Na2SO4·10H2O (глауберовой соли), которые требуются для приготовления 500 г раствора с массовой долей Na2SO4 15%.
6. Какую массу кристаллогидрата Na2SO4·10H2O необходимо растворить в 400 мл воды, чтобы получить раствор с ω(Na2SO4) = 10%?
7. Нужно приготовить 320 г раствора с ω(CuSO4) = 12%. Рассчитайте массу кристаллогидрата CuSO4·5H2O и массу раствора с ω1(CuSO4) = 8%, которые потребуются для приготовления заданного раствора.
8. Вычислите, какую массу кристаллогидрата AlCl3·6H2O нужно растворить в 1 кг раствора хлорида алюминия с массовой долей AlCl3 2%, чтобы получить раствор с массовой долей AlCl3 3%.
9. Сколько граммов кристаллогидрата Na2SO4·10H2O необходимо добавить к 100 мл раствора сульфата натрия с массовой долей Na2SO4 8% и плотностью 1,07 г/мл, чтобы удвоить массовую долю Na2SO4 в растворе?
10. Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
Какую массу CuSO4·5H2O (медного купороса) нужно растворить в 1 кг раствора сульфата меди(II) с массовой долей CuSO4 5%, чтобы получить раствор с массовой долей CuSO4 10%?
11. Вычислите массу CuSO4·5H2O (медного купороса), необходимую для приготовления 5 л раствора с массовой долей CuSO4 8% (плотность раствора 1,084 г/мл)? Рассчитайте молярную концентрацию CuSO4 в этом растворе.
12. Массовая доля кристаллизационной воды в кристаллогидрате сульфата натрия (Na2SO4·xH2O) составляет 55,9%. Определите формулу кристаллогидрата. Вычислите массовую долю сульфата натрия в растворе, полученном при
растворении 80,5 г данного кристаллогидрата в 2 л воды.
13. К раствору сульфата железа(II) с массовой долей FeSO4 10% добавили 13,9 г кристаллогидрата этой соли. Получили раствор массой 133,9 г, с массовой долей FeSO4 14,64%. Определите формулу кристаллогидрата.
Определите формулу кристаллогидрата.
14. После растворения 13,9 г кристаллогидрата сульфата железа(II) (FeSO4·xH2O) в 86,1 г воды массовая доля FeSO4 в растворе оказалась равной 7,6%. Определите формулу кристаллогидрата.
15. При охлаждении 200 мл раствора сульфата магния с ω(MgSO4) = 24% (плотность раствора 1,270 г/мл) образовался осадок кристаллогидрата MgSO4·7H2O массой 61,5 г. Определите массовую долю MgSO4 в оставшемся
растворе.
16. При охлаждении 400 мл раствора сульфата меди(II) с массовой долей CuSO4 25% (плотность раствора 1,19 г/мл) образовался осадок кристаллогидрата CuSO4·5H2O массой 50 г. Определите массовую долю CuSO4 в оставшемся растворе.
17. При охлаждении 500 г раствора сульфата железа(II) с массовой долей FeSO4 35% выпало в осадок 150 г кристаллогидрата FeSO4·7H2O. Определите массовую долю FeSO4 в оставшемся растворе.
Определите массовую долю FeSO4 в оставшемся растворе.
18. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 8,4 г железа и после завершения реакции ещё 100 г 9,8%-ного раствора серной кислоты. Определите массовую долю соли в полученном растворе.
19. Медный купорос (CuSO4 × 5H2O) массой 100 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 32,5 г цинка и после завершения реакции ещё 560 г 40%-ного раствора гидроксида калия. Определите массовую долю гидроксида калия в полученном растворе.
20. К 20%-ному раствору соли, полученному при растворении в воде 50 г медного купороса (CuSO4 × 5H2O), добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 146 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
Определите массовую долю хлороводорода в образовавшемся растворе. (Процессами гидролиза пренебречь.)
21. Нитрид натрия массой 8,3 г растворили в 490 г 20%-ного раствора серной кислоты. К полученному раствору добавили 57,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю кислоты в конечном растворе. Учитывать образование только средних солей.
22. Медный купорос (CuSO4 × 5H2O) массой 12,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 5,6 г железа и после завершения реакции еще 117 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
23. Медный купорос (CuSO4 × 5H2O) массой 37,5 г растворили в воде и получили раствор с массовой долей соли 20%. К этому раствору добавили 11,2 г железа и после завершения реакции ещё 100 г 20%-ного раствора серной кислоты.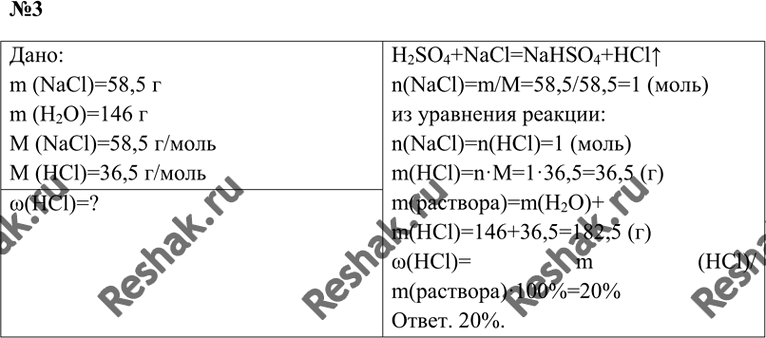 Определите массовую долю соли в полученном растворе.
Определите массовую долю соли в полученном растворе.
24. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 20%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 292 г 25%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
25. При растворении 25 г медного купороса (CuSO4 × 5H2O) в воде был получен 20%-ный раствор соли. К этому раствору добавили измельчённую смесь, образовавшуюся в результате прокаливания порошка алюминия массой 2,16 г с оксидом железа(III) массой 6,4 г. Определите массовую долю сульфата меди(II) в полученном растворе.
26. При растворении в воде 57,4 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 14,4 г магния. После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
После завершения реакции к полученной смеси прибавили 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в образовавшемся растворе. (Процессами гидролиза пренебречь.)
27. Свинцовый сахар ((CH3COO)2Pb × 3H2O) массой 37,9 г растворили в воде и получили 10%-ный раствор соли. К этому раствору добавили 7,8 г цинка и после завершения реакции добавили еще 156 г 10%-ного раствора сульфида натрия. Определите массовую долю сульфида натрия в конечном растворе.
28. Медный купорос (CuSO4 × 5H2O) массой 25 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 240 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
29. При растворении в воде 114,8 г цинкового купороса (ZnSO4 × 7H2O) получили 10%-ный раствор соли. К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
К полученному раствору добавили 12 г магния. После завершения реакции к полученной смеси прибавили 365 г 20%-ного раствора хлороводородной кислоты. Определите массовую долю кислоты в образовавшемся растворе. (Процессами гидролиза пренебречь.)
30. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 10%. К этому раствору добавили 19,5 г цинка и после завершения реакции ещё 200 г 30%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
Ответ: w(NaOH) = 3,8%
31. Медный купорос (CuSO4 × 5H2O) массой 50 г растворили в воде и получили раствор с массовой долей соли 16%. К этому раствору добавили 26 г цинка и после завершения реакции ещё 320 г 20%-ного раствора гидроксида натрия. Определите массовую долю гидроксида натрия в полученном растворе.
32. Фосфид кальция массой 18,2 г растворили в 182,5 г 20%-ного раствора соляной кислоты.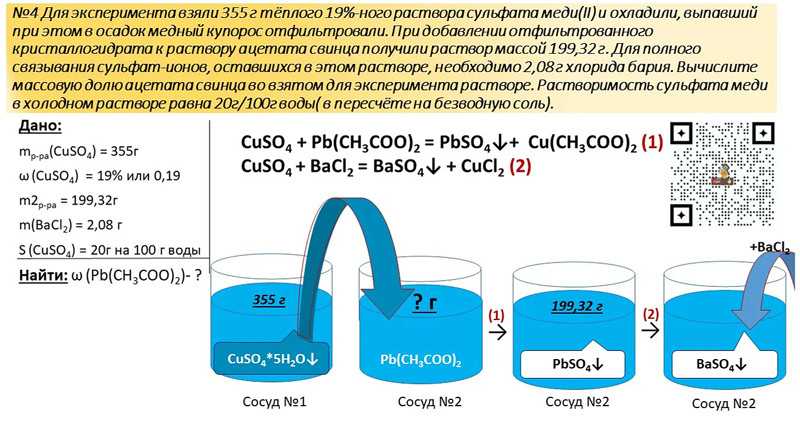 К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
К полученному раствору добавили 200,2 г кристаллической соды (Na2CO3 × 10H2O). Определите массовую долю карбоната натрия в конечном растворе.
Ответ: w(Na2CO3) = 6%
Задачи на состав и определение формулы кристаллогидратов:
- Вычислите массовую долю бария в кристаллогидрате гидроксида бария, в котором число атомов водорода в 1,8 раз больше числа атомов кислорода.
- Имеется смесь равных масс гептагидрата гидрофосфата натрия и дигидрата дигидрофосфата натрия. Сколько в это смеси приходится атомов кислорода на один атом фосфора?
- Число атомов водорода, равное числу Авогадро, содержится в 21,9 г кристаллогидрата ацетата цинка. Установите формулу кристаллогидрата.
- В некоторой порции пентагидрата сульфата меди содержится 0,25 моль воды. Вычислите массу этой порции кристаллогидрата.
- В какой массе дигидрата сульфата кальция содержится число электронов, равное числу Авогадро?
- Вычислите число атомов и число электронов 14г гептагидрата сульфата никеля (II).

- Рассчитайте массу атомов водорода, содержащихся в 143 моногидрата ацетата меди.
- В некоторой порции кристаллогидрата сульфата желез (III) число атомов кислорода в 15 раз больше числа Авогадро, а число атомов железа точно соответствует числу Авогадро. Выведите формулу кристаллогидрата.
- В 0,250 моль кристаллогидрата разница между массой кристаллизационной воды и массой беводной соли равна 59,5. Массовая доля кристаллизационной воды составляет 28,83%. Вычислите относительную молекулярную массу кристаллогидрата.
- В кристаллогидрате, образованном средней солью металла, массовая доля кристаллизационной воды равна 50,0%. Вычислите массу водорода, содержащегося в 100 г этого кристаллогидрата.
- В кристаллогидрате, образованном солью бескислородной кислоты, массовая доля соли равна 0,755. Вычислите массу кислорода, содержащегося в 1.00 г этого кристаллогидрата.
- В некоторой порции кристаллогидрата ацетата магния находится 9,632∙1023 атомов углерода и 3,371∙1024 атомов водорода.
 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. - В некоторой порции кристаллогидрата ацетата бария находится 4,816∙1023 атомов углерода и 8,428∙1023 атомов кислорода. Вычислите число атомов водорода, находящихся в этой порции кристаллогидрата.
14. В 0,250 моль дигидрата ацетата металла 2А-группы содержится 1,535∙1025 электронов. Установите, какой металл входит в состав кристаллогидрата.
Задачи на реакции с участием кристаллогидратов:
- Оксид меди (II) массой 16 г обработали 40 мл 5,0 %-го раствора серной кислоты (ρ=1,03 г/см3). Полученный раствор отфильтровали, фильтрат упарили. Определите массу полученного кристаллогидрата.
- Декагидрат карбоната натрия обработали раствором азотной кислоты массой 150 г, при этом выделилось 2,67 л углекислого газа (н.у.). Вычислите массовую долю азотной кислоты в исходном растворе.
- К сульфиду калия массой 3,30 г, находящемуся в водном растворе, добавили 0,02 моль гексагидрата хлорида меди.
 Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка. - При растворении 27,2 г смеси железа и оксида железа (II) в серной кислоте и выпаривании раствора досуха образовалось 111,2 г железного купороса — гептагидрата сульфата железа (II). Определите количественный состав исходной смеси.
- Какую массу медного купороса необходимо добавить к 150 г 12%-ного раствора гидроксида натрия, чтобы щёлочь полностью прореагировала?
- 7,5 г медного купороса (пентагидрат сульфата меди) растворили в 142,5 воды. К полученному раствору добавили 150 мл 10 %-ного раствора гидроксида калия (плотность 1,1 г/мл). Определить состав полученного раствора в массовых процентах.
- Какую массу декагидрата карбоната натрия необходимо растворить в 130 г 10%-ного раствора хлорида алюминия, чтобы полностью осадить гидроксид алюминия? Определить состав раствора (в массовых процентах) после отделения осадка.
8. В 1 л воды растворили 57,2 г кристаллической соды (декагидрат карбоната натрия). Через полученный раствор пропустили 1,12 л углекислого газа. Найти массовые доли веществ в полученном растворе.
Найти массовые доли веществ в полученном растворе.
Задачи на материальный баланс и растворы с участием кристаллогидратов:
- Медный купорос массой 12,5 г; растворили в 87,5 мл воды. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 200 г раствора сульфата меди (II) с массовой долей соли 4% растворили 50 г медного купороса. Вычислите массовую долю (в %) сульфата меди (II) в полученном растворе.
- В 5 л воды растворили дигидрат хлорида бария массой 250 г. Вычислите массовую долю (в %) безводной соли в полученном растворе.
- В 135,6 г воды растворили глауберову соль массой 64,4 г. Рассчитайте массовую долю (в %) безводной соли в полученном растворе.
- Необходимо приготовить 2 л 0,1 М водного раствора сульфата меди (II). Какая масса медного купороса потребуется для этого?
- Выпарили досуха 0,5 л 15-процентного раствора сульфата натрия (плотность 1,14 г/см3). Вычислите массу полученных кристаллов, учитывая, что соль выделяется в виде кристаллогидрата — декагидрата сульфата натрия.

- До какого объема надо разбавить 500 мл 20-процентного раствора хлорида натрия (плотность 1,152 г/мл), чтобы получить 4,5-процентный раствор плотностью 1,029 г/мл?
- Смешали 500 мл 32 — процентного раствора азотной кислоты плотностью 1,2 г/мл и один литр воды. Вычислите массовую долю (в %) азотной кислоты в полученном растворе.
- Рассчитайте объем 25% раствора сульфата цинка (плотность 1,3 г/мл), который необходимо разбавить водой для получения 0,5 М раствора этой соли объемом 4л.
- Декагидрат карбоната натрия массой 0,05 кг растворили в воде объемом 0,15 л. Вычислите массовую долю безводной соли в полученном растворе.
- В воде объемом 0,157 м3 растворили медный купорос массой 43 кг. Вычислите массовую долю безводной соли в полученном растворе.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Массовая доля безводной соли в кристаллогидрате равна 64%. Какую массу кристаллогидрата нужно взять для приготовления 150 г 50%-го раствора соли?
- В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- В каком объеме воды следует растворить 0,3 моль пентагидрата сульфата меди (II) для получения 12%-го раствора?
- Рассчитайте, сколько г FeSO4×7H2O и воды потребуется для приготовления 200 мл 18 мас % раствора сульфата железа (II) с плотностью 1,19 г/мл.

- Кристаллогидрат фосфата натрия Nа3РО4×12Н2О количеством вещества 1 моль растворили в 75 моль воды. Плотность получившегося раствора оказалась равной 1,098 г/мл. Вычислите молярную концентрацию ионов натрия в этом растворе.
- В 225 г 25,5%-го раствора бромида кальция растворили гексагидрат бромида кальция массой 50,0 г. Вычислите массовые доли веществ в получившемся растворе.
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- К 2% раствору хлорида алюминия добавили 100 г кристаллогидрата АlСl3∙6Н2О.
 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. - Сколько граммов кристаллогидрата СuSО4∙5Н2О и какой объем раствора сульфата меди, содержащего 5 мас.% СuSО4 и имеющего плотность 1,045 г/мл, надо взять для приготовления 400 мл раствора сульфата меди, содержащего 7 мас.% СuSО4 и имеющего плотность 1,06 г/см3?
- Сколько граммов кристаллогидрата Nа2СО3∙10 Н2О надо добавить к 400 мл раствора карбоната натрия, содержащего 5 мас.% Na2СО3 и имеющего плотность 1,05 г/см , чтобы получить 16 мас.% раствор, плотность которого 1,17 г/см ?
- Какой объем 5% раствора сульфата натрия надо взять, чтобы растворение в нем 150 г кристаллогидрата Nа2SO4∙10Н2О привело к образованию 14% раствора? Плотности растворов Nа2SО4 равны, соответственно, 1,044 и 1,131 г/мл.
- Алюмокалиевые квасцы КАl(SО4)2∙12Н2О количеством вещества 10 ммоль растворили в 10 моль воды.
 Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе. - В каком количестве вещества воды следует растворить 100 г декагидрата карбоната натрия для получения раствора с массовой долей соли, равной 10,0%?
- Из какой массы 25,0%-го раствора карбоната натрия выпало при охлаждении 10 г декагидрата, если в результате этого массовая доля соли в растворе уменьшилась в два раза?
- Из 500 г 15,0%-го раствора сульфита натрия при охлаждении выпало 25,2 г гептагидрата сульфита натрия. Рассчитайте массовую долю соли в полученном растворе.
- Из 250 г 17,0%-го раствора карбоната натрия при охлаждении выпало 28,6 г декагидрата карбоната натрия. Рассчитайте массовую долю соли в полученном растворе.
- В 20,0 г 5,00%-го раствора гидроксида натрия растворили 4 г тетрагидрата гидроксида натрия, при этом плотность полученного раствора стала равной 1,11 г/мл. Вычислите молярную концентрацию полученного раствора.
- Какую массу дигидрата фторида калия можно получить из 450 г 25,0%-го раствора фторида калия?
- Какую массу кристаллогидрата сульфата хрома (III), кристаллизующегося с 18 молекулами воды, можно получить из 80 мл раствора с концентрацией сульфата хрома 0,8 моль/л?
Понравилось это:
Нравится Загрузка. ..
..
9.6: Сочетание стехиометрии и законов идеального газа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 79589
- Пол Р. Янг
- Университет Иллинойса в Чикаго via ChemistryOnline.com
С пониманием законов идеального газа теперь можно применить эти принципы к задачам химической стехиометрии. Например, металлический цинк и соляная кислота (хлорид водорода, растворенный в воде) реагируют с образованием хлорида цинка (II) и газообразного водорода в соответствии с приведенным ниже уравнением:
2 HCl (водн.) + Zn (т) → ZnCl 2 (водн.) + H 2 (г)
Пример \(\PageIndex{1}\):
Образец чистого цинка массой 5,98 г вводят в реакцию с избытком соляной кислоты и собирают (сухой) газообразный водород при 25,0 °C и 742 мм рт. ст. Какой объем газообразного водорода будет произведен?
ст. Какой объем газообразного водорода будет произведен?
Решение
Это задача «одного состояния», поэтому мы можем решить ее, используя закон идеального газа, PV = nRT . Чтобы найти объем газообразного водорода ( V ), нам нужно знать количество молей водорода, которое будет получено в результате реакции. Наша стехиометрия просто один моль водорода на моль цинка , поэтому нам нужно знать количество молей цинка, которые присутствуют в 5,98 граммах металлического цинка. Температура дана в градусах Цельсия, поэтому нам нужно преобразовать в кельвины, а также нам нужно преобразовать мм ртутного столба в атм.
Преобразования :
\[25.0\; С+273=298\; K \номер\]
\[(742\; мм\; рт.ст.)\times \left ( \frac{1\; atm}{760\; мм\; рт.ст.} \right )=0,976\; атм \номер \]
\[(5,98\; г\; Zn)\раз \влево ( \фрак{1,00\; моль}{65,39{-1})(298\; К)}{(0,976\; атм)}=2,29\; L \nonumber \]
Мы также можем использовать тот факт, что один моль газа занимает 22,414 л при СТП, чтобы рассчитать количество молей газа, образующегося в результате реакции. Например, органическая молекула этана (CH 3 CH 3 ) реагирует с кислородом с образованием углекислого газа и воды в соответствии с приведенным ниже уравнением:
Например, органическая молекула этана (CH 3 CH 3 ) реагирует с кислородом с образованием углекислого газа и воды в соответствии с приведенным ниже уравнением:
2 CH 3 CH 3 (г) + 7 O 2 (г) → 4 CO 2 (г) + 6 Н 2 О (г)
Пример \(\PageIndex{1}\):
Неизвестная масса этана подвергается реакции с избытком кислорода, а образовавшийся диоксид углерода отделяется и собирается. Собранный диоксид углерода занимает 11,23 л при нормальных условиях; какая масса этана была в исходной пробе?
Решение
Поскольку объем диоксида углерода измеряется при стандартных нормальных условиях, наблюдаемое значение может быть непосредственно преобразовано в моль диоксида углерода путем деления на 22,414 л моль –1 . Как только известны моли диоксида углерода, стехиометрия задачи может быть использована для непосредственного получения молей этана (молярная масса 30,07 г моль -1 ), что приводит непосредственно к массе этана в образце.
\[(11,23\; L\; CO_{2})\times \left ( \frac{1\; моль}{22,414\; L} \right )=0,501\; моль\; CO_{2} \номер\]
Стехиометрия реакции :
\[(0,501\; моль\; CO_{2})\times \left ( \frac{2\; моль\; CH_{3}CH_ {3}}{4\; моль\; CO_{2}} \справа )=0,250\; моль\; CH_{3}CH_{3} \номер\]
Законы идеального газа позволяют проводить количественный анализ всего спектра химических реакций. Когда вы подходите к этим проблемам, не забудьте сначала решить класс проблемы:
- Если это проблема «одного состояния» (газ производится при одном заданном наборе условий), то вы хотите использовать PV = nRT.
- Если это проблема «двух состояний» (газ меняется с одного набора условий на другой), вы хотите использовать \[\frac{P_{1}V_{1}}{n_{1}T_{1} }=\frac{P_{2}V_{2}}{n_{2}T_{2}} \nonumber \]
- Если объем газа указан в нормальных нормальных условиях, вы можете быстро преобразовать этот объем в моли с помощью деления на 22,414 л моль -1 .

После того, как вы изолировали свой подход, проблемы закона идеального газа не более сложны, чем проблемы стехиометрии, которые мы рассматривали в предыдущих главах.
Упражнение \(\PageIndex{1}\)
- Для надувания автомобильной подушки безопасности требуется около 62 л газообразного азота. Газообразный азот образуется при разложении азида натрия в соответствии с приведенным ниже уравнением 9.0010
2 NaN 3 (т) → 2 Na (т) + 3 N 2 (г)
Какой объем азида азота необходим для получения необходимого объема азида натрия 25 ˚C и 1 атм?
- При нагревании Fe 2 O 3 в присутствии углерода образуется газ CO 2 в соответствии с приведенным ниже уравнением. Образец 96,9 г Fe 2 O 3 нагревают в присутствии избытка углерода и CO 9Произведенный 0039 2 собирается и измеряется при 1 атм и 453 К.
 Какой объем CO 2 будет наблюдаться?
Какой объем CO 2 будет наблюдаться?
2 Fe 2 O 3 (s) + 3 C (s) → 4 Fe (s) + 3 CO 2 (g)
- The reaction цинка и соляной кислоты образует газообразный водород в соответствии с приведенным ниже уравнением. Наблюдается, что неизвестное количество цинка в образце
производит 7,50 л газообразного водорода при температуре 404 К и давлении 1,75 атм. Сколько молей цинка было в образце?
Zn (S) + 2 HCL (AQ) → ZnCl 2 (AQ) + H 2 (G)
. Законы об идеальных газах распространяются под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором является Пол Р. Янг (ChemistryOnline.com) с помощью исходного контента, отредактированного в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Пол Р. Янг
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- идеальный газ
- закон идеального газа
- Законы идеального газа
- источник@https://en.
 wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online - стехиометрия
- СТП
ChemTeam: Задачи на молярность #11–25
Задача №11: Какой объем (в мл) 12,0 М HCl необходим для содержания 3,00 молей HCl?
Задача №12: Сколько граммов Ca(OH) 2 необходимо для приготовления 100,0 мл 0,250 М раствора?
Задача № 13: Какова молярность раствора, полученного путем растворения 20,0 г H 3 PO 4 в 50,0 мл раствора?
Задача №14: Какой вес (в граммах) KCl содержится в 2,50 л 0,500 М раствора KCl?
Задача №15: Какова молярность раствора, содержащего 12,0 г NaOH в 250,0 мл раствора?
(x) (0,2500 л) = 12,0 г / 39,9969 г моль¯ 1Задача № 16: Определите молярность этих растворов:
а) 4,67 моль Li 2 SO 3 растворяют, чтобы получить 2,04 литра раствора.
b) 0,629 моль Al 2 O 3 для приготовления 1,500 литров раствора.
c) 4,783 г Na 2 CO 3 для приготовления 10,00 литров раствора.
d) 0,897 г (NH 4 ) 2 CO 3 для приготовления 250 мл раствора.
e) 0,0348 г PbCl 2 для получения 45,0 мл раствора.
Наборы растворов:
а) х = 4,67 моль/2,04 л
b) x = 0,629 моль/1,500 л
c) (x) (10,00 л) = 4,783 г/106,0 г моль¯ 1
d) (x) (0,250 л) = 0,897 г/96,09 г моль¯ 1
e) (x) (0,0450 л) = 0,0348 г / 278,1 г моль¯ 1
Задача № 17: Определите количество молей растворенного вещества для приготовления следующих растворов:
а) 2,35 л 2,00 М раствора Cu(NO 3 ) 2 .
б) 16,00 мл 0,415-молярного раствора Pb(NO 3 ) 2 .
c) 3,00 л 0,500 М раствора MgCO 3 .
г) 6,20 л 3,76-молярного раствора Na 2 O.
Наборы растворов:
a) x = (2,00 моль л¯ 1 ) (2,35 л)
б) x = (0,415 моль л¯ 1 ) (0,01600 л)
в) x = (0,500 моль л¯ 1 ) ( 3,00 л)
d) x = (3,76 моль л¯ 1 ) (6,20 л)
Комментарий: используется следующая техника:
МВ = моли растворенного вещества
Этот конкретный вариант уравнения молярности довольно часто встречается в определенных частях кислотно-основной единицы.
Задача № 18: Определите количество граммов растворенного вещества для приготовления следующих растворов:
а) 0,289 л 0,00300 М раствора Cu(NO 3 ) 2 .
b) 16,00 мл 5,90-молярного раствора Pb(NO 3 ) 2 .
в) 508 мл 2,75-молярного раствора NaF.
г) 6,20 л 3,76-молярного раствора Na 2 O.
д) 0,500 л 1,00 М раствора KCl.
f) 4,35 л 3,50 М раствора CaCl 2 .
Настройки решения:
а) (0,00300 моль л¯ 1 ) (0,289 л) = x / 187,56 г моль¯ 1
б) (5,90 моль л¯ 1 ) (0,01600 л) = x / 331,2 1 1 1 моль¯
c) (2,75 моль л¯ 1 ) (0,508 л) = x / 41,99 г моль¯ 1
d) (3,76 моль л¯ 1 ) (6,20 л) = x / 61,9 моль¯8 1
e) (1,00 моль л¯ 1 ) (0,500 л) = x / 74,55 г моль¯ 1
f) (3,50 моль л¯ 1 ) (4,31 л) = x 9,99 г моль¯ 1
Задача №19: Определите конечный объем этих растворов:
а) 4,67 моль Li 2 SO 3 растворяют с получением 3,89 М раствора.
b) 4,907 моль Al 2 O 3 для получения 0,500 М раствора.
c) 0,783 г Na 2 CO 3 для получения 0,348 М раствора.
d) 8,97 г (NH 4 ) 2 CO 3 для получения 0,250-молярного раствора.
e) 48,00 г PbCl 2 для образования 5,0-молярного раствора.
Наборы растворов:
а) х = 4,67 моль/3,89 моль л¯ 1
б) х = 4,907 моль/0,500 моль л¯ 1
в) (0,348 моль л¯ 1 ) (х) = 0,1083 г/9 моль¯ 1
d) (0,250 моль л¯ 1 ) (x) = 8,97 г / 96,01 г моль¯ 1
e) (5,00 моль л¯ 1 4 ) (x) 278,1 г моль¯ 1
Задача № 20: Учащийся поместил 11,0 г глюкозы (C 6 H 12 O 6 ) в мерную колбу, добавил достаточное количество воды, чтобы растворить глюкозу путем завихрения, затем осторожно добавил дополнительную воду до тех пор, пока Достигнута отметка 100 мл на горлышке колбы. Затем колбу встряхивали, пока раствор не стал однородным. Образец этого раствора глюкозы объемом 20,0 мл разбавляли до 0,500 л. Сколько граммов глюкозы содержится в 100 мл конечного раствора?
Путь решения №1:
1) Рассчитайте молярность первого раствора (полученного растворением 11,0 г глюкозы):
MV = граммы / молярная масса(х) (0,100 л) = 11,0 г / 180,155 г/моль
x = 0,610585 моль/л (я добавлю несколько цифр).
2) Рассчитайте молярность второго раствора (полученного разбавлением первого раствора):
M 1 V 1 = M 2 V 2(0,0200 л) (0,610585 моль/л) = (0,500 л) (x)
х = 0,0244234 моль/л
3) Определить граммы глюкозы в 100 мл второго раствора:
MV = граммы / молярная масса(0,0244234 моль/л) (0,100 л) = x / 180,155 г/моль
х = 0,44 г
Путь решения №2:
1) Рассчитайте, сколько глюкозы содержится в 20,0 мл первого раствора.
11,0 г соответствует 100,0 мл, поскольку x соответствует 20,0 мл.2) Когда вы разбавляете образец объемом 20,0 мл до 500,0 мл, в растворе содержится 2,2 г глюкозы.Перемножить и разделить
100x = 11,0 умножить на 20,0
х = 2,2 г
2,2 г соответствует 500 мл, как x соответствует 100 млПеремножить и разделить
500х = 2,2 умножить на 100
х = 0,44 г
В 100 мл готового раствора содержится 0,44 г глюкозы.
Проблема №21: Коммерческий отбеливатель содержит 5,25% (по массе) NaClO в воде. Он имеет плотность 1,08 г/мл. Рассчитайте молярность этого раствора. (Подсказка: предположим, что у вас есть 1,00 л раствора; молярная масса NaClO 74,4 г/моль)
Решение:
1) Определить массу 1,00 л раствора:
(1,08 г/мл) (1000 мл) = 1080 г
2) Определите массу NaClO в 1080 г раствора:
(1080 г) (0,0525) = 56,7 г
3) Определить количество молей NaClO:
56,7 г / 74,4 г/моль = 0,762 моль
4) Определите молярность раствора:
0,762 моль/1,00 л = 0,762 М
Задача № 22: Какова моляльность (и молярность) 20,0% по массе раствора соляной кислоты? Плотность раствора 1,0980 г/мл.
Решение: 1) Определить моль HCl в 100,0 г 20,0% раствора.
20,0 % по массе означает 20,0 г HCl в 100,0 г раствора.2) Определить моляльность:20,0 г / 36,4609 г/моль = 0,548 моль
0,548 моль/0,100 кг = 5,48 м3) Определить объем 100,0 г раствора.
100,0 г / 1,0980 г/мл = 91,07468 мл4) Определяем молярность:
0,548 моль/0,09107468 л = 6,02 м
Задача №23: 25,0 мл 0,250 М KI, 25,0 мл 0,100 К 2 SO 4 и 15,0 мл 0,100 М MgCl 2 смешивали вместе в химическом стакане. Каковы молярные концентрации I¯, Cl¯ и K + в стакане?
Решение:
1) Рассчитайте общий объем смешанных растворов:
25,0 мл + 25,0 мл + 15,0 мл = 65,0 мл
2) Концентрация йодид-иона:
M 1 V 1 = M 2 V 2(0,250 моль/л) (25,0 мл) = (x) (65,0 мл)
х = 0,09615 М
до трех знаков инжира, 0,0962 M
3) Концентрация иона хлорида:
моль Cl¯ —> (0,100 моль/л) (0,0150 л) (2 Cl¯ / 1 MgCl 2 ) = 0,00300 моль0,00300 моль/0,065 л = 0,04615 М
до трех знаков инжира, 0,0462 M
4) Концентрация иона калия:
моль K + из KI —> (0,250 моль/л) (0,0250 л) = 0,00625 моль
молей K + из K 2 SO 4 —> (0,100 моль/л) (0,0250 л) (2 K + / 1 K 2 SO 4 ) = 0,00500 моль0,00625 моль + 0,00500 моль = 0,01125 моль
0,01125 моль/0,0650 л = 0,173 М
Задача № 24: Рассчитайте общую концентрацию всех ионов в каждом из следующих растворов:
а.3,25 М NaCl
б. 1,75 М Ca(BrO 3 ) 2
в. 12,1 г (NH 4 ) 2 SO 3 в 615 мл в растворе.
Решение:
1) раствор натрия хлорида:
на каждый растворенный NaCl образуются два иона (один Na + и один Cl¯).общая концентрация всех ионов такова:
(3,25 моль/л) умножить на (2 общих иона / 1 формульную единицу NaCl) = 6,50 М
2) раствор бромата кальция:
всего три иона образуется на каждый один Ca(BrO 3 ) 2 растворяется (один Ca 2+ и два BrO 3 ¯общая концентрация всех ионов такова:
(1,75 моль/л) умножить на (3 суммарных иона / 1 Ca(BrO 3 ) 2 формульная единица) = 5,25 M
3) раствор сульфита аммония:
расчет концентрации (NH 4 ) 2 SO 3 :(x) (0,615 л) = 12,1 г / 116,1392 г/моль
х = 0,169407 М рассчитать концентрацию всех ионов:
(NH 4 ) 2 SO 3 производит три иона на каждую растворяющуюся формульную единицу.


 Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата.
Вычислите число атомов кислорода, находящихся в этой порции кристаллогидрата. Вычислите массу образовавшегося осадка.
Вычислите массу образовавшегося осадка.

 Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл.
Найдите концентрацию полученного раствора, объем которого составил 1047 мл, а плотность 1,07 г/мл. Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
Вычислите массовые доли сульфата калия и сульфата алюминия в образовавшемся растворе.
 Какой объем CO 2 будет наблюдаться?
Какой объем CO 2 будет наблюдаться? wikibooks.org/wiki/Introductory_Chemistry_Online
wikibooks.org/wiki/Introductory_Chemistry_Online






 3,25 М NaCl
3,25 М NaCl 
Leave A Comment