Тренажер по ЕГЭ (химия) 26 задание (10-11 класс)
26.1 Смешали 80 г раствора с массовой долей нитрата натрия 25% и 20 г раствора этой же соли с массовой долей 40%. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
26.2 Вычислите массу нитрата калия, который следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ дайте в граммах точностью до десятых.
26.3 Вычислите массовую долю соли в растворе, полученном при смешивании 1 кг 11%-ного раствора с 3 кг 15%-го раствора соли. Ответ дайте в процентах с точностью до целых.
26.4 Смешали 200 г 11%-го раствора нашатыря и 350 г 17%-го раствора этой же соли. Вычислите массовую долю нашатыря в полученном растворе. Ответ укажите в процентах с точностью до десятых.
26.5 Упариванием 500 г
раствора с массовой долей соли 10% получен раствор с массовой долей соли 14%.
26.7 Вычислите массу едкого натра, который следует растворить в 300 г 5%-го раствора для
получения 10%-ного раствора Ответ укажите в граммах с точностью до десятых.
26.8 К 250 г 10%-го раствора нитрата натрия добавили 10 г этой же соли и 50 мл воды. Вычислите массовую долю нитрата натрия в полученном растворе. Ответ дайте в процентах с точностью до десятых.
26.9 К 200 г 5%-го раствора хлорида аммония добавили 15 г этой же соли и столько же граммов воды. Вычислите массовую долю хлорида аммония в полученном растворе. Ответ дайте в процентах с точностью до целых.
26.10 К 250 г 20%-й серной кислоты добавили 50 мл 60%-й кислоты (плотностью 1,6 г/мл). Вычислите массовую долю кислоты в полученном растворе. Ответ дайте в процентах с точностью до целых.
26.11 Вычислите массу
уксусной кислоты в растворе, полученном при смешивании 155 г 5%-го и 207 г
11%-го растворов кислоты. Ответ дайте в граммах с точностью до десятых.
Ответ дайте в граммах с точностью до десятых.
26.12 Вычислите массу воды, которую следует добавить к 300 г 22%-го раствора уксусной кислоты, чтобы получить 9%-й раствор. Ответ дайте в граммах с точностью до целых.
26.13 При упаривании 300 г 5%-го раствора сахарозы получены 245 г раствора. Вычислите массовую долю сахарозы в нём.
26.14 К 400 г 10%-го раствора соли добавили 50 г этой же соли. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до целых.
26.15 Из 400 г горячего 50%-го раствора соли при охлаждении выпало 80 г кристаллов соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до десятых.
26.17 Вычислите массу
карбоната калия, который надо прибавить к 100 г 16%-го раствора, чтобы
получить 30%-й раствор. Ответ представьте в граммах с точностью до
целых.
26.18 Вычислите массу гидроксида калия, который надо прибавить к 40 г 10%-го раствора, чтобы получить 40%-й раствор. Ответ дайте в граммах с точностью до целых.
26.19 Вычислите массу воды, которую нужно добавить к 50 г 20%-го раствора соляной кислоты, чтобы уменьшить её концентрацию до 10%. Ответ укажите в граммах с точностью до целых.
26.20 Вычислите массу воды, которую нужно добавить к 30 г 20%-го раствора гидроксида натрия, чтобы понизить его концентрацию до 15%.
26.21 Вычислите массу воды, которую нужно испарить из 500 г 10%-го раствора гидроксида натрия, чтобы увеличить его концентрацию в 1,5 раза. Ответ укажите в граммах с точностью до целых.
26.22 Вычислите массу воды, которую нужно испарить из 300 г 15%-го раствора гидроксида калия, чтобы увеличить его концентрацию в два раза. Ответ укажите в граммах с точностью до целых.
26. 23 Вычислите массу
соли, которую нужно добавить к 50 г 20%-го раствора, чтобы увеличить её
концентрацию в два раза.
23 Вычислите массу
соли, которую нужно добавить к 50 г 20%-го раствора, чтобы увеличить её
концентрацию в два раза.
26.24 К 300 г 10%-го раствора гидроксида натрия добавили 60 г чистого гидроксида натрия. Вычислите массовую долю растворённого вещества в полученном растворе. Ответ укажите в процентах с точностью до целых.
26.25 К 200 г 10%-го раствора гидроксида калия добавили 25 г чистого гидроксида калия. Вычислите массовую долю растворённого вещества в полученном растворе. Ответ укажите в процентах с точностью до целых.
26.26 Вычислите массу твёрдого нитрата аммония, который надо добавить к 210 г воды, чтобы получить 16%-й раствор соли. Ответ укажите в граммах с точностью до целых.
26.27 Вычислите массу твёрдого гидроксида калия, который надо добавить к 120 г воды, чтобы получить 20%-й раствор щёлочи.
26. 28 К 240 г раствора
с массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в
полученном растворе. Ответ дайте в процентах с точностью до целых.
28 К 240 г раствора
с массовой долей соли 10% добавили 160 мл воды. Вычислите массовую долю соли в
полученном растворе. Ответ дайте в процентах с точностью до целых.
26.29 При выпаривании 25%-го водного раствора получено 60 г сухого вещества. Вычислите массу испарившейся воды. Ответ дайте в граммах с точностью до целых.
26.30 При выпаривании 20%-го водного раствора получено 36 г сухого вещества. Вычислите массу испарившейся воды.
26.31 Вычислите массу гидроксида калия, который необходимо растворить в 150 г воды для получения раствора с массовой долей щёлочи 25%. Ответ дайте в граммах с точностью до целых.
26.32 Растворяя соль в горячей воде, приготовили 300 г 40%-го раствора. При охлаждении раствора из него выпало 50 г осадка безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до целых.
26. 33 Вычислите массу
15%-го раствора вещества, который можно получить разбавлением 200 г 36%-го
раствора.
33 Вычислите массу
15%-го раствора вещества, который можно получить разбавлением 200 г 36%-го
раствора.
26.34 Растворяя соль в горячей воде, приготовили 200 г 55%-го раствора. При охлаждении раствора из него выпало 50 г осадка безводной соли. Вычислите массовую долю соли в растворе над осадком. Ответ дайте в процентах с точностью до целых.
26.35 Разбавлением 25%-го раствора вещества получили 350 г 10%-го раствора. Вычислите массу 25%-го раствора. Ответ дайте в граммах с точностью до целых.
26.36 Сколько граммов 25%-го раствора вещества надо добавить к 270 г 5%-го раствора, чтобы получить 10%-й раствор? Запишите число с точностью до целых.
26.37 Вычислите массу 5%-го раствора вещества, который надо добавить к 120 г 30%-го раствора, чтобы получить 15%-й раствор. Ответ дайте в граммах с точностью до целых.
26.38 Вычислите массу
воды, которую надо добавить к 200 г 36%-й соляной кислоты, чтобы получить
20%-ю кислоту. Ответ дайте в граммах с точностью до целых.
Ответ дайте в граммах с точностью до целых.
26.39 Вычислите массу воды, которую надо добавить к 200 г 63%-й азотной кислоты, чтобы получить 15%-ю кислоту. Ответ дайте в граммах с точностью до целых.
26.40 В 100 г 5%-го раствора хлорида натрия растворили ещё 25 г этого вещества. Чему равна массовая доля хлорида натрия в новом растворе?
26.41 В 200 г 10%-го раствора гидроксида калия растворили ещё 25 г этого вещества. Чему равна массовая доля гидроксида калия в новом растворе? Ответ выразите в процентах в виде целого числа.
26.42 Сколько граммов 98%-ой серной кислоты надо добавить к 300 г воды, чтобы получить 10%-ый раствор кислоты? Ответ округлите до ближайшего целого числа.
26.43 Сколько граммов
68%-ой азотной кислоты надо добавить к 400 г воды, чтобы получить 10%-ый
раствор кислоты? Ответ округлите до ближайшего целого числа.
26.44 К 75 г раствора с массовой долей соли 14% добавили 10 г той же соли и 10 мл воды. Вычислите массовую долю соли в полученном растворе. Ответ дайте в процентах с точностью до десятых.
26.45 При охлаждении 400 г горячего 50%-го раствора нитрата калия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка, если раствор над осадком содержал 34% нитрата калия по массе? Ответ дайте в граммах и округлите до ближайшего целого числа.
26.46 При охлаждении 100 г горячего 55%-го раствора нитрата натрия выпал осадок, не содержащий кристаллизационной воды. Чему равна масса осадка, если раствор над осадком содержал 47% нитрата натрия по массе?
26.47 Сколько граммов 40%-го раствора гидроксида калия надо смешать с 200 г 10%-го раствора этого вещества, чтобы получить 15%-й раствор? Ответ выразите в виде целого числа.
26. 48 Сколько граммов
65%-го раствора азотной кислоты надо смешать с 270 г 10%-го раствора этого
вещества, чтобы получить 20%-й раствор? Ответ выразите в виде целого
числа.
48 Сколько граммов
65%-го раствора азотной кислоты надо смешать с 270 г 10%-го раствора этого
вещества, чтобы получить 20%-й раствор? Ответ выразите в виде целого
числа.
26.49 При разбавлении 35%-й соляной кислоты получили 210 г 10%-й кислоты. Сколько граммов 35%-го раствора было взято? Ответ выразите в виде целого числа.
26.50 При разбавлении 25%-го раствора аммиака получили 300 г 10%-го раствора. Сколько граммов 25%-го раствора было взято? Ответ выразите в виде целого числа.
26.51 200 г горячего 30%-го раствора соли охладили до комнатной температуры. Сколько граммов соли выпадет в осадок, если насыщенный при комнатной температуре раствор содержит 20% соли по массе? Осадок представляет собой безводную соль. Ответ запишите с точностью до целых.
26.52 Насыщенный
раствор содержит 30% соли по массе. Сколько граммов соли нужно растворить в
350 г 20%-го раствора для получения насыщенного раствора? Ответ
выразите в виде целого числа.
26.53 Имеется 120 г 24%-го раствора вещества. Из него надо получить 16%-й раствор. Сколько граммов воды требуется добавить? Ответ округлите до ближайшего целого числа.
26.54 Имеется 140 г 24%-го раствора вещества. Из него надо получить 30%-й раствор. Сколько граммов чистого вещества требуется добавить? Ответ округлите до ближайшего целого числа.
26.55 Сколько граммов чистого вещества надо добавить к 100 г его 20%-го раствора, чтобы получить 36%-й раствор? Ответ представьте в виде целого числа.
26.56 30 граммов чистого вещества добавили к 10%-му раствору этого вещества и получили 16%-й раствор. Сколько граммов 10%-го раствора было взято? Ответ представьте в виде целого числа.
26.57 Горячий раствор
нитрата калия охладили, при этом выпало 20 г осадка (безводной соли) и
образовалось 180 г 24%-го раствора. Чему была равна массовая доля нитрата
калия в горячем растворе? Ответ дайте в процентах и округлите до
десятых.
26.58 Горячий раствор нитрата натрия охладили, при этом выпало 30 г осадка (безводной соли) и образовалось 270 г 48%-го раствора. Чему была равна массовая доля нитрата натрия в горячем растворе? Ответ дайте в процентах и округлите до десятых.
26.59 В 81 г воды растворили 9 г сульфата натрия. Вычислите массовую долю вещества в полученном растворе. Ответ дайте в процентах с точностью до целых.
26.60 К 250 г 12%-го раствора гидроксида калия добавили твердый и после перемешивания получили 20%-й раствор. Сколько граммов твердой щёлочи добавили? Ответ выразите в виде целого числа.
26.61 К 300 г 15%-го раствора хлорида калия добавили твёрдый и после перемешивания получили 25%-й раствор. Сколько граммов твёрдой соли добавили? Ответ выразите в виде целого числа.
26.62 Найдите массу
воды, которую необходимо добавить к 130 г 20%-го раствора соли, чтобы получить
13%-й раствор. Запишите число с точностью до целых.
26.63 Сколько граммов нитрата серебра надо добавить к 130 г 2,0%-го раствора этой соли, чтобы получить 5,0%-й раствор? Ответ запишите с точностью до десятых.
26.64 Сколько граммов карбоната калия надо добавить к 200 г 15%-го раствора этой соли, чтобы получить 20%-й раствор? Ответ запишите с точностью до десятых.
26.65 Сколько граммов 98%-го раствора серной кислоты надо добавить к 468 г воды, чтобы получить 20%-й раствор? Ответ округлите до ближайшего целого числа.
26.66 Сколько граммов 63%-го раствора азотной кислоты надо добавить к 244 г воды, чтобы получить 10%-й раствор? Ответ округлите до ближайшего целого числа.
26.67 В 200 г воды растворили 10 г медного купороса (пятиводного сульфата меди). Чему равна массовая доля сульфата меди в полученном растворе? Ответ дайте в процентах и округлите до ближайшего целого числа.
26.68 В 200 г воды
растворили 85,8 г кристаллической соды (десятиводного карбоната натрия). Чему
равна массовая доля карбоната натрия в полученном растворе? Ответ дайте
в процентах и округлите до ближайшего целого числа.
Чему
равна массовая доля карбоната натрия в полученном растворе? Ответ дайте
в процентах и округлите до ближайшего целого числа.
26.69 Какую массу 17%-го раствора хлорида меди(II) надо взять, чтобы при добавлении 15 г воды получить раствор с массовой долей соли 10%? Запишите число с точностью до десятых.
26.70 Какую массу 17%-го раствора хлорида аммония надо взять, чтобы при добавлении 10 г воды получить раствор с массовой долей соли 7%? Запишите число с точностью до целых.
26.71 Сколько граммов десятиводного кристаллогидрата потребуется для приготовления 300 г 5,3%-го раствора карбоната натрия? Ответ приведите с точностью до десятых.
26.72 Сколько граммов семиводного кристаллогидрата потребуется для приготовления 200 г 12%-го раствора сульфата магния? Ответ приведите с точностью до десятых.
26.73 Раствор массой
120 г, содержащий 17,0% растворенной соли, оставили на некоторое время на
открытом воздухе. За это время его масса уменьшилась на 16 г. Чему равна
массовая доля соли в новом растворе? Ответ дайте в процентах и
округлите до десятых.
За это время его масса уменьшилась на 16 г. Чему равна
массовая доля соли в новом растворе? Ответ дайте в процентах и
округлите до десятых.
26.74 Раствор массой 220 г, содержащий 21,0% растворенной соли, упарили на водяной бане, в результате его масса уменьшилась на 45 г. Чему равна массовая доля соли в новом растворе? Ответ дайте в процентах и округлите до десятых.
26.75 Какую массу 5%-го раствора хлорида меди(II) надо взять, чтобы при выпаривании 10 г воды получить раствор с массовой долей 7%. Ответ укажите в граммах с точностью до целых.
26.76 Определите массу 14%-го раствора соли, при добавлении к которому 10 г воды образуется раствор с массовой долей 8%. Ответ укажите в граммах с точностью до десятых.
26.77 Массовая доля
хлорида натрия в насыщенном растворе при 20 °С равна 26,5 %. Сколько граммов
хлорида натрия надо растворить в 200 г воды, чтобы получить насыщенный
раствор? Ответ дайте в граммах и запишите с точностью до целых.
26.78 Массовая доля нитрата серебра в насыщенном растворе при 25 °С равна 71,4 %. Сколько граммов нитрата серебра надо растворить в 20 г воды, чтобы получить насыщенный раствор? Ответ дайте в граммах и запишите с точностью до целых.
26.79 Массовая доля бромида калия в насыщенном растворе при 20 °С равна 39,5 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 32 г бромида калия при этой температуре? Ответ дайте в граммах и запишите с точностью до целых.
26.80 Массовая доля нитрита калия в насыщенном растворе при 20 °С равна 75,4 %. Сколько граммов воды надо взять, чтобы получить насыщенный раствор, содержащий 282 г нитрита калия при этой температуре? Ответ запишите с точностью до целых.
26.81 Сколько граммов медного купороса надо растворить в 200 г воды, чтобы получить 10%-й раствор сульфата меди? Ответ запишите с точностью до целых.
26.82 Сколько граммов
железного купороса надо
растворить в 210 г. воды, чтобы получить 10%-й раствор сульфата
железа(II)? Ответ запишите с точностью до целых.
воды, чтобы получить 10%-й раствор сульфата
железа(II)? Ответ запишите с точностью до целых.
26.83 Сколько граммов семиводного кристаллогидрата образуется при полном выпаривании 150 г 14%-го раствора сульфата магния? Ответ запишите с точностью до целых.
26.84 Сколько граммов шестиводного кристаллогидрата образуется при полном выпаривании 120 г 10%-го раствора хлорида железа(III)? Ответ запишите с точностью до целых.
26.85 Сколько граммов 12%-ного раствора сульфата меди(II) надо взять, чтобы при добавлении 10 г этой же соли получить раствор с массовой долей соли 18%? (Запишите число с точностью до десятых.)
26.87 В 200 г воды растворили 75 г декагидрата сульфата натрия. Рассчитайте массовую долю сульфата натрия (в %) в полученном растворе. Ответ запишите с точностью до целых.
26.88 Сколько граммов
раствора с массовой долей 20% нитрата серебра нужно добавить к 180 г 12%-го
раствора этой же соли, чтобы получить раствор с массовой долей растворенного
вещества 18%? Запишите число с точностью до целых.
26.89 Вычислите массу 14 %-го раствора нитрата калия, к которому необходимо добавить 15 г воды, чтобы получить 5 %-й раствор соли. Запишите число с точностью до десятых.
26.90 В 250 г воды растворили 75 г тетрагидрата нитрата кальция. Рассчитайте массовую долю нитрата кальция (в %) в полученном растворе. Ответ запишите с точностью до целых.
26.91 Сколько граммов 10%-го раствора серной кислоты надо добавить к 120 г 30%-го раствора этого же вещества, чтобы получить 16%-й раствор? Запишите число с точностью до целых)
26.92 Твердый нитрат калия массой 10 г добавили к 5%-му раствору этого же вещества и получили 15%-й раствор. Сколько граммов 5%-го раствора было взято? Запишите число с точностью до целых.
26.93 При охлаждении 100 г 80%-го раствора выпал осадок и образовался насыщенный, 60%-й раствор. Сколько граммов выпало в осадок? Запишите число с точностью до целых.
26. 94 При охлаждении
100 г 70%-го раствора выпал
осадок и образовался насыщенный, 50%-й раствор. Сколько
граммов выпало в осадок? Запишите число с точностью до целых.
94 При охлаждении
100 г 70%-го раствора выпал
осадок и образовался насыщенный, 50%-й раствор. Сколько
граммов выпало в осадок? Запишите число с точностью до целых.
26.95 Растворимость нитрата калия в воде при 60 °С составляет 110 г на 100 г воды. Сколько граммов нитрата калия содержится в 170 г насыщенного раствора при этой температуре? Запишите число с точностью до целых.
26.96 В 115 г насыщенного при определённой температуре раствора карбоната калия содержится 62 г соли. Чему равна растворимость карбоната калия при этой температуре (в г соли на 100 г воды)? Запишите число с точностью до целых.
26.97 В лаборатории имеется 36,5%-я соляная кислота. Из неё надо приготовить 600 мл 0,5 М соляной кислоты. Сколько граммов 36,5%-го раствора для этого понадобится? Запишите число с точностью до целых.
26.98 В лаборатории
имеется 2 М раствор серной кислоты. Из него надо приготовить 245 г 10%-го
раствора серной кислоты. Сколько миллилитров 2 М раствора для этого
понадобится? Запишите число с точностью до целых.
Сколько миллилитров 2 М раствора для этого
понадобится? Запишите число с точностью до целых.
26.99 Сколько граммов воды следует добавить к 600 г 10%-ного раствора нитрата аммония, чтобы массовая доля соли стала равной 3%? Запишите число с точностью до целых.
26.100 В 100 г воды растворили 35 г медного купороса (пентагидрата сульфата меди(II)). Рассчитайте массовую долю (в %) сульфата меди(II) в растворе. Запишите число с точностью до десятых.
26.101 В 100 г воды растворили 42,9 г кристаллической соды (декагидрата карбоната натрия). Рассчитайте массовую долю (в %) карбоната натрия в растворе. Запишите число с точностью до десятых.
26.102 При охлаждении 20%-го раствора соли выпал осадок, не содержащий кристаллизационной воды. Осадок отфильтровали и получили фильтрат массой 150 г и массовой долей соли 12%. Найдите массу исходного раствора (в г). Запишите число с точностью до целых.
26. 103 При охлаждении
28%-го раствора соли выпал осадок, не содержащий кристаллизационной воды.
Осадок отфильтровали и получили фильтрат массой 240 г и массовой долей соли
10%. Найдите массу осадка (в г). Запишите число с точностью до целых.
103 При охлаждении
28%-го раствора соли выпал осадок, не содержащий кристаллизационной воды.
Осадок отфильтровали и получили фильтрат массой 240 г и массовой долей соли
10%. Найдите массу осадка (в г). Запишите число с точностью до целых.
26.104 Массовая доля аммиака в насыщенном растворе при 20 °C и 1 атм составляет 34,2%. Рассчитайте растворимость аммиака в граммах на 100 г воды. Запишите число с точностью до целых.
26.105 Массовая доля хлороводорода в насыщенном растворе при 25 °C и 1 атм составляет 40,83%. Рассчитайте растворимость хлороводорода в граммах на 100 г воды. Запишите число с точностью до целых.
26.106 В 207,8 г воды растворили 57,2 г кристаллической соды (декагидрата карбоната натрия). Рассчитайте массовую долю (в %) карбоната натрия в полученном растворе. Запишите число с точностью до целых.
26.107 В 100,8 г воды
растворили 49,2 г английской соли (гептагидрата сульфата магния). Рассчитайте
массовую долю (в %) сульфата магния в полученном растворе. Запишите
число с точностью до целых.
Запишите
число с точностью до целых.
26.108 При охлаждении 200 г раствора гидрокарбоната аммония выпал осадок — безводная соль. Раствор над осадком имел массу 150 г и содержал 18% соли по массе. Найдите массовую долю (в %) соли в исходном растворе. Запишите число с точностью до десятых.
26.109 При охлаждении 400 г 70%-го раствора нитрата аммония выпал осадок — безводная соль. В образовавшемся растворе массовая доля нитрата аммония снизилась до 60%. Найдите массу осадка (в г). Запишите число с точностью до целых.
Решение задач на приготовление растворов приблизительной концентрации
Вариант 1.
Часть а
Выберите один правильный вариант ответа
1. Массовая доля ( % ) растворенного вещества в растворе, полученном при растворении 40 г. нитрата серебра в 200 г. воды, равна
а) 8,35
б) 10,0
в) 16,7
г) 20,0
2. Масса соли, которую необходимо растворить
в 50 мл. воды для приготовления 20%-ного
раствора
воды для приготовления 20%-ного
раствора
а) 10 г.
б) 12,5 г.
в) 20,0 г.
г) 25,0 г.
3. Из 200 г. 15% — ного раствора сахарозы выпарили 50 г. воды. Определите массовую долю сахарозы в оставшемся растворе.
а) 11,25 %
б) 12 %
в) 20 %
г) 25%
Часть в
4. В медицинской практике применяют водные растворы перманганата калия разной концентрации. Рассчитайте массу KМnO4 и объем воды, необходимые для приготовления 100г. 3%-ного раствора перманганата калия.
5. При ожогах щелочами пораженный участок
кожи в течение 10-15 минут обмывают водой,
а затем нейтрализуют раствором с массовой
долей уксусной кислоты 2%. Какая масса
уксусной эссенции с массовой долей
кислоты 60% необходима для приготовления
2%-ного раствора массой 600г. ?
?
6. Сколько граммов Na2SO4 ∙ 10H2O надо растворить в 800мл. воды, чтобы получить 10%-ный раствор Na2SO4? ( Ответ: 234,6г)
Решение задач на приготовление растворов приблизительной концентрации
Вариант 2.
Часть а
Выберите один правильный вариант ответа
1. Массовая доля ( % ) растворенного вещества в растворе, полученном при растворении 20 г. сахара в 140 мл. воды, равна
а) 6,25
б) 12,5
в) 18,75
г) 20,0
2. Масса щелочи, которую необходимо растворить в 50 г. воды для приготовления 10%-ного раствора
а) 5,6 г.
б) 6,25 г.
в) 10,0 г.
г) 12,5 г.
3. При охлаждении 150 г. 40% — ного раствора вещества выпало 15 г. осадка (не содержащего воды). Осадок отфильтровали. Определите концентрацию полученного раствора.
а) 33,3 %
б) 30 %
в) 36 %
г) 44,4 %
Часть в
4. В медицине применяется 5%-ный спиртовой
раствор йода для обработки ран, ссадин,
операционного поля. Какой объем 5%-ного
спиртового раствора йода можно приготовить
из 10г. кристаллического йода? Плотность
раствора 0,950г/мл.
В медицине применяется 5%-ный спиртовой
раствор йода для обработки ран, ссадин,
операционного поля. Какой объем 5%-ного
спиртового раствора йода можно приготовить
из 10г. кристаллического йода? Плотность
раствора 0,950г/мл.
5. Сколько мл. 12%-ного раствора серной кислоты и воды потребуется для приготовления 600 г. 8%-ного раствора?
6. Для приготовления 5%-ного раствора MgSO4 взято 400г MgSO4∙ 7Н2О. Найти массу полученного раствора. (Ответ: 3,90кг)
Решение задач на приготовление растворов приблизительной концентрации
Вариант 3.
Часть а
Выберите один правильный вариант ответа
1. Массовая доля (%) глюкозы в растворе, содержащем 280 г. воды и 40 г. глюкозы.
а) 14,3
б) 16,6
в) 12,5
г) 7,0
2. Какая масса хлорида железа (III)
содержится в 200 мл.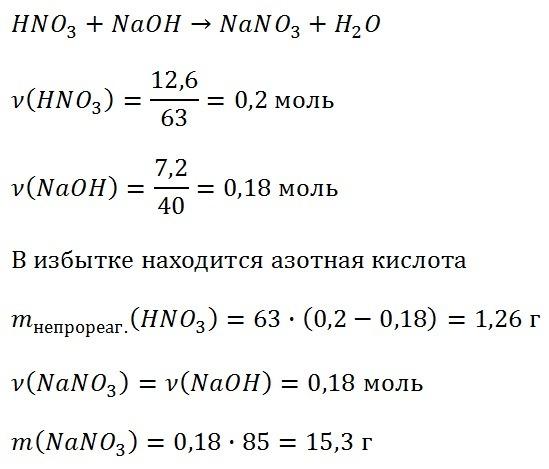 раствора с массовой
долей FeCl3 40 %? Плотность раствора 1,13г/мл.
раствора с массовой
долей FeCl3 40 %? Плотность раствора 1,13г/мл.
а) 90,4 г.
б) 80,0 г.
в) 70,8 г.
г) 5,0 г.
3. Из 400 г. 20 %-ного при охлаждении выделилось 50 г. растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
а) 22, 3 %
б) 28 %
в) 7,5 %
г) 8,6 %
УРАН (Книга) | ОСТИ.ГОВ
УРАН (Книга) | ОСТИ.GOVперейти к основному содержанию
- Полная запись
- Другие родственные исследования
- Авторов:
- Родден, Си Джей
- Дата публикации:
- Исследовательская организация:
- Лаборатория Нью-Брансуика, AEC, Нью-Джерси (США)
- Организация-спонсор:
- США AEC
- Идентификатор ОСТИ:
- 4844186
- Номер(а) отчета:
- ТИД-21384
- Номер АНБ:
- НСА-19-005798
- Тип ресурса:
- Книга
- Отношение ресурсов:
- Связанная информация: В: Глава 1 в Анализе основных материалов для ядерных реакторов, Rodden, CJ (ed.
 ), 1964. 1297 страниц.
), 1964. 1297 страниц.
- Страна публикации:
- США
- Язык:
- Английский
- Тема:
- ХИМИЯ; аналитические процедуры; БИБЛИОГРАФИЯ; КАЧЕСТВЕННЫЙ АНАЛИЗ; КОЛИЧЕСТВЕННЫЙ АНАЛИЗ; ОБЗОР; ПРОЦЕССЫ СЕПАРАЦИИ; УРАН; СОЕДИНЕНИЯ УРАНА
Форматы цитирования
- MLA
- АПА
- Чикаго
- БибТекс
Родден, С. Дж. УРАН . США: Н. П., 1964.
Веб.
Копировать в буфер обмена
Родден, С. Дж. УРАН . Соединенные Штаты.
Копировать в буфер обмена
Родден, CJ. 1964.
"УРАН". Соединенные Штаты. https://www.osti.gov/servlets/purl/4844186.
1964.
"УРАН". Соединенные Штаты. https://www.osti.gov/servlets/purl/4844186.
Копировать в буфер обмена
@статья{osti_4844186,
название = {УРАН},
автор = {Rodden, CJ},
abstractNote = {},
дои = {},
URL-адрес = {https://www.osti.gov/biblio/4844186},
журнал = {},
номер =,
объем = ,
место = {США},
год = {1964},
месяц = {1}
}
Копировать в буфер обмена
Просмотреть книгу (9,40 МБ)
Дополнительную информацию о получении полнотекстового документа см. в разделе «Доступность документа». Постоянные посетители библиотек могут искать в WorldCat библиотеки, в которых хранится эта книга.
Экспорт метаданных
Сохранить в моей библиотеке
Вы должны войти в систему или создать учетную запись, чтобы сохранять документы в своей библиотеке.
Аналогичных записей в сборниках OSTI.GOV:
- Аналогичные записи
Домашнее задание по химии 3
Домашнее задание по химии 3Страница домашнего задания по химии I, материал для экзамена 3
Страница домашнего задания без видимых ответов
На этой странице есть все необходимые домашние задания по материалу третьего экзамена первого семестра по общей химии. Учебником, связанным с этим домашним заданием, является ХИМИЯ Центральная наука , написанная Brown, LeMay, et.al. Последнее издание, которое я попросил студентов купить, было 12 th 9.0165 (ХИМИЯ Центральная наука, 12-е изд., Браун, ЛеМей, Берстен, Мерфи и Вудворд), но для этого курса подойдет любое издание этого текста.
Примечание. Вы ожидаете, что дойдет до конца задач в главах вашего учебника, найдет похожие вопросы и решит эти задачи.
Это всего лишь обязательный список задач для викторины. Вы также должны изучить упражнения в главах. Упражнения представляют собой отработанные примеры вопросов в конце главы. В учебном пособии также проработаны примеры.
Это голые вопросы. Вопросы из учебника будут содержать дополнительную информацию, которая может оказаться полезной и которая связывает задачи с приложениями в реальной жизни, многие из которых относятся к биологии.
Термохимия (гл. 5)
- Ответьте на следующие вопросы по термохимии.
- Мармеладный мишка массой 0,88 г сжигается в бомбовом калориметре. Температура начиналась с 21,5°С и стабилизировалась на уровне 24,2°С. Изготовитель бомбового калориметра определил теплоемкость калориметра равной 11,4 кДж/°С. Рассчитайте теплоту сгорания одного грамма мармеладного мишки.
- Ответ
- ΔE = C v ΔT = (11,4 кДж/°C)(24,2–21,5 °C) = (11,4 кДж/°C)(2,7 °C) = 30,78 кДж (30,78 кДж)/(0,88 г) = 34,98 кДж/г
- При сжигании 100 г образца метана СН 4 в бомбовом калориметре температура изменяется с 21 °С до 31 °С и выделяется 2200 Дж тепла.
 Какова удельная теплоемкость метана?
Какова удельная теплоемкость метана?- Ответ
- ΔE = C v ΔT ⇒ C v = ΔE/ΔT = (2200 Дж)/(10 °C) = 220 Дж/°C Удельная теплоемкость = C v /г = (220 Дж/°С)/(100 г) = 2,20 Дж/г-°С
- Температура блока меди массой 0,85 кг оказалась равной 21 °C. Медь поместили на солнце и подняли температуру до 28 °C. Примите удельную теплоемкость меди равной 0,385 Дж/г-°С и определите количество теплоты, поглощенное куском меди.
- Ответ
- ΔH = C p ΔT = (850 г)(0,385 Дж/г-°C)(7 °C) = 2291 Дж = 2,3 кДж
- Кусок твердого калия массой 0,258 г помещают в воду внутри калориметра кофейной чашки, что приводит к бурной реакции. Предположим, что общий объем полученного раствора составляет 100 мл. Температура раствора изменяется от 22°C до 25,1°C за счет реакции. Какое количество теплоты выделяется в этой реакции на 1 грамм калия? Предположим, что плотность раствора после реакции равна плотности воды и что теплоемкость раствора и реакционного сосуда обусловлена только водой, имеющей удельную теплоемкость 4,184 Дж/г-°С.

- Ответ
- ΔH = C p ΔT = (100 г)(4,184 Дж/г-°C)(3,1°C) = 1297 Дж (1297 Дж)/(0,258 г) = 5027 Дж/г .
- Образец натрия массой 22,99 г реагирует с 1,0 л воды в калориметре постоянного давления следующим образом: температура воды колеблется от 20°C до 65°C. Предположим, что объем раствора остается равным 1,0 л, но плотность изменяется до 1,02 г/мл, а удельная теплоемкость изменяется до 4,00 Дж/г-°С. Сколько тепла выделяется на каждый моль H 2 (г) произведено?
- Ответ
- ΔH = C p ΔT = (1000 мл)(1,02 г/мл)(4,00 Дж/г-°C)(45°C) = 183600 Дж = 183,6 кДж
(183,6 кДж)/(0,5 моль H 2 (г)) = 367,2 кДж на моль H 2 (г) .( 22,99 г Na(т) ) ( 1 моль Na 22,99 г Na(т) ) ( 1 моль H 2 (г) 2 моль Na ) = 0,5 моль H 2 (г) 
- ΔH = C p ΔT = (1000 мл)(1,02 г/мл)(4,00 Дж/г-°C)(45°C) = 183600 Дж = 183,6 кДж
- Блок никеля массой 1,5 кг при температуре 100 °С помещают в 500 мл воды с температурой 21 °С. Чему равна конечная температура, если предположить, что удельная теплоемкость никеля равна 0,44 Дж/г-°С, а удельная теплоемкость воды равна 4,184 Дж/г-°С. Подсказка: общее количество потерянного тепла равно общему полученному теплу!
- Ответ
- Общее количество тепла, потерянного Ni = (1500 г Ni)(0,44 Дж/г-°C)(100 °C — T f )
Общее количество тепла, полученное H 2 O = (500 мл)(1 г/1 мл)(4,184 Дж/г-°C)(T ф — 21 °С)
Установите два выражения равными друг другу и найдите T f = 40 °C .
——————
Обратите внимание, что для расчета общего количества тепла, потерянного никелем, конечная температура была вычтена из начальной температуры, чтобы получить положительное число.
Другой способ взглянуть на это — записать выражения для ΔH никеля и ΔH воды, а затем сделать ΔH никеля отрицательным значением ΔH воды.
 Это потому, что Ni выделяет тепло, а вода поглощает такое же количество тепла.
Это потому, что Ni выделяет тепло, а вода поглощает такое же количество тепла.ΔH вода = (500 мл)(1 г/1 мл)(4,184 Дж/г-°C)(T f — 21 °C)
ΔH Ni = (1500 г Ni)(0,44 Дж/г-°C)(T f — 100 °C)
ΔH вода = -ΔH Ni дает те же выражения, что и выше.
- Общее количество тепла, потерянного Ni = (1500 г Ni)(0,44 Дж/г-°C)(100 °C — T f )
Общее количество тепла, полученное H 2 O = (500 мл)(1 г/1 мл)(4,184 Дж/г-°C)(T ф — 21 °С)
Установите два выражения равными друг другу и найдите T f = 40 °C .
- Какая химическая реакция соответствует ΔH o f для каждого из следующих веществ?
- HClO
- ½H 2 (г) + ½Cl 2 (г) + ½O 2 (г) → HClO
- С 2 Н 5 ОХ
- 2C(т) + 3H 2 (г) + ½O 2 (г) → C 2 H 5 OH
- КМНО 4
- K(s) + Mn(s) + 2O 2 → KMnO 4
- Ответ
- Ответ
- Ответ
- Используйте Приложение C для расчета ΔH° для каждой из следующих реакций?
- 4FeO(т) + O 2 (г) → 2Fe 2 O 3 (т)
- ΔH rxn = (2 моль)(-822,16 кДж/моль) — (4 моль)(-297,9 кДж/моль) = -452,72 кДж
- H 2 SO 4 (л) + 2NaCl(т) → 2HCl(г) + Na 2 SO 4 (т)
- (-1387,1 кДж) + (2)(-92,30 кДж) — (-814,0 кДж) — (2)(-410,9 кДж) = 64,1 кДж
- 4ХНО 3 (г) + 2H 2 O(г) → 2N 2 H 4 (г) + 7O 2 (г)
- (2)(95,4 кДж) + 0 — 4(-134,63 кДж) — (2)(-241,82 кДж) = 1212 кДж
- C 2 H 5 OH(ж) + O 2 (ж) → H 2 O(ж) + CO 2 (ж)
- (-285,83 кДж) + (-393,5 кДж) — (-277,7 кДж) — 0 = -401,63 кДж
- Ответ
- Ответ
- Ответ
- Ответ
- Рассчитайте ΔH для
O 3 (г) + 2NO 2 (г) → N 2 O 5 (г) + O 2 (г)
Учитывая следующие уравнения:O 3 (г) + NO 2 (г) → NO 3 (г) + O 2 (г) ΔH = 10,1 кДж
N 2 O 5 (г) → NO 3 (г) + NO 2 (г) ΔH = 48,3 кДж
- Ответ
- Переключите второе уравнение и прибавьте к первому.

О 3 (г) + NO 2 (г) → NO 3 (г) + O 2 (г) ΔH = 10,1 кДж
NO 3 (г) + NO 2 (г) → N 2 O 5 (г)) ΔH = -48,3 кДж
Объединение уравнений дает:
O 3 (г) + 2NO 2 (г) → N 2 O 5 (г) + O 2 (г) ΔH = -38,2 кДж
- Переключите второе уравнение и прибавьте к первому.
- Рассчитайте ΔH для
4K 2 O(s) + 3O 2 (g) → 3K 2 O 2 (s) + 2KO 2 (s)
Учитывая следующие уравнения:K 2 O(т) + ½O 2 (г) → K 2 O 2 (т) ΔH = -132,6 кДж
4KO 2 (т) → 2K 2 O(т) + 3O 2 (г) ΔH = 411,6 кДж
2KO 2 (т) → K 2 O 2 (т) + O 2 (г) ΔH = 73,2 кДж
- Ответ
- Умножьте первое уравнение на 2, поменяйте местами второе уравнение, добавьте их к последнему уравнению.

2K 2 O(т) + O 2 (г) → 2K 2 O 2 (т) ΔH = -265,2 кДж
2K 2 O(т) + 3O 2 (г) → 4KO 2 (т) ΔH = -411,6 кДж
2KO 2 (т) → K 2 O 2 (т) + O 2 (г) ΔH = 73,2 кДж
Объединение уравнений дает:
4К 2 О(т) + 3О 2 (ж) → 3К 2 О 2 (т) + 2КО 2 (т)
ΔH = -265,2 кДж — 411,6 кДж + 73,2 кДж = -603,6 кДж
- Умножьте первое уравнение на 2, поменяйте местами второе уравнение, добавьте их к последнему уравнению.
- При полном сгорании одного моля твердого нафталина C 10 H 8 выделяется 4981 кДж теплоты. Предположим, что образуется H 2 O(г) и что для CO 2 , ΔH o f = -393,5 кДж/моль. Что такое ΔH o f для нафталина?
- Ответ
C 10 H 8 (т) + 12O 2 (г) → 10CO 2 (г) + 4H 2 O(г) ∆H = -4981 кДж
ΔH rxn = 4ΔH o f,H 2 O + 10ΔH o f,CO 2 — ΔH или f,C 10 H 8 — 12ΔH o f,O 2
ΔH O F, C 10 H 8 = 4 (-241,82 кДж) + 10 (-393,5 кДж) + 4981 KJ = 78,7 KJ/Mole
Обычной добавкой к бензину является октановое число C 8 H 18 .


 ), 1964. 1297 страниц.
), 1964. 1297 страниц. Это всего лишь обязательный список задач для викторины. Вы также должны изучить упражнения в главах. Упражнения представляют собой отработанные примеры вопросов в конце главы. В учебном пособии также проработаны примеры.
Это всего лишь обязательный список задач для викторины. Вы также должны изучить упражнения в главах. Упражнения представляют собой отработанные примеры вопросов в конце главы. В учебном пособии также проработаны примеры. Какова удельная теплоемкость метана?
Какова удельная теплоемкость метана?

 Это потому, что Ni выделяет тепло, а вода поглощает такое же количество тепла.
Это потому, что Ni выделяет тепло, а вода поглощает такое же количество тепла.


Leave A Comment