Исследование свойств воды при кристаллизации
Внимание! Администрация сайта rosuchebnik.ru не несет ответственности за содержание методических разработок, а также за соответствие разработки ФГОС.
- Участник:Ковалёв Павел Алексеевич
- Руководитель:Шик Галина Яковлевна
Цель работы: провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Вступление
Вода является не только одним из самых необходимых, но и самых удивительных явлений на нашей планете. Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Введение
Большая часть поверхности Земли покрыта водой (океаны, моря, озёра, реки, льды). На Земле примерно 96,5 % воды приходится на океаны, 1,7 % мировых запасов составляют грунтовые воды, ещё 1,7 % – ледники и ледяные шапки Антарктиды и Гренландии, небольшая часть находится в реках, озёрах и болотах, и 0,001 % в облаках, которые образуются из взвешенных в воздухе частиц льда и жидкой воды.
Вода при нормальных условиях находится в жидком состоянии, однако при температуре в 0 °C она переходит в твердое состояние – лед и кипит (превращается в водяной пар) при температуре 100 °C.
Значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию».
Лёд встречается в природе в виде собственно льда (материкового, плавающего, подземного), а также в виде снега, инея, изморози. Под действием собственного веса лёд приобретает пластические свойства и текучесть.
Природный лёд обычно значительно чище, чем вода, так как при кристаллизации воды в первую очередь в решётку встают молекулы воды.
Общие запасы льда на Земле около 30 млн. км³. Основные запасы льда сосредоточены в полярных шапках (главным образом, в Антарктиде, где толщина слоя льда достигает 4 км).
В мировом океане вода солёная и это препятствует образованию льда, поэтому лёд образуется только в полярных и субполярных широтах, где зима долгая и очень холодная. Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Замерзают некоторые неглубокие моря, расположенные в умеренном поясе.
Кроме того, имеются данные о наличии льда на планетах Солнечной системы (например, на Марсе), их спутниках, на карликовых планетах и в ядрах комет.
Исследование свойств воды необходимо для человечества.
При этом процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней школе.
Актуальность работы использование на уроках физики, для знакомства учащихся со свойствами воды при кристаллизации.
Объектом исследования является кристаллизация воды.
Предмет исследования – изучения свойств воды при кристаллизации.
Цель работы провести опыты по кристаллизации воды и подготовить предложения по их проведению.
Главной задачей является изучение свойств воды при кристаллизации.
Для решения главной задачи необходимо:
- Повести анализ основных свойств воды.

- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.
- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Теоретическая значимость работы заключается в систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли.
Практическая значимость работы – изучение процесса кристаллизации воды во время проведение опытов, а также подготовка предложений по проведению опытов на уроках в средней школе.
1. Подготовка к исследованию
1.1 Анализ основных свойств воды
Вода является одним из самых удивительных веществ на планете Земля. Встретить воду можно практически везде в естественных условиях как на поверхности планеты, так и в ее недрах в трех возможных физических состояниях для веществ: жидкое, твердое, газообразное (то есть вода, лед, водяной пар).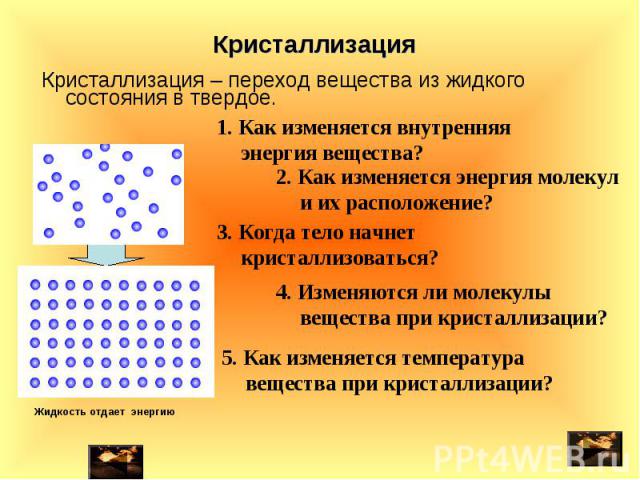
Конечно, существуют вещества, которые можно получить в виде жидкости, твердого тела или газа. Однако, не существует подобного химического вещества, которое именно в естественных условиях встречается в указанных выше трех физических состояниях.
Свойства воды:
- Вода является веществом, которое не имеет ни цвета, ни запаха, ни вкуса.
- Вода является единственным на планете Земля известным науке веществом, встречающимся в природных условиях в трех физических состояниях: твердое тело, жидкость, газ.
- Вода является универсальным растворителем, имея возможность растворять большее количество солей, а также других веществ, чем какие-либо другие вещества.
- Вода с большим трудом поддается окислению. Вода — достаточно химически устойчива, то есть разложить ее на составные части или сжечь достаточно проблематично.
- Окислению водой поддаются практически все естественные металлы, так же под ее воздействием разрушаются особо твердые горные породы.

- При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
- Вода, как физическое вещество, характеризуется большим сродством сама с собой. Такое сродство у воды является самым большим среди всех жидкостей. Вследствие этого вода на поверхности размещается в виде капель сферической формы, поскольку сфера обладает наименьшей при заданном объеме поверхностью.
- Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды. Однако, замерзание морской воды происходит при более низких температурах: минус 1,9 градусов Цельсия, при солености 35%.
- Вода обладает очень высокой теплоемкостью, относительно мало нагреваясь при этом. Также вода обладает достаточно высокой скрытой теплотой плавления (порядка 80 кал/г), а также испарения ( порядка 540 кал/г). Вода способна поглощать значительные объемы дополнительного тепла.

- Дистиллированная вода практически не проводит электрический ток, однако наличие в воде даже небольшого количества солей значительно увеличивает ее токопроводящие свойства.
Свойства снега:
- При смешивании соли со снегом наблюдается два процесса: разрушение кристаллической структуры соли, которое происходит с поглощением тепла, и гидрация ионов. Последний процесс происходит с выделением тепла в окружающую среду. Для поваренной соли и хлористого кальция первый процесс превалирует над вторым. Поэтому при смешивании снега с этими солями происходит активный отбор тепла из окружающей среды. Ещё одна особенность соляных растворов состоит в том, что их точка замерзания ниже 0 градусов. Чтобы снег на тротуарах таял при температуре ниже 0 градусов, его посыпают этими солями.
- Снег обладает удивительным свойством – памятью. Он сохраняет следы. По следам можно, например, изучать физику.
 Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
1.2 Значение кристаллизации воды для флоры и фауны
Мы любим снег не только за то, что он дарит нам великолепные зимние пейзажи. У нашей любви к снегу немало рациональных причин. «Снег на полях — хлеб в закромах», «Зима без снега – лето без хлеба», – справедливо утверждают старинные русские пословицы. Снежный покров — это огромный запас влаги, столь необходимый полям, в то же время это своеобразное гигантское одеяло, защищающее поверхность земли от холодных ветров. Академик Б. И. Вернадский подчеркивал, что снежный покров — «не просто теплая покрышка озимых, это живительная покрышка», весной он дает талые воды, насыщенные кислородом.
Запасы снега существенно влияют на уровень воды в реках, определяют изменения климата на больших территориях.
Кроме того, снег является хорошим строительным материалом для различных построек на севере — от иглу (жилищ эскимосов) до больших складских помещений. Существует самая большая в мире гостиница, полностью сделанная изо льда и снега, находится она в шведской Лапландии в 200 километрах от Северного полярного круга.
Он служит основой зимних дорог и даже аэродромов.
Благодаря снегу мы каждый год любуемся сказочными зимними пейзажами, играем в снежки, строим снежные городки, крепости, катаемся на лыжах, санках, в снежном уборе приходит к нам прекрасный новогодний праздник.
Значение льда трудно недооценить. Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд оказывает большое влияние на условия обитания и жизнедеятельности растений и животных, на разные виды хозяйственной деятельности человека. Покрывая воду сверху, лед играет в природе роль своего рода плавучего экрана, защищающего реки и водоемы от дальнейшего замерзания и сохраняющего жизнь подводному миру. Если бы плотность воды увеличивалась при замерзании, лед оказался бы тяжелее воды и начал тонуть, что привело бы к гибели всех живых существ в реках, озерах и океанах, которые замерзли бы целиком, превратившись в глыбы льда, а Земля стала ледяной пустыней, что неизбежно привело бы к гибели всего живого.
Лёд может вызывать ряд стихийных бедствий с вредными и разрушительными последствиями – обледенение летательных аппаратов, судов, сооружений, дорожного полотна и почвы, град, метели и снежные заносы, речные заторы с наводнениями, ледяные обвалы и др. Природный лёд используется для хранения и охлаждения пищевых продуктов, биологических и медицинских препаратов, для чего он специально производится и заготавливается.
1.3 Выбор и обоснование опытов для проведения исследования
Для проведения опытов с водой необходимо выбрать те, которые наиболее полно характеризуют и подтверждают свойства воды.
Проведенный анализ показал, что лучше всего это будет реализовано при выполнении следующих опытов:
- Замерзание соленой воды.
- Расширение воды при замерзании.
- Замерзание жидкости при внешнем воздействии снега.
- Замерзание мыльных пузырей.
- Срастание сосульки.
- Скрип сухого снега.
- Примерзание к поверхности.
2. Проведение исследования
2.1 Подготовка материальной части
Для проведения опытов были взяты:
- предметы – кастрюля, стеклянная бутылка, пластиковая бутылка, одноразовые стаканы, тонкая медная проволока, трубочка;
- вещества – снег, сосулька, соль, вода, мыльный раствор, сок.
2.
 2 Проведение опытов с описанием основных результатов
2 Проведение опытов с описанием основных результатов1. Замерзание соленой воды.
Налейте в две формочки воду – чистую и очень солёную. Вынесите формочки на мороз или поставьте в морозильную камеру. Вы заметите, что чистая пресная вода превратилась в лёд, а солёная замёрзнет при очень сильном морозе.
Замерзание воды происходит не при температурных условиях ее наибольшей плотности (при 4 градусах Цельсия), а при нуле градусов Цельсия. Это свойства пресной воды.
При этом, морской лед отличается от пресноводного в ряде отношений. У соленой воды температура замерзания понижается по мере увеличения солености. В диапазоне солености от 30 до 35 промилле точка замерзания меняется от -1.6 до -1.9 град. Образование морского льда можно рассматривать как замерзание пресной воды с вытеснением солей в ячейки морской воды внутри толщи льда. Когда температура достигает точки замерзания, образуются ледяные кристаллы, которые «окружают» не замерзшую воду.
2. Расширение воды при замерзании.
Наполните водой пластиковый стакан, пластиковую бутылку и стеклянную бутылку. Выставьте их на мороз. Замерзая, вода увеличивается в объёме, «вылезает» из стакана, стеклянную бутылку разрывает даже в том случае, когда она заполнена наполовину. Пластиковая бутылка остаётся без видимых изменений.
При замерзании вода обладает уникальными свойствами расширения. Благодаря таким свойствам лед на воде, которая находится в виде жидкости, плавает.
Зимой из-за этого свойства воды происходят аварии на водопроводах. В сильные морозы основная причина таких аварий – замерзание текучей воды. Происходит ее расширение, так что образующийся лед легко разрывает трубы, так как плотность льда – 917 кг/м3, а плотность воды – 1000 кг/м3, то есть объем увеличивается в 1,1 раза, что довольно существенно.
3. Замерзание жидкости при внешнем воздействии снега.
Налейте в пластиковый стакан (пробирку) сок и поставьте его в кастрюлю с солёным снегом.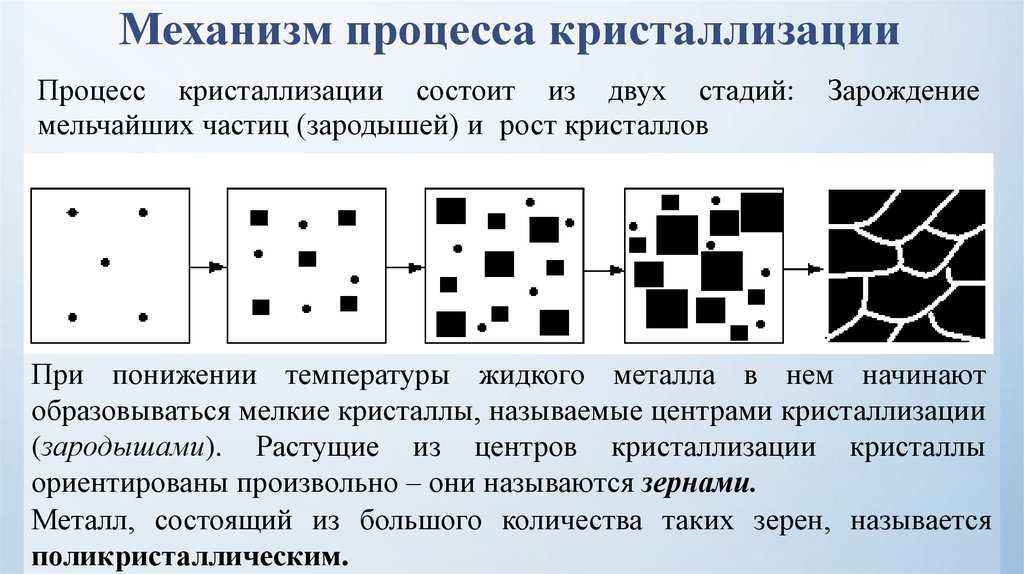 Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
Сок замёрзнет, и очень скоро вы будете лакомиться фруктовым льдом.
При смешивании соли со снегом наблюдается разрушение кристаллической структуры соли, которое происходит с поглощением тепла. Поэтому при смешивании снега с солью происходит активный отбор тепла из сока и сок превращается в лед.
4. Замерзание мыльных пузырей.
Приготовьте мыльный раствор. Раствор на морозе держите в рукавице, чтобы он не замёрз. Выдувайте пузыри трубочкой для сока. Из-за разности температур изнутри пузыря и снаружи возникает большая подъёмная сила, мгновенно уносящая пузыри вверх. Тонкая мыльная плёнка на морозе быстро замерзает, превращая пузыри в ледяные шарики.
Таким образом, тончайшая пленка мыльного пузыря замерзает за считанные секунды.
5. Срастание сосульки.
Возьмите сосульку. Перекиньте через неё тонкую проволоку, концы которой утяжелите грузиками. Наблюдайте, как проволока растапливает лёд, проникает всё глубже в сосульку. Вода над сосулькой вновь замерзает.
Вода над сосулькой вновь замерзает.
Это подтверждает свойство поглощения тепла большей массой льда.
Лед нарастает снизу, сразу над проволокой, так как стекающая вниз талая вода замерзает при соприкосновении с холодными стенками сосульки.
6. Скрип сухого снега.
Насыпьте в тарелку сахарный песок горкой и начните давить его ложкой. Вы услышите характерный скрип. Намочите песок и вновь разотрите. Скрип исчез. В морозные дни звук распространяется на большие расстояния.
Снег скрипит только в мороз (ниже -5°C), и звук скрипа меняется в зависимости от температуры воздуха – чем крепче мороз, тем выше тон скрипа. При достаточном опыте можно оценивать температуру воздуха по звуку, который издает скрипящий снег. Скрип образуется из-за того, что при давлении разрушаются мельчайшие кристаллики снега. Причем каждый из них по отдельности очень мал, чтобы издавать звук, доступный уху человека, но вместе они ломаются довольно громко. Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
Усиление морозов делает ледяные кристаллики более твердыми и хрупкими. При каждом шаге ледяные иглы ломаются. При температуре воздуха ниже -50°C скрип снега становится таким сильным, что его можно слышать через тройные стекла (этому способствует также большая плотность морозного воздуха).
7. Примерзание к поверхности.
Добавьте в кастрюлю со снегом поваренную соль в соотношении примерно 1 к 6. Тщательно размешайте смесь. Если теперь вы захотите переставить кастрюлю, то её придётся поднять вместе с табуретом.
Это также подтверждает поглощение тепла из окружающей среды.
При смешивании соли со снегом происходит образование раствора, сопровождающееся сильным охлаждением вследствие большого поглощения теплоты льдом при его плавлении и солью при ее растворении. Так, например, температура смеси из 29 грамм соли и 100 грамм льда понижается до – 21°С. А если взять 143 грамма соли и 100 грамм льда, то температура может быть понижена до – 55°С.
2.3 Предложения по проведению опытов
Опыты по изучению свойств воды целесообразно проводить на уроках в средней и начальной школе.
При этом для детей начальной школы рекомендуется проведение опытов № 1 и 2 в домашних условиях под присмотром родителей.
Для учеников средней школы возможно проведение опытов № 3, 6 и 7 на уроках под руководством учителя, а опыты № 4 и 5 – факультативно или самостоятельно в домашних условиях.
Заключение
Таким образом, исследование свойств воды необходимо для человечества.
Процесс кристаллизации воды можно изучать в домашних условиях, а также на уроках в средней и начальной школе.
В работе удалось решить следующие задачи:
- Повести анализ основных свойств воды.
- Изучить значение кристаллизации воды для флоры и фауны Земли.
- Определить основные опыты для проведения исследования.

- Провести опыты и описать основные результаты.
- Подготовить предложения по проведению опытов на уроках в средней школе.
Значимость работы по систематизации основных свойств воды и значения кристаллизации воды для флоры и фауны Земли подтвердилась.
Цель достигнута.
Минимальное число молекул Ученые рассчитали самый маленький кристалл льда: Наука и техника: Lenta.ru
Все мы много раз слышали об уникальных свойствах воды. Если бы «жидкость без цвета и запаха» не обладала особыми качествами, жизнь на Земле в ее нынешнем виде была бы невозможна. То же самое можно сказать о твердой форме воды — льде. Теперь ученые выяснили еще один его секрет: в только что опубликованном исследовании специалисты, наконец, определили, сколько именно молекул нужно для того, чтобы получить кристаллик льда.
Уникальная связь
Перечислять удивительные свойства воды можно очень долго. Она обладает самой высокой удельной теплоемкостью среди жидкостей и твердых тел, плотность ее кристаллической формы — то есть льда — меньше, чем плотность воды в жидком состоянии, способность к адгезии («прилипанию»), высокое поверхностное натяжение — все это и многое другое позволяет существовать на Земле жизни как таковой.
Своей уникальностью вода обязана водородным связям, точнее их количеству. С их помощью одна молекула H2O может «связаться» с четырьмя другими молекулами. Такие «контакты» ощутимо менее прочны, чем ковалентные связи (разновидность «обычных» связей, которые удерживают вместе, например, атомы водорода и кислорода в молекуле воды), и разорвать каждую водородную связь по отдельности достаточно просто. Но в воде таких взаимодействий очень много, и вместе они заметно ограничивают свободу молекул H2O, не давая им слишком уж легко отрываться от «товарищей», скажем, при нагревании. Каждая из водородных связей сама по себе существует ничтожную долю секунды — они постоянно разрушаются и возникают вновь. Но при этом в любой момент большая часть молекул воды оказывается вовлечена во взаимодействие с «соседями».
Айсберг в море Лазарева у берегов Антарктиды. Фото РИА Новости, Алексей Никольский
Lenta.ru
Водородные связи несут ответственность и за необычное поведение воды при кристаллизации, то есть при образовании льда. Плавающие по поверхности океана айсберги, корка льда в пресных водоемах — все эти явления нас не удивляют, потому что мы привыкли к ним с рождения. Но если бы основной на Земле была не вода, а какая-нибудь другая жидкость, то ни катков, ни подледной рыбалки не существовало бы вовсе. Плотность практически всех веществ при переходе из жидкого состояния в твердое увеличивается, потому что молекулы теснее «прижимаются» друг к другу, а значит, на единицу объема их становится больше.
Плавающие по поверхности океана айсберги, корка льда в пресных водоемах — все эти явления нас не удивляют, потому что мы привыкли к ним с рождения. Но если бы основной на Земле была не вода, а какая-нибудь другая жидкость, то ни катков, ни подледной рыбалки не существовало бы вовсе. Плотность практически всех веществ при переходе из жидкого состояния в твердое увеличивается, потому что молекулы теснее «прижимаются» друг к другу, а значит, на единицу объема их становится больше.
Иначе обстоят дела с водой. До температуры в 4 градуса Цельсия плотность H2O дисциплинированно растет, но при переходе этой границы скачкообразно падает на 8 процентов. Объем замерзшей воды, соответственно, увеличивается. С этой особенностью хорошо знакомы жители домов с давно не ремонтировавшимися трубами или те, кто забывал в морозилке слабоалкогольные напитки.
Причина аномального изменения плотности воды при переходе из жидкого состояния в твердое кроется все в тех же водородных связях. Кристаллическая решетка льда напоминает пчелиные соты, в шести углах которых располагаются молекулы воды. Они соединены между собой водородными связями, а их длина превышает длину «обычной» ковалентной связи. В итоге между молекулами затвердевшей H2O оказывается больше пустого пространства, чем было между ними в жидком состоянии, когда частицы свободно перемещались и могли подходить друг к другу совсем близко. Наглядное сопоставление укладок молекул жидкой и твердой фаз воды приведено, например, здесь.
Кристаллическая решетка льда напоминает пчелиные соты, в шести углах которых располагаются молекулы воды. Они соединены между собой водородными связями, а их длина превышает длину «обычной» ковалентной связи. В итоге между молекулами затвердевшей H2O оказывается больше пустого пространства, чем было между ними в жидком состоянии, когда частицы свободно перемещались и могли подходить друг к другу совсем близко. Наглядное сопоставление укладок молекул жидкой и твердой фаз воды приведено, например, здесь.
Исключительные свойства и особая важность воды для обитателей Земли обеспечили ей постоянное внимание ученых. Не будет большим преувеличением сказать, что соединение двух атомов водорода и одного атома кислорода — наиболее тщательно исследованное вещество на планете. И тем не менее специалисты, выбравшие H2O предметом своего интереса, без работы не останутся. Например, они всегда могут заняться изучением того, как же, собственно, жидкая вода превращается в твердый лед. Процесс кристаллизации, приводящий к столь драматическим изменениям всех свойств, происходит очень быстро, и многие его детали до сих пор остаются неизвестными. После выхода последнего номера журнала Science одной загадкой стало меньше: теперь ученые точно знают, сколько молекул воды нужно положить в стакан, чтобы на холоде его содержимое превратилось в привычный лед.
Процесс кристаллизации, приводящий к столь драматическим изменениям всех свойств, происходит очень быстро, и многие его детали до сих пор остаются неизвестными. После выхода последнего номера журнала Science одной загадкой стало меньше: теперь ученые точно знают, сколько молекул воды нужно положить в стакан, чтобы на холоде его содержимое превратилось в привычный лед.
Разный лед
Слово «привычный» в предыдущем предложении употреблено не из стилистических соображений. Оно подчеркивает, что речь идет о кристаллическом льде — том самом, с похожей на соты гексагональной решеткой. Хотя привычным такой лед является разве что на Земле — в бесконечном межзвездном пространстве преобладает совсем другая форма льда, которую на третьей планете от Солнца получают в основном в лабораториях. Этот лед называется аморфным, и никакой регулярной структуры у него нет.
Аморфный лед можно получить, если очень быстро (в течение миллисекунд или даже быстрее) и очень сильно (ниже 120 кельвинов — минус 153,15 градуса Цельсия) охладить жидкую воду.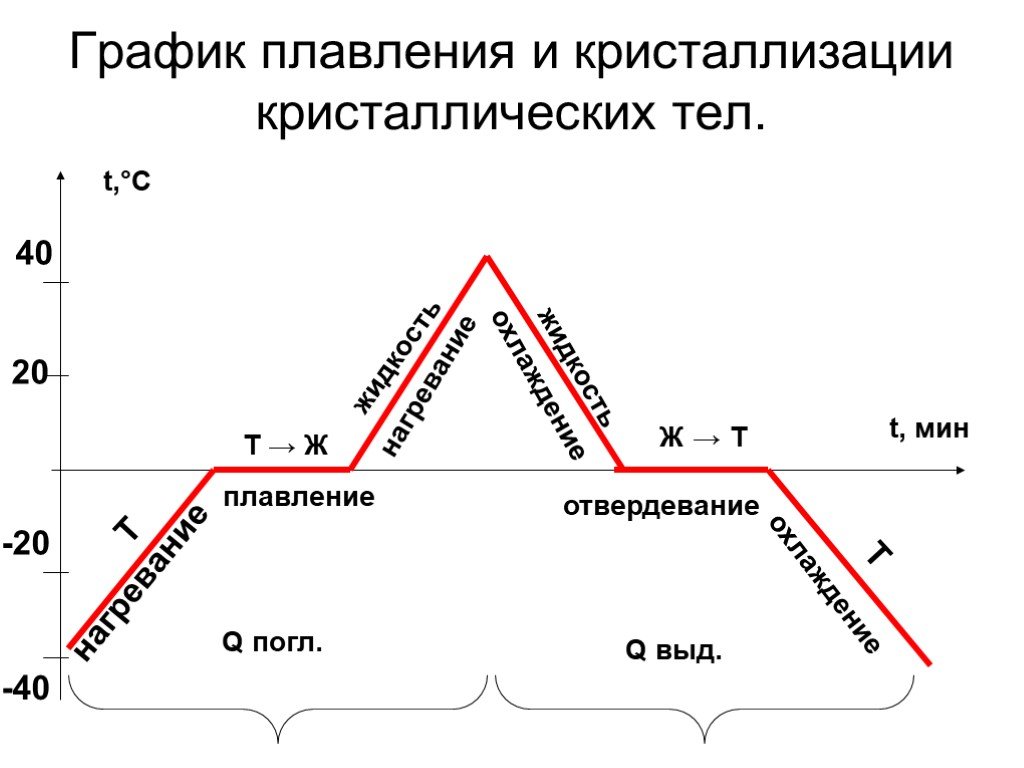 В таких экстремальных условиях молекулы H2O не успевают сорганизоваться в упорядоченную структуру, и вода превращается в вязкую жидкость, плотность которой чуть больше плотности льда. Если температура остается низкой, то вода может пребывать в форме аморфного льда очень долго, но при потеплении она переходит в более привычное состояние кристаллического льда.
В таких экстремальных условиях молекулы H2O не успевают сорганизоваться в упорядоченную структуру, и вода превращается в вязкую жидкость, плотность которой чуть больше плотности льда. Если температура остается низкой, то вода может пребывать в форме аморфного льда очень долго, но при потеплении она переходит в более привычное состояние кристаллического льда.
Аморфным и гексагональным кристаллическим льдом разновидности твердой формы воды не ограничиваются — всего на сегодня ученым известно более 15 ее видов. Самый распространенный на Земле лед носит название лед I h, но в верхних слоях атмосферы можно отыскать и лед I с, кристаллическая решетка которого напоминает решетку алмаза. Другие модификации льда могут быть тригональными, моноклинными, кубическими, ромбическими и псевдоромбическими.
Но в некоторых случаях фазового перехода между этими двумя состояниями не произойдет: если молекул воды будет слишком мало, то вместо того, чтобы формировать строго организованную решетку, они «предпочтут» остаться в менее упорядоченном виде.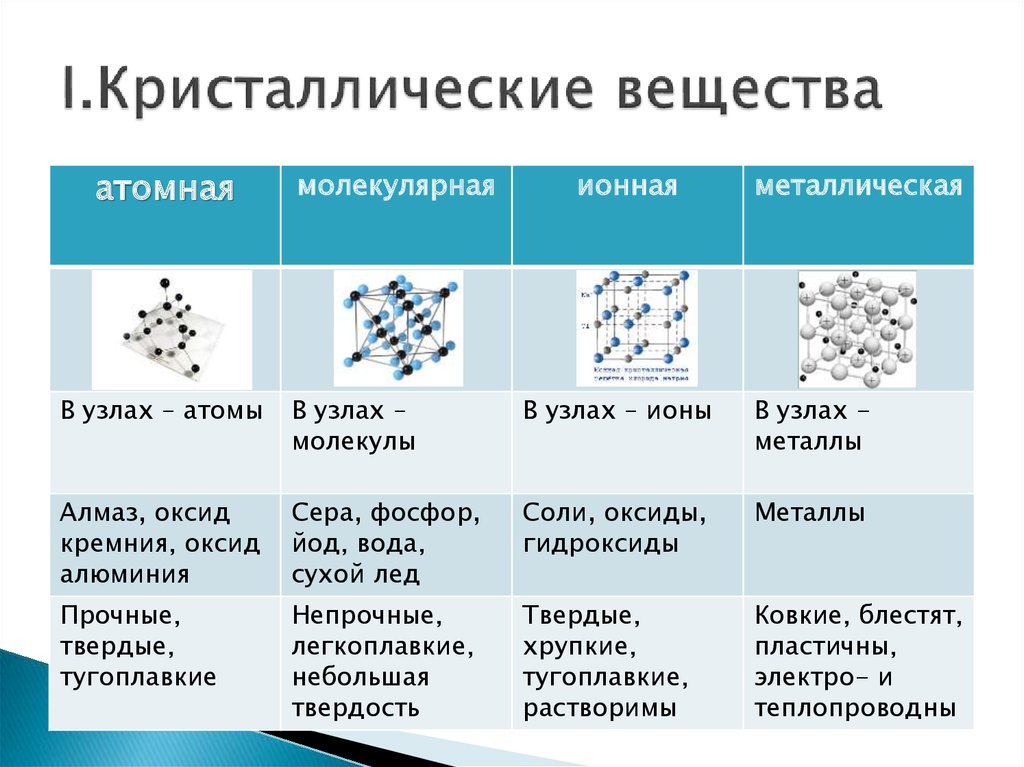 «В любом молекулярном кластере взаимодействия на поверхности конкурируют со взаимодействиями внутри кластера, — объяснил «Ленте.ру» один из авторов новой работы, сотрудник института физической химии при Гёттингенском университете Томас Цойх (Thomas Zeuch). — Для кластеров меньшего размера энергетически более выгодным оказывается максимально оптимизировать структуру поверхности кластера, нежели формировать кристаллическую «сердцевину». Поэтому такие кластеры остаются аморфными».
«В любом молекулярном кластере взаимодействия на поверхности конкурируют со взаимодействиями внутри кластера, — объяснил «Ленте.ру» один из авторов новой работы, сотрудник института физической химии при Гёттингенском университете Томас Цойх (Thomas Zeuch). — Для кластеров меньшего размера энергетически более выгодным оказывается максимально оптимизировать структуру поверхности кластера, нежели формировать кристаллическую «сердцевину». Поэтому такие кластеры остаются аморфными».
Законы геометрии диктуют: по мере роста размеров кластера доля молекул, оказывающихся на поверхности, уменьшается. В какой-то момент энергетическая выгода от формирования кристаллической решетки перевешивает достоинства оптимального расположения молекул на поверхности кластера, и происходит фазовый переход. Но когда именно наступает этот самый момент, ученые не знали.
Группе исследователей, работавших под руководством профессора Удо Бака (Udo Buck) из института динамики и самоорганизации в Гёттингене, удалось дать ответ. Специалисты показали, что минимальное число молекул, которые могут образовать кристаллик льда, составляет 275 плюс-минус 25 штук.
Специалисты показали, что минимальное число молекул, которые могут образовать кристаллик льда, составляет 275 плюс-минус 25 штук.
В своем исследовании ученые использовали метод инфракрасной спектроскопии, модернизированный так, чтобы на выходе можно было отличать спектры, которые дают водяные кластеры, различающиеся по размеру всего на несколько молекул. Созданная авторами методика дает максимальное разрешение для кластеров, включающих от 100 до 1000 молекул — а именно в этом интервале, как считалось, и лежит «пороговое» число, после которого начинается кристаллизация.
Ученые получали аморфный лед, пропуская водяной пар, смешанный с гелием, сквозь очень тоненькое отверстие в вакуумную камеру. Пытаясь протиснуться в крошечную дырочку, молекулы воды и гелия непрерывно сталкивались друг с другом и в этой давке теряли значительную часть своей кинетической энергии. В итоге в вакуумную камеру попадали уже «успокоившиеся» молекулы, легко формирующие кластеры.
Возникновение кристаллической решетки при увеличеннии числа молекул воды в кластерах. Изображение Victoria Buch, Cristoph Pradzynski and Udo Buck. Нажмите на картинку, чтобы увеличить
Изображение Victoria Buch, Cristoph Pradzynski and Udo Buck. Нажмите на картинку, чтобы увеличить
Lenta.ru
Изменяя количество молекул воды и сравнивая итоговые спектры, исследователи смогли засечь момент перехода от аморфной к кристаллической форме льда (спектры этих двух форм имеют очень характерные отличия). Полученная учеными динамика хорошо согласовывалась с теоретическими моделями, которые предсказывают, что после прохождения «точки Х» формирование кристаллической решетки начинается в середине кластера и распространяется к его краям. Признаком того, что кристаллизация неизбежна (опять же, согласно теоретическим изысканиям), является формирование кольца из шести соединенных водородными связями молекул — именно это и происходит, когда общее число молекул в кластере становится равным 275-ти. Дальнейшее увеличение числа молекул ведет к постепенному разрастанию решетки, и на стадии 475 штук спектр ледяного кластера уже полностью неотличим от спектра, который дает обычный кристаллический лед.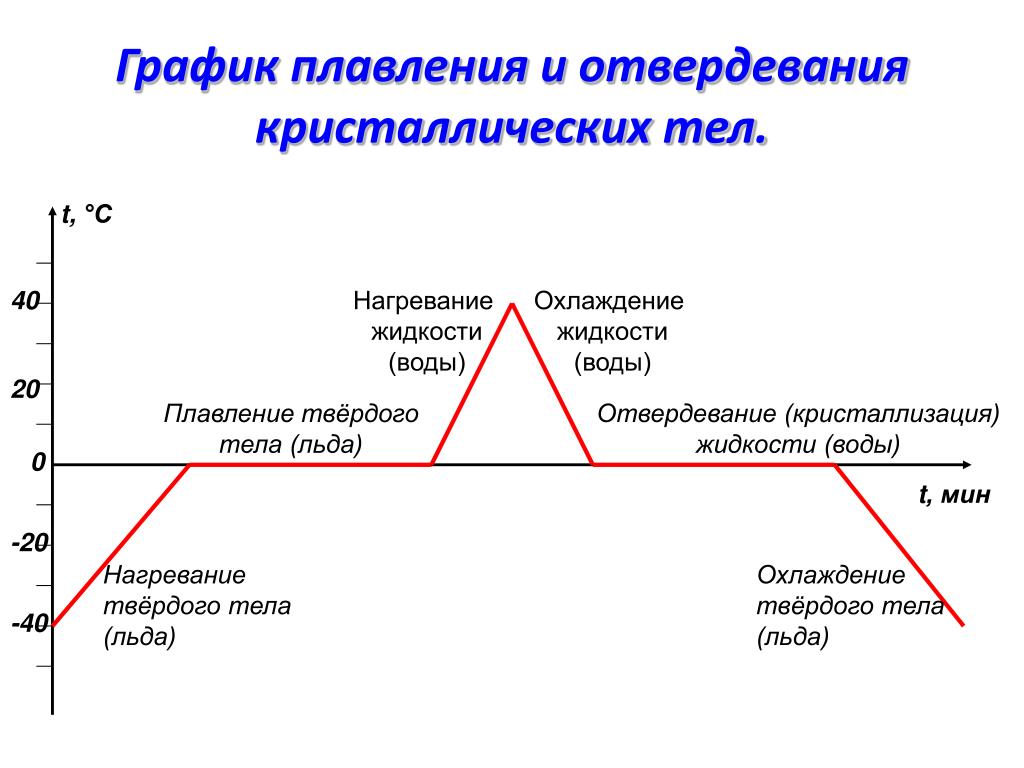
«Механизм фазового перехода из аморфного состояния в кристаллическое на микроуровне в деталях до сих пор не изучен, — поясняет Цойх. — Мы можем сравнивать наши экспериментальные данные только с теоретическими предсказаниями — и в данном случае согласование оказалось замечательно хорошим. Теперь, отталкиваясь от нынешних результатов, мы вместе с химиками-теоретиками сможем продолжить изучение фазового перехода и, в частности, попытаемся выяснить, насколько быстро он происходит».
Работа Бака и коллег попадает в категорию «чисто фундаментальных», хотя кое-какие практические перспективы у нее тоже есть. Авторы не исключают, что в будущем созданная ими технология изучения водяных кластеров, позволяющая видеть различия при добавлении нескольких молекул, может оказаться востребованной и в прикладных областях. «В своей статье мы описали все ключевые компоненты технологии, так что в принципе ее вполне можно приспособить для изучения кластеров из других нейтральных молекул. Впрочем, основные принципы устройства лазера были понятны еще в 1917 году, а первый лазер был создан только в 1960-е», — предостерегает от излишнего оптимизма Цойх.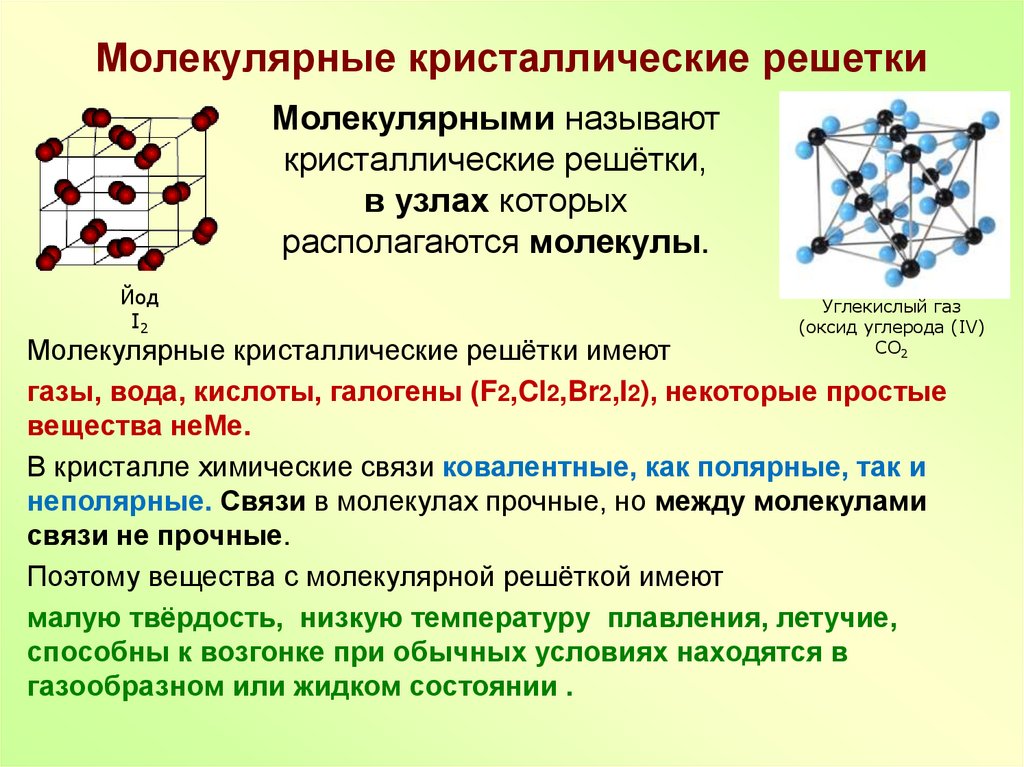
По применению — МЕТТЛЕР ТОЛЕДО
Лабораторное взвешивание
Измерение плотности с помощью лабораторных весов, подготовка проб для титрования, тестирование выбросов — гравиметрическое определение твердых частиц, определение нелетучих остатков — гравиметрическое определение содержания NVR, определение содержания влаги, остатка пестицидов Тестирование – подготовка точных стандартов, разработка рецептур и производство точных рецептур, элементный анализ CHNSO – подготовка проб, анализ следовых количеств металлов: подготовка проб и стандартов, подготовка буферов – решения, расчет и решение общих проблем, подготовка культуральных сред, статистический контроль качества в лабораториях, Автоматическое дозирование растворителя, Автоматическое дозирование порошка, Заполнение капсул, Высокопроизводительные эксперименты (HTE) — роботизированная подготовка проб, хроматографический анализ — подготовка проб и стандартов, ситовой анализ
Лабораторные аналитические приложения
Приложения для термического анализа, определения температуры плавления и каплепадения, титрования, измерения pH, определения содержания влаги, измерения плотности, определения показателя преломления, УФ/видимого излучения
Приложения AutoChem
Химический синтез, кристаллизация и осаждение, разработка и масштабирование химических процессов, безопасность химических процессов, технологическая аналитическая технология (PAT), распределение частиц по размерам, размер частиц в рецептурах, параллельный синтез, ферментация и биотехнология, проточная химия, рамановская спектроскопия, FTIR-спектроскопия
Приложения для анализа технологических процессов
Биотехнологические и гигиенические процессы, химические процессы, анализ технологических и складских газов, очистка воды (Thornton), применение сточных вод, производство перчаток
Промышленные приложения для взвешивания
Дозирование, составление рецептуры, взвешивание в опасных зонах, взвешивание в движении, контрольное взвешивание с превышением/недостатком, простое взвешивание, статистический процесс и контроль качества, валидация, весоизмерительная ячейка/бункер, взвешивание в бункерах и емкостях, взвешивание во влажных зонах, почтовые приложения, покраска — Смесительные весы, Автоматическое определение веса, Перевалка сыпучих материалов, Контроль качества в процессе производства, Калибровка приборов/расходомеров, Высокоточное взвешиваниеПриложения для транспорта и логистики
Взвешивание грузовых автомобилей, взвешивание на железнодорожном транспорте, планирование упаковки и загрузки, складские весы, возврат доходов, отгрузка и декларирование, сортировка и отслеживание Проверка качества содержимого и упаковки, отслеживание и сериализация, статистический процесс и контроль качества, приложения для проверки этикеток
Розничная торговля
Свежие продукты, прилавок свежих продуктов, подсобные помещения, пекарни, кассы, специализированные
Жидкие кристаллы превращают капли воды в «драгоценные камни», исследования Penn Research показывают
Жидкие кристаллы — это замечательные материалы, сочетающие оптические свойства кристаллических твердых тел со свойствами текучести жидкостей, характеристиками, которые объединяются для обеспечения работы дисплеев, используемых в большинстве компьютерных мониторов, телевизоров и смартфонов.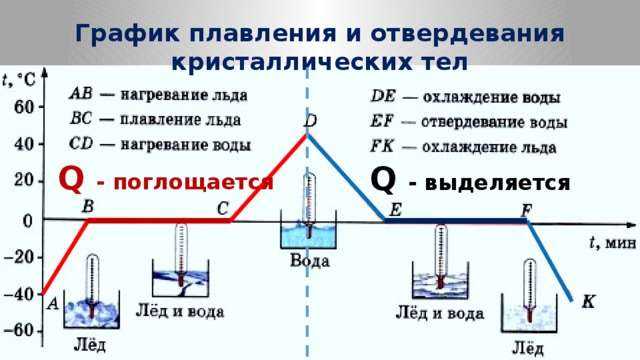
В исследовании, опубликованном в Proceedings of the National Academy of Sciences, исследователи из Пенсильванского университета и Swarthmore College описывают новое исследование типа жидких кристаллов, которые растворяются в воде, а не избегают ее, как маслянистые жидкие кристаллы, обнаруженные в воде. дисплеи. Это свойство означает, что эти жидкие кристаллы обладают потенциалом для биомедицинских применений, где их изменяющиеся внутренние структуры могут сигнализировать о присутствии специфических белков или других биологических макромолекул.
Исследователи поместили эти жидкие кристаллы в капли воды, которые, в свою очередь, были помещены в масло, образуя эмульсию. При достаточно высоких концентрациях внутри капель жидкие кристаллы демонстрируют извилистую структуру, видимую под оптическим микроскопом.
Однако при еще более высоких концентрациях жидкие кристаллы проявляют еще более необычное поведение: составляющие их молекулы складываются в столбцы, которые организуются в кристаллоподобные структуры и превращают обычно сферические капли воды в ограненные жидкие драгоценные камни.
Исследованием руководили научный сотрудник Джунву Чон и аспирантка Зои Дэвидсон, члены исследовательской группы Арджуна Йода в Пенсильвании. Йод руководит Лабораторией исследования структуры материи и является профессором кафедры физики и астрономии Школы искусств и наук. Завершают сотрудничество Том Лубенски, также профессор кафедры физики и астрономии Пенна, и Питер Коллингс, профессор кафедры физики и астрономии в Суортморе.
«Наша долгосрочная цель, — сказал Йод, — состоит в том, чтобы лучше понять и контролировать эту жидкокристаллическую систему, чтобы использовать ее возможности для создания новых полезных материалов. Исследования с этим типом жидких кристаллов находятся на той же стадии, что и жидкие кристаллы для дисплеев в начале 70-х годов. Первые дисплеи были ограничены до тех пор, пока их свойства не были полностью поняты».
Тип жидких кристаллов, которые исследователи исследовали в этом исследовании, — лиотропные хромоновые жидкие кристаллы или LCLC.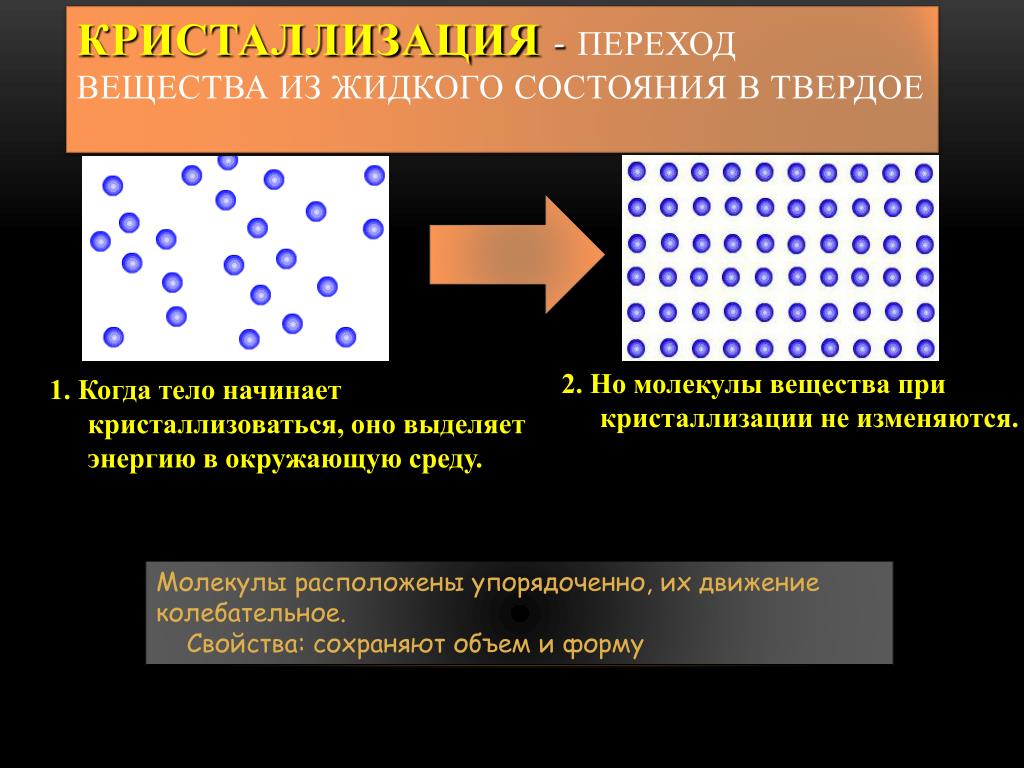 Они содержат органические соли, широко известные как «желтый закат» или «желтый 6», широко используемый пищевой краситель, содержащийся в апельсиновой газировке, закусках со вкусом сыра и многих других продуктах.
Они содержат органические соли, широко известные как «желтый закат» или «желтый 6», широко используемый пищевой краситель, содержащийся в апельсиновой газировке, закусках со вкусом сыра и многих других продуктах.
При попадании в воду отдельные молекулы красителя складываются, как фишки для покера, образуя микроскопические палочки. Затем жидкокристаллические капли воды смешивают с масляной суспензией вместе с мылоподобными поверхностно-активными веществами. Один конец притягивается к воде, а другой отталкивается от нее, и молекулы поверхностно-активного вещества перемещаются к поверхности капли, когда она погружена в масло. Это помогает стабилизировать каплю в виде сферы, которая является оптимальной формой для минимизации поверхностной энергии.
Как только капли попадают в масляную эмульсию, стержни взаимодействуют друг с другом, образуя различные типы выровненных фаз. В отличие от жидких кристаллов, присутствующих в дисплеях, фазы или узоры, образованные лиотропными жидкими кристаллами, зависят от их концентрации. Чтобы варьировать концентрацию LCLC, исследователи начали с разных концентраций молекул красителя в каплях и позволили концентрации увеличиваться дальше по мере диффузии воды из капель.
Чтобы варьировать концентрацию LCLC, исследователи начали с разных концентраций молекул красителя в каплях и позволили концентрации увеличиваться дальше по мере диффузии воды из капель.
При достаточно высоком уровне концентрации стержни сближаются настолько, что начинают выстраиваться параллельно друг другу, образуя то, что известно как «нематическая» фаза. Это дает капле четко очерченную ось север-юг, проходящую через ее центр. Стержни вблизи этой оси выстраиваются параллельно, пока не дойдут до двух «полюсов», где стержни не ориентированы друг относительно друга.
Этот паттерн возникает из-за тенденции жидкого кристалла перестраиваться в «самое легкое» состояние с наименьшей энергией. И, подобно жидким кристаллам в дисплеях, на это состояние могут влиять внешние эффекты, и результирующее поведение может быть использовано для приложений.
«Большая часть работы, которая проделана для понимания этих типов жидкокристаллических систем, — сказал Коллингс, — состоит в том, чтобы положить на них два конкурирующих влияния, таких как естественная тенденция молекул идеально выстраиваться в линию против некоторого ограничения или внешнего ограничения». поле с надписью «Мы не позволим вам это сделать»» 9.0003
поле с надписью «Мы не позволим вам это сделать»» 9.0003
Удержанием в данном случае является сферическая поверхность капли.
«Стержни хотят выстроиться параллельно друг другу, — сказал Чон, — но они также хотят выровняться с границей падения, и они не могут делать то и другое одновременно. При этом стержни должны подвергаться деформации. Интересно, что в данном случае они изгибаются, чтобы приспособиться к такому заключению».
Это скручивание не меняет форму отдельных стержней, которые остаются прямыми, а меняет ориентацию стержней относительно друг друга. Если смотреть на каплю так, чтобы стержни были направлены вертикально вдоль ее оси, то это закручивание происходит по линиям от оси к поверхности капли. Подобно прищепкам, прикрепленным к этим линиям, отдельные стержни могут поворачиваться из своего первоначального вертикального положения, скручиваясь в среднем более чем на 9 раз.0 градусов.
Большинство жидких кристаллов на масляной основе, встречающихся в дисплеях, одинаково реагируют на такое ограничение в том смысле, что они образуют центральную ось с двумя полюсами, но отличаются тем, что не отклоняются от этой оси.
«Это означает, что, в отличие от жидких кристаллов дисплея, все, что мы делаем с этими LCLC, должно учитывать этот поворот», — сказал Коллингс.
Эти узоры зависят от свойств поверхности капли, поэтому на скручивание стержней могут влиять внешние молекулы, которые прикрепляются к поверхности и изменяют ее граничные условия.
«Это свойство LCLC позволяет им быть детекторами, — сказал Йод. «Небольшие изменения на молекулярном уровне могут вызвать изменения в структуре жидких кристаллов, которые видны под микроскопом».
Однако по мере дальнейшего увеличения концентрации капель жидкий кристалл переходит из нематической фазы в «столбчатую» фазу, в которой стержни собираются вместе, как пучки соломинок. Эта упаковка предотвращает скручивание стержней, поэтому они реагируют на сигнал с поверхности капли, выстраиваясь в ряды столбцов, держась параллельно границе и вращаясь вокруг центральной оси капли.
В столбчатой фазе упорядоченная внутренняя структура жидкого кристалла создает среду, в которой сфера больше не является оптимальной формой для минимизации поверхностной энергии капли.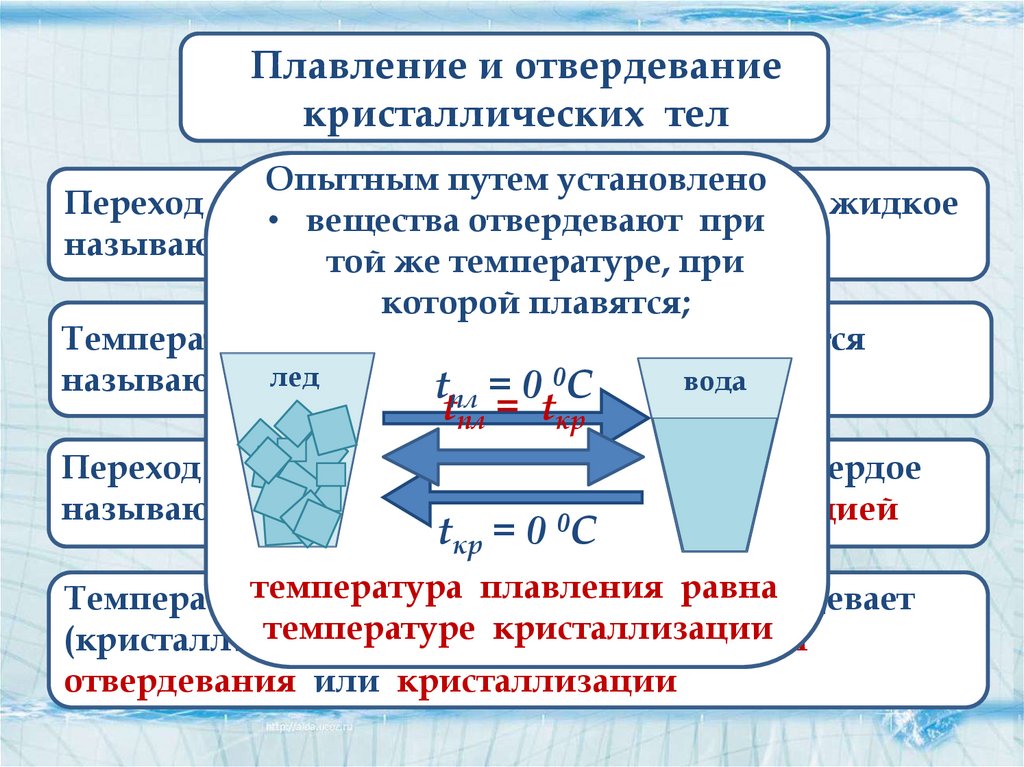

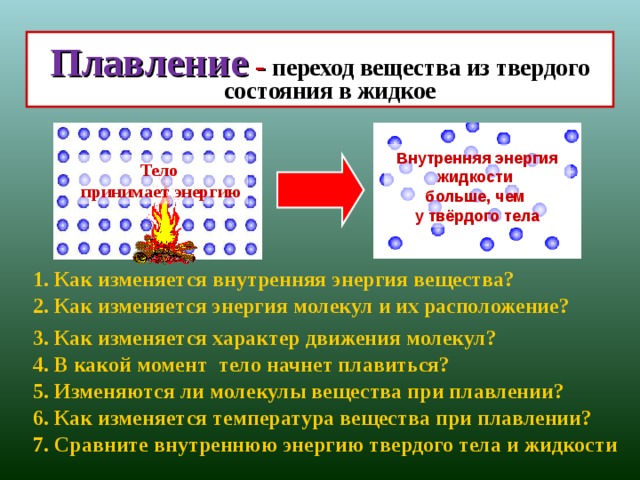

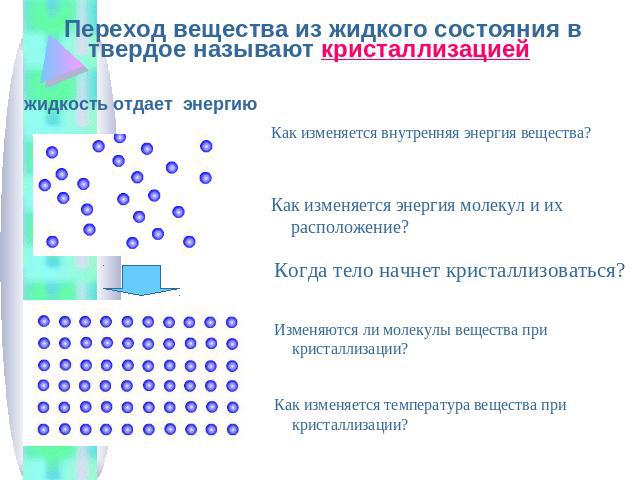
 Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Чем крупнее животное, тем глубже от него след, следовательно, тем большее давление оно оказывает на снег. Следы собаки более глубокие, чем следы её щенков. Мыши, ласки оставляет неглубокие чёрточки. Природа снабдила копытных животных способностью раздвигать копыта и увеличивать площадь опоры. Это помогает им зимой при передвижение по заснеженному лесу и полям не так глубоко погружаться в снег.
Leave A Comment