Гексан (C6h24): физические и химические свойства, строение, применение, токсичность — наука
Видео: Полное сгорание гексана (C6h24) Сбалансированное уравнениеСодержание
- Физические и химические свойства гексанов
- Внешний вид
- 9000 6 Молярная масса
- Запах
- Порог запаха
- Плотность
- Температура плавления
- Температура кипения
- Температура воспламенения
- Растворимость в воде
- Растворимость в растворителях 900 05 Относительная плотность пара с воздухом
- Коэффициент распределения октанол/вода
- Давление пара
- Длина волны максимальной оптической плотности
- Показатель преломления
- Вязкость
- Теплоемкость
- Теплота сгорания
- Теплота парообразования
- Поверхностное натяжение
- Потенциал ионизации 900 09
- Стабильность
- Реакционная способность
- Структура гексана
- Межмолекулярные взаимодействия
- Изомеры
- Применение
- Токсичность
- Вдыхание и контакт
- Безопасная доза
- Список литературы 141
Гексан
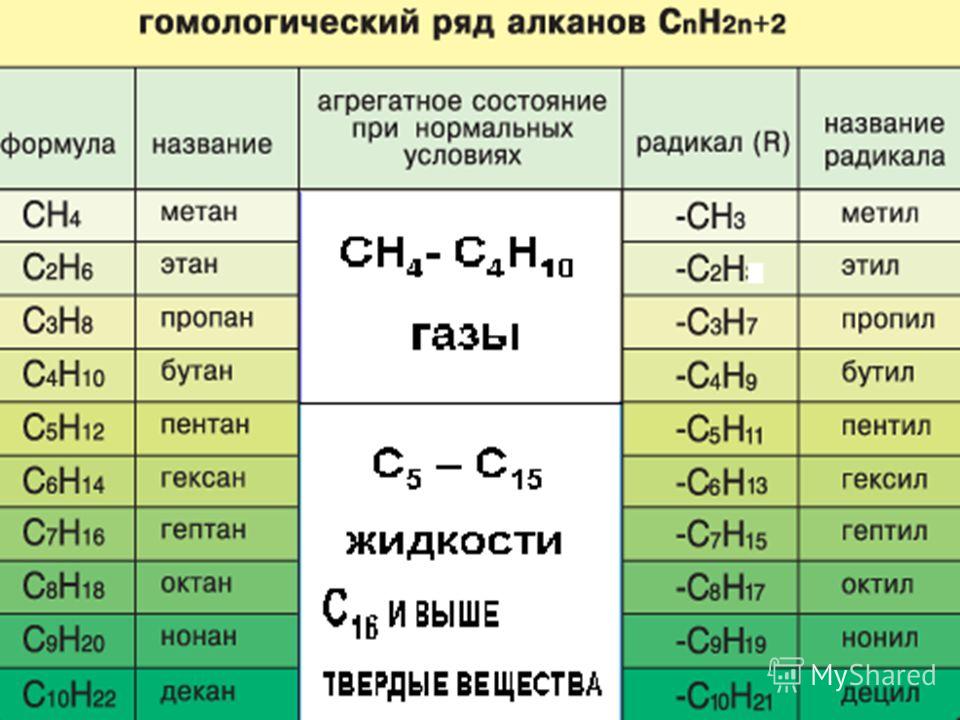
представляет собой углеводород, характеризующийся тем, что он является органическим соединением, сокращенная химическая формула которого C 6 H 14 . Это бесцветная прозрачная жидкость, которую нельзя смешивать с водой. Он имеет пять изомеров, являясь линейным одним из наиболее важных парафиновых углеводородов в промышленности и исследованиях.
Это бесцветная прозрачная жидкость, которую нельзя смешивать с водой. Он имеет пять изомеров, являясь линейным одним из наиболее важных парафиновых углеводородов в промышленности и исследованиях.Гексан получают фракционной перегонкой сырой нефти. Точно так же он естественным образом присутствует в цитрусовых и в летучих фракциях различных растений или фруктов, таких как яблоко, гуава, жареный фундук, сладкий картофель и шалфей.
Это легковоспламеняющаяся летучая жидкость, содержащаяся в бензине, быстросохнущих клеях и резиновом клее. Гексан используется в качестве растворителя в процессе экстракции растительных масел, а также липидов и жиров, присутствующих в загрязненной воде и почве.
У лиц, профессионально контактирующих с гексаном, может наблюдаться поражение периферической нервной системы, проявляющееся покалыванием и судорогами в ногах и руках; помимо генерализованной мышечной слабости и, в тяжелых случаях, атрофии скелетных мышц.
Физические и химические свойства гексанов Внешний видБесцветная, прозрачная и легколетучая жидкость.
Молярная масса
86,178 г/моль
ЗапахАналогичен бензину
Порог запаха1,5 ppm
Плотность 901 42 0,6606 г/мл Температура плавленияот -96 до -94 ºC
Температура кипенияот 68,5 до 69,1 ºC
точка воспламенения-22 ºC (закрытый тигель).
Растворимость в воде9,5 мг/л (практически не смешивается с водой)
Растворимость в растворителяхХорошо растворим в этаноле, растворим в этиловом эфире и хлороформе. Смешивается со спиртом, хлороформом и эфиром.
Относительная плотность пара с воздухом2,97 (воздух = 1)
Коэффициент распределения октанол/водаLog P = 3,764
900 02 Давление пара17,60 кПа при 20 °C
Длина волны максимальной оптической плотности200 нм
Показатель преломления1,375
Вязкость0,3 мПа·с
Кал емкость265,2 ДжК -1 Моль -1
Теплота сгорания4163,2 кДж моль -1
Теплота парообразования31,56 кДж моль -1
Поверхностное натяжение17,89 мН/м при 25 ºC
Потенциал ионизации10,18 эВ
СтабильностьСтабильность.
Реакционная способность Несовместим с окислителями, хлором, фтором, перхлоратом магния. Образует взрывоопасную смесь с воздухом.
Несовместим с окислителями, хлором, фтором, перхлоратом магния. Образует взрывоопасную смесь с воздухом.Гексан может энергично реагировать с окислителями, такими как жидкий хлор, концентрированный кислород, гипохлорит натрия и гипохлорит кальция. Он также несовместим с четырехокисью азота. Гексан может разрушать некоторые виды пластмасс, резины и покрытий.
Структура гексана Межмолекулярные взаимодействияПервое изображение показывает молекулу N -Hexane, представленное моделью сферов и баров. Черные сферы соответствуют атомам углерода, составляющим зигзагообразный углеродный скелет, а белые сферы — атомам водорода. Следовательно, n -гексан представляет собой углеводород, линейный и высокодинамичный.
Поскольку все его связи C-H имеют низкую полярность, у молекулы отсутствует дипольный момент. При этом их межмолекулярные взаимодействия носят не диполь-дипольный характер, а зависят исключительно от молекулярной массы и лондоновских дисперсионных сил.

Каждая молекула н -гексана «укладывается» одна поверх другой при очень низких температурах, как и следовало бы предположить по ее кристаллической структуре. С другой стороны, в жидкости их скелеты изгибаются и вращают свои связи C-H, в результате чего указанная жидкость становится летучей и кипит при 68,7 ºC.
ИзомерыУглеводородный гексан фактически состоит из пяти изомеров, из которых n -гексан является наименее разветвленным, (1). Остальные четыре изомера в порядке возрастания:
2-метилпропан (2)
3-метилпропан (3)
2,2-диметилбутан (4)
2,3-диметилбутан (5)
Также обратите внимание, что структуры становятся более разветвленными из (1) к (5). Будучи более разветвленным, дисперсионные силы уменьшаются, так как больше нет линейных участков, которые эффективно стыкуются. Это приводит к снижению и изменению температур кипения изомеров; хотя некоторые допустимые расхождения наблюдаются.

И 2-метилпропан (т. кип. = 60,3 °С), и 3-метилпропан (т. кип. = 63,3 °С) одинаково разветвлены, но температуры кипения у них разные. Затем следует 2,3-диметилбутан (peb = 58 ºC), чтобы, наконец, определить 2,2-диметилбутан как наиболее летучую жидкость (peb = 490,7 ºС).
Области примененияГексан смешивают с аналогичными химическими веществами для получения растворителей. Среди названий, данных этим растворителям, технический гексан, смешанные гексаны и т. д. Они используются в качестве чистящих средств в текстильной, мебельной и глубокой полиграфической промышленности.
Гексан входит в состав клеев, используемых для гидроизоляции крыш, обуви и кожи. Он также используется для переплета книг, формования пилюль и таблеток, консервирования, изготовления шин и бейсбольных мячей.
Гексан используется при определении показателя преломления минералов и заливочной жидкости для термометров вместо ртути; обычно с красным или синим оттенком.
 Он также используется при экстракции жира и масла из воды для анализа ее загрязняющих веществ.
Он также используется при экстракции жира и масла из воды для анализа ее загрязняющих веществ.Гексан используется в качестве растворителя при экстракции масла из семян овощей, таких как соевые бобы, рапс или ежевика. Кроме того, его используют для обезжиривания деталей различного происхождения. Он используется при денатурации спирта, в методе анализа ВЭЖХ и в спектрофотометрии.
Токсичность Вдыхание и контактОстрая токсичность гексана относительно низка, хотя он является мягким анестетиком. Острое воздействие высоких концентраций гексана может вызвать при вдыхании легкое угнетение центральной нервной системы (ЦНС), проявляющееся головокружением, вертиго, легкой тошнотой и головной болью.
Также может вызывать дерматит и раздражение глаз и горла. Хроническое вдыхание гексана, связанное с трудовой деятельностью, может вызвать поражение периферической нервной системы (сенсомоторная полинейропатия).

Начальными симптомами являются покалывание и судороги в ногах и руках, за которыми следует мышечная слабость. В тяжелых случаях может возникнуть атрофия скелетных мышц, потеря координации и проблемы со зрением.
Токсичность гексана связана с образованием метаболита гексан-2,5-диона. Это вступает в реакцию с аминокислотой лизин боковой цепи белка, вызывая потерю функции белка.
Безопасная дозаАгентство по охране окружающей среды (EPA) рассчитало референтную концентрацию (RfC) для гексана, равную 0,2 мг/м 3 , а референтная доза (Рд) 0,06 мг/кг массы тела/сут.
В 1960-х и 1970-х годах у группы рабочих японской обувной промышленности было выявлено наличие нервных расстройств. Причина заключалась в том, что они дышали гексановой атмосферой с концентрацией 500-2500 частей на миллион по 8-14 часов в сутки.
У рабочих проявились известные симптомы хронического вдыхания гексана, обнаружившие у врачей повреждение нервов, управляющих мышцами рук и ног.
Ссылки
- Даниэль Рид. (2019). Гексан: структура, формула и свойства. Изучать. Получено с: Study.com
- Национальный центр биотехнологической информации. (2019). гексан. База данных PubChem. CID = 8058. Получено с: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). гексан. Получено с: en.wikipedia.org
- Мир молекул. (с.ф.). Молекула гексана. Получено с: worldofmolecules.com
- Химическая книга. (2017). гексан. Получено с сайта:chemicalbook.com
- Содружество Австралии. (с.ф.). н-Гексан: Источники выбросов. Получено с: npi.gov.au
- EPA. (2000). гексан. [PDF]. Получено с: epa.gov
- Агентство регистрации токсичных веществ и заболеваний. (1999). Заявление об общественном здравоохранении для н-гексана. Получено с: atsdr.cdc.gov
Лабораторное моделирование химии межзвездных зерен и образования сложных органических молекул
NTRS
 lt-lg=»» routerlink=»/search» tabindex=»0″> NTRS — Сервер технических отчетов NASA
lt-lg=»» routerlink=»/search» tabindex=»0″> NTRS — Сервер технических отчетов NASAО нас Помощь Войти
Назад к результатамЛабораторное моделирование химии межзвездных зерен и образования сложных органических молекулЗа последние 15 лет был достигнут значительный прогресс в методах наблюдений в среднем инфракрасном диапазоне (от 5000 до 500 см(-1), от 2 до 20 микрон м), область спектра, наиболее диагностическая для молекулярных колебаний. Теперь доступны спектры многих различных астрономических источников инфракрасного излучения, некоторые из которых глубоко встроены в темные молекулярные облака. Эти спектры дают мощный инструмент для идентификации не только межзвездных молекул в обеих газовых и твердых фазах, но также и физических и химических условий, преобладающих в этих двух очень разных областях. Сравнивая эти астрономические спектры со спектрами лабораторных льдов, можно определить состав и содержание ледяных материалов, намерзших на холодных (10К) пылинках, находящихся внутри молекулярных облаков. Эти зерна и их ледяные покровы вполне могут быть строительными блоками, из которых состоят кометы. В качестве иллюстрации процессов, которые могут происходить при облучении и последующем нагревании льда, исследователи приводят инфракрасные спектры смеси h3O:Ch4OH:CO:Nh4:C6h24 (100:50:10:10:10). За исключением последнего вида, соотношение этих соединений характерно для простейших льдов, обнаруженных в межзвездных облаках. Последний компонент был включен в этот конкретный эксперимент в качестве индикатора поведения неароматического углеводорода. Показано изменение состава в результате ультрафиолетового фотолиза этой ледяной смеси с использованием УФ-лампы для имитации поля межзвездного излучения. При фотолизе образуются CO, CO2, Ch5, HCO, h3CO, а также семейство умеренно летучих углеводородов. Также производятся менее летучие углеродсодержащие материалы. Проиллюстрирована эволюция инфракрасного спектра льда при нагревании образца до комнатной температуры. Исследователи полагают, что изменения аналогичны тем, которые происходят при выбросе льда из кометы и нагревании солнечным излучением.
Эти зерна и их ледяные покровы вполне могут быть строительными блоками, из которых состоят кометы. В качестве иллюстрации процессов, которые могут происходить при облучении и последующем нагревании льда, исследователи приводят инфракрасные спектры смеси h3O:Ch4OH:CO:Nh4:C6h24 (100:50:10:10:10). За исключением последнего вида, соотношение этих соединений характерно для простейших льдов, обнаруженных в межзвездных облаках. Последний компонент был включен в этот конкретный эксперимент в качестве индикатора поведения неароматического углеводорода. Показано изменение состава в результате ультрафиолетового фотолиза этой ледяной смеси с использованием УФ-лампы для имитации поля межзвездного излучения. При фотолизе образуются CO, CO2, Ch5, HCO, h3CO, а также семейство умеренно летучих углеводородов. Также производятся менее летучие углеродсодержащие материалы. Проиллюстрирована эволюция инфракрасного спектра льда при нагревании образца до комнатной температуры. Исследователи полагают, что изменения аналогичны тем, которые происходят при выбросе льда из кометы и нагревании солнечным излучением. Последовательность прогрева показывает, что соединение, содержащее нитрил или изонитрил, образующееся во время фотолиза, испаряется при температуре от 200 до 250 К, что позволяет предположить, что оно переносится небольшими молекулами. Эти молекулы могут быть похожи на исходный материал кометы Галлея, который гранулами выбрасывается в кому, высвобождается путем сублимации и фотолизуется солнечным излучением, образуя наблюдаемые джеты.
Последовательность прогрева показывает, что соединение, содержащее нитрил или изонитрил, образующееся во время фотолиза, испаряется при температуре от 200 до 250 К, что позволяет предположить, что оно переносится небольшими молекулами. Эти молекулы могут быть похожи на исходный материал кометы Галлея, который гранулами выбрасывается в кому, высвобождается путем сублимации и фотолизуется солнечным излучением, образуя наблюдаемые джеты.Идентификатор документа
19 8264
Тип документа
Доклад конференции
Авторы
Allamandola, L. J.(НАСА, Исследовательский центр Эймса, Моффет Филд, Калифорния, США) 903 22
Sandford, S.A.(НАСА Эймс исследовательский центр Моффетт Филд , Калифорния, США)
Valero, G. J.(НАСА Эймс Исследовательский центр Моффет Филд, Калифорния, США)
Дата приобретения
6 сентября 2013 г.


 Это бесцветная прозрачная жидкость, которую нельзя смешивать с водой. Он имеет пять изомеров, являясь линейным одним из наиболее важных парафиновых углеводородов в промышленности и исследованиях.
Это бесцветная прозрачная жидкость, которую нельзя смешивать с водой. Он имеет пять изомеров, являясь линейным одним из наиболее важных парафиновых углеводородов в промышленности и исследованиях.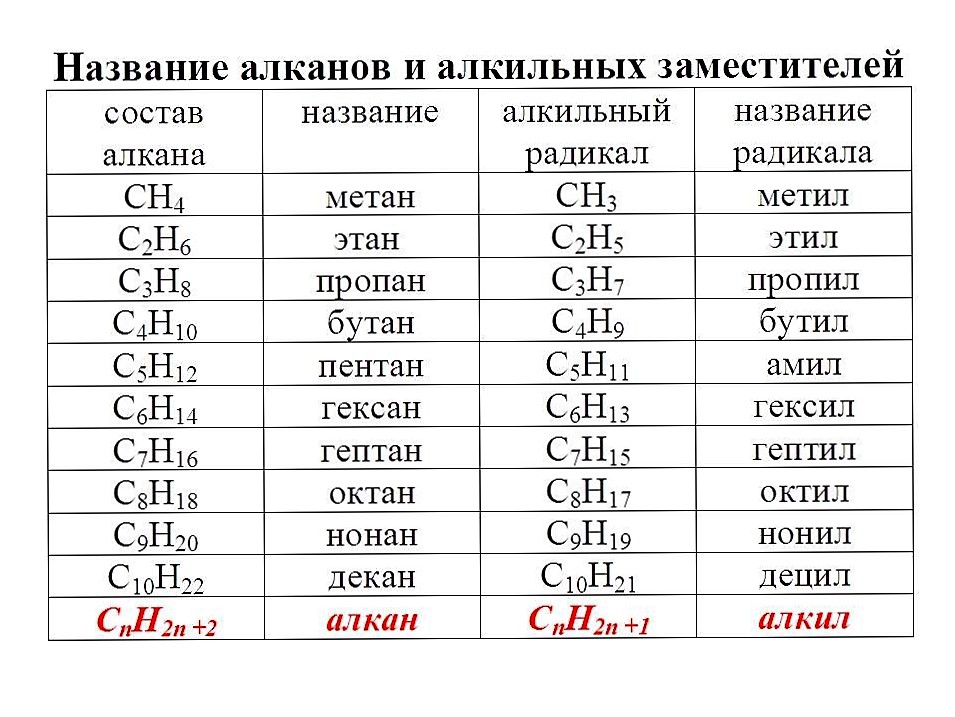
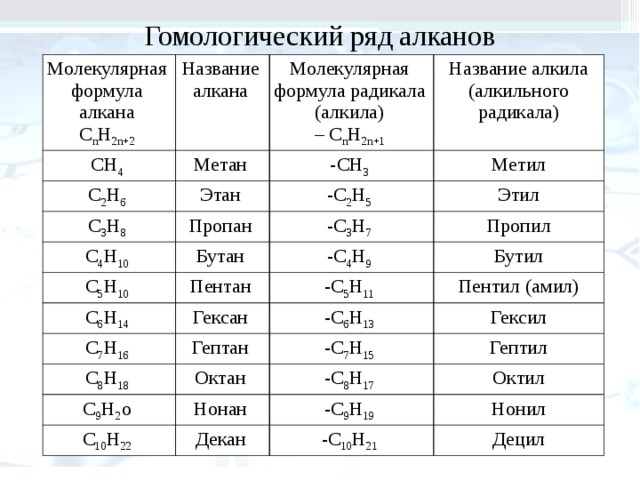 Несовместим с окислителями, хлором, фтором, перхлоратом магния. Образует взрывоопасную смесь с воздухом.
Несовместим с окислителями, хлором, фтором, перхлоратом магния. Образует взрывоопасную смесь с воздухом.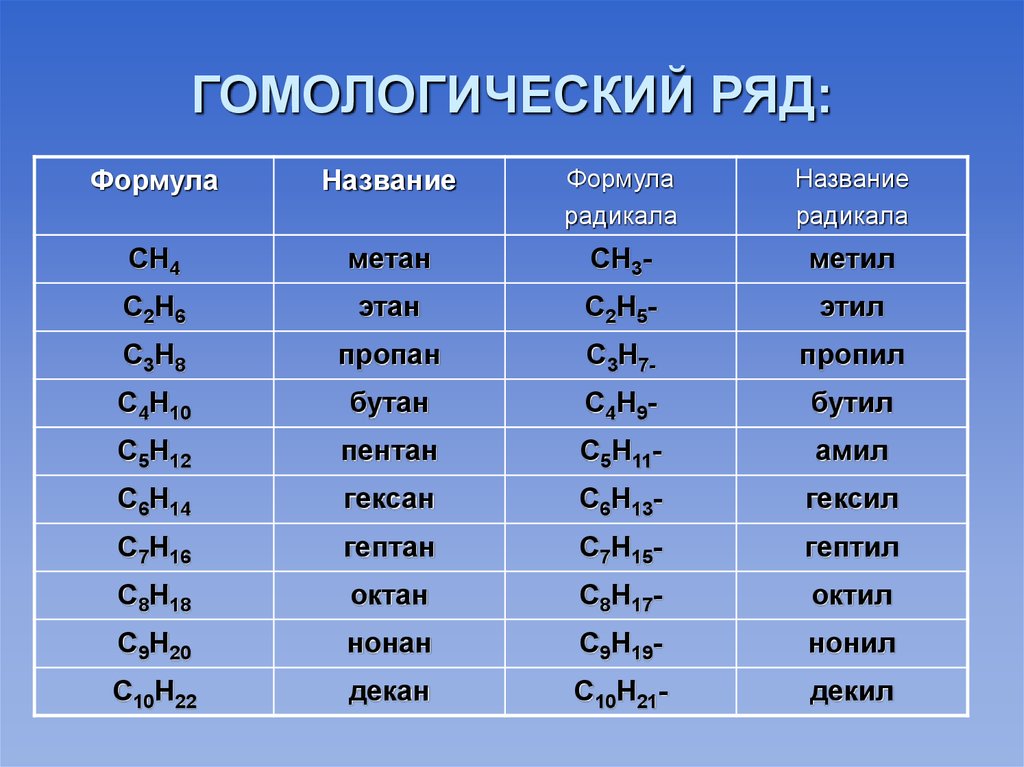
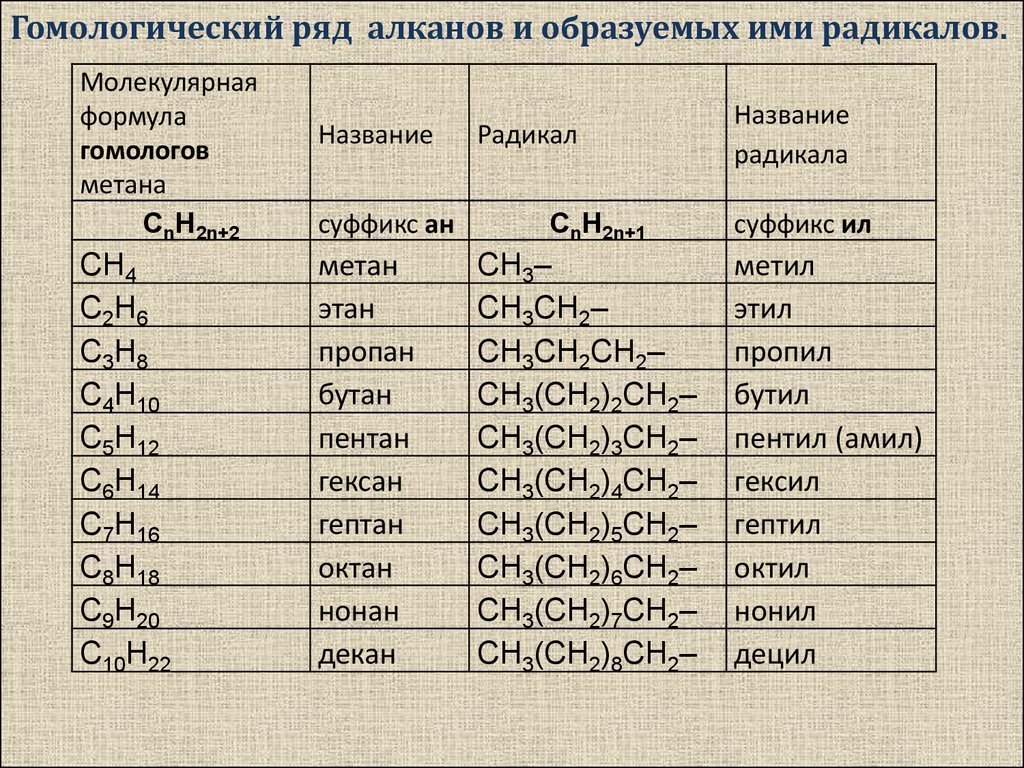
 Он также используется при экстракции жира и масла из воды для анализа ее загрязняющих веществ.
Он также используется при экстракции жира и масла из воды для анализа ее загрязняющих веществ.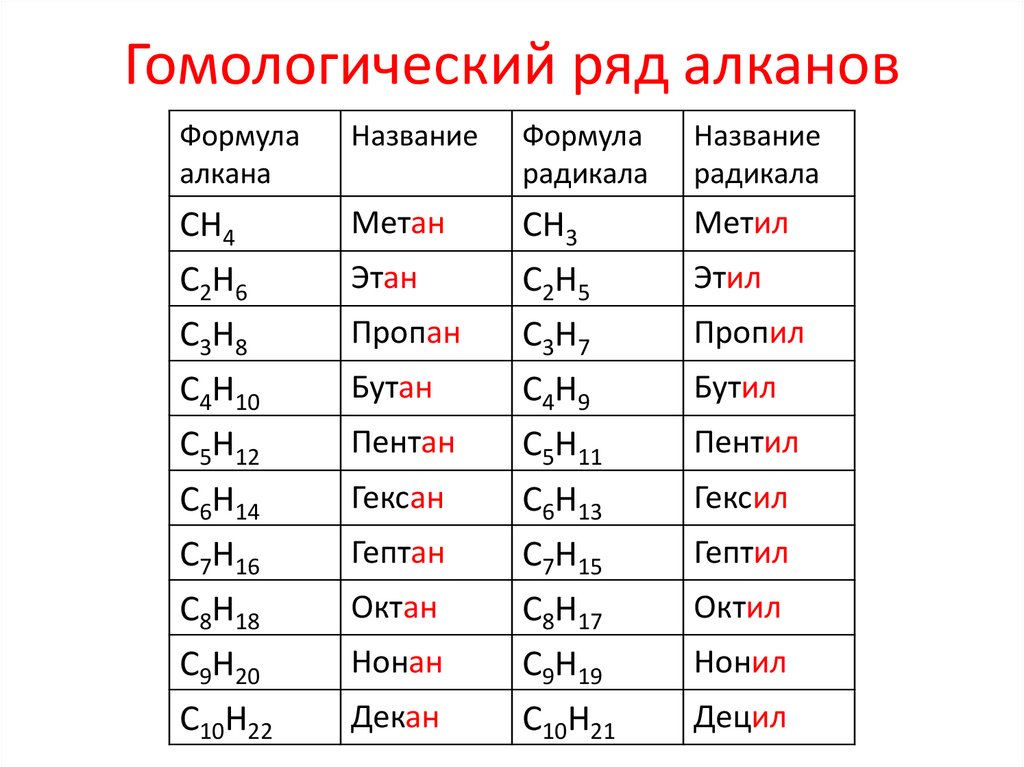
 lt-lg=»» routerlink=»/search» tabindex=»0″> NTRS — Сервер технических отчетов NASA
lt-lg=»» routerlink=»/search» tabindex=»0″> NTRS — Сервер технических отчетов NASA Эти зерна и их ледяные покровы вполне могут быть строительными блоками, из которых состоят кометы. В качестве иллюстрации процессов, которые могут происходить при облучении и последующем нагревании льда, исследователи приводят инфракрасные спектры смеси h3O:Ch4OH:CO:Nh4:C6h24 (100:50:10:10:10). За исключением последнего вида, соотношение этих соединений характерно для простейших льдов, обнаруженных в межзвездных облаках. Последний компонент был включен в этот конкретный эксперимент в качестве индикатора поведения неароматического углеводорода. Показано изменение состава в результате ультрафиолетового фотолиза этой ледяной смеси с использованием УФ-лампы для имитации поля межзвездного излучения. При фотолизе образуются CO, CO2, Ch5, HCO, h3CO, а также семейство умеренно летучих углеводородов. Также производятся менее летучие углеродсодержащие материалы. Проиллюстрирована эволюция инфракрасного спектра льда при нагревании образца до комнатной температуры. Исследователи полагают, что изменения аналогичны тем, которые происходят при выбросе льда из кометы и нагревании солнечным излучением.
Эти зерна и их ледяные покровы вполне могут быть строительными блоками, из которых состоят кометы. В качестве иллюстрации процессов, которые могут происходить при облучении и последующем нагревании льда, исследователи приводят инфракрасные спектры смеси h3O:Ch4OH:CO:Nh4:C6h24 (100:50:10:10:10). За исключением последнего вида, соотношение этих соединений характерно для простейших льдов, обнаруженных в межзвездных облаках. Последний компонент был включен в этот конкретный эксперимент в качестве индикатора поведения неароматического углеводорода. Показано изменение состава в результате ультрафиолетового фотолиза этой ледяной смеси с использованием УФ-лампы для имитации поля межзвездного излучения. При фотолизе образуются CO, CO2, Ch5, HCO, h3CO, а также семейство умеренно летучих углеводородов. Также производятся менее летучие углеродсодержащие материалы. Проиллюстрирована эволюция инфракрасного спектра льда при нагревании образца до комнатной температуры. Исследователи полагают, что изменения аналогичны тем, которые происходят при выбросе льда из кометы и нагревании солнечным излучением. Последовательность прогрева показывает, что соединение, содержащее нитрил или изонитрил, образующееся во время фотолиза, испаряется при температуре от 200 до 250 К, что позволяет предположить, что оно переносится небольшими молекулами. Эти молекулы могут быть похожи на исходный материал кометы Галлея, который гранулами выбрасывается в кому, высвобождается путем сублимации и фотолизуется солнечным излучением, образуя наблюдаемые джеты.
Последовательность прогрева показывает, что соединение, содержащее нитрил или изонитрил, образующееся во время фотолиза, испаряется при температуре от 200 до 250 К, что позволяет предположить, что оно переносится небольшими молекулами. Эти молекулы могут быть похожи на исходный материал кометы Галлея, который гранулами выбрасывается в кому, высвобождается путем сублимации и фотолизуется солнечным излучением, образуя наблюдаемые джеты.
Leave A Comment