Галогенпроизводные и гидроксильные соединения. Спирты и фенолы — СУНЦ МГУ
Тема 16. Галогеналканы
2 семестр. Лекция 01. Галогеналканы
Видеофрагмент лекции. Галогенпроизводные, ч.1. Знакомство с реакциями нуклеофильного замещения
Видеофрагмент лекции. Галогенпроизводные, ч.2. Замещение vs элиминирование
Качественная реакция на хлорорганику — проба Бельштейна. Видеоэксперимент от В.В. Загорского
БАЛЛАДА О НУКЛЕОФИЛЬНОМ ЗАМЕЩЕНИИ И КОНКУРИРУЮЩИХ РЕАКЦИЯХ В РАСТВОРЕ, РАССКАЗАННАЯ ОДНИМ ИЗ ГИДРОКСИЛОВ.
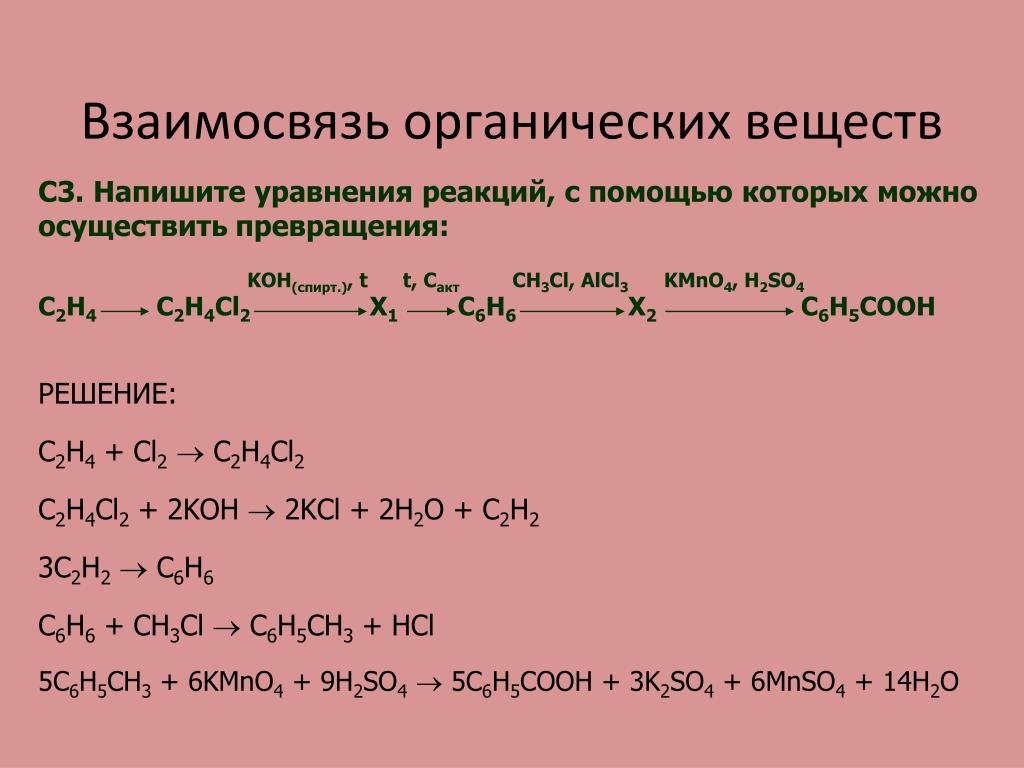
- Напишите уравнения реакций водного и спиртового растворов гидроксида калия с: а) бромэтаном, б) 1-бром-2-метилбутаном, в) 2-бром-3,4-диметил-3-этилпентаном, г) 1-бром-2,2-диметилбутаном.
- Написать структурные формулы веществ, которые могут преимущественно получаться при действии на бромэтан:
1 — аммиака
2 — металлического натрия при нагревании,
3 — гидросульфида натрия,
4 — сульфида натрия
5 — ацетата натрия
6 — толуола в присутствии хлорида алюминия?
- К 25 г бромида калия добавили 23 мл 40%-го водного раствора этилового спирта C2H5OH и 400 мл 10%-ной серной кислоты (плотности растворов кислоты и спирта считать равными 1 г/мл).
 При нагревании реакционной смеси собрали 16 г летучего продукта бромэтана. Напишите уравнение реакции. Определите выход бромэтана. Что будет наблюдаться, если перепутать порядок сливания реагентов — к сухому бромиду калия сначала добавить концентрированную кислоту и только потом — воду и спирт? Напишите уравнение реакции.
При нагревании реакционной смеси собрали 16 г летучего продукта бромэтана. Напишите уравнение реакции. Определите выход бромэтана. Что будет наблюдаться, если перепутать порядок сливания реагентов — к сухому бромиду калия сначала добавить концентрированную кислоту и только потом — воду и спирт? Напишите уравнение реакции. - Указать структурные формулы веществ А-Д в следующей цепочке превращений:1 моль Br2 КОН, t HBr NH
- При взаимодействии бромпроизводного, содержащего 35% углерода и 6,6% водорода (по массе), с раствором гидроксида калия образуется соединение, 210 мг которого при сгорании дают 660 мг углекислого газа и 270 мг воды. Предложите возможные формулы бромпроизводного и продукта его реакции с гидроксидом калия. В каких условиях протекала данная реакция?
- Задание ЕГЭ.
 При сгорании бескислородного органического вещества образуется 26,4 г углекислого газа, 5,4 г воды и 13,44 л хлороводорода (н.у.) Это вещество можно получить взаимодействием соответствующего углеводорода с избытком хлороводорода. На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции получения этого вещества из углеводорода (используйте структурные формулы органических веществ).
При сгорании бескислородного органического вещества образуется 26,4 г углекислого газа, 5,4 г воды и 13,44 л хлороводорода (н.у.) Это вещество можно получить взаимодействием соответствующего углеводорода с избытком хлороводорода. На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции получения этого вещества из углеводорода (используйте структурные формулы органических веществ). - Задание ЕГЭ. При сгорании органического вещества, не содержащего кислород, образуется 6,16 г углекислого газа, 1,08 г воды и 448 мл хлороводорода (н.у.). Это вещество можно получить взаимодействием на свету соответствующего углеводорода с хлором. На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции получения этого вещества из соответствующего углеводорода и хлора (используйте структурные формулы органических веществ).

- (Олимпиадная задача). Бесцветная летучая жидкость, воспламеняющаяся на воздухе, реагирует с третбутилхлоридом в эфире. Реакция приводит к образованию двух продуктов: газообразного при комнатной температуре предельного углеводорода и галогенида некоторого элемента с содержанием галогена 52,2% по массе. При бромировании образовавшегося углеводорода на свету образуется только одно монобромпроизводное.1) Определите все упомянутые соединения 2) Предложите метод синтезы исходной летучей жидкости 3) Приведите структурные формулы всех дибромпроизводных упомянутого предельного углеводорода.
Тема 17. Гидроксильные соединения. Одноатомные спирты
2 семестр. Лекция 02. Презентация. Свойства предельных одноатомных спиртов
Видеофрагменты лекций:
- Спирты. Классификация и названия
- Физические свойства спиртов. Роль водородных связей
- Химические свойства спиртов. Кислотность
- Химические свойства спиртов нуклеофильные реакции, элиминирование, окисление
- Методы получения спиртов
- Многоатомные спирты
- Физиологическое действие спиртов
- Простые эфиры
- Фенолы
Окисление этанола оксидом меди. Видеоэксперимент от В.В. Загорского
Видеоэксперимент от В.В. Загорского
5-1 Спирты
5-2 Химические свойства спиртов
- Сколько существует структурных изомеров C5H12O? Приведите формулы и названия двух, относящихся к разным классам.
- Напишите формулу простейшего третичного спирта с четырьмя первичными атомами углерода и назовите его. Приведите формулу изомера этого соединения, не являющегося спиртом.
- Напишите формулу простейшего третичного спирта с пятью первичными атомами углерода и назовите его. Приведите формулу изомера этого соединения, не являющегося спиртом.
- При сжигании предельного одноатомного спирта объем выделившегося CO2 в 8 раз больше объема водорода, выделившегося при действии избытка натрия на то же количество спирта. Определите формулу спирта, если известно, что он имеет 3 метильные группы.
- (Муниц 16-17) В образце предельного одноатомного спирта массой 18,50 г содержится суммарно 3,75 моль атомов C, H и O.
 Определите молекулярную формулу спирта и приведите его возможные структурные формулы. Установите структурную формулу искомого спирта, если при его дегидратации образуется алкен, имеющий геометрические изомеры. Приведите уравнение реакции дегидратации искомого спирта и укажите условия её проведения.
Определите молекулярную формулу спирта и приведите его возможные структурные формулы. Установите структурную формулу искомого спирта, если при его дегидратации образуется алкен, имеющий геометрические изомеры. Приведите уравнение реакции дегидратации искомого спирта и укажите условия её проведения. - Приведите структурные формулы геометрических изомеров продукта дегидратации искомого спирта.
- Составьте уравнения реакций по схеме:
C3H7ONa -> C3H8O -> C6H14O -> C6H13OCl
8. При нагревании 3-метилбутанола-1 (т.кип.130-132oС) с конц. серной кислотой отгоняется жидкость с т.кип. 20-39oС. Как можно объяснить это явление?
9. Полученное из глюкозы соединение А при реакции с натрием образует соединение C2H5NaO. При реакции А с концентрированной серной кислотой образуются два вещества — C2H4 и C4H10O, одно из которых реагирует с бромной водой и перманганатом калия.
10. Соединение А C5H12O реагирует с натрием и окисляется в C5H10O2. При реакции А с концентрированной серной кислотой при нагревании образуется единственный продукт C10H22O. Предложите структуру А и напишите схемы упомянутых реакций.
11. Органическое вещество Х устойчиво к действию нейтрального раствора перманганата калия, медленно реагирует с выделением водорода с металлическим натрием, быстро реагирует с концентрированной соляной кислотой, образуя при этом галогенпроизводное, содержащее 33% хлора. Установите структурную формулу вещества Х, назовите его по систематической номенклатуре и напишите уравнения приведенных превращений.
12. Вещество А представляет собой бесцветную жидкость со своеобразным запахом, легче воды и хорошо в ней растворяющуюся. При нагревании А с концентрированной серной кислотой образуется газ Б легче воздуха. При взаимодействии Б с HBr образуется тяжелая жидкость В. Приведите формулы А,Б,В и уравнения всех реакций.
При взаимодействии Б с HBr образуется тяжелая жидкость В. Приведите формулы А,Б,В и уравнения всех реакций.
13. Два газа А (простое вещество) и B (сложное вещество) вступают между собой в реакцию при температуре 300
14. Расположите в порядке возрастания кислотности следующие вещества: сероводородная кислота, 2-метилпропанол-2, соляная кислота, 2,2-дихлорэтанол, этанол.
15. Ментол (5-метил-2-изопропилциклогексанол) — кристаллическое вещество с мятным запахом, входит в состав сосудорасширяющего средства «валидол». Приведите структурную формулу ментола и напишите уравнения двух реакций с его участием.
16. На основании теории химического строения предскажите физические и химические свойства аллилового спирта (пропен-2-ола-1). Напишите уравнения соответствующих реакций.
17. Сколько летучих веществ (т. кип ниже 50oC) может получиться при нагревании смеси метилового и этилового спиртов с концентрированной серной кислотой?
18. Напишите схему реакций получения бутанола-2 из бутанола-1.
19. Вычислите массу простого эфира, который получится из 25г метанола, если реакция протекает с 80% выходом.
20. Из 18,4г этанола получено 6г простого эфира. Вычислите выход реакции.
21. Сколько мл этанола потребуется для получения 3 л этилена, если выход этилена составляет 40%, плотность этанола 0,8 г/мл, а объем газа приведен к нормальным условиям?
22. (ПП2394) Вычислите массовые доли веществ, которые получатся при добавлении 1,00 г воды к 75,0 г 6%-ного раствора этилата натрия в этаноле.
23. (ПП, 2394) Вычислите массы метанола и калия, которые надо взять, чтобы приготовить 10,0 г 5,00%-ного раствора метилата калия в метаноле.
24. Вычислите массовые доли веществ (в процентах), которые получатся при добавлении 9 мл воды к 816 г 5%-ного раствора этилата натрия в этаноле.
25. В 200 мл этилового спирта с массовой долей спирта 96% (плотность 0,80 г/мл) растворили 10 г металлического натрия. Рассчитайте массовые доли веществ в полученном спиртовом растворе.
26. Определите массовую долю метанола в водном растворе, содержащем 7,224*1023 атомов Н и 3,01*1023 атомов О.
27. При межмолекулярной дегидратации смеси двух одноатомных спиртов выделилось 10,8 г воды и образовалось 36 г смеси трех органических соединений в равных количествах, принадлежащих к одному классу (выход 100%). Определить строение исходных спиртов.
28. При межмолекулярной дегидратации смеси двух одноатомных спиртов выделилось 10,8 г воды и образовалось 46 г смеси трех органических соединений в равных количествах, принадлежащих к одному классу соединений. Каково строение исходных спиртов?
29. Чему равна массовая доля продукта окисления 60 г метанола оксидом меди при нагревании, если все вещества поглощены 140 г воды, а окисление прошло на 50%?
30. Смесь двух соседних членов гомологического ряда обработали натрием, при этом выделилось 8,96л газа (н.у.). При взаимодействии такого же количества этой смеси с HBr образуется 78.8г смеси бромалканов. Определите качественный и количественный (в граммах) состав исходной смеси.
Смесь двух соседних членов гомологического ряда обработали натрием, при этом выделилось 8,96л газа (н.у.). При взаимодействии такого же количества этой смеси с HBr образуется 78.8г смеси бромалканов. Определите качественный и количественный (в граммах) состав исходной смеси.
31. Для количественного дегидрирования 15,2г смеси двух предельных одноатомных спиртов потребовалось 24г CuO. На образовавшуюся смесь подействовали избытком аммиачного раствора оксида серебра и получили 86,4г осадка. Определите структуры спиртов и их количества в исходной смеси.
32. Оксид углерода (II) смешали с водородом в молярном соотношении 1:4 при давлении 10 МПа и температуре 327оС в замкнутом реакторе, предназначенном для синтеза метанола. После окончания процесса давление смеси в сосуде при неизменной температуре уменьшилось на 10%. Определите объемную долю паров метанола в реакционной смеси и вычислите процент превращения оксида углерода в метанол.
33. ДВИ 2015. Для полного окисления навески предельного спирта требуется 400 мл подкисленного раствора дихромата калия с концентрацией 0,15 моль/л. При количественном протекании реакции (выход 100%) масса продукта меньше массы исходного спирта на 1.72%. Установите строение и массу спирта и продукта окисления, если известно, что выход в реакции окисления составляет 80%, а при дегидратации спирта образуется только один неразветвленный алкен.
При количественном протекании реакции (выход 100%) масса продукта меньше массы исходного спирта на 1.72%. Установите строение и массу спирта и продукта окисления, если известно, что выход в реакции окисления составляет 80%, а при дегидратации спирта образуется только один неразветвленный алкен.
34. ДВИ 2017. При добавлении к некоторому количеству пентанола-1 насыщенного вторичного спирта масса увеличилась в 1.225 раза, а число атомов кислорода возросло на 33%. Установите формулу спирта. Какой объём подкисленного раствора перманганата калия с концентрацией 0.2 моль/л потребуется для полного окисления 21.56 г полученной смеси спиртов? Газ, образовавшийся при сжигании той же навески спиртов, пропустили через 5% раствор KOH с плотностью 1.04 г/мл и получили эквимолярную смесь солей. Определите объём использованного раствора щелочи.
35. При дегидратации 22,2 г предельного одноатомного спирта получена смесь двух изомеров в молярном соотношении 1:9. Побочного продукта было выделено 1,68 г. Установите строение исходного соединения.
Установите строение исходного соединения.
36. Органическое соединение А содержит 18,18% кислорода. Оно медленно реагирует с металлическим натрием, не изменяется под действием 2%-ного раствора перманганата калия, быстро реагирует с хлороводородом и при сгорании дает только оксид углерода (IV) и воду. Определить А.
37. Предельный одноатомный спирт массой 44,4 г обработали концентрированным раствором серной кислоты при нагревании. Внутримолекулярная дегидратация прошла с выходом 75,0%. Выделившийся газ пропустили через избыток нейтрального раствора перманганата калия, масса образовавшегося осадка составила 26,1 г. Установите строение спирта, если известно, что при его окислении образуется кетон.
38. Навеска смеси двух изомерных бутиловых спиртов массой 22,2 г была количественно подвергнута окислению в условиях, исключающих разрыв углеродной цепи. После окисления получено 23,2 г органических продуктов реакций. Установите количественный состав смеси. Если задача имеет несколько решений или условий недостаточно для установления строения взятых спиртов, проанализируйте эти решения и предложите простейшие дополнительные исследования, позволяющие выбрать однозначный ответ.
39. К 16,6 г смеси этилового и пропилового спиртов добавили избыток натрия. Выделившийся при этом водород смешали с 4,48 л аргона (н.у.) и получили смесь с плотностью по воздуху 0,818. Вычислите массовые доли спиртов в исходной смеси.
40. (химфак 99) В стальной сосуд емкостью3,75 л поместили 1,50 г ароматического спирта, являющегося гомологом бензилового спирта. Затем туда ввели 3,70 г кислорода (н.у.). После поджигания спирт полностью сгорел, при этом температура внутри сосуда достигла 327 градусов С, а давление составило 272,6 кПа. Определите формулу спирта и приведите структурные формулы четырех его ароматических изомеров.
41. (Менд. олимп. 1992, 3 тур). Штирлиц задумчиво разглядывал свой сейф, вскрытый Мюллером. Бутылка из-под французского коньяка — подарок Бормана — валялась пустая на полу. А ведь в ней был бесценный образец топлива ФАУ!
-Все-таки пьянство погубило тебя, Мюллер! — подумал Штирлиц, перешагнул через труп эсэсовца и, не обращая внимание на резкий, неуловимо знакомый запах, направился к выходу.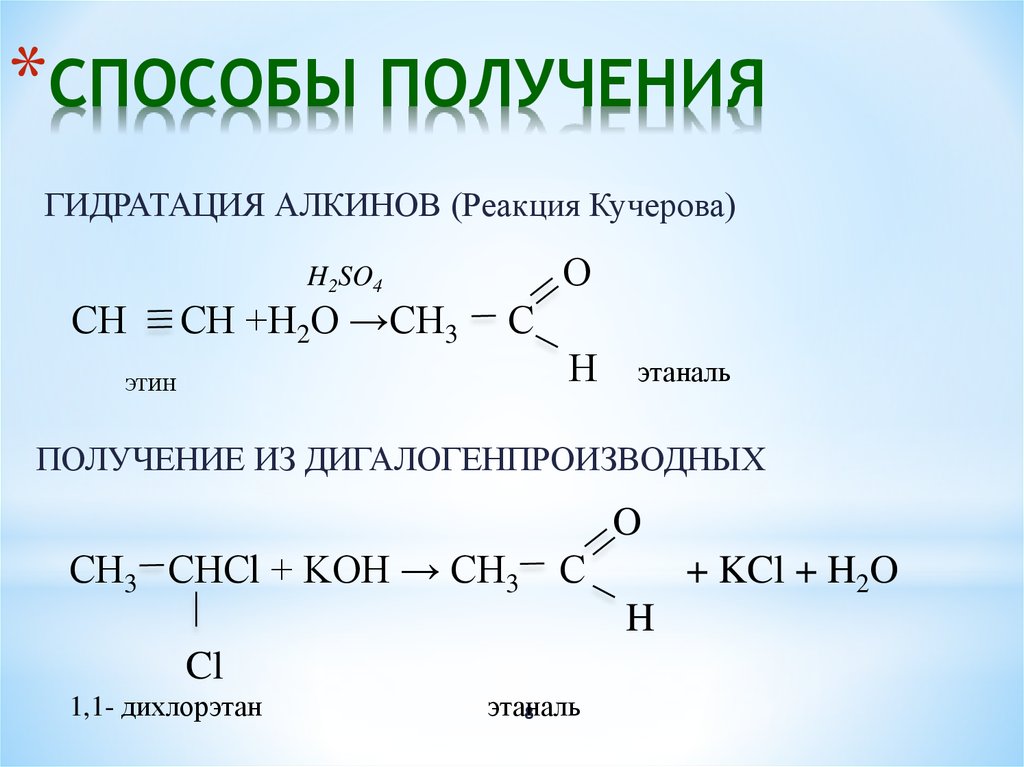
Штирлиц знал, что русская пианистка уже отправила в Центр шифровку с составом топлива:
Ц 2609
В 1301
Н 6090
Расшифруйте состав топлива ракеты ФАУ.
Тема 18. Многоатомные спирты, фенолы и простые эфиры
2 семестр. Лекция 03. Получение спиртов. Многоатомные спирты, фенолы и простые эфиры
5-3 Многоатомные спирты и фенолы
- Сравните физические и химические свойства п-крезола (п-метилфенола), гексадеканола-1 и сорбита (1,2,3,4,5,6-гексангексаола). Как различить эти вещества и разделить их смесь?
- Напишите схему получения глицерина из пропанола-1, указав над стрелкой необходимые реагенты и условия протекания реакций
- С какими из перечисленных ниже реагентов должен реагировать этиленгликоль :
1 — 10%-ная соляная кислота,
2 — 1%-ный водный раствор перманганата калия,
3 — 5%-ный водный раствор гидроксида калия,
4 — металлический натрий,
5 — гидроксид меди (II) в щелочном растворе,
6 — бромная вода (без действия света),
7 — раствор хлорида железа (III),
8 — конц. серная кислота при нагревании,
серная кислота при нагревании,
9 — бромоводород
4. Предложите способ разделения смеси бензола и бета-нафтола (2-гидроксинафталина, т.пл.97oС), предусмотрев выделение каждого из этих компонентов в индивидуальном состоянии. Как можно проконтролировать чистоту выделенных соединений? Ответ подтвердите необходимыми уравнениями реакций.
5. Какие вещества вступили в реакцию, и при каких условиях, если в результате образовались следующие вещества (указаны все продукты без коэффициентов):
1) С6H5OH + NaHCO3
2) CH3-O-C2H5 + NaI
Напишите полные уравнения реакций
- Расположите в порядке увеличения кислотности следующие соединения:
а) фенол, б) 4-нитрофенол, в) метанол, г) 2,4,6-тринитрофенол, д) 2,2-диметилпропанол, е) вода
- В трех пробирках без этикеток находятся фенол, глицерин, бутанол-1. Как, основываясь а) только на физических, б) только на химических свойствах, различить эти вещества?
- Предложите способ разделения смеси бензола и фенола, предусмотрев выделение каждого из этих компонентов в индивидуальном состоянии.
 Как можно проконтролировать чистоту выделенных соединений? Ответ подтвердите необходимыми уравнениями реакций.
Как можно проконтролировать чистоту выделенных соединений? Ответ подтвердите необходимыми уравнениями реакций. - Установите структурную формулу вещества У состава С7H8O, которое почти нерастворимо в растворе гидроксида натрия, не дает окрашивания с раствором хлорида железа (III), реагирует с металлическим натрием с выделением водорода, с бромоводородом образует соединение С7H7Br, обесцвечивает раствор перманганата калия, причем после подкисления реакционной смеси можно выделить соединение состава С7H6O2. Напишите уравнения реакций.
- Соединение А – белое кристаллическое вещество, окрашивающее пламя в фиолетовый цвет, хорошо растворимое в воде. При пропускании газа В через водный раствор вещества А происходит его помутнение, связанное с образованием малорастворимого в воде, но хорошо растворимого в щелочах вещества С, обладающего характерным запахов. Приведите формулы веществ А,В, С и напишите уравнения реакций.

- (ФББ-2005) Определите молекулярную формулу предельного многоатомного спирта, в 37,67 г которого содержится 16,62 г углерода.
- Какой объём 9,4%-ного раствора фенола в этаноле (плотность 0,9 г/мл) должен прореагировать с избытком металлического натрия, чтобы выделившимся водородом можно было полностью каталитически гидрировать ацетилен объёмом 2,56 л (н.у.)
- При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидроксида калия (плотность 1,4 г/мл). Определите массовые доли веществ в исходной смеси.
- ДВИ 2008 биофак. Вещество содержит 67,74% углерода по массе, 6,45% водорода и кислород. Установите возможное строение этого вещества, если известно, что образец массой 3,1 г может прореагировать со 100 мл 0,5М раствора гидроксида натрия или с 800 г 1,5%-ного раствора бромной воды.
- ДВИ 2008 ББ. Органическое соединение состава С10Н14О массой 7.
 5 г ввели в реакцию с избытком перманганата калия в присутствии серной кислоты. При этом выделилось 2,486 л газа (измерено при 22оС и 740 мм рт. ст.) Предложите возможную структурную формулу неизвестного органического соединения. Ответ обоснуйте.
5 г ввели в реакцию с избытком перманганата калия в присутствии серной кислоты. При этом выделилось 2,486 л газа (измерено при 22оС и 740 мм рт. ст.) Предложите возможную структурную формулу неизвестного органического соединения. Ответ обоснуйте. - Смесь ароматического углеводорода и фенола общей массой 14 г обработали бромной водой. При этом выпало 33,1 г осадка. Определите структурную формулу ароматического углеводорода, если известно, что он находился в исходной смеси в количестве 0,05 моль.
- При горении спирта образовались равные количества веществ воды и углекислого газа. К каким гомологическим рядам может относиться этот спирт?
- (Менд. олимп. 1992, 3 тур) Винни-Пух массой 1 кг захотел меда из дупла. Он взял 0,5 л напитка В, содержащего 40 объемных процентов компонента С, и после каталитической дегидратации С с выходом 50% получил вещество К. Из вещества К он приготовил нерастяжимую оболочку толщиной 0,05 мм. После этого Винни заполнил оболочку продуктом А, выделяющимся при взаимодействии дверной ручки с концентрированной щелочью.
 (Ручка полностью растворилась).
(Ручка полностью растворилась).
1) Опишите превращения С -> К -> оболочка.
2) Удалось ли Винни-Пуху стать тучкой? (плотность К=1)
19. (Менд. олимп. 1992, 3 тур).
-Да ты навоз со дна бери, который старый, с белой корочкой!
-Чтоб воняло меньше?
-Да нет, так у аптекаря в прописи. А купорос кипяти… Да с крышки маслом капай в навоз… Давай сюды портянки… Ну вот тебе и порох!
-Ну ты, Василий Иванович, голова!
-Да смотри, Петька, карболку в лохань лей тихо, студи лохань…
Вот тебе и шимоза!
-Конец теперь белым, Василий Иванович!
Опишите технологию, пользуясь уравнениями реакций.
Задачи на вывод формул органических веществ
Задачи №40. Вывод формулы органического вещества по реакции.
Часть 1. Углеводороды
1.1 При взаимодействии 1,74 г алкана с бромом образовалось 4,11
г монобромпроизводного. Определите молекулярную формулу алкана.
Определите молекулярную формулу алкана.
1.2 При действии брома на свету на неизвестный углеводород образуется единственное галогенпроизводное, плотность паров которого в 5,207 раз больше плотности воздуха при одинаковых условиях. Определите строение углеводорода.
1.3 Определить формулу алкена, если известно, что он имеет цис-транс изомеры, а 5,6 г его при присоединении воды образуют 7,4 г спирта.
1.4 При взаимодействии 0,672 л алкена (н.у.) с хлором образуется 3,39 г его дихлорпроизводного. Определите молекулярную формулу алкена, запишите его структурную формулу и название.
1.5 Алкен нормального строения содержит двойную связь при первом атоме углерода. 0,35 г этого алкена могут присоединить 0,8 г брома. Определите формулу алкена и назовите его.
1.6 Определите строение углеводорода, если известно, что его 8,4
г обесцвечивают бромную воду, присоединяют 3,36
л водорода в присутствии никелевого катализатора, а при окислении водным
раствором перманганата калия на холоду образует соединение симметричного строения.
1.7 Определите молярную массу и напишите структурные формулы всех возможных изомеров этиленового углеводорода, если известно, что 1,12 г его могут обесцветить 8 г 40-процентного раствора брома в хлороформе.
1.8 Какова структурная формула углеводорода ряда алкенов, если 1,4 г его реагируют с 4 г брома, а при окислении водным раствором перманганата калия образуется симметричный двухатомный спирт.
1.9 Алкен с неразветвленной углеродной цепью, который не существует в виде цис-транс изомеров, количественно присоединил 20,25 г бромоводорода. Полученный продукт обработали 54,5 мл раствора NaOH с массовой долей 10% и плотностью 1,1 г/см3, в результате чего получили 10,56 г соответствующего спирта. Определите структурные формулы исходного алкена и спирта, если превращение галогенпроизводного в спирт идёт с выходом 80%.
1.10
Установите молекулярную формулу алкена и продукта
взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет
относительную плотность по воздуху 4,24. Укажите название одного изомера
исходного алкена.
Укажите название одного изомера
исходного алкена.
1.11 При гидратации 8,96 л (н. у.) алкена получили 2,4 г первичного спирта и 21,6 г вторичного спирта. Установите строение исходного вещества.
1.12 Установите молекулярную формулу алкена, не имеющего геометрических изомеров, если известно, что 1,5 г его способны присоединить 0,6 л (н.у.) водорода. Запишите названия алкенов, удовлетворяющих условию задачи, дайте им названия.
1.13 При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного или 12,3 г бромпроизводного. Определите молекулярную формулу алкена.
1.14 При взаимодействии одного и того же количества алкена с галогенами образуется соответственно 11,3 г дихлорпроизводного или 20,2 г дибромпроизводного. Определите молекулярную формулу алкена, запишите его название и структурную формулу.
1.15
Установите молекулярную формулу алкена, гидратацией
которого получается спирт, пары которого в 2,07 раза тяжелее воздуха.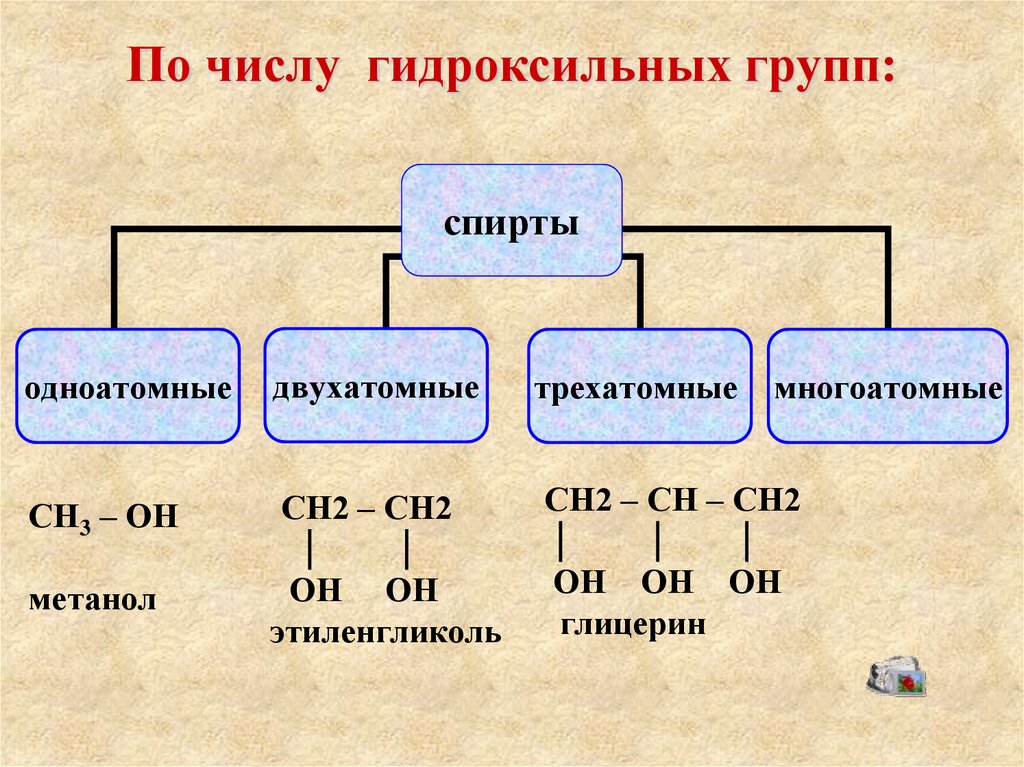
1.16 Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
1.17 Из дихлоралкана, массовая доля хлора в котором равна 62,8%, с 80%-м выходом был получен ацетиленовый углеводород объемом 500 мл (н. у.). Определите формулу алкина. Вычислите, какая масса дихлоралкана вступила в реакцию.
1.18 На полное гидрирование 2,8 г этиленового углеводорода израсходовано 0,896 л водорода (н.у.). Вычислите молярную массу и напишите структурную формулу этого соединения, имеющего нормальную цепь углеродных атомов.
1.19 Установите молекулярную формулу алкена, если известно, что 0,5 г его способны присоединить 200 мл (н.у.) водорода.
1.20 Установите молекулярную формулу алкена, взаимодействие которого с хлороводородом приводит к образованию монохлорпроизводного с относительной плотностью по азоту 3,3.
1. 21 Ацетиленовый углеводород может максимально
присоединить 80 г брома с образованием продукта реакции массой 97
г. Установите молекулярную формулу этого углеводорода.
21 Ацетиленовый углеводород может максимально
присоединить 80 г брома с образованием продукта реакции массой 97
г. Установите молекулярную формулу этого углеводорода.
1.22 Углекислый газ, образующийся при полном сгорании 0,1 моль алкана, при пропускании в избыток известковой воды дает 60 г белого осадка. Что это за алкан?
1.23 Какой газ находится в цилиндре, если известно, что он гомолог этилена и для полного сгорания 60 см3 этого газа требуется 270 см3 кислорода (н.у.)?
1.24 Для сжигания алкана объемом 20 л потребовался кислород объемом 160 л (н.у.). Установите, какой алкан вступил в реакцию.
1.25 Для сжигания порции алкана, содержащей 1∙1023 молекул, требуется порция кислорода, содержащая 1,6∙1024 атомов. Установите состав и возможное строение (все изомеры) алкана.
1.26
Углеводород
массой 2 г может прореагировать либо с 2,24
л водорода, либо с 16 г брома, либо с 1,15
г металлического натрия. Напишите формулу соединения
Напишите формулу соединения
Часть 2. Спирты и карбонильные соединения.
2.1 При взаимодействии 1,48 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 224 мл этилена (н.у.). Определите молекулярную формулу спирта.
2.2 При взаимодействии 30 г предельного одноатомного спирта с металлическим натрием выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу спирта.
2.3 При дегидратации предельного одноатомного спирта получили простой эфир с массовой долей водорода 13,73%. Определите молекулярную формулу исходного спирта.
2.4 При окислении предельного одноатомного спирта оксидом меди (II) получили 9,73 г альдегида, 8,65 г меди и воду. Определите молекулярную формулу исходного спирта.
2.5 Определить формулу предельного одноатомного спирта, если 8,8 г его может прореагировать с 8,1 г бромоводорода.
2.6 Предельный одноатомный спирт обработали
металлическим натрием. В результате реакции получили вещество массой 20,5
г и выделился газ объемом 2,8 л (н.у.). Определите молекулярную формулу
спирта.
В результате реакции получили вещество массой 20,5
г и выделился газ объемом 2,8 л (н.у.). Определите молекулярную формулу
спирта.
2.7 В результате реакции предельного одноатомного спирта с хлороводородом массой 18,25 г получили органический продукт массой 46,25 г и воду. Определите молекулярную формулу исходного спирта.
2.8 При нагревании предельного одноатомного спирта массой 12 г с концентрированной серной кислотой образовался алкен массой 6,3 г. Выход продукта составил 75%. Определите формулу спирта.
2.9 Какой одноатомный спирт был взят для реакции, если при взаимодействии 30 мл спирта (ρ=0,8 г/мл), с натрием выделился водород в количестве, достаточном для гидрирования 4,48 л этилена (н.у.).
2.10 Определить формулу предельного одноатомного спирта, если 4,4 г его можно получить при действии 1,12 л водорода на соответствующее карбонильное соединение.
2.11
Установите молекулярную формулу спирта, если при
нагревании 274 г этого спирта с концентрированной серной кислотой образуется 133,4
г непредельного углеводорода с одной двойной связью. Выход в реакции равен 80%.
Выход в реакции равен 80%.
2.12 Определите строение предельного одноатомного спирта, если известно, что при взаимодействии его с бромоводородом образуется вторичный алкилбромид, а при действии на 30 мл этого спирта (плотность 0,8 г/см3) избытком металлического натрия выделяется водород в количестве, достаточном для полного гидрирования 2,24 л (н.у.) дивинила.
2.13 Установите молекулярную формулу предельного одноатомного спирта, зная, что 18,5 г его в реакции с некоторым щелочным металлом выделяет 2,8 л водорода (н.у.).
2.14 При дегидратации первичного предельного спирта образуется газообразный непредельный углеводород, объем которого в 4 раза меньше объема оксида углерода(IV), образующегося при сгорании такого же количества спирта. Какой спирт и в каком количестве был подвергнут дегидратации, если полученный непредельный углеводород может полностью обесцветить 180 г 20%-ного раствора брома в тетрахлориде углерода.
2.15
При межмолекулярной дегидратации предельного
одноатомного спирта образовалось 7,4 г простого эфира, а при внутримолекулярной
дегидратации такой же массы спирта был получен этиленовый углеводород в
количестве, которое может присоединить 4,48
л хлора (при н. у.). Определите строение исходного спирта. Какое
дихлорпроизводное образовалось и какова его масса?
у.). Определите строение исходного спирта. Какое
дихлорпроизводное образовалось и какова его масса?
2.16 На взаимодействие с 33,2 г смеси предельного одноатомного спирта неизвестного состава и глицерина при комнатной температуре потребовалось 19,5 г гидроксида меди(II). При обработке такого же количества исходной смеси натрием выделилось 8,96 л газа (н.у.). Определите строение одноатомного спирта, если известно, что в его молекуле имеется неразветвленная цепь углеродных атомов.
2.17 При взаимодействии 23 г предельного одноатомного спирта с металлическим натрием выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу спирта.
2.18 При окислении 10,8 г органического соединения аммиачным раствором оксида серебра (I) выделилось 32,4 г серебра. Вычислить молекулярную массу полученного органического вещества.
2.20.
При взаимодействии раствора альдегида массой 10
г (массовая доля альдегида 22%) с избытком аммиачного раствора оксида серебра
получено 10,8 г осадка. Определить формулу альдегида.
Определить формулу альдегида.
2.21. Предельный одноатомный спирт сожгли. В результате реакции получили 22,4 л (н.у.) углекислого газа и 22,5 г водяных паров. Определите молекулярную формулу спирта.
2.22. При взаимодействии 35,52 г некоторого предельного одноатомного спирта с металлическим натрием получено 0,48 г водорода. Определите молекулярную формулу спирта.
2.23. При действии на 17,25 г натрия избытком предельного одноатомного спирта получили 51 г алкоголята. Определите формулу спирта.
Часть 3. Карбоновые кислоты и сложные эфиры.
3.1 На нейтрализацию 0,1 моль карбоновой кислоты с молярной массой 90 г/моль израсходовано 8 г едкого натра. Найдите молекулярную формулу кислоты.
3.2 Выведите формулу одноосновной карбоновой кислоты, на нейтрализацию 120 г которой израсходовано 80 г гидроксида натрия.
3.3 При сплавлении натриевой соли одноосновной карбоновой кислоты с
гидроксидом натрия выделилось 11,2 л газообразного органического соединения, 1
л которого при н.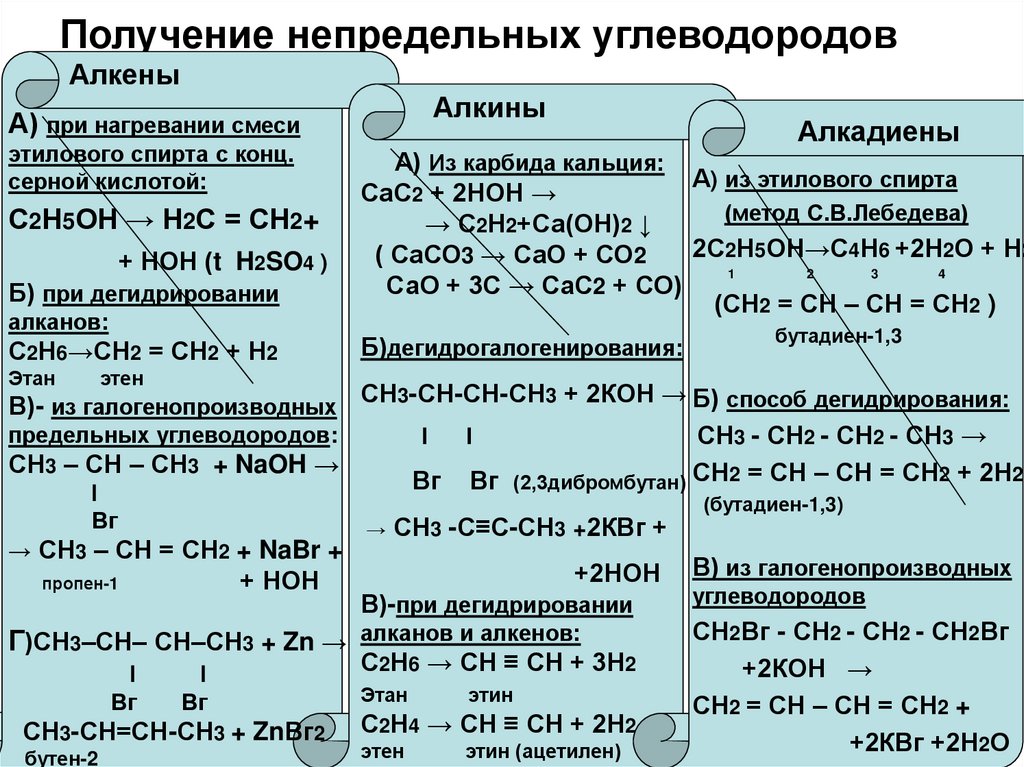 у. имеет массу 1,965
г. Определите массу соли, вступившей в реакцию и состав выделившегося газа.
у. имеет массу 1,965
г. Определите массу соли, вступившей в реакцию и состав выделившегося газа.
3.4 При взаимодействии 71,15 мл 30%-ного раствора (плотность 1,04 г/см3) неизвестной органической одноосновной кислоты с избытком гидрокарбоната натрия выделилось 6720 мл газа (н.у.). Определите, какая кислота находилась в растворе.
3.5 На нейтрализацию 25,5 г предельной одноосновной кислоты потребовался раствор, содержащий 10 г гидроксида натрия. Определите молекулярную формулу кислоты.
3.6 Определите молекулярную массу одноосновной карбоновой кислоты, если известно, что для нейтрализации 4,8 г ее потребовалось 16,95мл раствора гидроксида калия плотностью 1,18 г/см3 и с массовой долей 22,4%.
3.7 На нейтрализацию 18,5 г предельной одноосновной кислоты потребовался раствор, содержащий 10 г гидроксида натрия. Определите молекулярную формулу кислоты.
3.8
При взаимодействии 11,6
г предельного альдегида с избытком гидроксида меди (П) при нагревании образовался
осадок массой 28,8 г.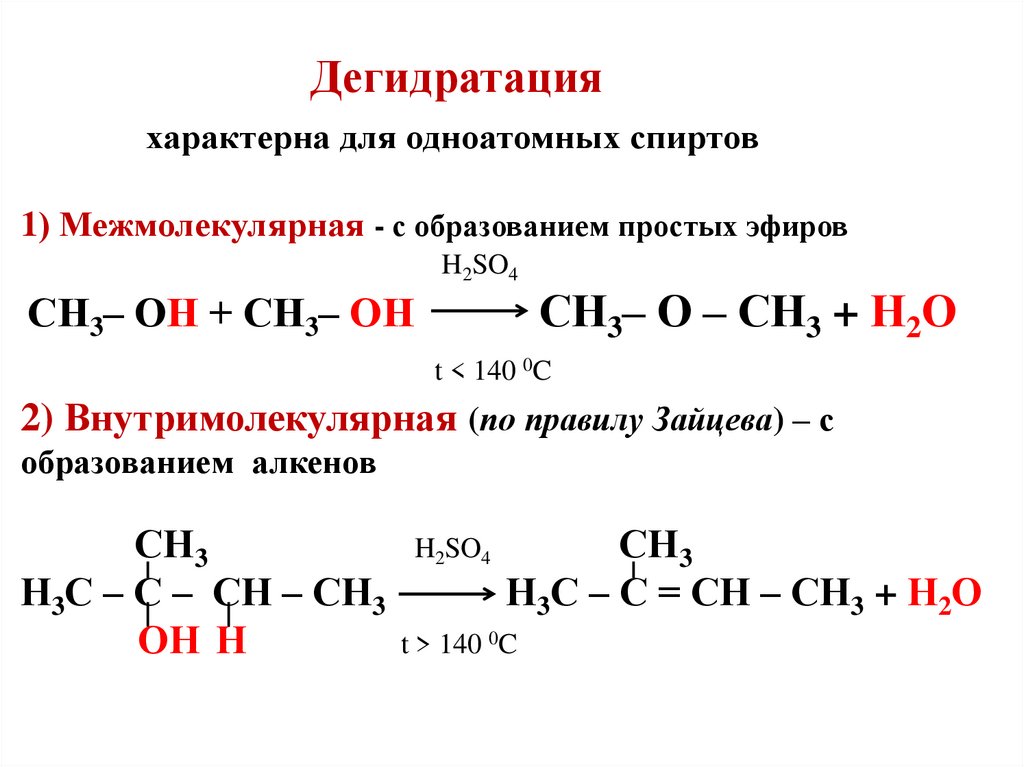 Выведите молекулярную формулу альдегида.
Выведите молекулярную формулу альдегида.
3.9 При окислении первичного спирта массой 12 г получено 14,8 г одноосновной карбоновой кислоты с тем же числом углеродных атомов, что и у исходного спирта. Какова формула этого спирта?
3.10 Кислородсодержащее соединение массой 3,8 г взаимодействует с металлическим натрием; при этом выделяется 1,12 л водорода (н.у.). При окислении того же количества данного соединения образуется 3,6 г вещества, дающего реакцию «серебряного зеркала». Определите молярную массу кислородсодержащего соединения и составьте структурные формулы всех возможных изомеров.
3.11
При гидролизе сложного эфира этиленгликоля получено
36,6 г ароматической одноосновной кислоты, на нейтрализацию которой пошло 108
мл 10%-ного водного раствора гидроксида натрия (плотность 1,11 г/мл).
установите структурную формулу исходного сложного эфира, если известно, что
полученный при его гидролизе этиленгликоль может прореагировать с осажденным из
37,5 г медного купороса гидроксидом меди (II). Сколько (и
какого) эфира подвергли гидролизу?
Сколько (и
какого) эфира подвергли гидролизу?
3.12 Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.
3.13 При взаимодействии 22 г предельной одноатомной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
3.14 Некоторая предельная одноосновная кислота массой 6 г требует для полной этерификации такой же массы спирта. При этом получается 10,2 г сложного эфира. Установите молекулярную формулу кислоты.
3.15 Некоторый сложный эфир массой 7,4 г подвергнут щелочному гидролизу. При этом получено 9,8 г калиевой соли предельной одноосновной кислоты и 3,2 г спирта. Установите молекулярную формулу этого эфира.
3.16 При щелочном гидролизе 6
г некоторого сложного эфира получено 6,8
г натриевой соли предельной одноосновной кислоты и 3,2
г спирта. Установите молекулярную формулу сложного эфира.
Установите молекулярную формулу сложного эфира.
3.17 Сложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу сложного эфира.
3.18 При щелочном гидролизе 37 г некоторого сложного эфира получено 49 г калиевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу сложного эфира.
3.19 Какова структурная формула предельной одноосновной кислоты, если объем CO2, образующегося при сжигании некоторого ее количества, в три раза больше объема CO2, выделившегося при действии на такое же количество данной кислоты избытка водного раствора гидрокарбоната натрия?
3.20 При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л газа. Определите формулу кислоты
Часть 4. Амины и аминокислоты.
4.1 При сгорании 9 г предельного вторичного амина выделилось 2,24
л азота и 8,96 л углекислого газа. Определите молекулярную формулу амина.
Определите молекулярную формулу амина.
4.2 При полном сжигании вещества, не содержащего кислорода, образуется азот и вода. Относительная плотность паров этого вещества по водороду равна 16. Объем необходимого на сжигание кислорода равен объему выделившегося азота. Определите молекулярную формулу соединения.
4.3 При сгорании 0,9 г некоторого первичного амина выделилось 0,224 л азота (н.у.). Установите молекулярную формулу амина.
4.4 При сгорании 35,6 г органического вещества образовалось 52,8 г углекислого газа, 5,6 г азота и 25,2 г воды. Установите молекулярную формулу вещества, если известно, что его молярная масса меньше 150 г/моль. Ответ представьте в виде четырех чисел, перечислив по порядку число атомов углерода, водорода, азота и кислорода в молекуле.
4.5 Образец одноосновной аминокислоты массой 16,5 г может прореагировать с 20 г 28%-ного раствора гидроксида калия. Определите молярную массу аминокислоты (г/моль).
Часть 5. Смешанные задачи
5. 1. Органическое
соединение массой 6 г реагирует с металлическим натрием, при этом выделяется 1,12
л газа (н.у.). Для сжигания той же массы соединения требуется 4,48
л кислорода (н.у.). Пары органического соединения примерно в 2 раза тяжелее
воздуха. Напишите формулу соединения.
1. Органическое
соединение массой 6 г реагирует с металлическим натрием, при этом выделяется 1,12
л газа (н.у.). Для сжигания той же массы соединения требуется 4,48
л кислорода (н.у.). Пары органического соединения примерно в 2 раза тяжелее
воздуха. Напишите формулу соединения.
5.2.При прокаливании соли массой 12,8 г получили 7,2 г воды и 4,48 л (н.у.) бесцветного газа, который при обычных условиях реагирует только с литием и имеет относительную плотность по метану 1,75. Определите формулу соли.
Реакция между спиртами и натрием
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3902
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице описывается реакция между спиртами и металлическим натрием и вводятся свойства образующегося алкоксида. Мы будем рассматривать реакцию между натрием и этанолом как типичную, но вы можете заменить ее любым другим спиртом, и реакция будет такой же.
Мы будем рассматривать реакцию между натрием и этанолом как типичную, но вы можете заменить ее любым другим спиртом, и реакция будет такой же.
Реакция между металлическим натрием и этанолом
Если в этанол капнуть небольшой кусочек натрия, он постоянно реагирует с выделением пузырьков газообразного водорода и оставляет бесцветный раствор этоксида натрия: \(CH_3CH_2ONa\). Анионный компонент представляет собой 9-\) ионы.
Примечание
Причина, по которой формула этоксида написана с кислородом справа, в отличие от гидроксид-иона, является просто вопросом ясности. Если написать наоборот, то сразу не получится, что это этанол. Вы обнаружите, что то же самое происходит, когда вы пишете формулы для органических солей, таких как, например, этаноат натрия.
У этой реакции есть два простых применения:
- Безопасная утилизация небольших количеств натрия: Если вы пролили немного натрия на стол или у вас осталось небольшое количество натрия после реакции, вы не можете просто вылить его в раковину.
 Он имеет тенденцию бурно реагировать с водой — и снова летит на вас! Гораздо мягче реагирует с этанолом. Поэтому этанол используется для растворения небольших количеств отработанного натрия. Образовавшийся раствор можно без проблем смыть (при условии, что вы помните, что этоксид натрия сильно щелочной — см. ниже).
Он имеет тенденцию бурно реагировать с водой — и снова летит на вас! Гораздо мягче реагирует с этанолом. Поэтому этанол используется для растворения небольших количеств отработанного натрия. Образовавшийся раствор можно без проблем смыть (при условии, что вы помните, что этоксид натрия сильно щелочной — см. ниже). - Для проверки группы -ОН в спиртах: Из-за опасностей, связанных с обращением с натрием, это не лучший тест для алкоголя такого уровня. Поскольку натрий бурно реагирует с кислотами с образованием соли и водорода, вам сначала нужно убедиться, что тестируемая жидкость нейтральна. Вы также должны быть уверены, что не было никаких следов воды, потому что натрий реагирует с группой -ОН в воде даже лучше, чем с группой в спирте. С этими оговорками, если вы добавите крошечный кусочек натрия в нейтральную жидкость, свободную от воды, и получите пузырьки водорода, тогда жидкость будет спиртом. 9- \]
Единственное отличие состоит в том, что там, где на правом конце молекулы продукта был атом водорода, теперь присутствует алкильная группа.
 Две алкильные (или другие углеводородные) группы, соединенные мостиковой связью с атомом кислорода, называются эфиром. В частности, это 1-этоксипропан или этилпропиловый эфир. Эта реакция известна как синтез эфира Вильямсона и является хорошим методом синтеза эфиров в лаборатории.
Две алкильные (или другие углеводородные) группы, соединенные мостиковой связью с атомом кислорода, называются эфиром. В частности, это 1-этоксипропан или этилпропиловый эфир. Эта реакция известна как синтез эфира Вильямсона и является хорошим методом синтеза эфиров в лаборатории.Авторы
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Композиция в виде карандаша с хлоридом натрия и стеариловым спиртом
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к косметическим композициям в виде карандаша, в частности, к композициям в виде твердого карандаша-дезодоранта. Более конкретно, настоящее изобретение относится к дезодорантной композиции, содержащей основу многоатомного (например, пропиленгликоля) и/или одноатомного (например, этанол) спирта вместе с водой, желированной солями щелочных металлов и насыщенных жирных кислот, обладающей улучшенными свойствами. ясность и внешний вид. В частности, настоящее изобретение относится к композициям прозрачных дезодорантов, содержащих пропиленгликоль и воду в качестве основы и желированных натриевыми солями насыщенных жирных кислот с длиной углеродной цепи 12-22 (то есть натриевыми солями с относительно длинной углеродной цепью).
 жирные кислоты), имеющие повышенную прозрачность и внешний вид без образования кристаллов (то есть композиция не образует кристаллов в течение периода времени после образования композиции).
жирные кислоты), имеющие повышенную прозрачность и внешний вид без образования кристаллов (то есть композиция не образует кристаллов в течение периода времени после образования композиции).Было желательно получить прозрачные композиции косметических стиков (например, прозрачные композиции твердых дезодорантов в стиках), имеющие основу композиции из многоатомного спирта (например, гликоля, такого как пропиленгликоль) и/или одноатомного спирта (например, этанола). ), вместе с водой, желированные, например, с натриевыми солями насыщенных жирных кислот, при этом образование кристаллов после формирования композиции уменьшается (тем самым улучшая прозрачность композиции и внешний вид продукта). Эта проблема образования кристаллов и снижения прозрачности и внешнего вида продукта особенно остро стоит в тех случаях, когда соли щелочных металлов (например, соли натрия) насыщенных жирных кислот включают соли с относительно длинной углеродной цепью жирной кислоты (например, длина углеродной цепи до C 22 ).
 Желательно использование таких жирных кислот с относительно длинной углеродной цепью, поскольку они обеспечивают продукт, имеющий относительно высокую температуру плавления и, соответственно, относительно большую стабильность.
Желательно использование таких жирных кислот с относительно длинной углеродной цепью, поскольку они обеспечивают продукт, имеющий относительно высокую температуру плавления и, соответственно, относительно большую стабильность.Патент США. В патенте № 4382079, выданном Marschner, описан косметический стик-дезодорант, состоящий в основном из по меньшей мере примерно 0,1-3% и вплоть до примерно 70% бикарбоната щелочного металла и примерно 0,10% суспендирующего агента, диспергированного в геле на мыльной основе, который содержит основную часть количество водного или безводного многоатомного спирта или смеси многоатомного спирта и одноатомного спирта, загущенное небольшим количеством соли щелочного металла и жирной кислоты, содержащей от 14 до 20 атомов углерода. В этом патенте раскрывается, что гель на основе натриевого или калиевого мыла, в который вводят водный раствор или суспензию бикарбоната, включает многоатомный спирт или смесь многоатомного и одноатомного спирта, подходящие многоатомные спирты, включая глицерин и низшие алкиленгликоли с низкой молекулярной массой.
 которые являются жидкими при комнатной температуре, такие как этиленгликоль, диэтиленгликоль, бутиленгликоль и предпочтительно пропиленгликоль. В этом патенте далее раскрывается, что любой тип насыщенной жирной кислоты с высокой молекулярной массой может быть использован в качестве жирной кислоты для соли щелочного металла (например, натрия или калия), используемой в качестве гелеобразующего агента, хотя предпочтительно использовать коммерческую стеариновую кислоту, которая включает по существу смесь стеариновой и пальмитиновой кислот (C 16 и С 18 кислоты).
которые являются жидкими при комнатной температуре, такие как этиленгликоль, диэтиленгликоль, бутиленгликоль и предпочтительно пропиленгликоль. В этом патенте далее раскрывается, что любой тип насыщенной жирной кислоты с высокой молекулярной массой может быть использован в качестве жирной кислоты для соли щелочного металла (например, натрия или калия), используемой в качестве гелеобразующего агента, хотя предпочтительно использовать коммерческую стеариновую кислоту, которая включает по существу смесь стеариновой и пальмитиновой кислот (C 16 и С 18 кислоты).Хотя раскрыты композиции дезодорантов-карандашей на мыльной основе, в которых гелеобразующие агенты, соли щелочных металлов и насыщенных жирных кислот, используют жирные кислоты с длиной углеродной цепи до 20, в этом патенте не описаны какие-либо возникающие проблемы кристаллизации, которые могут повлиять на прозрачность и внешний вид конечного продукта. Фактически, этот патент в первую очередь относится к включению бикарбоната в стик и раскрывает, что прозрачность бикарбонатного стика снижается по мере снижения растворимости бикарбоната в мыльном геле.
 Кроме того, в этом патенте раскрывается, что в качестве гелеобразующего агента предпочтительно используются натриевые соли коммерческой стеариновой кислоты (содержащие стеариновую и пальмитиновую кислоты с относительно короткой углеродной цепью). Таким образом, в данном патенте, в частности, не рассматривается острая проблема образования кристаллов, происходящая в стиках на основе спиртовых мыльных гелей, желированных, например, натриевыми солями насыщенных жирных кислот, имеющих относительно большую длину углеродной цепи, вплоть до С 9 и выше.0153 22 .
Кроме того, в этом патенте раскрывается, что в качестве гелеобразующего агента предпочтительно используются натриевые соли коммерческой стеариновой кислоты (содержащие стеариновую и пальмитиновую кислоты с относительно короткой углеродной цепью). Таким образом, в данном патенте, в частности, не рассматривается острая проблема образования кристаллов, происходящая в стиках на основе спиртовых мыльных гелей, желированных, например, натриевыми солями насыщенных жирных кислот, имеющих относительно большую длину углеродной цепи, вплоть до С 9 и выше.0153 22 .Патент США. В патенте США № 4322400, выданном Yuhas, описаны косметические композиции в виде карандашей. Композиции содержат в качестве основного наполнителя смесь воды и стеарата натрия в пропорциях, достаточных для образования самонесущей твердой композиции, которая не деформируется быстро, и все же не настолько твердая, чтобы получилась твердая воскообразная композиция, которая не оставляет следов. отложение активного ингредиента на коже, на которую наносят композицию.
 Композиция, описанная в этом патенте, дополнительно включает (в дополнение к активному ингредиенту, воде и стеарату натрия) водосовместимые полигидроксильные соединения, такие как глицерин, гликоль или полигликоль, для изменения физических свойств композиции и придания улучшенного «ощущения». «, и относительно небольшое количество хлорида натрия. Хлорид натрия добавляют для предотвращения «синерезиса» (то есть выделения воды из твердой палочки) при экстремальных температурах от 0° до 40°С или выше 50°С. В этом патенте раскрывается, что добавление относительно небольшие количества хлорида натрия также повышают температуру затвердевания, а также скорость затвердевания водно-стеаратно-натриевой основы косметического карандаша. В этом патенте далее раскрывается, что хлорид натрия можно использовать в количестве по меньшей мере примерно 0,5 % по массе, а предпочтительно по меньшей мере примерно 1 % по массе и до примерно 5 % по массе в расчете на водно-стеаратно-натриевую основу.
Композиция, описанная в этом патенте, дополнительно включает (в дополнение к активному ингредиенту, воде и стеарату натрия) водосовместимые полигидроксильные соединения, такие как глицерин, гликоль или полигликоль, для изменения физических свойств композиции и придания улучшенного «ощущения». «, и относительно небольшое количество хлорида натрия. Хлорид натрия добавляют для предотвращения «синерезиса» (то есть выделения воды из твердой палочки) при экстремальных температурах от 0° до 40°С или выше 50°С. В этом патенте раскрывается, что добавление относительно небольшие количества хлорида натрия также повышают температуру затвердевания, а также скорость затвердевания водно-стеаратно-натриевой основы косметического карандаша. В этом патенте далее раскрывается, что хлорид натрия можно использовать в количестве по меньшей мере примерно 0,5 % по массе, а предпочтительно по меньшей мере примерно 1 % по массе и до примерно 5 % по массе в расчете на водно-стеаратно-натриевую основу.Патент США.
 US 4322400 в первую очередь касается включения хлорида натрия в композиции на водной основе, желированные стеаратом натрия, и не дает дальнейшего определения гелеобразующего агента, за исключением раскрытия использования «стеарата натрия». В этом патенте не раскрываются проблемы кристаллизации, в частности такие проблемы, когда в гелеобразующем агенте используются жирные кислоты с относительно длинной углеродной цепью, а раскрывается только то, что хлорид натрия включается во избежание проблем «синерезиса» и для достижения повышенной температуры осаждения и скорости схватывания (что то есть этот патент не раскрывает включение хлорида натрия в состав косметической палочки во избежание проблем с кристаллизацией).
US 4322400 в первую очередь касается включения хлорида натрия в композиции на водной основе, желированные стеаратом натрия, и не дает дальнейшего определения гелеобразующего агента, за исключением раскрытия использования «стеарата натрия». В этом патенте не раскрываются проблемы кристаллизации, в частности такие проблемы, когда в гелеобразующем агенте используются жирные кислоты с относительно длинной углеродной цепью, а раскрывается только то, что хлорид натрия включается во избежание проблем «синерезиса» и для достижения повышенной температуры осаждения и скорости схватывания (что то есть этот патент не раскрывает включение хлорида натрия в состав косметической палочки во избежание проблем с кристаллизацией).Патент США. В патенте США № 4725432 на май описаны твердые составы карандашей на основе воскообразных материалов длинноцепочечных жирных спиртов в сочетании с летучими силиконами, такие составы также содержат спирт, выбранный из группы, состоящей из (1) спиртов C 20 , (2) те спирты, чьи цепи длиннее, чем C 20 , и (3) смеси (1) и (2) на уровне от примерно 1% до примерно 3% от общего количества длинноцепочечных жирных спиртов, присутствующих в композициях.
 В этом патенте далее раскрывается, что жирные спирты с длинной цепью, образующие основу композиции, представляют собой спирты с температурой плавления от примерно 100°F до примерно 150°F, включая жирные спирты, содержащие от примерно 8 до примерно 18 атомов углерода в их цепи, подходящие примеры включают цетиловый спирт, стеариловый спирт, миристиловый спирт, лауриловый спирт и их смеси.
В этом патенте далее раскрывается, что жирные спирты с длинной цепью, образующие основу композиции, представляют собой спирты с температурой плавления от примерно 100°F до примерно 150°F, включая жирные спирты, содержащие от примерно 8 до примерно 18 атомов углерода в их цепи, подходящие примеры включают цетиловый спирт, стеариловый спирт, миристиловый спирт, лауриловый спирт и их смеси.Патент США. № 4725432 не представляет собой композицию карандаша на основе воды или спирта/воды, желатинизированную с помощью солей щелочных металлов и насыщенных жирных кислот. Кроме того, этот патент не раскрывает четких композиций; и не затрагивает проблему образования кристаллов в дезодорирующих композициях на основе спирта и воды, желированных солями щелочных металлов и насыщенных жирных кислот, или особенно острую проблему образования кристаллов, возникающую, когда желирующий агент включает жирные кислоты с относительно длинной углеродной цепью. кислоты.
Как видно из вышеизложенного, в ссылках не рассматривается проблема образования кристаллов, что снижает прозрачность и внешний вид твердой композиции карандаша, включающей основу из спирта и воды, желатинизированную с солями щелочных металлов и насыщенных жирных кислот; или особенно острая проблема образования кристаллов, возникающая там, где насыщенные жирные кислоты имеют относительно большую длину углеродной цепи вплоть до C 22 и выше.
 Более того, композиции, раскрытые в этих ссылках, по своей сути не решают эту проблему. Соответственно, по-прежнему желательно создать косметическую композицию в виде карандаша (например, прозрачный твердый дезодорант в виде карандаша), имеющую основу из многоатомного и/или одноатомного спирта и воды, гелеобразную с солями щелочных металлов и насыщенных жирных кислот, избегая образования кристаллов таких веществ. состав и связанное с ним снижение прозрачности и внешнего вида продукта.
Более того, композиции, раскрытые в этих ссылках, по своей сути не решают эту проблему. Соответственно, по-прежнему желательно создать косметическую композицию в виде карандаша (например, прозрачный твердый дезодорант в виде карандаша), имеющую основу из многоатомного и/или одноатомного спирта и воды, гелеобразную с солями щелочных металлов и насыщенных жирных кислот, избегая образования кристаллов таких веществ. состав и связанное с ним снижение прозрачности и внешнего вида продукта.СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Соответственно, целью настоящего изобретения является создание композиции косметического карандаша (например, состава карандаша-дезодоранта), обладающей улучшенной прозрачностью и внешним видом (то есть, при этом прозрачность и внешний вид продукта при не уменьшается в течение периода времени после образования композиции).
Еще одной целью настоящего изобретения является создание прозрачной косметической композиции в виде карандаша (например, прозрачного твердого дезодоранта в виде карандаша), имеющей пониженную кристаллизацию и, соответственно, улучшенную прозрачность и внешний вид композиции.

Еще одной целью настоящего изобретения является создание прозрачной косметической композиции в виде карандаша, включающей основу, включающую многоатомный и/или одноатомный спирт и воду, загущенную солями щелочных металлов и насыщенных жирных кислот, имеющей улучшенную прозрачность и внешний вид.
Еще одной целью настоящего изобретения является создание косметической композиции в виде карандаша (в частности, твердого дезодоранта в виде карандаша), имеющего основу, включающую многоатомный и/или одноатомный спирт и воду, желированных солями щелочных металлов насыщенных жирных кислот. кислоты, причем такие насыщенные жирные кислоты представляют собой насыщенные жирные кислоты с относительно длинной углеродной цепью, имеющие пониженное образование кристаллов и, соответственно, улучшенную прозрачность и внешний вид.
Еще одной целью настоящего изобретения является создание прозрачной косметической композиции в виде карандаша, имеющей основу композиции из пропиленгликоля и воды и желированной натриевыми солями насыщенных жирных кислот (в частности, насыщенных жирных кислот C 12 — C 22 длина углеродной цепи), с уменьшенным образованием кристаллов и, соответственно, улучшенной прозрачностью и внешним видом.

Вышеупомянутые задачи достигаются путем включения как хлорида натрия, так и стеарилового спирта в состав косметической палочки, включающей основу из многоатомного и/или одноатомного спирта и воды, желированных солями щелочных металлов и насыщенных жирных кислот.
Соответственно, композиция по настоящему изобретению включает в качестве основных ингредиентов многоатомный и/или одноатомный спирт и воду в качестве основы, желатинизированную с солями щелочных металлов и насыщенных жирных кислот, и, кроме того, включает как хлорид натрия, так и стеариловый спирт.
Конечно, в композицию по настоящему изобретению также могут быть включены другие ингредиенты, обычно известные как включаемые в композиции косметических стиков (например, композиции твердых дезодорантов в виде стиков, например, для борьбы с подмышечным запахом). Например, настоящее изобретение предусматривает включение обычных дезодорирующих активных материалов (например, для борьбы с подмышечным запахом), включая (но не ограничиваясь ими) ароматизирующие компоненты и бактериостатические вещества, а также наполнители, такие как тальк, коллоидный кремнезем, глины и т.
 д.
д.Благодаря использованию как хлорида натрия, так и стеарилового спирта, включенных в состав карандаша, уменьшено образование кристаллов и, как следствие, улучшенная прозрачность и внешний вид по сравнению с соответствующими составами карандаша, включающими либо хлорид натрия, либо стеариловый спирт (но не оба), а также по сравнению с композициями, не содержащими ни хлорида натрия, ни стеарилового спирта.
Проблема образования кристаллов в композициях стиков, содержащих основу, включающую многоатомный и/или одноатомный спирт и воду, желированных солями щелочных металлов и насыщенных жирных кислот, особенно остро стоит в случае твердых композиций стиков, желированных солями щелочных металлов (например, натрия) жирных кислот C 12 -C 22 длина углеродной цепи; такая проблема по существу не возникает, когда жирные кислоты имеют длину углеродной цепи C 16 — C 18 (то есть, когда максимальная длина углеродной цепи относительно короткая).
 Однако когда в качестве гелеобразующего агента используются жирные кислоты с длиной цепи С 16 — С 18 , композиции плавятся при слишком низкой температуре и образующийся продукт недостаточно стабилен. Таким образом, желательно использовать в качестве гелеобразующего агента соли щелочных металлов (например, соли натрия) насыщенных жирных кислот с относительно длинной углеродной цепью (например, до C 22 , включая смеси солей С 12 — С 22 жирных кислот).
Однако когда в качестве гелеобразующего агента используются жирные кислоты с длиной цепи С 16 — С 18 , композиции плавятся при слишком низкой температуре и образующийся продукт недостаточно стабилен. Таким образом, желательно использовать в качестве гелеобразующего агента соли щелочных металлов (например, соли натрия) насыщенных жирных кислот с относительно длинной углеродной цепью (например, до C 22 , включая смеси солей С 12 — С 22 жирных кислот).Соответственно, благодаря использованию настоящего изобретения можно получить относительно стабильную композицию косметического карандаша на основе спиртов, желированную солями щелочных металлов и насыщенными жирными кислотами с относительно длинной углеродной цепью, без проблем образования кристаллов, снижающих прозрачность и внешний вид композиции.
Таким образом, в соответствии с настоящим изобретением прозрачная косметическая твердая композиция в виде карандаша (например, твердый дезодорант в виде карандаша), включающая основу многоатомного и/или одноатомного спирта и воду, желированная солями щелочных металлов насыщенных жирных кислот (в в частности, натриевые соли насыщенных жирных кислот с относительно длинной углеродной цепью) с уменьшенным образованием кристаллов после формирования композиции и с соответствующей улучшенной прозрачностью и внешним видом.
 Благодаря использованию настоящего изобретения улучшаются как качество поверхности (то есть меньшее количество поверхностных кристаллов), так и прозрачность (задержка образования кристаллов внутри формованного продукта). Кроме того, общая прочность геля также улучшается (то есть уменьшается синерезис).
Благодаря использованию настоящего изобретения улучшаются как качество поверхности (то есть меньшее количество поверхностных кристаллов), так и прозрачность (задержка образования кристаллов внутри формованного продукта). Кроме того, общая прочность геля также улучшается (то есть уменьшается синерезис).ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Хотя изобретение будет описано в связи с конкретными и предпочтительными вариантами осуществления, следует понимать, что оно не предназначено для ограничения изобретения этими вариантами осуществления. Напротив, он предназначен для охвата всех изменений, модификаций и эквивалентов, которые могут быть включены в сущность и объем изобретения, определенные прилагаемой формулой изобретения.
На протяжении всего настоящего описания, где композиции описываются как включающие или содержащие конкретные компоненты, авторы изобретения предполагают, что композиции по настоящему изобретению также состоят по существу или состоят из перечисленных компонентов.
 Соответственно, в настоящем описании любая описанная композиция может состоять по существу или состоять из перечисленных компонентов.
Соответственно, в настоящем описании любая описанная композиция может состоять по существу или состоять из перечисленных компонентов.В настоящем изобретении рассматривается композиция косметического карандаша (в частности, композиция прозрачного карандаша, включая прозрачный карандаш-дезодорант), включающая по меньшей мере один из многоатомного и/или одноатомного спирта и воды в качестве основы, причем такая основа представляет собой гель с щелочным металлом. соли насыщенных жирных кислот, причем композиция дополнительно включает как хлорид натрия, так и стеариловый спирт. Включение в композицию как хлорида натрия, так и стеарилового спирта уменьшает образование кристаллов с течением времени после образования композиции (например, в конечном продукте), тем самым улучшая прозрачность и внешний вид продукта.
Многоатомный спирт, используемый в соответствии с настоящим изобретением, может представлять собой любой из спиртов, известных для использования в производстве косметических стиков, включая (но не ограничиваясь ими) пропиленгликоль, дипропиленгликоль, глицерин и сорбит.
 Предпочтительным является пропиленгликоль. Различные многоатомные спирты, используемые в композициях косметических стиков (в частности, композициях стиков-дезодорантов), раскрыты в патенте США No. № 4382079, содержание которого полностью включено в настоящее описание посредством ссылки.
Предпочтительным является пропиленгликоль. Различные многоатомные спирты, используемые в композициях косметических стиков (в частности, композициях стиков-дезодорантов), раскрыты в патенте США No. № 4382079, содержание которого полностью включено в настоящее описание посредством ссылки.Дополнительные конкретные многоатомные спирты, которые можно использовать в композициях косметических карандашей, также раскрыты в патенте США No. № 4322400 (обозначенный в этом патенте как «полигидроксильные соединения»), содержание которого полностью включено в настоящее описание посредством ссылки.
Одноатомные спирты (например, этанол) также могут быть использованы как часть основы, желатинизированной с солью щелочного металла жирной кислоты, в соответствии с настоящим изобретением. Как правило, использовались различные одноатомные спирты, такие как этанол или изопропиловый спирт, что также обсуждалось в патенте США No. № 4 382 079(содержание которых во всей своей полноте ранее было включено в настоящий документ посредством ссылки).

Настоящее изобретение дает наибольший эффект в снижении образования кристаллов при использовании солей щелочных металлов (натриевых солей) насыщенных жирных кислот, имеющих длину углеродной цепи C 12 -C 22 (то есть распределение различных жирные кислоты в гелеобразователе). Типичное распределение жирных кислот для гелеобразователя показано ниже:
______________________________________ % Range (by weight of the C-Chain Length total fatty acids) ______________________________________
C 12 Lauric
0-1
C 14 Myristic
4 -10
C 16 Palmitic
20-30
C 18 Stearic
25-42
C 20 Arachidic
15-18
C 22 4465 4.5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
5 4.
 65
655 65 65 4.
5965
.0265__________________________________________ Цели настоящего изобретения достигаются путем включения в композицию как хлорида натрия, так и стеарилового спирта. Иллюстративно, хлорид натрия может быть введен в композицию в количестве от 0,1 до 3,0% по массе от общей массы композиции; и стеариловый спирт может быть введен в композицию в количестве от 0,1 до 1,0% по массе от общей массы композиции. Предпочтительные диапазоны содержания хлорида натрия и стеарилового спирта составляют соответственно от 0,3 до 0,6% по весу и от 0,1 до 0,4% по весу.
В зависимости от использования композиции косметического карандаша (например, в качестве твердого дезодоранта) к ранее обсужденным компонентам могут быть добавлены различные дополнительные ингредиенты. При использовании в качестве дезодоранта композиция может включать различные материалы, например отдушки, красители, загустители или агенты, повышающие вязкость, бактериостаты и т.
 д. Различные необязательные ингредиенты, которые могут быть включены в композицию, когда такая композиция используется в виде твердого дезодоранта-карандаша. , описаны в патенте США No. № 4 382 079, содержание которого ранее было полностью включено в настоящее описание посредством ссылки.
д. Различные необязательные ингредиенты, которые могут быть включены в композицию, когда такая композиция используется в виде твердого дезодоранта-карандаша. , описаны в патенте США No. № 4 382 079, содержание которого ранее было полностью включено в настоящее описание посредством ссылки.Следует также обратить внимание на патент США №
. № 4322400, содержание которого уже полностью включено в настоящее описание посредством ссылки, в котором раскрываются различные необязательные ингредиенты, включенные в состав карандаша для получения стиков-дезодорантов, парфюмерных стиков, стиков-репеллентов и т. д.Далее следует изложены конкретные диапазоны различных компонентов композиции карандаша, когда необязательные компоненты включены для получения карандаша-дезодоранта. Эти диапазоны, показанные в следующей таблице 1, являются иллюстративными и не ограничивающими.
TABLE 1 ______________________________________ Item % by weight in the composition ______________________________________
Propylene Glycol
50-80
Water 15-40
Sodium Stearate
6-9
Духи 0,5–2
Триклозан 0,05–0,4
Натрия хлорид
0,1–3,0
Стеариловый спирт
0,1–1,0______________________________________ Твердые композиции карандашей по настоящему изобретению изготавливают в соответствии с хорошо зарекомендовавшими себя способами, известными специалистам в данной области.
 В частности, внимание обращено на пат. № 4382079 и патент США № 4382079. № 4322400, содержание каждого из которых полностью включено в настоящее описание посредством ссылки, в каждом из которых описываются методы формирования композиции карандаша, а также, например, заполнение жидкой композицией упаковки для формирования окончательного упакованный продукт.
В частности, внимание обращено на пат. № 4382079 и патент США № 4382079. № 4322400, содержание каждого из которых полностью включено в настоящее описание посредством ссылки, в каждом из которых описываются методы формирования композиции карандаша, а также, например, заполнение жидкой композицией упаковки для формирования окончательного упакованный продукт.Конечно, настоящая композиция карандаша может быть использована (например, в виде карандаша-дезодоранта) так, как обычно использует потребитель.
ПРИМЕРЫ
В следующей таблице 2 показаны шесть конкретных композиций дезодоранта-карандаша, первые пять из которых выходят за рамки настоящего изобретения (то есть первые пять содержат либо хлорид натрия, либо стеариловый спирт, но не оба) , и шестой подпадает под объем настоящего изобретения (то есть шестой содержит как хлорид натрия, так и стеариловый спирт).
TABLE 2 ______________________________________ ITEM 1 2 3 4 5 6 ______________________________________
Propylene Glycol
70 70 70. 25 70 70 70
25 70 70 70
Water 22.1 19.7 21.1 21.45
21.25 20.95
Стеарат натрия
6 8 7 7 7 7
Духи 1 1 1 1 1 1
Хлорид натрия
0,5 1,0 0,3 — — 0,5
стеариловый спирт
— — — 0,2 0,4 0,2
Триклозан 0,3 0,2 0,25 0,25 0,25 0,25
.При сохранении вышеуказанных шести композиций композиции 1-3, в которых используется хлорид натрия, но не стеариловый спирт, оставались прозрачными до девяти месяцев. Композиции 4 и 5, каждая из которых включала стеариловый спирт, но не содержала хлорида натрия, оставались прозрачными в течение трех-четырех месяцев. С другой стороны, композиция № 6, имеющая комбинацию хлорида натрия и стеарилового спирта, оставалась прозрачной до восемнадцати месяцев. Это показывает лучшие результаты, достигнутые при использовании комбинации хлорида натрия и стеарилового спирта для обеспечения композиции карандаша с улучшенной прозрачностью и внешним видом в течение длительного периода времени после формирования композиции.


 При нагревании реакционной смеси собрали 16 г летучего продукта бромэтана. Напишите уравнение реакции. Определите выход бромэтана. Что будет наблюдаться, если перепутать порядок сливания реагентов — к сухому бромиду калия сначала добавить концентрированную кислоту и только потом — воду и спирт? Напишите уравнение реакции.
При нагревании реакционной смеси собрали 16 г летучего продукта бромэтана. Напишите уравнение реакции. Определите выход бромэтана. Что будет наблюдаться, если перепутать порядок сливания реагентов — к сухому бромиду калия сначала добавить концентрированную кислоту и только потом — воду и спирт? Напишите уравнение реакции. При сгорании бескислородного органического вещества образуется 26,4 г углекислого газа, 5,4 г воды и 13,44 л хлороводорода (н.у.) Это вещество можно получить взаимодействием соответствующего углеводорода с избытком хлороводорода. На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции получения этого вещества из углеводорода (используйте структурные формулы органических веществ).
При сгорании бескислородного органического вещества образуется 26,4 г углекислого газа, 5,4 г воды и 13,44 л хлороводорода (н.у.) Это вещество можно получить взаимодействием соответствующего углеводорода с избытком хлороводорода. На основании данных условия задания:1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;3) напишите уравнение реакции получения этого вещества из углеводорода (используйте структурные формулы органических веществ).
 Определите молекулярную формулу спирта и приведите его возможные структурные формулы. Установите структурную формулу искомого спирта, если при его дегидратации образуется алкен, имеющий геометрические изомеры. Приведите уравнение реакции дегидратации искомого спирта и укажите условия её проведения.
Определите молекулярную формулу спирта и приведите его возможные структурные формулы. Установите структурную формулу искомого спирта, если при его дегидратации образуется алкен, имеющий геометрические изомеры. Приведите уравнение реакции дегидратации искомого спирта и укажите условия её проведения. Как можно проконтролировать чистоту выделенных соединений? Ответ подтвердите необходимыми уравнениями реакций.
Как можно проконтролировать чистоту выделенных соединений? Ответ подтвердите необходимыми уравнениями реакций.
 5 г ввели в реакцию с избытком перманганата калия в присутствии серной кислоты. При этом выделилось 2,486 л газа (измерено при 22оС и 740 мм рт. ст.) Предложите возможную структурную формулу неизвестного органического соединения. Ответ обоснуйте.
5 г ввели в реакцию с избытком перманганата калия в присутствии серной кислоты. При этом выделилось 2,486 л газа (измерено при 22оС и 740 мм рт. ст.) Предложите возможную структурную формулу неизвестного органического соединения. Ответ обоснуйте. (Ручка полностью растворилась).
(Ручка полностью растворилась). Он имеет тенденцию бурно реагировать с водой — и снова летит на вас! Гораздо мягче реагирует с этанолом. Поэтому этанол используется для растворения небольших количеств отработанного натрия. Образовавшийся раствор можно без проблем смыть (при условии, что вы помните, что этоксид натрия сильно щелочной — см. ниже).
Он имеет тенденцию бурно реагировать с водой — и снова летит на вас! Гораздо мягче реагирует с этанолом. Поэтому этанол используется для растворения небольших количеств отработанного натрия. Образовавшийся раствор можно без проблем смыть (при условии, что вы помните, что этоксид натрия сильно щелочной — см. ниже). Две алкильные (или другие углеводородные) группы, соединенные мостиковой связью с атомом кислорода, называются эфиром. В частности, это 1-этоксипропан или этилпропиловый эфир. Эта реакция известна как синтез эфира Вильямсона и является хорошим методом синтеза эфиров в лаборатории.
Две алкильные (или другие углеводородные) группы, соединенные мостиковой связью с атомом кислорода, называются эфиром. В частности, это 1-этоксипропан или этилпропиловый эфир. Эта реакция известна как синтез эфира Вильямсона и является хорошим методом синтеза эфиров в лаборатории.
 жирные кислоты), имеющие повышенную прозрачность и внешний вид без образования кристаллов (то есть композиция не образует кристаллов в течение периода времени после образования композиции).
жирные кислоты), имеющие повышенную прозрачность и внешний вид без образования кристаллов (то есть композиция не образует кристаллов в течение периода времени после образования композиции). Желательно использование таких жирных кислот с относительно длинной углеродной цепью, поскольку они обеспечивают продукт, имеющий относительно высокую температуру плавления и, соответственно, относительно большую стабильность.
Желательно использование таких жирных кислот с относительно длинной углеродной цепью, поскольку они обеспечивают продукт, имеющий относительно высокую температуру плавления и, соответственно, относительно большую стабильность. которые являются жидкими при комнатной температуре, такие как этиленгликоль, диэтиленгликоль, бутиленгликоль и предпочтительно пропиленгликоль. В этом патенте далее раскрывается, что любой тип насыщенной жирной кислоты с высокой молекулярной массой может быть использован в качестве жирной кислоты для соли щелочного металла (например, натрия или калия), используемой в качестве гелеобразующего агента, хотя предпочтительно использовать коммерческую стеариновую кислоту, которая включает по существу смесь стеариновой и пальмитиновой кислот (C 16 и С 18 кислоты).
которые являются жидкими при комнатной температуре, такие как этиленгликоль, диэтиленгликоль, бутиленгликоль и предпочтительно пропиленгликоль. В этом патенте далее раскрывается, что любой тип насыщенной жирной кислоты с высокой молекулярной массой может быть использован в качестве жирной кислоты для соли щелочного металла (например, натрия или калия), используемой в качестве гелеобразующего агента, хотя предпочтительно использовать коммерческую стеариновую кислоту, которая включает по существу смесь стеариновой и пальмитиновой кислот (C 16 и С 18 кислоты). Кроме того, в этом патенте раскрывается, что в качестве гелеобразующего агента предпочтительно используются натриевые соли коммерческой стеариновой кислоты (содержащие стеариновую и пальмитиновую кислоты с относительно короткой углеродной цепью). Таким образом, в данном патенте, в частности, не рассматривается острая проблема образования кристаллов, происходящая в стиках на основе спиртовых мыльных гелей, желированных, например, натриевыми солями насыщенных жирных кислот, имеющих относительно большую длину углеродной цепи, вплоть до С 9 и выше.0153 22 .
Кроме того, в этом патенте раскрывается, что в качестве гелеобразующего агента предпочтительно используются натриевые соли коммерческой стеариновой кислоты (содержащие стеариновую и пальмитиновую кислоты с относительно короткой углеродной цепью). Таким образом, в данном патенте, в частности, не рассматривается острая проблема образования кристаллов, происходящая в стиках на основе спиртовых мыльных гелей, желированных, например, натриевыми солями насыщенных жирных кислот, имеющих относительно большую длину углеродной цепи, вплоть до С 9 и выше.0153 22 . Композиция, описанная в этом патенте, дополнительно включает (в дополнение к активному ингредиенту, воде и стеарату натрия) водосовместимые полигидроксильные соединения, такие как глицерин, гликоль или полигликоль, для изменения физических свойств композиции и придания улучшенного «ощущения». «, и относительно небольшое количество хлорида натрия. Хлорид натрия добавляют для предотвращения «синерезиса» (то есть выделения воды из твердой палочки) при экстремальных температурах от 0° до 40°С или выше 50°С. В этом патенте раскрывается, что добавление относительно небольшие количества хлорида натрия также повышают температуру затвердевания, а также скорость затвердевания водно-стеаратно-натриевой основы косметического карандаша. В этом патенте далее раскрывается, что хлорид натрия можно использовать в количестве по меньшей мере примерно 0,5 % по массе, а предпочтительно по меньшей мере примерно 1 % по массе и до примерно 5 % по массе в расчете на водно-стеаратно-натриевую основу.
Композиция, описанная в этом патенте, дополнительно включает (в дополнение к активному ингредиенту, воде и стеарату натрия) водосовместимые полигидроксильные соединения, такие как глицерин, гликоль или полигликоль, для изменения физических свойств композиции и придания улучшенного «ощущения». «, и относительно небольшое количество хлорида натрия. Хлорид натрия добавляют для предотвращения «синерезиса» (то есть выделения воды из твердой палочки) при экстремальных температурах от 0° до 40°С или выше 50°С. В этом патенте раскрывается, что добавление относительно небольшие количества хлорида натрия также повышают температуру затвердевания, а также скорость затвердевания водно-стеаратно-натриевой основы косметического карандаша. В этом патенте далее раскрывается, что хлорид натрия можно использовать в количестве по меньшей мере примерно 0,5 % по массе, а предпочтительно по меньшей мере примерно 1 % по массе и до примерно 5 % по массе в расчете на водно-стеаратно-натриевую основу. US 4322400 в первую очередь касается включения хлорида натрия в композиции на водной основе, желированные стеаратом натрия, и не дает дальнейшего определения гелеобразующего агента, за исключением раскрытия использования «стеарата натрия». В этом патенте не раскрываются проблемы кристаллизации, в частности такие проблемы, когда в гелеобразующем агенте используются жирные кислоты с относительно длинной углеродной цепью, а раскрывается только то, что хлорид натрия включается во избежание проблем «синерезиса» и для достижения повышенной температуры осаждения и скорости схватывания (что то есть этот патент не раскрывает включение хлорида натрия в состав косметической палочки во избежание проблем с кристаллизацией).
US 4322400 в первую очередь касается включения хлорида натрия в композиции на водной основе, желированные стеаратом натрия, и не дает дальнейшего определения гелеобразующего агента, за исключением раскрытия использования «стеарата натрия». В этом патенте не раскрываются проблемы кристаллизации, в частности такие проблемы, когда в гелеобразующем агенте используются жирные кислоты с относительно длинной углеродной цепью, а раскрывается только то, что хлорид натрия включается во избежание проблем «синерезиса» и для достижения повышенной температуры осаждения и скорости схватывания (что то есть этот патент не раскрывает включение хлорида натрия в состав косметической палочки во избежание проблем с кристаллизацией).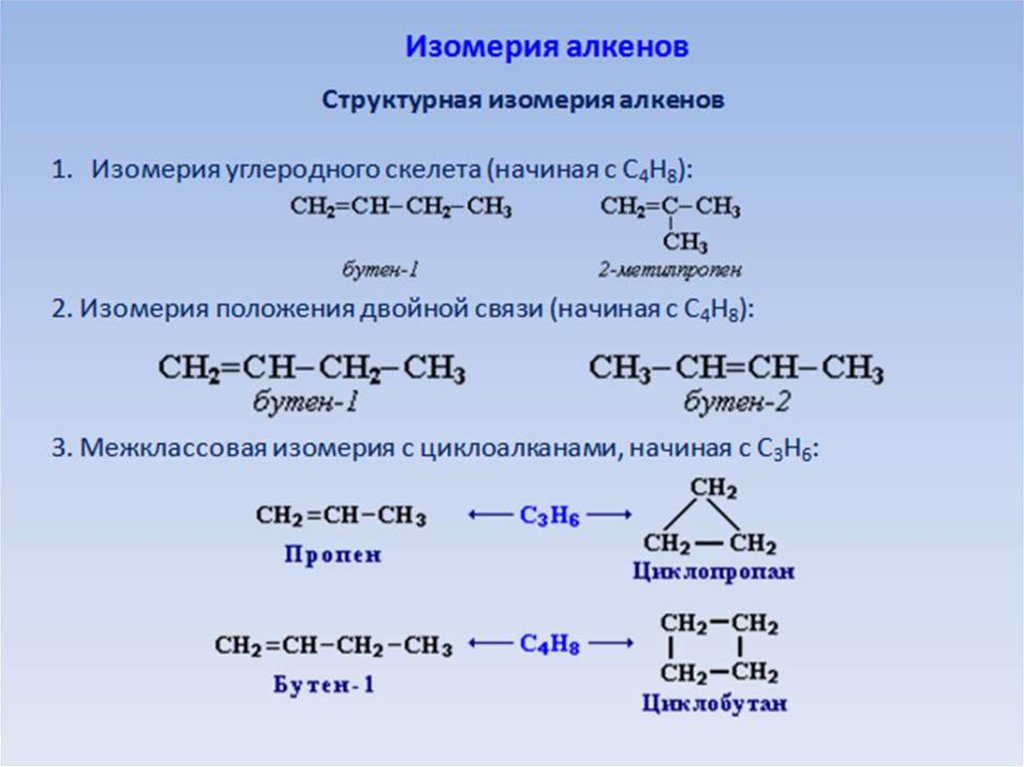 В этом патенте далее раскрывается, что жирные спирты с длинной цепью, образующие основу композиции, представляют собой спирты с температурой плавления от примерно 100°F до примерно 150°F, включая жирные спирты, содержащие от примерно 8 до примерно 18 атомов углерода в их цепи, подходящие примеры включают цетиловый спирт, стеариловый спирт, миристиловый спирт, лауриловый спирт и их смеси.
В этом патенте далее раскрывается, что жирные спирты с длинной цепью, образующие основу композиции, представляют собой спирты с температурой плавления от примерно 100°F до примерно 150°F, включая жирные спирты, содержащие от примерно 8 до примерно 18 атомов углерода в их цепи, подходящие примеры включают цетиловый спирт, стеариловый спирт, миристиловый спирт, лауриловый спирт и их смеси. Более того, композиции, раскрытые в этих ссылках, по своей сути не решают эту проблему. Соответственно, по-прежнему желательно создать косметическую композицию в виде карандаша (например, прозрачный твердый дезодорант в виде карандаша), имеющую основу из многоатомного и/или одноатомного спирта и воды, гелеобразную с солями щелочных металлов и насыщенных жирных кислот, избегая образования кристаллов таких веществ. состав и связанное с ним снижение прозрачности и внешнего вида продукта.
Более того, композиции, раскрытые в этих ссылках, по своей сути не решают эту проблему. Соответственно, по-прежнему желательно создать косметическую композицию в виде карандаша (например, прозрачный твердый дезодорант в виде карандаша), имеющую основу из многоатомного и/или одноатомного спирта и воды, гелеобразную с солями щелочных металлов и насыщенных жирных кислот, избегая образования кристаллов таких веществ. состав и связанное с ним снижение прозрачности и внешнего вида продукта.

 д.
д. Однако когда в качестве гелеобразующего агента используются жирные кислоты с длиной цепи С 16 — С 18 , композиции плавятся при слишком низкой температуре и образующийся продукт недостаточно стабилен. Таким образом, желательно использовать в качестве гелеобразующего агента соли щелочных металлов (например, соли натрия) насыщенных жирных кислот с относительно длинной углеродной цепью (например, до C 22 , включая смеси солей С 12 — С 22 жирных кислот).
Однако когда в качестве гелеобразующего агента используются жирные кислоты с длиной цепи С 16 — С 18 , композиции плавятся при слишком низкой температуре и образующийся продукт недостаточно стабилен. Таким образом, желательно использовать в качестве гелеобразующего агента соли щелочных металлов (например, соли натрия) насыщенных жирных кислот с относительно длинной углеродной цепью (например, до C 22 , включая смеси солей С 12 — С 22 жирных кислот). Благодаря использованию настоящего изобретения улучшаются как качество поверхности (то есть меньшее количество поверхностных кристаллов), так и прозрачность (задержка образования кристаллов внутри формованного продукта). Кроме того, общая прочность геля также улучшается (то есть уменьшается синерезис).
Благодаря использованию настоящего изобретения улучшаются как качество поверхности (то есть меньшее количество поверхностных кристаллов), так и прозрачность (задержка образования кристаллов внутри формованного продукта). Кроме того, общая прочность геля также улучшается (то есть уменьшается синерезис).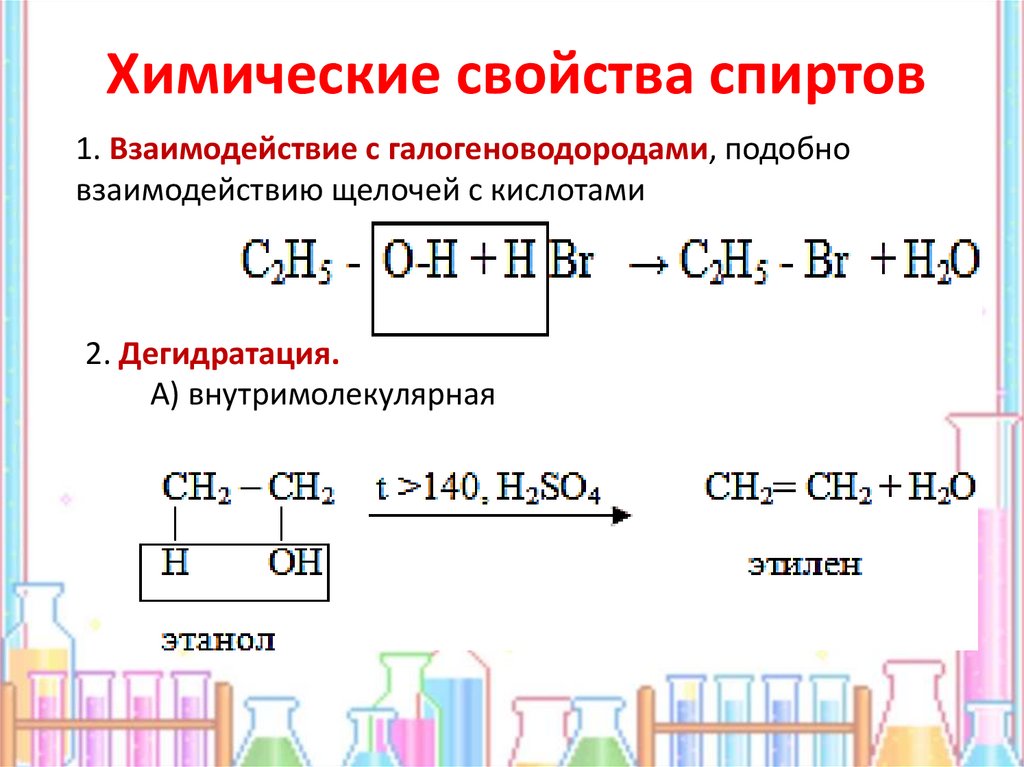 Соответственно, в настоящем описании любая описанная композиция может состоять по существу или состоять из перечисленных компонентов.
Соответственно, в настоящем описании любая описанная композиция может состоять по существу или состоять из перечисленных компонентов. Предпочтительным является пропиленгликоль. Различные многоатомные спирты, используемые в композициях косметических стиков (в частности, композициях стиков-дезодорантов), раскрыты в патенте США No. № 4382079, содержание которого полностью включено в настоящее описание посредством ссылки.
Предпочтительным является пропиленгликоль. Различные многоатомные спирты, используемые в композициях косметических стиков (в частности, композициях стиков-дезодорантов), раскрыты в патенте США No. № 4382079, содержание которого полностью включено в настоящее описание посредством ссылки.
 65
65 д. Различные необязательные ингредиенты, которые могут быть включены в композицию, когда такая композиция используется в виде твердого дезодоранта-карандаша. , описаны в патенте США No. № 4 382 079, содержание которого ранее было полностью включено в настоящее описание посредством ссылки.
д. Различные необязательные ингредиенты, которые могут быть включены в композицию, когда такая композиция используется в виде твердого дезодоранта-карандаша. , описаны в патенте США No. № 4 382 079, содержание которого ранее было полностью включено в настоящее описание посредством ссылки. В частности, внимание обращено на пат. № 4382079 и патент США № 4382079. № 4322400, содержание каждого из которых полностью включено в настоящее описание посредством ссылки, в каждом из которых описываются методы формирования композиции карандаша, а также, например, заполнение жидкой композицией упаковки для формирования окончательного упакованный продукт.
В частности, внимание обращено на пат. № 4382079 и патент США № 4382079. № 4322400, содержание каждого из которых полностью включено в настоящее описание посредством ссылки, в каждом из которых описываются методы формирования композиции карандаша, а также, например, заполнение жидкой композицией упаковки для формирования окончательного упакованный продукт. 25 70 70 70
25 70 70 70 
Leave A Comment