Вопрос 1 § 1-3 Химия 9 класс Рудзитис, Фельдман
Вопрос 1 § 1-3 Химия 9 класс Рудзитис, Фельдман — почему раствор сахара не проводит электрический ток – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Помогите ответить
Поясните, почему раствор сахара не проводит электрический ток, а раствор хлорида натрия проводит.
ответы
Раствор хлорида натрия является электролитом.
При растворении в воде ионная кристаллическая
решетка хлорида натрия разрушается. NaCl распа-
дается на ионы Na+ и Сl−.
Раствор сахара электролитом не является. Мо-
лекулы сахара имеют ковалентную неполярную
связь, при растворении сахара в воде разрушение
его молекулы и образование заряженных ионов не
происходит, поэтому такой раствор электрического
тока не проводит.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
Что произойдет с процессом кристаллизации воды в растворе, если не понижать температуру раствора? Ответ поясните
Задание № 15219Что произойдет с процессом кристаллизации воды в растворе, если не понижать температуру раствора? Ответ поясните
Как замерзают растворы
Если охладить раствор какой-либо соли в воде, то обнаружится, что температура кристаллизации понизилась. Кристаллики появятся в жидкости лишь при температуре на несколько градусов ниже нуля градусов.
Температура кристаллизации зависит от концентрации раствора. Она тем ниже, чем выше концентрация раствора. Например, при растворении 45 кг поваренной соли в 1 м3 воды температура кристаллизации уменьшается до -3 °С. Самую низкую температуру имеет насыщенный раствор, т. е. раствор, содержащий максимально возможное количество растворённой соли. При этом уменьшение температуры достаточно существенное. Так, насыщенный раствор поваренной соли в воде кристаллизуется при температуре -21 °С, а насыщенный раствор хлористого кальция — при температуре -55 °С.
е. раствор, содержащий максимально возможное количество растворённой соли. При этом уменьшение температуры достаточно существенное. Так, насыщенный раствор поваренной соли в воде кристаллизуется при температуре -21 °С, а насыщенный раствор хлористого кальция — при температуре -55 °С.
Рассмотрим, как идёт процесс кристаллизации. После того как в растворе появятся первые кристаллики льда, концентрация раствора повысится. Возрастёт относительное число молекул соли, увеличатся помехи процессу кристаллизации воды, и температура кристаллизации понизится. Если дальше не понижать температуру, то кристаллизация остановится. При дальнейшем понижении температуры кристаллики воды продолжат образовываться, и раствор станет насыщенным. Дальнейшее обогащение раствора растворённым веществом (солью) становится невозможным, и раствор застывает сразу. Если рассмотреть замёрзшую смесь в микроскоп, то можно увидеть, что она состоит из кристалликов льда и кристалликов соли.
Таким образом, раствор замерзает не так, как простая жидкость.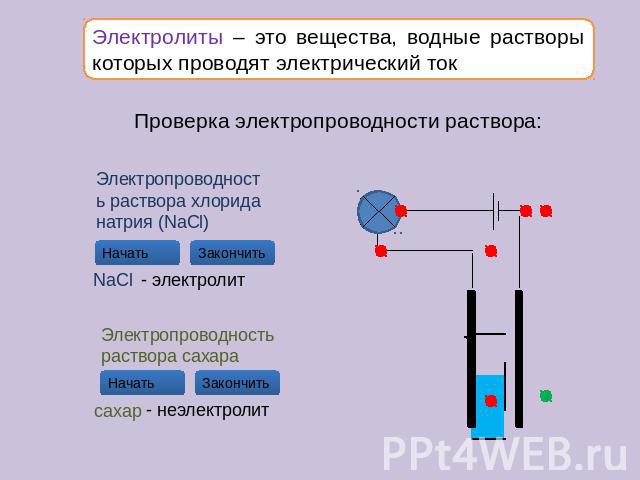 Процесс замерзания растягивается на большой температурный интервал.
Процесс замерзания растягивается на большой температурный интервал.
Если посыпать лёд солью, то лёд начнёт таять. Конечно, это будет иметь место, если температура замерзания насыщенного раствора соли ниже температуры воздуха. При этом лёд будет плавиться, а соль — растворяться в образовавшейся воде. Процесс плавления требует энергии, которую лёд потребляет из окружающего воздуха. В результате температура воздуха понижается.
Решать другие задания по теме: {topic-name}
[topic]
Показать ответ
Комментарий:
1. Кристаллизация остановится.
2. При появлении в растворе соли первых кристалликов льда, повысится концентрация раствора, молекулы соли будут мешать образованию кристаллов льда, соответственно понизится температура кристаллизации воды, и кристаллизация остановится. Для дальнейшей кристаллизации следует понизить температуру раствора, процессу кристаллизации воды, и температура кристаллизации понизится.
Ответ:
Нашли ошибку в задании? Выделите фрагмент и нажмите Ctrl + Enter.
Решение | Определение и примеры
- Связанные темы:
- коллоид рН Твердый раствор идеальное решение закон Генри
См. все сопутствующие материалы →
раствор , в химии гомогенная смесь двух или более веществ в относительных количествах, которые можно непрерывно изменять до так называемого предела растворимости. Термин «раствор» обычно применяется к жидкому состоянию вещества, но возможны растворы газов и твердых тел. Воздух, например, представляет собой раствор, состоящий в основном из кислорода и азота со следовыми количествами нескольких других газов, а латунь представляет собой раствор, состоящий из меди и цинка.
Ниже приводится краткое описание решений. Для полной обработки см. жидкость: Растворы и растворимости.
Викторина «Британника»
Наука: правда или вымысел?
Жизненные процессы во многом зависят от решений. Кислород из легких переходит в раствор в плазме крови, химически соединяется с гемоглобином в эритроцитах и выделяется в ткани организма. Продукты пищеварения также разносятся в растворе к различным частям тела. Способность жидкостей растворять другие жидкости или твердые вещества имеет множество практических применений. Химики используют разницу в растворимости для разделения и очистки материалов, а также для проведения химического анализа. Большинство химических реакций протекают в растворе и зависят от растворимости реагентов. Материалы для химического производственного оборудования выбираются таким образом, чтобы противостоять растворяющему действию их содержимого.
Кислород из легких переходит в раствор в плазме крови, химически соединяется с гемоглобином в эритроцитах и выделяется в ткани организма. Продукты пищеварения также разносятся в растворе к различным частям тела. Способность жидкостей растворять другие жидкости или твердые вещества имеет множество практических применений. Химики используют разницу в растворимости для разделения и очистки материалов, а также для проведения химического анализа. Большинство химических реакций протекают в растворе и зависят от растворимости реагентов. Материалы для химического производственного оборудования выбираются таким образом, чтобы противостоять растворяющему действию их содержимого.
Жидкость в растворе принято называть растворителем, а добавляемое вещество – растворенным. Если оба компонента являются жидкостями, различие теряет значение; тот, который присутствует в меньшей концентрации, вероятно, будет называться растворенным веществом. Концентрация любого компонента в растворе может быть выражена в единицах веса или объема или в молях.
Кристаллы некоторых солей содержат решетки ионов, т. е. атомов или групп атомов с чередующимися положительными и отрицательными зарядами. Когда такой кристалл необходимо растворить, притяжение противоположно заряженных ионов, которые в значительной степени ответственны за сцепление в кристалле, должно быть преодолено электрическими зарядами в растворителе. Они могут быть обеспечены ионами расплавленной соли или электрическими диполями в молекулах растворителя. Такие растворители включают воду, метиловый спирт, жидкий аммиак и фтористый водород. Ионы растворенного вещества, окруженные диполярными молекулами растворителя, отрываются друг от друга и могут свободно мигрировать к заряженным электродам. Такой раствор может проводить электричество, а растворенное вещество называется электролитом.
Потенциальная энергия притяжения между простыми неполярными молекулами (неэлектролитами) очень мала; оно уменьшается примерно как седьмая степень расстояния между ними. Для электролитов энергия притяжения и отталкивания заряженных ионов падает только в первой степени расстояния. Соответственно, их растворы имеют совсем другие свойства, чем растворы неэлектролитов.
Для электролитов энергия притяжения и отталкивания заряженных ионов падает только в первой степени расстояния. Соответственно, их растворы имеют совсем другие свойства, чем растворы неэлектролитов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Обычно предполагается, что все газы полностью смешиваемы (взаимно растворимы во всех соотношениях), но это верно только при нормальном давлении. При высоких давлениях пары химически разнородных газов вполне могут проявлять лишь ограниченную смешиваемость. Многие различные металлы смешиваются в жидком состоянии, иногда образуя узнаваемые соединения. Некоторые достаточно похожи, чтобы образовывать твердые растворы ( см. сплав ).
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Эриком Грегерсеном.
Раствор – определение, типы и примеры
Раствор. Определение
Раствор – это гомогенная смесь молекул растворителя и растворенного вещества. Растворитель — это вещество, которое растворяет другое вещество, разделяя молекулы посредством электрохимических взаимодействий. Затем растворенное вещество диффундирует через растворитель до тех пор, пока концентрация не станет одинаковой во всех частях раствора. Раствор может быть жидким, твердым или газообразным. Кроме того, раствор может представлять собой смесь жидкостей, газов и твердых тел. В некоторых случаях, например в морской воде, раствор состоит из множества различных типов растворенных веществ, таких как соли, кислород и органические молекулы.
Растворитель — это вещество, которое растворяет другое вещество, разделяя молекулы посредством электрохимических взаимодействий. Затем растворенное вещество диффундирует через растворитель до тех пор, пока концентрация не станет одинаковой во всех частях раствора. Раствор может быть жидким, твердым или газообразным. Кроме того, раствор может представлять собой смесь жидкостей, газов и твердых тел. В некоторых случаях, например в морской воде, раствор состоит из множества различных типов растворенных веществ, таких как соли, кислород и органические молекулы.
Типы растворов
Полярные и неполярные растворы
Полярный раствор образуется, когда полярный растворитель растворяет полярное растворенное вещество. Противоположные заряды молекул растворителя взаимодействуют с противоположными зарядами молекул растворенного вещества, что распределяет их по всему растворителю. В полярном растворе связи заряжены статически, т. е. не меняются. Это не относится к неполярному раствору.
В неполярном растворе тот же самый принцип противоположных зарядов, действующих друг на друга, заставляет растворитель растворять растворенное вещество. Однако неполярные молекулы не имеют статического заряда. Вместо этого электроны иногда группируются на одной стороне молекулы. Эта отрицательная область отталкивает электроны от других молекул и создает области с положительным зарядом. Эти индуцированные заряды движутся по всему раствору, перемешивая его и перемещая молекулы растворенного вещества.
Кислотные и основные растворы
В биологических системах важна кислотность раствора. Если раствор слишком кислый или слишком щелочной, белки в клетке потеряют свою форму и не будут функционировать должным образом. Вода является растворителем в большинстве биологических систем, и многие химические вещества могут изменить кислотность воды. Клетки имеют множество механизмов для поддержания баланса кислот и основы их клеток. Клетки активно выводят свободные радикалы (заряженные молекулы) и кислые протоны из клетки, когда это необходимо. Некоторые клетки также могут производить буферы или химические вещества, которые поддерживают определенную кислотность раствора. Ученые используют Шкала рН для измерения кислотности, которая зависит от концентрации протонов, присутствующих в воде. Чем больше протонов, тем кислее раствор.
Некоторые клетки также могут производить буферы или химические вещества, которые поддерживают определенную кислотность раствора. Ученые используют Шкала рН для измерения кислотности, которая зависит от концентрации протонов, присутствующих в воде. Чем больше протонов, тем кислее раствор.
Примеры раствора
Питательные вещества в почве
Для выживания растениям необходим доступ к питательным веществам и минералам в почве. Чтобы получить эти питательные вещества и минералы, растения должны распространять питательные вещества через мембраны своих корней. Для этого питательные вещества должны быть растворены водой. Затем раствор омывает корни, и белки, встроенные в корневые мембраны, могут транспортировать питательные вещества в клетки. Как только клетки получают питательные вещества, больше воды заполняет клетки. Этот механизм в растениях позволяет воде и питательным веществам течь от корней к верхним листьям даже в самых высоких деревьях. На листьях растение испаряет воду в воздух, позволяя осмотическому давлению продолжать заставлять питательные вещества и поливать листья. Все это возможно, потому что вода — отличный раствор, который создает растворы, необходимые для жизни.
Все это возможно, потому что вода — отличный раствор, который создает растворы, необходимые для жизни.
Цветочный нектар
Многие цветы выделяют в своих цветках раствор, привлекающий пчел, птиц и других опылителей. В растворе используется растворитель из воды и растворенного вещества сахара. Вода — полярный растворитель, а сахар — полярное растворенное вещество. Вместе они составляют полярный раствор. Этот сахарно-водный раствор является легко усваиваемым источником питания для опылителей. Пчелы используют раствор для создания меда, еще одного более вязкого раствора, используемого для кормления их детенышей. Колибри и некоторые другие опылители просто используют раствор для получения энергии. Хотя это может показаться не таким уж большим, связи сахара содержат огромное количество энергии. На самом деле, даже человеческое тело использует глюкозу для получения энергии. Большая часть сахара, который мы едим, поступает из фруктов и овощей и находится в более сложной форме, которую наш организм должен расщепить.
- Растворенное вещество – Молекулы, взвешенные в растворе растворителем.
- Растворитель – Материал или вещество, которое растворяет молекулы растворенного вещества в растворе.
- Полярность – количество положительных и отрицательных зарядов молекулы и то, как они взаимодействуют.
- Концентрация – Количество растворенного вещества на объем растворителя в растворе.
Тест
1. Вы пьете газировку. В нем есть сахар, вода и углекислый газ. Какие из них являются растворенными в этом растворе? 9
C. Сахар и углекислый газ В этом случае вода действует как растворитель, распределяя и удерживая сахар и воду. Однако после того, как вы откроете газировку, концентрация углекислого газа в газировке будет выше, чем в атмосфере. Таким образом, CO 2 имеет тенденцию покидать банку, из-за чего ваша газировка испаряется. Углекислый газ может легко диффундировать из воды, потому что это не полярная молекула. С другой стороны, сахар существует в виде растворенного твердого вещества и представляет собой полярную молекулу, которая будет оставаться в растворе до тех пор, пока вода не выкипит.
С другой стороны, сахар существует в виде растворенного твердого вещества и представляет собой полярную молекулу, которая будет оставаться в растворе до тех пор, пока вода не выкипит.
2. Если у вас когда-либо был аквариум, вы знаете, что барботеры важны. Барботер — это небольшое устройство, которое создает пузырьки на дне резервуара и позволяет им подняться наверх. Пока они поднимаются, пузырьки распространяют кислород в воду. Этот кислород нужен рыбам, чтобы выжить. Если вода в резервуаре является раствором, то что является растворенным веществом и растворителем?
A. Растворитель=H 2 O, растворенное вещество=кислород
B. Растворитель=кислород, растворенное вещество=H 2 O
C. Растворитель=Кислород , Растворенное вещество=Кислород
Ответ на вопрос №2
Правильно . Кислород представляет собой полярную молекулу, которая может растворяться в растворителе, воде. В то время как «вода из резервуара» является раствором, чистая вода является растворителем. Вода в резервуаре включает в себя все растворенные вещества в резервуаре, включая кислород, минералы, углекислый газ и многие другие.
В то время как «вода из резервуара» является раствором, чистая вода является растворителем. Вода в резервуаре включает в себя все растворенные вещества в резервуаре, включая кислород, минералы, углекислый газ и многие другие.
3. Концентрация протонов, растворенных в воде, является мерой кислотности раствора. Ученые разработали шкалу рН как быструю ссылку на количество протонов в растворе. Кислоты ближе к 0, а основные растворы ближе к 14. Ниже приведены значения pH различных растворов. В каком из них растворено больше всего протонов?
A. 12
B. 4
C. 5
Ответ на вопрос № 3
B верно. Чем ближе к 0, тем кислее. Следовательно, раствор с наименьшим номером будет иметь наибольшую концентрацию протонов. Из них pH 4 является самым низким. В растворе с рН 12 почти не будет свободного водорода по сравнению с растворами 4 и 5. Однако в растворе с рН 4 будет намного больше протонов, чем в растворе с рН 5.

Leave A Comment