Генетический код. Задачи — презентация онлайн
ЗАДАЧИ.
ГЕНЕТИЧЕСКИЙ КОД
ЗАДАЧА №1
Определите последовательность
нуклеотидов на иРНК, антикодоны
тРНК и аминокислотную
последовательность соответствующего
фрагмента молекулы белка (используя
таблицу генетического кода), если
фрагмент цепи ДНК имеет следующую
последовательность нуклеотидов: ГТГ
ЦЦГ ТЦА ААА.
РЕШЕНИЕ
По принципу комплиментарности определяем последовательность иРНК (с
ДНК) и тРНК (с иРНК)
1) Последовательность на и-РНК:
ЦАЦГГЦАГУУУУ;
2) антикодоны на т-РНК:
ГУГ,ЦЦГ,УЦА,ААА;
3) аминокислотная последовательность:
Гис-гли-сер-фен
ЗАДАЧА №2
Одна из цепей ДНК имеет последовательность нуклеотидов:
ЦАТГГЦТГТТЦЦГТЦ Объясните, как
изменится структура молекулы белка,
если произойдет удвоение четвертого
триплета нуклеотидов в цепи ДНК?
РЕШЕНИЕ
1) Произошла дупликация. Новая цепь
ДНК будет: ЦАТ ГГЦ ТГТ ТЦЦ ТЦЦ
ГТЦ.
2) Структура и-РНК будет: ГУА ЦЦГ
АЦА АГГ АГГ ЦАГ.
3) Произойдет удлинение молекулы
белка на одну аминокислоту. Молекула
белка будет состоять из аминокислот:
вал – про – тре – арг – арг – глн.
ЗАДАЧА №3
В биосинтезе полипептида участвуют молекулы т-РНК с антикодонами УГА, АУГ,
АГУ, ГГЦ, ААУ. Определите нуклеотидную
последовательность участка каждой цепи
молекулы ДНК, который несет информацию
о синтезируемом полипептиде, и число нуклеотидов, содержащих аденин (А), гуанин
(Г), тимин (Т), цитозин (Ц) в двухцепочной
молекуле ДНК. Ответ поясните.
РЕШЕНИЕ
1) и-РНК: АЦУ УАЦ УЦА ЦЦГ УУА (по
принципу комплементарности).
2) ДНК: 1-ая цепь: ТГА АТГ АГТ ГГЦ
ААТ
2-ая цепь: АЦТ ТАЦ ТЦА ЦЦГ ТТА
3) количество нуклеотидов: А — 9 (30%),
Т — 9 (30%),
так как А=Т; Г — 6 (20%), Ц — 6 (20%), так
как Г=Ц.
ЗАДАЧА №4
Антикодоны тРНК поступают к рибосомам
в следующей последовательности нуклеотидов УЦГ, ЦГА, ААУ, ЦЦЦ. Определите последовательность нуклеотидов на иРНК, последовательность нуклеотидов на ДНК, кодирующих определенный белок и последовательность аминокислот во фрагменте молекулы синтезируемого белка, используя
Определите последовательность нуклеотидов на иРНК, последовательность нуклеотидов на ДНК, кодирующих определенный белок и последовательность аминокислот во фрагменте молекулы синтезируемого белка, используя
таблицу генетического кода.
ЗАДАЧА №5
Определите
последовательность
нуклеотидов на и-РНК, антикодоны
соответствующих
т-РНК
и
аминокислотную последовательность
соответствующего
фрагмента
молекулы белка (используя таблицу
генетического кода), если фрагмент
цепи
ДНК
имеет
следующую
последовательность
нуклеотидов:
ГТГТАТГГААГТ.
ЗАДАЧА №6
Фрагмент цепи ДНК имеет следующую
поcледовательность нуклеотидов:
ТАЦЦЦТЦАЦТТГ. Определите
последовательность нуклеотидов на
иРНК, антикодоны соответствующих
тРНК и аминокислотную
последовательность соответствующего
фрагмента молекулы белка, используя
таблицу генетического кода.
ЗАДАЧА №7
В
процессе
трансляции
участвовало 30 молекул тРНК.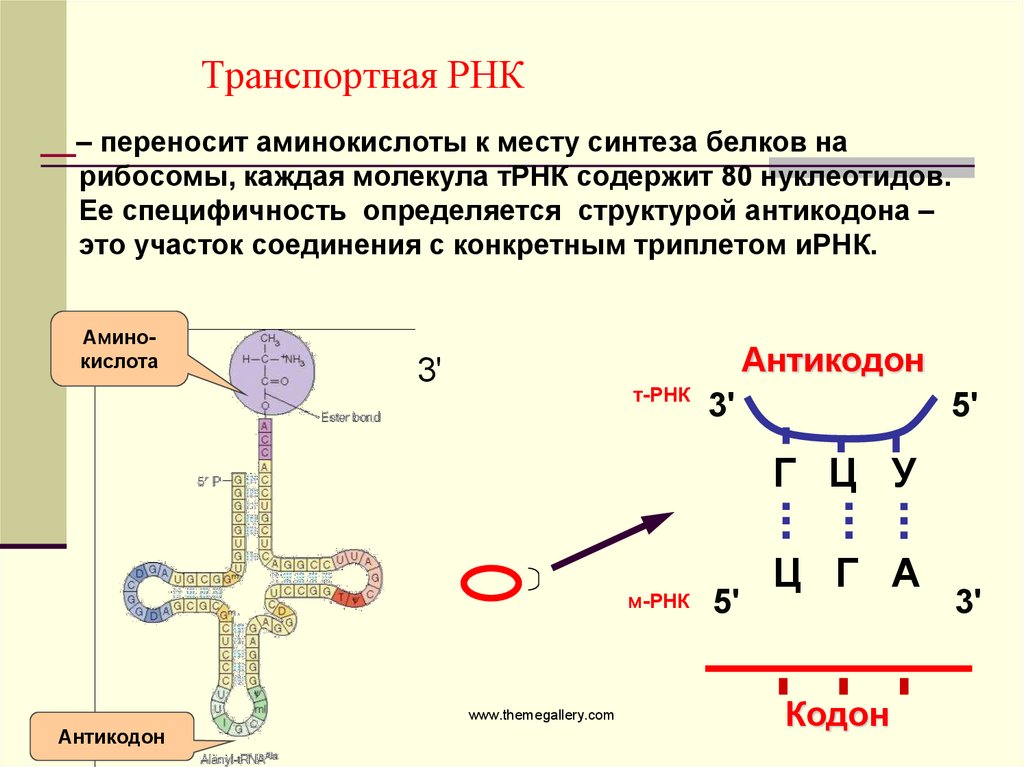
Определите число аминокислот,
входящих в состав синтезируемого
белка, а также число триплетов и
нуклеотидов в гене, который
кодирует этот белок.
РЕШЕНИЕ
1) одна тРНК транспортирует одну аминокислоту, следовательно, 30 тРНК соответствуют 30 аминокислотам, и белок состоит
из 30 аминокислот;
2) одну аминокислоту кодирует триплет
нуклеотидов, значит, 30 аминокислот, кодируют 30 триплетов;
3) количество нуклеотидов в гене, кодирующем белок из 30 аминокислот, 30 х 3 = 90.
ЗАДАЧА №8
и-РНК состоит из 156 нуклеотидов.
Определите
число
аминокислот,
входящих в кодируемый ею белок,
число молекул т-РНК, участвующих в
процессе биосинтеза этого белка, и
количество
триплетов
в
гене,
кодирующем первичную структуру
белка.
Объясните
полученные
результаты.
РЕШЕНИЕ
1. Белок содержит 52 аминокислоты, т.к.
одну аминокислоту кодирует один триплет
(156:3).
2. т-РНК транспортирует к месту синтеза
белка одну аминокислоту, следовательно,
всего в синтезе участвуют 52 т-РНК.
3. В гене первичную структуру белка кодируют 52 триплета, так как каждая аминокислота кодируется одним триплетом
ЗАДАЧА №9
В результате мутации во фрагменте молекулы белка аминокислота треонин (тре) заменилась на глутамин (глн). Определите аминокислотный состав фрагмента молекулы
нормального и мутированного белка и
фрагмент мутированной иРНК, если в
норме иРНК имеет последовательность:
ГУЦАЦАГЦГАУЦААУ. Ответ поясните. Для
решения задания используйте таблицу генетического кода.
РЕШЕНИЕ
1) иРНК ГУЦ−АЦА-ГЦГ- АУЦ- ААУ
нормальный белок вал–тре-ала-иле-асн
(Определяем последовательность аминокислот с помощью таблицы генетического кода.)
2) После мутации фрагмент молекулы белка
будет иметь состав вал-глн-ала-иле-асн.
3) Глутамин кодируется двумя кодонами ЦАА и
ЦАГ, следовательно, мутированная иРНК будет
ГУЦ−ЦАА−ГЦГ−АУЦ−ААУ или
ГУЦ−ЦАГ−ГЦГ−АУЦ−ААУ.
ЗАДАЧА №10
В одной молекуле ДНК нуклеотиды с
тимином (Т) составляют 24% от общего числа нуклеотидов.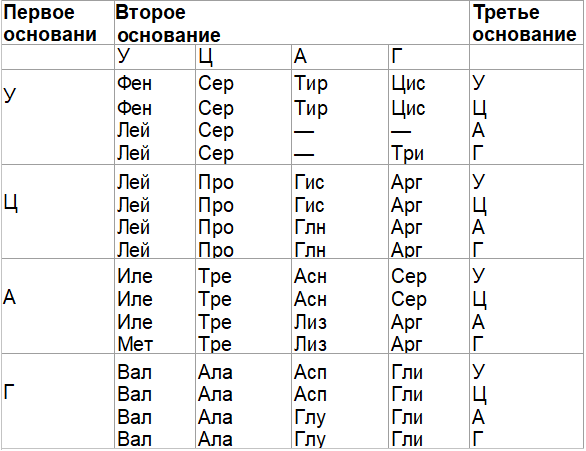 Определите количество (в %) нуклеотидов с гуанином (Г), аденином (А), цитозином (Ц) в
Определите количество (в %) нуклеотидов с гуанином (Г), аденином (А), цитозином (Ц) в
молекуле ДНК и объясните полученные результаты.
РЕШЕНИЕ
Аденин (А) комплементарен тимину (Т), а
гуанин (Г) — цитозину (Ц), поэтому количество комплементарных нуклеотидов одинаково;
2) количество нуклеотидов с аденином составляет 24%;
3) количество гуанина (Г) и цитозина (Ц)
вместе составляют 52%, а каждого из них —
26%.
ЗАДАЧА №11
Известно, что все виды РНК синтезируются на
ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет
следующую последовательность нуклеотидов: ТЦЦГЦАТАЦГАТАГГ. Установите нуклеотидную последовательность участка тРНК, который синтезируется на
данном фрагменте, и аминокислоту, которую будет
переносить эта тРНК в процессе биосинтеза белка,
если третий триплет является антикодоном тРНК.
Ответ поясните. Для решения задания используйте
таблицу генетического кода.
РЕШЕНИЕ
1) Синтезируемая тРНК — АГГЦГУАУГЦУАУЦЦ (по принципу комплементарности
на основе указанной цепи ДНК)
2) Так как антикодон тРНК — третий
триплет — АУГ по условию, то кодон на
иРНК — УАЦ
3) Пользуясь таблицей генетического
кода определяем, что кодон на иРНК —
УАЦ — кодирует аминокислоту –ТИР-
ЗАДАЧА №12
Известно, что все виды РНК синтезируются на
ДНК-матрице. Фрагмент молекулы ДНК, на котором синтезируется участок тРНК, имеет следующую последовательность нуклеотидов ТТГ-ГААААА-ЦГГ-АЦТ. Установите нуклеотидную последовательность участка тРНК который синтезируется
Фрагмент молекулы ДНК, на котором синтезируется участок тРНК, имеет следующую последовательность нуклеотидов ТТГ-ГААААА-ЦГГ-АЦТ. Установите нуклеотидную последовательность участка тРНК который синтезируется
на данном фрагменте. Какой кодон иРНК будет
соответствовать центральному антикодону этой
тРНК? Какая аминокислота будет транспортироваться этой тРНК? Ответ поясните. Для решения
задания используйте таблицу генетического
кода.
РЕШЕНИЕ
Нуклеотидная последовательность
участка тРНК: ААЦ,ЦУУ,УУУ,ГЦЦ,УГА;
2) нуклеотидная последовательность
антикодона тРНК — УУУ;
3) нуклеотидная последовательность
кодона иРНК — ААА;
4) транспортируемая аминокислота — лизин.
1)
ЗАДАЧА №13
Генетический аппарат вируса представлен молекулой РНК, фрагмент которой имеет следующую нуклеотидную последовательность: Г УГАААГАУЦАУГЦГ УГГ. Определите нуклеотидную последовательность
двуцепочной молекулы ДНК, которая синтезируется
в результате обратной транскрипции на РНК вируса. Установите последовательность нуклеотидов в
Установите последовательность нуклеотидов в
и-РНК и аминокислот во фрагменте белка вируса,
которая закодирована в найденном фрагменте молекулы ДНК. Матрицей для синтеза иРНК, на которой идёт синтез вирусного белка, является вторая
цепь двуцепочной ДНК. Для решения задачи используйте таблицу генетического кода.
РЕШЕНИЕ
1) РНК вируса: ГУГ ААА ГАУ ЦАУ ГЦГ УГГ
ДНК 1 цепь: ЦАЦ ТТТ ЦТА ГТА ЦГЦ АЦЦ
ДНК 2 цепь: ГТГ ААА ГАТ ЦАТ ГЦГ ТГГ
2) иРНК: ЦАЦ УУУ ЦУА ГУА ЦГЦ АЦЦ (по
принципу комплементарности построена по 2 цепи ДНК)
3) белок: гис – фен – лей – вал – арг –
тре (по таблице генетического кода, на
основе найденной иРНК)
ЗАДАЧА №14
Последовательность аминокислот
во фрагменте молекулы белка следующая: ФЕН-ГЛУ-МЕТ. Определите,
пользуясь таблицей генетического
кода, возможные триплеты ДНК, которые кодируют этот фрагмент
белка.
РЕШЕНИЕ
1)
Аминокислота ФЕН кодируется следующими
триплетами иРНК: У У У или У УЦ, следовательно,
на ДНК ее кодируют триплеты ААА или ААГ.
2) Аминокислота ГЛУ кодируется следующими
триплетами иРНК: ГАА или ГАГ. Следовательно,
на ДНК ее кодируют триплеты ЦТТ или ЦТЦ.
3) Аминокислота МЕТ кодируется триплетом
и-РНК АУГ. Следовательно, на ДНК ее кодирует
триплет ТАЦ.
ЗАДАЧА №15
Белок состоит из 100 аминокислот.
Установите, во сколько раз
молекулярная масса участка гена,
кодирующего данный белок,
превышает молекулярную массу
белка, если средняя молекулярная
масса аминокислоты – 110, а
нуклеотида — 300. Ответ поясните.
РЕШЕНИЕ
1) генетический код триплетен,
следовательно, белок, состоящий из 100
аминокислот, кодируют 300 нуклеотидов;
2) молекулярная масса белка 100 х 110 =
11000; молекулярная масса гена 300 х
300 = 90000;
3) участок ДНК тяжелее, чем кодируемый
им белок, в 8 раз (90 000/11 000).
ЗАДАЧА №16
Дан фрагмент двухцепочечной молекулы ДНК. Воспользовавшись таблицей
генетического кода, определите, какие
фрагменты белковых молекул могут кодироваться кодируемой этим участком
ДНК. Укажите не менее трёх этапов
Укажите не менее трёх этапов
данного процесса. Ответ докажите.
ДНК: ААА ТТТ ГГГ ЦЦЦ
ТТТ ААА ЦЦЦ ГГГ
РЕШЕНИЕ
1) Если и-РНК синтезируется на верхней цепи ДНК, то её фрагмент будет
УУУАААЦЦЦГГГ.
2) Фрагмент белка: фен–лиз–про–гли.
3) Если белок кодируется нижней
цепью, то иРНК — АААУУУГГГЦЦЦ.
4) Фрагмент белка: лиз–фен–гли−про.
Решение задач третьего типа. Определение последовательности аминокислотного состава белка с использованием генетического года. — Студопедия
Поделись с друзьями:
Справочная информация:
Транскрипция — это процесс синтеза и-РНК по матрице ДНК.
Транскрипция осуществляется по правилу комплементарности.
В состав РНК вместо тимина входит урацил.
Пример1. Фрагмент одной из цепей ДНК имеет следующее строение: ААГГЦТАЦГТТГ. Постройте на ней и-РНК и определите последовательность аминокислот во фрагменте молекулы белка.
Элементы ответа:
1)по правилу комплементарности определяем фрагмент и-РНК и разбиваем его на триплеты: УУЦ-ЦГА-УГЦ-ААУ.
2)по таблице генетического кода определяем последовательность аминокислот: фен-арг-цис-асн.
Пример 2. Дан фрагмент двухцепочечной молекулы ДНК. Воспользовавшись таблицей генетического кода, определите, какие фрагменты белковых молекул могут кодироваться кодируемой этим участком ДНК. Укажите не менее трёх этапов данного процесса. Ответ докажите.
ДНК
ААА – ТТТ – ГГГ – ЦЦЦ
ТТТ – ААА – ЦЦЦ – ГГГ
Генетический код (иРНК)
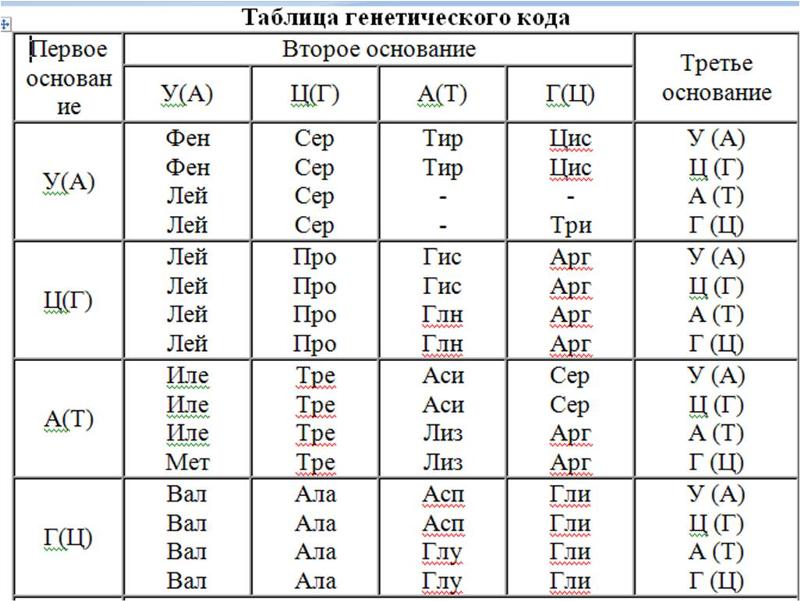
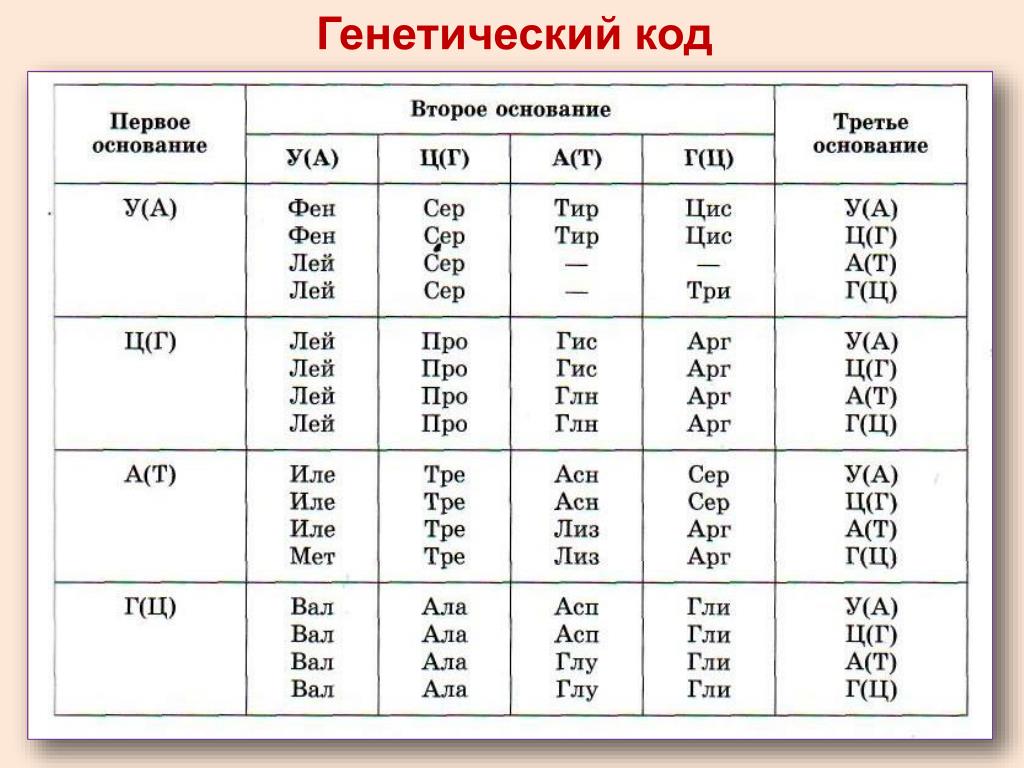
| Первое основание | Второе основание | Третье основание | |||
| У | Ц | А | Г | ||
| У | Фен Фен Лей Лей | Сер Сер Сер Сер | Тир Тир — — | Цис Цис — Три | У Ц А Г |
| Ц | Лей Лей Лей Лей | Про Про Про Про | Гис Гис Глн Глн | Арг Арг Арг Арг | У Ц А Г |
| А | Иле Иле Иле Мет | Тре Тре Тре Тре | Асн Асн Лиз Лиз | Сер Сер Арг Арг | У Ц А Г |
| Г | Вал Вал Вал Вал | Ала Ала Ала Ала | Асп Асп Глу Глу | Гли Гли Гли Гли | У Ц А Г |
Правила пользования таблицей
Первый нуклеотид в триплете берётся из левого вертикального ряда, второй — из верхнего горизонтального ряда и третий — из правого вертикального. Там, где пересекутся линии, идущие от всех трёх нуклеотидов, и находится искомая аминокислота.
Там, где пересекутся линии, идущие от всех трёх нуклеотидов, и находится искомая аминокислота.
Элементы ответа:
1) Если и-РНК синтезируется на верхней цепи ДНК, то её фрагмент будет УУУАААЦЦЦГГГ.
2) Фрагмент белка: фен–лиз–про–гли.
3) Если белок кодируется нижней цепью, то иРНК — АААУУУГГГЦЦЦ.
4) Фрагмент белка: лиз–фен–гли−про.
Пример3. Последовательность аминокислот во фрагменте молекулы белка следующая: ФЕН-ГЛУ-МЕТ. Определите, пользуясь таблицей генетического кода, возможные триплеты ДНК, которые кодируют этот фрагмент белка.
Элементы ответа:
1) Аминокислота ФЕН кодируется следующими триплетами иРНК: УУУ или УУЦ, следовательно, на ДНК ее кодируют триплеты ААА или ААГ.
2) Аминокислота ГЛУ кодируется следующими триплетами иРНК: ГАА илиГАГ. Следовательно, на ДНК ее кодируют триплеты ЦТТ или ЦТЦ.
3) Аминокислота МЕТ кодируется триплетом иРНК АУГ. Следовательно, на ДНК ее кодирует триплет ТАЦ.
Пример 4. Одна из цепей ДНК имеет последовательность нуклеотидов: ЦАТ-ГГЦ-ТГТ–ТЦЦ–ГТЦ… Объясните, как изменится структура молекулы белка, если произойдет удвоение четвертого триплета нуклеотидов в цепи ДНК?
Элементы ответа:
1) Произошла дупликация. Новая цепь ДНК будет: ЦАТ — ГГЦ — ТГТ – ТЦЦ — ТЦЦ – ГТЦ.
2) Структура и-РНК будет: ГУА – ЦЦГ – АЦА – АГГ – АГГ – ЦАГ.
3) Произойдет удлинение молекулы белка на одну аминокислоту. Молекула белка будет состоять из аминокислот: вал – про – тре – арг – арг – глн.
Пример 5. Генетический аппарат вируса представлен молекулой РНК, фрагмент которой имеет следующую нуклеотидную последовательность: ГУГАААГАУЦАУГЦГУГГ. Определите нуклеотидную последовательность двуцепочной молекулы ДНК, которая синтезируется в результате обратной транскрипции на РНК вируса.
Элементы ответа:
1) РНК вируса ГУГ ААА ГАУ ЦАУ ГЦГ УГГ
ДНК 1 цепь ЦАЦ ТТТ ЦТА ГТА ЦГЦ АЦЦ
ДНК 2 цепь ГТГ ААА ГАТ ЦАТ ГЦГ ТГГ
2) иРНК ЦАЦ УУУ ЦУА ГУА ЦГЦ АЦЦ
3) белок гис – фен – лей – вал – арг – тре
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Аминокислотная последовательность фрагмента А, ферментативно активного фрагмента дифтерийного токсина. III. Химотриптические пептиды, пептиды, полученные расщеплением остатков триптофана, и полная последовательность белка
. 1979 г., 10 июля; 254 (13): 5838-42.
1979 г., 10 июля; 254 (13): 5838-42.
Р. Дж. ДеЛанж, Л. К. Уильямс, Р. Э. Дразин, Р. Дж. Коллиер
- PMID: 221484
Бесплатная статья
Р. Дж. ДеЛанж и др. Дж. Биол. Хим. .
Бесплатная статья
. 1979 г., 10 июля; 254 (13): 5838-42.
Авторы
Р. Дж. ДеЛанж, Л. К. Уильямс, Р. Э. Дразин, Р. Дж. Коллиер
- PMID: 221484
Абстрактный
Фрагмент А (21 145 дальтон в его самой длинной известной форме) может быть получен из дифтерийного токсина (60 000 дальтон) путем мягкого расщепления и восстановления трипсином.
Похожие статьи
Аминокислотная последовательность фрагмента А, ферментативно активного фрагмента дифтерийного токсина.
 II. Цианогенбромидные пептиды.
II. Цианогенбромидные пептиды.Дразин Р.Э., Коллиер Р.Дж., Уильямс Л.С., ДеЛанж Р.Дж. Дразин Р.Э. и соавт. Дж. Биол. Хим. 1979 г., 10 июля; 254 (13): 5832-7. Дж. Биол. Хим. 1979. PMID: 221483
Аминокислотная последовательность фрагмента А, ферментативно активного фрагмента дифтерийного токсина. I. Триптические пептиды малеилированного белка.
DeLange RJ, Williams LC, Collier RJ. ДеЛанж Р.Дж. и соавт. Дж. Биол. Хим. 1979 г., 10 июля; 254(13):5827-31. Дж. Биол. Хим. 1979. PMID: 221482
Наличие триптофана в ферментативно активном центре фрагмента дифтерийного токсина А.
Мишель А., Диркс Дж. Мишель А. и др. Биохим Биофиз Акта.
 1977 г., 28 марта; 491 (1): 286–95. doi: 10.1016/0005-2795(77)
1977 г., 28 марта; 491 (1): 286–95. doi: 10.1016/0005-2795(77)-2. Биохим Биофиз Акта. 1977. PMID: 849463
Аминокислотная последовательность фрагмента А, ферментативно активного фрагмента дифтерийного токсина.
ДеЛанж Р.Дж., Дразин Р.Е., Коллиер Р.Дж. ДеЛанж Р.Дж. и соавт. Proc Natl Acad Sci U S A. 1976 января; 73 (1): 69-72. doi: 10.1073/pnas.73.1.69. Proc Natl Acad Sci U S A. 1976. PMID: 1061128 Бесплатная статья ЧВК.
Дифтерийный токсин.
Паппенгеймер А. М. мл. Паппенгеймер А.М. мл. Анну Рев Биохим. 1977; 46:69-94. doi: 10.1146/annurev.bi.46.070177.000441. Анну Рев Биохим. 1977. PMID: 20040 Обзор.
 Аннотация недоступна.
Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
Общее мультиплексирование тандемных масс-меток на основе эталонов для относительного количественного определения пептидов: разработка и применение для анализа деградации дифтерийного анатоксина.
Michiels TJM, van Veen MA, Meiring HD, Jiskoot W, Kersten GFA, Metz B. Michiels TJM и др. J Am Soc Масс-спектр. 2021 2 июня; 32(6):1490-1497. дои: 10.1021/jasms.1c00070. Epub 2021 13 мая. J Am Soc Масс-спектр. 2021. PMID: 33983728 Бесплатная статья ЧВК.
Детоксикация нескольких тяжелых металлов полумолекулярным переносчиком ABC, HMT-1, и целомоцитами Caenorhabditis elegans.
Шварц М.
 С., Бенчи Д.Л., Селоте Д.С., Шарма А.К., Чен А.Г., Данг Х., Фарес Х., Ватаманюк О.К.
Шварц М.С. и соавт.
ПЛОС Один. 2010 5 марта; 5 (3): e9564. doi: 10.1371/journal.pone.0009564.
ПЛОС Один. 2010.
PMID: 20221439
Бесплатная статья ЧВК.
С., Бенчи Д.Л., Селоте Д.С., Шарма А.К., Чен А.Г., Данг Х., Фарес Х., Ватаманюк О.К.
Шварц М.С. и соавт.
ПЛОС Один. 2010 5 марта; 5 (3): e9564. doi: 10.1371/journal.pone.0009564.
ПЛОС Один. 2010.
PMID: 20221439
Бесплатная статья ЧВК.Генетический анализ эндоцитоза у Caenorhabditis elegans: дефектные мутанты по поглощению целомоцитов.
Фарес Х., Гринвальд И. Фарес Х. и др. Генетика. 2001 г., сен; 159 (1): 133–45. doi: 10.1093/генетика/159.1.133. Генетика. 2001. PMID: 11560892 Бесплатная статья ЧВК.
Модуляция внутриклеточной стабильности и токсичности дифтерийного токсина посредством деградации по пути правила N-конца.
Фальнес PO, Олснес С. Фалнес П.
 О. и соавт.
EMBO J. 15 января 1998 г .; 17 (2): 615–25. doi: 10.1093/emboj/17.2.615.
ЭМБО Дж. 1998.
PMID: 9430652
Бесплатная статья ЧВК.
О. и соавт.
EMBO J. 15 января 1998 г .; 17 (2): 615–25. doi: 10.1093/emboj/17.2.615.
ЭМБО Дж. 1998.
PMID: 9430652
Бесплатная статья ЧВК.Нуклеотидная последовательность структурного гена дифтерийного токсина коринебактериофага бета.
Гринфилд Л., Бьорн М.Дж., Хорн Г., Фонг Д., Бак Г.А., Коллиер Р.Дж., Каплан Д.А. Гринфилд Л. и др. Proc Natl Acad Sci U S A. 1983 Nov; 80 (22): 6853-7. doi: 10.1073/pnas.80.22.6853. Proc Natl Acad Sci U S A. 1983. PMID: 6316330 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
вещества
8.11: Расщепление белков — Биология LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 10449
- Кевин Ахерн, Индира Раджагопал и Таралин Тан
- Университет штата Орегон
Из-за большого размера интактные белки трудно изучать с помощью аналитических методов, таких как масс-спектрометрия.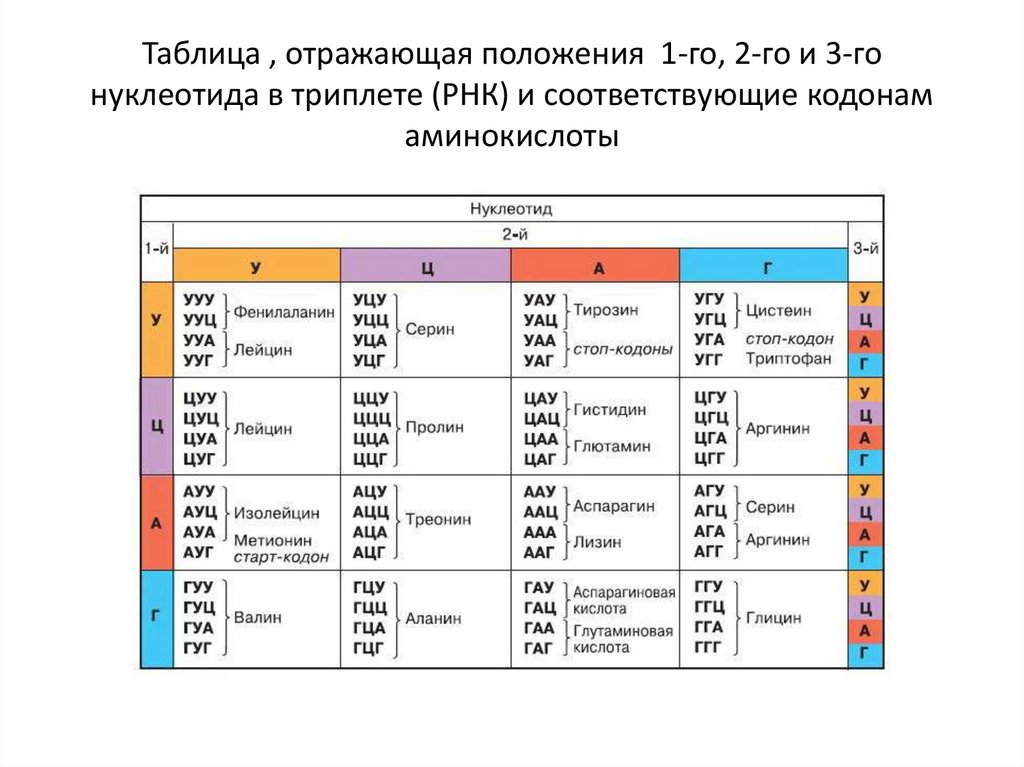 Следовательно, часто желательно разбить большой полипептид на более мелкие части. Протеазы представляют собой ферменты, которые обычно разрывают пептидные связи, связываясь со специфическими последовательностями аминокислот в белке и катализируя их гидролиз.
Следовательно, часто желательно разбить большой полипептид на более мелкие части. Протеазы представляют собой ферменты, которые обычно разрывают пептидные связи, связываясь со специфическими последовательностями аминокислот в белке и катализируя их гидролиз.
Химические реагенты, такие как бромистый циан, который расщепляет пептидные связи на С-концевой стороне остатка метионина, также можно использовать для разрезания более крупных белков на более мелкие пептиды. Общие белки, выполняющие эту функцию, находятся в пищеварительной системе и показаны ниже.
- Субтилизин — С-концевая сторона больших незаряженных боковых цепей
- Химотрипсин — С-концевая сторона ароматических соединений (Phe, Tyr, Trp)
- Трипсин — С-концевая сторона лизина и аргининов (не рядом с пролином)
- Карбоксипептидаза — N-концевая сторона С-концевой аминокислоты
- Эластаза — Гидролиз С-стороны малых аминокислот (Gly, Ala)
- Цианогенбромид (химический) — гидролизует C-сторону Met
 8.45. Сайты расщепления протеазами полипептида
8.45. Сайты расщепления протеазами полипептида. Масс-спектрометрия, как следует из названия, представляет собой метод, который можно использовать для определения массы молекул. Когда-то ограниченный анализом малых молекул, с тех пор он был адаптирован и улучшен для анализа биологически важных молекул, таких как белки и нуклеиновые кислоты. Масс-спектрометры используют электрическое поле для ускорения ионизированной молекулы по направлению к детектору. Время, необходимое ионизированной молекуле для перемещения от точки ионизации до детектора, будет зависеть как от ее массы, так и от ее заряда, и называется временем ее пролета (TOF).
MALDI-TOF
Рисунок 8.46 – Настольная система MALDI-TOF MALDI-TOF (матричная лазерная десорбционная ионизация – время пролета) представляет собой аналитический метод, позволяющий определять молекулярные массы биологически значимых молекул с большой точностью. точность. Он широко используется в протеомике и определении массы больших биомолекул, в том числе нуклеиновых кислот. Разработка MALDI, которая позволяет производить ионные формы относительно больших молекул, имела решающее значение для успешного использования масс-спектрометрии биомолекул. На рис. 8.46 показана компактная система MALDI-TOF.
Разработка MALDI, которая позволяет производить ионные формы относительно больших молекул, имела решающее значение для успешного использования масс-спектрометрии биомолекул. На рис. 8.46 показана компактная система MALDI-TOF.
Процесс MALDI-TOF состоит из трех основных этапов. Во-первых, анализируемый материал помещают в твердый материал-носитель (матрицу), который можно испарить в вакуумной камере с помощью лазерного луча. Во второй части процесса лазер, сфокусированный на матрице, испаряет образец, заставляя молекулы внутри него испаряться и в процессе образовывать ионы, приобретая или теряя протоны. В-третьих, созданные таким образом ионы в образце ускоряются электрическим полем по направлению к детектору. Скорость их движения к детектору зависит от отношения их массы к заряду (m/z). Ион с массой 100 и зарядом +1 будет двигаться в два раза быстрее, чем ион с массой 200 и зарядом +1, и с той же скоростью, что и ион с массой 200 и зарядом + 2. Таким образом, точно определяя время, необходимое для перехода иона от ионизации (нулевой момент лазерной обработки) до обнаружения, можно легко определить отношение массы к заряду для всех молекул в образце.
Ионизация может привести к дестабилизации более крупных молекул, которые распадаются на более мелкие в камере обнаружения MALDI-TOF. Размер каждого из субфрагментов более крупной молекулы позволяет определить ее идентичность, если это заранее не известно. Эта фрагментация может быть преднамеренно усилена за счет столкновения ускоренных ионов с инертным газом, таким как аргон.
Фрагментация молекулы также может быть проведена перед анализом, например, путем расщепления белка на более мелкие пептиды с использованием ферментов или химических агентов. Аминокислотную последовательность белка можно определить с помощью MALDI-TOF путем анализа точных молекулярных масс множества коротких пептидных фрагментов, полученных из белка. Когда одна аминокислота, например, является фрагментом более крупного пептида, это можно обнаружить как разницу в массе между фрагментом с аминокислотой и без нее, поскольку каждая аминокислота будет иметь характерную молекулярную массу. Таким образом, путем снятия отпечатков пальцев пептидной массы и анализа меньших фрагментов отдельных пептидов можно определить всю последовательность полипептида.

 II. Цианогенбромидные пептиды.
II. Цианогенбромидные пептиды.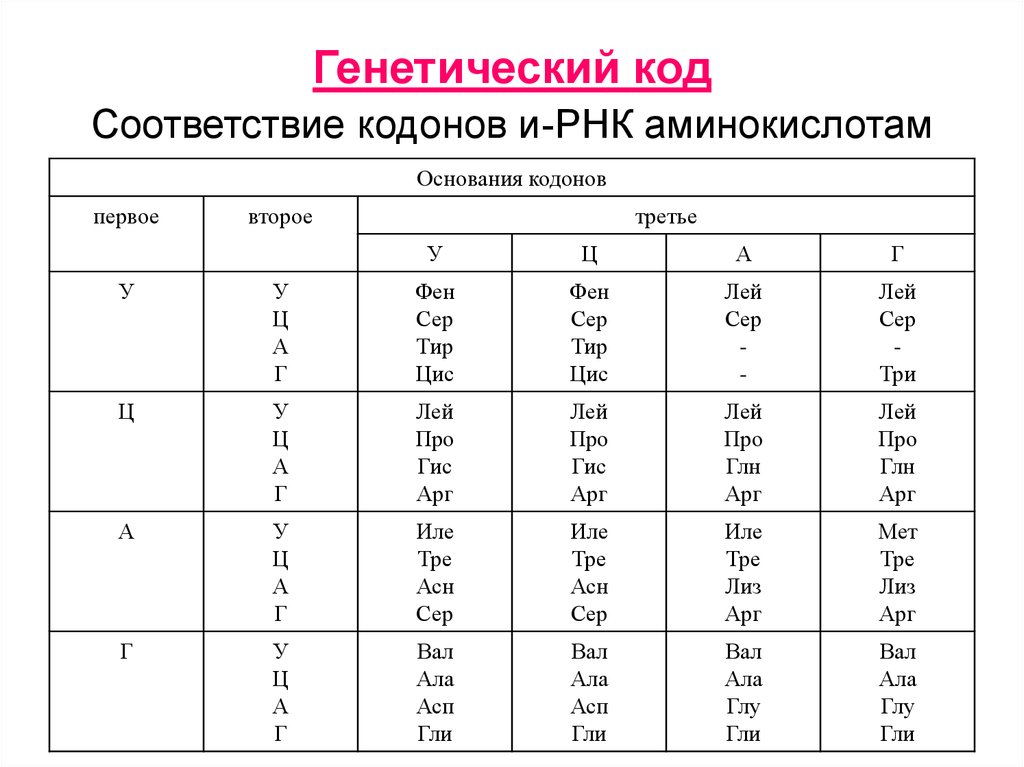 1977 г., 28 марта; 491 (1): 286–95. doi: 10.1016/0005-2795(77)
1977 г., 28 марта; 491 (1): 286–95. doi: 10.1016/0005-2795(77)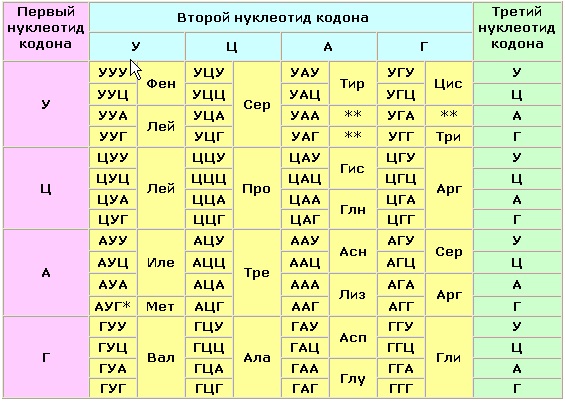 Аннотация недоступна.
Аннотация недоступна. С., Бенчи Д.Л., Селоте Д.С., Шарма А.К., Чен А.Г., Данг Х., Фарес Х., Ватаманюк О.К.
Шварц М.С. и соавт.
ПЛОС Один. 2010 5 марта; 5 (3): e9564. doi: 10.1371/journal.pone.0009564.
ПЛОС Один. 2010.
PMID: 20221439
Бесплатная статья ЧВК.
С., Бенчи Д.Л., Селоте Д.С., Шарма А.К., Чен А.Г., Данг Х., Фарес Х., Ватаманюк О.К.
Шварц М.С. и соавт.
ПЛОС Один. 2010 5 марта; 5 (3): e9564. doi: 10.1371/journal.pone.0009564.
ПЛОС Один. 2010.
PMID: 20221439
Бесплатная статья ЧВК.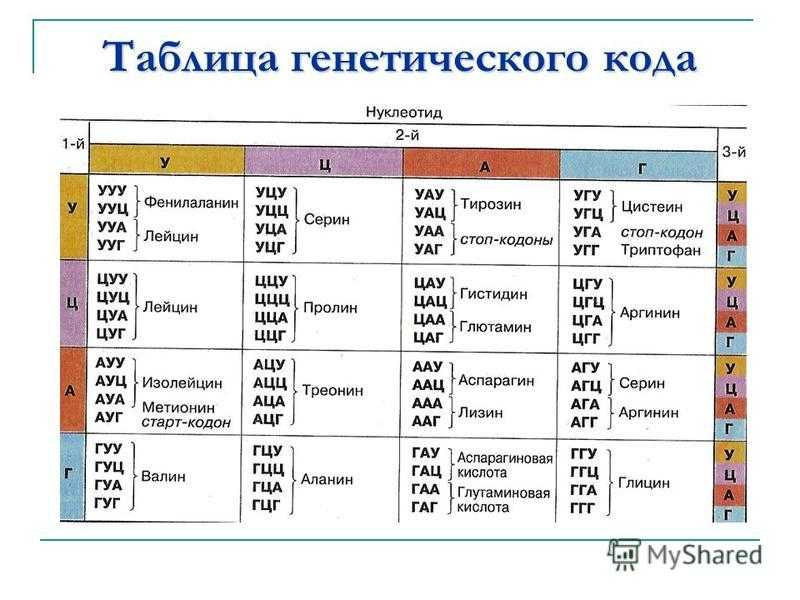 О. и соавт.
EMBO J. 15 января 1998 г .; 17 (2): 615–25. doi: 10.1093/emboj/17.2.615.
ЭМБО Дж. 1998.
PMID: 9430652
Бесплатная статья ЧВК.
О. и соавт.
EMBO J. 15 января 1998 г .; 17 (2): 615–25. doi: 10.1093/emboj/17.2.615.
ЭМБО Дж. 1998.
PMID: 9430652
Бесплатная статья ЧВК.
Leave A Comment