Ковалентная связь | Методическая разработка по химии (8 класс) на тему:
Урок-семинар по теме «Виды ковалентной связи для учащихся 8-го класса по химии»
Цель:
- Закрепить понятие электроотрицательности химических элементов, видов ковалентной связи: полярной и неполярной;
- Упражнять в умении составлять электронные, структурные формулы соединений, объяснять механизм образования ковалентных связей; использовать приобретенные знания и умения в практической деятельности;
- Способствовать развитию коммуникативных умений;
- Развивать логическое мышление.
Методы и приемы:
Эвристическая беседа, фронтальный опрос, тестовая работа, с/р
Оборудование: презентация в PowerPoint Приложение 1, Приложение 2, таблицы, карточки с заданиями, опорный конспект, алгоритм составления образования ковалентной связи, электронных, структурных формул.
Ход урока
Слайд 1. Приложение2
Вступительное слово учителя:
Сегодня на уроке мы проведем семинар по теме “Виды ковалентной связи”.
Слайд 2. Приложение 2
Девиз урока:
“В твоих знаниях, твоя сила. На нашем семинаре, друзья, инертным газом быть нельзя!”
На уроке мы обобщим и закрепим имеющиеся знания по теме “Ковалентная связь”.
Слайд 3. Приложение 2 Слово учителя:
Сегодня на уроке:
- Вы вспомните: что такое электроотрицательность химических элементов, какую связь называют ковалентной, какие виды ковалентной связи существуют.
В ходе урока:
- Вы составите электронные и структурные формулы соединений, определите виды химической связи в соединениях.
- Вы закрепите полученные знания на практике
- Вы получите много полезной научной информации !
- Вы приятно удивитесь: оказывается вы многое знаете!
Слайд 4. Приложение 2 Учитель: Разрешите представить Программу семинара:
I часть “Поделись знаниями”
II часть “Обсуждение главных вопросов семинара”:
1. Электроотрицательность химических элементов
2. Виды ковалентной связи. Механизм образования:
Механизм образования:
— ковалентная неполярная связь
— ковалентная полярная связь
3. Характеристики ковалентной связи.
Часть III.
Тренинг “А как обстоят дела на практике?”:
— определение видов связей в соединениях
— решение задач
Часть IV. “Для любознательных”
Часть V. “Подведем итоги!”
Учитель: Сегодня предоставится возможность участникам семинара высказать свои взгляды, мнения, суждения по главным обсуждаемым вопросам, закрепить полученные знания в ходе выполнения различных заданий. В семинаре принимают участие 2 команды: 1 команда – “Аргон”, 2 команда — “Неон”.В команде свой капитан. Каждая команда должна заработать как можно больше баллов и победить. Также среди учеников будут разыграны номинации “Лучший химик”,“отличник”, “хорошист”, “участник семинара”.
Слайд 5. Приложение 2 Учитель: Переходим к первой части “Поделись знаниями!”. Каждый поучаствует в обсуждении вопросов, выполнив тест. Вам предложен тестовая работа уровня А и Б. Необходимо правильные ответы внести в таблицу. Проверить тест можно по ключу. (Учащиеся выполняют тест). Из массива данных выбрать соответствующий правильный ответ. Приложение1. После выполнения теста учащиеся обмениваются работами друг с другом, проверяют правильность по ключу. (Переход по управляющей кнопке к слайду “Ключ”). Выставляют оценки, сдают работу. (Далее возврат по управляющей кнопке к слайду 5 “Поделись знаниями”.
Необходимо правильные ответы внести в таблицу. Проверить тест можно по ключу. (Учащиеся выполняют тест). Из массива данных выбрать соответствующий правильный ответ. Приложение1. После выполнения теста учащиеся обмениваются работами друг с другом, проверяют правильность по ключу. (Переход по управляющей кнопке к слайду “Ключ”). Выставляют оценки, сдают работу. (Далее возврат по управляющей кнопке к слайду 5 “Поделись знаниями”.
Учитель: Следующее задание. Письменно у доски, выполнить задания по карточкам.
1 задание: Написать схему строения электронной оболочки атома С. Подчеркнуть валентные электроны. Изобразить графически переход атома в возбужденное состояние.
2 задание: Написать схему электронного строения атома Ве. Подчеркнуть валентные электроны. Изобразить графически переход атома в возбужденное состояние.
3 задание: Решить задачу. Мr вещества, формула которого ХСО3, равна 100. Определите, какой элемент обозначен через Х. укажите какую информацию о веществе несет выведенная формула.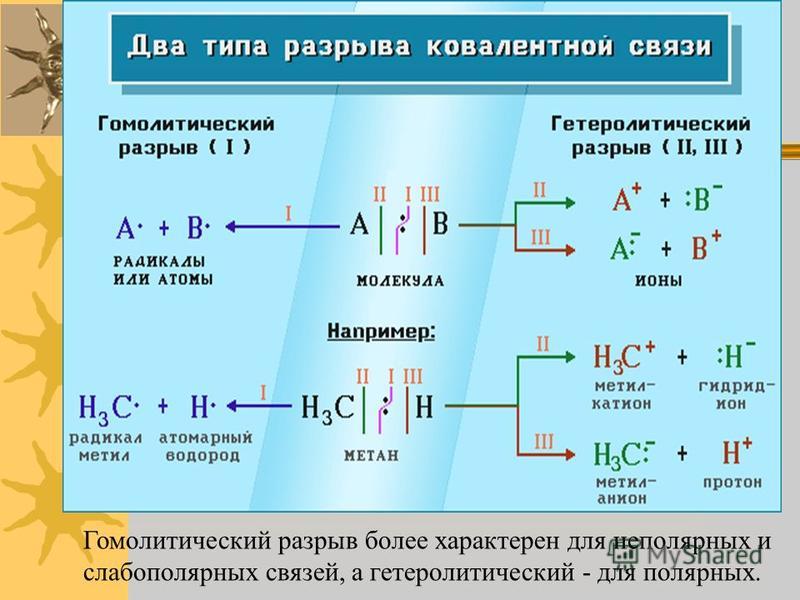 Определите W (O) в веществе.
Определите W (O) в веществе.
Учитель: Все участники семинара примут участие в викторине “Проверь себя”. Кто быстрее и правильно ответит на вопросы, тот заработает больше баллов. За каждый правильный ответ участник получает жетоны. Приложение 2 (Переход со слайда 5. по управляющей кнопке на слайд Тест “Выбери правильный ответ”. Затем, после проведения теста, возврат на слайд “Поделись знаниями )
Вопросы теста “Выбери правильный ответ” (выполняют устно):
6. Радиус атома в ряду увеличивается:
А) Se – S – O
Б) Na – Mg — Al
7. “Третий лишний”.
Выбери лишний элемент, объясни:
а) Na, K, Li, С в) h3O, O2, F2, Сl2
б) Mg, С, N, F г) NaCl, HBr, HI, N2
Устно:
Конкурс “Разминка”
1. Электроны, за счет которых атомы вступают в химические связи называются ……. (валентными).
2. Способность атомов образовывать химические связи называют … (валентностью).
3. Валентные электроны расположены на …. (последнем энергетическом уровне)
4. Что показывает номер группы?
Что показывает номер группы?
5. В чем физический смысл номера периода?
6. Сколько валентных электронов в атоме Са, N?
7. Сила, соединяющая два или несколько взаимодействующих атомов в молекулы называется… (химической связью).
8. Химическая связь, образуемая за счет общих электронных пар называется …. (ковалентной).
9. Неметаллические свойства в периоде с возрастанием заряда ядра ….(увеличиваются)?
10. Металлические свойства в группе сверху вниз ….. (возрастают)?
11. Энергия ионизации — это …
12. Наименьшей энергией ионизации обладают…(металлы). Как изменяется значение энергии ионизации по периоду с возрастанием заряда ядра? (возрастает).
13. Энергия, выделяемая при присоединении одного е к атому, называется … (сродством к электрону).
14. Наибольшим сродством к электрону обладают … (неметаллы).
15. Самый активный неметалл?
16. Самый активный металл?
17. Какими квантовыми числами характеризуется состояние электрона в атоме?
18. В чем физический смысл порядкового номера?
В чем физический смысл порядкового номера?
Слайд.6 ЧастьII “Обсуждение главных вопросов”.
Учитель: Мы обобщили имеющиеся знания. Теперь приступим к обсуждению главных вопросов конференции.
Периодическую систему Д.И. Менделеева заполняют более 107 элементов. Они образуют 7 миллионов простых и сложных веществ. Причина этого явления заключена в том, что, взаимодействуя между собой, атомы элементов вступают в химические связи между собой, образуют тем самым соединения. Какова же причина соединения атомов в молекулы?
Учащиеся: Причиной образования химической связи является стремление атомов металлов и неметаллов путем взаимодействия с другими атомами достичь более устойчивой электронной структуры, подобной структуре инертных элементов.
Учитель: Какие виды химической связи вы знаете? (Слайд. 7 “Виды химической связи.”) Используя представленную на слайде информацию , перечислите.
Учащиеся, используя материал слайда, перечисляют виды химической связи.
Учитель: С механизмом образования какой связи вы уже знакомы?
Учащиеся: Ковалентной.
Учитель: По ходу конференции каждый участник должен составить отчет, отразить важные вопросы в тетради. Учащиеся записывают по ходу уроку задания. Запишите тему урока.
Учитель: Дайте определение ковалентной связи.
Учащиеся: Дают определение.
Учитель: Используя информацию предложенную вам, охарактеризуйте основные моменты отражающие образование ковалентной связи.
Учащиеся дают ответ. (Переход при помощи управляющей кнопки со слайда 7 на слайд 8. Затем на слайд 7 по управляющей кнопке).
Учитель: На прошлом уроке мы рассмотрели механизм образования ковалентной связи. Выяснили, что связь образуется за счет общих электронных пар. На каком расстоянии от ядер атомов находится общая электронная пара в молекуле Н2 , Сl2 ?
Учащиеся: На одинаковом расстоянии.
Учитель: А в соединениях HCl, HF?
Учащиеся: Смещаются в сторону Сl, F.
Учитель: Верно. Как называется способность атомов притягивать к себе общие электронные пары в соединениях. Слайд 9. (Электроотрицательность).
(Электроотрицательность).
Следовательно в молекуле Н2 два атома с одинаковой ЭО, в результате этого общая пара электронов находится на одинаковом расстоянии от ядер. А в молекуле НСl два атома с разной ЭО, при чем у Сl она больше, чем у Н, вследствие этого общая пара е смещается в сторону Сl.
Численные значения электроотрицательности химических элементов представлены в таблице, (ЭОН= 2.1) под порядковым номером. Обратим внимание на значение ЭО. Как она изменяется по периоду с возрастанием зарядов ядер химических элементов.
Учащиеся. В периодах Э.О. элементов возрастает с увеличением заряда ядра, а в главных подгруппах снизу вверх.
Учитель: У металлов значения ЭО 2. Самый электроотрицательный элемент – F, менее электроотрицательный Fr. В какую сторону смещаются общие электронные пары?
Учащиеся: В сторону более электроотрицательного химического элемента.
Учитель: У более электроотрицательного элемента скапливается избыток отрицательного заряда, у менее электроотрицательного избыток положительного заряда. Чем больше различается разность величин ЭО взаимодействующих атомов, тем больше полярность связи. В формулах соединений химический знак менее электроотрицательного элемента пишется на первом месте. (Переход к слайду 10 “Задания”. Учащиеся выполняют представленные задания на слайде). Приложение 2
Чем больше различается разность величин ЭО взаимодействующих атомов, тем больше полярность связи. В формулах соединений химический знак менее электроотрицательного элемента пишется на первом месте. (Переход к слайду 10 “Задания”. Учащиеся выполняют представленные задания на слайде). Приложение 2
Следовательно, на основании сказанного различают два вида ковалентной связи: полярная ковалентная связь и неполярная ковалентная связь. (Слайд 11.) Приложение 2. Основываясь на имеющиеся знания, дайте определение полярной и неполярной ковалентной связи.
Учащиеся: Связь между атомами с одинаковой электроотрицательностью называют ковалентной неполярной связью. Общие электронные пары в равной степени принадлежат обоим атомам.
Связь между атомами, с незначительно отличающимися значениями электроотрицательности называют ковалентной полярной связью. Общие электронные пары смещаются в сторону наиболее электроотрицательного элемента.
Учитель: Необходимо также отметить, что ЭО в неполярной связи = 0, а в полярной связи
Учитель. Слайд 12. Приложение 2. На примере образования молекулы N2 поясните механизм образования ковалентной неполярной связи. (Переход со слайда 11 по управляющей кнопке на слайд13 “Механизм образования молекулы N2 Далее переход на слайд 11 “Виды ковалентной связи”.) Приложение 2
Слайд 12. Приложение 2. На примере образования молекулы N2 поясните механизм образования ковалентной неполярной связи. (Переход со слайда 11 по управляющей кнопке на слайд13 “Механизм образования молекулы N2 Далее переход на слайд 11 “Виды ковалентной связи”.) Приложение 2
Учащиеся. Поясняют механизм образования.
Учитель Слайд. 13. Приложение 2. На примере образования молекулы НF поясняют механизм образования ковалентной полярной связи. (Переход со слайда 11 “Виды ковалентной связи” на слайд14 “Механизм образования ковалентной полярной связи в молекуле HF”. Зтем переход на слайд 11)
(Все учащиеся записывают в тетрадь).
Учитель: Слайд 15. Приложение 2.Закрепим умение составлять электронные, структурные формулы веществ, объяснять механизм образования ковалентной связи, определять ее вид. В этом нам поможет алгоритм, который представленный перед вами. “Выполни упражнение ”: (Переход со слайда 15 по управляющей кнопке на слайд 16.
Задание “Выполни упражнение”.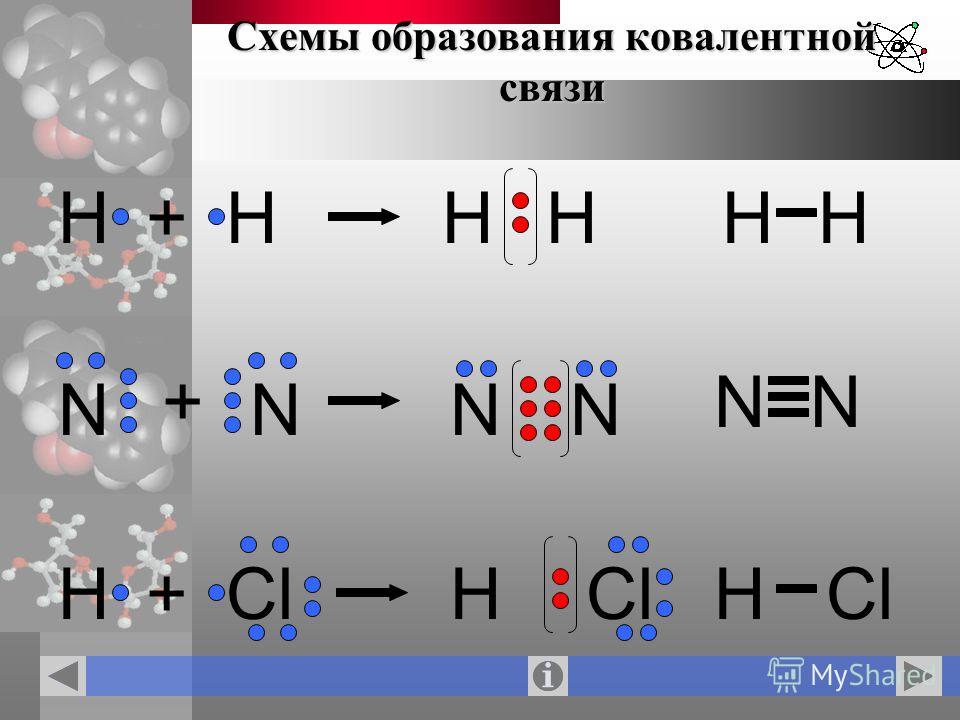
Из приведенного ряда веществ:
О2, НCl, Ch5, N2, h3S, F2, OF2, NaCl, h3, ССl4, СO2, KBr
выпишите соединения с :
а) ковалентной неполярной связью
б) ковалентной полярной связью
Составьте электронные и структурные формулы веществ.
(Затем возврат по управляющей кнопке к слайду 15)
Учитель: Проведем физминутку. Работа по карточкам: если соединение с ковалентной полярной связью, поднимаем левую руку, если соединение с ковалентной неполярной связью поднимаем правую руку. Если неметалл поднимаем две руки вверх, если металл – дотрагиваемся до кончика носа (карточки с соединениями заранее подготовлены учителем). 1- 2 мин.
Учитель: Слайд 15. Приложение 2
Проведем “Химический диктант”. Составь формулу и определи вид химической связи:
А) молекула состоит из трех атомов кислорода – О3
Б) молекула состоит из двух атомов водорода и одного атома кислорода. – h3O
В) три атома водорода один атом фосфора четыре атома кислорода. – h4PO4
Г) шесть атомов кислорода двенадцать атомов водорода шесть атомов кислорода. – С6Н12О6
– С6Н12О6
Учитель: (Переход к слайду 17. Приложение 2. “Характеристики ковалентной связи”
Какими свойствами обладает ковалентная связь?
Учащиеся, используя материал слайда перечисляют. (Далее переход к слайду 18. Приложение 2 “Выполни задание”:
Расположите молекулы в порядке увеличения прочности связи и укажите молекулу с наибольшей длиной связи: F2, N2, S2
(Переход на слайд 20. Часть III.“Тренинг “А как обстоят дела на практике?”.Приложение 2)
Учитель: А теперь переходим к III части Тренингу “Выполни задания”. (По управляющей кнопке 1. переход на слайд 21 “Какие утверждения верны” По мере выполнения, со слайда 21 по управляющей кнопке возврат к слайду 20)
Задание 1. Проверь свои знания. Какие утверждения верны.
“Проверь себя! Верны ли утверждения”:
- В молекулах соединений: НСl, Nh4 связь ковалентная полярная.
- В молекулах соединений: Сl2, h3связь ковалентная неполярная.
- В молекулах соединений Br2, O2 связь ковалентная полярная.

- В молекулах соединений СO2, N2O связь ковалентная неполярная
- Наиболее электроотрицательный элемент O.
- В ходе образования химической связи общая электронная пара смещается в сторону наиболее электроотрицательного элемента.
- У металлов электроотрицательность > 2.
- Наименьшей электроотрицательностью обладает атом Fr.
- В молекуле азота тройная связь
- Длина связи – это расстояние между ядрами атомов в молекуле.
- Электроотрицательность элементов возрастает по периоду с увеличением заряда ядра.
(Работает весь класс, поднимает карточки “+” — верно, “- ” — неверно)
Слайд 22. Приложение 2
Учитель: Далее выполним задания:
Опишите качественный и количественный состав:
а)СO и СO2 б) SO2 и SO3
Определите вид химической связи, вычислите W(O) в соединениях.
2. Вычислите Мr и W(O) в веществах: а,б,в – 10 баллов, г,д,е – 15 баллов. Выпишите вещества с ковалентной связью.
а) в горном хрустале – SiO2
б) корунде – Al2O3
в) кальците – CaCO3
г) малахите — (CuOH)2 CO3
д) глюкозе – C6h22O6
е) сахаре – C12h32O11
Каждый может выбрать свой темп выполнения заданий. Чем больше заданий выполнено. Тем больше баллов заработает каждый.
Чем больше заданий выполнено. Тем больше баллов заработает каждый.
(По мере выполнения возврат к слайду 20. Приложение 2)
Слайд.23.Приложение 2. Учитель: Рассмотрим где же встречаются в повседневной жизни вещества с ковалентной связью. (Переход со слайда 23 на слайды по управляющим кнопкам по очереди)
Учитель: Подведем итоги подсчитаем баллы. Выставим оценки. Определим победителей. Слайд. 30. Приложение 2
Является ли HBr полярным или неполярным?
Ричард — 0
Бромид водорода (HBr) представляет собой полярную молекулу, потому что разности электроотрицательностей между водородом (2,2) и бромом (2,96). Бром более электроотрицателен, чем водород, поэтому он притягивает электроны от водорода, в результате индуцируются два дипольных полюса, поэтому молекула имеет результирующий дипольный момент.
HBr, химическое название которого бромистый водород, а его водный раствор известен как бромистоводородная кислота, представляет собой жидкость от бесцветного до светло-желтого цвета,
образован одним атомом водорода и одним атомом брома и считается сильным
кислота.
Теперь, прежде чем углубиться в его полярную природу, сначала мы должны знать, что такое полярные и неполярные молекулы:
Полярные молекулы
Полярные молекулы просто определяются как наличие полярной связи внутри молекулы или имеют неправильную геометрию (несимметричную структуру), поэтому суммарный дипольный момент молекулы не равен нулю, так как центр тяжести отрицательный заряд и положительный заряд разделены небольшим расстоянием.
Эти молекулы используются, чтобы показать небольшое ионное характеристики, т. е. они растворимы в воде, могут проводить электричество, имеют сильная электростатическая сила и многое другое.
Примеры полярных молекул : вода (h3O), соляная кислота (HCl), аммиак (Nh4) и т. д.
с взаимным обменом электронами и имеют нулевой суммарный дипольный момент. как есть
отсутствие частичного положительного и отрицательного заряда на атомах из-за одинаковой разницы в электроотрицательности между атомами (двухатомные молекулы, такие как h3,
O2, N2 и т.
Когда неполярные молекулы помещаются в электрическое поле, центр тяжести положительного заряда движется в направлении поля, а центр тяжести отрицательного заряда в противоположном направлении. Это разделение между положительные и отрицательные заряды продолжаются до тех пор, пока приложенная внешняя сила и внутренние силы уравновешены.
Пример неполярных молекул : Все двухатомные молекулы (h3, N2, O2, Cl2 и т. д.), четыреххлористый углерод (CCl4), двуокись углерода (CO2), тетрафторид ксенона (XeF4) и т. д.
HBr Полярный или неполярный (на основе характеристик)
Бромид водорода (HBr) представляет собой полярную молекулу, а бром
атом, ближайший к отрицательной стороне, потому что бром имеет более высокую электроотрицательность
чем атом водорода, так что бром немного тянет неподеленную пару электронов
ближе, что вызывает индукцию положительного заряда на атоме H и отрицательного заряда на
Бр атом.
Вот некоторые характеристики HBr, раскрывающие его полярность природа почему HBr является полярной молекулой:
Электроотрицательность Разница
Электроотрицательность – это сила, действующая на атом или молекулы в момент образования связи на партнере по связыванию. Это означает атом оказывает силу на соответствующий связывающий атом во время разделения одинокого пара электронов. Чем выше электроотрицательное значение, тем больше силы будет приложено для притяжения электронов. Если два атома с одинаковым значением EN приложили силы будет аннулирован.
В молекуле HBr,
Электроотрицательность водорода = 2,2
Электроотрицательность брома = 2,96
Разница электроотрицательностей = 2,96-2,2 = 0,76
Из приведенных выше данных разница электроотрицательностей между H
а Br около 0,76 и по шкале Паули , если электроотрицательность
разница между двумя атомами составляет от 0,5 до 2,0, соответствующая связь
считается полярной связью. Таким образом, разница EN составляет 0,76, связь H-Br полярная.
Таким образом, разница EN составляет 0,76, связь H-Br полярная.
Структура Льюиса и молекулярная геометрия
Соединение HBr имеет в общей сложности 8 валентных электронов (электроны на самой внешней оболочке), один из водорода и 7 из брома, который принимает участие в формировании точечной структуры Льюиса. Оба атома делят по одному неподеленному электрону на выполняют свою внешнюю оболочку во время склеивания.
Поскольку HBr является гетероядерной двухатомной молекулой, молекулярная геометрия является линейной с углом связи 180 °, что вызывает индуцированное частичное заряды не компенсируют друг друга, и молекула имеет чистый дипольный момент.
Дипольный момент
Дипольный момент является основным свойством любого соединения, будь то полярное или неполярное. Те молекулы, у которых чистый дипольный момент равен нулю, считаются неполярными молекулами, а остальные — полярными. Дипольный момент можно определить как произведение индуцированного заряда и расстояния.
Дипольный момент = заряд (Q) * расстояние разделения (r)
Он измеряется в единицах Дебая, обозначаемых буквой «D». 1D = 3,33564*10-30 см, где С — кулон, а m — метр.
Бромистый водород имеет чистый дипольный момент 820 мД, который возникает из-за разницы в электроотрицательности водорода и брома также геометрия молекулы линейна.
Сродство к электрону
Сродство к электрону – это возможность нахождения электрона на орбита атома или молекулы. невозможно точно определить положение электрона в определенное время в соответствии с неопределенностью принцип. Но мы можем просто предсказать максимальные шансы получить электрон в зависимости от природы молекулы или атома.
Так как HBr является полярной молекулой, максимальные шансы получить
электрон выше ближе к атому брома, потому что он тянет неподеленную пару
электроны ближе к своему ядру. Но в неполярных молекулах максимальные шансы
получение электрона выше в центральном положении связи.
Принцип растворимости
В соответствии с принципом растворимости « лайков растворяют лайков» означает полярные соединения растворимы в различных полярных растворителях и неполярных растворителях растворимы в неполярных растворителях. То же самое в случае с HBr, он растворим в воде. который является полярным растворителем для получения бромистоводородной кислоты. Не только в воде можно легко растворяться во многих более полярных растворителях, таких как спирт, аммиак и т. д.
Источники и получение бромистого водорода (HBr)
Для промышленных целей бромистый водород получают путем объединения водород и бром при температуре 400 °C в присутствии платины катализатор.
В лаборатории чаще всего получают перегонкой бромида калия с серной кислотой.
KBr + h3SO4 → KHSO4 + HBr
Свойства HBr
1. Это бесцветный газ с резким раздражающим запахом. молекулярная масса 80,91 г/моль.
2. Сильно разъедает и раздражает при вдыхании, так что
с ним следует обращаться очень осторожно, иначе возникнет много серьезных проблем.
Использование HBr (бромистоводородной кислоты)
- Он используется во многих химических промежуточных продуктах в качестве дезинфицирующее и дезинфицирующее средство.
- Используется при получении многих органических соединений в качестве реагент и катализатор.
- Он также используется в проточных батарея.
Поляризуемость — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 40699
- Роберт Дж. Ланкашир
- Университет Вест-Индии в Моне
Теперь, пересмотрев основы тенденций по Периодической таблице и вниз, мы можем использовать концепции эффективного ядерного заряда и электроотрицательности для обсуждения факторов, влияющих на типы связей, образованных между элементами.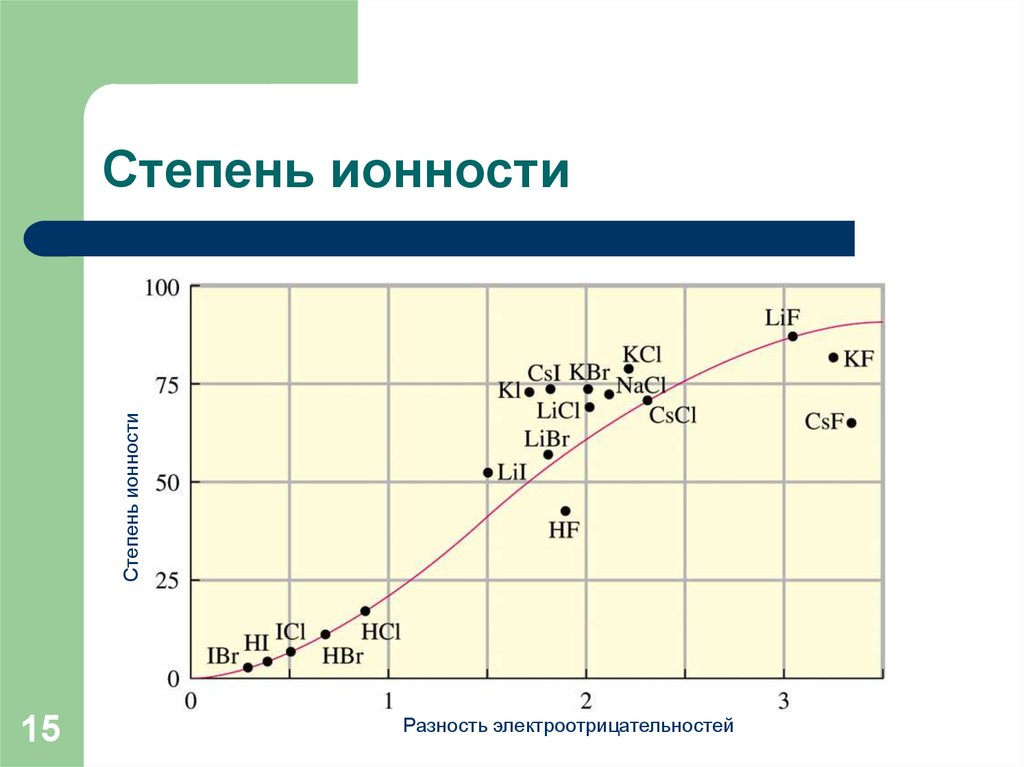
Правила Фаянса
Правила, сформулированные Казимежем Фаянсом в 1923 году, могут использоваться для предсказания того, будет ли химическая связь преимущественно ионной или ковалентной, и зависят от относительных зарядов и размеров катиона и аниона. Если два противоположно заряженных иона сведены вместе, характер связи между ними зависит от действия одного иона на другой .
неполярная ковалентная полярная ковалентная ионная
| Ковалентная | Ионный |
|---|---|
| Малый катион (< ~100 мкм) | Крупный катион (> ~100 мкм) |
| Большой анион | Малый анион |
| Высокие заряды | Низкие заряды |
Хотя связь в соединении типа X + Y — можно считать 100% ионным, она всегда будет иметь некоторую степень ковалентного характера. Когда два противоположно заряженных иона (X + и Y — ) сближаются, катион притягивает электроны в самой внешней оболочке аниона, но отталкивает положительно заряженное ядро. Это приводит к искажению, деформации или поляризации аниона. Если степень поляризации совсем мала, то образуется ионная связь, а если степень поляризации велика, то образуется ковалентная связь.
Когда два противоположно заряженных иона (X + и Y — ) сближаются, катион притягивает электроны в самой внешней оболочке аниона, но отталкивает положительно заряженное ядро. Это приводит к искажению, деформации или поляризации аниона. Если степень поляризации совсем мала, то образуется ионная связь, а если степень поляризации велика, то образуется ковалентная связь.
Способность катиона искажать анион известна как его поляризационная способность, а тенденция аниона поляризоваться катионом известна как его поляризуемость. Поляризующей способности и поляризуемости, которые усиливают образование ковалентных связей, способствуют следующие факторы:
- Малый катион: высокая поляризующая способность обусловлена большей концентрацией положительного заряда на небольшой площади. Это объясняет, почему LiBr более ковалентен, чем KBr (Li + 90 пм, сравните K + 152 пм).
- Большой анион: высокая поляризуемость связана с большим размером, когда внешние электроны удерживаются слабее и могут легче искажаться катионом.
 Это объясняет, почему для обычных галогенидов йодиды являются наиболее ковалентными в природе (I — 206 вечера).
Это объясняет, почему для обычных галогенидов йодиды являются наиболее ковалентными в природе (I — 206 вечера). - Большие заряды: по мере увеличения заряда иона увеличивается электростатическое притяжение катиона к внешним электронам аниона, что приводит к увеличению степени образования ковалентной связи.
Напоминание. Крупные катионы находятся в нижней левой части периодической таблицы, а маленькие анионы — в верхней правой. Чем больше положительный заряд, тем меньше становится катион, а ионный потенциал является мерой отношения заряда к радиусу.
Заряд катиона увеличивается (размер уменьшается), а справа увеличивается размер аниона, оба варианта приводят к увеличению ковалентности. Таким образом, ковалентность увеличивается в следующем порядке:
[Na + Cl — , NaCl] < [Mg 2 + 2(Cl) — , MgCl 2 9 5 8 Al 30 [18Al 30 ] + 3(Cl) — , AlCl 3 ] и [Al 3 + 3(F) — , AlF 3 ] < [Al 3 + 3 (Cl) — , AlCl 3 ] < [Al 3 + 3 (Br) — 93 Br 92 , AlCl
Электронная конфигурация катиона: для двух катионов одинакового размера и заряда катион с псевдоконфигурацией благородного газа (с 18 электронами на самой внешней оболочке) будет более поляризующим, чем катион с конфигурацией благородного газа (с 8 электронами на внешней оболочке). самая внешняя оболочка). Таким образом, хлорид цинка (II) ( Zn(II) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 и Cl — 5 1s 62 2 9 0186 2p 6 3s 2 3p 6 ) есть более ковалентна, чем хлорид магния ( Mg(II) 1s 2 2s 2 2p 6 ), несмотря на ион Zn 2 + (74 пм) и Mg 2 pm (ион ) с аналогичными размерами и зарядами.
самая внешняя оболочка). Таким образом, хлорид цинка (II) ( Zn(II) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 и Cl — 5 1s 62 2 9 0186 2p 6 3s 2 3p 6 ) есть более ковалентна, чем хлорид магния ( Mg(II) 1s 2 2s 2 2p 6 ), несмотря на ион Zn 2 + (74 пм) и Mg 2 pm (ион ) с аналогичными размерами и зарядами.
С точки зрения МО, перекрытие орбит рассеивает заряд каждого иона и, таким образом, ослабляет электровалентные силы во всем твердом теле. Это можно использовать для объяснения тенденции, наблюдаемой для температур плавления галогенидов лития.
LiF = 870°C, LiCl = 613°C, LiBr = 547°C, LiI = 446°C
Установлено, что чем больше возможность поляризации, тем ниже температура плавления и теплота сублимации и больше растворимость в неполярных растворителях.
Пример \(\PageIndex{1}\):
Температура плавления KCl выше, чем у AgCl, хотя радиусы кристаллов ионов Ag + и K + почти одинаковы.
Решение:
При сравнении температур плавления двух соединений предполагается, что то, которое имеет более низкую температуру плавления, имеет меньшую степень ионного характера. В этом случае оба являются хлоридами, поэтому анион остается прежним. Решающим фактором должен быть катион. (Если бы анионы были разными, то на ответ могло бы повлиять изменение аниона.) Здесь существенное различие между катионами заключается в их электронных конфигурациях. K + = [Ar] и Ag + = [Kr] 4d 10 . Это означает, что необходимо провести сравнение между ядром благородного газа и ядром псевдоблагородного газа, которое, как отмечалось выше, предполагает, что псевдоблагородный газ будет более поляризующим.
Процент ионного характера и распределение заряда
На основании правил Фаяна ожидается, что каждое ионное соединение будет иметь, по крайней мере, некоторое количество ковалентного характера.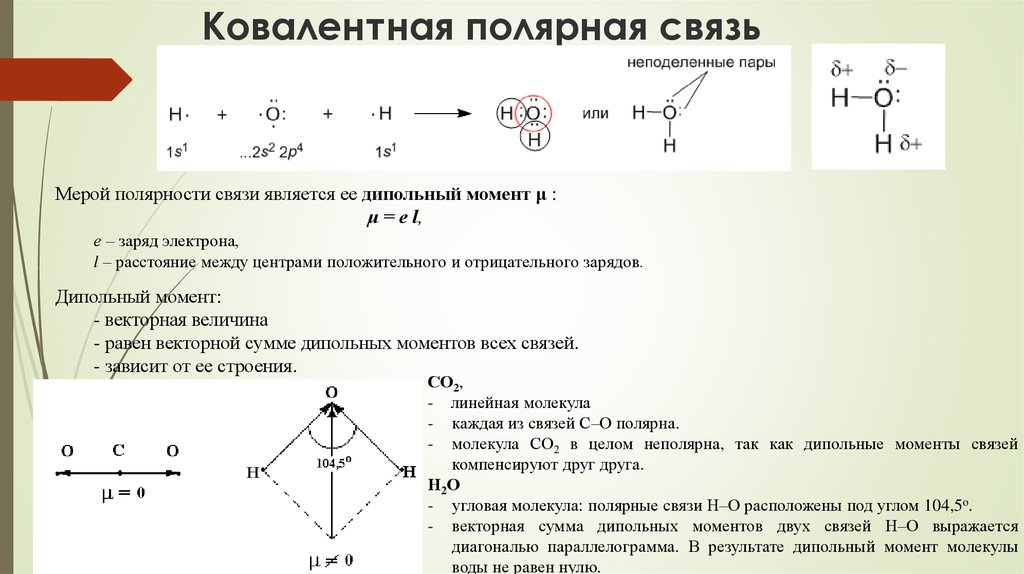 Процент ионного характера в соединении можно оценить по дипольным моментам. Дипольный момент связи использует идею электрического дипольного момента для измерения полярности химической связи внутри молекулы. Это происходит всякий раз, когда есть разделение положительных и отрицательных зарядов. Диполь связи μ определяется как:
Процент ионного характера в соединении можно оценить по дипольным моментам. Дипольный момент связи использует идею электрического дипольного момента для измерения полярности химической связи внутри молекулы. Это происходит всякий раз, когда есть разделение положительных и отрицательных зарядов. Диполь связи μ определяется как:
μ = δ d
Диполь связи моделируется как +δ — δ- с расстоянием d между частичными зарядами. Это вектор, параллельный оси связи и условно направленный от минуса к плюсу (обратите внимание, что многие тексты игнорируют соглашение и указывают от плюса к минусу). Единицей СИ для электрического дипольного момента является кулон-метр (С·м). Считается, что это дает значения, слишком большие, чтобы их можно было использовать на молекулярном уровне, поэтому дипольные моменты связи обычно измеряют в Дебае, что обозначается символом D.
Исторически Дебай определялся с точки зрения дипольного момента, возникающего в результате двух одинаковых зарядов противоположного знака и разделенных 1 Ангстрем (10 -10 м) как 4,801 D . Это значение получается из (1,602 х 10 -19 * 1 х 10 -10 ) / 3,336 х 10 -30 , где D = 3,336 х 10 -30 см м (или 1 см м = 2,9979 х 10979 х 1 29 Д).
Это значение получается из (1,602 х 10 -19 * 1 х 10 -10 ) / 3,336 х 10 -30 , где D = 3,336 х 10 -30 см м (или 1 см м = 2,9979 х 10979 х 1 29 Д).
Типичные дипольные моменты простых двухатомных молекул находятся в диапазоне от 0 до 11 D (см. таблицу ниже).
% ионного характера = μ наблюдаемое / μ вычисленное (при условии 100% ионной связи) * 100 %
Пример \(\PageIndex{12}\):
Из таблицы ниже наблюдаемый дипольный момент KBr дается как 10,41 D (3,473 x 10 -29 кулон-метр), что близко к верхнему уровню 11 указывает на то, что это высокополярная молекула. Межатомное расстояние между K + и Br — составляет 282 пм. Отсюда можно рассчитать теоретический дипольный момент молекулы KBr, предполагая противоположные заряды одной фундаментальной единицы, расположенной на каждом ядре, и, следовательно, процентный ионный характер KBr.
Решение
дипольный момент μ = q * e * d кулоновый метр
q = 1 для полного разделения единичного заряда
e = 1,602 x 10 -19 C
d = 2,82 x 10 -10 м для KBr (282 пм)
Отсюда рассчитано мк KBr = 1 * 1,602 x 10 -19 * 2,82 x 10 -10 = 4,518 x 10 -29 См (13,540 D) КБр = 3,473 x 10 -29 Cm (10,41 D)
% ионного характера KBr = 3,473 x 10 -29 / 4,518 х 10 -29 или 10,41 / 13,54 = 76,87% и, следовательно, % ковалентного характера составляет около 23% (100 — 77).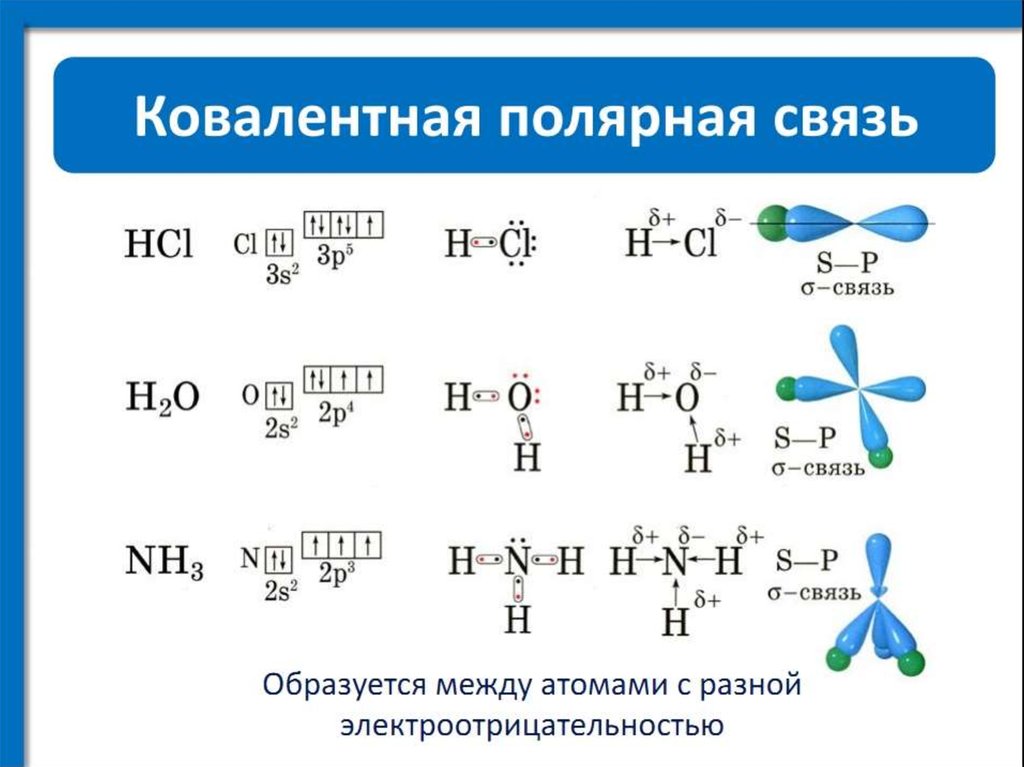
Учитывая, что наблюдаемый дипольный момент равен 10,41 D (3,473 x 10 -29 ), можно оценить распределение заряда из того же уравнения, решив теперь для q:
Дипольный момент μ = q * e * d Кулоновские метры , но поскольку q больше не равно 1, мы можем подставить значения для µ и d, чтобы получить для него оценку.
q = мк / (е * d) = 3,473 х 10 -29 / (1,602 x 10 -19 * 2,82 x 10 -10 )
таким образом q = 3,473 x 10 -29 / (4,518 x 10 9 -20 δ- и δ+ равны -0,8 и +0,8 соответственно.
Пример \(\PageIndex{3}\):
Для HI рассчитайте процент ионного характера, учитывая длину связи = 161 пм и наблюдаемый дипольный момент 0,44 дптр. 100% ионная связь
μ = 1 * 1,602 x 10 -19 * 1,61 x 10 -10 / (3,336 x 10 -30 ) = 7,73 D
% ионного характера = 0,44/7,73 * 100 = 5,7%
Расчетный % ионного характера составляет 5,7% % ковалентного характера (100 — 5,7) = 94,3%. Ионный характер возникает из-за поляризуемости и поляризующих эффектов H и I. Точно так же, зная длину связи и наблюдаемый дипольный момент HCl, можно найти, что% ионного характера составляет 18%. Таким образом, можно видеть, что в то время как HI в основном ковалентна, HCl имеет значительный ионный характер.
Ионный характер возникает из-за поляризуемости и поляризующих эффектов H и I. Точно так же, зная длину связи и наблюдаемый дипольный момент HCl, можно найти, что% ионного характера составляет 18%. Таким образом, можно видеть, что в то время как HI в основном ковалентна, HCl имеет значительный ионный характер.
Обратите внимание, что согласно этому упрощенному определению для достижения 100 % ковалентного характера соединение должно иметь наблюдаемый дипольный момент, равный нулю. Хотя это и не совсем верно для гетероядерных молекул, он обеспечивает простой качественный метод для предсказания характера связи.
Характер связи, основанный на разнице электроотрицательности
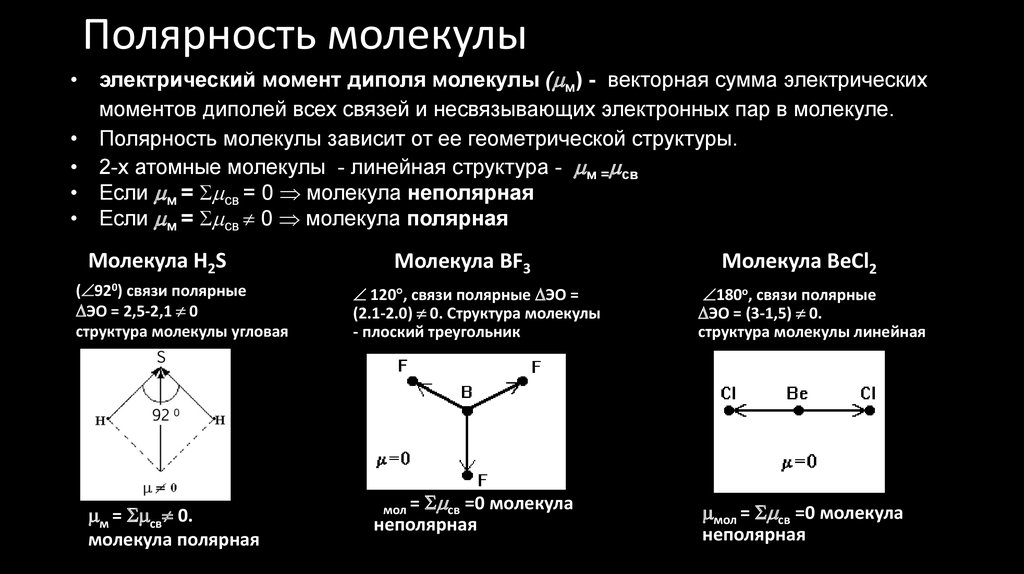
Можно предсказать, будет ли данная связь неполярной, полярной ковалентной или ионной, на основе разницы электроотрицательности, поскольку чем больше разница, тем более полярна связь.
| Разность электроотрицательностей, ΔχP | Бонд |
|---|---|
| Δχ < 0,4 | ковалентный |
| 0,4 < Δχ < 1,7 | полярная ковалентная |
| Δχ > 1,7 | ионный |
Лайнус Полинг предложил эмпирическую зависимость, которая связывает процент ионного характера связи с разницей электроотрицательностей. 92 )* 100
92 )* 100
Это показано в виде кривой красного цвета ниже и сравнивается со значениями для некоторых двухатомных молекул, рассчитанными на основе наблюдаемых и рассчитанных дипольных моментов.
| двухатомный | Δ х | %ионный | связка дист /пм | Обс мк/Д | Расчет мк/D |
|---|---|---|---|---|---|
| Класс 2 | 0,0 | 0,0 | 200 | 0,00 | 9,60 |
| ИБр | 0,3 | 5,9 | 247 | 0,70 | 11,86 |
| Привет | 0,4 | 5,7 | 161 | 0,44 | 7,73 |
| ИКл | 0,5 | 5,4 | 232 | 0,60 | 11. 14 14 |
| HBr | 0,7 | 12,1 | 141 | 0,82 | 6,77 |
| HCl | 0,9 | 17,7 | 127 | 1,08 | 6.10 |
| CLF | 1,0 | 11,2 | 163 | 0,88 | 7,83 |
| БрФ | 1,2 | 15,1 | 178 | 1,29 | 8,55 |
| ЛиИ | 1,5 | 65,0 | 238 | 7,43 | 11,43 |
| ВЧ | 1,9 | 41,2 | 92 | 1,82 | 4,42 |
| LiBr | 1,8 | 69,8 | 217 | 7,27 | 10. 42 42 |
| КИ | 1,7 | 73,7 | 305 | 10,80 | 14,65 |
| LiCl | 2,0 | 73,5 | 202 | 7,13 | 9,70 |
| КБр | 2,0 | 76,9 | 282 | 10,41 | 13,54 |
| NaCl | 2,1 | 79,4 | 236 | 9,00 | 11,33 |
| KCl | 2,2 | 80,1 | 267 | 10,27 | 12,82 |
| CsCl | 2,3 | 74,6 | 291 | 10,42 | 13,97 |
| LiF | 3,0 | 86,7 | 152 | 6,33 | 7,30 |
| КФ | 3,2 | 82,5 | 217 | 8,60 | 10,42 |
| ЧФ | 3,3 | 64,4 | 255 | 7,88 | 12,25 |
Лондонские дисперсионные силы
Межмолекулярные силы — это силы притяжения между молекулами, без которых все вещества были бы газами. Различные типы этих взаимодействий охватывают большие различия в энергии, а для галогенов и межгалогенов, как правило, весьма малы. Силы, участвующие в этих случаях, называются лондонскими дисперсионными силами (в честь Фрица Вольфганга Лондона, 1900-1954). Они возникают в результате мгновенных колебаний электронного заряда в атомах и, следовательно, присутствуют между всеми частицами (атомами, ионами и молекулами).
Различные типы этих взаимодействий охватывают большие различия в энергии, а для галогенов и межгалогенов, как правило, весьма малы. Силы, участвующие в этих случаях, называются лондонскими дисперсионными силами (в честь Фрица Вольфганга Лондона, 1900-1954). Они возникают в результате мгновенных колебаний электронного заряда в атомах и, следовательно, присутствуют между всеми частицами (атомами, ионами и молекулами).
Легкость, с которой электронное облако атома может быть искажено, чтобы стать асимметричным, называется поляризуемостью молекулы. Чем больше электронов имеет атом, тем дальше внешние электроны будут от ядра и тем больше у них шансов сместиться внутри молекулы. Это означает, что более крупные неполярные молекулы, как правило, имеют более сильные лондоновские дисперсионные силы. Это становится очевидным при рассмотрении двухатомных элементов 17-й группы, галогенов. Все эти гомоядерные двухатомные элементы представляют собой неполярные ковалентно связанные молекулы. По убыванию группы фтор и хлор – газы, бром – жидкость, йод – твердое вещество. Для неполярных молекул чем дальше вы спускаетесь по группе, тем сильнее лондоновские дисперсионные силы.
Для неполярных молекул чем дальше вы спускаетесь по группе, тем сильнее лондоновские дисперсионные силы.
Чтобы представить себе, как это происходит, сравните ситуацию 1) когда электроны распределены равномерно, а затем рассмотрите 2) мгновенный диполь, который возник бы из-за неравномерного распределения электронов на одной стороне ядра. Когда две молекулы находятся близко друг к другу, мгновенный диполь одной молекулы может индуцировать диполь во второй молекуле. Это приводит к синхронному движению электронов и притяжению между ними. 3) когда этот эффект распространяется на многочисленные молекулы, общий результат состоит в том, что притяжение удерживает эти молекулы вместе, а для дийода достаточно, чтобы сделать его твердым.
В среднем электронное облако для молекул можно считать сферическим по форме. Когда две неполярные молекулы сближаются, притяжение или отталкивание между электронами и ядрами может привести к искажению их электронных облаков (т.е. индуцируются диполи).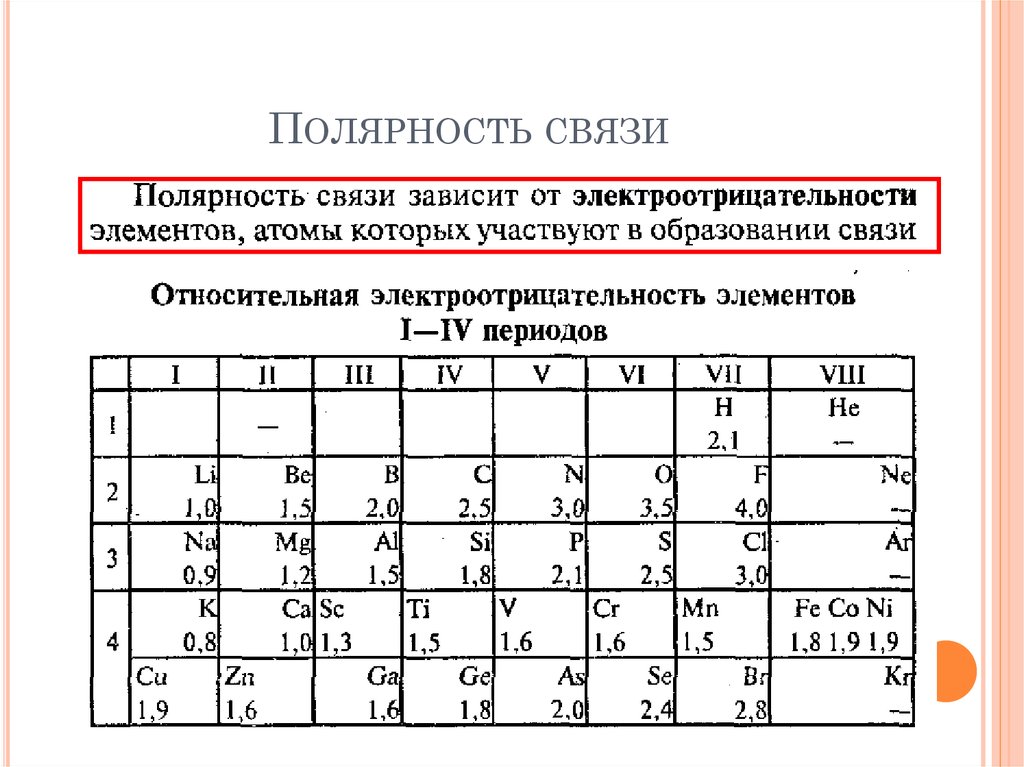 Когда больше молекул взаимодействует, эти индуцированные диполи приводят к межмолекулярному притяжению.
Когда больше молекул взаимодействует, эти индуцированные диполи приводят к межмолекулярному притяжению.
Изменения, наблюдаемые в вариациях MP и BP для дигалогенов и бинарных интергалогенов, можно объяснить увеличением лондоновских дисперсионных сил притяжения между молекулами. Обычно они увеличиваются с увеличением атомного номера.
Аномальное поведение элементов 2-го ряда: Li, Be, B, C, N, O, F
Для элементов 2-го ряда с увеличением атомного номера уменьшается атомный радиус элементов, увеличивается электроотрицательность , а энергия ионизации увеличивается.
Во 2-м ряду два металла (литий и бериллий), что делает его наименее металлическим периодом и больше всего неметаллов (четыре). Элементы во 2-м ряду часто имеют самые экстремальные свойства в соответствующих группах; например, фтор является наиболее реакционноспособным галогеном, неон — наиболее инертным благородным газом, а литий — наименее реакционноспособным щелочным металлом.
Эти различия в свойствах с последующими рядами являются результатом:
- меньшего размера атомов
- внешняя оболочка с максимум 8 электронами (2s и 2p) и нижележащая оболочка только с 2 электронами
- нет доступных d-орбиталей — энергия слишком высока для использования в соединении
За исключением 2-й строки (без учета H/He 1-й строки) все более поздние строки заканчиваются инертными газами, но они не имеют завершенных квантовых уровней.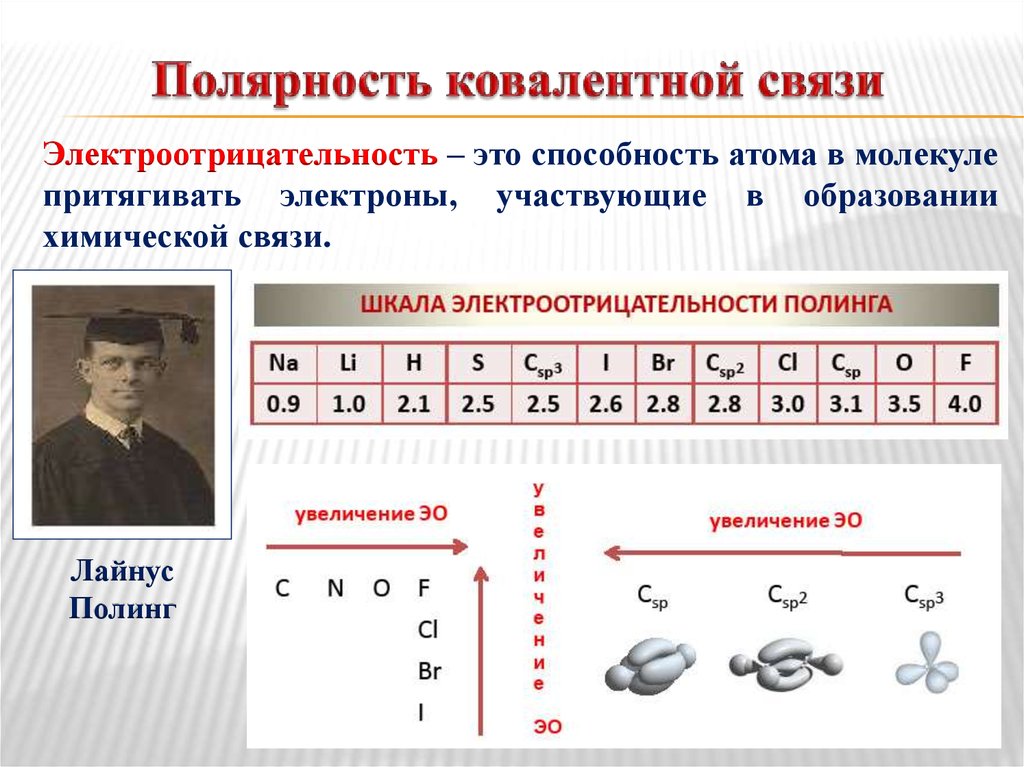 Элементы 2-го ряда обычно могут использовать только 2s- и 2p-электроны для связи, что ограничивает общее количество связей до 4.
Элементы 2-го ряда обычно могут использовать только 2s- и 2p-электроны для связи, что ограничивает общее количество связей до 4.
Таким образом, ожидается, что N не будет иметь более 4 связей, а 3 обычно, в то время как для P 5 и 6 связанных видов довольно распространены.
Реакционная способность металлов и металлоидов
Для лития по сравнению с другими щелочными металлами
Реакция с водой:
Li медленно реагирует с водой при 25 °C
Na бурно реагирует, а K в пламени
2M(s) + 2H 2 O(ж) → 2M + (водн.) + 2OH — + H 2 (г)
Обычно Li, Be, B, C, N, O, F менее реакционноспособны по отношению к воде, чем их более тяжелые сородичи.
Реакция с кислородом:
В условиях избытка кислорода только Li образует простой оксид, Li 2 O. Другие металлы образуют пероксиды и супероксиды
Реакция с азотом:
Li реагирует непосредственно с N 2 с образованием Li 3 N
6Li(т) + N 2 (г) → 2Li 3 N(т).
Ни один другой щелочной металл не реагирует с N 2
Растворимость:
LiF, LiOH и Li 2 CO 3 менее растворимы, чем соответствующие соединения Na и K
Для бериллия по сравнению с другими щелочноземельными металлами:
С водой:
Все металлы группы 2, кроме Be, реагируют с водой
M(s) + 2H 2 O(l) → M 2+ (водн.)+ 2OH — (водн.) + H 2 (г)
С кислородом (воздух):
Be реагирует с воздухом при температуре выше 600 °C только в том случае, если он мелкодисперсный. Образующийся BeO является амфотерным (остальные оксиды 2-й группы являются основными).
Из элементов группы 2 только Be реагирует с NaOH или KOH с выделением H 2 и образуют [Be(OH) 4 ] 2- .
Li и Be являются металлами, но имеют меньшую проводимость, чем высшие элементы групп 1 и 2, из-за их высоких IE (электроны близки к ядру).
Ионизация бора до B 3+ требует больших затрат энергии, а B принимает ковалентную полимерную структуру с полуметаллическими свойствами.
Другие элементы группы 14 становятся все более металлическими по мере понижения группы из-за уменьшения энергии ионизации.
Кристаллический бор химически инертен — не подвергается воздействию кипящей HCl и только медленно окисляется горячей концентрированной HNO 3 в виде тонкого порошка.
Ковалентный характер
Li + и Be 2+ малы и обладают сильными поляризующими способностями. Их соединения более ковалентны, чем соединения более тяжелых элементов в их группах.
BeCl 2 является ковалентным, тогда как MCl 2 (M = Mg-Ba) является ионным. Проводимость расплавленного хлорида бериллия составляет всего 1/1000 проводимости хлорида натрия в аналогичных условиях.
Катетерация
Катетенация – это соединение атомов одного и того же элемента в более длинные цепочки. Катенообразование наиболее легко происходит в углероде, который образует ковалентные связи с другими атомами углерода, образуя более длинные цепи и структуры.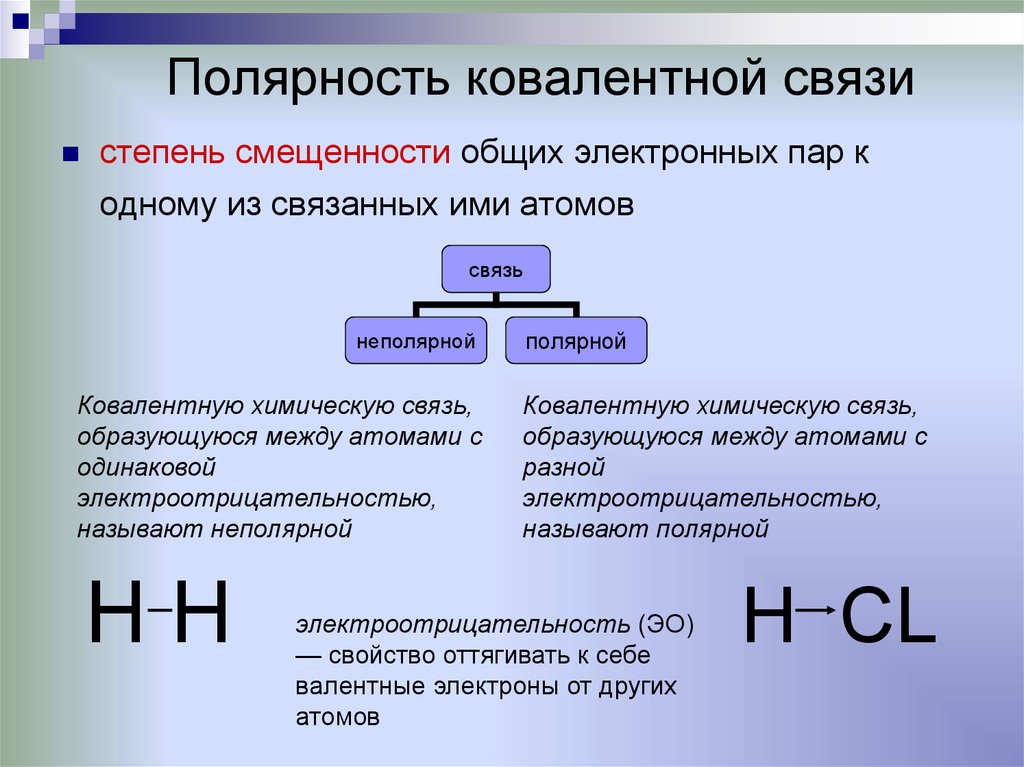 Это является причиной наличия в природе огромного количества органических соединений.
Это является причиной наличия в природе огромного количества органических соединений.
Способность элемента к цепочке в основном основана на энергии связи элемента с самим собой, которая уменьшается с более диффузными орбиталями (с более высоким азимутальным квантовым числом), перекрывающимися для образования связи. Следовательно, углерод с наименее диффузной валентной оболочкой 2p-орбитали способен образовывать более длинные p-p-сигма-связанные цепочки атомов, чем более тяжелые элементы, которые связываются через более высокие валентные орбитали оболочки.
Гетеро-катенация довольно распространена в неорганической химии. Примерами этого являются фосфаты и силикаты со связями P-O-P-O и Si-O-Si-O.
Множественные связи
C, N и O способны образовывать множественные связи (двойные и/или тройные). В группе 14 стабильны двойные связи C=C (134 пм), но двойные связи Si=Si (227 пм) встречаются редко. На приведенной ниже диаграмме показано, как образуются множественные связи с участием π-перекрытия 2p-орбиталей. Для сравнения, 3p-орбитали соответствующих элементов третьего ряда Si, P и S более размыты, и более длинные расстояния связи, ожидаемые для этих более крупных атомов, приведут к плохому перекрытию π.
Для сравнения, 3p-орбитали соответствующих элементов третьего ряда Si, P и S более размыты, и более длинные расстояния связи, ожидаемые для этих более крупных атомов, приведут к плохому перекрытию π.
Длина связи C=C = 134 пм и длина связи Si=Si = 227 пм . Они реагируют даже с инертными газами с образованием таких соединений, как XeO 3 , XeO 4 , XeF 4 и XeF 6 . В 1962 году Нил Бартлетт из Университета Британской Колумбии провел реакцию гексафторида платины и ксенона в эксперименте, который продемонстрировал химическую активность благородных газов. Он открыл горчично-желтое соединение, гексафторплатинат ксенона, которое, возможно, сейчас лучше всего формулируется как смесь соединений [XeF + ][PtF 5 ] — , [XeF + ][Pt 2 F 11 ] — , и [Xe 2 3 ] + [ПтФ 6 ] — .
Впоследствии было открыто несколько сотен соединений других благородных газов: в 1962 г.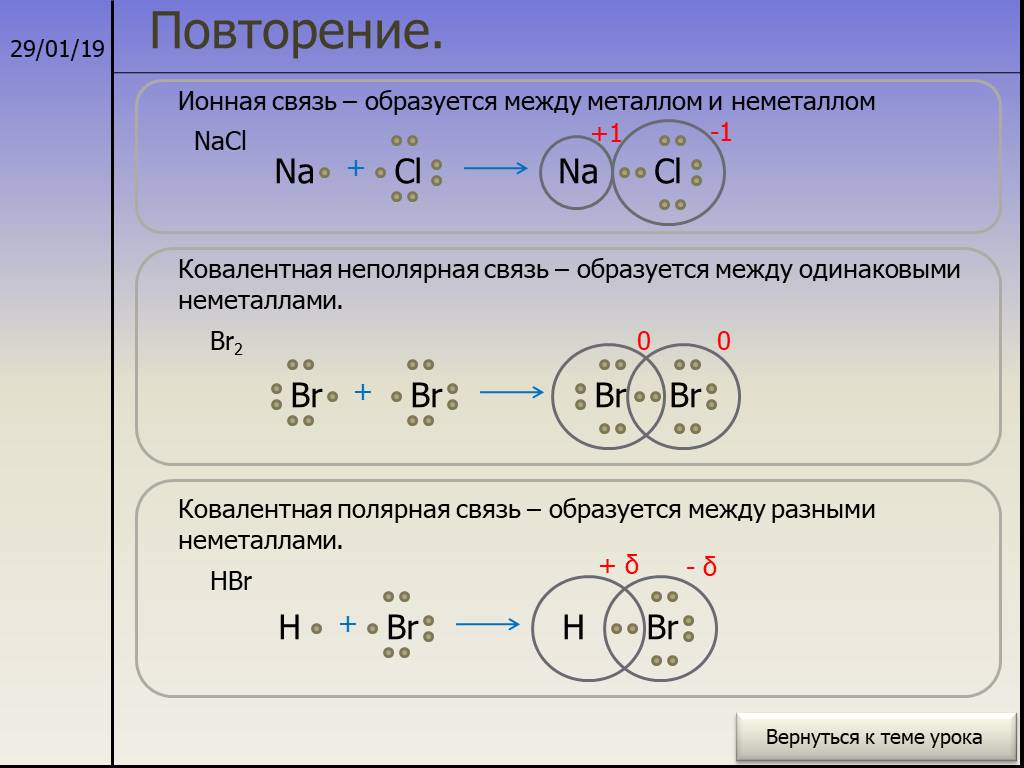

 Это объясняет, почему для обычных галогенидов йодиды являются наиболее ковалентными в природе (I — 206 вечера).
Это объясняет, почему для обычных галогенидов йодиды являются наиболее ковалентными в природе (I — 206 вечера).
Leave A Comment