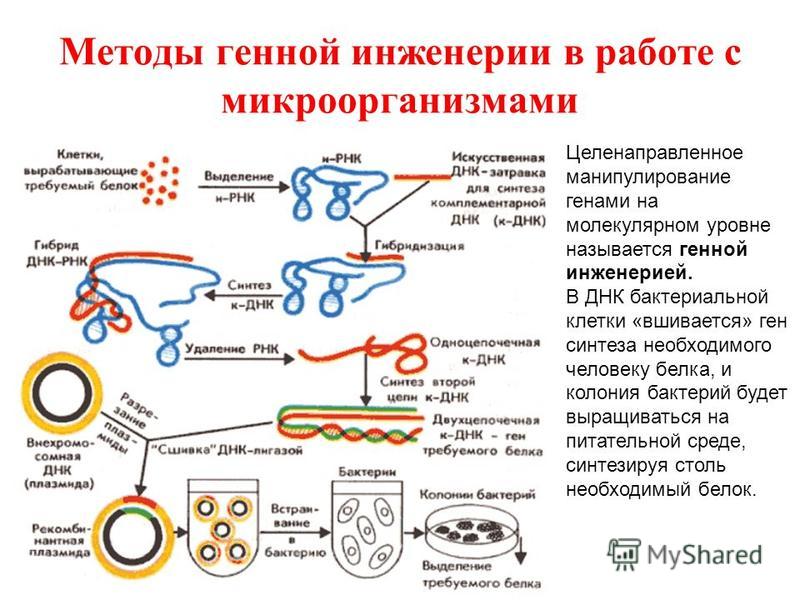
32. Получение инсулина на основе методов генной инженерии.
Получают плазмиды кишечной палочки – 1) ДНК разрезаем ферментом (рестриктаза) по липким концам. Ищет последовательность ААТТ и режет через эти основания. Фермент надо удалить в воде, центрифугой. 2) берем ген ДНК человека, который надо продуцирует инсулин. Пришиваем лигазой в ДНК, она сшивает по липким концам. 3) Получаем гибридную (рекомбинантную) ДНК. Отмывка фермента центрифугированием.
Достигнутые
результаты по культивированию кл. и
тканей, и возможности получения целого
растения из 1 кл., позволили получать
растения с несвойственными им признаками
(ГМО).Вариант с 7-ю этапами: 1) поиск и
удаление нужного гена из организма
донора. 2) клонирование гена. 3) встраивание
гена в вектор трансформации растения.
4) трансформация растительной клетки
(плазмида, протопласт, каллусная ткань).
5) образование каллусной ткани путем
размножения клетки и получения побегов,
которые потом укореняют. 6) получение
целых растений. 7) проверка ГМР на
продуктивность и биобезопасность.Вариант
с 4-мя этапами: 1) Выбор гена и его
клонирование. Для трансформации берут
гены, определяющие устойчивость к
неблагопр. факторам, насекомым, гербицидам.
Берут у дикорастущего растения или
выделяют из бактерий. 2) Подбор генотипа
растения – реципиента. Берут высокоурожайные
сорта по имеющимся недостаткам. 3)
Введение гена и его экспрессия в геноме
реципиента. Перенос осущ-ся векторами.
Для двудольных – агробактериальный
вектор с ипол-м Тi-плазмиды.
4) Регенерация из клетки целого растения,
отбор трансген. раст. Для злаковых
регенерация идет хуже.
7) проверка ГМР на
продуктивность и биобезопасность.Вариант
с 4-мя этапами: 1) Выбор гена и его
клонирование. Для трансформации берут
гены, определяющие устойчивость к
неблагопр. факторам, насекомым, гербицидам.
Берут у дикорастущего растения или
выделяют из бактерий. 2) Подбор генотипа
растения – реципиента. Берут высокоурожайные
сорта по имеющимся недостаткам. 3)
Введение гена и его экспрессия в геноме
реципиента. Перенос осущ-ся векторами.
Для двудольных – агробактериальный
вектор с ипол-м Тi-плазмиды.
4) Регенерация из клетки целого растения,
отбор трансген. раст. Для злаковых
регенерация идет хуже.

Первые
генетически модифицированные (или
трансгенные) продукты были разработаны
американской бывшей военной компанией
Монсанто в конце 80-х годов. С 1996г. общая
площадь посевных площадей под трансгенными
культурами выросла в 50 раз и в 2005г.
составила 90 млн га (17% от общей площади).
Наибольшее количество посевных площадей
засеяно в США, Канаде, Бразилии, Аргентине
и Китае. При этом 96% всех посевных площадей
принадлежит США.Биобезопасность –
защитить человека и цивилизацию от
опасных для жизни и здоровья людей
биологических в-в, ГМО и полученных из
них продуктов.3 опасности мирового
уровня: 1) ядовитые грибы. 2) алкоголь. 3)
наркотики. ГМО и продукты из них: вновь
полученные сорта, гибриды должны пройти
лабораторный и полевой контроль, чтобы
не попали мутанты и с низкими качествами.

Билет 19. Клональное микроразмножение растений in vitro.
С давних пор существует вегет. способ размн. Клон (отпрыск, побег, черенок) – отпрыски растений размн. неполовым путем и они не являются индивидуумами, а лишь частью клона материнской особи и идентичны ей и между собой.
Преимущества: 1) Голландия (60 млн. раст. в год), Франция (40 млн.). Высокий коэф. размн. в год. 1 млн. раст. из одного (Лобанова). 2) Миниатюризация процесса, приводящая к уменьшению площади. 3) Возможность оздоровления от вирусных, миксоплазматических раст. и нематод. 4) В условиях in vitro можно размножать растения, которые вегет. не размн. (Гвинейская маслиничная пальма. Французы срезали приморий листьев (зачаточные), на пит. среде заставили образоваться растению).
Получение инсулина, соматостатина и соматотропина (генная инженерия) : Farmf
ПОЛУЧЕНИЕ ИНСУЛИНА НА ОСНОВЕ МЕТОДОВ ГЕНЕТИЧЕСКОЙ ИНЖЕНЕРИИ
СИНТЕЗ СОМАТОСТАТИНА
СИНТЕЗ СОМАТОТРОПИНА
Инсулин — гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний — сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин — небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний — сахарному диабету, который как причина смерти стоит на третьем месте после сердечно-сосудистых заболеваний и рака. Инсулин — небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника — препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Известно несколько форм сахарного диабета. Самая тяжелая форма, для лечения которой больному необходим инсулин (инсулин зависимая форма заболевания), вызвана избирательной гибелью клеток, синтезирующих этот гормон (клетки островков Лангерганса в поджелудочной железе).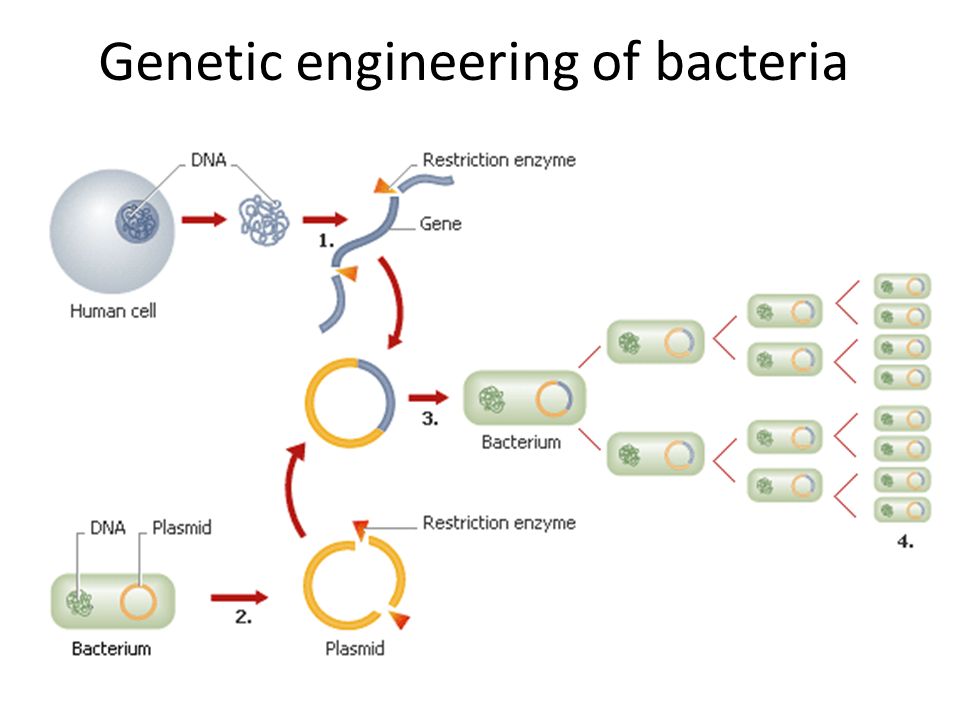 Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800— 1000 кг исходного сырья.
Форма сахарного диабета, для лечения которой инсулин не требуется, распространена чаще, с ней удается справляться с помощью соответствующих диет и режима. Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800— 1000 кг исходного сырья.
Синтез обеих цепей и соединение их дисульфидными связями для получения инсулина были проведены в 1963 и 1965 гг. тремя коллективами исследователей в США, Китае и ФРГ. В 1980 г. датская компания «Ново индастри» разработала метод превращения инсулина свиньи в инсулин человека путем замещения 30-го остатка аланина в цепи В на остаток треонина. Оба инсулина не различались по активности и времени действия.
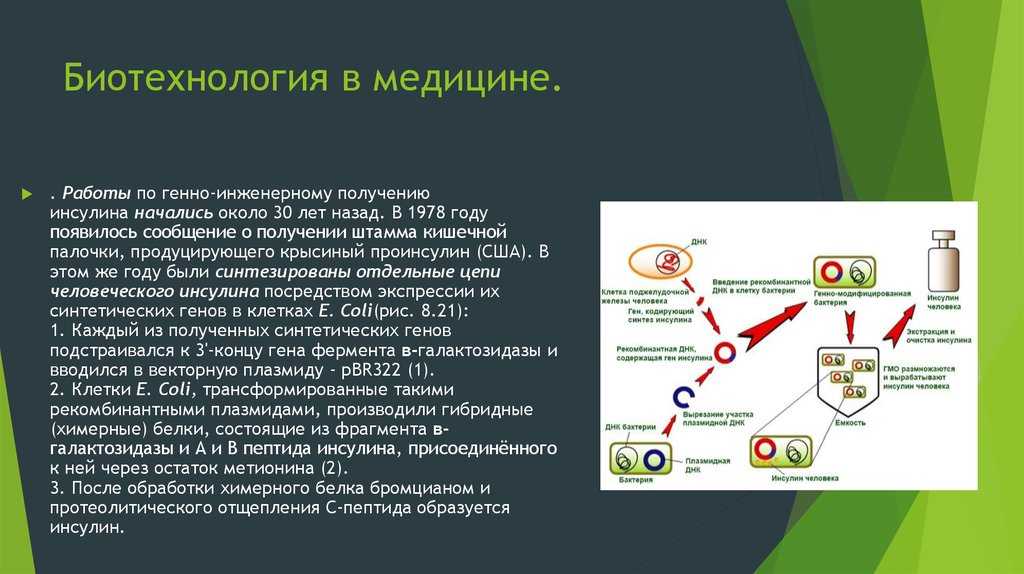
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к 3′-концу гена фермента бета-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента бета-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисупьфидных мостиков между образованными цепями инсулина происходило с трудом.
В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli (рис. 5.11). Каждый из полученных синтетических генов подстраивался к 3′-концу гена фермента бета-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные) белки, состоящие из фрагмента бета-галактозидазы и А или В пептида инсулина, присоединенного к ней через остаток метионина. При обработке химерного белка бромцианом пептид освобождается. Однако замыкание дисупьфидных мостиков между образованными цепями инсулина происходило с трудом.
В 1981 г. синтезирован ген-аналог проинсулина — мини-С- проинсулин, в котором 35-звенный С-пептид был заменен на сегмент из шести аминокислот: арг-арг-гли-сер-лиз-арг и показана его экспрессия в Е. coli.
В 1980 г. У.Гилберт с сотрудниками выделили мРНК инсулина из опухоли бета-клеток поджелудочной железы крысы и с помощью обратной транскриптазы получили с нее кДНК Полученную кДНК встроили в плазмиду pBR322 Е.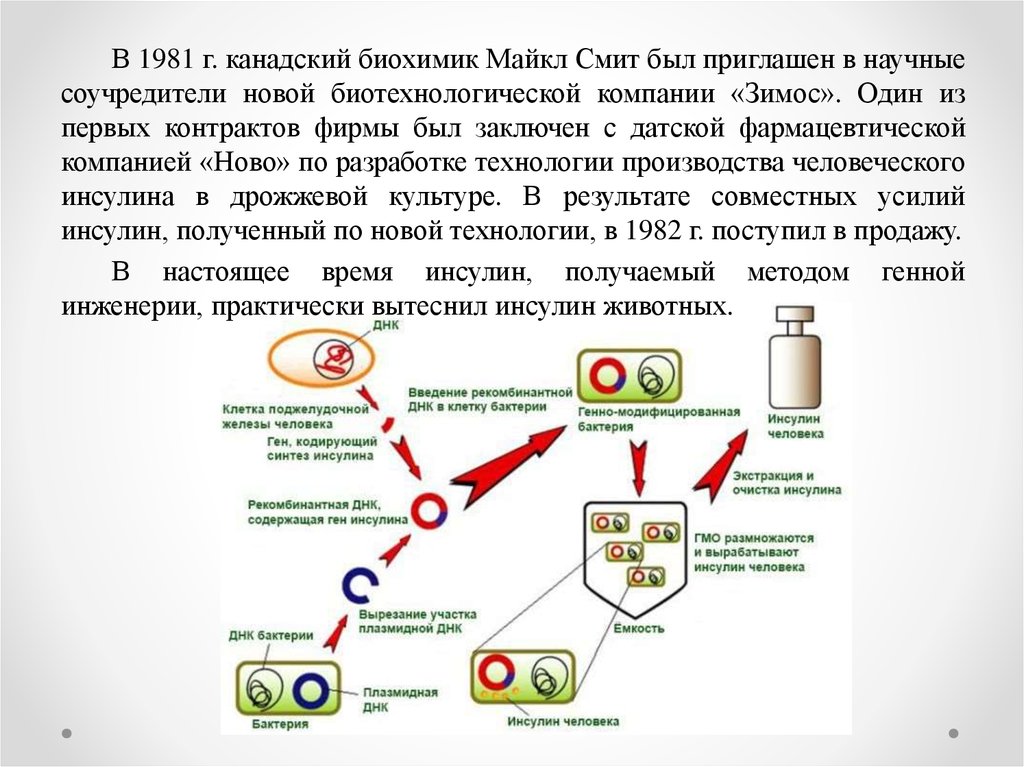 coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
coli, в среднюю часть гена пенициллиназы. Рекомбинантная плазмида содержала информацию о структуре проинсулина. В результате трансляции мРНК в клетках синтезировался гибридный белок, содержащий последовательности пенициллиназы и проинсулина, который выщепляли из такого белка трипсином.
В 1978 г. сотрудниками Института биоорганической химии под руководством академика Ю. А. Овчинникова был осуществлен синтез двух структурных генов, кодирующих синтез нейропептидов: лейцин-энкефалина и брадикинина. Синтезированный ген лейцин-энкефалина имел два «липких» конца:
Полученный синтетический ген был встроен вместе с фрагментом природной ДНК, содержащим промотор и проксимальную часть гена белка бета-галактозидазы кишечной палочки Е. coli, в плазмиду-вектор pBR322 и обработан смесью рестриктаз — EcoRI и BamHI. Полученная рекомбинантная плазмида рЕк была трансформирована в клетки Е. coli. В результате экспрессии встроенного ген бактерия начала продуцировать гибридный (химерный) белок, cодержащий на N-конце участок бета-галактозидазы, а на С-конце последовательность нейропептида. С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетиче| кого гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.
С помощью бромциана химерный белок расщепляли in vitro и получали активный лейцин-энкефалин. На рис. 5.12 представлены схема клонирования синтетиче| кого гена лейцин-энкефалина и его экспрессия в клетках кишечной палочки.
СИНТЕЗ СОМАТОСТАТИНА
Аналогичным путем был синтезирован соматостатин — гормон гипоталамуса (рис. 5.13). Молекула соматостатина состоит из 14 аминокислотных остатков. Соматостатин подавляет выделение инсулина и гормона роста человека. В Национальном медицинском центре «Хоуп» (Калифорния) был осуществлен химико-ферментативный синтез гена длиной в 42 нуклеотида, способного кодировать соматостатин. Участок ДНК, кодирующий гормон соматостатин, получен путем соединения тринуклеотидов. Из 52 н. п. синтетического гена 42 пары составляли структурный ген гормона, а остальные служили для присоединения синтетического гена к плазмиде pBR322, а также к сегменту лактозного оперона (lac) из генома Е. coli или к бета-галактозидазному гену. Такую синтетическую чужеродную ДНК встраивали непосредственно за бактериальным геномом (или внутри его) после расщепления ДНК рестрикционными эндонуклеазами с образованием в результате трансляции гибридного белка.
Основные этапы генно-инженерного синтеза соматостатина показаны на рис. 5.14. Синтетический ген соматостатина был встроен в плазмиду pBR322 Е. coli вблизи конца гена, кодирующего фермент бета-галактозидазу. Между двумя генами был помещен кодон метионина. После выделения рекомбинантной плазмиды в бактериальную клетку кишечная палочка стала синтезировать гибридный белок. Часть его (соматостатин) затем отщепляли от бета-галактозидазы BrCN. Такой сложный способ получения гормона был необходим, так как соматостатин, синтезированный в виде свободных молекул, быстро деградирует под действием бактериальных протеаз. Первый синтез соматостатина генно-инженерным способом был осуществлен в 1977 г. Бойером. Выход гормона составил 10000 молекул на одну клетку. Из 100 г биомассы Е.coli, выращенной в ферментере объемом 8 л, удалось выделить 5 мг соматостатина, т.е. столько, сколько можно его выделить из 100 г овечьих мозгов.
5.8. СИНТЕЗ СОМАТОТРОПИНА
Соматотропин (или гормон роста человека ГРЧ) секретируется передней долей гипофиза.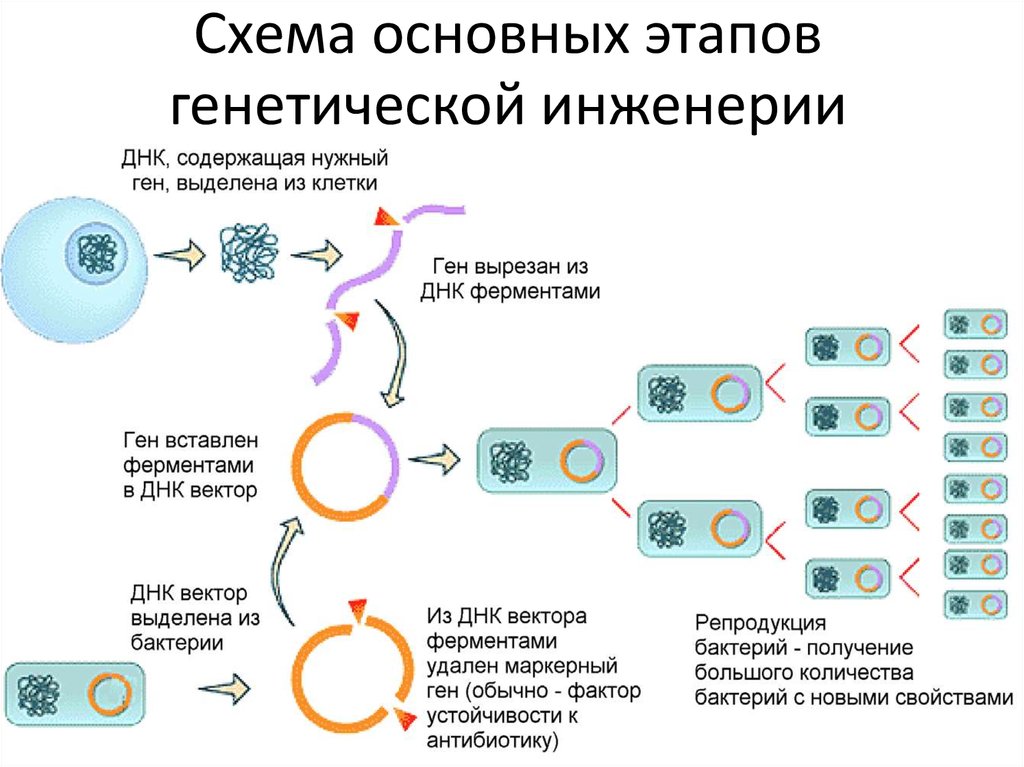 Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Впервые он был выделен и очищен в 1963 г. из гипофиза. Его недостаток приводит к заболеванию — гипофизарной карликовости (1 случай на 5000 человек). Гормон обладает видовой специфичностью. Обычно его получают из гипофиза трупов, но в недостаточном количестве. Гормона хватает лишь для лечения 1/3 случаев гипофизарной карликовости в развитых странах. Основные производители — Швеция, Италия, Швейцария и США. Молекула ГРЧ состоит из 191 аминокислотного остатка.
Препарат из трупного материала представляет собой смесь из нескольких форм, из которых пять имеют 22 кДа, другие являются димерами, а остальные — фрагментами, образующимися при протеолизе. Это приводило к тому, что у 30 % больных, получавших препарат, против гормона вырабатывались антитела, сводившие на нет его биологическую активность.
Принимая во внимание это обстоятельство, в настоящее время ГРЧ синтезируют методами генетической инженерии в специально сконструированных клетках бактерий. Будучи синтезированным в клетках Е. coli, ГРЧ содержит дополнительный остаток метионина на Н2N-конце молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, — с фен (—Nh3) долей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку; Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
coli, ГРЧ содержит дополнительный остаток метионина на Н2N-конце молекулы. Биосинтез ГРЧ из 191 аминокислотного остатка был осуществлен в 1979 г. Д. Гедделем с сотрудниками. Сначала клонировали двунитевую кДНК; далее путем расщепления получали последовательность, кодирующую аминокислотный порядок гормона, за исключением первых 23 аминокислот, — с фен (—Nh3) долей (23), и синтетический полинуклеотид, соответствующий аминокислотам от первой до двадцать третьей со стартовым ATG-кодоном в начале. Затем два фрагмента объединяли и подстраивали к паре lac-промоторов и участку связывания рибосом. Конечный выход гормона составил 2,4 мкг на 1 мл культуры, что составляет 100 000 молекул гормона на клетку; Полученный гормон на конце полипептидной цепи содержал дополнительный остаток метионина и обладал значительной биологической активностью. С 1984 г. после серьезных клинических испытаний на токсичность компанией «Генетек» (Сан-Франциско) было начато широкомасштабное производство бактериального соматотропина.
ГРЧ в клетках Е. coli и в культуре клеток животных был получен в 1982 г. одновременно в Институте Пастера (Париж) и в Институте молекулярной биологии (Москва). Оказалось, что в бактериальных клетках возможен синтез аналогов ГРЧ, с помощью которых изучались участки молекулы, важные для стимулирования роста и процесса неоглюкогенеза на молекулярном уровне.
Огромный интерес представляют выделение и синтез полипептида, обладающего полной биологической активностью гипоталамического рилизинг-фактора соматотропина (СТГ-РФ). Введение этого фактора способно компенсировать недостаток соматотропина. Таким образом, наличие СТГ-РФ и самого гормона, полученных в генетически сконструированных бактериальных клетках, очень важно для успешного лечения заболеваний, обусловленных недостатком этого гормона, и ряда патологических заболеваний, таких, как некоторые формы диабета, регенерация тканей после ожогов и др. Предполагаем, что СТГ-РФ можно использовать и для увеличения массы и роста домашних животных, так как он, не обладая видовой специфичностью, способен стимулировать освобождение гормона роста у ряда животных.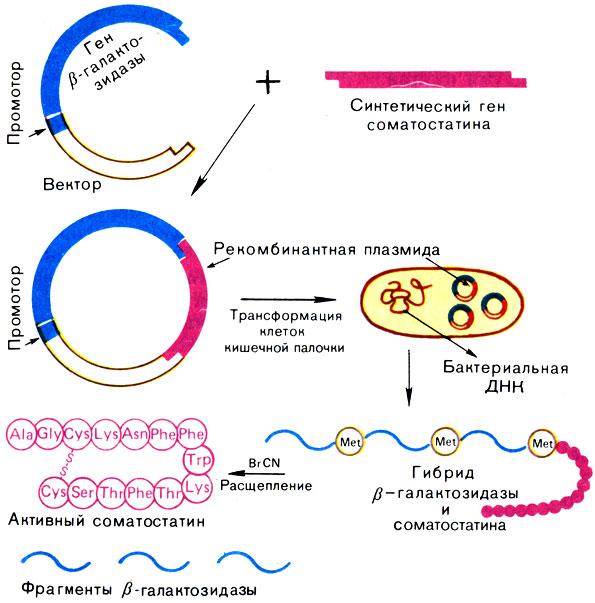
бета-Эндорфин — опиат мозга, состоящий из 31 аминокислотного остатка, был синтезирован в генетически сконструированных клетках в 1980 г. группой ученых из Австралии и США. Бета-эндорфин получен в клетках Е. coli в виде гибридного белка с бета-галактозидазой. Процедура синтеза бета-эндорфина включала: получение путем обратной транскрипции мРНК — кДНК, кодирующей белок- предшественник, содержащий помимо последовательности бета-эндорфина последовательность АКТГ и бета-липотропина (Р-ЛТГ), в дальнейшем удаляемые. Бета-эндорфин, полученный из гибридного белка и тщательно очищенный, обладал значительной биологической активностью. Он специфически взаимодействовал с антисывороткой против бета-эндорфина. От бета-эндорфина человека генно-инженерный бета-эндорфин отличался по двум аминокислотам, и эти отличия можно было легко устранить на нуклеотидном уровне путем замены двух кодонов в ДНК бактериальной плазмиды.
Что такое генная инженерия? – Ваш геном
Что такое генная инженерия?
- Генная инженерия, иногда называемая генетической модификацией, представляет собой процесс изменения ДНК в геноме организма.

- Это может также означать извлечение ДНК из генома другого организма и объединение ее с ДНК этого человека.
- Генная инженерия используется учеными для улучшения или изменения характеристик отдельного организма.
- Генную инженерию можно применять к любому организму, от вируса до овцы.
- Например, с помощью генной инженерии можно получить растения с более высокой питательной ценностью или способные переносить воздействие гербицидов.
Как работает генная инженерия?
Чтобы объяснить процесс генной инженерии, мы взяли пример с инсулином, белком, который помогает регулировать уровень сахара в крови.
- В норме инсулин вырабатывается поджелудочной железой, но у людей с диабетом 1 типа возникают проблемы с выработкой инсулина.
- Поэтому людям с диабетом приходится вводить инсулин, чтобы контролировать уровень сахара в крови.

- Генная инженерия использовалась для производства типа инсулина, очень похожего на наш, из дрожжей и бактерий, таких как E. coli .
- Этот генетически модифицированный инсулин «Хумулин» был лицензирован для использования человеком в 1982 году.
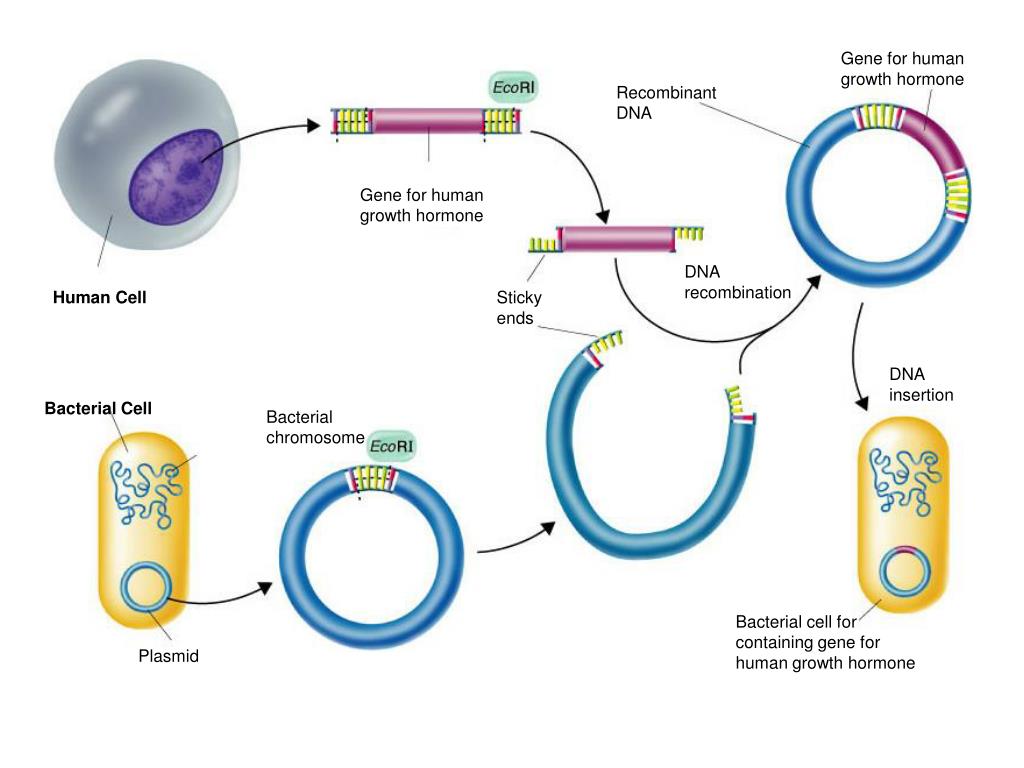
- Небольшой фрагмент кольцевой ДНК, называемый плазмидой, извлекается из бактерии или дрожжевой клетки.
- Затем из кольцевой плазмиды вырезается небольшой участок с помощью ферментов рестрикции, «молекулярных ножниц».
- Ген человеческого инсулина вставлен в пробел в плазмиде. Эта плазмида теперь генетически модифицирована.
- Генетически модифицированная плазмида вводится в новую бактериальную или дрожжевую клетку.
- Затем эта клетка быстро делится и начинает вырабатывать инсулин.
- Чтобы создать большое количество клеток, генетически модифицированные бактерии или дрожжи выращивают в больших сосудах для ферментации, которые содержат все необходимые им питательные вещества.

- По окончании ферментации смесь фильтруют для выделения инсулина.
- Затем инсулин очищают и упаковывают во флаконы и шприц-ручки для раздачи пациентам с диабетом.
Иллюстрация, показывающая, как генетическая модификация используется для производства инсулина в бактериях.
Изображение предоставлено: Genome Research Limited
Для чего еще используется генная инженерия?
- Первым генетически модифицированным организмом, который был создан в 1973 году, была бактерия.
- В 1974 году те же методы были применены к мышам.
- В 1994 году стали доступны первые генетически модифицированные продукты.
- Генная инженерия имеет ряд полезных применений, включая научные исследования, сельское хозяйство и технологии.
- В отношении растений генная инженерия применялась для повышения устойчивости, питательной ценности и скорости роста таких культур, как картофель, помидоры и рис.

- На животных он использовался для выведения овец, которые производят терапевтический белок в своем молоке, который можно использовать для лечения кистозного фиброза, или червей, которые светятся в темноте, чтобы ученые могли больше узнать о таких болезнях, как болезнь Альцгеймера.
Болезнь Альцгеймера и гельминтоз
- Червь-нематода, C. elegans , имеет только около 300 клеток во всей своей нервной системе, что делает его очень простой моделью для изучения болезни Альцгеймера.
- Также, благодаря тому, что червь почти прозрачен, когда его нервные клетки помечены зеленым флуоресцентным белком (GFP), можно наблюдать под микроскопом расположение и активность различных структур и белков.
- Генетический материал C. elegans можно легко генетически модифицировать, чтобы заставить червя производить определенные белки, которые исследователи хотят изучить.
- У человека ген APP кодирует белок, связанный с амилоидными бляшками, характерными для людей с болезнью Альцгеймера.

- Итак, чтобы изучить болезнь Альцгеймера, исследователи генетически сконструировали нервные клетки червя, чтобы они содержали ген APP , что фактически дало ему болезнь Альцгеймера.
- Пометив белок АРР, вырабатываемый червем, зеленым флуоресцентным белком, можно было увидеть, что все клетки, вступившие в контакт с АРР, погибли по мере взросления червя.
- Затем исследователи смогли наблюдать за прогрессированием болезни Альцгеймера у червя и применить полученные результаты для понимания роли АРР у людей с болезнью Альцгеймера.
Последнее обновление этой страницы: 17 февраля 2017 г.
Клеточные фабрики по производству инсулина
1. Cohen SN, Chang ACY, Boyer HW, Helling RB. Конструирование биологически функциональных бактериальных плазмид in vitro. Proc Natl Acad Sci U S A. 1973; 70:3240–3244. doi: 10.1073/pnas.70.11.3240. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Нильсен Дж. Производство биофармацевтических белков дрожжами.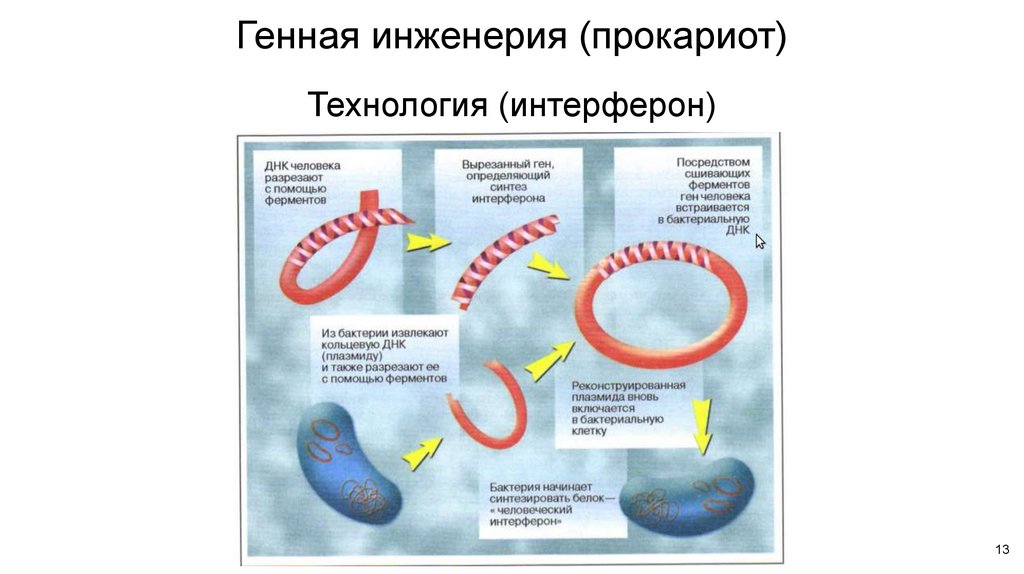 Landes Biosci Bioengineered. 2013;4(4):207–211. doi: 10.4161/bioe.22856. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Landes Biosci Bioengineered. 2013;4(4):207–211. doi: 10.4161/bioe.22856. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
3. Гудман М., Обзор рынка Продажи биопрепаратов продемонстрируют устойчивый рост до 2013 года. Nat Rev Drug Discov. 2009; 8:837. doi: 10.1038/nrd3040. [PubMed] [CrossRef] [Google Scholar]
4. Аггарвал С. Что подпитывает биотехнологический двигатель с 2010 по 2011 год. Nat Biotechnol. 2011;29:1083–1089. doi: 10.1038/nbt.2060. [PubMed] [CrossRef] [Google Scholar]
5. Walsh G. Biopharmaceuticals: одобрения и тенденции одобрения в 2004 г. Biopharm Int. 2005; 18:58–65. [Google Scholar]
6. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2005 г. BioPharm Int. 2006; 9: 58–68. [Google Scholar]
7. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2006 г. BioPharm Int. 2007; 20:40–48. [Google Scholar]
8. Walsh G. Biopharmaceuticals: тенденции одобрения в 2007 г. BioPharm Int. 2008; 21:52–65. [Академия Google]
[Академия Google]
9. Уолш Г. Биофармацевтические препараты: тенденции одобрения в 2008 г. BioPharm Int. 2009;22(10):68–77. [Google Scholar]
10. Уолш Г. Тенденции одобрения биофармацевтических препаратов в 2009 г. BioPharm Int. 2010;23(10):30–41. [Google Scholar]
11. Уолш Г. Биофармацевтические тесты. Нац биотехнолог. 2010;28:917–924. doi: 10.1038/nbt0910-917. [PubMed] [CrossRef] [Google Scholar]
12. Уолш Г. Новые биофармацевтические препараты. БиоФарм Инт. 2012; 25:34–36. [Google Scholar]
13. Уолш Г. Тенденции одобрения биофармацевтических препаратов в 2013 году. Biopharm Int. 2013;26(4):54–56. [Академия Google]
14. Уолш Г. Терапевтические инсулины и их крупномасштабное производство. Приложение Microbiol Biotechnol. 2005; 67: 151–159. doi: 10.1007/s00253-004-1809-x. [PubMed] [CrossRef] [Google Scholar]
15. Ferrer-Miralles N, Domingo-Espin J, Corchero JL, Vazquez E, Villaverde A. Микробные фабрики для рекомбинантных фармацевтических препаратов. Факт микробной клетки. 2009; 8:17. дои: 10.1186/1475-2859-8-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Факт микробной клетки. 2009; 8:17. дои: 10.1186/1475-2859-8-17. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
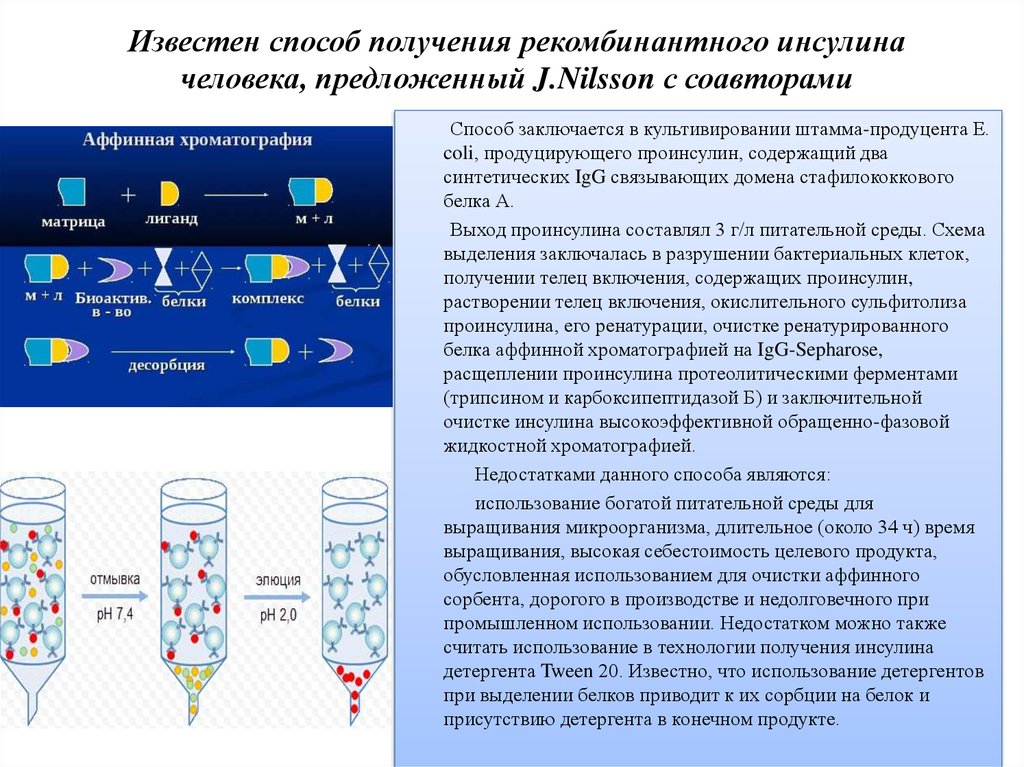
16. Nilsson J, Jonasson P, Samuelsson E, Stahl S, Uhlen M. Интегрированное производство человеческого инсулина и его C-пептида. Дж Биотехнолог. 1996;48:241–250. doi: 10.1016/0168-1656(96)01514-3. [PubMed] [CrossRef] [Google Scholar]
17. Thim L, Hansen MT, Norris K, Hoegh I, Boel E, Forstrom J, Ammerer G, Fiil NP. Секреция и процессинг предшественников инсулина в дрожжах. Proc Natl Acad Sci U S A. 1986; 83:6766–6770. doi: 10.1073/pnas.83.18.6766. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
18. Markussen J, Damgaard U, Diers I, Fiil N, Hansen MT, Larsen P, Norris F, Norris K, Schou O, Snel L, Thim Л, Фойгт ХО. Биосинтез человеческого инсулина в дрожжах через одноцепочечные предшественники. Диабетология. 1986;29:568А–569А. [Google Scholar]
19. Kjeldsen T. Секреторная экспрессия предшественников инсулина в дрожжах.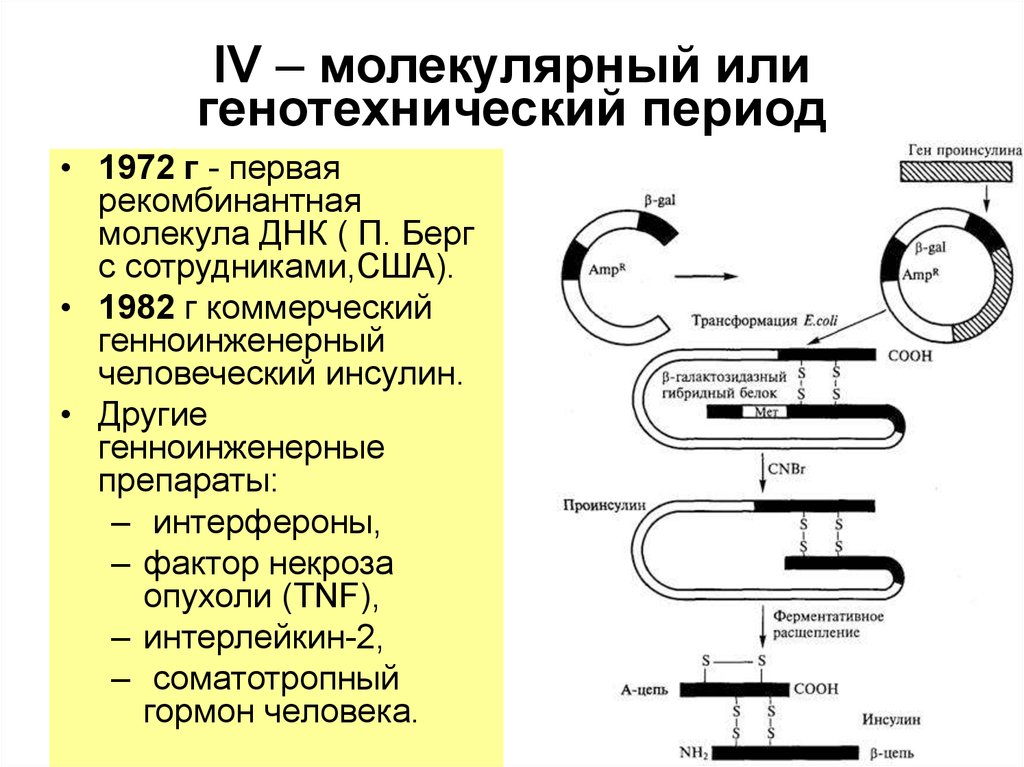 Приложение Microbiol Biotechnol. 2000; 54: 277–286. doi: 10.1007/s002530000402. [PubMed] [CrossRef] [Google Scholar]
Приложение Microbiol Biotechnol. 2000; 54: 277–286. doi: 10.1007/s002530000402. [PubMed] [CrossRef] [Google Scholar]
20. Холленберг С.П., Геллиссен Г. Производство рекомбинантных белков метилотрофными дрожжами. Курр Опин Биотехнолог. 1997; 8: 554–560. doi: 10.1016/S0958-1669(97)80028-6. [PubMed] [CrossRef] [Google Scholar]
21. Геллиссен Г., Холленберг С.П. Применение дрожжей в исследованиях экспрессии генов Сравнение Saccharomyces cerevisiae, Hansenula polymorpha и Kluyveromyces lactis – обзор. Ген. 1997;190:87–97. doi: 10.1016/S0378-1119(97)00020-6. [PubMed] [CrossRef] [Google Scholar]
22. Романос М. Успехи в использовании Pichia pastoris для экспрессии генов высокого уровня. Курр Опин Биотехнолог. 1995; 6: 527–533. doi: 10.1016/0958-1669(95)80087-5. [CrossRef] [Google Scholar]
23. Weydemann U, Keup P, Piontek M, Strasser AW, Schweden J, Gellissen G, Janowicz ZA. Высокий уровень секреции гирудина Hansenula polymorpha — аутентичный процессинг трех разных препрогирудинов. Приложение Microbiol Biotechnol. 1995;44:377–385. doi: 10.1007/BF00169932. [PubMed] [CrossRef] [Google Scholar]
Приложение Microbiol Biotechnol. 1995;44:377–385. doi: 10.1007/BF00169932. [PubMed] [CrossRef] [Google Scholar]
24. Порро Д., Зауэр М., Брандуарди П., Маттанович Д. Производство рекомбинантного белка в дрожжах. Мол Биотехнолог. 2005; 31: 245–259. doi: 10.1385/МБ:31:3:245. [PubMed] [CrossRef] [Google Scholar]
25. Yanagita M, Nakayama K, Takeuchi T. Процессинг мутированного проинсулина с сайтами четырехосновного расщепления в биоактивный инсулин в неэндокринной клеточной линии COS-7. ФЭБС лат. 1992; 311: 55–59. дои: 10.1016/0014-5793(92)81366-Т. [PubMed] [CrossRef] [Google Scholar]
26. Arakawa T, Yu J, Chong DKX, Hough J, Engen PC, Langridge WHR. Слитый белок субъединицы холерного токсина В и инсулина растительного происхождения защищает от развития аутоиммунного диабета. Нац биотехнолог. 1998; 16: 934–938. doi: 10.1038/nbt1098-934. [PubMed] [CrossRef] [Google Scholar]
27. Nykiforuk CL, Boothe JG, Murray EW, Keon RG, Goren HJ, Markley NA, Moloney MM. Трансгенная экспрессия и выделение биологически активного рекомбинантного инсулина человека из семян Arabidopsis thaliana.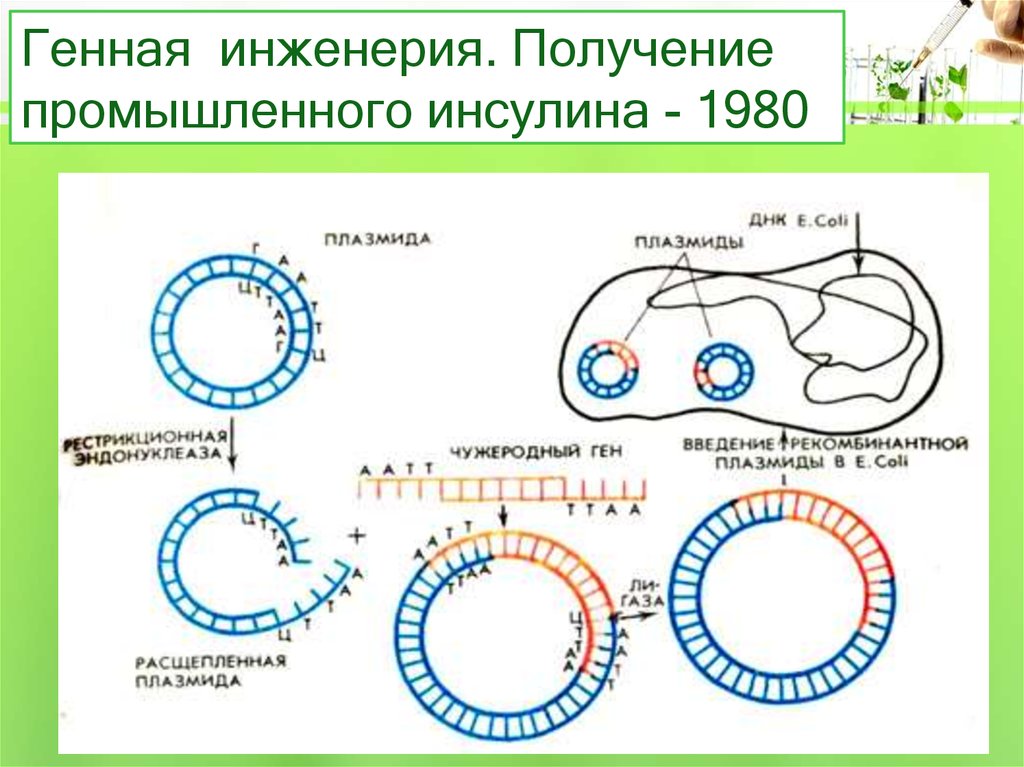 Plant Biotech J. 2006; 4:77–85. doi: 10.1111/j.1467-7652.2005.00159.Икс. [PubMed] [CrossRef] [Google Scholar]
Plant Biotech J. 2006; 4:77–85. doi: 10.1111/j.1467-7652.2005.00159.Икс. [PubMed] [CrossRef] [Google Scholar]
28. Boyhan D, Daniell H. Недорогое производство проинсулина в хлоропластах табака и салата для инъекций или пероральной доставки функционального инсулина и C-пептида. Plant Biotech J. 2011;9:585–598. doi: 10.1111/j.1467-7652.2010.00582.x. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
29. Wild S, Roglic G, Green A, Sicree R, King H. Глобальная распространенность диабета: оценки на 2000 год и прогнозы на 2030 год. Диабет Забота. 2004; 27:1047–1053. doi: 10.2337/diacare.27.5.1047. [PubMed] [CrossRef] [Академия Google]
30. Сахдев С., Хаттар С.К., Сайни К.С. Производство активных эукариотических белков с помощью бактериальных систем экспрессии: обзор существующих биотехнологических стратегий. Мол Селл Биохим. 2008; 307: 249–264. doi: 10.1007/s11010-007-9603-6. [PubMed] [CrossRef] [Google Scholar]
31. Арья Р., Бхаттачарья А., Шайни К.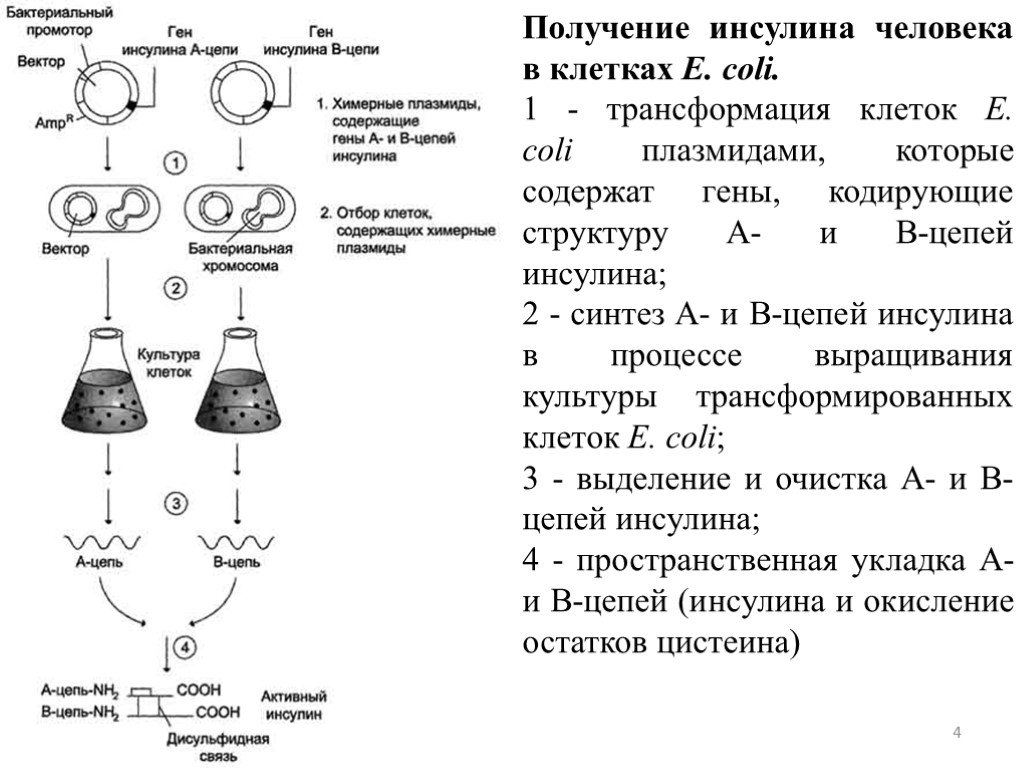 С. Dictyostelium discoideum — многообещающая система экспрессии для продукции эукариотических белков. FASEB J. 2008; 22:4055–4066. doi: 10.1096/fj.08-110544. [PubMed] [CrossRef] [Академия Google]
С. Dictyostelium discoideum — многообещающая система экспрессии для продукции эукариотических белков. FASEB J. 2008; 22:4055–4066. doi: 10.1096/fj.08-110544. [PubMed] [CrossRef] [Академия Google]
32. Ferrer-Miralles N, Villaverde A. Фабрики бактериальных клеток для производства рекомбинантных белков; расширение каталога. Факт микробной клетки. 2013;12:113. дои: 10.1186/1475-2859-12-113. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Kjeldsen T, Pettersson AF, Hach M. Секреторная экспрессия и характеристика инсулина у Pichia pastoris. Биотехнология Appl Biochem. 1999; 29: 79–86. [PubMed] [Google Scholar]
34. Gerngross TU. Достижения в производстве терапевтических белков человека в дрожжах и мицелиальных грибах. Нац биотехнолог. 2004;22:1409–1414. doi: 10.1038/nbt1028. [PubMed] [CrossRef] [Google Scholar]
35. Мансур М., Кабельо С., Эрнандес Л., Паис Дж., Варас Л., Вальдес Дж., Терреро Ю., Идальго А., Плана Л., Бесада В., Гарсия Л., Ламазарес Э. , Кастелланос Л., Мартинес Э. Множественное количество копий гена усиливает секрецию предшественника инсулина у дрожжей Pichia pastoris. Биотехнологическая лат. 2005; 27: 339–345. doi: 10.1007/s10529-005-1007-7. [PubMed] [CrossRef] [Google Scholar]
, Кастелланос Л., Мартинес Э. Множественное количество копий гена усиливает секрецию предшественника инсулина у дрожжей Pichia pastoris. Биотехнологическая лат. 2005; 27: 339–345. doi: 10.1007/s10529-005-1007-7. [PubMed] [CrossRef] [Google Scholar]
36. Wurm FM. Производство рекомбинантных белковых терапевтических средств в культивируемых клетках млекопитающих. Нац биотехнолог. 2004; 22:1358–139.3. doi: 10.1038/nbt1026. [PubMed] [CrossRef] [Google Scholar]
37. Vajo Z, Fawcett J, Duckworth WC. Технология рекомбинантной ДНК в лечении диабета: аналоги инсулина. Endocr Rev. 2001; 22:706–717. doi: 10.1210/edrv.22.5.0442. [PubMed] [CrossRef] [Google Scholar]
38. Ахмад Б. Фармакология инсулина. Br J Диабет Vasc Dis. 2004; 4:10–14. doi: 10.1177/14746514040040010201. [CrossRef] [Google Scholar]
39. Дженкинс Н. Модификации терапевтических белков: проблемы и перспективы. Цитотехнология. 2007; 53: 121–125. doi: 10.1007/s10616-007-9075-2. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Уолш Г., Джефферис Р. Посттрансляционные модификации в контексте терапевтических белков. Нац биотехнолог. 2006; 24:1241–1252. doi: 10.1038/nbt1252. [PubMed] [CrossRef] [Google Scholar]
Уолш Г., Джефферис Р. Посттрансляционные модификации в контексте терапевтических белков. Нац биотехнолог. 2006; 24:1241–1252. doi: 10.1038/nbt1252. [PubMed] [CrossRef] [Google Scholar]
41. Wacker M, Linton D, Hitchen PG, Nita-Lazar M, Haslam SM, North SJ, Panico M, Morris HR, Dell A, Wren BW, Aebi M. N. -связанное гликозилирование в Campylobacter jejuni и его функциональный перенос в E. coli. Наука. 2002;298: 1790–1793. doi: 10.1126/science.298.5599.1790. [PubMed] [CrossRef] [Google Scholar]
42. Feldman MF, Wacker M, Hernandez M, Hitchen PG, Marolda CL, Kowarik M, Morris HR, Dell A, Valvano MA, Aebi M. Engineering N-связанное гликозилирование белков с разнообразными структурами липополисахарида О-антигена в Escherichia coli. Proc Natl Acad Sci U S A. 2005;102:3016–3021. doi: 10.1073/pnas.0500044102. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
43. Wacker M, Feldman MF, Callewaert N, Kowarik M, Clarke BR, Pohl NL, Hernandez M, Vines ED, Valvano MA, Whitfield C, Aebi М.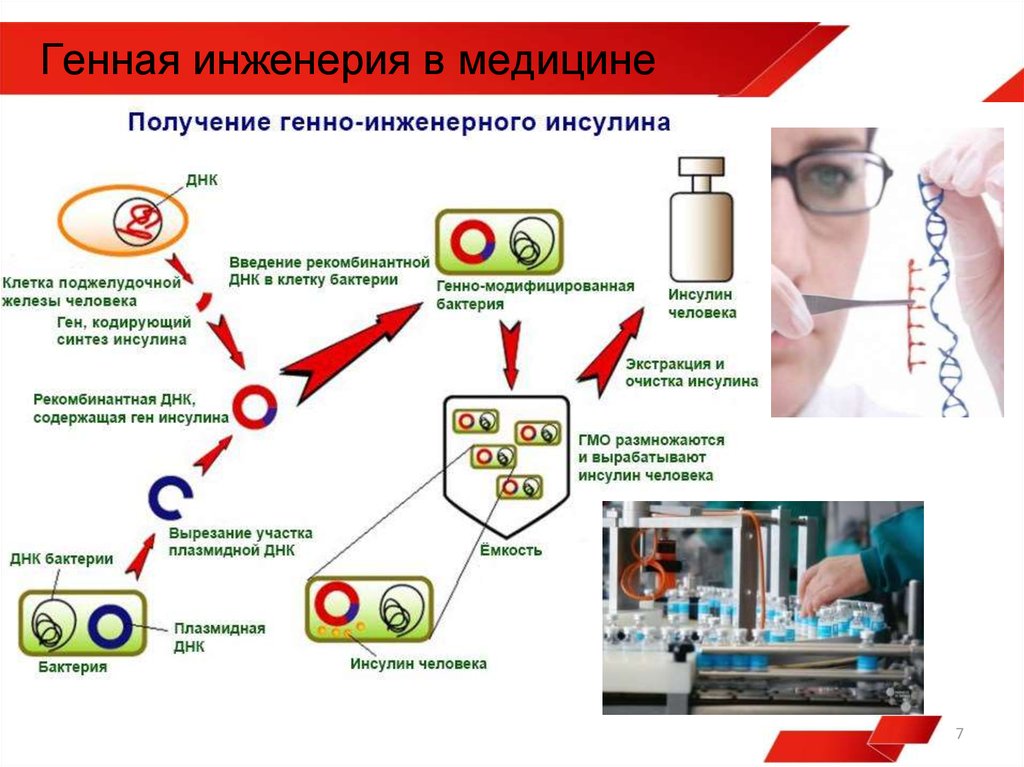 Субстратная специфичность бактериальной олигосахарилтрансферазы предполагает общий механизм переноса для бактериальной и эукариотической систем. Proc Natl Acad Sci U S A. 2006; 103:7088–709.3. doi: 10.1073/pnas.0509207103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Субстратная специфичность бактериальной олигосахарилтрансферазы предполагает общий механизм переноса для бактериальной и эукариотической систем. Proc Natl Acad Sci U S A. 2006; 103:7088–709.3. doi: 10.1073/pnas.0509207103. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
44. Fisher AC, Haitjema CH, Guarino C, Celik E, Endicott CE, Reading CA, Merritt JH, Ptak AC, Zhang S, DeLisa MP. Продукция секреторных и внеклеточных N-связанных гликопротеинов в Escherichia coli. Appl Environ Microbiol. 2011;77:871–881. doi: 10.1128/AEM.01901-10. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
45. Ihssen J, Kowarik M, Dilettoso S, Tanner C, Wacker M, Thoxy-Meyer L. Производство гликопротеиновых вакцин в Escherichia coli. Факт микробной клетки. 2010;9:61. дои: 10.1186/1475-2859-9-61. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
46. Lizak C, Fan Y, Web TC, Aebi M. N-связанное гликозилирование фрагментов антител в Escherichia coli. Биоконьюг Хим. 2011; 22: 488–496. doi: 10.1021/bc100511k. [PubMed] [CrossRef] [Google Scholar]
2011; 22: 488–496. doi: 10.1021/bc100511k. [PubMed] [CrossRef] [Google Scholar]
47. Pandhal H, Ow SY, Noirel J, Wright PC. Улучшение эффективности N-гликозилирования в Escherichia coli с использованием анализа метаболической сети протеомики дробовика и селективного мониторинга реакций. Биотехнология Биоинж. 2011;108:902–912. doi: 10.1002/bit.23011. [PubMed] [CrossRef] [Google Scholar]
48. Чен Р. Бактериальные системы экспрессии для производства рекомбинантных белков: E. coli и другие. Биотехнология Adv. 2012;30:1102–1107. doi: 10.1016/j.biotechadv.2011.09.013. [PubMed] [CrossRef] [Google Scholar]
49. Makrides SC. Стратегии достижения высокого уровня экспрессии генов в Escherichia coli. Microbiol Rev. 1996;60:512–538. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Kane JF. Влияние кластеров редких кодонов на высокий уровень экспрессии гетерологичных белков в Escherichia coli. Курр Опин Биотехнолог. 1995;6(5):494–500. doi: 10.1016/0958-1669(95)80082-4. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
51. Trundova M, Celer V. Экспрессия гена ORF2 свиного цирковируса 2 нуждается в кодон-оптимизированных клетках E.coli. Гены вирусов. 2007; 34: 199–204. doi: 10.1007/s11262-006-0043-2. [PubMed] [CrossRef] [Google Scholar]
52. Sorensen HP, Sperling-Petersen HU, Mortensen KK. Производство рекомбинантных термостабильных белков, экспрессированных в Escherichia coli: завершение синтеза белка является узким местом. J Chromatogr B Analyt Technol Biomed Life Sci. 2003; 786: 207–214. дои: 10.1016/S1570-0232(02)00689-ИКС. [PubMed] [CrossRef] [Google Scholar]
53. Bill RM, Henderson PJF, Iwata S, Kunji ERS, Michel H, Neutze R, Newstead S, Poolman B, Tate CG, Voge H. Преодоление барьеров в структуре мембранного белка определение. Нац биотехнолог. 2011;29(4):335–340. doi: 10.1038/nbt.1833. [PubMed] [CrossRef] [Google Scholar]
54. Huang CJ, Lin H, Yang X. Промышленное производство рекомбинантных терапевтических средств в Escherichia coli и его последние достижения.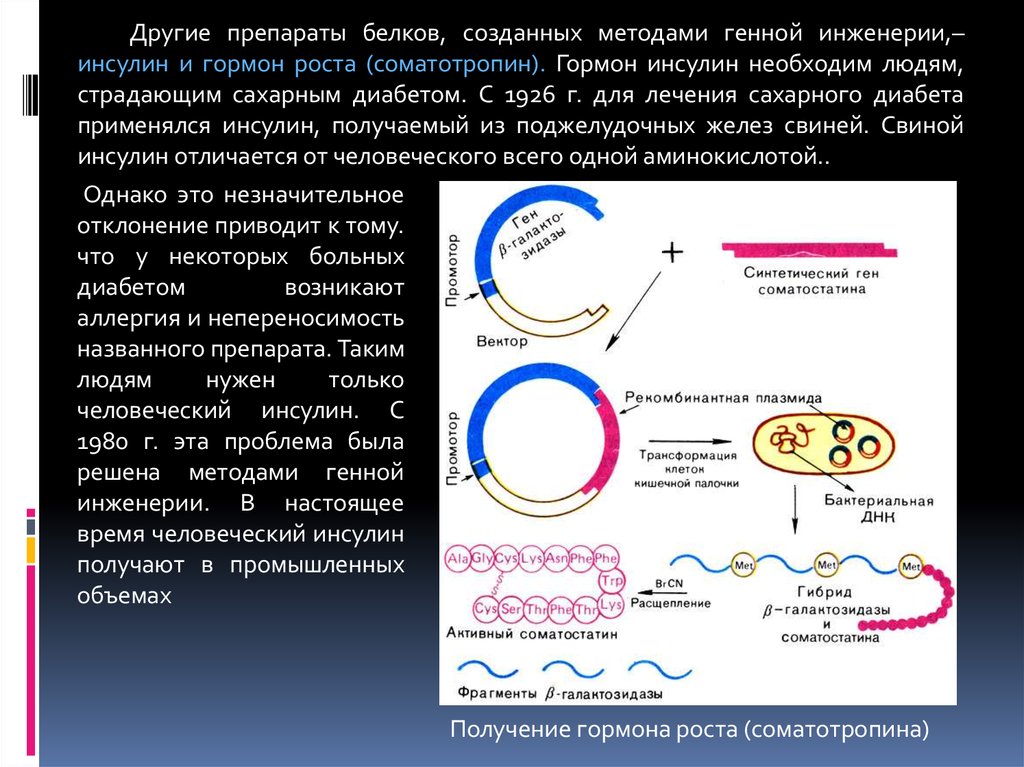 J Ind Microbiol Biotechnol. 2012; 39: 383–39.9. doi: 10.1007/s10295-011-1082-9. [PubMed] [CrossRef] [Google Scholar]
J Ind Microbiol Biotechnol. 2012; 39: 383–39.9. doi: 10.1007/s10295-011-1082-9. [PubMed] [CrossRef] [Google Scholar]
55. Рейли Д.Е., Янсура Д.Г. Продукция моноклональных антител в E. coli. В: Шайр С.Дж., Гомботц В., Бехтольд-Питерс К., Андья Дж., редакторы. Современные тенденции в разработке и производстве моноклональных антител. Нью-Йорк: Спрингер; 2010. С. 295–308. [Google Scholar]
56. Овертон Т.В. Продукция рекомбинантных белков в бактериях-хозяевах. Наркотиков Дисков Сегодня. 2014;19(5):590–601. doi: 10.1016/j.drudis.2013.11.008. [PubMed] [CrossRef] [Академия Google]
57. Каррио М.М., Вильяверде А. Роль молекулярных шаперонов в формировании телец включения. Фебс Летт. 2003;537(1–3):215–221. doi: 10.1016/S0014-5793(03)00126-1. [PubMed] [CrossRef] [Google Scholar]
58. Де Марко А. Протокол получения белков с улучшенной растворимостью путем совместной экспрессии с молекулярными шаперонами в Escherichia coli. Нат Проток. 2007;2(10):2632–2639. doi: 10.1038/nprot. 2007.400. [PubMed] [CrossRef] [Google Scholar]
2007.400. [PubMed] [CrossRef] [Google Scholar]
59. Шанс Р., Фрэнк Б. Исследования, разработка, производство и безопасность биосинтетического инсулина человека. Уход за диабетом. 1993;16(3):133–142. [PubMed] [Google Scholar]
60. Chance R, Glazer N, Wishner K. Insulin Lispro (Humalog) In: Walsh G, Murphy B, editors. Биофармацевтика, промышленная перспектива. Клювер: Дордрехт; 1999. С. 149–172. [Google Scholar]
61. Бланделл Т., Додсон Г., Ходжкин Д., Меркола Д. Инсулин: структура в кристалле и ее отражение в химии и биологии. Adv Prot Chem. 1972; 26: 279–402. doi: 10.1016/S0065-3233(08)60143-6. [CrossRef] [Google Scholar]
62. Kang S, Creagh F, Peters J, Brange J, Volund A, Owens D. Сравнение подкожного растворимого человеческого инсулина и аналогов инсулина на колебания уровня глюкозы в плазме, связанные с приемом пищи, у больных диабетом 1-го типа. предметы. Уход за диабетом. 1991;14:571–577. doi: 10.2337/diacare.14.7.571. [PubMed] [CrossRef] [Google Scholar]
63. Брандж Дж., Рибель Дж., Хансен Дж. Ф., Додсон Г., Хансен М.Т., Хавелунд С., Мельберг С.Г., Норрис К., Норрис Л., Снел Л., Соренсен А.Р., Фойгт Х.О. Мономерные инсулины, полученные с помощью белковой инженерии, и их медицинские последствия. Природа. 1988; 333: 679–682. doi: 10.1038/333679a0. [PubMed] [CrossRef] [Google Scholar]
Брандж Дж., Рибель Дж., Хансен Дж. Ф., Додсон Г., Хансен М.Т., Хавелунд С., Мельберг С.Г., Норрис К., Норрис Л., Снел Л., Соренсен А.Р., Фойгт Х.О. Мономерные инсулины, полученные с помощью белковой инженерии, и их медицинские последствия. Природа. 1988; 333: 679–682. doi: 10.1038/333679a0. [PubMed] [CrossRef] [Google Scholar]
64. Brange J, Owens DR, Kang S, Volund A. Мономерные инсулины и их экспериментальное и клиническое значение. Уход за диабетом. 1990;13(9):923–954. doi: 10.2337/diacare.13.9.923. [PubMed] [CrossRef] [Google Scholar]
65. Wildt S, Gerngross TU. Гуманизация путей N-гликозилирования у дрожжей. Нат микробиол. 2005;3:119–128. doi: 10.1038/nrmicro1087. [PubMed] [CrossRef] [Google Scholar]
66. Гринна Л.С., Чопп Дж.Ф. Распределение по размерам и общие структурные особенности N-связанных олигосахаридов метилотрофных дрожжей Pichia pastoris. Дрожжи. 1989; 5: 107–115. doi: 10.1002/yea.320050206. [PubMed] [CrossRef] [Академия Google]
67. Tschopp JF, Sverlow G, Kosson R, Craig W, Grinna L. Высокий уровень секреции гликозилированной инвертазы у метилотрофных дрожжей pichia pastoris. Биотехнология. 1987; 5: 1305–1308. doi: 10.1038/nbt1287-1305. [CrossRef] [Google Scholar]
Высокий уровень секреции гликозилированной инвертазы у метилотрофных дрожжей pichia pastoris. Биотехнология. 1987; 5: 1305–1308. doi: 10.1038/nbt1287-1305. [CrossRef] [Google Scholar]
68. Ellis SB, Brust PF, Koutz PJ, Waters AF, Harpold MM, Gingeras TR. Выделение алкогольоксидазы и двух других генов, регулируемых метанолом, из дрожжей Pichia pastoris. Мол Селл Биол. 1985; 5: 1111–1121. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Tschopp JF, Brust PF, Cregg JM, Stillman C, Gingeras TR. Экспрессия гена lacZ из двух промоторов, регулируемых метанолом, у Pichia pastoris. Нуклеиновые Кислоты Res. 1987; 15: 3859–3876. doi: 10.1093/нар/15.9.3859. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
70. Порро Д., Гассер Б., Фоссати Т., Маурер М., Брандуарди П., Зауэр М., Маттанович Д. Производство рекомбинантных белков и метаболитов в дрожжах. Приложение Microbiol Biotechnol. 2011; 89: 939–948. doi: 10.1007/s00253-010-3019-з. [PubMed] [CrossRef] [Google Scholar]
71. Shin CS, Hong MS, Bae CS, Lee J. Повышенное производство мини-проинсулина человека в культурах с подпиткой при высокой плотности клеток Escherichia coli BL21 (DE3) [ pET-3aT2M2] Biotechnol Prog. 1997; 13: 249–257. doi: 10.1021/bp970018m. [PubMed] [CrossRef] [Google Scholar]
Shin CS, Hong MS, Bae CS, Lee J. Повышенное производство мини-проинсулина человека в культурах с подпиткой при высокой плотности клеток Escherichia coli BL21 (DE3) [ pET-3aT2M2] Biotechnol Prog. 1997; 13: 249–257. doi: 10.1021/bp970018m. [PubMed] [CrossRef] [Google Scholar]
72. Mergulhao F, Taipa M, Cabral J, Monteiro G. Оценка узких мест в секреции проинсулина Escherichia coli. Дж Биотехнолог. 2004; 109:31–43. doi: 10.1016/j.jbiotec.2003.10.024. [PubMed] [CrossRef] [Академия Google]
73. Gurramkonda C, Polez S, Skoko N, Adnan A, Gabel T, Chugh D, Swaminathan S, Khanna N, Tisminetzky S, Rinas U. Применение простого метода периодической подпитки для секреторного производства предшественника инсулина на высоком уровне. с использованием Pichia pastoris с последующей очисткой и конверсией в человеческий инсулин. Факт микробной клетки. 2010;9:31. дои: 10.1186/1475-2859-9-31. [Статья бесплатно PMC] [PubMed] [CrossRef] [Google Scholar]
74. Оуэнс Д.Р., Вора Дж.П., Долбен Дж. Человеческий инсулин и не только: обзор технологии полусинтеза и рекомбинантной ДНК. В: Pickup JC, редактор. Биотехнология инсулинотерапии. Оксфорд: Блэквелл; 1991. стр. 24–41. [Google Scholar]
Человеческий инсулин и не только: обзор технологии полусинтеза и рекомбинантной ДНК. В: Pickup JC, редактор. Биотехнология инсулинотерапии. Оксфорд: Блэквелл; 1991. стр. 24–41. [Google Scholar]
75. Фрэнк Б. Манипулирование положением пролина в В-цепи привело к получению мономерных инсулинов. Диабет. 1991; 40 (Приложение 1): 423A. [Google Scholar]
76. Kurtzhals P, Havelund S, Jonassen S, Markussen J. Влияние жирных кислот и некоторых лекарств на связывание альбумина ацилированного аналога инсулина длительного действия. Дж. Фарм. 1997;86(12):1365–1368. doi: 10.1021/js9701768. [PubMed] [CrossRef] [Google Scholar]
77. Оуэнс Д.Р., Зинман Б., Болли Г. Инсулины сегодня и в будущем. Ланцет. 2001;358:739–746. doi: 10.1016/S0140-6736(01)05842-1. [PubMed] [CrossRef] [Google Scholar]
78. Havelund S, Plum A, Ribel U, Jonassen I, Volund A, Markussen J, Kurtzhals P. Механизм пролонгации инсулина детемира, ацилированного аналога длительного действия. человеческого инсулина.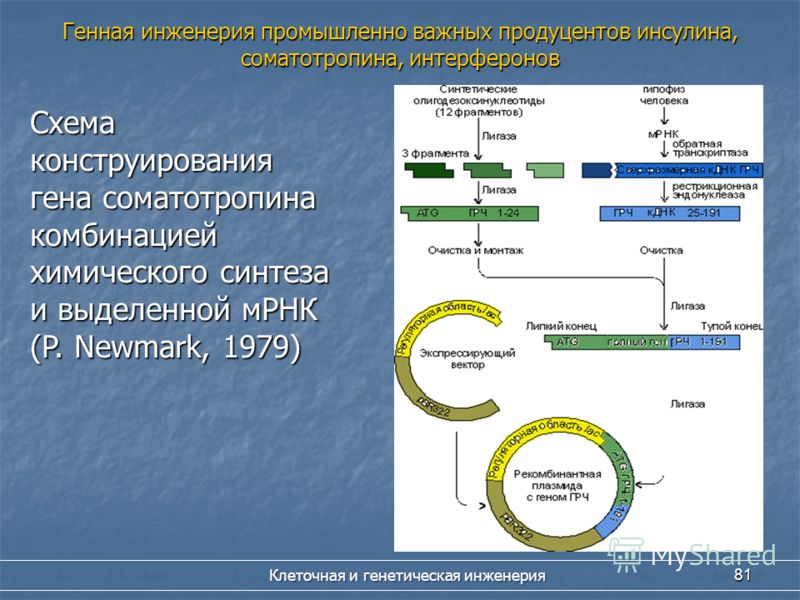



Leave A Comment