Содди Ф. История атомной энергии. — 1979 — Электронная библиотека «История Росатома»
Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка123456789101112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Фронтиспис
2Титульные листы
5Кривомазов А. Н., Трифонов Д. Н.
Предисловие редакторов перевода21Предисловие
23Предисловие к изданию 1954 года
25Глава первая. От алхимии к химии
25[Цель данной книги]
27Происхождение химии
32Химия в древности
34Атомистическая теория древних греков и ее извращение
38Появление экспериментальных наук
44Глава вторая. Современная атомная и молекулярная теории
44[Атом и молекула]
46Подлинное появление атомной теории
47Дальтон и атомная теория
50Работа Вильяма Хиггинса
58Молекулярная теория
59Атомная теория Берцелиуса
62Периодическая система химических элементов
68Спиральная форма периодического закона
70Глава третья. Энергия и электричество
70[Тепло]
71Законы термодинамики
74Кинетическая теория газов
77Броуновское движение и число Авогадро
79Современное представление о молекуле
80Электричество
83Теория электролитической диссоциации Аррениуса
84Электромагнитная теория света
86Спектральный анализ
87«Лучевая материя»
90Глава четвертая.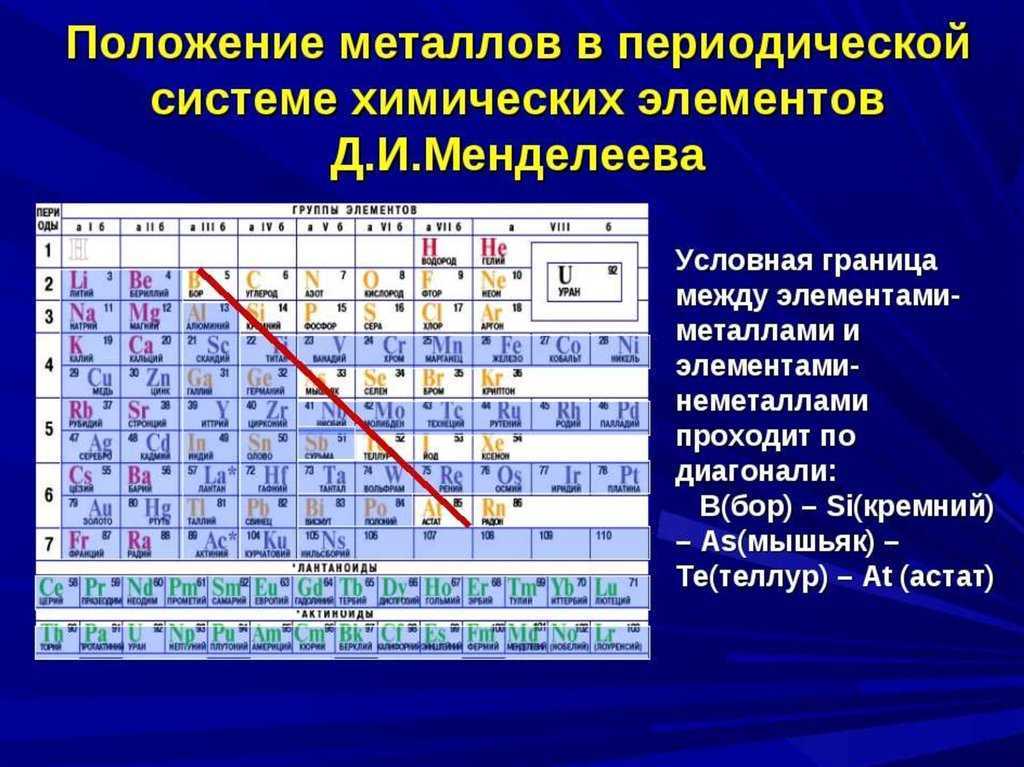 Рентгеновское излучение, радиоактивность и электрон
Рентгеновское излучение, радиоактивность и электрон
90[Социальная значимость энергии]
91Рентгеновское излучение и электрон
93Радиоактивность
96Новые радиоактивные элементы
98Радий
99Ионизация газов
101Альфа-, бета- и гамма-излучение
103Эманации и активные осадки
105Глава пятая. Открытие атомной энергии
105[Монреаль и Резерфорд]
106Эманация — это инертный газ
106Торий-X и уран-X
109Теория радиоактивного распада
110Гелий и радиоактивность
111Возраст Земли
112Альфа-излучение
115Образование гелия из радия
122Радиоактивное равновесие
122Материнские вещества полония, актиния и радия
126Исследование Брэггом природы альфа-излучения
129Альфа-частица — это испускаемое ядро гелия
131Глава шестая. Энергия и масса. изотопы
131[Введение]
131Электромагнитная теория массы
133Теория относительности
134Внутренняя энергия массы
135Эквивалентность массы и энергии
136Происхождение концепции изотопов
137Радиоторий
138Мезоторий
138Анализ продуктов распада
140Интерпретация периодического закона
143Исключения из периодического закона
144Предсказания на основе закона радиоактивных смещений
144Материнское вещество актиния: протактиний
145Изотопы свинца
149Глава седьмая.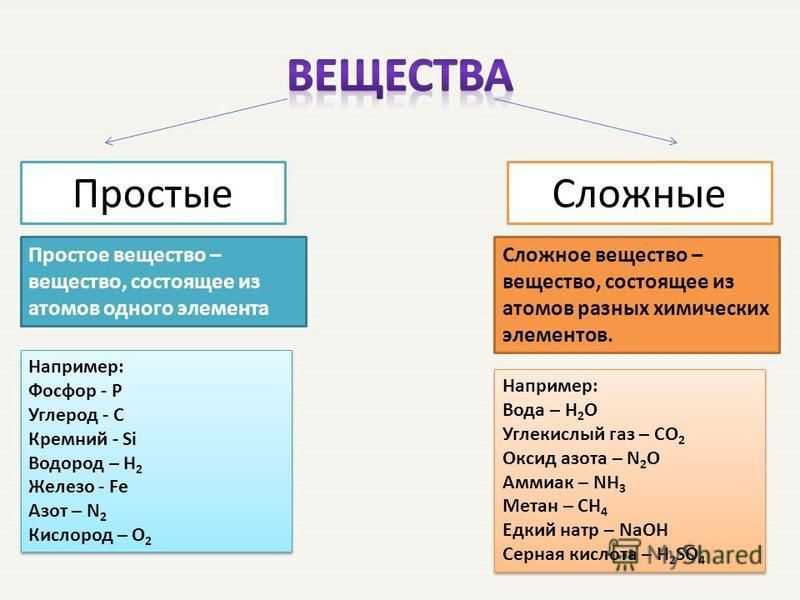 Квантовая теория и ядерная модель атома
Квантовая теория и ядерная модель атома
149[Введение]
150Квантовая теория
151Действие
153Атом действия
154Quanta и «кванты»
155Модель атома Томсона
156Открытие атомного ядра
158Атом Резерфорда — Бора
158Спектральные серии
159Теория оптических спектров Бора
160Соотношение между двумя частотами
161Простой вывод формулы спектральной серии
162Постоянная Ридберга
163Дилемма физики
164Глава восьмая. Квантовая теория и химия
164[Введение]
165Дифракция рентгеновского излучения
167Характеристическое рентгеновское излучение Барклы
168Закон Мозли
171Гафний и рений
172Общие аспекты теории атомного ядра
174Статическая модель атома или кубический атом
175Полярные соединения
176Неполярные соединения
177Молекулярные соединения и соединения Вернера
179Периодический закон как следствие атомизации электричества и действия
181Принцип неопределенностей
182Нулевая энергия
182Невероятен ли покой?
185Глава девятая. На пути к осуществлению первого искусственного превращения
На пути к осуществлению первого искусственного превращения
185Методы регистрации единичного распада
189Методы усиления
190Атомное ядро и астрономия
191Испускаемые протоны
192Расщепление ядер легких элементов альфа-частицами
194Электронвольт
195Исследования Астона в области изотопов
205Четные и нечетные элементы
205Возрождение гипотезы Праута
208Коэффициент Астона
211Первая искусственная трансмутация
212Расщепление ядра лития
212Выделение энергии из лития
214Глава десятая. Новые фундаментальные открытия и методы
214Чудесный год радиоактивности
215Электронная пара
215Расщепление фотона
216Нейтрон
218Новое ядро
219Тяжелый водород
220Полосатые спектры изотопов
221Свойства тяжелой воды
222Водород и энергия при абсолютном нуле
223Система записи ядерных реакций
224Искусственная радиоактивность
225Электротехника высокого напряжения
226Циклотрон
230Превращения, осуществленные на циклотроне
232Искусственное получение радиоэлементов
232Нейтрон в роли агента превращений
233Глава одиннадцатая.
233Всевозрастающая сложность
235Появление простоты
235Соотношение чисел нейтронов и протонов
236Область стабильности ядер
237Ядерная химия
237Космическое излучение
239Ливни или вспышки космического излучения
241Мезон
242Ядерное деление радиоэлементов
244Продукты деления и их энергия отдачи
245Испускание нейтронов
246Деление урана
247Актиноуран или уран-235
248Глава двенадцатая. Практическое использование превращений элементов
248Две цели
248Военная цель
249Мирная цель
250Замедлитель
250Урановый реактор
252Установки в Клинтоне и Ханфорде
252Величайшее достижение в истории человечества
253«Томная» и «атомная» энергия
254Условия «томной» детонации
255«Томная» бомба
256Разделение изотопов урана
257Электромагнитное разделение
258Трансураковые элементы
258Плутоний
260«Отравление» уранового реактора
261США имели всего три бомбы
261Периодический закон в новом освещении
263Нептуний
264Глава тринадцатая. Будущее атомной энергии
Будущее атомной энергии
264Предварительные итоги
265Социальная ответственность ученого
266Естественные источники урана
266Зачем впустую растрачивать уран?
267Интенсивность и количество в энергетике
268Нераскрытые возможности
270Новые виды излучений и мутации
271Правильное использование новых знаний
271Рабочий пример международной науки
272Наука и общество
273Полное уничтожение войны
274Наука, культура, философия и государство
276Трифонов Д. Н., Кривомазов А. Н.
Хронология важнейших открытий в учении о радиоактивности284Трифонов Д. Н., Кривомазов А. Н.
Список рекомендуемой литературы285Оглавление
288Концевая страница
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.
 biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации). Права Администрации Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей
или в соответствии с условиями, установленными такими правообладателями.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также индивидуальные предприниматели (далее — «Пользователи»).
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.
- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.

- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям (третьим лицам).
- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в
непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.

- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома» (www.biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт —
электронная
библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован
материал.

- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-, видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.
- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от
них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.

- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте.
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес info@biblioatom.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Для скачивания — Кафедра химии
- Главная
- Университет
- Для скачивания
- Кафедра химии
Лекция. Растворы неэлектролитов
Размер файла:
638.79 kB
Автор:
Апанович, З.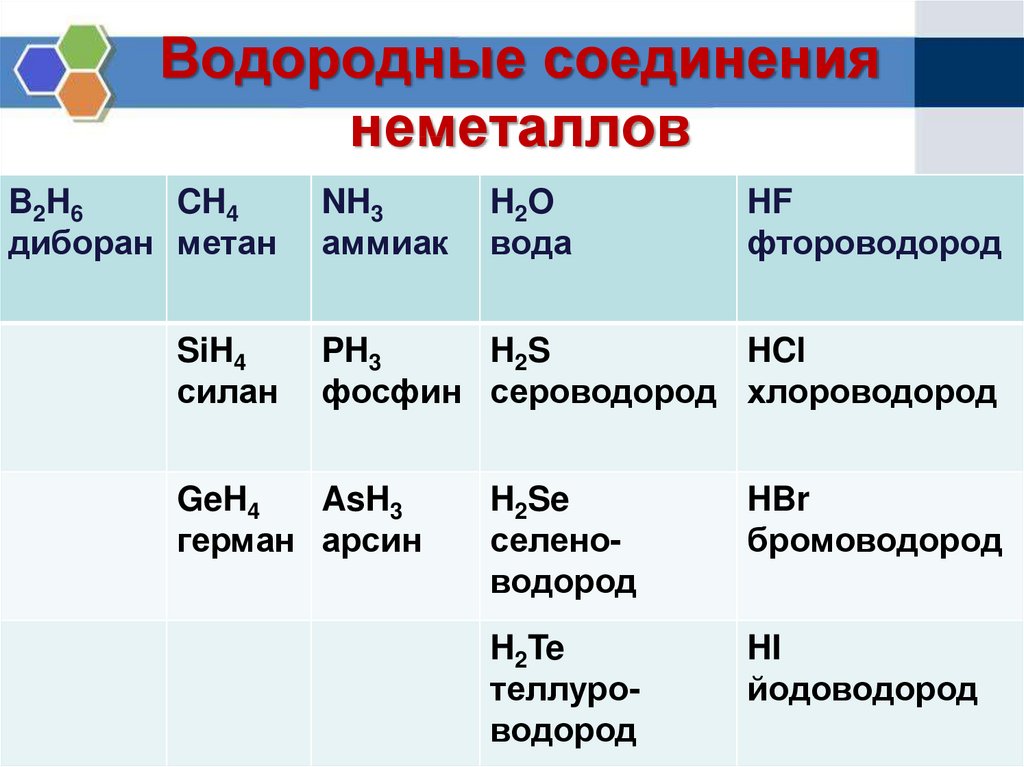 В.
В.
Дата:
26.12.2016 12:03
Растворы неэлектролитов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 33 с.
Учебно-методическое пособие включает лекцию по теме «Растворы неэлектролитов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Окислительно-восстановительные реакции
Размер файла:
609.98 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Окислительно – восстановительные реакции. Лекция по курсу «Общая химия » для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекцию по теме «Окислительно – восстановительные реакции» и предназначено для контролируемой самостоятельной работы студентов инженерно–технологического факультета.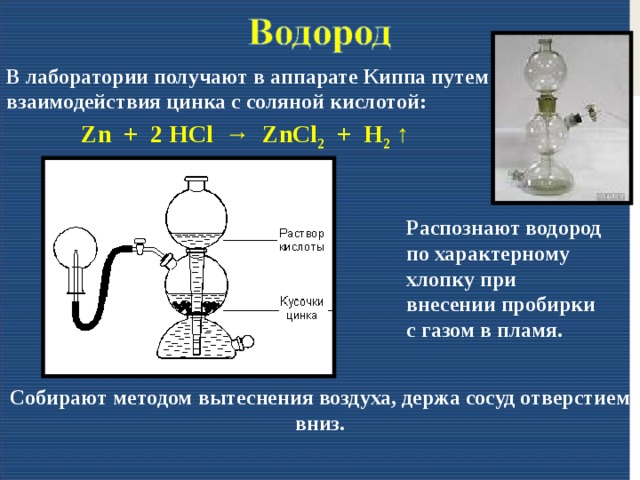 Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Комплексные соединения
Размер файла:
531.46 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Лекция «Комплексные соединения» по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 26 с.
Учебно-методическое пособие включает лекцию по теме «Комплексные соединения» курса «Общая химия». Комплексные соединения играют важную роль в природе и технике, прежде всего, это ферментативные и фотохимические процессы, перенос кислорода в биологических системах, тонкая технология редких металлов, каталитические реакции и т.д. Координационные свойства проявляются всеми элементами периодической системы.
Скачать
Лекция. Кинетика химических реакций. Химическое равновесие
Размер файла:
768.32 kB
Автор:
Апанович, З. В.
В.
Дата:
26.12.2016 12:03
Кинетика химических реакций. Химическое равновесие. Лекции по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 44 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Предэкзаменационные тесты по органической и биологической ХИМИИ
Размер файла:
1.30 MB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
26.12.2016 12:02
Предэкзаменационные тесты по органической и биоло-гической химии для студентов биотехнологического факультета / А.Ф. Макарчиков, И.К. Колос – Гродно: ГГАУ, 2016. – 205 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на биотехнологическом факультете, по предмету «Химия (органическая и биологическая)»
Скачать
Лекция. Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Электролиз. Коррозия металлов и методы защиты металлов от коррозии
Размер файла:
758.87 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Электролиз. Коррозия металлов и методы защиты металлов от коррозии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 31 с.
Учебно-методическое пособие включает лекции по отдельным темам курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование таких пособий, в которых рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Энергетика химических процессов.
Размер файла:
604.00 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Энергетика химических процессов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.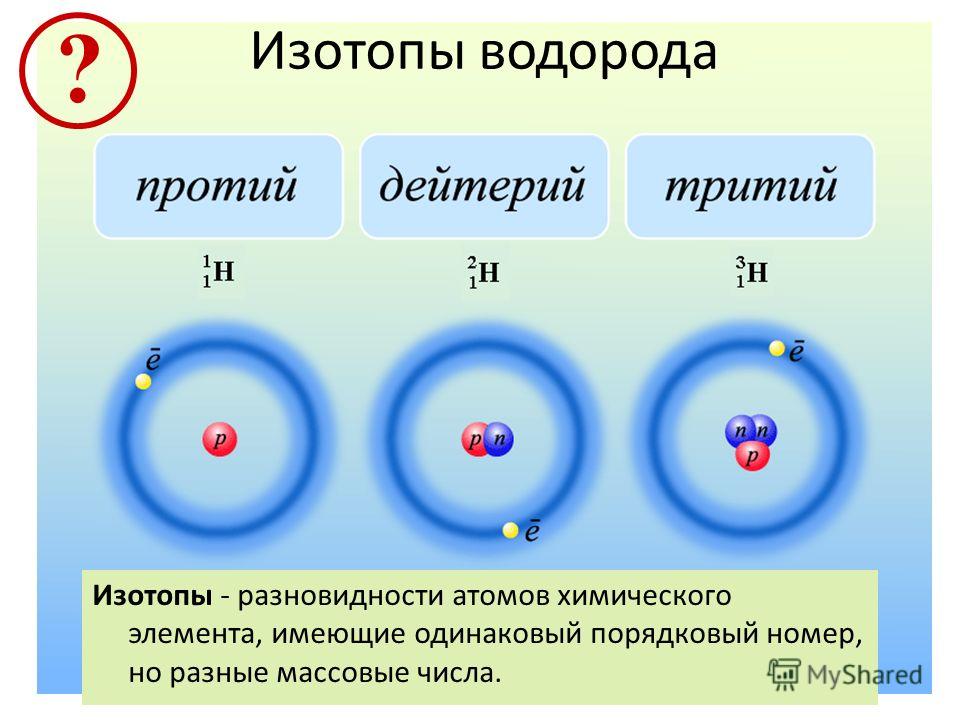 В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
В. Апанович. – Гродно : ГГАУ, 2016. – 25 с.
Учебно-методическое пособие включает лекцию по теме «Энергетика химических процессов» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование такого пособия, в котором рассмотрены важнейшие вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Строение атомов элементов
Размер файла:
789.90 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:02
Строение атомов элементов. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ , 2016. – 23 с.
Учебно-методическое пособие включает лекцию по теме «Строение атомов элементов» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование пособия, в котором рассмотрены важнейшие теоретические вопросы в доступной и сжатой форме, позволит студентам быстрее и эффективнее изучить материал.
Скачать
Лекция. Основные понятия и законы химии
Размер файла:
675.23 kB
Автор:
Апанович, З.В.
Дата:
26.12.2016 12:03
Основные понятия и законы химии. Лекция по курсу «Общая химия» для студентов инженерно-технологического факультета / З.В. Апанович. – Гродно : ГГАУ, 2016. – 30 с.
Учебно-методическое пособие включает лекцию по теме «Основные понятия и законы химии» курса «Общая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета. Использование студентами распечатки лекционной темы значительно сэкономит время для понимания материала, излагаемого лектором, и конспектирования.
Скачать
Предэкзаменационные тесты по химии
Размер файла:
813.02 kB
Автор:
Макарчиков А.Ф., Колос И.К.
Дата:
14.11.2016 11:47
Предэкзаменационные тесты по химии для студентов, обучающихся на агробиологических специальностях / А.Ф. Макарчиков, И. К. Колос – Гродно: ГГАУ, 2016. – 201 с.
К. Колос – Гродно: ГГАУ, 2016. – 201 с.
В пособии приведен перечень вопросов для проведения предэкзаменационного тестирования студентов, обучающихся на агробиологических специальностях, по предмету «Химия».
Скачать
Методическое пособие для лабораторных работ по аналитической химии
Размер файла:
544.41 kB
Автор:
Апанович З.В., Тараненко Т.В., Томашева Е.В., Кулеш И.В., Цветницкая Э.В.
Дата:
28.12.2015 12:22
В пособие излагается материал по аналитической химии в объеме соответствующих программ по специальностям: «Ветеринарная медицина», «Аграномия», «Биотехналогия». Содержатся методические указания по технике выполнения лабораторных работ по качественному и количественному анализу.
Скачать
Комментарии для работы с рабочими тетрадями по химии элементов
Размер файла:
655.75 kB
Дата:
28.12.2015 12:22
Комментарии для работы с рабочими тетрадями по химии элементов / З.В. Апанович, Ю.А. Лукашенко.
Учебно-методическое пособие включает лекции по отдельным темам курса «Неорганическая химия» и предназначено для контролируемой самостоятельной работы студентов инженерно – технологического факультета, для которых введен отдельный курс по химии элементов, а также может быть использовано студентами других факультетов.
Скачать
Практикум по физической химии
Размер файла:
1.03 MB
Дата:
01.04.2013 04:24
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
Практикум по физической химии: учеб.-мет. пособие / О. И. Валентюкевич.- Гродно: ГГАУ, 2008 – 88с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Коллоидная химия
Размер файла:
834.37 kB
Дата:
01. 04.2013 04:09
04.2013 04:09
Учебно-методическое пособие (для проведения лабораторных занятий) для студентов инженерно-технического факультета
К-60 Практикум по физической химии: учеб.-мет. пособие / И. В. Кулеш, О. И. Валентюкевич.- Гродно: ГГАУ, 2013 – 94с.
Данное пособие предназначено для студентов технологических специальностей аграрного университета. Целью данного пособия является оказание помощи в изучении теоретического материала, а также выработка навыков экспериментальной работы.
Скачать
Курс лекций по дисциплине «Неорганическая химия»
Размер файла:
1.33 MB
Дата:
28.12.2015 12:22
Лекции по курсу «Неорганическая химия »для студентов инженерно – технологического факультета / З.В. Апанович.
Скачать
Рабочая тетрадь и методические указания по неорганической химии
Размер файла:
701.32 kB
Дата:
28.12.2015 12:23
Рабочая тетрадь и методические указания по неорганической химии. Для студентов технологических специальностей / З. В. Апанович.
В. Апанович.
Скачать
Ионные равновесия и обменные реакции в растворах электролитов
Скачать
Лабораторные работы по химии элементов для студентов технологических специальностей
Скачать
Университет
Химия водорода (Z=1) — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 590
Водород — это бесцветный газ без запаха и вкуса, который является самым распространенным элементом в известной Вселенной. Это также самый легкий (с точки зрения атомной массы) и самый простой, имеющий только один протон и один электрон (и не имеет нейтронов в его наиболее распространенном изотопе). Это все вокруг нас. Это компонент воды (H 2 O), жиры, нефть, столовый сахар (C 6 H 12 O 6 ), аммиак (NH 3 ) и перекись водорода (H 2 O 2 9002) — штука необходимы для жизни, как мы ее знаем.
Это компонент воды (H 2 O), жиры, нефть, столовый сахар (C 6 H 12 O 6 ), аммиак (NH 3 ) и перекись водорода (H 2 O 2 9002) — штука необходимы для жизни, как мы ее знаем.
Факты о водороде
- Атомный номер: 1
- Атомный символ: H
- Атомный вес: 1,0079
- Электронная конфигурация: 1 с 1
- Степени окисления: 1, -1
- Атомный радиус: 78 пм
- Температура плавления: -259,34°C
- Точка кипения: -252,87°С
- Элементарная классификация: неметалл
- При комнатной температуре: двухатомный газ без цвета и запаха
История водорода
Водород в переводе с греческого означает «производитель воды» («гидро» = вода и «gennao» = делать). Впервые выделенный и идентифицированный как элемент Кавендишем в 1766 году, водород считался множеством различных веществ. Сам Кавендиш думал, что это «горючий воздух из металлов» из-за его образования при действии кислот на металлы. До этого Роберт Бойль и Парацельс оба использовали реакции железа и кислот для получения газообразного водорода, а Антуан Лавуазье дал водороду свое название, потому что он производил воду при воспламенении в воздухе. Другие думали, что это чистый флогистон из-за его воспламеняемости. Водород входит в десятку самых распространенных элементов на планете, но его очень мало в элементарной форме из-за его низкой плотности и реакционной способности. Большая часть земного водорода заключена в молекулах воды и органических соединениях, таких как углеводороды.
Сам Кавендиш думал, что это «горючий воздух из металлов» из-за его образования при действии кислот на металлы. До этого Роберт Бойль и Парацельс оба использовали реакции железа и кислот для получения газообразного водорода, а Антуан Лавуазье дал водороду свое название, потому что он производил воду при воспламенении в воздухе. Другие думали, что это чистый флогистон из-за его воспламеняемости. Водород входит в десятку самых распространенных элементов на планете, но его очень мало в элементарной форме из-за его низкой плотности и реакционной способности. Большая часть земного водорода заключена в молекулах воды и органических соединениях, таких как углеводороды.
Свойства водорода
Водород является неметаллом и находится выше группы в периодической таблице, поскольку имеет электронную конфигурацию ns 1 , как и щелочные металлы. Однако он сильно отличается от щелочных металлов, поскольку образует катионы (H + ) более неохотно, чем другие щелочные металлы. Энергия ионизации водорода составляет 1312 кДж/моль, тогда как литий (щелочной металл с самой высокой энергией ионизации) имеет энергию ионизации 520 кДж/моль.
Энергия ионизации водорода составляет 1312 кДж/моль, тогда как литий (щелочной металл с самой высокой энергией ионизации) имеет энергию ионизации 520 кДж/моль.
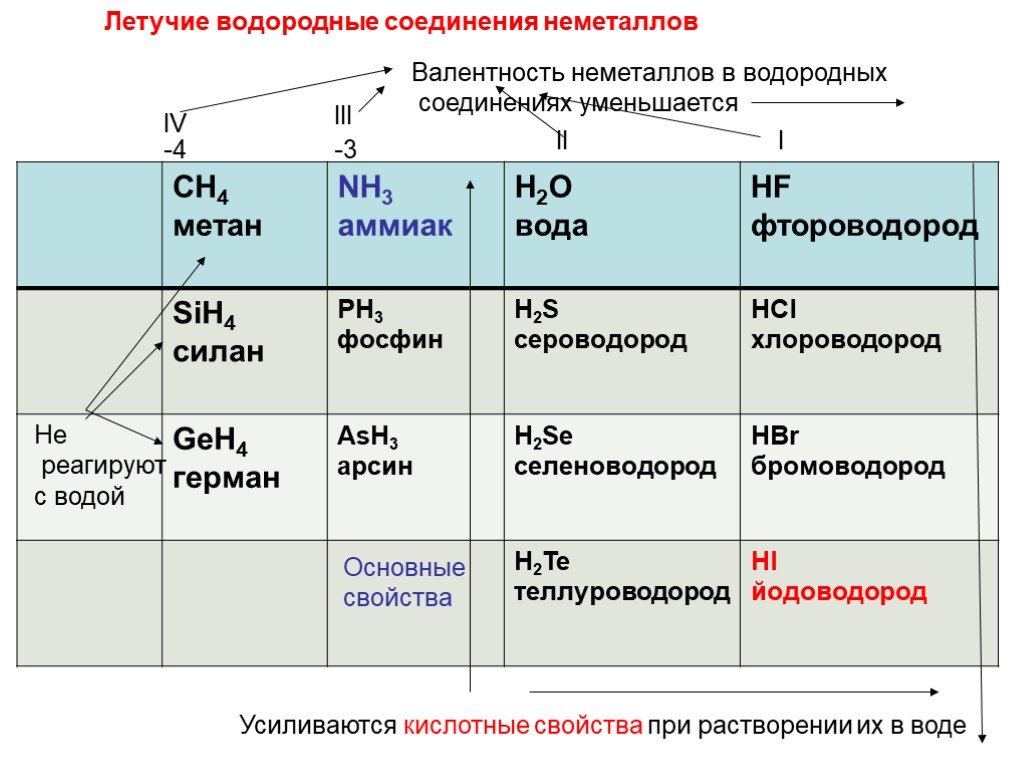
Поскольку водород является неметаллом и образует H — (гидрид-анионы), его иногда помещают выше галогенов в периодической таблице. Водород также образует H 2 диводородоподобные галогены. Однако водород сильно отличается от галогенов. Водород имеет гораздо меньшее сродство к электрону, чем галогены.
H 2 диводород или молекулярный водород неполярен с двумя электронами. Между молекулами H 2 действуют слабые силы притяжения, что приводит к низким температурам кипения и плавления. Однако Н 2 обладает очень сильными внутримолекулярными силами; Реакции H 2 обычно медленны при комнатной температуре из-за сильной связи H—H. H 2 легко активируется нагреванием, облучением или катализом. Газообразный активированный водород очень быстро и экзотермически реагирует со многими веществами.
Водород также обладает способностью образовывать ковалентные связи с большим количеством веществ. Поскольку он образует прочные связи O—H, он является хорошим восстановителем для оксидов металлов. Пример: CuO(s) + H 9-_{(g)}\]
Реакции водорода с активными металлами
Водород принимает e- от активного металла с образованием ионных гидридов, таких как LiH. Образуя ион с зарядом -1, водород ведет себя как галоген.
Металлы группы 1
\[2M_{(s)}+H_{2(g)} \rightarrow 2MH_{(s)}\]
где \(M\) представляет щелочные металлы группы 1
Примеры:
- \(2K_{(s)}+H_{2(g)} \rightarrow 2KH_{(s)}\)
- \(2K_{(s)}+Cl_{2(g)} \rightarrow 2KCl_{(s)}\)
Металлы группы 2
\[M_{(s)}+H_{2(g)} \rightarrow MH_{2(s)}\]
где \(M\) представляет щелочноземельные металлы группы 2
Пример:
- \(Ca_{(s)}+H_{2(g)} \rightarrow CaH_{2(s)}\)
- \(Ca_{(s)}+Cl_{2(g)} \rightarrow CaCl_{2(s)}\)
Реакции водорода с неметаллами
В отличие от металлов, образующих ионные связи с неметаллами, водород образует полярные ковалентные связи. Несмотря на то, что он электроположителен, как активные металлы, образующие ионные связи с неметаллами, водород гораздо менее электроположителен, чем активные металлы, и образует ковалентные связи.
Несмотря на то, что он электроположителен, как активные металлы, образующие ионные связи с неметаллами, водород гораздо менее электроположителен, чем активные металлы, и образует ковалентные связи.
Водород + галоген → галогенид водорода
\[H_{2(г)}+ Cl_{2(г)} \rightarrow HCl_{(г)}\]
Газообразный водород, реагирующий с кислородом с образованием воды и большого количество тепла: водород + кислород → вода
\[(H_{2(г)}+O_{2(г)} \rightarrow H_2O_{(г)}\]
Реакции с переходными металлами
Реакции водорода с переходными металлами (группы 3-12) образуют гидриды металлов.Фиксированного отношения атома водорода к металлу нет, поскольку атомы водорода заполняют пустоты между атомами металла в кристаллической структуре.
Использование и применение
Подавляющее большинство водорода, производимого в настоящее время в промышленности, производится либо путем обработки метанового газа паром, либо при производстве «водяного газа» в результате реакции угля с паром. Большая часть этого водорода используется в процессе Габера для производства аммиака.
Большая часть этого водорода используется в процессе Габера для производства аммиака.
Водород также используется для гидрогенизации растительных масел, превращения их в маргарин и шортенинг, а часть используется для жидкого ракетного топлива. Жидкий водород (в сочетании с жидким кислородом) является основным компонентом ракетного топлива (как уже упоминалось выше, сочетание водорода и кислорода дает огромное количество энергии). Поскольку водород является хорошим восстановителем, он используется для производства металлов, таких как железо, медь, никель и кобальт, из их руд.
Поскольку один кубический фут водорода может поднять около 0,07 фунта, водородные дирижабли или дирижабли стали очень распространены в начале 1900-х годов. Однако использование водорода для этой цели было в основном прекращено во время Второй мировой войны после взрыва The Hindenburg. ; это побудило к более широкому использованию инертного гелия, а не легковоспламеняющегося водорода для авиаперелетов.
Видео Взрыв Гинденбург . (Видео с Youtube)
В последнее время из-за опасений, что ископаемое топливо иссякнет, проводятся обширные исследования водорода как источника энергии. Из-за их умеренно высокой плотности энергии жидкий водород и сжатый газообразный водород являются возможными видами топлива для Будущее. Огромным преимуществом их использования является то, что при их сгорании образуется только вода (она горит «чисто»). Однако это очень дорого и экономически нецелесообразно с современными технологиями.
При сгорании топлива вырабатывается энергия, которая может быть преобразована в электрическую энергию, когда энергия пара приводит в действие турбину, приводящую в движение генератор. Однако это не очень эффективно, поскольку большое количество энергии теряется в виде тепла. Производство электроэнергии с использованием гальванического элемента может дать больше электроэнергии (форма полезной энергии).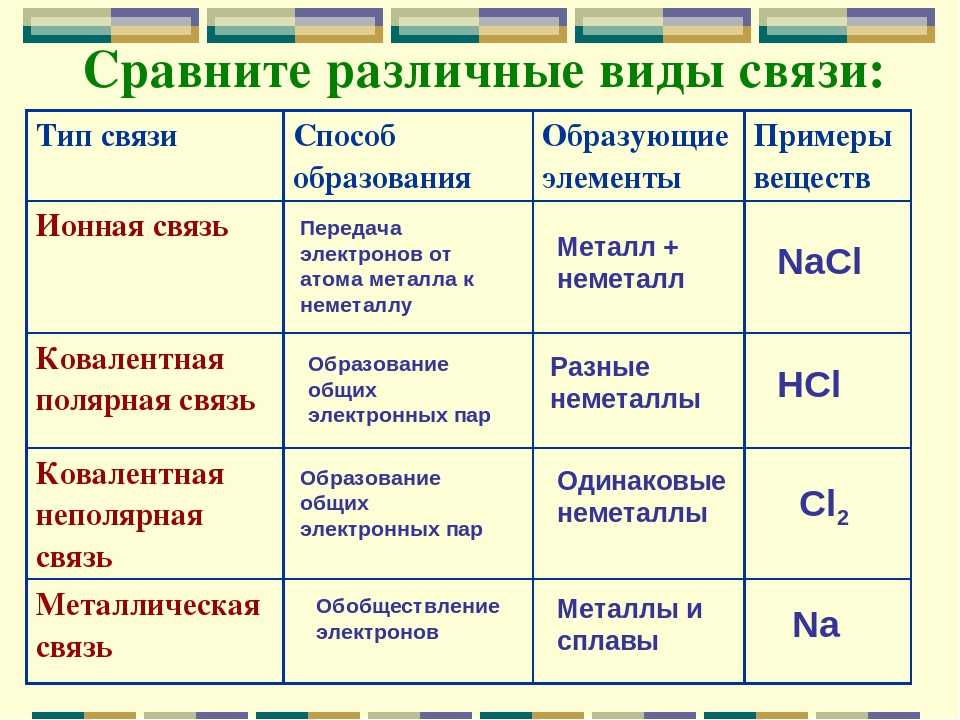 Гальванические элементы, которые преобразуют химическую энергию в топливо (например, H 2 и CH 4 ), называются топливными элементами. Они не являются автономными и поэтому не считаются батареями. Водородный элемент представляет собой тип топливного элемента, в котором используется реакция между H 2 (г) с O 2 (г) для образования жидкой воды; эта ячейка в два раза эффективнее лучшего двигателя внутреннего сгорания. В ячейке (в основных условиях) кислород восстанавливается на катоде, а водород окисляется на аноде.
Гальванические элементы, которые преобразуют химическую энергию в топливо (например, H 2 и CH 4 ), называются топливными элементами. Они не являются автономными и поэтому не считаются батареями. Водородный элемент представляет собой тип топливного элемента, в котором используется реакция между H 2 (г) с O 2 (г) для образования жидкой воды; эта ячейка в два раза эффективнее лучшего двигателя внутреннего сгорания. В ячейке (в основных условиях) кислород восстанавливается на катоде, а водород окисляется на аноде.
Восстановление: O 2 (г)+2H 2 O(ж)+4e — → 4OH — (водн.)
Окисление: H 2 90 49 OH (г) (г) водн.) → 2H 2 O(ж) + 2e-
Всего: 2H 2 (г) + O 2 (g) → 2H 2 O(l)
E°cell= Reduction- Oxidation= E° O 2 /OH — — E° h3O /h3 = 0,401В – (-0,828В) = +1,23
Однако эта технология далека от использования в быту из-за ее большой стоимости.
Изображение водородного топливного элемента. (Изображение сделал Ридхи Сачдев)
Природные и другие источники
Природный водород
Водород является топливом для реакций Солнца и других звезд (реакции синтеза). Водород — самый легкий и самый распространенный элемент во Вселенной. Около 70-75% Вселенной состоит из водорода по массе. Все звезды по существу представляют собой большие массы газообразного водорода, которые производят огромное количество энергии за счет слияния атомов водорода в их плотных ядрах. В меньших звездах атомы водорода сталкивались и сливались, образуя гелий и другие легкие элементы, такие как азот и углерод (необходимые для жизни). В более крупных звездах в результате синтеза образуются более легкие и тяжелые элементы, такие как кальций, кислород и кремний.
На Земле водород в основном встречается в ассоциации с кислородом; его наиболее распространенной формой является вода (H 2 O). Водорода на Земле всего 0,9% по массе и 15% по объему, несмотря на то, что вода покрывает около 70% планеты. Поскольку водород очень легкий, в атмосфере его содержится всего 0,5 ppm (частей на миллион), что хорошо, учитывая, что он ЧРЕЗВЫЧАЙНО легко воспламеняется.
Водорода на Земле всего 0,9% по массе и 15% по объему, несмотря на то, что вода покрывает около 70% планеты. Поскольку водород очень легкий, в атмосфере его содержится всего 0,5 ppm (частей на миллион), что хорошо, учитывая, что он ЧРЕЗВЫЧАЙНО легко воспламеняется.
Другие источники водорода
Газообразный водород можно получить путем взаимодействия разбавленной сильной кислоты, такой как соляная кислота, с активным металлом. Металл превращается в оксиды, а H 9{2+}_{(aq)} + H_{2(g)}\]
Самая чистая форма H 2 (g) может быть получена в результате электролиза H 2 O(l), наиболее распространенного водородное соединение на этом заводе. Этот метод также не является коммерчески выгодным, поскольку требует значительного количества энергии (\(\Delta H = 572 \;kJ\)):
\[2H_2O_{(l)} \rightarrow 2H_{2(g)} + O_{2(g)} \]
\(H _2 O\) — самая распространенная форма водорода на планете, поэтому кажется логичным попытаться извлечь водород из воды без электролиза воды. Для этого мы должны восстановить водород со степенью окисления +1 до водорода со степенью окисления 0 (в газообразном водороде). Обычно используются три восстановителя: углерод (в коксе или угле), окись углерода и метан. Они реагируют с водяным паром в форме H 2 (г):
Для этого мы должны восстановить водород со степенью окисления +1 до водорода со степенью окисления 0 (в газообразном водороде). Обычно используются три восстановителя: углерод (в коксе или угле), окись углерода и метан. Они реагируют с водяным паром в форме H 2 (г):
\[C_{(s)} + 2H_2O_{(g)} \rightarrow CO(g) + H_{2(g)}\]
\[CO_{(g)} + 2H_2O_{(г)} \rightarrow CO2 + H_{2(г)}\]
Риформинг метана:
\[CH_{4(г)} + H_2O_{(г)} \rightarrow CO(г) + 3H_{2(g)}\]
Эти три метода являются наиболее промышленно осуществимыми (рентабельными) способами получения H 2 (g).
Изотопы
Есть два важных изотопа водорода. Дейтерий ( 2 H ) имеет содержание 0,015% земного водорода, а ядро изотопа содержит один нейтрон.
Рисунок: Три изотопа водорода (изображение, сделанное Ридхи Сачдевом)- Протий ( 1 H) — наиболее распространенный изотоп, состоящий на 99,98% из встречающегося в природе водорода.
 Это ядро, содержащее один протон.
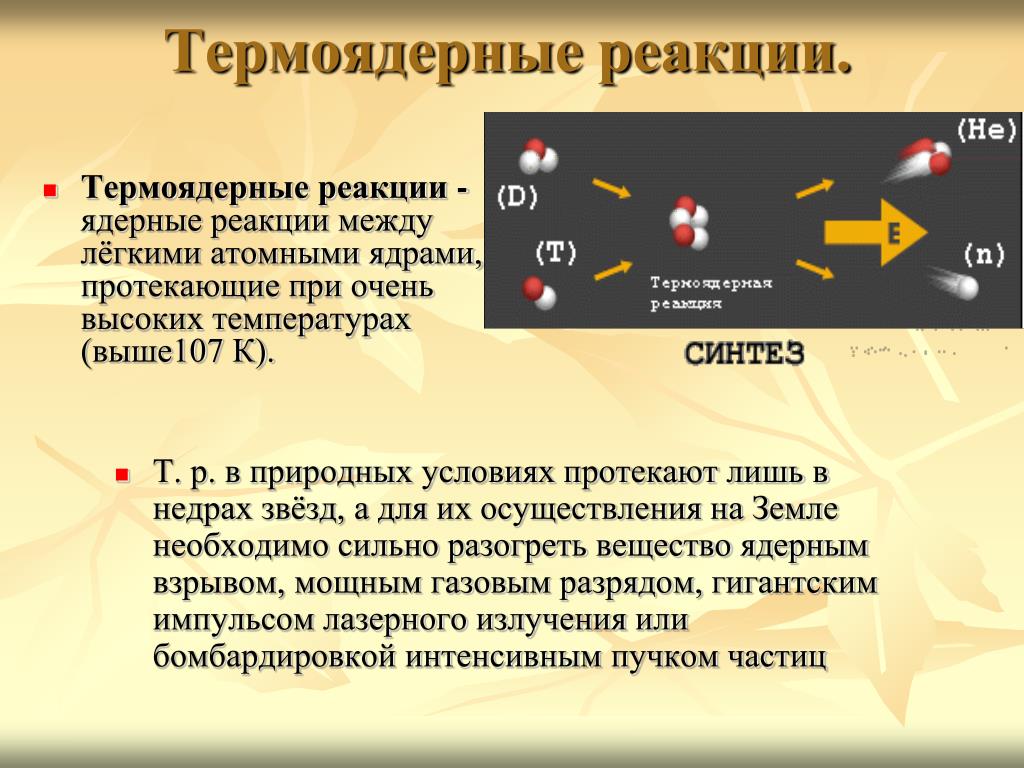
Это ядро, содержащее один протон. - Дейтерий ( 2 H ) — еще один изотоп, содержащий протон и нейтрон, состоящий только из 0,0156% встречающегося в природе водорода. Обычно обозначаемый символом D и иногда называемый тяжелым водородом, дейтерий выделяют фракционной перегонкой жидкого водорода, но его также можно получить длительным электролизом обычной воды. Приблизительно 100 000 галлонов воды производят один галлон D 9.0024 2 О, «тяжелая вода». Этот особый вид воды имеет более высокую плотность, температуру плавления и температуру кипения, чем обычная вода, и используется в качестве замедлителя в некоторых энергетических реакторах деления. Дейтериевое топливо используется в экспериментальных термоядерных реакторах. Замена протия дейтерием имеет важное значение для изучения механизмов реакции с помощью кинетического изотопного эффекта.
- Тритий ( 3 H) содержит в своем ядре два нейтрона и является радиоактивным с периодом полураспада 12,3 года, непрерывно образующимся в верхних слоях атмосферы за счет космических лучей.
 Его также можно изготовить в лаборатории из лития-6 в ядерном реакторе. Тритий также используется в водородных бомбах. Он встречается очень редко (примерно 1 из каждых 1018 атомов) и образуется в окружающей среде в результате бомбардировки космическими лучами. Большая часть трития производится путем бомбардировки Li нейтронами. Тритий используется в термоядерном оружии и экспериментальных термоядерных реакторах.
Его также можно изготовить в лаборатории из лития-6 в ядерном реакторе. Тритий также используется в водородных бомбах. Он встречается очень редко (примерно 1 из каждых 1018 атомов) и образуется в окружающей среде в результате бомбардировки космическими лучами. Большая часть трития производится путем бомбардировки Li нейтронами. Тритий используется в термоядерном оружии и экспериментальных термоядерных реакторах.
Список литературы
- Шульц М., Келли М., Парицкий Л., Вагнер Дж. Тематический курс: Водород как топливо будущего . Journal of Chemical Education 2009 86 (9), 105.
- Ригден, Джон. Водород: основной элемент . Президент и члены Гарвардского колледжа. 2003.
- Бэнкс, Олтон. Водород . Журнал химического образования 1989 66 (10), 801.
- Петруччи, Ральф Х.
 Общая химия . 9-е изд. Река Аппер-Сэдл: Прентис-холл, 2007 г. Печать .
Общая химия . 9-е изд. Река Аппер-Сэдл: Прентис-холл, 2007 г. Печать . - Садава, Хеллер, Орианс, Пурвес, Хиллис. Жизнь Биология . 8-е изд. Сандерленд, Массачусетс: WH Фриман, 2008.
- Dinga, G. Водород: лучший носитель топлива и энергии. Журнал химического образования 1988 65 (8), 688.
Внешние ссылки
- http://www.webelements.com/hydrogen/
- http://periodic.lanl.gov/elements/1.html
- http://education.jlab.org/itselemental/ele002.html
Задачи
- Напишите реакцию Na(s) с H 2 (г).
- Как называется радиоактивный изотоп водорода?
- Какие свойства щелочных металлов проявляет водород?
- Какие характеристики галогенов проявляет водород?
- Чем отличается электроотрицательность водорода от галогенов?
- Какова электронная конфигурация нейтрального атома водорода.

Ответы
- 2Na(s) + H 2 (g)→ 2NaH(s)
- Тритий
- Водород помещен выше группы в периодической таблице, потому что он имеет ns 1 Электронная конфигурация аналогична щелочным металлам. Однако он сильно отличается от щелочных металлов, поскольку образует катионы (H + ) более неохотно, чем другие щелочные металлы. Энергия ионизации водорода составляет 1312 кДж/моль, тогда как литий (щелочной металл с самой высокой энергией ионизации) имеет энергию ионизации 520 кДж/моль.
- Поскольку водород является неметаллом и образует H — (анионы гидрида), его иногда помещают выше галогенов в периодической таблице. Водород также образует H 2 диводородоподобные галогены. Однако водород сильно отличается от галогенов. Водород имеет гораздо меньшее сродство к электрону, чем галогены.
- Водород менее электроотрицателен, чем галогены.
- 1с 1
Авторы и ссылки
- Ридхи Сачдев (Калифорнийский университет в Дэвисе)
Стивен Р. Марсден
Марсден
Chemistry of Hydrogen (Z=1) распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- Кавендиш
- сжигание
- элемент
- газ
- гидро
- Водород
- гидрирование
- Встречается в природе
Водород – к какой химической группе он относится? – David Game College
Водород – самый распространенный элемент во Вселенной и самый простой – его атом состоит только из протона и вращающегося по орбите электрона.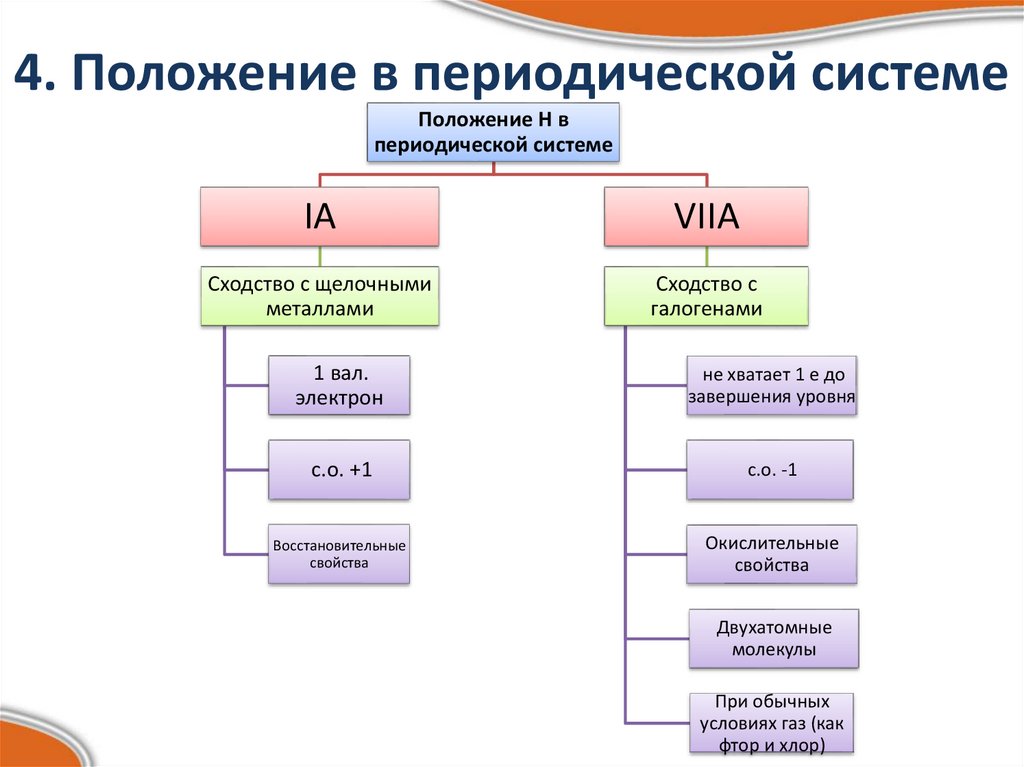 Без водорода нас бы здесь не было; все органические соединения, входящие в состав живых существ, содержат водород, а также он входит в состав воды, необходимой для всей известной жизни.
Без водорода нас бы здесь не было; все органические соединения, входящие в состав живых существ, содержат водород, а также он входит в состав воды, необходимой для всей известной жизни.
Наше Солнце, как и большинство других звезд, высвобождает энергию, превращая водород в гелий в результате ядерного синтеза, без которого не было бы энергии для поддержания жизни на Земле.
Таким образом, водород, возможно, является самым важным элементом для жизни, но можем ли мы поместить его в группу периодической таблицы?
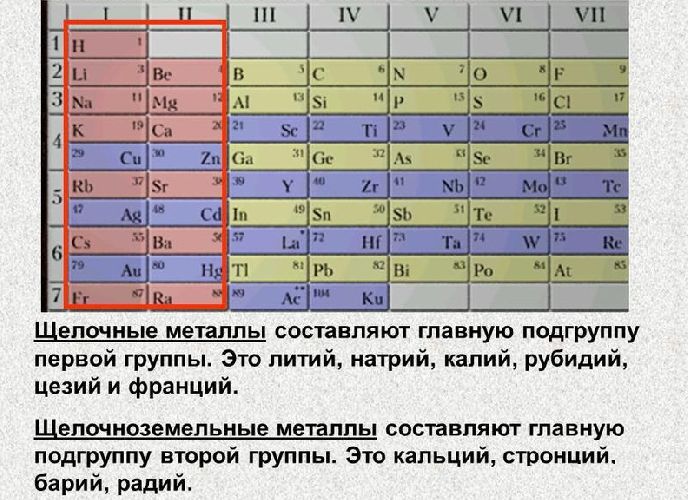
Некоторые предыдущие попытки классифицировать водород как группу 1 (щелочной металл) или как группу 17 (галоген), но ни одна из них не является удовлетворительной.
Водород как щелочной металл?
Единственное, что общего между водородом и щелочными металлами, это наличие одного электрона на внешней оболочке и валентность (комбинационная способность), равная единице. В отличие от элементов первой группы водород явно не металл (это газ при комнатной температуре) и плохой проводник тепла и электричества.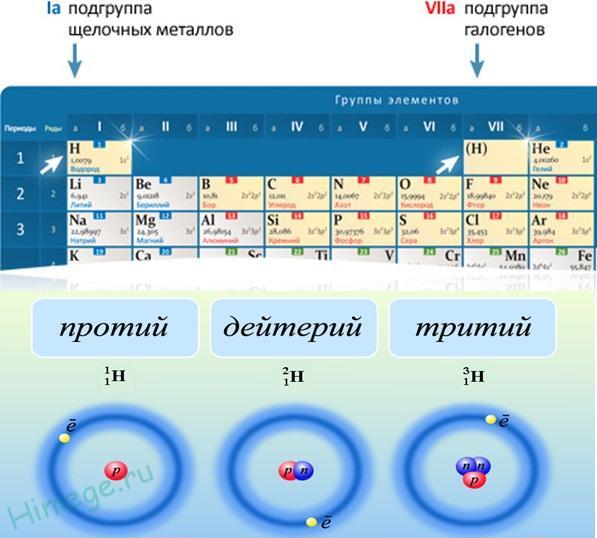 Он с трудом образует катионы Н+ и образует ковалентные связи в большинстве соединений, тогда как металлы 1 группы легко образуют катионы и образуют только ионные связи. Кроме того, щелочные металлы образуют основные оксиды, в то время как оксид водорода (вода) является амфотерным (как кислотным, так и основным).
Он с трудом образует катионы Н+ и образует ковалентные связи в большинстве соединений, тогда как металлы 1 группы легко образуют катионы и образуют только ионные связи. Кроме того, щелочные металлы образуют основные оксиды, в то время как оксид водорода (вода) является амфотерным (как кислотным, так и основным).
Водород как галоген?
Водород, как и галогены, имеет один электрон, которому не хватает полной внешней оболочки, и может образовывать ионы H-, такие как Cl-, и поэтому образует ионные соединения с химически активными металлами – NaH, по структуре близкие к NaCl. Водород также существует в виде двухатомного газа, такого как фтор и хлор. Однако на этом сходство заканчивается – водород является восстановителем, а галогены – окислителями, водород энергично реагирует с кислородом, но не с большинством металлов, а с галогенами все наоборот. Кроме того, оксид водорода (вода) является амфотерным, а оксиды галогенов — только кислыми.
Итак, водород не является ни щелочным металлом, ни галогеном.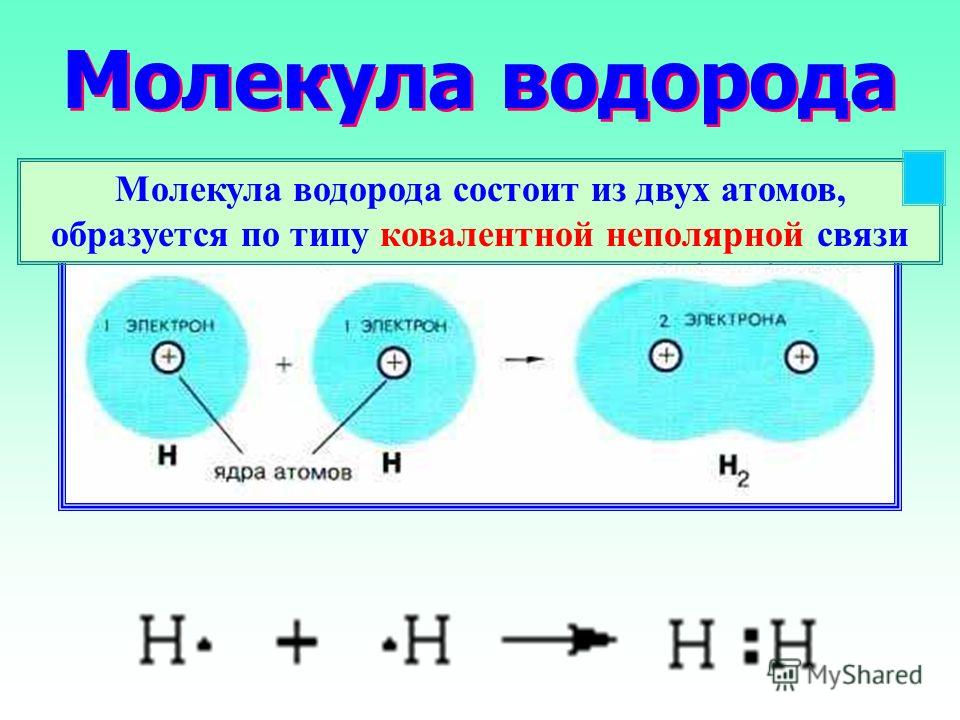 Принадлежит ли он к какой-либо другой группе?
Принадлежит ли он к какой-либо другой группе?
Лучший способ подойти к этому вопросу, как и к любому научному исследованию, — это собрать данные и изучить их. Данные о физических и химических свойствах элементов имеются в большинстве хороших учебников по химии. Большинство точек плавления и кипения были известны в течение многих лет (с 19 века или ранее), а другие характеристики, такие как энергия ионизации, сродство к электрону и электроотрицательность, были установлены в течение 20 века. В качестве упражнения, почему бы не изучить эти и любые другие данные для себя и попытаться привести аргументы в пользу помещения или не включения водорода в определенную группу периодической таблицы.
Тот, кто представит наиболее аргументированное дело, будет опубликован на веб-сайте David Game.
Отправьте записи ниже или по электронной почте [email protected].
Удачи!
Нравится:
Нравится Загрузка…
Tagged Наука уровня A, Колледж Дэвида Гейма, Наука GCSE, Водород, Конкурс научных писем Добро пожаловать в Дэвид Гейм Колледж
«Колледж Дэвида Гейма был основан в 1974 году и постоянно обеспечивает лучшее качество обучения для обеспечения успеха.

 biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок
взаимодействия с Администрацией Сайта.
 Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на
конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.


 ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
ru направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем. В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
 Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
Администрация Сайта обязуется
уведомить
заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес,
указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация
Сайта
вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все
возможные
меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
 Это ядро, содержащее один протон.
Это ядро, содержащее один протон. Его также можно изготовить в лаборатории из лития-6 в ядерном реакторе. Тритий также используется в водородных бомбах. Он встречается очень редко (примерно 1 из каждых 1018 атомов) и образуется в окружающей среде в результате бомбардировки космическими лучами. Большая часть трития производится путем бомбардировки Li нейтронами. Тритий используется в термоядерном оружии и экспериментальных термоядерных реакторах.
Его также можно изготовить в лаборатории из лития-6 в ядерном реакторе. Тритий также используется в водородных бомбах. Он встречается очень редко (примерно 1 из каждых 1018 атомов) и образуется в окружающей среде в результате бомбардировки космическими лучами. Большая часть трития производится путем бомбардировки Li нейтронами. Тритий используется в термоядерном оружии и экспериментальных термоядерных реакторах. Общая химия . 9-е изд. Река Аппер-Сэдл: Прентис-холл, 2007 г. Печать
Общая химия . 9-е изд. Река Аппер-Сэдл: Прентис-холл, 2007 г. Печать
Leave A Comment