Урок 4. Химические элементы в живых организмах
Содержание
Химические элементы в живых организмах образуют два класса соединений: органические и неорганические, а также находятся в свободном состоянии — в виде ионов. Все 94 элемента естественного происхождения имеют разное число протонов, расположение и количество электронов. Когда в XIX в. Дмитрий Менделеев выстроил их в таблицу согласно номерам, он открыл одну из величайших закономерностей естествознания: элементы демонстрируют химические свойства, которые по повторяемости можно объединить в 8 групп. Эта закономерная картина дала таблице своё название: Периодическая таблица химических элементов.
Периодическая таблица отображает химические элементы согласно атомному номеру и их свойству
Периодичность элементов, найденная Менделеевым, основана на взаимодействии электронов разных атомов на внешнем энергетическом уровне. Эти электроны называются валентными, и их контакты являются основой химических реакций. Для большинства атомов, важных для жизни, внешний энергетический уровень может содержать не более 8 электронов. Химическое поведение элемента зависит от того, сколько из его восьми позиций заполнено.
Для большинства атомов, важных для жизни, внешний энергетический уровень может содержать не более 8 электронов. Химическое поведение элемента зависит от того, сколько из его восьми позиций заполнено.
Элементы, обладающие всеми восьмью электронами внешнего энергетического уровня (у гелия 2) являются инертными, т. е. нереактивными. К ним относятся: гелий (He), неон (Ne), аргон (Ar) и другие благородные газы. Напротив, элементы с семью электронами внешнего энергетического уровня, такие как фтор (F), хлор (Cl) и бром (Br) реактивны. Как правило, они получают дополнительные электроны, необходимые для заполнения энергетического уровня.
Другие элементы с одним электроном в их внешнем энергетическом уровне: литий (Li), натрий (Na) и калий (K) имеют тенденцию к потере одного своего электрона.
Строение атома литияАвтор: Ahazard.sciencewriter, CC BY-SA 4.0
Таким образом, Периодическая таблица Менделеева демонстрирует правило октета, или правило восьми (лат. Octo – «восемь»): атомы стремятся полностью восстановить свои внешние энергетические уровни, дополнить количество электронов на них до 8.
Химические элементы в составе живых организмов
Отгадайте, о составе какого объекта идёт речь?
- 43 кг кислорода,
- 18 кг углерода,
- 7 кг водорода,
- 1,8 кг азота,
- 0,780 кг фосфора,
- 0,0042 кг железа
- и ещё около 20 химических элементов.
Это состав человека среднего размера и веса. В отличие от неживой природы в живых существах химические элементы организованы в клетки.
Химический состав:1 — земной коры,
2 — живых организмов
В земной коре преобладают кислород, кремний, алюминий и железо. В основе живых организмов находятся 4 элемента: кислород, углерод, водород, азот. Все элементы кроме кислорода, преобладающие в живых организмах, составляют незначительную долю массы земной коры.
Основные химические элементы в живых организмах — это:
- углерод – C,
- водород – H,
- кислород – O,
- азот – N,
- фосфор – P,
- сера – S,
- натрий – Na,
- калий – K,
- кальций – Ca,
- железо – Fe,
- хлор – Cl.

Их доля в живых организмах может составлять 0,01% и выше. Все они имеют атомные номера меньше 21, так как их атомная масса низка. Первые 4 элемента: углерод, водород, кислород и азот составляют 96,3% массы любого организма.
| Таб. 1. Химические элементы в живых организмах | |||
| Органогенные (биоэлементы), или макронутриенты
| Макроэлементы | Микроэлементы (от 0,001 % до 0,000001 % массы тела) | |
| Кислород — 65 %; Углерод — 18 %; Водород — 10 %; Азот — 3 %. | Кальций (Са) – 0,04-2,00 Фосфор (Р) – 0,2-1,0 Калий (К) – 0,15-0,4 Сера (S) – 0,15-0,2 Хлор (Cl) – 0,05-0,1 Натрий (Na) – 0,02-0,Ц03 Магний (Mg) – 0,02-0,03 Железо (Fe) – 0,01
| Кремний (Ci) – 0,001(для растений – микроэлемент) Цинк (Zn) – 0,0003 Медь (Cu) – 0,0002 Фтор (F) – 0,0001 Йод (I) – 0,0001 Марганец (Mn) – менее 0,0001 Кобальт (Co) – менее 0,0001 Молибден (Мо) – менее 0,0001 | Золото Серебро Ртуть Селен Мышьяк Платина Цезий Бериллий Радий Уран
|
Большинство молекул (кроме воды), из которых состоит наше тело, представляют собой соединения углерода, называемые органическими веществами.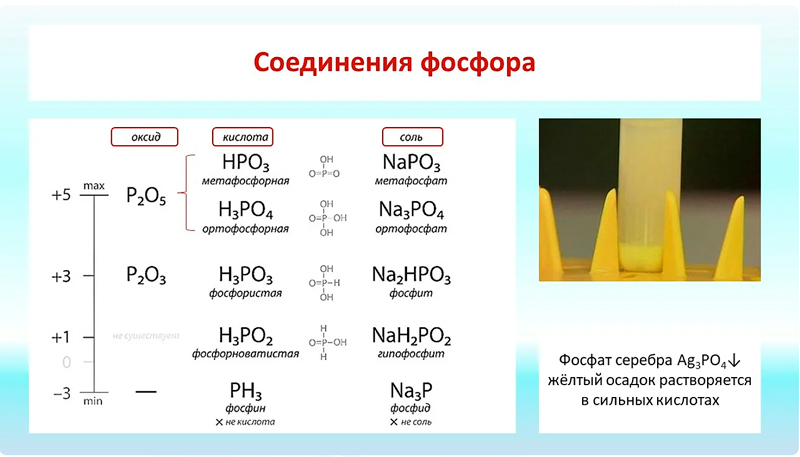 Органические вещества в основном и состоят из этих первых четырёх макроэлементов, чем и объясняется их распространённость в живых системах.
Органические вещества в основном и состоят из этих первых четырёх макроэлементов, чем и объясняется их распространённость в живых системах.
Некоторые микроэлементы, такие как цинк (Zn) и йод (I), хотя и присутствуют в крошечных количествах, играют важнейшую роль в процессах жизнедеятельности. Дефицит йода, например, может привести к увеличению щитовидной железы, образованию так называемого зоба.
Таб.2. Роль химических элементов в клетке
| Название химического элемента | Описание роли элемента в клетке | |
| 1 | Кислород (О) | Входит в состав органических молекул и воды, обеспечивает реакцию окисления, в процессе которой выделяется нужная организму энергия |
| 2 | Углерод (С) | Составляет основу всех органических соединений |
| 3 | Водород (Н) | Является составной частью всех органических веществ и молекул воды |
| 4 | Азот (N) | Входит в молекулы белков, нуклеиновых кислот, АТФ |
| 5 | Кальций (Са) | Является составной частью клеточной стенки растений. У животных входит в состав костной ткани, эмали зубов, участвует в свёртывании крови и сокращении мышц У животных входит в состав костной ткани, эмали зубов, участвует в свёртывании крови и сокращении мышц |
| 6 | Фосфор (Р) | Нужен для формирования зубной эмали и костной ткани. Входит в состав органических молекул, таких как ДНК, РНК, АТФ |
| 7 | Калий (К) | В качестве катиона участвует в создании биоэлектрического потенциала, регулируя работу клеточной мембраны. Влияет на работу сердца, участвует в процессе фотосинтеза |
| 8 | Сера (S) | Есть в составе некоторых белков и аминокислот |
| 9 | Хлор (Cl) | Является основным анионом организма животных. Находится в составе соляной кислоты желудка |
| 10 | Натрий (Na) | В качестве иона (катиона) участвует в создании биоэлектрического потенциала мембран клеток, в синтезе гормонов и регуляции сердечного ритма |
| 11 | Магний (Mg) | Входит в состав зубной эмали, костной ткани, некоторых ферментов и хлорофилла |
| 12 | Железо (Fe) | Необходимый компонент гемоглобина и миоглобина, входит в состав некоторых ферментов, участвует в процессах фотосинтеза и клеточного дыхания |
| 13 | Кремний (Si) | Компонент клеточной оболочки растений. Принимает участие в образовании коллагена, костной ткани Принимает участие в образовании коллагена, костной ткани |
| 14 | Цинк (Zn) | Участвует в синтезе гормонов у растений, находится в составе инсулина и некоторых ферментов |
| 15 | Медь (Cu) | Принимает участие в процессах синтеза гемоглобина, фотосинтеза, клеточного дыхания. Входит в состав дыхательных пигментов крови (гемоцианинов) и гемолимфы некоторых беспозвоночных |
| 16 | Фтор (F) | Необходим для формирования костной ткани и зубной эмали |
| 17 | Йод (I) | Необходимый компонент гормонов щитовидной железы |
| 18 | Марганец (Mn) | Делает более активными некоторые ферменты, входит в их состав, принимает участие в формировании костной ткани и в процессе фотосинтеза |
| 19 | Кобальт (Со) | Принимает участие в процессе образования клеток крови, находится в составе витамина B12 |
| 20 | Молибден (Mo) | Помогает клубеньковым бактериям связывать атмосферный азот |
Таб.
| № | Название | ||||
| Описание объекта | Изображение | Роль в клетке | |||
| 1 | Катионы | Положительно заряженные ионы. | |||
| 2 | Катионы калия и натрия | К+ Na+ | Основные катионы в организме животных. Они создают электрический потенциал клеточной мембраны, регулируют ритм сердечной деятельности. | ||
| 3 | Катионы кальция | Ca2+ | Принимает участие в свёртывании крови, отвечает за сократимость мышц, входит в состав клеточной стенки растений. | ||
| 4 | Катион магния | Mg2+ | Нужен растениям для осуществления фотосинтеза, так как он входит в состав хлорофилла. Является компонентом некоторых ферментов, есть в костной ткани и эмали зубов. Является компонентом некоторых ферментов, есть в костной ткани и эмали зубов. | ||
| 5 | Катионы водорода | Н+ | Отвечают за кислотность и основность внутренней среды организма (pH). | ||
| 6 | Анионы | Отрицательно заряженные ионы | |||
| 7 | Анионы хлора | Сl— | Хлор – основной анион клетки животных, принимает участие в создании электрического потенциала клеточной мембраны. Присутствует в составе соляной кислоты желудочного сока. | ||
| 8 | ОН— | Выполняет ту же роль что и катион водорода | |||
Как соединяются химические элементы в живых организмах?
 При изучении веществ в живых организмах нам будут встречаться следующие типы химических связей:
При изучении веществ в живых организмах нам будут встречаться следующие типы химических связей:
- ионные – когда притягиваются атомы с противоположными зарядами;
- ковалентные – характеризующиеся обобщением (перекрытием) в облако пары валентных электронов от разных атомов;
- водородные – связи между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
Ионные связи образуют кристаллы
В обычной поваренной соли – хлориде натрия (NaCl) – атомы удерживаются ионными связями, образуя решётку. Натрий имеет 11 электронов: 2 во внутреннем энергетическом уровне (К), 8 на уровне L и 1 на внешнем уровне М (валентность). Одиночный неспаренный валентный электрон имеет тенденцию к соединению с другим непарным электроном в другом атоме.
Стабильная конфигурация достигается за счёт потери электрона одним атомом и приобретения его другим. Натрий, теряя электрон, становится положительно заряженным ионом – катионом (Na+).
Натрий, теряя электрон, становится положительно заряженным ионом – катионом (Na+).
У атома хлора 17 электронов: 2 в уровне К, 8 в уровне L и 7 на М-уровне. Одна из орбиталей на внешнем энергетическом уровне содержит неспаренный электрон. Добавление электрона от другого атома превращает атом хлора в отрицательно заряженный хлорид-ион (Cl-). Так как противоположные заряды притягиваются, натрий и хлор остаются связанными нейтральным ионным соединением.
Кристаллическая решётка хлорида натрия. Голубой цвет = Na+ Зелёный цвет = Cl−Автор: H Padleckas
Если кристаллическую решётку соли поместить в воду, электрическое притяжение молекул воды разрушает силы, удерживающие ионные связи. Раствор соли в воде представляет собой смесь свободных катионов натрия (Na+) и анионов хлора (Cl-).
Так как живые системы всегда содержат воду, то ионы для них важнее кристаллов. Многие химические элементы в живых организмах находятся в виде ионов. Необходимые в клеточных системах ионы – это:
Необходимые в клеточных системах ионы – это:
- Ca2+, обеспечивающий передачу клеточных сигналов;
- K + и Na +, участвующие в проведении нервных импульсов.
Если совместить металлический натрий и газообразный хлор, реакция образования хлорида натрия будет экзотермической – быстрой и с выделением тепла.
Ковалентные связи соединяют химические элементы в живых организмах и создают стабильные молекулы
Ковалентные связи образуются, когда два атома делят одну или несколько пар валентных электронов. В качестве примера рассмотрим газообразный водород (H2). Каждый атом водорода имеет неспаренный электрон, а значит и незаполненный внешний уровень. По этой причине атом водорода нестабилен. Когда два атома водорода образуют тесную связь, оба валентных электрона притягиваются к их ядрам. Они как бы делят между собой электроны, в результате чего получается двухатомная молекула газообразного водорода.
Ковалентная связь, формирующая молекулу водорода h3 (справа), где два атома водорода перекрывают два электронаАвтор: Jacek FH, CC BY-SA 3.
 0
0Молекула, образованная двумя атомами водорода, стабильна по трём причинам:
- Она нейтральна, так как содержит 2 протона и 2 электрона.
- Правило октета в ней выполнено. Каждый общий электрон атомов вращается вокруг обоих ядер.
- У них нет неспаренных электронов.
Многие химические элементы в живых организмах образуют ковалентные связи.
Прочность ковалентных связей
Прочность ковалентных связей зависит от количества их общих электронов. В прошлом пункте мы рассматривали одинарную связь, двойная же связь объединяет 2 пары электронов, она более крепкая. Чтобы разорвать её, требуется больше энергии. Самые сильные ковалентные связи – тройные, такие которые объединяют два атома в молекулу газообразного азота (N2).
Ковалентные связи в химических формулах показывают линиями. Каждая линия между атомами представляет собой совместное использование одной пары электронов. Структурная формула газообразного водорода H–H, кислорода O=O, а их молекулярные формулы H2 и O2. Структурный характер формулы для N2 N ≡ N.
Структурный характер формулы для N2 N ≡ N.
Молекулы с несколькими ковалентными связями
Огромное количество биологических соединений состоит более чем из двух атомов. Атом, который требует двух, трёх или четырёх дополнительных электронов для заполнения внешнего уровня, может приобрести их путём обмена с двумя и более атомами.
Например, атом углерода (С) содержит шесть электронов, четыре из них находятся на его внешнем энергетическом уровне и не имеют пары. Чтобы удовлетворить правилу октета, атом углерода должен образовать 4 ковалентных связи. Так как эти 4 скрепления могут производиться разными путями, углерод образует множество молекул, например: СО2 (углекислый газ), СН4 (метан), С2Н5ОН (этанол).
Модель атома углеродаАвтор: Ahazard.sciencewriter, CC BY-SA 4.0
Полярные и неполярные ковалентные связи
Атомы отличаются количеством электронов, это свойство называется электроотрицательностью. В строке Периодической таблицы она увеличивается вправо и уменьшается книзу колонки, то есть элементы в правом верхнем углу имеют наиболее высокую электроотрицательность.
Для связи между двумя идентичными атомами, например между двумя атомами водорода или кислорода, электроны делятся поровну. Области их соединения называются неполярными. Таковы, например, молекулы Н2, О2.
При соединении значительно отличающихся по электроотрицательности атомов электроны не делятся поровну. Общие электроны, скорее всего, будут ближе к атому с большей отрицательностью, и хотя получившаяся молекула будет электрически нейтральной, заряд в ней распределится неравномерно. Неравномерность заряда приводит к областям частичной отрицательности (в районе наиболее отрицательного атома) и положительного заряда вблизи наименее отрицательного атома. Такие связи называются полярными ковалентными, а молекулы – полярными.
На схемах с изображением полярных молекул эти частичные заряды обозначаются греческой буквой Дельта (δ). Интересно, что хотя С и Н немного отличаются по электроотрицательности, связь между ними неполярна. Н2О – полярная молекула, электроны в ней концентрируются около ядра атома кислорода. О воде мы будем говорить более подробно в следующем уроке.
Н2О – полярная молекула, электроны в ней концентрируются около ядра атома кислорода. О воде мы будем говорить более подробно в следующем уроке.
Химические реакции взаимосвязаны и обратимы
Процессы образования и разрыва связей между атомами называются химическими реакциями. Все химические реакции обозначают перенос атома от одной молекулы в другое соединение, без каких-либо изменений в количестве или идентичности атомов. Для удобства оригинал молекул до начала реакции называют реагентом, а молекулы, образующиеся в результате реакции – продуктами. Например:
6H2O + 6CO2 → C6H12O6 + 6O2, где 6H2O + 6CO2 – реагент, а C6H12O6 + 6O2– продукт. Это упрощённая формула реакции фотосинтеза, где вода и углекислый газ, вступая в реакцию, образуют молекулы глюкозы и кислорода.
Все химические реакции происходят под влиянием трёх факторов.
- Температура. Нагрев реагентов увеличивает скорость реакции, потому что атомы при этом двигаются быстрее и сталкиваются друг с другом чаще. Но необходимо позаботиться о том, чтобы температура не поднялась слишком высоко и не разрушила молекулы.
- Концентрация реагентов и продуктов. Реакции проходят быстрее, когда из-за более частых столкновений доступно больше реагентов. Накопление продуктов замедляет реакцию, а в обратимой реакции может привести к возвращению к исходным веществам.
- Катализаторы. Катализатор – это вещество, которое увеличивает скорость реакции. Он не изменяет соотношения между реагентом и продуктом, а сокращает время их изменения. В живых системах почти во всех реакциях катализаторами служат белки энзимы (ферменты).
Многие реакции в природе обратимы. Это значит, что продукты могут снова стать реагентами, а реагенты – продуктами. Соответственно, мы можем записать предыдущую формулу в обратном порядке:
C6H12O6 + 6O2→ 6H2O + 6CO2
Эта упрощённый вариант окисления глюкозы, протекающего во время клеточного дыхания, когда глюкоза расщепляется на воду и углекислый газ в присутствии кислорода. Почти все живые организмы осуществляют разные формы окисления глюкозы.
Почти все живые организмы осуществляют разные формы окисления глюкозы.
Организмы – накопители химических элементов
Организмы, способные накапливать в своём теле один или несколько химических элементов называют концентраторами. Если элемент составляет 10% от веса их тела или от атомной массы, тогда они относятся к данной группе.
| Организмы-концентраторы | Химические элементы, которые они накапливают |
| Подсолнечник, картофель | Калий (К) |
| Бобовые, фораминиферы, моллюски, кораллы | Кальций (Са) |
| Злаки, хвощи, радиолярии, губки, диатомовые водоросли | Кремний (Si) |
| Плауны, чай | Алюминий (Al) |
| Растения засолённых почв (галофиты) | Натрий (Na) хлор (Cl) |
| Мхи, железобактерии | Железо (Fe) |
| Водоросли | Йод (I) |
| Пауки, раки | Медь (Сu) |
| Серобактерии | Сера (S) |
| Морепродукты | кальций (Ca) калий (K) натрий (Na) магний (Mg) медь (Сu) |
| Наземные растения | Марганец (Mn) |
| Наземные животные | Фосфор (P) азот (N) |
Химический состав клетки | Параграф 2.
 2
2«Биология. Общая биология. Базовый уровень. 10-11 классы». В.И. Сивоглазов (гдз)
Вопрос 1. В чем заключается сходство биологических систем и объектов неживой природы?
Основное сходство — это родство химического состава. Подавляющее большинство известных на сегодняшний день химических элементов обнаружено как в живых организмах, так и в неживой природе. Атомов, характерных только для живых систем, не существует. Однако содержание конкретных элементов в живой и неживой природе резко различается. Организмы (от бактерий до позвоночных) способны избирательно накапливать элементы, которые необходимы для жизнедеятельности.
Можно однако выделить совокупность свойств, которые присущи всем живым существам и отличают их от тел неживой природы. Для живых объектов характерна особая форма взаимодействия с окружающей средой — обмен веществ. Основу его составляют взаимосвязанные и сбалансированные процессы ассимиляции (анаболизм) и диссимиляции (катаболизм). Эти процессы направлены на обновление структур организма, а также на обеспечение различных сторон его жизнедеятельности необходимыми питательными веществами и энергией. Обязательным условием обмена веществ служит поступление извне определенных химических соединений, т. е. существование организма как открытой системы.
Эти процессы направлены на обновление структур организма, а также на обеспечение различных сторон его жизнедеятельности необходимыми питательными веществами и энергией. Обязательным условием обмена веществ служит поступление извне определенных химических соединений, т. е. существование организма как открытой системы.
Интересно, что неживые объекты могут проявлять отдельные свойства, более характерные для живого. Так, кристаллы минералов способны к росту и обмену веществ с окружающей средой, а фосфор может «запасать» энергию света. Но всей совокупностью черт, присущих живому организму, не обладает ни одна неорганическая система.
Вопрос 2. Перечислите биоэлементы и объясните, каково их значение в образовании живой материи.
К биоэлементам (органогенам) относят кислород, углерод, водород, азот, фосфор и серу. Они составляют основу белков, липидов, углеводов, нуклеиновых кислот и других органических веществ. Для всех органических молекул особое значение имеют атомы углерода, образующие каркас. К этому каркасу присоединяются разнообразные химические группы, образованные другими биоэлементами. В зависимости от состава и расположения таких групп органические молекулы приобретают индивидуальные свойства и функции. Например, аминокислоты в большом количестве содержат азот, а нуклеиновые кислоты — фосфор.
К этому каркасу присоединяются разнообразные химические группы, образованные другими биоэлементами. В зависимости от состава и расположения таких групп органические молекулы приобретают индивидуальные свойства и функции. Например, аминокислоты в большом количестве содержат азот, а нуклеиновые кислоты — фосфор.
В клетках некоторых организмов обнаружено повышенное содержание отдельных химических элементов. Например, бактерии способны накапливать марганец, морские водоросли — йод, ряска -радий, моллюски и ракообразные — медь, позвоночные — железо.
Химические элементы входят в состав органических соединений. Углерод, кислород и водород участвуют в построении молекул углеводов и жиров. В молекулы белков помимо этих элементов входят азот и сера, а в молекулы нуклеиновых кислот фосфор и азот. Ионы железа и меди включены в молекулы окислительных ферментов, магний — в молекулу хлорофилла, железо входит в состав гемоглобина, йод — в состав гормона щитовидной железы — тироксина, цинк — в состав инсулина — гормона поджелудочной железы, кобальт — в состав витамина В12.
Химические элементы, принимающие участие в процессах обмена веществ и обладающие выраженной биологической активностью, называют биогенными.
Вопрос 3. Что такое микроэлементы? Приведите примеры и охарактеризуйте биологическое значение этих элементов.
Многие химические элементы содержатся в живых системах в очень малых количествах (доли процента от общей массы). Такие вещества называют микроэлементами.
Микроэлементы: Си, В, Со, Мо, Мn, Ni, Вг, Т.п. I и другие. На их долю в клетке суммарно приходится более 0,1%; концентрация каждого не превышает 0,001%. Это ионы металлов, входящие в состав биологически активных веществ (гормонов, ферментов и др.). Растения, грибы, бактерии получают микроэлементы из почвы и воды; животные — в основном с пищей. В большинстве своем микроэлементы входят в состав белков и биологически активных веществ (гормонов, витаминов). Например, цинк содержится в гормоне поджелудочной железы инсулине, а иод — в тироксине (гормоне щитовидной железы). Кобальт является важнейшей составной частью витамина В12. Железо входит в состав примерно семидесяти белков организма, медь — в состав двадцати белков и т. д.
Кобальт является важнейшей составной частью витамина В12. Железо входит в состав примерно семидесяти белков организма, медь — в состав двадцати белков и т. д.
В клетках некоторых организмов обнаружено повышенное содержание отдельных химических элементов. Например, бактерии способны накапливать марганец, морские водоросли — йод, ряска -радий, моллюски и ракообразные — медь, позвоночные — железо. Ультрамикроэлементы: уран, золото, бериллий, ртуть, цезий, селен и другие. Их концентрация не превышает 0,000001%. Физиологическая роль многих из них не установлена.
Вопрос 4. Как отразится на жизнедеятельности клетки и организма недостаток какого-либо микроэлемента? Приведите примеры таких явлений.
Недостаток какого-либо микроэлемента приводит к уменьшению синтеза того органического вещества, в состав которого этот микроэлемент входит. В результате нарушаются процессы роста, обмена веществ, воспроизведения и т. п. Например, дефицит иода в пище приводит к общему падению активности организма и разрастанию щитовидной железы — эндемическому зобу._images/lekciya_2_td_chasty_1_(4)_14.jpg) Недостаток бора вызывает отмирание верхушечных почек у растений. Основной функцией железа в организме является перенос кислорода и участие в окислительных процессах (посредством десятков окислительных ферментов). Железо входит в состав гемоглибина, миоглобина, цитохромов. Железо играет важную роль в процессах выделения энергии, в обеспечении имунных реакций организма, в метаболизме холестерина. При недостатке цинка нарушается дифференцировка клеток, выработка инсулина, всасывание витамина Е, нарушается регенерация кожных клеток. Немаловажную роль цинк играет в переработке алкоголя, поэтому недостаток его в организме вызывает предрасположенность к алкоголизму (особенно у детей и подростков). Цинк входит в состав инсулина. ряда ферментов, участвует в кроветворении.
Недостаток бора вызывает отмирание верхушечных почек у растений. Основной функцией железа в организме является перенос кислорода и участие в окислительных процессах (посредством десятков окислительных ферментов). Железо входит в состав гемоглибина, миоглобина, цитохромов. Железо играет важную роль в процессах выделения энергии, в обеспечении имунных реакций организма, в метаболизме холестерина. При недостатке цинка нарушается дифференцировка клеток, выработка инсулина, всасывание витамина Е, нарушается регенерация кожных клеток. Немаловажную роль цинк играет в переработке алкоголя, поэтому недостаток его в организме вызывает предрасположенность к алкоголизму (особенно у детей и подростков). Цинк входит в состав инсулина. ряда ферментов, участвует в кроветворении.
Нехватка селена может привести к возникновению раковых заболеваний у человека и животных. По аналогии с авитаминозамитакие заболевания называют микроэлементозами.
Вопрос 5. Расскажите об ультрамикроэлементах. Каково их содержание в организме? Что известно об их роли в живых организмах?
Каково их содержание в организме? Что известно об их роли в живых организмах?
Ультрамикроэлементы — это элементы, которые содержатся в клетке в ничтожно малых количествах (концентрация каждого не превышает одной миллионной доли процента). К ним относят уран, радий, золото, серебро, ртуть, бериллий, мышьяк и др.
Мышьяк относят к условно эссенциальным, иммунотоксичным элементам. Известно, что мышьяк с белками (цистеином, глутамином), липоевой кислотой. Мышьяк оказывает влияние на окислительные процессы в митохондриях и принимает участие во многих других важных биологических процессах, он входит в состав ферментов, защищающих мембраны наших клеток от окисления, и необходим для их нормальной работы.
В организме литий способствует высвобождению магния из клеточных «депо» и тормозит передачу нервного импульса, тем самым снижая. возбудимость нервной системы. литий также влияет на нейроэндокринные процессы, жировой и углеводный обмен.
Ванадий принимает участие в регуляции углеводного обмена и сердечно-сосудистой системы также входит в метаболизме тканей костей и зубов. Физиологическая роль большинства из ультраэлементов не установлена. Не исключено, что она вообще отсутствует, и тогда часть ультрамикроэлементов являются просто примесями живых организмов. Многие ультрамикроэлементы токсичны для человека и животных в определённых концентрациях, например, серебро, титан, мышьяк и др.
Физиологическая роль большинства из ультраэлементов не установлена. Не исключено, что она вообще отсутствует, и тогда часть ультрамикроэлементов являются просто примесями живых организмов. Многие ультрамикроэлементы токсичны для человека и животных в определённых концентрациях, например, серебро, титан, мышьяк и др.
Вопрос 6. Приведите примеры известных вам биохимических эндемий. Объясните причины их происхождения.
Биохимические эндемии — это заболевания растений, животных и человека, связанные с явным недостатком либо избытком какого-либо химического элемента в окружающей среде. В результате развиваются микроэлементозы или некоторые другие нарушения. Так, во многих районах нашей страны значительно снижено количество иода в воде и почве. Нехватка иода приводит к падению синтеза гормона тироксина, щитовидная железа, пытаясь компенсировать его нехватку, разрастается (развивается эндемический зоб). Другими примерами могут служить дефицит селена в почве ряда районов Монголии, а также избыток ртути в воде некоторых горных рек Чили и Цейлона.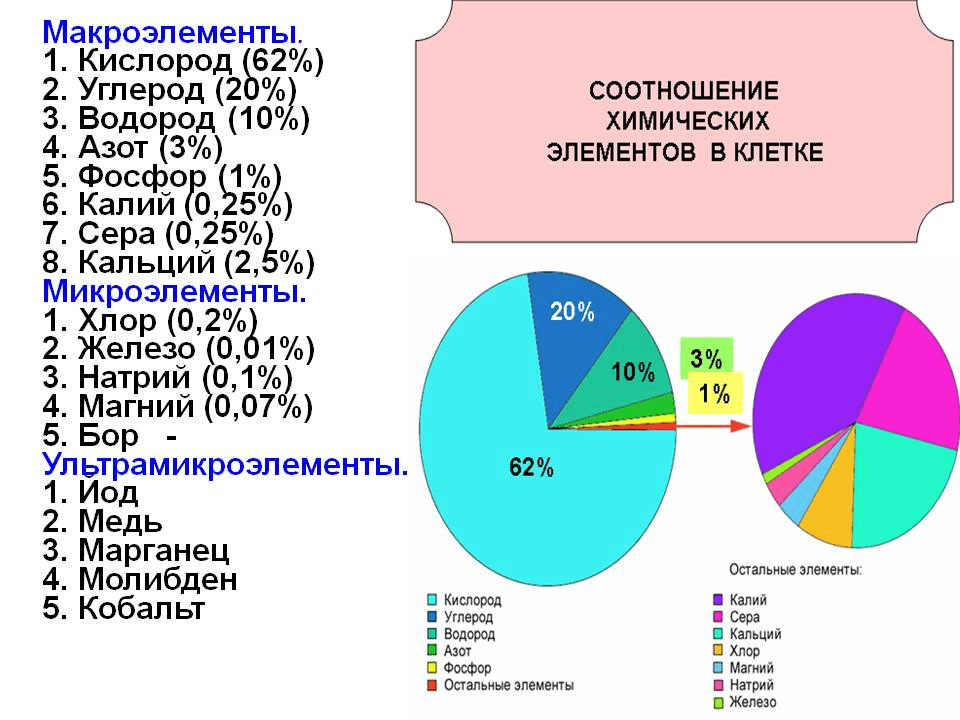 Наблюдается избыток фтора в воде многих районов, что приводит к заболеванию зубов — флюорозов.
Наблюдается избыток фтора в воде многих районов, что приводит к заболеванию зубов — флюорозов.
Одной из форм биохимических эндемий можно считаь избыток радиоактивных элементов в районе Чернобыльской АЭС и мест, подвергшихся интенсивному радиооблучению, например,
углерод, водород, кислород, азот, сера, фосфор
Если сравнить химический состав живого вещества (биосферы) с составом атмосферы, гидросферы и литосферы, которые представляют собой три слоя, занимаемых живыми существами, можно сделать следующие выводы. нарисуйте:
- В биосфере мы найдем большое количество H и O, потому что живое вещество состоит из воды в процентах, которые варьируются от 65% (наземные организмы) до 90% (водные организмы). Все химические реакции, происходящие в живых существах, развиваются в воде, поэтому существование живого вещества без воды невозможно. Все это указывает на то, что жизнь зародилась в воде .
- Остальные первичные биоэлементы (C, N, S и P) биосферы не так распространены в атмосфере, гидросфере или литосфере, поэтому можно сделать вывод, что живое вещество образовалось не из наиболее распространенных элементов.
 в изобилии, но из те (C, H, O, N, P и S), которые благодаря своим свойствам способны составлять его . Эти свойства:
в изобилии, но из те (C, H, O, N, P и S), которые благодаря своим свойствам способны составлять его . Эти свойства:- Их атомная масса относительно мала, что способствует установлению стабильные ковалентные связи в сочетании . Чем меньше атом, тем больше стремление положительного ядра завершить свою последнюю орбиталь электронами, образующими связи, и, следовательно, тем стабильнее эти связи.
- Кислород и азот являются сильно электроотрицательными элементами , , поэтому, когда они ковалентно соединяются с другими атомами, они часто дают начало дипольным молекулам. Поскольку вода тоже диполярна, эти соединения хорошо растворяются в нем и могут реагировать друг с другом, делая возможными биохимические процессы, необходимые для жизни.

Остальные свойства не являются общими, поэтому они обсуждаются отдельно ниже.
- Углерод.
- Водород.
- Кислород.
- Азот.
- Сера.
- Фосфор.
Углерод
Это основной скелет всех органических биомолекул, который определяет разницу между органическим и неорганическим веществом.
Он имеет четыре электрона на внешней оболочке и может образовывать ковалентные связи с другими атомами углерода, что позволяет ему образовывать длинные цепочки атомов (макромолекулы). Эти связи могут быть одинарными (С — С), двойными (С = С) или тройными (С≡С). Он также может связываться с различными радикалами, образованными другими элементами (-H, = O, -OH, -NH 2 , -SH, -H 2 PO 4 и т. количество различных молекул, которые будут вмешиваться во множество химических реакций и, таким образом, смогут использовать преимущества большого разнообразия элементов, существующих в окружающей среде.
Андреза Мемелли (собственная работа) [общественное достояние], через Wikimedia Commons
Четыре ковалентные связи образуют в пространстве вершины воображаемого тетраэдра, позволяя формировать трехмерные структуры, такие как плазматическая мембрана или другие органеллы.
Углерод также позволяет другой макромолекуле, ДНК, содержать всю информацию, необходимую для производства других молекул тела и репликации для передачи этой информации своим потомкам, что необходимо для жизни.
Биологическая песня: Углеродный цикл (Разочаровывающее путешествие атома углерода). Юлинки.
Водород
Вместе с кислородом он необходим для образования органического вещества , которое определяется как вещество, состоящее в основном из углерода и водорода.
Например, некоторые липиды состоят только из атомов углерода и водорода. Такие же, как нефть и ее производные (бутан, бензин, дизельное топливо и др.), состоящие только из углерода и водорода, поэтому их называют углеводороды .
Такие же, как нефть и ее производные (бутан, бензин, дизельное топливо и др.), состоящие только из углерода и водорода, поэтому их называют углеводороды .
Электрон в атоме водорода позволяет ему связываться с любым другим первичным биоэлементом. Ковалентные связи, которые образуются между водородом и углеродом, достаточно прочны, чтобы быть стабильными, но недостаточно прочны, чтобы предотвратить их разрыв , , что позволяет синтезировать другие молекулы. Молекулы, состоящие только из углерода и водорода, представляют собой неполярных ковалентов (нерастворимых в воде).
Кислород
Самый электроотрицательный первичный биоэлемент, поэтому, когда он связывается с водородом, он притягивает свой единственный электрон, создавая электрические полюса. Следовательно, радикалы -ОН, -СНО и -СООН являются полярными радикалами. Когда эти радикалы заменяют некоторые гидрогены цепи углеродов и гидрогидов, таких как глюкоза (C 6 H 12 O 6 ), они ищут растворимые молекулы в The polar molecule is electrically neutral, it has the same number of positive and negative charges, but there is no symmetry in the distribution of electric charges.»> Polar жидкости , такие как , как вода.
Из-за своей электроотрицательности кислород обладает большой способностью притягивать электроны от других атомов, оставляя их окисленными. Поскольку этот процесс включает разрыв связей и высвобождение большого количества энергии, реакция соединений углерода с кислородом, называемая аэробное дыхание, является наиболее распространенным способом получения энергии. Другой путь, ферментация, пришел в упадок с тех пор, как водоросли и растения посредством фотосинтеза начали обогащать первичную атмосферу кислородом.
Окисление биологических соединений в основном осуществляется путем вычитания водорода из атомов углерода. Кислород (более электроотрицательный) сильнее притягивает электрон от водорода, чем углерод, поэтому способен его отобрать. При этом образуется вода (кислород плюс водород) и выделяется большое количество энергии, которой пользуются живые существа. По мере того как атом углерода переходит от общего электрона с водородом к общему количеству электронов с кислородом, он испытывает «потерю» электронов, то есть окисляется:
C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O + энергия
Азот
Азот обладает отличной способностью образовывать соединения как с водородом ( NH 3 ), так и с кислородом (NO — ), позволяя переключаться из одной формы в другую, высвобождая энергия.
Содержится в аминокислотах (молекулах, из которых состоят белки), образующих аминогрупп (-NH 2 ) и в азотистых оснований из нуклеиновых кислот .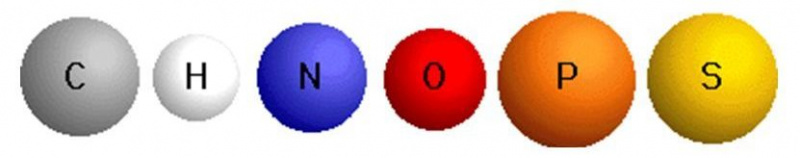 Хотя азот является самым распространенным газом в атмосфере, очень немногие организмы могут его использовать. Практически весь азот включается в живое вещество водорослями и растениями, которые поглощают его в растворенном виде в виде нитрат-иона (NH 3 — ).
Хотя азот является самым распространенным газом в атмосфере, очень немногие организмы могут его использовать. Практически весь азот включается в живое вещество водорослями и растениями, которые поглощают его в растворенном виде в виде нитрат-иона (NH 3 — ).
Сера
Встречается в форме сульфгидрильного радикала (-SH) в некоторых аминокислотах, таких как цистеин и метионин . Эти радикалы позволяют установить между двумя соседними аминокислотами прочные ковалентные связи, называемые дисульфидными мостиками (-SS-), которые поддерживают структуру белка .
Фосфор
Это очень важно, поскольку образует богатые энергией связи. Путем разрыва связи, соединяющей две фосфатные группы -PO 3 — ~ PO 3 — ~ PO 3 2- , обычно молекулы, называемой АТФ (аденозинтрифосфат) , высвобождается энергия, содержащаяся в указанной связи. Энергия, высвобождаемая в других реакциях, таких как окисление при дыхании, хранится в этих связях.
Энергия, высвобождаемая в других реакциях, таких как окисление при дыхании, хранится в этих связях.
Кроме того, фосфор очень важен, поскольку он входит в состав нуклеиновых кислот (ДНК и РНК) , фосфолипидов плазматической мембраны и костей позвоночных, а также потому, что он помогает поддерживать кислотность внутренней среды организма постоянной.
Под лицензией Creative Commons Attribution Share Alike License 4.0
Химические элементы человеческого тела
показать/скрыть слова, которые нужно знать
Элемент: в химии вещество, которое не может быть разрушено (выделено) химическим процессом… подробнее
След: количество что-то в очень малых количествах… подробнее
Какие элементы содержатся в организме человека?
В природе на Земле встречается 92 элемента. Для живых существ только 11 из этих элементов обнаруживаются в количествах, превышающих следовые количества. Любое количество 0,01% или менее считается микроэлементом. Для позвоночных, таких как люди, есть два дополнительных элемента, которые встречаются в количествах, превышающих следовые количества, это йод и железо. Приведенная ниже периодическая таблица элементов имеет цветовую кодировку, чтобы показать элементы, обнаруженные в организме человека.
Любое количество 0,01% или менее считается микроэлементом. Для позвоночных, таких как люди, есть два дополнительных элемента, которые встречаются в количествах, превышающих следовые количества, это йод и железо. Приведенная ниже периодическая таблица элементов имеет цветовую кодировку, чтобы показать элементы, обнаруженные в организме человека.
Иллюстрация периодической таблицы элементов, обнаруженных в организме человека. Нажмите, чтобы увеличить.
Четыре основных элемента, обнаруженных в человеческом теле
Из элементов, обнаруженных в человеческом теле, четыре из них составляют наибольший процент массы нашего тела (96,2%). Четыре элемента – это кислород, водород, углерод, азот. Прежде чем вы начнете думать, что мы должны уплыть со всеми атомами кислорода, водорода и азота, помните, что молекулы кислорода в основном являются частью воды в нашем теле (h3O). На самом деле более половины человеческого тела состоит из воды (50-70%).
Одиннадцать общих элементов, встречающихся в организме человека, и их процентное содержание в общей массе тела. Другие микроэлементы (менее 0,01%): бор (B), кадмий (Cd), хром (Cr), кобальт (Co), медь (Cu), фтор (F), йод (I), железо (Fe). ), марганец (Mn), молибден (Mo), селен (Se), кремний (Si), олово (Sn), ванадий (V) и цинк (Zn).
Другие микроэлементы (менее 0,01%): бор (B), кадмий (Cd), хром (Cr), кобальт (Co), медь (Cu), фтор (F), йод (I), железо (Fe). ), марганец (Mn), молибден (Mo), селен (Se), кремний (Si), олово (Sn), ванадий (V) и цинк (Zn).
Подробнее о: Строительные блоки жизни
Просмотреть ссылку
Библиографические сведения:
- Статья: Атомы и жизнь
- Автор(ы): Шьямала Айер
- Издатель: Школа естественных наук Университета штата Аризона Ask A Biologist
- Название объекта: ASU — Спросите у биолога
- Дата публикации: 27 сентября 2009 г.
- Дата обращения: 6 мая 2023 г.
- Ссылка: https://askabiologist.asu.edu/content/atoms-life
APA Style
Шьямала Айер. (2009, 27 сентября). Атомы и жизнь. АГУ — Спросите у биолога. Получено 6 мая 2023 г. с https://askabiologist.asu.edu/content/atoms-life 9.0003
Американская психологическая ассоциация. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/560/10/
http://owl.english.purdue.edu/owl/resource/560/10/
Чикагское руководство по стилю
Шьямала Айер. «Атомы и жизнь». АГУ — Спросите у биолога. 27 сентября 2009 г. https://askabiologist.asu.edu/content/atoms-life
Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/717/04/
MLA 2017 Style
Shyamala Iyer. «Атомы и жизнь». АГУ — Спросите у биолога. 27 сентября 2009 г. ASU — Спросите биолога, Интернет. 6 мая 2023 г. https://askabiologist.asu.edu/content/atoms-life
Ассоциация современного языка, 7-е изд. Для получения дополнительной информации см. http://owl.english.purdue.edu/owl/resource/747/08/
Элементы — кислород, углерод, водород и азот — составляют 96,2% веса вашего тела.
Примите участие в программе
Спросите у биолога
Выступив добровольно или просто отправив нам отзыв на сайте. Ученые, учителя, писатели, иллюстраторы и переводчики важны для программы. Если вы заинтересованы в помощи с веб-сайтом, у нас есть страница волонтеров, чтобы начать процесс.


 в изобилии, но из те (C, H, O, N, P и S), которые благодаря своим свойствам способны составлять его . Эти свойства:
в изобилии, но из те (C, H, O, N, P и S), которые благодаря своим свойствам способны составлять его . Эти свойства:
Leave A Comment